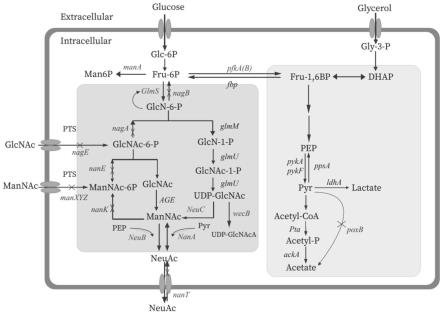
检测黄芪及土壤中根腐病菌尖孢镰刀菌的引物和pcr方法
技术领域
1.本发明涉及农业生物技术领域,具体涉及一种黄芪根腐病菌尖孢镰刀菌(fusarium oxysporum)分子检测的特异引物及其在黄芪及土壤中的实时荧光pcr检测方法。
背景技术:
2.黄芪,具有补气固表,托疮生肌等功效,是中医药学公认的道地大宗药材和保健品原料,以其为原料的中成药多达200余种,上市保健品达160余种,民间也将黄芪作为重要的滋补食材。近年来,黄芪的市场需求激增,出口、药用、食用和其他用途的年需求量在8.85万吨以上。然而,随着种植面积扩大、轮作周期缩短、重茬和迎茬面积增加等因素,素有“植物癌症”之称的根腐病在甘肃、山西、内蒙等主产区普遍发生,且危害逐年加重,如甘肃渭源和定西,发病率分别为40%-60%和35%-92%;内蒙古为30%-80%;山西一般为10%-30%,重者达60%。根腐病的发生蔓延给黄芪产业的发展造成了严重影响,经济损失巨大。
3.尽早准确判别植物病害和明确其致病菌/群,是对病害进行有效防控的最关键一环。然而,黄芪根腐病致病菌的复杂性、症状的多样性、发病的隐蔽性和多年性,给该病害的早期鉴别和针对病原实施精准防控造成了极大困扰。首先,黄芪根腐病由多种病原菌混合侵染引起,镰刀菌属的腐皮镰刀菌(fusarium solani)、锐顶镰刀菌(fusarium acuminatum)、尖孢镰刀菌(fusarium oxysporum)是最主要的致病菌,且不同地区优势致病菌存在差异,如甘肃省渭源县黄芪根腐病的优势致病菌为尖孢镰刀菌和腐皮镰刀菌;内蒙古以立枯丝核菌(rhizoctonia solani)为主要致病菌,其次是尖孢镰刀菌和腐皮镰刀菌;山西省为锐顶镰刀菌、腐皮镰刀菌和尖孢镰刀菌。其次,黄芪根腐病症状多样,具有一定地域差异,且引发不同症状的优势致病菌也不尽相同。以山西为例,纤维状腐烂和皱缩变软在浑源、应县和五寨县均有分布,前者以浑源县和五寨县为多,后者以应县居多;而侧根发黑在浑源县未被发现。引起纤维状腐烂的致病菌,浑源县主要为锐顶镰刀菌、腐皮镰刀菌,五寨县为锐顶镰刀菌、尖孢镰刀菌,应县则为锐顶镰刀菌;引起皱缩软根症状的致病菌,五寨县主要为尖孢镰刀菌、锐顶镰刀菌、腐皮镰刀菌;浑源县为链格孢菌(alternaria spp.)、锐顶镰刀菌、腐皮镰刀菌;应县为腐皮镰刀菌和锐顶镰刀菌;引起侧根发黑的致病菌,五寨县和应县均主要为锐顶镰刀菌和腐皮镰刀菌。第三,黄芪根腐病作为土传病害具有隐蔽性。当症状在植株地上部肉眼明显可见时,根部往往已是病害发生的中后期,此时常规施用农药已基本无效,药农不得不加大用量;加之黄芪为多年生植物,为了防止病菌在后续生长年份继续经土壤传播危害,还需要长期用药加以控制。如此,农药用量一再加大,很难控制在合理的范围。
4.目前,黄芪根腐病病原菌的鉴定通常采用的是先从发病组织中分离和纯化、再通过形态学和分子生物学技术加以鉴定,这种鉴定方法通常耗时长达半年以上,无法实现病菌的快速鉴定。在田间,症状观察是根腐病诊断的唯一手段,但根腐病早期症状的不明显和隐蔽性,常使得即便药农凭经验通过田间症状观察发现了病害,也往往已到发病后期;加之
根腐症状的多样性,也常导致病害诊断的准确性难以保证。上述种种情形,使根腐病的防治要么“药不对病”、“药不对菌”,要么病害发现太晚,贻误防治时机,最终导致病害防治失败或农药大/超量使用却收效甚微,甚至因农药残留而影响黄芪的品质、污染种植地的土壤环境、造成生态危害。
5.基于上述生产实际,亟需建立一种快速、灵敏、准确、可操作性强的根腐病/菌诊断鉴别方法,实现黄芪根腐病的“早发现、早确诊、早防治”、并且能够“对症施药”、“对菌施药”,以期在科学合理施用农药的基础上,既有效控制根腐病的发生蔓延,又可保障人们用药安全,保护生态环境。
6.实时荧光定量pcr(quantitative real-time pcr,qpcr)技术与普通pcr方法相比,具有灵敏度高、特异性强、重复性好、成本低、操作方便和直观等优点,是病原菌的早期检测和鉴定、病害发生的动态监测、以及植物和土壤中病菌含量测定的有力工具,但针对黄芪根腐病/菌,目前还未见相关检测方法报道。
技术实现要素:
7.本发明的目的在于提供一种检测黄芪植株内及其种植地土壤中根腐病菌尖孢镰刀菌(fusarium oxysporum)的特异性引物及其实时荧光定量pcr方法,用于黄芪根腐病早期鉴别和诊断、病原菌确定、以及土壤中根腐病菌含量的预警测定。
8.为实现上述目的,本发明提供一种检测黄芪及土壤中尖孢镰刀菌(f.oxysporum)的特异性引物对,其核苷酸序列如下:
9.faef2:5’—ggcatttactccgccacttg—3’,
10.faer2:5’—agctcagcggcttcctattg—3’。
11.所述的特异性引物的设计是根据黄芪根腐病菌尖孢镰刀菌ef-1α(genbank登录号:kx094899)序列,通过ncbi数据库的primer-blast设计出的特异性引物对faef2/faer2。
12.所述的特异性引物对可以在检测黄芪或土壤中尖孢镰刀菌中应用。
13.本发明提供一种快速检测黄芪及土壤中尖孢镰刀菌的方法,包括如下步骤:
14.(1)取黄芪发病样品或种植地的发病土壤,分别通过ezup柱式真菌基因组dna抽提试剂盒和ezup柱式土壤dna抽提试剂盒提取黄芪发病样本及土壤的dna;
15.(2)以步骤(1)提取的黄芪发病样本及土壤的dna为模板,利用所述的特异性引物对faef2/faer2分别进行基于荧光染料sybrgreeni的实时荧光pcr检测;
16.所述实时荧光pcr检测的反应条件:95℃3min;95℃5s;62℃20s,39个循环,溶解曲线分析温度设于65~95℃之间。反应体系:反应总体积20μl,其组分为sybrgreen i荧光染料10μl,模板dna 2μl,引物各1μl(浓度为2μm),ddh2o补足20μl;
17.(3)利用所述的特异性引物对faef2/faer2,以不同浓度梯度的黄芪根腐病菌尖孢镰刀菌的dna为模板,进行实时荧光pcr检测,制作黄芪发病样本检测的标准曲线;同样,利用所述的特异性引物对faef2/faer2,以模拟不同梯度的黄芪根腐病菌尖孢镰刀菌带菌量的土壤dna为模板,进行实时荧光pcr检测,制作土壤检测的标准曲线;
18.所述实时荧光pcr检测的反应条件:95℃3min;95℃5s;62℃20s,39个循环,溶解曲线分析温度设于65~95℃之间。反应体系:反应总体积20μl,其组分为sybrgreen i荧光染料10μl,模板dna 2μl,引物各1μl(浓度为2μm),ddh2o补足20μl;
19.(4)根据步骤(2)中的检测结果判断黄芪植株及土壤是否带有根腐病菌尖孢镰刀菌,根据步骤(3)获得的标准曲线,对黄芪植株及土壤中的根腐病菌尖孢镰刀菌的生物量进行计算。
20.进一步地,所述步骤(3)中黄芪样本中病原菌实时荧光定量pcr检测标准曲线的制作方法如下:取黄芪根腐病菌尖孢镰刀菌基因组dna,用ddh2o进行10倍浓度稀释,稀释后获得浓度分别为70ng/μl、7ng/μl、0.7ng/μl、0.07ng/μl和0.007ng/μl的梯度模板,然后进行实时荧光定量pcr扩增,扩增反应条件同所述步骤(3)的反应条件,以cq值为纵坐标,浓度的对数值为横坐标,制作标准曲线。
21.进一步地,所述步骤(3)中土壤中病原菌实时荧光定量pcr检测标准曲线的制作方法如下:以模拟土壤中黄芪根腐病菌尖孢镰刀菌孢子量分别为107cfu/g、106cfu/g、105cfu/g、104cfu/g、103cfu/g、102cfu/g的土壤dna为模板,然后进行实时荧光定量pcr扩增,扩增反应条件同所述步骤(3)中反应条件,以cq值为纵坐标,孢子量的对数值为横坐标,制作标准曲线。
22.进一步地,所述步骤(3)黄芪样本中根腐病菌尖孢镰刀菌检测的标准曲线扩增效率(e)为99.5%,决定系数(r2)为0.9955,标准曲线的方程为y=-3.3764x 24.074。
23.进一步地,所述步骤(3)土壤中根腐病菌尖孢镰刀菌检测的标准曲线扩增效率(e)为97.0%,决定系数(r2)为0.9706,标准曲线的方程为y=-3.1494x 40.777。
24.进一步地,所述步骤(2)中,当检测出黄芪样本及土壤中待测根腐病菌尖孢镰刀菌时,根据待测样品cq值以及步骤(3)所述标准曲线,计算根腐病菌尖孢镰刀菌在黄芪及土壤中的生物量。
25.进一步地,通过扩增曲线及cq值来判定待测植株是否为黄芪根腐病菌尖孢镰刀菌侵染阳性植株,当扩增曲线良好并且cq《37时,则为阳性,即判断待测植株被根腐病菌尖孢镰刀菌侵染;反之,cq≥37时,则为阴性,即判断待测植株未被侵染。
26.进一步地,通过扩增曲线及cq值来判定待测土壤中是否含有黄芪根腐病菌尖孢镰刀菌,当扩增曲线良好并且cq《34时,则为阳性,即判断待测土壤被黄芪根腐病菌尖孢镰刀菌污染;反之,cq≥34时,则为阴性,即判断待测土壤未被污染。
27.与现有技术相比,本发明的有益效果是:
28.本发明基于镰刀菌基因的ef-1α序列设计特异性引物,建立了黄芪植株及种植地土壤中根腐病菌尖孢镰刀菌的实时荧光定量pcr检测方法。本检测方法灵敏度高、特异性强,且具有操作方便、成本低、结果直观等特点,可用于田间黄芪植株或其种植区土壤中黄芪根腐病菌尖孢镰刀菌的特异分子检测,检测结果是根腐病的早期快速鉴别和诊断、病原菌确定的依据,也可作为土壤中病原菌含量的预警检测方法。本方法是为针对黄芪根腐病进行靶向性早期防治和科学合理用药提供直接依据的有力技术手段,对减少根腐病造成的经济损失具有重要意义。
附图说明
29.图1为黄芪根腐病菌尖孢镰刀菌分子检测,引物faef2/faer2特异性验证的常规pcr结果图,其中泳道1-9分别为:dna marker;f.oxysporum;f.solani;f.acuminatum;f.graminearum;f.graminearumschw.;f.rdeolens;alternaria sp.;ddh2o。
30.图2为利用引物faef2/faer2进行常规pcr的灵敏度检测图,其中泳道1和8分别为:dna marker和ddh2o;泳道2-7:依次为在20μl的pcr扩增体系中dna浓度分别是100ng/μl、10ng/μl、1ng/μl、0.1ng/μl、0.01ng/μl、0.001ng/μl时的扩增结果。
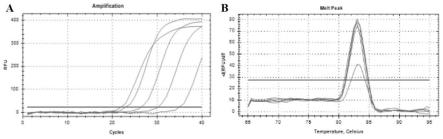
31.图3为引物faef2/faer2特异性检测的实时荧光定量pcr扩增曲线(a)和熔解曲线(b)
32.图4为10倍梯度稀释黄芪根腐病菌尖孢镰刀菌(f.oxysporum)基因组dna的实时荧光定量pcr扩增曲线(a)及溶解曲线(b)
33.图5为黄芪植株中根腐病菌尖孢镰刀菌(f.oxysporum)实时荧光定量pcr检测的标准曲线
34.图6为梯度含量黄芪根腐病菌尖孢镰刀菌(f.oxysporum)模拟带菌土壤dna的实时荧光定量pcr扩增曲线(a)及溶解曲线(b)
35.图7为种植地土壤中黄芪根腐病菌尖孢镰刀菌(f.oxysporum)实时荧光定量pcr检测的标准曲线
36.图8为根腐病菌尖孢镰刀菌(f.oxysporum)侵染黄芪不同时间下生物量的实时荧光定量pcr检测结果
37.图9为黄芪不同种植地区同一种植年限下发病土壤中根腐病菌尖孢镰刀菌含量的测定结果
具体实施方式
38.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功能。以下实施例仅用于说明和解释本发明,而不构成对本发明技术方案的限制。
39.下面实施例中所涉及的材料,试剂和设备具体来源为:
40.1、材料
41.供试病原菌:锐顶镰刀菌(f.acuminatum)、腐皮镰刀菌(f.solani)、尖孢镰刀菌(f.oxysporum)、芬芳镰刀菌(f.rdeolens)、链格孢菌(alternaria sp.)为本课题组前期鉴定保存,禾谷镰刀菌(f.graminearum)、小麦赤霉病菌(f.graminearumschw.)分别来自河南农业大学和沈阳化工大学;黄芪发病植株检测样品为采用“浸根法”接种致病尖孢镰刀菌后,不同时间点所收集的黄芪发病组织;黄芪模拟带菌土壤为将致病尖孢镰刀菌的菌悬液进行梯度稀释后,加入无菌土壤,使其带菌量为10
7-102cfu/g;黄芪发病土壤样本为2021年采集自山西大同浑源县4年生发病土壤及朔州市应县4年生发病土壤。
42.2、培养基:马铃薯葡萄糖琼脂(pda)培养基、马铃薯葡萄糖液体培养基(pd)。
43.3、试剂(盒):ezup柱式真菌基因组dna抽提试剂盒、ezup柱式土壤dna抽提试剂盒、pcr master mix(2
×
)、dna分子量标准、sgexcel fast sybr mixture、核糖核酸酶a溶液(10mg/ml),上述试剂均购自生工生物(上海)股份有限公司。
44.特异性引物faef2/faer2由申请人设计、生工生物(上海)股份有限公司合成。
45.4、设备:eppendorf centrifuge 5424小型高速离心机,olympus bx53荧光显微镜(日本)、gen5多功能酶标仪(美国伯腾)、bio-rad c100 pcr仪、bio-rad凝胶成像系统,bio-rad cfx96实时荧光定量pcr仪等。
46.实施例1
47.黄芪根腐病菌尖孢镰刀菌特异引物faef2/faer2的设计、合成,及其特异性的常规pcr分子检测方法建立,以及利用其检测引物特异性的使用效果,包括以下步骤:
48.1.1引物的设计合成
49.根据黄芪根腐病菌尖孢镰刀菌ef-1α序列(genbank登录号:kx094899),通过ncbi数据库以及primer-blast比对设计出特异性引物对faef2/faer2,其中,
50.faef2:5’—ggcatttactccgccacttg—3’;
51.faer2:5’—agctcagcggcttcctattg—3’。
52.引物由生工生物工程(上海)股份有限公司合成。
53.1.2引物特异性的常规pcr检测和检测体系灵敏度测试
54.(1)将供试菌株锐顶镰刀菌(f.acuminatum)、腐皮镰刀菌(f.solani)、尖孢镰刀菌(f.oxysporum)、芬芳镰刀菌(f.rdeolens)、链格孢菌(alternaria sp.)、禾谷镰刀菌(f.graminearum)、小麦赤霉病菌(f.graminearumschw.)接种于pda培养基,28℃培养5d。
55.(2)参照真菌基因组dna提取试剂盒说明书,提取各病原菌纯化菌株的dna,备用。
56.(3)常规pcr检测引物faef2/faer2的特异性:以步骤(1)中各病原菌纯化菌株的dna为模板,进行常规pcr扩增。
57.初始检测:20μl扩增体系:模板1μl,上下游引物各1μl(引物浓度5μm),taq pcr master mix 10μl,ddh2o 7μl;扩增程序:95℃预变性5min,94℃变性30s,60℃退火30s,72℃延伸1min,32个循环,72℃延伸10min,扩增产物4℃保存。
58.最终优化反应体系为总体积20μl,其中,模板1μl,上下游引物各1μl(引物浓度1μm),taq pcr master mix 10μl,ddh2o 7μl。最终反应条件为:95℃预变性5min,94℃变性30s,62℃退火30s,72℃延伸30s,30个循环,72℃延伸10min,扩增产物4℃保存。
59.特异性检测结果显示,仅黄芪根腐病菌尖孢镰刀菌(f.oxysporum)的泳道扩增出122bp的目的条带,表明该引物具有良好的特异性(图1)。
60.(4)常规pcr检测体系的灵敏度:将黄芪根腐病菌尖孢镰刀菌基因组dna从100ng/μl开始依次10倍稀释至0.001ng/μl,各浓度取1μl为模板利用步骤(3)所述最终优化体系及反应条件进行扩增。
61.(5)灵敏度检测结果显示,特异性引物faef2/faer2能在黄芪根腐病菌尖孢镰刀菌dna模板浓度为1ng/μl及以上时,扩增出相应大小的特异性条带,表明其检测灵敏度为1ng/μl(图2)。
62.1.3荧光定量pcr检测引物特异性
63.以1.2-(1)中的各病原菌纯化菌株的dna为模板,在实时荧光定量pcr反应条件下进行多个循环反应。
64.初始检测反应体系:20μl扩增体系,dna模板1μl,引物1μl(浓度为1μm),荧光染料10μl,以无菌水补齐至20μl;扩增程序:95℃3min;95℃5s;60℃20s,37个循环,溶解曲线分析温度设于65~95℃之间,升温时收集荧光信号,建立溶解曲线。
65.最终优化反应体系:20μl扩增体系,dna模板2μl,引物1μl(浓度为2μm),荧光染料10μl,以无菌水补齐至20μl;扩增程序:95℃3min;95℃5s;62℃20s,39个循环,溶解曲线分析温度设于65~95℃之间,升温时收集荧光信号,建立溶解曲线。
66.特异性检测结果显示,仅黄芪根腐病菌尖孢镰刀菌有扩增曲线且出现平台期;溶解曲线峰型单一,产物专一,未形成引物二聚体,表明该引物特异性良好(图3)。
67.实施例2
68.黄芪植株中根腐病菌尖孢镰刀菌生物量检测的标准曲线建立,包括如下步骤:
69.(1)模板的制备:将黄芪根腐病菌尖孢镰刀菌活化后,接到铺有玻璃纸的pda培养基上,28℃恒温培养5d,待菌丝长满平板后,将培养好的菌丝从玻璃纸上刮下,置于灭菌研钵内,液氮研磨至粉末状。取100mg转入2ml的灭菌离心管,采用ezup柱式真菌基因组dna抽提试剂盒提取dna。
70.(2)标准曲线的建立:使用酶标仪测定黄芪根腐病菌尖孢镰刀菌基因组dna浓度,并对其进行10倍梯度稀释,dna浓度分别为:70ng/μl、7ng/μl、0.7ng/μl、0.07ng/μl和0.007ng/μl。按实施例1中1.3优化反应体系和扩增程序进行实时荧光定量pcr扩增;扩增结束后由软件自动收集数据,生成扩增曲线和溶解曲线(图4),以模板浓度的对数值为横坐标,cq值为纵坐标,建立标准曲线(图5)。
71.(3)从标准曲线可知,利用实时荧光定量pcr检测黄芪植株中根腐病菌尖孢镰刀菌生物量的灵敏度为0.007ng/μl(图5),该灵敏度比常规pcr高1000倍。
72.(4)从实验结果可知,当扩增曲线良好并且cq《37时,黄芪植株为阳性,即判断其被根腐病菌尖孢镰刀菌侵染;反之,cq≥37时,则为阴性,即判断待测植株未被侵染。
73.实施例3
74.土壤中黄芪根腐病菌尖孢镰刀菌生物量检测的标准曲线建立,包括如下步骤:
75.(1)病原菌孢子悬液的制备:致病尖孢镰刀接入pda平板,25℃下培养5~7d后,用打孔器沿菌落边缘各打取5个菌碟(直径5mm),接入100ml pd培养液,震荡培养3~5d(25℃,180r/min)后,滤除菌丝,加入无菌水进行系列梯度稀释,使其浓度分别为1.6
×
107cfu/ml、1.6
×
106cfu/ml、1.6
×
105cfu/ml、1.6
×
104cfu/ml、1.6
×
103cfu/ml、1.6
×
102cfu/ml。
76.(2)模拟带菌土壤dna模板的制备:称取8g未种植黄芪的无菌土置于培养皿中(6份),依次加入5ml系列梯度稀释的菌悬液,使其模拟土壤带菌量为107cfu/g、106cfu/g、105cfu/g、104cfu/g、103cfu/g、102cfu/g;另取8g土加入5ml无菌水,用作阴性对照。利用ezup柱式土壤dna抽提试剂盒提取模拟带菌土壤dna。
77.(3)标准曲线的建立:提取不同梯度带菌土壤的dna为模板,按实施例1中1.3的优化反应体系和扩增程序进行实时荧光定量pcr扩增,扩增结束后由软件自动收集数据,生成扩增曲线和溶解曲线(图6),以土壤中不同含量黄芪根腐病菌尖孢镰刀菌孢子数的对数值为横坐标,cq值为纵坐标,建立标准曲线(图7)。
78.(4)从标准曲线可知,利用实时荧光定量pcr检测黄芪种植地土壤中根腐病菌尖孢镰刀菌生物量的灵敏度为102cfu/g,即当土壤中含有102cfu/g及以上的根腐病菌尖孢镰刀菌时就能够被检测出来(图7)。
79.(5)从实验结果可知,当扩增曲线良好并且cq《34时,黄芪种植地土壤为阳性,即判断其被黄芪根腐病菌尖孢镰刀菌污染;反之,cq≥34时,则为阴性,即判断待测土壤未被污染。
80.实施例4
81.黄芪植株发病样本中根腐病菌尖孢镰刀菌含量的测定,步骤如下:
82.4.1接种根腐病菌尖孢镰刀菌的黄芪发病样品的采集
83.(1)病原菌孢子悬液的制备
84.将f.oxysporum接入pda平板,25℃下培养5~7d后,用打孔器沿菌落边缘各打取5个菌碟(直径5mm),接入100ml pd培养液,震荡培养3~5d(25℃、180r/min)后,滤除菌丝后加入无菌水使其浓度为1.5
×
106~2.5
×
107cfu/ml。
85.(2)健康黄芪样本的准备
86.选择大小粗细一致的健康黄芪根,清水洗净泥土后,先用无菌水涮洗1次,再于75%酒精中浸泡10~15s,然后无菌水涮洗2~3次,备用。
87.(3)病原菌接种和样本采集
88.用灭菌接种针在各黄芪根段上平滑健康的相同部位作梅花状刺伤,刺伤间隔2cm,每株刺伤10处;然后在病菌孢子悬浮液中浸泡1h后取出,栽于装有无菌土的花盆中,将剩余病菌孢子悬浮液浇注进花盆(每盆种植10株,三次重复),人工气候室恒温培养[(25
±
1)℃,光暗交替12h/12h],于0d、7d、14d、21d、28d时整根采集样本,然后用无菌解剖刀切取每根黄芪发病部位斑点(斑点直径5mm),将每个时间点采集的病斑混匀,每个混匀样本取样量2g。样品液氮速冻淬灭后,-80℃保存。
[0089]
4.2发病黄芪样本中根腐病菌尖孢镰刀菌生物量的检测
[0090]
(1)将各时间点黄芪病斑的混匀样本用液氮研磨至粉状,精确称取0.1g至无菌的2ml ep管中。采用ezup柱式真菌基因组dna抽提试剂盒提取dna,并以其为模板进行实时荧光定量pcr扩增,体系和程序为实施例1中1.3所述,试验重复三次。测定后依据实施例2中所建立的标准曲线进行发病黄芪样本中根腐病菌尖孢镰刀菌生物量计算。
[0091]
(2)生物量测定结果显示(图8),致病尖孢镰刀菌侵染黄芪1h后,即可在黄芪根内检测到,其生物量为0.9936ng/g;此后随时间的延长,样本中病菌的生物量也逐渐升高,整体趋势为0-14d缓慢升高且无显著性差异,21-28d则显著升高,28d时生物量最大,为9.5139ng/g,表示该时间点黄芪根腐发病最重。
[0092]
实施例5
[0093]
黄芪种植地土壤中根腐病菌尖孢镰刀菌含量的测定,步骤如下:
[0094]
5.1土壤样本的采集及测定
[0095]
样品1采集地为山西省大同市浑源县裴村乡千哨村,样本为4年生仿野生黄芪病土;样本2采集地为山西省朔州市应县下马峪乡下马村,样本为4年生仿野生黄芪病土。采用5点取样法收集土壤样本,每点采集3-5株黄芪根围半径10cm、深度10cm之内的土壤,装进无菌自封袋即为试验的子样品。带回实验室后,去除石子、秸秆等杂质,称取子样品各150g混合均匀得最终试验样品,保存于-80℃冰箱。
[0096]
5.2土壤样本中致病根腐尖孢镰刀菌的检测
[0097]
(1)精确称取0.3g土壤样本至无菌2ml ep管中。采用ezup柱式土壤dna抽提试剂盒提取dna,并以其为模板进行实时荧光定量pcr扩增,体系和程序为实施例1中1.3所述。试验设3次重复。测定后依据实施例3中所建立的标准曲线进行土壤样本中致病根腐尖孢镰刀菌的检测。
[0098]
(2)黄芪不同种植地发病土壤中根腐病菌尖孢镰刀菌生物量测定结果显示(图9),应县种植区内黄芪发病土壤中根腐病菌尖孢镰刀菌生物量为10696.52cfu/g,浑源种植区
尖孢镰刀菌的含量654.90cfu/g。浑源种植区域内尖孢镰刀菌的含量低于应县地区。
[0099]
实验结果与技术效果分析:
[0100]
(1)引物faef2/faer2的常规pcr特异性检测结果如图1所示
[0101]
仅黄芪根腐病菌尖孢镰刀菌(f.oxysporum)的泳道扩增出122bp的目的条带,表明引物faef2/faer2是该黄芪根腐病菌尖孢镰刀菌的特异性引物,能够将其从多种病原菌中检测出来。
[0102]
(2)常规pcr检测体系检测引物灵敏度的结果如图2所示
[0103]
特异性引物faef2/faer2能在黄芪根腐病菌尖孢镰刀菌dna模板浓度为1ng/μl及以上时,扩增出相应大小的特异性条带。
[0104]
(3)实时荧光定量pcr最终优化体系检测引物特异性的结果如图3所示
[0105]
以引物faef2/faer2对黄芪根腐病菌尖孢镰刀菌及参比菌株进行特异性扩增,只有黄芪根腐病菌尖孢镰刀菌有扩增曲线且出现平台期;溶解曲线峰型单一,产物专一,未形成引物二聚体,故该扩增体系满足测定要求,且引物显示出良好的特异性。
[0106]
(4)黄芪植株中致病尖孢镰刀菌实时荧光定量pcr检测标准曲线的建立结果如图4、图5所示
[0107]
10倍梯度稀释致病尖孢镰刀菌基因组dna,使其浓度分别为70ng/μl、7ng/μl、0.7ng/μl、0.07ng/μl和0.007ng/μl。以稀释后的dna为模板,用faef2/faer2特异性引物,在已确定的优化体系和扩增程序下,进行实时荧光定量pcr扩增,5个梯度的dna均能有效扩增(图4a),扩增曲线平滑有序;熔解曲线为单峰(图4b)。依据扩增结果绘制的标准曲线如图5所示。
[0108]
dna浓度区间为70ng/μl~0.007ng/μl时,其对数值与cq值呈良好的线性关系,线性方程为y=-3.3764x 24.074,相关系数r2=0.9955,扩增效率为99.55%,可以用于黄芪中根腐病菌尖孢镰刀菌的生物量检测。
[0109]
(5)土壤中黄芪根腐病菌尖孢镰刀菌生物量检测标准曲线建立结果如图6、图7所示
[0110]
模拟带菌土壤中黄芪根腐病菌尖孢镰刀菌的孢子量分别为107cfu/g、106cfu/g、105cfu/g、104cfu/g、103cfu/g、102cfu/g,以提取的土壤dna为模板,用特异性引物faef2/faer2进行实时荧光定量pcr扩增。如图6a所示,6个梯度浓度的dna均扩增效率良好,扩增曲线平滑有序;熔解曲线为单峰(图6b)。依据扩增结果绘制的标准曲线如图7所示。
[0111]
土壤中致病尖孢镰刀菌含量为107cfu/g~102cfu/g时,其对数值与cq值呈良好的线性关系,线性方程为y=-3.1494x 40.777,相关系数r2=0.9706,扩增效率为97.06%,可以用于土壤中致病尖孢镰刀菌的检测。
[0112]
(6)致病尖孢镰刀菌接种黄芪幼苗后,不同侵染时间下病原菌生物量的测定如图8所示
[0113]
病菌侵染黄芪1h后,即可在黄芪根内检测到致病尖孢镰刀菌的定殖,其生物量为0.9936ng/g,此后随时间的延长,不同时间点样本中病菌的生物量也逐渐升高,0-14d缓慢升高且无显著性差异,21-28d显著升高,28d时致病尖孢镰刀菌的生物量最大,为9.5139ng/g,表示此时发病最重。
[0114]
(7)黄芪不同种植地同一种植年限发病土壤中根腐病菌尖孢镰刀菌含量检测结果
如图9所示
[0115]
应县种植区内黄芪发病土壤中根腐病菌尖孢镰刀菌生物量为10696.52cfu/g,浑源种植区尖孢镰刀菌的含量654.90cfu/g。浑源种植区域内尖孢镰刀菌的含量低于应县地区。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。