基因重组海参肽raj-hrp在抗肿瘤药物中的应用
技术领域
1.本技术属于生物技术领域,具体涉及基因重组海参肽raj-hrp的制备及其通过抑制肿瘤细胞egfr细胞信号通路在抗肿瘤药物制备中的应用。
背景技术:
2.癌症目前已经成为全球性第一大致死因素,到2020年每年死于癌症的人数超过1200万人,到2030年,预计每年新发癌症病例数将增加到2360万。而就癌症的发病情况来看,肺癌、胃癌、食管癌、肝癌、乳腺癌、宫颈癌最为多见,约占全部恶性肿瘤的70%-80%。因此,寻找并研发安全强效的抗肿瘤药物已刻不容缓。
3.目前,抗癌药物分为三大类别,包括:常规化疗药物、激素治疗药物、分子靶向药物。在这三大类抗癌药物中,化疗药物和激素治疗药物因其毒副作用强而限制了其治疗效果,而分子靶向药物则因其疗效好、副作用小的优势成为抗肿瘤药物市场的发展趋势,其已占全球抗肿瘤药物市场的60%份额。但不容忽视的是,靶向药物大多数为单抗类产品,具有拮抗肿瘤类型单一、研发代价高、生产成本高、销售价格高的特点,这严重限制了患者的广泛使用。因此,寻找新型抗癌药物成为全球相关领域科研工作者的神圣使命。由于陆地资源有限,向海洋要药俨然成为寻找新型抗肿瘤药物的热点。由于本课题组一直致力于海洋生物活性研究,因此我们把抗癌药物寻找的目光聚焦到了仿刺参(apostichopus japoicus)这一物种。
4.仿刺参属棘皮动物门、海参纲、楯手目、刺参科,是辽宁地区重要的海珍品经济养殖品种,关于其活性成分的研究还处于起步阶段,在抗肿瘤研究领域更是一片空白。
5.有鉴于此,提出本发明。
技术实现要素:
6.本技术的第一目的在于提供一种全新重组海参肽raj-hrp;
7.本技术的第二目的在于提供一种所述重组海参肽raj-hrp的制备方法;
8.本技术的第三目的在于提供所述重组海参肽raj-hrp在抗肿瘤中的应用;
9.本技术的第四目的在于提供所述重组海参肽raj-hrp在制备抗肿瘤药物中的应用。
10.为实现上述目的,本技术具体提供如下技术方案:
11.本技术首先提供一种重组海参肽,其氨基酸序列为如下任一:
12.1)包含seq id no.1所示序列;
13.2)满足氨基酸保守替代的基础上,与seq id no.2具有至少80%以上同源性;
14.优选的,至少80%、90%、95%或99%的序列同源性。
15.3)如seq id no.1所示序列。
16.优选的,所述重组海参肽是分离的,或合成的。
17.本技术还提供一种分离的核苷酸序列,其编码上述任一所述的重组海参肽。
18.优选的,所述核苷酸序列入seq id no.1所示。
19.更优选的,所述重组海参肽是分离的,或合成的。
20.本技术还提供一种重组序列,所述重组序列连接有上述任一所述的重组海参肽或核苷酸序列。
21.本技术还提供一种组合物,包含上述任一所述的重组海参肽或核苷酸序列。
22.本技术还提供一种重组载体,包括上述任一所述的核苷酸序列。
23.进一步的,所述载体为克隆载体或表达载体。
24.更进一步的,所述表达载体为真核表达载体或原核表达载体。
25.本技术还提供一种重组细胞,所述细胞包含上述任一所述的重组载体。
26.本技术还提供上述重组海参肽的制备方法,利用上述任一所述重组载体进行表达的步骤。
27.优选的,进一步包括分离和纯化的步骤。
28.本技术还提供一种上述任一所述重组海参肽的如下任一应用:
29.1)在抗肿瘤活性中的应用;
30.2)在抗肿瘤细胞增殖、迁移或侵染中的应用;
31.3)在制备抗肿瘤药物中的应用,优选的,在制备以egfr为靶点的抗肿瘤药物中的应用;
32.4)在筛选肿瘤抑制中的应用;优选的以egfr为靶点的肿瘤抑制剂中的应用;
33.5)在抗肿瘤活性评价中的应用。
34.本技术还提供一种上述任一所述核苷酸的如下任一应用:
35.1)在抗肿瘤活性中的应用;
36.2)在抗肿瘤细胞增殖、迁移或侵染中的应用;
37.3)在制备抗肿瘤药物中的应用,优选的,在制备以egfr为靶点的抗肿瘤药物中的应用;
38.4)在筛选肿瘤抑制中的应用;优选的以egfr为靶点的肿瘤抑制剂中的应用;
39.5)在抗肿瘤活性评价中的应用。
40.本技术还提供一种在体外或体内抑制肿瘤细胞的方法,包括给予或过表达上述任一所述重组海参肽的步骤。
41.本技术的有益技术效果:
42.本技术从仿刺参中首次分离出一种全新的重组海参肽raj-hrp,实验证实raj-hrp具有体内与体外剂量依赖性地抑制肿瘤细胞的功能,且作用靶点为egfr,raj-hrp有望应用于egfr为靶点的抗肿瘤药物制备领域。
附图说明
43.图1、纯化raj-hrp肽的tricine sds-page电泳图。其中,泳道1:raj-hrp肽;泳道2:小分子蛋白marker。
44.图2、cck法检测raj-hrp对hct116细胞增殖的抑制结果。其中,(a)结肠癌hct116细胞增殖的抑制作用;横坐标为raj-hrp的浓度(μm),纵坐标为hct116细胞增殖抑制率(%);(b)胃癌mgc803增殖的抑制作用,横坐标为raj-hrp的浓度(μm),纵坐标为mgc803细胞增殖
抑制率(%);(c)大鼠脑胶质瘤c6细胞增殖的抑制作用,横坐标为raj-hrp的浓度(μm),纵坐标为c6细胞增殖抑制率(%)。
45.图3、raj-hrp对移植瘤体积的影响结果(n=5),横坐标为实验组组别,纵坐标为肿瘤体积。其中,(a)raj-hrp对hct116移植瘤裸鼠肿瘤体积的影响;(b)raj-hrp对mgc803移植瘤裸鼠肿瘤体积的影响;(c)raj-hrp对c6移植瘤裸鼠肿瘤体积的影响。
46.图4、raj-hrp对hct116移植瘤裸鼠肿瘤重量的影响结果(n=5,与模型组数据的显著性差异用星号表示,*p《0.05,**p《0.01,***p《0.001),横坐标为实验组组别,纵坐标为肿瘤重量(g)。其中,(a)raj-hrp对hct116移植瘤裸鼠肿瘤体积的影响;(b)raj-hrp对mgc803移植瘤裸鼠肿瘤体积的影响;(c)raj-hrp对c6移植瘤裸鼠肿瘤体积的影响。
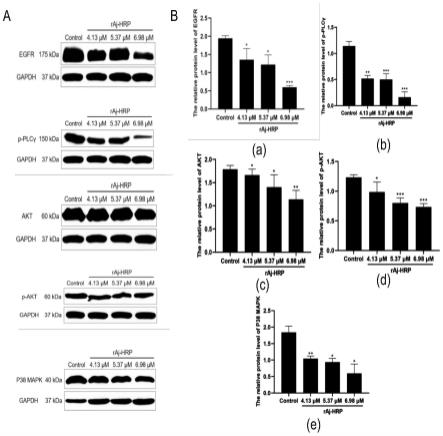
47.图5、raj-hrp对hct116细胞egfr信号通路相关分子egfr、p-plcγ、akt、p-akt和p38mapk表达的影响结果。其中,(a)egfr、p-plcγ、akt、p-akt和p38 mapk的western blot结果图;(b)蛋白相对灰度值统计图(与各泳道gapdh相比,gapdh为内参),横坐标为实验组别,纵坐标为蛋白相对灰度值。b中,(a)raj-hrp对hct116细胞egfr分子表达的影响;(b)raj-hrp对hct116细胞p-plcγ分子表达的影响;(c)raj-hrp对hct116细胞akt分子表达的影响;(d)raj-hrp对hct116细胞p-akt分子表达的影响;(e)raj-hrp对hct116细胞p38 mapk分子表达的影响。
48.图6、raj-hrp对mgc803细胞egfr信号通路相关分子egfr、pi3k、akt、p-akt信号通路相关分子表达的影响结果。其中,(a)egfr、pi3k、akt、p-akt的western blot结果图;(b)蛋白相对灰度值统计图(与各泳道gapdh相比,gapdh为内参),横坐标为实验组别,纵坐标为蛋白相对灰度值。b中,(a)raj-hrp对mgc803细胞egfr分子表达的影响;(b)raj-hrp对mgc803细胞pi3k、akt、p-akt分子表达的影响。
49.图7、raj-hrp对c6细胞对egfr信号通路下游akt、p-akt、p38 mapk与p-p38 mapk信号分子的抑制结果。其中,(a)akt、p-akt、p38 mapk与p-p38 mapk的western blot结果图;(b)蛋白相对灰度值统计图(与各泳道gapdh相比,gapdh为内参),横坐标为实验组别,纵坐标为蛋白相对灰度值。b中,(a)raj-hrp对c6细胞akt分子表达的影响;(b)raj-hrp对c6细胞p-akt分子表达的影响;(c)raj-hrp对c6细胞p38 mapk分子表达的影响;(d)raj-hrp对c6细胞p-p38 mapk分子表达的影响。
具体实施方式
50.为了能够更清楚地理解本发明的上述目的、特征和优点,下面结合附图和具体实施方式对本发明进行进一步的详细描述。需要说明的是,在不冲突的情况下,本技术的实施例及实施例中的特征可以相互组合。
51.定义
52.除非在下文中另有定义,本文中所用的所有技术术语和科学术语的含义意图与本领域技术人员通常所理解的相同。提及本文中使用的技术意图指在本领域中通常所理解的技术,包括那些对本领域技术人员显而易见的技术的变化或等效技术的替换。虽然相信以下术语对于本领域技术人员很好理解,但仍然阐述以下定义以更好地解释本发明。
53.如本文中所使用,术语“包括”、“包含”、“具有”、“含有”或“涉及”及其在本文中的其它变体形式为包含性的(inclusive)或开放式的,且不排除其它未列举的元素或方法步
骤。
54.在提及单数形式名词时使用的不定冠词或定冠词例如“一个”或“一种”,“所述”,包括该名词的复数形式。
55.本发明中的术语“大约”、“大体”表示本领域技术人员能够理解的仍可保证论及特征的技术效果的准确度区间。该术语通常表示偏离指示数值的
±
10%,优选
±
5%。
56.此外,说明书和权利要求书中的术语第一、第二、第三、(a)、(b)、(c)以及诸如此类,是用于区分相似的元素,不是描述顺序或时间次序必须的。应理解,如此应用的术语在适当的环境下可互换,并且本发明描述的实施方案能以不同于本发明描述或举例说明的其它顺序实施。
57.本技术的分离的重组海参肽raj-hrp,是这样一类短肽,其一级结构由67个氨基酸组成且富含组氨酸,分子量为7.99kda。生物信息学分析表明,raj-hrp与斜纹夜蛾(spodoptera litura)、疟原虫(plasmodium lophurae)、穹蛛(stegodyphus dumicola)等物种的富组氨酸蛋白(histidine-rich glycoprotein,hrg)的富组氨酸区域具有60%左右的相似性。目前,尚无来源于仿刺参swyg-2、3及来源于斜纹夜蛾、疟原虫、穹蛛等物种hrg抗肿瘤功能的任何研究与报道。
58.本技术经过实验证实raj-hrp能够在体外呈剂量依赖方式抑制人结肠癌hct116细胞、人胃癌mgc-803、大鼠脑胶质瘤c6细胞的增殖,其ic
50
分别为5.21μm、4.23μm及4.95μm。而在体内,在建立balb/c裸鼠的结肠癌细胞hct116、胃癌mgc802皮下移植瘤模型基础上,低(50μg/kg)、中(100μg/kg)、高(200μg/kg)剂量的raj-hrp的裸鼠腹腔注射14天的实验结果表明,raj-hrp对裸鼠的结肠癌及胃癌的肿瘤体积及瘤重的均具有显著抑制作用,且与阳性对照10mg/kg剂量的5-氟尿嘧啶(5-fu)组相比,raj-hrp低(50μg/kg)、中(100μg/kg)、高(200μg/kg)剂量的给药组小鼠体重下降趋势不明显,说明raj-hrp的毒性小于5-fu。与模型组相比,各给药组小鼠肿瘤体积及瘤重都明显下降,且呈剂量依赖性,而raj-hrp给药剂量为微克级、5-fu给药剂量为毫克级,说明raj-hrp更高效;在建立balb/c裸鼠的大鼠脑胶质瘤c6细胞皮下移植瘤模型基础上,分别设置模型组、5-氟尿嘧啶阳性对照组(5-fu,20mg/kg)以及重组海参富组肽raj-hrp给药组(200μg/kg、400μg/kg、800μg/kg),在建模成功后连续给药14天,实验结果表明,raj-hrp在基本不影响小鼠体重的前提下,能够以剂量依赖的特点有效抑制脑胶质瘤的体积与重量,而5-氟尿嘧啶阳性对照组则因毒性引起小鼠体重明显下降,这表明重组海参富组肽raj-hrp具有高效低毒的体内抗脑胶质瘤作用。
59.作用机制研究结果表明,raj-hrp能够下调hct116细胞、人胃癌mgc-803、大鼠脑胶质瘤c6细胞的egfr信号通路上egfr及其下游信号分子p-plcγ、akt、p-akt、p38 mapk、pi3k等分子的表达,这表明raj-hrp对上述肿瘤体内外增殖的抑制作用是以egfr及其下游分子为靶点进行的,raj-hrp具有广谱抑制肿瘤增殖的作用,可以应用于肿瘤的治疗药物制备。
60.因此,可以获知,本技术的重组海参肽raj-hrp具有体内与体外剂量依赖性地抑制肿瘤细胞的功能,raj-hrp有望应用于egfr为靶点的抗肿瘤药物制备领域。
61.在一些具体实施方式中,所述重组海参肽raj-hrp序列入seq id no.2所示,但可以理解,本技术的抗肿瘤活性肽并不仅限于该67个氨基酸序列(seq id no.2),任何包含该序列段的序列,在保留该序列完整性的基础上,都将具有抗肿瘤活性,因此在本技术的一些事实方式中,所述重组海参肽raj-hrp为包含seq id no.2所示序列的肽。
62.另外,本领域清楚,氨基酸可以保守型取代,所述保守氨基酸取代将导致氨基酸序列发生变化,比如与原序列具有至少80%、90%、95%或99%的序列同源性。
63.保守取代是指一个氨基酸经相同类别内的另一氨基酸取代,例如一个酸性氨基酸经另一酸性氨基酸取代,一个碱性氨基酸经另一碱性氨基酸取代,或一个中性氨基酸经另一中性氨基酸取代。示例性的取代如下表所示:
64.示例的氨基酸取代如下:
65.原始残基示例性取代优选的取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;asp、lys;argglnasp(d)glu;asnglucys(c)ser;alasergln(q)asn;gluasnglu(e)asp;glnasp
66.原始残基示例性取代优选的取代gly(g)alaalahis(h)asn;gln;lys;argargile(i)leu,val;met;ala;phe;正亮氨酸leuleu(l)正亮氨酸;ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)trp;leu;val;ile;ala;tyrtyrpro(p)alaalnser(s)thrthrthr(t)val;sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;ala;正亮氨酸leu
67.所以,本技术的抗肿瘤活性肽还可以是这样的一类序列,在满足氨基酸保守替代的基础上,与seq id no.2具有至少80%以上同源性;在一些优选的实施方式中,是至少90%、95%或99%的序列同源性。
68.任何编码本技术重组海参肽的核酸序列都是本技术的保护范围,核酸序列并不限制,seq id no.1仅是特定实施例,不限制本技术保护范围。
69.任何包括上述任一所述的核苷酸序列的重组载体都是本技术的保护范围,包括但不限于表达载体、克隆载体等;而载体对物种也不限制,但凡能够用于本技术核酸表达或克隆的载体都适用,因此可以是真核载体或原核载体。
70.相应的,包含上述重组载体的细胞也都是本技术的保护范围,细胞类型也不受限。
71.在已知本技术重组海参肽序列的技术上,本领域技术人员可以通过现有已知的方法进行合成或表达,任何形式获得的包含seq id no.2的序列都属于本技术的保护范围。
72.而基于本技术的实验,作为本领域技术人员可以合理的概括出,本技术重组海参肽可具有如下任一应用:
73.1)在抗肿瘤/肿瘤细胞活性中的应用;
74.2)在抗肿瘤细胞增殖、迁移或侵染中的应用;
75.3)在制备抗肿瘤药物中的应用,优选的,在制备以egfr为靶点的抗肿瘤药物中的应用;
76.4)在筛选肿瘤抑制中的应用;优选的,以egfr为靶点的肿瘤抑制剂中的应用;
77.5)在抗肿瘤活性评价中的应用。
78.根据本技术实施例中人结肠癌、胃癌、脑胶质瘤肿瘤细胞和小鼠模型的实验可知概括,本技术的肿瘤或癌类型并不作限制,其可以是各种类型的肿瘤。在一些具体的实施方式中,所述肿瘤类型是结肠癌、胃癌、脑胶质瘤的肿瘤类型。
79.如下为具体的实施例,用以解释本技术的保护内容。
80.实施例1、raj-hrp的发现和序列确定
81.本课题组多年来一直致力于海洋生物活性物质的研究,本技术从仿刺参(apostichopus japonicus)的cdna文库中发现一种全新序列,通过相关基因构建、表达及纯化获得相应基因的重组肽,其一级结构由67个氨基酸组成且富含组氨酸,分子量为7.99kda。生物信息学分析表明,其与斜纹夜蛾(spodoptera litura)、疟原虫(plasmodium lophurae)、穹蛛(stegodyphus dumicola)等物种的富组氨酸蛋白(histidine-rich glycoprotein,hrg)的富组氨酸区域具有60%左右的相似性,因此命名该序列为raj-hrp,其具体核苷酸和氨基酸序列分别如下所以(对应序列seq id no.1和2)。
[0082][0083][0084]
截至目前,尚无来源于仿刺参swyg-2、3及来源于斜纹夜蛾、疟原虫、穹蛛等物种hrg抗肿瘤功能的任何研究与报道。
[0085]
实施例2、海参肽raj-hrp的重组表达和制备
[0086]
本实施例对海参肽raj-hrp进行重组表达用于后续功能性实验。
[0087]
1、aj-hrp基因的克隆与阳性重组子的筛选鉴定
[0088]
1)aj-hrp基因的获得:aj-hrp基因采用人工合成方法获得,在人工合成时,将终止密码子加在了aj-hrp基因序列3’末端,这使得该基因表达的重组蛋白不带有任何纯化标签。同时,在该序列基因合成时,在序列的5’端加入了nde i酶切位点,在该序列3’端加入了xho i酶切位点。人工基因合成由南京金斯瑞生物技术有限公司完成。
[0089]
2)目的基因dna片段与载体pet23b的连接:由于所设计的引物分别带有nde i及xho i酶切位点(见引物序列下划线部分),而这两个酶切位点也是pet23b的多克隆位点,这使得将目的基因dna片段与载体pet23b的连接成为可能。引物序列为:
[0090]
p1:5
’‑
xxcatatggcgcttattcgatgtttg-3’[0091]
p2:5
’‑
xxtctgagtcaatggtgttcaccatggtg-3’[0092]
3)连接产物cacl2法转化至克隆菌e.coli bl21中:宿主菌e.coli bl21接种于lb(amp-)中培养过夜,次日将部分菌液移至50ml lb培养液中于37℃下继续培养至od
600
达到0.2-0.3之间。培养物置于冰上10min,5000rpm 4℃离心10min。弃上清,倒置离心管1min,加入5ml冰预冷的0.1m cacl2溶液致敏并悬浮细胞,冰上10min。5000rpm 4℃离心10min回收细胞,弃上清,每25ml的原培养物再加入2ml冰冷的0.1m cacl2溶液,悬浮细胞并置于冰上3h,每份200μl分装细胞。加10μl含40ng的dna溶液至200μl感受态细胞中温和混匀,于42℃热休克90s后迅速放回冰中,将细胞冷却1~2min后,加入800μl lb(amp-)培养基,37℃225rpm摇荡培养细菌45~90min。取100μl转化产物铺于90mm的lb(amp
)琼脂平板上,室温下放置20-30min后,倒置平皿于37℃培养12-16h,待lb(amp )琼脂平板上长出菌落后即可进行阳性转化子的筛选鉴定。
[0093]
4)阳性转化子的筛选鉴定:利用t7通用引物法进行阳性转化子的筛选鉴定。raj-hrp的213bp基因片段(含酶切位点序列)插入pet23b质粒后,t7通用引物的pcr扩增产物片段长度应该为406bp,而pet23b空质粒因没有外源基因片段的插入,其t7通用引物pcr扩增产物仅有193bp,故可依据t7通用引物的结果进行阳性重组子的判断。
[0094]
具体方法如下:
[0095]
用灭菌牙签挑取转化菌单菌落的一部分于10μl双蒸水中煮沸10min作为模板,以t7通用引物进行pcr扩增。t7通用引物序列为:
[0096]
p1:5
’‑
xxaaattaatacgactcactata-3’[0097]
p2:5
’‑
xxgctagttattgctcagcggtg-3’[0098]
pcr反应条件为:94℃预变性2min后,94℃变性45s,55℃复性45s,72℃延伸45s,30个循环;最后72℃延伸6min。
[0099]
2、对阳性重组菌进行终浓度为1mm的iptg诱导表达。诱导表达条件为30℃过夜诱导。
[0100]
3、raj-hrp肽的提取与纯化
[0101]
1)收菌:将诱导后菌液分装至50ml离心管中,配平后离心10min(4℃、4000rpm);
[0102]
2)超声破碎:弃上清,加入20ml预冷的1
×
binding buffer重悬沉淀,将悬液倒入小烧杯中,冰浴条件下超声破碎30min(30%功率、破碎5s停止5s);
[0103]
3)过滤澄清:将破碎后菌液分装至离心管中,配平后离心20min(4℃、12000rpm),
收集上清,用0.45μm滤器过滤至灭菌离心管中备用;
[0104]
4)纯化目的蛋白:虽然在基因构建时该重组肽无纯化标签,但由于raj-hrp肽富含组氨酸,本发明采用镍离子亲和层析纯化。纯化过程如下:
[0105]
将镍离子层析柱固定在铁架台上,流尽保护液,沿管壁加入10ml预冷的1
×
binding buffer(平衡柱子),流尽后沿管壁加入过滤后的上清液,待上清液流尽后,沿管壁加入10ml预冷的1
×
binding buffer(使层析柱能够亲和结合蛋白中的组氨酸标签),流尽后沿管壁加入10ml预冷的1
×
wash buffer(洗脱杂蛋白),最后加入5ml预冷的1
×
elute buffer,弃前两滴液体,用1.5ml ep管收集纯化的目的蛋白,标记后于-20℃保存;
[0106]
5)目的蛋白的纯度鉴定:取适量目的蛋白,将其与小分子量上样buffer以1:1的比例混合,沸水浴5min后得到电泳样品,之后进行小分子tricine-sds page电泳。
[0107]
4、raj-hrp的小分子tricine-sds page电泳
[0108]
本实验采用三层tricine-sds page电泳分析分子量较小的蛋白。实验流程如下:
[0109]
1)制样:分别在上述各组培养液中取1ml样品,离心15min(12000rpm),弃上清,向沉淀中加入100μl小分子量上样buffer,振荡摇匀后,沸水浴5min;
[0110]
2)制胶:取一套胶板组装并验漏,按照表1配方配制电泳胶,中层胶和下层胶以异丁醇压线,使各层胶面保持平整;
[0111]
表1.小分子tricine-sds page电泳胶配方
[0112][0113][0114]
3)上样:安装好电泳胶槽,外槽加入1
×
阳极缓冲液,内槽加入1
×
阴极缓冲液使液面没过上样孔,缓慢拔出梳子,将小分子量预染蛋白marker(3μl/孔)和电泳样品(20μl/孔)加入到上样孔中;
[0115]
4)电泳:采用30v电压电泳至样品跑出上样孔,之后采用80v电压至样品进入下层胶,最后采用100v电压至电泳结束。电泳全程将冰袋置于电泳槽四周,避免电解生热影响电泳结果;
[0116]
5)固定:取下凝胶,只保留分离胶部分,放入固定液中,静置30min;
[0117]
6)染色:移除固定液,加入染色液,摇床染色1-2h;
[0118]
7)脱色:移除染色液,加入脱色液,摇床脱色3次,每次10min,并更换脱色液,之后加入纯水摇床脱色过夜,直至出现清晰的条带。
[0119]
制备结果如图1所示。
[0120]
实施例3、cck法检测raj-hrp对肿瘤细胞增殖的影响
[0121]
1)将培养至对数期的hct116细胞、人胃癌mgc-803、大鼠脑胶质瘤c6细胞分别经胰酶处理后,离心3min(2000rpm),弃上清,加入适量完全培养基,制成密度合适的细胞悬液;
[0122]
2)取96孔板,每孔加入100μl细胞悬液和梯度浓度的raj-hrp(终浓度为0μm、2.29μm、3.43μm、4.57μm、5.72μm、6.86μm、8.01μm、9.15μm、10.29μm、11.44μm),加药体积使用pbs补齐至10μl,置于37℃、5%co2下培养24h;
[0123]
3)每孔加入10μl cck-8溶液,继续培养3-4h;
[0124]
4)使用酶标仪检测各孔在波长为450nm处的od值;
[0125]
5)进行三组重复实验,取平均值,使用excel统计并计算raj-hrp对hct116细胞、人胃癌mgc-803、大鼠脑胶质瘤c6细胞增殖的抑制率,公式如下:
[0126]
抑瘤率=[(对照组od值-实验组od值)/对照组od值]x100%
[0127]
6)使用graphpad prism 8.0绘图,并计算细胞半抑制浓度ic
50
。
[0128]
具体结果如图2所示,横坐标为raj-hrp的浓度,单位为μm;纵坐标为c6细胞增殖抑制率(%)。其中,(a)结肠癌hct116细胞增殖的抑制作用。横坐标为raj-hrp的浓度,单位为μm;纵坐标为hct116细胞增殖抑制率(%);(b)胃癌mgc803增殖的抑制作用。横坐标为raj-hrp的浓度,单位为μm;纵坐标为mgc803细胞增殖抑制率(%);(c)大鼠脑胶质瘤c6细胞增殖的抑制作用。
[0129]
由此可见,raj-hrp能够在体外呈剂量依赖方式抑制人各种肿瘤细胞的增殖,其ic
50
分别为5.21μm、4.23μm及4.95μm。
[0130]
实施例4、raj-hrp对小鼠模型肿瘤增殖的影响
[0131]
1)肿瘤细胞的处理:将培养至对数期的hct116细胞、人胃癌mgc-803、大鼠脑胶质瘤c6细胞分别经胰酶处理后,离心3min(2000rpm),弃上清,加入适量生理盐水,制成浓度为1
×
107个/ml的细胞悬液,备用。
[0132]
2)裸鼠皮下移植瘤模型的建立及实验动物分组:裸鼠适应性饲养一周后,于裸鼠右侧腋下接种0.2ml上述细胞悬液,建立人结肠癌裸鼠皮下移植瘤模型。接种后每日观察裸鼠的精神状态,约一周后成瘤。
[0133]
3)将裸鼠随机分为5组,每组5只。模型组为0.9%生理盐水。hct116和mgc803移植瘤体内的阳性对照组均为5-氟尿嘧啶,给药剂量均为10mg/kg。raj-hrp低、中、高剂量组,给药剂量均分别为50、100、200μg/kg。每天给药一次,给药容量为10μl/g,腹腔注射,连续给药14天;c6移植瘤体内的阳性对照组为5-氟尿嘧啶,给药剂量为20mg/kg;raj-hrp低、中、高剂量组,给药剂量均分别为200μg/kg、400μg/kg、800μg/kg。每天给药一次,给药容量为10μl/g,腹腔注射,连续给药14天。
[0134]
4)raj-hrp对移植瘤体积和裸鼠体重的影响:每天对裸鼠体重进行测量并记录;每两天用电子数显游标卡尺测量裸鼠移植瘤的长径(l)和短径(w),使用excel统计并计算移植瘤的体积,公式如下:
[0135]
v=1/2x l x w2[0136]
5)各组裸鼠最后一次给药后24h,称重并断颈处死;
[0137]
6)取出皮下移植瘤,测量肿瘤体积和肿瘤重量;
[0138]
抑瘤率=[(模型组平均瘤重-给药组平均瘤重)/模型组平均瘤重]x100%
[0139]
7)使用graphpad prism 8.0绘图。
[0140]
结果如图3和4所示,图3是raj-hrp对移植瘤体积的影响(n=5),横坐标为实验组组别,纵坐标为肿瘤体积。其中,(a)raj-hrp对hct116移植瘤裸鼠肿瘤体积的影响。(a)raj-hrp对hct116移植瘤裸鼠肿瘤体积的影响;(b)raj-hrp对mgc803移植瘤裸鼠肿瘤体积的影响;(c)raj-hrp对c6移植瘤裸鼠肿瘤体积的影响。图4是raj-hrp对移植瘤裸鼠肿瘤重量的影响(n=5,与模型组数据的显著性差异用星号表示,*p《0.05,**p《0.01,***p《0.001),横坐标为实验组组别;纵坐标为肿瘤重量(g)。(a)raj-hrp对hct116移植瘤裸鼠肿瘤体积的影响。(a)raj-hrp对hct116移植瘤裸鼠肿瘤体积的影响;(b)raj-hrp对mgc803移植瘤裸鼠肿瘤体积的影响;(c)raj-hrp对c6移植瘤裸鼠肿瘤体积的影响。
[0141]
由此可见,在建立balb/c裸鼠的结肠癌细胞hct116、胃癌mgc802皮下移植瘤模型基础上,低(50μg/kg)、中(100μg/kg)、高(200μg/kg)剂量的raj-hrp的裸鼠腹腔注射14天的实验结果表明,raj-hrp对裸鼠的结肠癌及胃癌的肿瘤体积及瘤重的均具有显著抑制作用,且与阳性对照10mg/kg剂量的5-氟尿嘧啶(5-fu)组相比,raj-hrp低(50μg/kg)、中(100μg/kg)、高(200μg/kg)剂量的给药组小鼠体重下降趋势不明显,说明raj-hrp的毒性小于5-fu。与模型组相比,各给药组小鼠肿瘤体积及瘤重都明显下降,且呈剂量依赖性;在建立balb/c裸鼠的大鼠脑胶质瘤c6细胞皮下移植瘤模型基础上,分别设置模型组、5-氟尿嘧啶阳性对照组(5-fu,20mg/kg)以及重组海参富组肽raj-hrp给药组(200μg/kg、400μg/kg、800μg/kg),在建模成功后连续给药14天,实验结果表明,raj-hrp能够以剂量依赖的特点有效抑制脑胶质瘤的体积与重量。
[0142]
同时,上述关于raj-hrp抑制balb/c裸鼠的结肠癌细胞hct116、胃癌mgc802及大鼠脑胶质瘤c6的移植瘤体内实验结果表明,在同等抗肿瘤药效下,raj-hrp给药剂量为微克级、5-fu给药剂量为毫克级,说明raj-hrp更高效;raj-hrp基本对裸鼠体重没有影响,而5-氟尿嘧啶阳性对照组则因毒性引起小鼠体重明显下降,说明raj-hrp低毒。由此可见,raj-hrp的抗肿瘤功效具有高效低毒的特点。
[0143]
实施例5、western blot检测raj-hrp对egfr通路相关蛋白的影响
[0144]
(1)制备样品
[0145]
a)将对数生长期的肿瘤细胞消化重悬,平均接种至4个培养瓶中,置于37℃、5%co2下培养24h左右,至细胞密度达到70-80%;
[0146]
b)更换培养液后,向各个培养瓶中加入梯度浓度的raj-hrp(终浓度为0μm、4.13μm、5.37μm、6.98μm),体系使用空培养基补齐,置于37℃、5%co2下培养24h;
[0147]
c)用细胞刮刀将培养瓶中的细胞刮下,与培养液一同收集至离心管中,1ml pbs清洗培养瓶和细胞刮刀,收集残留细胞;
[0148]
d)配平后离心5min(4℃、12000rpm),弃上清,将沉淀置于冰上备用;
[0149]
e)配制细胞裂解液,根据需要计算使用量,均匀混合ripa裂解液和蛋白酶抑制剂pmsf(ripa:pmsf=100:1);
[0150]
f)分别向沉淀中加入400μl细胞裂解液,混合均匀后,冰上静置20min,每隔5min振荡一次,使细胞充分裂解;
[0151]
g)分别向裂解后的样品中加入100μl 5
×
loading buffer,混合均匀后,沸水浴5-10min,得到蛋白样品,于-20℃保存。
[0152]
(2)sds-page电泳
[0153]
a)制胶:取一套胶板组装并验漏,根据实验的不同分子选取适合的凝胶浓度,按照如表2及表3配方配制电泳胶,分离胶以异丁醇压线,使胶面保持平整;
[0154]
表2.不同浓度sds-page分离胶配方(5ml)
[0155][0156]
表3.sds-page浓缩胶配方(3ml)
[0157][0158]
b)上样:安装电泳胶槽,加入1
×
sds-page电泳缓冲液,缓慢拔出梳子,将双色预染蛋白marker(3μl/孔)和蛋白样品(15-20μl/孔)加入到上样孔中;
[0159]
c)电泳:采用80v电压电泳至样品进入分离胶,采用120v电压至电泳结束。
[0160]
(3)切胶:根据检测蛋白的分子量和marker的位置,对凝胶进行切割;
[0161]
(4)转膜
[0162]
a)裁剪适当大小的pvdf膜,放入甲醇中浸泡3min;
[0163]
b)裁剪8张适当大小的滤纸,与pvdf膜一起放入膜转移缓冲液中浸泡10min;
[0164]
c)按照石墨极
→
4层滤纸
→
pvdf膜
→
蛋白凝胶
→
4层滤纸
→
金属极的顺序,将上述材料放置到转膜仪上进行转膜,转膜速度约为1kda/min;
[0165]
(5)封闭:将pvdf膜放入封闭缓冲液中,室温摇床封闭1-2h;
[0166]
(6)孵育一抗:将pvdf膜放入按说明比例稀释的一抗孵育袋中,4℃孵育过夜;
[0167]
(7)洗膜:回收一抗,置于-20℃保存,将pvdf膜放入1
×
tbst buffer中,室温摇床清洗4次,每次10min;
[0168]
(8)孵育二抗:将pvdf膜放入按说明比例稀释的二抗中,37℃摇床孵育1h;
[0169]
(9)洗膜:回收二抗,置于-20℃保存,将pvdf膜放入1
×
tbst buffer中,室温摇床清洗4次,每次10min,之后将pvdf膜放入1
×
pbs中,室温摇床清洗10min;
[0170]
(10)配制ecl发光液:根据实验需要计算使用量,均匀混合试剂盒中的a液和b液(a液:b液=1:1);
[0171]
(11)化学发光:取出pvdf膜,将ecl发光液均匀覆盖在pvdf膜上,使用化学发光凝胶成像系统进行曝光成像;
[0172]
(12)灰度分析:使用imagej对分子条带进行灰度分析,使用excel和graphpad prism 8.0进行统计和绘图,实验结果以表格形式统计检测蛋白分子的相对灰度值,以柱形图形式进行直观显示,横坐标代表raj-hrp的浓度,纵坐标代表检测蛋白分子的相对表达量。
[0173]
(13)数据处理:采用t检验对实验所得数据进行统计分析,统计结果以平均数
±
标准差的形式表示。p《0.05代表实验组之间具有差异,p《0.01代表实验组之间具有显著性差异、p《0.001代表实验组之间具有极显著性差异。
[0174]
结果如图5-7所示。图5中,raj-hrp对hct116细胞egfr信号通路相关分子egfr、p-plcγ、akt、p-akt和p38 mapk表达的影响。其中,(a)egfr、p-plcγ、akt、p-akt和p38 mapk的western blot结果图;(b)蛋白相对灰度值统计图(与各泳道gapdh相比,gapdh为内参)。横坐标为实验组别,纵坐标为蛋白相对灰度值。(a)raj-hrp对hct116细胞egfr分子表达的影响;(b)raj-hrp对hct116细胞p-plcγ分子表达的影响;(c)raj-hrp对hct116细胞akt分子表达的影响;(d)raj-hrp对hct116细胞p-akt分子表达的影响;(e)raj-hrp对hct116细胞p38 mapk分子表达的影响。图6中,raj-hrp对mgc803细胞egfr信号通路相关分子egfr、pi3k、akt、p-akt信号通路相关分子表达的影响。其中,(a)egfr、pi3k、akt、p-akt的western blot结果图;(b)蛋白相对灰度值统计图(与各泳道gapdh相比,gapdh为内参),横坐标为实验组别,纵坐标为蛋白相对灰度值。b中,(a)raj-hrp对mgc803细胞egfr分子表达的影响;(b)raj-hrp对mgc803细胞pi3k、akt、p-akt分子表达的影响。图7中,raj-hrp对c6细胞对egfr信号通路下游akt、p-akt、p38 mapk与p-p38 mapk信号分子的抑制作用。其中,(a)akt、p-akt、p38 mapk与p-p38 mapk的western blot结果图;(b)蛋白相对灰度值统计图(与各泳道gapdh相比,gapdh为内参)。横坐标为实验组别,纵坐标为蛋白相对灰度值。b中,(a)raj-hrp对c6细胞akt分子表达的影响;(b)raj-hrp对c6细胞p-akt分子表达的影响;(c)raj-hrp对c6细胞p38 mapk分子表达的影响;(d)raj-hrp对c6细胞p-p38 mapk分子表达的影响。
[0175]
由此可见,raj-hrp能够下调hct116细胞、人胃癌mgc-803、大鼠脑胶质瘤c6细胞的egfr信号通路上egfr及其下游信号分子p-plcγ、akt、p-akt、p38 mapk、pi3k等分子的表达,这表明raj-hrp对上述肿瘤体内外增殖的抑制作用是以egfr及其下游分子为靶点进行的,raj-hrp具有广谱抑制肿瘤增殖的作用,可以应用于肿瘤的治疗药物制备。
[0176]
前述对本技术的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本技术限定为所公开的精确形式,并且很显然,根据上述教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本技术的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本技术的各种不同的示例性实施方案以及各种不同的选择和改变。本技术的范围意在由权利要求书及其等同形式所限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。