1.本发明属于生物医学技术领域,具体涉及一种缓解病毒感染造成肠道功能紊乱的组合物及其制备方法和应用。
背景技术:
2.据统计,全球每年约20万儿童死于轮状病毒感染引起的腹泻等相关疾病。轮状病毒感染导致急性腹泻会伴有明显肠道菌群失衡、炎症因子水平升高及导致自身免疫功能降低,以及炎症感染等。目前,临床上主要采用补液治疗和接种口服轮状病毒减毒活疫苗等手段,尚无抗rv的特效药物。
3.益生菌具有维持机体微生态平衡、调节免疫反应、减少传染性疾病以及肠道炎症的发生等功能,是临床中预防轮状病毒感染的一个重要途径。益生菌可缩短轮状病毒感染导致的腹泻持续时间、减少腹泻发病次数等。
4.如何通过构建轮状病毒感染诱发的小鼠腹泻模型,通过优化多糖活性成分提取方法,将具有缓解轮状病毒感染造成的肠道通透性增加、肠道功能降低,增强肠道免疫力的活性多糖组分复配益生菌用于治疗轮状病毒感染诱发的小鼠腹泻成为缓解病毒性腹泻的重要研究方向。
技术实现要素:
5.本发明的目的是要提供一种采用中医药提取技术、副作用小、疗效独特的缓解病毒感染造成肠道功能紊乱的组合物及其制备方法和应用。
6.为了解决上述技术问题,本发明采取的技术方案如下:
7.一种缓解病毒感染造成肠道功能紊乱的组合物,其包括活性多糖和益生菌,所述活性多糖和益生菌的质量百分比为(1.1-2):(0.02-0.2)。
8.上述的一种缓解病毒感染造成肠道功能紊乱的组合物,其所述活性多糖包括蓝莓活性多糖、白桃活性多糖,所述蓝莓活性多糖和白桃活性多糖的质量百分比为1:(0.01-1)。
9.上述的一种缓解病毒感染造成肠道功能紊乱的组合物,其所述蓝莓活性多糖和白桃活性多糖的分子量为1-3kd。
10.上述的一种缓解病毒感染造成肠道功能紊乱的组合物,其包括益生菌包括短双歧杆菌、罗伊氏乳杆菌,所述短双歧杆菌和罗伊氏乳杆菌的质量百分比为1: 1。
11.一种缓解病毒感染造成肠道功能紊乱的组合物的制备方法,其包括以下步骤:
12.(1)活性多糖的制备:选取一定量的蓝莓多糖和白桃多糖,分别加入5-10 倍的去离子水溶解,将多糖水溶液用透析袋透析,收集透析液,冻干制得不同分子量的蓝莓活性多糖和白桃活性多糖;
13.(2)分别称取蓝莓活性多糖、白桃活性多糖和益生菌冻干粉,蓝莓活性多糖、白桃活性多糖和益生菌冻干粉的质量百分比为1:(0.1-1):(0.02-0.2);
14.(3)将称取的蓝莓活性多糖和白桃活性多糖混合均匀,加去离子水调成固含量为5-25%的浆状液体,浆状液体经过冻干制成组合物粉末,将组合物粉末复配益生菌冻干粉,混和均匀,再次冻干,即制得缓解病毒感染造成肠道功能紊乱的组合物。
15.上述的一种缓解病毒感染造成肠道功能紊乱的组合物的制备方法,其所述透析袋的孔径小于等于10kd,优选透析袋的孔径小于等于3kd。
16.上述的一种缓解病毒感染造成肠道功能紊乱的组合物的制备方法,其所述益生菌冻干粉包括短双歧杆菌冻干粉和罗伊氏乳杆菌冻干粉。
17.上述的一种缓解病毒感染造成肠道功能紊乱的组合物的制备方法,其所述蓝莓活性多糖、白桃活性多糖、短双歧杆菌冻干粉、罗伊氏乳杆菌冻干粉的质量比为1:(0.1-1):(0.01-0.1):(0.01-0.1),优选地,蓝莓活性多糖、白桃活性多糖、短双歧杆菌冻干粉、罗伊氏乳杆菌冻干粉的质量比为1:1:0.05: 0.05。
18.一种缓解病毒感染造成肠道功能紊乱的组合物的应用,其适用于轮状病毒感染所致的肠道屏障、功能损伤。
19.上述的一种缓解病毒感染造成肠道功能紊乱的组合物的应用,其所述缓解病毒感染造成肠道功能紊乱的组合物添加辅料,适用于食品、膳食补充剂、功能性食品或药品。
20.有益效果:
21.本发明通过简单的、基于活性评价的方法分离获得蓝莓活性多糖、白桃活性多糖具有缓解轮状病毒感染造成的肠道通透性增加、肠道功能降低,增强肠道免疫力的活性成分,然后将蓝莓活性多糖、白桃活性多糖最优活性成分优化组合并复配具有缓解轮状病毒感染造成的肠道通透性增加、肠道功能降低,增强肠道免疫力的短双歧杆菌、罗伊氏乳杆菌冻干菌粉,将这种活性多糖成分复配益生菌组合物用于缓解轮状病毒感染造成的肠道通透性增加、肠道功能降低,增强肠道免疫力有非常显著的活性,且无副作用。
附图说明
[0022][0023]
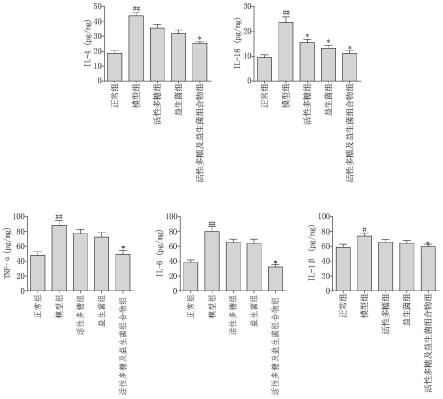
图1本发明对感染rv乳鼠血清tnf-α、il-1β、il-18、il-6及il-4含量的影响;
[0024]
图2本发明对感染rv乳鼠血清no、pge2、ifn-γ、il-10及tgf-β含量的影响;
[0025]
图3本发明对感染rv乳鼠血清中iga抗体及mmcp-1的影响;
[0026]
图4本发明对感染rv乳鼠inos、cox-2表达的影响;
[0027]
图5本发明对感染rv乳鼠iκbα的磷酸化、nf-κb蛋白核转移的影响;
[0028]
图6本发明对感染rv乳鼠nlrp3炎症小体蛋白表达的影响。
具体实施方式
[0029]
下面将结合实施例对本发明技术方案进行清楚、完整的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
[0030]
实施例1
[0031]
本实施例提供了一种缓解病毒感染造成肠道功能紊乱的组合物,其包括活性多糖
和益生菌,活性多糖和益生菌的质量百分比为(1.1-2):(0.02-0.2)。
[0032]
其中,活性多糖包括分子量为1-3kd的蓝莓活性多糖、分子量为1-3kd的白桃活性多糖,蓝莓活性多糖和白桃活性多糖的质量百分比为1:(0.01-1);益生菌包括短双歧杆菌、罗伊氏乳杆菌,短双歧杆菌和罗伊氏乳杆菌的质量百分比为1:1。
[0033]
本实施例的制备方法包括:
[0034]
(1)蓝莓活性多糖的制备
[0035]
取蓝莓多糖100g并加入500-1000g的去离子水溶解,蓝莓多糖水溶液用孔径为10kd,5kd,3kd,1kd的透析袋透析,分别收集不同分子量的透析液,冻干得到不同分子量的蓝莓活性多糖。基于构建的轮状病毒感染诱发的小鼠腹泻模型评价不同分子量蓝莓多糖的保护活性,实验结果显示,分子大小在 1-3kd之间的蓝莓多糖对轮状病毒感染诱发的腹泻小鼠保护活性最佳。
[0036]
(2)白桃活性多糖的制备
[0037]
取白桃多糖100g并加入500-1000g的去离子水溶解,白桃多糖水溶液用孔径为10kd,5kd,3kd,1kd的透析袋透析,分别收集不同分子量的透析液,冻干得到不同分子量的白桃活性多糖。基于构建的轮状病毒感染诱发的小鼠腹泻模型评价不同分子量白桃多糖的保护活性,实验结果显示,分子大小在 1-3kd之间的白桃多糖对轮状病毒感染诱发的腹泻小鼠保护活性最佳。
[0038]
(3)益生菌筛选
[0039]
基于构建的轮状病毒感染诱发的小鼠腹泻模型评价多种益生菌的保护活性,实验结果显示,短双歧杆菌、罗伊氏乳杆菌对轮状病毒感染诱发的腹泻小鼠保护活性最佳。
[0040]
(4)本实施例组合物的制备
[0041]
根据配方称取:分子大小在1-3kd之间的蓝莓活性多糖1g、分子大小在 1-3kd之间的白桃活性多糖1g、短双歧杆菌冻干粉0.05g、罗伊氏乳杆菌冻干粉0.05g。
[0042]
将称取好的蓝莓活性多糖、白桃活性多糖混合混匀,加去离子水调成固含量为5-25%的浆状液体,浆状液体经过冻干制成组合物粉末,组合物粉末加短双歧杆菌冻干粉、罗伊氏乳杆菌冻干粉,混匀,再次冻干即制得本实施例的缓解病毒感染造成肠道功能紊乱的组合物。
[0043]
本实施例的缓解病毒感染造成肠道功能紊乱的组合物适用于轮状病毒感染所致的肠道屏障、功能损伤。添加辅料可适用于食品、膳食补充剂、功能性食品或药品。
[0044]
应用实验:
[0045]
将4日龄乳鼠分为正常组、模型组、活性多糖(分子量1-3kd之间的蓝莓活性多糖与分子量1-3kd之间的白桃活性多糖之间质量比为1:1)组、益生菌 (短双歧杆菌、罗伊氏乳杆菌之间质量比为1:1)组、本实施例的活性多糖及益生菌组合物组,每组10只。正常组灌服dmem培养液100μl/只;模型组和给药组灌服sa-11株rv液(100tcid50,100倍病毒的半数组织培养感染剂量), 100μl/只,a群轮状病毒检测试剂盒检测结果为阳性时表明造模成功。24h 后,活性多糖组0.1g/kg/d、益生菌组0.05g/kg/d、本实施例的活性多糖及益生菌组合物组0.1g/kg/d剂量灌服,灌服量均为100μl;正常组及模型组灌服双蒸水,每日1次,连续5d。
[0046]
每日记录各组乳鼠临床特征:精神状况、皮肤脱水情况、肛门红肿及腹部膨胀等现
象。每日记录每只乳鼠的体重,连续记录6d(造模1d,给药5d,一共6d)。计算乳鼠体重增长情况。轻按每只乳鼠腹部,观察其排出的粪便,基于乳鼠粪便的颜色、形态对其腹泻程度进行评分并记录腹泻分数,分为0~4 分。0分:没有粪便;1分:正常大便;2分:淡黄色软便;3分:淡黄色稀便; 4分:水样便。腹泻分数的判断由同一人完成。
[0047]
给药第1日和第5日,收集各组每只乳鼠大便分别置于1.5ml无菌ep管,按a群轮状病毒检测试剂盒使用说明书进行检测rv抗原,计算rv抗原转阴率, rv抗原转阴率=(给药第1日rv阳性个数-给药第5日rv阳性个数给药)/第 1日rv阳性个数。
[0048]
第5日给药1h后,断颈采血,处死乳鼠,取血液于无菌ep管中,4℃1000
×
g 离心10min取血清,elisa试剂盒检测iga抗体、肥大细胞蛋白酶(mmcp-1)、炎性细胞因子tnf-α、il-6、il-4、il-18、il-1β的水平及小鼠血清no、pge2、 ifn-γ、il-10、tgf-β的水平。western blot检测肠组织中inos、cox-2、iκbα、 nf-κb及nlrp3炎症小体相关蛋白的表达情况。
[0049]
结果如下:
[0050]
正常组乳鼠从实验开始到结束,大便呈黄棕色颗粒状,未见腹泻,皮肤红润饱满。
[0051]
模型组和各给药组乳鼠在感染rv后12~24h,出现腹部膨胀,体毛蓬松,活力下降,皮肤皱缩等现象,并陆续出现腹泻。
[0052]
模型组在造模后到实验结束持续腹泻。活性多糖及益生菌组合物组给药第2 日腹泻程度减轻或没有出现腹泻,精神明显好转,活动能力提升;给药第3日活性多糖及益生菌组给药组乳鼠腹泻程度明显减轻;给药第5日基本不再出现腹泻。
[0053]
表1活性多糖及益生菌组合物对各组小鼠体重增长情况的影响
[0054][0055]
由表1可看出,与正常组相比,模型组乳鼠在造模后第1天体重增长较正常组缓慢(p<0.05),造模后第2~5日体重增长较正常组更缓慢(p<0.01);与模型组相比,给药第3日,活性多糖及益生菌组合物组乳鼠体重增长较模型组快(p<0.05);给药第5日,活性多糖组及益生菌组体重增长缓慢(p<0.05),在整个给药过程中,活性多糖及益生菌组合物组乳鼠体重增长较快(p>0.05)。相比于活性多糖组及益生菌组,活性多糖及益生菌组合物组对小鼠体重的增长作用比单独使用活性多糖或益生菌效果更好。
[0056]
表2活性多糖及益生菌组合物对小鼠不同给药天数的粪便指数的影响
[0057][0058]
由表2可看出,与正常组相比,模型组乳鼠粪便指数明显大于正常组(p< 0.01);与模型组相比,给药第2日,各给药组乳鼠粪便指数均有下降,给药第3~5日,各个给药组乳
鼠粪便指数均下降明显(p<0.05)。给药第1~5日活性多糖及益生菌组合物组乳鼠粪便指数下降更加明显(p>0.05)。表明活性多糖及益生菌组合物具有优异的抗rv乳鼠腹泻的功效。
[0059]
表3活性多糖及益生菌组合物对感染rv乳鼠抗原转阴率的影响
[0060][0061][0062]
由表3可看出,经5d给药干预后,与模型组比较,各给药组乳鼠rv抗原转阴率明显高于模型组,其中活性多糖及益生菌组合物组转阴率高达90%。
[0063]
参照图1,与正常对照组比较,模型组小鼠tnf-α、il-1β、il-18、il-6 及il-4表达明显升高,差异有统计学意义(p《0.01);说明轮状病毒感染诱发小鼠肠道炎症发生,会进一步损伤小鼠肠道功能;而与模型组比较,活性多糖及益生菌组合物组tnf-α、il-1β、il-18、il-6及il-4表达明显下调,差异有统计学意义(p《0.01),推测,活性多糖及益生菌组合物可能是通过抑制轮状病毒诱发的炎症,减轻对肠道的损伤,进而发挥保护活性的。
[0064]
参照图2,与正常对照组比较,模型组小鼠no、pge2含量明显升高,差异有统计学意义(p《0.01);说明轮状病毒感染诱发小鼠肠道炎症、损伤小鼠肠道功能;而与模型组比较,活性多糖及益生菌组合物组no、pge2含量明显下调,差异有统计学意义(p《0.05)。与正常对照组比较,模型组小鼠ifn-γ、 il-10及tgf-β含量明显降低,差异有统计学意义(p《0.01);说明轮状病毒感染诱发小鼠肠道炎症、损伤小鼠肠道功能;而与模型组比较,活性多糖及益生菌组合物组ifn-γ、il-10及tgf-β含量明显增加,差异有统计学意义 (p《0.05)。
[0065]
参照图3,按照elisa试剂盒说明书测定小鼠血清中iga抗体及mmcp-1水平。由图3可知,正常组小鼠血清iga、mmcp-1含量显著低于模型小鼠组;而活性多糖及益生菌组合物治疗后的小鼠血清iga抗体水平及mmcp-1分泌显著下降。由此可知,活性多糖及益生菌组合物能降低iga水平及mmcp-1分泌,从而缓解小鼠腹泻状况。
[0066]
参照图4,与正常对照组比较,模型组inos、cox-2蛋白表达显著增加,差异有统计学意义(p《0.01);与模型组比较,活性多糖及益生菌组合物组inos、 cox-2蛋白表达明显降低,差异有统计学意义(p《0.01)。
[0067]
参照图5,与正常对照组比较,模型组iκbα的磷酸化、nf-κb蛋白核转移表达显著增加,差异有统计学意义(p《0.01);与模型组比较,活性多糖及益生菌组合物组iκbα的磷酸化、nf-κb蛋白核转移明显降低,差异有统计学意义(p《0.01)。
[0068]
参照图6,与正常对照组比较,模型组caspase-1、nlrp3及asc表达显著增加,差异有统计学意义(p《0.01);与模型组比较,活性多糖及益生菌组合物组caspase-1、nlrp3及asc表达明显降低,差异有统计学意义(p《0.01)。
[0069]
急性毒性试验:
[0070]
1、试验动物:昆明种小鼠,体重20
±
2g,由广东省实验动物中心提供
[0071]
2、药物:本发明的活性多糖及益生菌组合物。
[0072]
3、试验方法:根据国家药品监督管理局颁布修订的“中药新药研究技术要求”,对本发明的活性多糖及益生菌组合物进行急性毒性实验。因受药物浓度及体积限制,无法测定ld50,故进行最大给药量实验。取昆明种小鼠30只,雌性各半,灌胃给予活性多糖及益生菌组合物1g/ml,每只0.8ml,即小鼠的最大灌胃体积用药后观察小鼠活动状态、饮食、粪便、呼吸、体重及死亡情况,连续观察14d。
[0073]
4、试验结果:各组小鼠灌胃给药后生长良好,体重增加,行为正常,均未见死亡及明显反应。将动物处死后,肉眼观察各主要脏器无异常现象。
[0074]
结果表明,本发明的活性多糖及益生菌组合物最大剂量口服应用,对动物无明显损害,未发现对机体产生的毒性反应,是一种安全可靠的药物(膳食补充剂)。
[0075]
实施例2
[0076]
本实施例与实施例1的不同之处在于,蓝莓活性多糖、白桃活性多糖、短双歧杆菌冻干粉、罗伊氏乳杆菌冻干粉的质量比为1:0.1:0.1:0.1。
[0077]
实施例3
[0078]
本实施例与实施例1的不同之处在于,蓝莓活性多糖、白桃活性多糖、短双歧杆菌冻干粉、罗伊氏乳杆菌冻干粉的质量比为1:0.1:0.01:0.01。
[0079]
实施例4
[0080]
本实施例与实施例1的不同之处在于,蓝莓活性多糖、白桃活性多糖、短双歧杆菌冻干粉、罗伊氏乳杆菌冻干粉的质量比为1:1:0.01:0.01。
[0081]
实施例5
[0082]
本实施例与实施例1的不同之处在于,蓝莓活性多糖、白桃活性多糖、短双歧杆菌冻干粉、罗伊氏乳杆菌冻干粉的质量比为1:1:0.1:0.1。
[0083]
实施例6
[0084]
本实施例与实施例1的不同之处在于,蓝莓活性多糖、白桃活性多糖、短双歧杆菌冻干粉、罗伊氏乳杆菌冻干粉的质量比为1:0.5:0.1:0.01。
[0085]
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。