1.本发明属于生物医药技术领域,具体涉及三种肺纤维化体外模型的构建方法,分别是肺类器官的纤维化模型、成纤维细胞-肺类器官共培养体系的纤维化模型和成纤维细胞-免疫细胞-肺类器官共培养体系的纤维化模型。
背景技术:
2.肺与人体呼吸息息相关,一旦肺部出现严重病变将会大大影响人的生活质量。肺纤维化即pulmonary fibrosis(pf),是一种由多种病因引起的慢性进行性肺间质疾病,特发性pf(ipf)是临床常见和具有代表性的慢性肺纤维化。ipf病因不明,主要影响的是60-75岁的男性,患病率为每10万人口13~20人,平均生存期只有3~5年,5年生存期仅有30%。目前肺移植和药物治疗是针对ipf常见的治疗手段,肺移植受限于肺源、手术条件、治疗费用、年龄等因素的干扰,甚至存在慢性同种异体移植功能障碍和感染的严重风险;fda获批的ipf治疗药物(吡非尼酮和尼达尼布)只能减缓患者的肺功能下降,在预防疾病进展和改善生活质量方面疗效有限,甚至还存在药物耐受问题,疾病晚期的患者更是无药可医。因此,构建具有代表性的肺纤维化模型对于疾病机制的研究和药物研发至关重要。
3.目前常用的特发性肺纤维化(ipf)模型主要包括博来霉素(blm)处理的动物模型(小鼠、大鼠、仓鼠、兔子、豚鼠、狗等)以及转化生长因子-β(transforming growth factor,tgf-β)处理的细胞模型(人胚肺成纤维细胞(mrc-5,hfl1)和ii型肺上皮细胞系(a549)等);近来,利用人干细胞(hpscs)诱导来源的肺类器官进行纤维化的诱导模型也取得了一定的进展。这些模型在一定程度上可以重现肺纤维化的某些特征,包括成纤维细胞的增殖,以及动物和类器官模型中能够检测到胶原的累积。
4.细胞模型的缺点在于原代肺上皮细胞获取困难、培养时长有限,永生化细胞系又不能维持源细胞特性等,使得其在模型构建上存在局限性;基于动物模型进行的研究并不一定能阐明人肺组织、发育和疾病特性,研究表明:小鼠肺和人类肺之间存在显著的细胞和分子差异;比如:研究发现依维莫司(具有免疫抑制和抗纤维增殖作用)在大鼠模型中可减轻blm诱导的肺纤维化,然而,在为期3年的人类研究(设置随机安慰剂为对照)中尚未发现其对ipf的治疗效果,甚至存在过度毒性;此外,还有研究发现tnf-a过表达与肺间质中成纤维细胞增加和ecm蛋白沉积有关,在小鼠模型中注射抗tnf-a的抗体可减少blm诱导的肺部炎症和纤维化,但在一项ii期试验中,依那西普(一种重组人tnf-a受体,结合并灭活tnf-a)在患者治疗中并未显示出显著改善效果,且目前还没有实验动物模型能够模拟在人类中检测到的肺纤维化的所有典型特征;hpscs诱导的肺类器官主要由上皮细胞组成,非上皮细胞的缺失使其并不能再现真实器官的结构,且诱导的肺类器官时间长,成本高,成熟度低,而肺纤维化是一种与年龄高度相关的疾病。此外,细胞和hpscs诱导的单一类器官来源的肺纤维化模型缺乏内皮细胞、间质细胞、成纤维细胞以及免疫细胞等相关微环境内的细胞间相互作用,使得其在疾病模拟、药物筛选和研发中存在弊端。
技术实现要素:
5.本发明的目的是提供一种基于人/鼠肺组织建立的肺纤维化类器官体外模型的构建方法,建立一种既能缩短实验周期,又能够更贴近肺纤维化组织结构,且包含间质细胞和免疫细胞的肺类器官纤维化体外模型,为疾病模拟和新药研发提供更优化的平台。
6.本发明的方法按以下步骤进行:
7.(1)获取肺组织,用生理盐水清洗去除血水、周围血管、脂肪和筋膜,然后将肺组织剪碎,获得均匀的组织碎块;
8.(2)将组织碎块置于trypsin或iv型胶原酶中,在37
±
0.5℃条件下摇晃消化,时间40~180min,获得均匀的消化细胞小团块;
9.(3)用2倍hbss终止消化后离心3~5min,收集细胞沉淀;
10.(4)将步骤(3)中的细胞进行红细胞裂解处理后,进行活细胞计数,然后按105~106个细胞/毫升的比例种胶滴,在37
±
0.5℃条件下孵育20~30min等胶滴凝固后,加入类器官培养基,培养6~10天后进行类器官传代;
11.(5)将步骤(3)中的细胞进行红细胞裂解处理后,进行活细胞计数,然后按105~106个细胞/毫升的比例转移至培养皿中,获得贴壁培养的成纤维细胞,培养6~8天后进行成纤维细胞传代;
12.(6)肺类器官的纤维化模型的构建方法,具体步骤包括:
13.(a)将步骤(4)中的类器官,用tryple express重新消化3~10min后种胶滴,按5000~10000个细胞/10ul胶滴培养至96孔板的一个孔中,加入类器官培养基培养1~2天;
14.(b)类器官培养1~2天后,将类器官培养基更换为含5~50ng/ml tgf-β1的类器官培养基处理48~72h,进行类器官的纤维化诱导,构建肺类器官纤维化模型;
15.(7)成纤维细胞-肺类器官共培养体系的纤维化模型的构建方法,具体步骤包括:
16.(a)使用步骤(5)中的成纤维细胞与肺类器官进行共培养,成纤维细胞数量为类器官的1~10倍,用类器官培养基重悬上述混合细胞并转移至低吸附96孔u型培养板中,培养1~2天。
17.(b)培养1~2天后,将上述成纤维细胞-共培养类器官的培养基换为含5~50ng/ml tgf-β1的肺类器官培养基处理48~72h,进行类器官的纤维化诱导,构建成纤维细胞-肺类器官共培养体系的纤维化模型;
18.(8)成纤维细胞-免疫细胞-肺类器官共培养体系的纤维化模型的构建方法,具体步骤包括:
19.(a)将成纤维细胞、免疫细胞和肺类器官三种细胞进行共培养,其中成纤维细胞的数量设置为类器官的1~10倍,免疫细胞的数量设置为类器官的1~20倍,由于地塞米松对免疫细胞的激活具有抑制作用,用去除地塞米松的类器官培养基重悬上述混合细胞并转移至低吸附96孔u型培养板中,培养1~2天;所述的免疫细胞为巨噬细胞或t细胞;
20.(b)培养1~2天后,将上述成纤维细胞-免疫细胞-肺类器官的培养基换成含5~50ng/ml tgf-β1或含3~20ug/ml blm且去除地塞米松的肺类器官培养基处理48~72h,进行类器官的纤维化诱导,构建成纤维细胞-免疫细胞-肺类器官共培养体系的纤维化模型。
21.上述的步骤(1)中,清洗是采用ph值=7.4的pbs缓冲液或生理盐水洗清。
22.上述的步骤(1)中,组织碎块的直径为1~2mm。
23.上述的步骤(2)中,trypsin的质量浓度为0.25%。
24.上述的步骤(2)中,每隔半小时观察组织松散状态,有大量细胞漏出后终止消化,获得消化细胞团块。
25.上述的步骤(3)中,离心速度为1000~1500rpm。
26.上述的步骤(4)中,种胶滴使用matrigel和dmem/f12的混合液,matrigel为dmem/f12的1.5~2倍。
27.上述的步骤(4)、(6)、(7)和(8)中,类器官培养的培养基成分包括dmem/f12基础培养基,100x的n2,50x的b27,1%的p/s,1~5mm的glutamax,0.2~1μm的monothioglycerol,1~10μm的chir99021,100~500ng/ml的r-spondin-1,1~50ng/ml的human fgf10,1~50ng/ml的human kgf,20~100nm的dexamethasone(地塞米松),0.05~0.3mm的8-bromo-camp(环磷酸腺苷)和0.05~0.3mm的ibmx(3-异丁基-1-甲基黄嘌呤),还有5~20ng/ml的bmp4和20~100nm的all-trans retinoic acid。
28.上述的步骤(4)中,前48h在培养基中添加10um的y-27632,用于促进细胞存活。
29.上述的步骤(4)中,培养4天后换新鲜培养基。
30.上述的步骤(5)中,进行成纤维细胞贴壁培养前,培养皿用质量浓度为0.1~0.2%的gelatin在37
±
0.5℃包被30~60min。
31.上述的步骤(5)中,进行成纤维细胞贴壁培养时,培养基成分包括dmem basic基础培养基,1%的p/s,1~5mm的glutamax,1~5mm的neaa,10~20%的fbs,以及5~20ng/ml的human fgf2。
32.上述的步骤(5)中,前24h在培养基中添加10um的y-27632,用于促进细胞存活。
33.上述的步骤(5)中,培养4天后换新鲜培养基。
34.本发明所述方法利用肺类器官培养技术,结合原代成纤维细胞-原代免疫细胞-肺类器官共培养技术,利用tgf-β1或blm构建的肺纤维化体外研究模型,可以弥补现有动物、细胞模型的不足,为肺纤维化疾病机制的研究、新药研发、药物敏感性检测和临床前患者反应性监测提供更有利的支持。
35.本发明培养基具体特点如下:
36.1、相比于动物模型和hpsc诱导来源的肺类器官模型,本肺纤维化模型可以缩短实验周期,降低实验成本。
37.2、本模型利用肺类器官、原代成纤维细胞和原代免疫细胞构建的肺纤维化模型,相比于细胞系模型,能够更好地模拟肺纤维化病理特征;相比于动物模型,简化了操作难度,增强了模型的稳定性和可控性,是一种良好的肺纤维化体外研究模型。
38.3、组织来源的肺类器官模型相比于hpsc诱导来源的肺类器官模型,能够更好的保持组织结构和特征,细胞的成熟度更高。
39.4、成纤维细胞和免疫细胞的存在还丰富了肺纤维化模型的微环境,为疾病模拟和新药研发提供更优化的平台。
附图说明
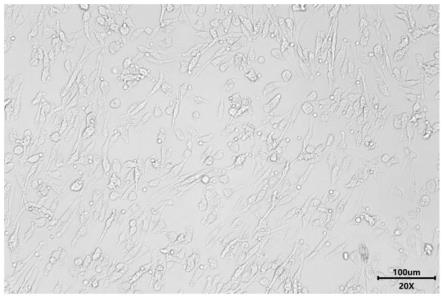
40.图1为本发明实施例1中培养得到的人肺类器官的光学显微图;
41.图2为本发明实施例1中培养得到的人原代肺成纤维细胞的光学显微图;
42.图3为本发明实施例2中培养得到的鼠肺类器官的光学显微图;
43.图4为本发明实施例2中培养得到的鼠肺类器官纤维化模型的光学显微图;
44.图5为本发明实施例2中对鼠肺类器官纤维化模型进行a-sma染色的鉴定结果图。
具体实施方式
45.本发明实施例的步骤(1)中,清洗是采用ph值=7.4的pbs缓冲液或生理盐水洗清。
46.本发明实施例的步骤(1)中,组织碎块的直径为1~2mm。
47.本发明实施例的步骤(2)中,trypsin的质量浓度为0.25%。
48.本发明实施例的步骤(2)中,每隔半小时观察组织松散状态,有大量细胞漏出后终止消化,获得消化细胞团块。
49.本发明实施例的步骤(3)中,离心速度为1000~1500rpm。
50.本发明实施例的步骤(4)中,种胶滴使用matrigel和dmem/f12的混合液,matrigel为dmem/f12的1.5~2倍。
51.本发明实施例的步骤(4)、(6)、(7)和(8)中,类器官培养的培养基成分包括dmem/f12基础培养基,100x的n2,50x的b27,1%的p/s,1~5mm的glutamax,0.2~1μm的monothioglycerol,1~10μm的chir99021,100~500ng/ml的r-spondin-1,1~50ng/ml的human fgf10,1~50ng/ml的human kgf,20~100nm的dexamethasone(地塞米松),0.05~0.3mm的8-bromo-camp(环磷酸腺苷)和0.05~0.3mm的ibmx(3-异丁基-1-甲基黄嘌呤),还有5~20ng/ml的bmp4和20~100nm的all-trans retinoic acid。
52.本发明实施例的步骤(4)中,前48h在培养基中添加10um的y-27632,用于促进细胞存活。
53.本发明实施例的步骤(4)中,培养4天后换新鲜培养基。
54.本发明实施例的步骤(5)中,进行成纤维细胞贴壁培养前,培养皿用质量浓度为0.1~0.2%的gelatin在37
±
0.5℃包被30~60min。
55.本发明实施例的步骤(5)中,进行成纤维细胞贴壁培养时,培养基成分包括dmem basic基础培养基,1%的p/s,1~5mm的glutamax,1~5mm的neaa,10~20%的fbs,以及5~20ng/ml的human fgf2。
56.本发明实施例的步骤(5)中,前24h在培养基中添加10um的y-27632,用于促进细胞存活。
57.本发明实施例的步骤(5)中,培养4天后换新鲜培养基。
58.实施例1人肺类器官纤维化模型的构建
59.(1)获取人肺组织,用生理盐水清洗去除血水、周围血管、脂肪和筋膜,然后将人肺组织剪碎,获得均匀的组织碎块;
60.(2)将组织碎块置于trypsin中,在37
±
0.5℃条件下摇晃消化,时间60min,获得均匀的消化细胞小团块;
61.(3)用2倍hbss终止消化离心3min,收集细胞沉淀;
62.(4)将步骤(3)中的细胞进行红细胞裂解处理后,进行活细胞计数,然后按105个细胞/毫升的比例种胶滴,在37
±
0.5℃条件下孵育30min等胶滴凝固后,加入类器官培养基,培养10天后进行人肺类器官传代,类器官的光学显微图如图1所示;
63.(5)将步骤(3)中的细胞进行红细胞裂解处理后,进行活细胞计数,然后按105个细胞/毫升的比例转移至培养皿中,获得贴壁培养的原代人肺成纤维细胞,培养8天后进行成纤维细胞传代,人原代肺成纤维细胞的光学显微图如图2所示;
64.(6)人肺类器官的纤维化诱导模型的构建方法,具体步骤包括:
65.(a)将步骤(4)中的人肺类器官,用tryple express重新消化3min后种胶滴,按10000个细胞/10ul胶滴培养至96孔板的一个孔中,加入类器官培养基培养1天;
66.(b)类器官培养1天后,将类器官培养基更换为含25ng/ml tgf-β1的类器官培养基处理72h,进行类器官的纤维化诱导,构建人肺类器官纤维化模型;
67.(7)成纤维细胞-肺类器官共培养体系的纤维化诱导模型的构建方法,具体步骤包括:
68.(a)使用步骤(5)中的成纤维细胞与肺类器官进行共培养,成纤维细胞数量为类器官的2倍,用类器官培养基重悬上述混合细胞并转移至低吸附96孔u型培养板中,培养2天。
69.(b)培养2天后,将上述成纤维细胞-共培养类器官的培养基换为含25ng/ml tgf-β1的肺类器官培养基处理72h,进行类器官的纤维化诱导,构建成纤维细胞-肺类器官共培养体系的纤维化模型;
70.(8)成纤维细胞-免疫细胞-肺类器官共培养体系的纤维化诱导模型的构建方法,具体步骤包括:
71.(a)将成纤维细胞、免疫细胞和肺类器官三种细胞进行共培养,其中成纤维细胞的数量设置为类器官的2倍,免疫细胞的数量设置为类器官的5倍,由于地塞米松对免疫细胞的激活具有抑制作用,用去除地塞米松的类器官培养基重悬上述混合细胞并转移至低吸附96孔u型培养板中,培养2天;所述的免疫细胞为巨噬细胞;
72.(b)培养2天后,将上述成纤维细胞-免疫细胞-肺类器官的培养基换成含25ng/ml tgf-β1且去除地塞米松的肺类器官培养基处理72h,进行类器官的纤维化诱导,构建成纤维细胞-免疫细胞-肺类器官共培养体系的纤维化模型。
73.实施例2鼠肺类器官纤维化模型的构建
74.方法同实施例1,不同点在于:
75.步骤(1)中,用的是鼠肺组织;
76.步骤(2)中,将组织碎块置于iv型胶原酶中,37
±
0.5℃消化时间40min;
77.步骤(3)中,用2倍hbss终止消化离心5min,收集细胞沉淀;
78.步骤(4)中,将步骤(3)中的细胞进行红细胞裂解处理后,进行活细胞计数,然后按106个细胞/毫升的比例种胶滴,在37
±
0.5℃条件下孵育20min等胶滴凝固后,加入类器官培养基,培养7天后进行鼠肺类器官传代,鼠肺类器官的光学显微图如图3所示;
79.步骤(5)中,将步骤(3)中的细胞进行红细胞裂解处理后,进行活细胞计数,然后按106个细胞/毫升的比例转移至培养皿中,获得贴壁培养的原代鼠肺成纤维细胞,培养6天后进行成纤维细胞传代;
80.步骤(6)的(a)中,将步骤(4)中的类器官,用tryple express重新消化10min后种胶滴,按5000个细胞/10ul胶滴培养至96孔板的一个孔中,加入类器官培养基培养2天;
81.步骤(6)的(b)中,类器官培养2天后,将类器官培养基更换为含50ng/ml tgf-β1的类器官培养基处理48h,进行类器官的纤维化诱导,构建鼠肺类器官纤维化模型,鼠肺类器
官纤维化模型的光学显微图如图4所示,其中左图为纤维化诱导前,中图和右图为纤维化诱导后;对鼠肺类器官纤维化模型进行a-sma染色的鉴定结果如图5所示,其中左图为纤维化诱导前,中图和右图为纤维化诱导后;
82.步骤(7)的(a)中,使用步骤(5)中的鼠成纤维细胞与鼠肺类器官进行共培养,成纤维细胞数量为类器官的5倍,用类器官培养基重悬上述混合细胞并转移至低吸附96孔u型培养板中,培养1天。
83.步骤(7)的(b)中,培养1天后,将上述成纤维细胞-共培养类器官的培养基换为含50ng/ml tgf-β1的肺类器官培养基处理48h,进行类器官的纤维化诱导,构建鼠成纤维细胞-鼠肺类器官共培养体系的纤维化模型;
84.步骤(8)的(a)中,将鼠成纤维细胞、鼠免疫细胞和鼠肺类器官三种细胞进行共培养,其中成纤维细胞的数量设置为类器官的5倍,免疫细胞的数量设置为类器官的20倍,由于地塞米松对免疫细胞的激活具有抑制作用,用去除地塞米松的类器官培养基重悬上述混合细胞并转移至低吸附96孔u型培养板中,培养1天;所述的免疫细胞为t细胞;
85.步骤(7)的(b)中,培养1天后,将上述鼠成纤维细胞-鼠免疫细胞-鼠肺类器官的培养基换成含20ug/ml blm且去除地塞米松的肺类器官培养基处理48h,进行类器官的纤维化诱导,构建鼠成纤维细胞-鼠免疫细胞-鼠肺类器官共培养体系的纤维化模型。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。