pet水解酶ispetase-csp突变酶及编码基因及工程菌
技术领域
1.本发明属于酶工程和生物工程技术领域,具体涉及一种pet水解酶ispetase-csp突变酶及编码基因及含有编码基因的质粒及工程菌。
背景技术:
2.pet是最丰富的聚酯塑料,由取自原油的对苯二甲酸(tpa)和乙二醇(eg)通过酯键相连构成。pet具有合成简单、价格低廉、坚固耐用等特性,pet产品包括纤维级pet和非纤维级pet(如瓶类、薄膜和工程塑料等),包装是pet最大的非纤维级应用市场,也是增速最快的领域。目前大部分瓶装水、软饮料都使用pet进行灌装;pet在食品、药品、化妆品和日用化学品包装等领域也得到更广泛的应用。
3.随之而来的是大量的pet通过生产或废物处理的方式被引入到环境中,在全球生态系统中累积从而导致严重的环境破坏。pet具有高比例的芳香族对苯二甲酸酯单元,会降低链迁移率,因此是一种极难水解的聚酯,在自然界中可存在16-48年。目前,pet塑料主要处理方法是填埋、焚烧、热解和化学降解,均存在对环境二次污染,而且超4000万吨/年pet塑料被遗弃/填埋至自然界中,造成全球污染极其严重。
4.近年,生物处理技术由于具有高效降解、低经济成本、绿色环保等特点被逐步应用到废弃塑料的处理当中。目前,在pet塑料的酶法降解领域已取得了较好的研究进展,为其进一步实现工业水平的循环利用提供了可能。此外,avantika singh等人预测酶法回收的tpa(rtpa)可能具有成本竞争力。除了有利的长期社会经济效益外,rtpa还可将每公斤tpa的总供应链能源使用量减少69%-83%,温室气体排放量减少17%-43%。一项针对美国的整体经济评估估计,与原始tpa生产相比,tpa回收过程可以减少高达95%的环境影响,同时产生高达45%的社会经济效益。
5.迄今为止,已经鉴定出许多pet水解酶,酯酶、脂肪酶或角质酶形式的pet水解酶是研究最广泛的塑料降解酶。但这些pet水解酶大多需要在50℃以上的温度条件下对pet进行降解,在常温下表现出极低的活性,因此利用这些酶无法对遗弃在自然界中的pet塑料实现就地降解。
6.2016年,日本团队发现一种将pet作为主要能量和碳源的细菌ideonella sakaiensis 201-f6,随后从中鉴定出pet水解酶ispetase和mhetase,ispetase首先将pet聚合物水解成mhet,然后类阿魏酸酯酶mhetase将mhet进一步水解成tpa和eg。与其他脂肪酶或角质酶对对硝基苯酯的高活性相比,ispetase更偏好pet底物。与低结晶度角质酶lcc、枯萎镰刀菌角质酶和thermififida fusca水解酶相比,在30℃下ispetase对pet膜的水解活性分别高5.5、88、120倍。
7.但ispetase仅在温和的条件下生长,其相对较低的热稳定性限制了其实际应用。此外,为了降低酶的制备和使用成本,应避免多种酶的使用。使用一种pet水解酶水解pet得到单一的tpa产物,将有利于tpa的回收及进一步的升级循环。因此,可通过对ispetase进行改造使其同时具有增强的水解pet活性和增强的mhetase酶活性,从而达到使用一种pet水
解酶ispetase突变体进行pet水解反应,反应得到的水解产物为单一的tpa,而没有中间产物mhet的累积。
技术实现要素:
8.本发明的目的是克服现有技术的不足,提供同时具有增强的pet降解活性和增强的mhet降解活性,使得降解pet反应得到单一tpa产物的pet水解酶ispetase-csp突变酶。
9.本发明的第二个目的是提供编码pet水解酶ispetase-csp突变酶ispetase
kea-csp的基因。
10.本发明的第三个目的是提供含有上述基因的重组质粒。
11.本发明的第四个目的是提供一种含有上述重组质粒的工程菌。
12.本发明的第五个目的是提供上述工程菌表达得到的ispetase
kea-csp在水解bhet中的应用。
13.本发明的第六个目的是提供上述工程菌表达得到的ispetase
kea-csp在水解pet中的应用。
14.本发明的技术方案概述如下:
15.pet水解酶ispetase-csp突变酶,命名为ispetase
kea-csp,所述ispetase
kea-csp的氨基酸序列如seq id no.1所示。
16.编码pet水解酶ispetase-csp突变酶的基因,所述基因的核苷酸序列如seq id no.2所示。
17.含有上述基因的重组质粒pet-22b-ispetase
kea-csp。
18.含有上述重组质粒的工程菌bl21(de3)/pet-22b-ispetase
kea-csp。
19.上述工程菌bl21(de3)/pet-22b-ispetase
kea-csp表达得到的ispetase
kea-csp在水解bhet中的应用,bhet为对苯二甲酸双(2-羟乙基)酯的简写。
20.上述应用,包括如下步骤:
21.向ph值为6.0~8.0的80mm磷酸氢二钠-hcl缓冲液中加入bhet使终浓度为800~1000μmol/l;加入ispetase
kea-csp使终浓度为50~200nm;在30~40℃,50~220rpm条件下孵育1~3天。
22.上述工程菌bl21(de3)/pet-22b-ispetase
kea-csp表达得到的ispetase
kea-csp在水解pet中的应用;pet为聚对苯二甲酸乙二醇酯的简写。
23.上述应用,包括如下步骤:
24.向ph值为8.5~9.5的50mm甘氨酸-naoh缓冲液中加入pet使终浓度为60~100mg/ml;加入ispetase
kea-csp使终浓度为500~1000nm;在30~40℃,50~220rpm条件下孵育1~3天。
25.本发明的优点:
26.本发明对pet水解酶ispetase-csp进行分子改造,经过表达纯化获得具有增强的pet降解活性和mhet降解活性的pet水解酶ispetase-csp突变酶,命名为ispetase
kea-csp,使用突变酶进行降解pet反应,可以使降解pet反应的产量提升,并得到单一的tpa产物。
附图说明
27.图1为pet水解酶ispetase和mhetase水解pet过程。
28.图2为pet水解酶突变酶水解pet过程。
29.图3为重组质粒pet-22b-ispetase-csp结构示意图。
30.图4为重组质粒pet-22b-ispetase
kea-csp结构示意图。
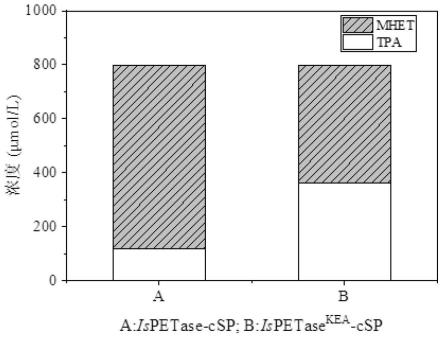
31.图5为pet水解酶ispetase-csp与ispetase
kea-csp催化降解对苯二甲酸双(2-羟乙基)酯的tpa和mhet产量。
32.图6为pet水解酶ispetase-csp与ispetase
kea-csp催化降解聚对苯二甲酸乙二醇酯的tpa和mhet产量。
具体实施方式
33.下面通过附图和具体实施例对本发明的技术方案做进一步详述,以下实施例只是描述性的,本发明所保护范围不限于此。
34.本发明中所使用的原料,如无特殊说明,均为常规的市售产品;本发明中所使用的方法,如无特殊说明,均为本领域的常规方法。
35.bhet为对苯二甲酸双(2-羟乙基)酯的简写;
36.pet为聚对苯二甲酸乙二醇酯的简写;
37.mhet为对苯二甲酸单(2-羟乙基)酯的简写;
38.tpa为对苯二甲酸的简写。
39.实施例1
40.含有编码pet水解酶ispetase-csp突变酶(ispetase
kea-csp)的基因的重组质粒pet-22b-ispetase
kea-csp的制备,具体步骤如下:
41.按照北京全式金生物生物技术有限公司无缝重组试剂盒的要求,以改造后的pet水解酶ispetase-csp基因(其中的pet水解酶的氨基酸序列如seq id no.3所示,基因如seq id no.4所示)作为模板,设计引物如下:
42.s92k-f:5
’‑
cgaccagccgaaaagccgctcgtcgcagcagatgg-3’(引入92位点的突变)(seq id no.5)
43.s92k-r:5
’‑
cgagcggcttttcggctggtcgagcgtggagttggtg-3’(引入92位点的突变)(seq id no.6)
44.d157e-f:5
’‑
ccgcaggccccgtgggagagctcgaccaac-3’(引入157位点的突变)(seq id no.7)
45.d157e-r:5
’‑
ctcccacggggcctgcggcgccgcggctttc-3’(引入157位点的突变)(seq id no.8)
46.r251a-f:5
’‑
gaacccgaacagcaccgccgtgtcggacttc-3’(引入251位点的突变)(seq id no.9)
47.r251a-r:5
’‑
gcggtgctgttcgggttctcgcaggcgaag-3’(引入251位点的突变)(seq id no.10)
48.按照无缝重组试剂盒的要求采用无缝连接和反向pcr技术构建含突变基因的重组质粒,主要分为三步:
49.(1)以重组质粒pet-22b-ispetase-csp(见图3,构建方法见已申请专利(申请号:202110900376.8),发明名称为:pet水解酶ispetase突变酶及编码基因及工程菌)为模板,s92k-f(seq id no.5)和s92k-r(seq id no.6)作为引物进行第一轮pcr扩增(95℃2min;95℃30s,58℃30s,72℃3.5min,30个循环;72℃10min),对其pcr产物进行dmt酶消化、核酸电泳和切胶回收后得到纯化的基因片段,在无缝重组连接酶作用下连接片段后,将其转化入dh5α感受态细胞,通过氨苄青霉素平板培养基筛选、质粒提取和测序验证,获得编码ispetase
k-csp突变酶的重组质粒pet-22b-ispetase
k-csp;
50.(2)以重组质粒pet-22b-ispetase
k-csp作为模板,d157e-f(seq id no.7)和d157e-r(seq id no.8)作为引物进行第二轮pcr扩增(95℃2min;95℃30s,58℃30s,72℃3.5min,30个循环;72℃10min),将获得的pcr产物按照同步骤(1)同样的步骤进行纯化,在无缝重组连接酶作用下连接片段后,转化入dh5α感受态细胞,通过氨苄青霉素平板培养基筛选、质粒提取和测序验证获得编码ispetase
ke-csp突变酶的重组质粒pet-22b-ispetase
ke-csp;
51.(3)以重组质粒pet-22b-ispetase
ke-csp作为模板,r251a-f(seq id no.9)和r251a-r(seq id no.10)作为引物进行第三轮pcr扩增(95℃2min;95℃30s,55℃30s,72℃3.5min,30个循环;72℃10min),将获得的pcr产物按照同步骤(1)同样的步骤进行纯化,在无缝重组连接酶作用下连接片段后,转化入dh5α感受态细胞,通过氨苄青霉素平板培养基筛选、质粒提取和测序验证获得编码ispetase
kea-csp突变酶的重组质粒pet-22b-ispetase
kea-csp,其结构如图4所示;
52.ispetase
kea-csp的氨基酸序列如seq id no.1所示。
53.编码pet水解酶ispetase-csp突变酶的基因,其特征是所述基因的核苷酸序列如seq idno.2所示。
54.所述氨苄青霉素平板培养基的配方为:酵母提取物5g/l,胰蛋白胨10g/l,氯化钠10g/l,琼脂粉15g/l,氨苄青霉素霉素50mg/l。
55.所述pcr反应体系以及pcr程序参照北京全式金生物技术有限公司fastpfudna polymerase试剂盒的要求进行,如下表所示:
[0056][0057]
实施例2
[0058]
bl21(de3)/pet-22b-ispetase
kea-csp工程菌的构建,包括如下步骤:
[0059]
将重组质粒pet-22b-ispetase
kea-csp转化入bl21(de3)感受态细胞,涂布于氨苄青霉素平板培养基,得到阳性重组子bl21(de3)/pet-22b-ispetase
kea-csp,即成功构建了含重组质粒pet-22b-ispetase
kea-csp的表达工程菌;
[0060]
按照上述方法构建对照菌bl21(de3)/pet-22b-ispetase-csp。
[0061]
实施例3
[0062]
工程菌bl21(de3)/pet-22b-ispetase
kea-csp的诱导表达和目的蛋白纯化
[0063]
将上述两种工程菌分别接种于lb液体培养基,37℃,220r/min培养过夜;将过夜培养菌液分别按1%的接种量接入新鲜的lb液体培养基中,37℃,220r/min培养至od600约为0.8时,添加0.1%(v/v)的iptg,降温至16℃诱导表达20h。4000rpm离心15min收集工程菌湿细胞。
[0064]
将工程菌湿细胞重悬于破菌缓冲液中,利用高压细胞破碎仪对重悬的湿细胞进行破菌处理。破菌后菌液经10000rpm离心60min除去细胞碎片,上清液经ni-nta填充柱吸附目的蛋白,利用洗杂缓冲液对非特异性吸附的杂蛋白进行清洗。利用洗脱缓冲液将目的蛋白洗脱,洗脱液经蛋白浓缩管浓缩。
[0065]
其中,所述lb液体培养基的配方为:酵母提取物5g/l,胰蛋白胨10g/l,氯化钠10g/l;
[0066]
所述破菌缓冲液的配方为:50mm tris-hcl,150mm nacl,10mm imidazole,ph=7.5;
[0067]
所述洗杂缓冲液的配方为:50mm tris-hcl,150mm nacl,20mm imidazole,ph=7.5;
[0068]
所述洗脱缓冲液的配方为:50mm tris-hcl,300mm nacl,300mm imidazole,ph=7.5;
[0069]
按照上述方法对对照菌bl21(de3)/pet-22b-ispetase-csp进行诱导表达后,在同样的条件下纯化和浓缩蛋白。
[0070]
实施例4
[0071]
利用pet水解酶ispetase-csp催化降解对苯二甲酸双(2-羟乙基)酯(bhet)
[0072]
向ph值为7.0的80mm磷酸氢二钠-hcl缓冲液中加入对苯二甲酸双(2-羟乙基)酯使终浓度为800μmol/l;加入ispetase-csp使终浓度为50nm;在35℃,50rpm条件下孵育3天。经hplc检测所得反应液中tpa产量为118.6μmol/l,mhet产量为680.4μmol/l,见图5中的a。
[0073]
实施例5
[0074]
利用pet水解酶ispetase-csp突变酶ispetase
kea-csp催化降解对苯二甲酸双(2-羟乙基)酯(bhet)
[0075]
向ph值为6.0的80mm磷酸氢二钠-hcl缓冲液中加入对苯二甲酸双(2-羟乙基)酯使终浓度为900μmol/l;加入ispetase
kea-csp使终浓度为200nm;在30℃,220rpm条件下孵育1天。经hplc检测所得反应液中tpa产量为202.7μmol/l,mhet产量为697.3μmol/l。
[0076]
实施例6
[0077]
利用pet水解酶ispetase-csp突变酶ispetase
kea-csp催化降解对苯二甲酸双(2-羟乙基)酯(bhet)
[0078]
向ph值为7.0的80mm磷酸氢二钠-hcl缓冲液中加入对苯二甲酸双(2-羟乙基)酯使终浓度为800μmol/l;加入ispetase
kea-csp使终浓度为50nm;在35℃,50rpm条件下孵育3天。经hplc检测所得反应液中tpa产量为360.0μmol/l,mhet产量为439.5μmol/l,见图5中的b。
[0079]
实施例7
[0080]
利用pet水解酶ispetase-csp突变酶ispetase
kea-csp催化降解对苯二甲酸双(2-羟乙基)酯(bhet)
[0081]
向ph值为8.0的80mm磷酸氢二钠-hcl缓冲液中加入对苯二甲酸双(2-羟乙基)酯使终浓度为1000μmol/l;加入ispetase
kea-csp使终浓度为100nm;在40℃,150rpm条件下孵育2天。经hplc检测所得反应液中tpa产量为303.8μmol/l,mhet产量为693.8μmol/l。
[0082]
实施例8
[0083]
利用pet水解酶ispetase-csp催化降解聚对苯二甲酸乙二醇酯(pet)
[0084]
向ph值为9.0的50mm甘氨酸-naoh缓冲液中加入聚对苯二甲酸乙二醇酯使终浓度为60mg/ml;加入ispetase-csp使终浓度为1000nm;在30℃,50rpm条件下孵育3天。经hplc检测所得反应液中tpa产量为0.83mg/l,mhet产量为1.61mg/l,见图6中的a。
[0085]
实施例9
[0086]
利用pet水解酶ispetase-csp突变酶ispetase
kea-csp催化降解聚对苯二甲酸乙二醇酯(pet)
[0087]
向ph值为9.0的50mm甘氨酸-naoh缓冲液中加入聚对苯二甲酸乙二醇酯使终浓度为60mg/ml;加入ispetase
kea-csp使终浓度为1000nm;在30℃,50rpm条件下孵育3天。经hplc检测所得反应液中tpa产量为3.03mg/l,见图6中的b。
[0088]
实施例10
[0089]
利用pet水解酶ispetase-csp突变酶ispetase
kea-csp催化降解聚对苯二甲酸乙二醇酯(pet)
[0090]
向ph值为8.5的50mm甘氨酸-naoh缓冲液中加入聚对苯二甲酸乙二醇酯使终浓度为80mg/ml;加入ispetase
kea-csp使终浓度为800nm;在40℃,100rpm条件下孵育2天。经hplc检测所得反应液中tpa产量为2.79mg/l。
[0091]
实施例11
[0092]
利用pet水解酶ispetase-csp突变酶ispetase
kea-csp催化降解聚对苯二甲酸乙二醇酯(pet)
[0093]
向ph值为9.5的50mm甘氨酸-naoh缓冲液中加入聚对苯二甲酸乙二醇酯使终浓度为100mg/ml;加入ispetase
kea-csp使终浓度为500nm;在35℃,220rpm条件下孵育1天。经hplc检测所得反应液中tpa产量为2.61mg/l。
[0094]
所述hplc的检测条件为:紫外检测器,240nm的特征吸收峰,zorbax eclipse plus c18反相色谱柱(5μl,250mm
×
4.6mm),流动相a为0.1%甲酸水溶液,流动相b为乙腈,在20min内流动相由5%乙腈升至70%乙腈,柱温30℃,进样量10μl,流速0.8ml/min。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。