1.本发明涉及高分子材料及化学化工领域,具体的,本发明涉及一种聚(α-亚甲基-δ-戊内酯)的制备方法。
背景技术:
2.随着社会经济的快速发展,高分子材料成为了人们生产生活中的必需品,广泛应用于服装制造,医疗卫生,食品包装等领域。传统的高分子材料不但严重依赖石油化工资源,而且不可降解/回收的聚合物的废弃势必会造成环境污染,而可再生高分子材料作为一种新型的“绿色”材料在近年来受到了社会各界的广泛关注。常见的可再生高分子材料包括聚己内酯、聚丙交酯、聚乳酸、聚羟基脂肪酸酯等。尽管这些可再生高分子材料以生物质为原料,也可以在自然环境下降解,但其降解通常产生二氧化碳和水,无法对原材料进行回收再利用,是对资源的极大浪费。
3.解决高分子材料污染问题的一种方法是制备化学可循环的高分子材料。化学可循环高分子材料是指聚合物通过化学方法可完全解聚得到其单体的高分子材料,并且解聚得到的单体能够再次高效聚合。目前对于这类高分子材料的研究主要有以下几种:聚(γ-丁内酯)、聚(反式六氢苯并呋喃-1(3h)酮)、4-羟基脯氨酸衍生的聚硫内酯、聚(α-亚甲基-δ-戊内酯)几种(nat.chem.2016,8,42-49;science 2018,360,398-403;j.am.chem.soc.2019,141,4928-4935;macromol.chem.phys.2019,220(12))。其中,聚(α-亚甲基-δ-戊内酯)是一类重要的聚酯材料,其单体α-亚甲基-δ-戊内酯可以通过生物基原料获得;另一方面,与现有常用聚酯材料相比,聚(α-亚甲基-δ-戊内酯)除了具有可降解的聚酯主链结构外,还含有双键侧基,可通过后修饰的方法对其进行改性,调控物理化学性质。然而,目前大多数的文献仅报道α-亚甲基-δ-戊内酯通过双键加聚反应得到主链为碳-碳键的聚合物,仅有一篇文献报道了通过开环聚合的方法制备得到主链为酯键的聚(α-亚甲基-δ-戊内酯)(macromol.chem.phys.2019,220(12))。该方法中使用了碱性有机催化剂(nhc)。然而,碱性催化剂所制备的聚合物分子量太低(mn≤5.6kg/mol),几乎没有力学性质;并且聚合反应需要在溶液中进行,大量有机溶剂的使用会造成更高的经济成本和环境污染。
4.有鉴于此,本发明提供了一种催化α-亚甲基-δ-戊内酯选择性本体开环聚合,制备高分子量聚(α-亚甲基-δ-戊内酯)的新方法。本发明提供的方法与以往报道的方法相比,具有以下有益之处:1)所得聚合产物分子量高,有较好的力学性质;2)所用催化体系选择性高,能够实现α-亚甲基-δ-戊内酯的选择性开环聚合,完整保留双键官能团,所得聚酯产品能够通过后修饰调控其物理化学性质;3)聚合反应无需溶剂,能够降低成本、简化生产工艺,符合绿色化学的要求。
技术实现要素:
5.本发明的目的是提供一种α-亚甲基-δ-戊内酯选择性本体开环聚合,制备高分子
量聚(α-亚甲基-δ-戊内酯)的方法,包括如下步骤:
6.(1)将引发剂、催化剂和α-亚甲基-δ-戊内酯混合均匀后,在一定温度下反应一段时间;
7.(2)加入碱性物质终止反应,将残留α-亚甲基-δ-戊内酯减压蒸馏除去后得到聚(α-亚甲基-δ-戊内酯)。
8.上述制备方法中,所述聚(α-亚甲基-δ-戊内酯)的化学结构如式(ⅰ)所示:
[0009][0010]
其特征在于,n为大于等于5的自然数,r1为羟基、烷氧基或芳基烷氧基,具体可为羟基、甲氧基、乙氧基、异丙氧基、叔丁氧基、苄氧基、苯基乙氧基、苯基丙氧基、二苯基甲氧基、2,2-二苯基乙氧基。
[0011]
上述的制备方法中,所述催化剂为磷酸酯,其结构如式(ⅱ)所示,r2和r3分别独立选自烷基或芳基,具体可分别为甲基、乙基、丁基、2-乙基己基、环己基、苯基、苄基、4-硝基苯基、4-甲氧基苯基、4-甲基苯基。
[0012][0013]
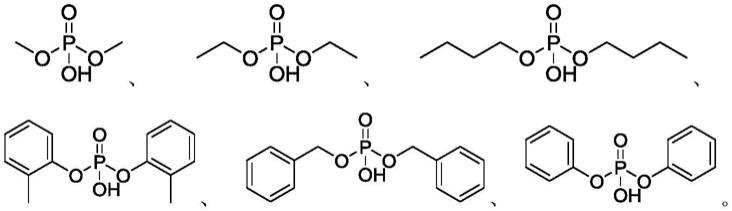
根据本发明的实施例,所述磷酸酯具有下列之一的结构:
[0014][0015]
上述制备方法中,步骤(1)中所述引发剂为醇,具体可为甲醇、乙醇、异丙醇、叔丁醇、苄醇、苯乙醇、苯丙醇、二苯基甲醇、2,2-二苯基乙醇、乙二醇、1,4-苯基二甲醇、丙三醇、季戊四醇;所述引发剂与催化剂的摩尔比例为1/0.01~1/10。
[0016]
上述制备方法中,步骤(1)中所述反应温度为10~80℃;所述反应时间为0.1~72h,所述引发剂与α-亚甲基-δ-戊内酯的摩尔比例为1/10~1/3000。
[0017]
上述制备方法中,所述碱性物质为三乙胺、吡啶、哌啶,所述碱性物质与催化剂的摩尔比例为1/1~10/1。
附图说明
[0018]
图1为实施例1中制得的聚(α-亚甲基-δ-戊内酯)的1h nmr谱图。
[0019]
图2为实施例1至实施例4制得的聚(α-亚甲基-δ-戊内酯)的gpc谱图。
[0020]
图3为实施例5中制得的聚(α-亚甲基-δ-戊内酯)的1h nmr谱图。
[0021]
图4为实施例6中制得的聚(α-亚甲基-δ-戊内酯)的1h nmr谱图。
具体实施方式
[0022]
下述实施案例对本发明进行具体描述,但本发明不限于这些实施案例。
[0023]
下述实施案例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0024]
对比实施例1
[0025]
在氮气保护下,分别将(0.04mmol,4.33mg)苄醇、(0.04mmol,3.84mg)甲基磺酸和(4mmol,448.50mg)α-亚甲基-δ-戊内酯加入到反应管中,置于50℃油浴中反应3h,加入1滴三乙胺终止反应,得到的产物无法溶于有机溶剂,为交联产物,表明同时发生了双键加成反应和开环聚合反应。
[0026]
实施例1
[0027]
在氮气保护下,分别将(0.04mmol,4.33mg)苄醇、(0.04mmol,10.00mg)磷酸二苯酯和(4mmol,448.50mg)α-亚甲基-δ-戊内酯加入到反应管中,置于50℃油浴中反应3h,加入1滴三乙胺终止反应。将残留α-亚甲基-δ-戊内酯减压蒸馏除去后得到聚合物,核磁表征聚合物为开环聚合产物,即聚(α-亚甲基-δ-戊内酯),其核磁氢谱如图1所示,gpc测得数均分子量为10.6kg/mol,分子量分布为1.10,gpc谱图如图2所示。
[0028]
实施例2
[0029]
在氮气保护下,分别将(0.04mmol,4.33mg)苄醇、(0.04mmol,10.00mg)磷酸二苯酯和(6mmol,672.78mg)α-亚甲基-δ-戊内酯加入到反应管中,置于30℃油浴中反应24h,加入2滴三乙胺终止反应。将残留α-亚甲基-δ-戊内酯减压蒸馏除去后得到聚合物,核磁表征聚合物为开环聚合产物,即聚(α-亚甲基-δ-戊内酯),gpc测得数均分子量为15.5kg/mol,分子量分布为1.19,gpc谱图如图2所示。
[0030]
实施例3
[0031]
在氮气保护下,分别将(0.40mmol,54.48mg)苯丙醇、(0.60mmol,126.13mg)磷酸二丁酯和(80mmol,13.45g)α-亚甲基-δ-戊内酯加入到反应管中,置于60℃油浴中反应8h,加入0.5ml三乙胺终止反应。将残留α-亚甲基-δ-戊内酯减压蒸馏除去后得到聚合物,核磁表征聚合物为开环聚合产物,即聚(α-亚甲基-δ-戊内酯),gpc测得数均分子量为21.5kg/mol,分子量分布为1.22,gpc谱图如图2所示。
[0032]
实施例4
[0033]
在氮气保护下,分别将(0.40mmol,55.26mg)对苯二甲醇、(0.80mmol,100.02mg)磷酸二甲酯和(120mmol,13.45g)α-亚甲基-δ-戊内酯加入到反应管中,置于70℃油浴中反应15h,加入1ml三乙胺终止反应。将残留α-亚甲基-δ-戊内酯减压蒸馏除去后得到聚合物,核磁表征聚合物为开环聚合产物,即聚(α-亚甲基-δ-戊内酯),gpc测得数均分子量为30.5kg/mol,分子量分布为1.25,gpc谱图如图2所示。
[0034]
实施例5
[0035]
在氮气保护下,分别将(0.04mmol,5.53mg)对苯二甲醇、(0.20mmol,55.64mg)磷酸酯二苄基酯和(50mmol,56.07mg)α-亚甲基-δ-戊内酯加入到反应管中,置于40℃油浴中反应80h,加入0.2ml三乙胺终止反应。将残留α-亚甲基-δ-戊内酯减压蒸馏除去后得到聚合物,核磁表征聚合物为开环聚合产物,即聚(α-亚甲基-δ-戊内酯),gpc测得数均分子量为
110.6kg/mol,分子量分布为1.31,其核磁氢谱如图3所示。
[0036]
实施例6
[0037]
在氮气保护下,分别将(0.10mmol,10.81mg)苄醇、(0.40mmol,100.00mg)磷酸二甲酯和(50mmol,5.61g)α-亚甲基-δ-戊内酯加入到反应管中,置于60℃油浴中反应30h,加入0.5ml三乙胺终止反应。将残留α-亚甲基-δ-戊内酯减压蒸馏除去后得到聚合物,核磁表征聚合物为开环聚合产物,即聚(α-亚甲基-δ-戊内酯),gpc测得数均分子量为50.5kg/mol,分子量分布为1.27,其核磁氢谱如图4所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。