靶向调节t细胞的长效白介素-2及其在治疗自身免疫病中的应用
1.本技术是申请号2019111207183,申请日为20191115,发明名称为“靶向调节t细胞的长效白介素-2及其在治疗自身免疫病中的应用”的专利申请的分案申请。
技术领域
2.本发明属于生物制药领域,具体涉及定点修饰的白细胞介素-2,例如进行定点聚乙二醇化的白细胞介素-2的衍生物,使其具备靶向性调节t细胞的作用。本发明进一步涉及上述定点修饰的白介素-2在治疗自身免疫病的用途,如作为安全、有效的类风湿关节炎、系统性红斑狼疮、自身免疫性糖尿病等的用途。
背景技术:
3.白细胞介素-2(interleukin-2)是第一类细胞因子,作为最早发现并药用的细胞因子之一,il-2在免疫调节中具有至关重要的生物学作用。剪切了信号序列的人il-2分子量为15418.02道尔顿,由133个氨基酸残基组成。
4.il-2通过与细胞膜上的il-2受体(il-2r)结合发挥生物作用,il-2r是由α、β、γ三分子亚基组成,其中α链(cd25)不具备信号传递功能,仅能与β和γ链一起,作为三分子复合物与il-2形成高亲和力结合(kd=10pm);而β链(cd122)和γ(cd132)链都属于i型细胞因子受体超家族,两者可以在缺失α链的前提下,与il-2形成中亲和力结合(kd=1nm,进而传导下游信号(r.spolski et al.,2018).三种受体亚基在不同的细胞亚群中表达量各不相同,例如il-2rα可以在调节t细胞(treg)表面持续长效表达;自然杀伤细胞(nk)和cd8 t杀伤细胞则在一般状态下低表达il-2rα而常规表达il-2rβ和γ。因此treg细胞在机体无外来抗原刺激情况下,对il-2的敏感性大于nk,cd8 t等效应细胞(boyman et al.,2006).il-2作为免疫调控的一柄“双刃剑”,在体内,稳态水平的il-2浓度可以保证cd4 cd25 treg细胞的存活和维持,但却不足以激活其它效应细胞;而由于效应细胞的数量大量高于treg,过多的il-2又会激活一定量的效应细胞,造成免疫增强的效果。因此,il-2复杂的生物学效果决定了将其作为药物,用于治疗免疫类疾病的复杂性和挑战性。
5.treg细胞作为免疫抑制的关键效应细胞之一,对自身免疫病的发生发展具有重要意义。已有的研究表明,il-2通过与treg上的三分子il-2rs结合,传递下游信号通路,可将未成熟的cd4 cd25
low
foxp3
low
细胞转化为功能性treg,通过上调cd25和foxp3功能分子,发挥treg的免疫抑制作用;另一方面,il-2也可通过诱导treg细胞的分化和生长,维持treg在外围的功能稳态。il-2作为treg细胞激活调控的关键分子,在免疫病的治疗上有巨大的潜力。如上所述的,由于il-2α在treg细胞表面的持续性高表达,因此treg细胞在机体无外来抗原刺激的情况下,对il-2更为敏感。通过精确的设计给药剂量和疗程,低剂量il-2在治疗自身免疫病中得到了越来越广泛的认可和应用。已有的研究表明,对患有恶性sle的患者连续5天注射il-2后,患者体内的treg细胞水平和功能能够明显提高,症状得到明显改善(c.von spee-mayer et al.,2016)。随后的进一步研究表明,低剂量il-2治疗sle中,除了
改善treg数量和功能外,还可抑制tfh和th17分化来调节免疫炎症反应而使机体恢复免疫稳态,为低剂量il-2治疗狼疮奠定了理论基础(j.he et al.,2016).此外,通过精确的控制给药剂量和给药方案,低剂量il-2方案在治疗包括i性糖尿病、移植物抗宿主病、类风湿关节炎、病毒诱导性血管炎等领域均起到一定效果,进一步支持了低剂量il-2治疗多种自身免疫疾病的可行性。
6.基于il-2广泛且高效的生物学效应,使il-2选择性激活靶细胞,提高il-2对特定疾病的治疗窗,对提高il-2治疗疾病的安全性和有效性具有重要意义。由于il-2与受体复合物结合的高度灵活性,il-2构象的改变或者对il-2进行不同位置的屏蔽,将会显著影响il-2对不同细胞亚群的激活作用,起到靶向激活的效果。通过将il-2与特定抗体偶联,形成il-2抗体复合物,是实现这一策略的有效手段之一。boyman等人的研究结果表明,通过将鼠源的il-2与特定抗体jes6-1结合形成复合物,可以达到更显著激活treg而较低水平激活其它效应细胞的效果(boyman et al.,2006);而将il-2与另一种抗体s4b6结合,则可以在激活所有相关免疫细胞的前提下,更偏向激活效应细胞。更进一步的研究表明,jes6-1与il-2结合后,空间上阻碍了il-2与il-2rβ和γ的结合,同时也降低了il-2与il-2α的结合,使il-2更偏向激活treg;而抗体s4b6与il-2的结合,不仅在空间上阻碍了il-2与il-2rα的结合,而且使结合后的il-2构象可以更稳定的与il-2rβ形成复合物,从而使il-2/s4b6抗体复合物具有靶向性激活效应细胞的效果(j.b.spangler et al.,2015)。基于上述研究工作,eleonora等人筛选并优化了一系列针对人源的il-2抗体,并最终确定了f5111.2可以和il-2形成抗体复合物,用于偏向性激活treg以治疗移植物抗宿主病和自身免疫病性糖尿病等多种自身免疫病(e.trotta et al.,2018)。另一方面,将il-2与抗体或者抗体fc段融合表达,对il-2上多个位点进行精细的多点突变,以及对il-2进行基于结构的重新设计合成等(j.b.spangler et al.,2018;l.b.peterson et al.,2018;a.b.shanafelt et al.,2000;d.a.silva et al.,2019)均可显著增加il-2对特定免疫细胞的靶向性激活作用,起到更有效的激活或抑制免疫作用,进而用于特定疾病的治疗。
7.尽管上述研究已经取得了一定的临床效果,但依然存在明显的实际应用问题。低剂量il-2的治疗方案针对不同疾病和不同个体存在很大的差别,难以在人体进行预测及剂量爬坡验证;另一方面,对于自身免疫病这类慢性疾病,il-2需要长期多次注射给药也严重降低了病人的依从性;从应用抗体方面,il-2/抗体复合物的化学剂量配比和复合物稳定性使其不利于工业制备以及临床实际使用,而应用此类抗体或其它il-2突变体带来的免疫原性也限制了此类型的方法在临床的广泛应用。因此,开发新型的以il-2为基础的生物技术药物,使其靶向性激活特定免疫细胞亚群,是该领域一直持续研究的关键科学问题,具有重要的临床转化意义。
技术实现要素:
8.为了解决上述问题,本发明提供靶向调节t细胞的长效白介素-2及其在治疗自身免疫病中的应用。
9.首先,本发明提供可使人白介素-2靶向激活treg的修饰位点和修饰位点组合,所选修饰位点选自:示于seq id no:1的第h16位,d20位,y31位,n33位,r38位、t51位,a73位,k76位,h79位,n88位,d109位或其它具有靶向激活treg活性修饰位点中的一个位点或多个
位点的组合,这些位点在修饰效果上,将更影响il-2与il-2受体β的结合,而较少影响对il-2受体α的结合。
10.本发明还提供定点突变的人白介素-2,其在所述的特定位点的一个氨基酸或多个氨基酸被突变为非天然氨基酸,所述非天然氨基酸为所示的非天然氨基酸或其它含有叠氮结构的非天然氨基酸中的至少一种;所述特定位点选自:示于seq id no:1的第h16位,d20位,y31位,n33位,r38位、t51位,a73位,k76位,h79位,n88位,d109中的一个位点或多个位点的组合。
11.优选的,定点突变的人白介素-2,其与示于seq id no:1的序列的区别在于:在seq id no:1所示的序列的第n位的氨基酸被突变为非天然氨基酸,所述突变氨基酸与seq id no:1所示的序列的连接方式如下式(ii)所示:
[0012][0013]
由r1到r2的方向为氨基酸序列的n末端到c末端方向,其中第n位的氨基酸选自第h16位,d20位,y31位,n33位,r38位、t51位,a73位,k76位,h79位,n88位,d109位氨基酸中的一个或几个,
[0014]
r1为seq id no:1所示序列的第1至第n-1位氨基酸残基,
[0015]
r2为seq id no:1所示序列的第n 1位至c末端的氨基酸残基,
[0016]
r4为
[0017]
本发明还提供经过修饰的所述的定点突变的人白细胞介素-2,其中用含非天然氨基酸的连接方式如下式(iii)或(iv)所示:其中r3可为相同或不同分子量peg,脂肪酸链、环糊精,糖,核酸,氨基酸,多肽或羧基端修饰基团,
[0018][0019]
(iii)含有叠氮基团的非天然氨基酸插入人白细胞介素-2后用需要催化剂的修饰
剂定点偶联的分子式;
[0020][0021]
(iv)含有叠氮基团的非天然氨基酸插入人白细胞介素-2后用含有环辛炔官能团的修饰剂定点偶联的分子式。
[0022]
其中,当取代的氨基酸位点多于一个时,不同的取代位点偶联的修饰物可以是相同的,也可以是不同的。
[0023]
本发明还提供经peg、脂肪酸链、糖修饰的所述的特定位点突变的人白细胞介素-2,其在修饰位置引入的修饰剂分子量范围为1k da-100kda。
[0024]
其中,所述peg分子量优选是5kda,10kda,20kda,30kda,或40kda。
[0025]
具体地,经peg修饰的特定位点突变的人白细胞介素-2优选是h16-5k,h16-10k,h16-20k,d20-5k,d20-10k,d20-20k,y31-5k,y31-10k,y31-20k,r38-5k,r38-10k,r38-20k,t51-5k,t51-10k,t51-20k,a73-5k,a73-10k,a73-20k,k76-5k,k76-10k,k76-20k,h79-5k,h79-10k,h79-20k,y31/t51-20k或其它其中任意两位点组合并修饰20kda大小peg的修饰产物,更优选为h16-10k,h16-20k,d20-10k,d20-20k,y31-20k,t51-20k,a73-20k、k76-20k、h79-10k、h79-20k、y31/t51-10k或y31/t51-20k。
[0026]
本发明还提供一种药物组合物,其含有有效量的所述人白细胞介素-2或者所述的经修饰的白细胞介素-2,以及药学上可以接受的载体。
[0027]
本发明还提供所述的白细胞介素-2或者所述的经修饰的白细胞介素-2在制备用于免疫调节和多种自身免疫病药物中的用途。
[0028]
本发明还提供白细胞介素-2或者所述的经修饰的白细胞介素-2在制备用于移植物抗宿主病、类风湿关节炎、系统性红斑狼疮、自身免疫病性糖尿病、皮肌炎、硬皮病、多发性硬化、重症肌无力、脱髓鞘疾病、原发性肾上腺皮质萎缩、慢性甲状炎、慢性非特异性溃疡性结肠炎、慢性活动性肝炎、恶习性贫血与萎缩性胃炎、自身免疫性肾小球肾炎、肺肾出血性综合症、自身免疫性溶血性贫血、特发性血小板减少性紫癜、特发性白细胞减少症、自身免疫性脱发的药物中的用途。
[0029]
发明人经过对现有技术的思考和研究,通过对il-2的特定位点进行特定位点的修饰,比如聚乙二醇(polyethulene glycol,peg)修饰,使其具有靶向性激活调节t细胞的作用,并延长其半衰期,起到更安全有效的治疗自身免疫病效果。
[0030]
基于本发明得到的il-2类衍生物与现有研究药物相比,具有的技术效果和优势主要体现在如下的一个或几个:
[0031]
本发明得到的il-2类衍生物具有更强的治疗有效性和安全性:相比于基于抗体复合物的屏蔽方法,其屏蔽位点和效果往往由大量随机筛选决定;而对il-2进行位点筛选,并进行定点修饰,例如peg修饰,将从il-2的结构水平上直接获取修饰位点,有目的的针对il-2与受体il-2rα/β的结合区域进行修饰设计,进而得到靶向作用更强的il-2修饰产物,大幅度提高il-2在自身免疫病中的治疗窗。
[0032]
本发明得到的il-2类衍生物兼具长效性和低免疫原性:本发明得到的产物通过对il-2的特定位点进行定点的修饰,在提高il-2靶向性的同时,也显著提高了il-2半衰期,降低免疫原性,进而减少il-2长期用药的使用剂量和注射次数,进一步提高了il-2治疗的有效性和安全性,也使病人具有更好的依从性。对上述位点,修饰peg的分子量越大,treg靶向性就越强,随之保留生物活性也就越低,但体内稳定性也越强,总体的治疗效果取决于两者之间的平衡。具体的,(1)y31和t51位点对peg修饰有较好的耐受,适宜进行大分子量,如20kda-peg以上的修饰;(2)h16,d20,a73,k76,h79修饰会造成明显的活性影响,对其进行10kda或20kda的修饰效果最佳;(3)对y31和t51双位点进行同时修饰,较对y31和t51单位点而言,可以大幅度提高修饰产物对treg的靶向性,对两个位点同时修饰10kda和20kda的peg分子可以在提高treg靶向性的同时,显著提高体内半衰期,并保留有可接受的生物学活性,起到最佳的治疗效果。
[0033]
本发明得到的il-2类衍生物为定点修饰的il-2类似物,具有化学性质和生物活性均一的特点。
附图说明
[0034]
图1所示为il-2的修饰位点设计和非天然氨基酸插入效率验证。将选择位点的对应位置突变为tag终止密码子,制备突变型表达载体,将突变型表达载体与辅助质粒psuvr-yav共转入大肠杆菌origamib(de3)中,在培养基中添加非天然氨基酸,通过诱导表达,得到该位点插非天然氨基酸的il-2供修饰使用。上图表示为所选不同位点与il-2rα、β、γ之间的关系;下图为非天然氨基酸插入验证,可见不同位点具有不同的插入效率。
[0035]
图2所示为不同位点修饰不同peg分子大小的il-2制备。将含有叠氮基团的非天然氨基酸的突变型il-2与不同分子量的dibo-peg(5、10、20kda)混合作用,修饰产物经过阳离子交换纯化(resource 15s)和分子排阻纯化(superdex200 increase),得到纯度大于95%的定点peg化il-2修饰衍生物。
[0036]
图3所示为不同位点、修饰不同分子量的peg化il-2对人pbmc中treg和cd8 t的pstat5磷酸化活性检测。a.20kda-peg修饰不同所选位点,对treg和cd8 t的磷酸化影响;可见野生型il-2(wt)仅在低浓度(1.6ng/ml)对treg有倾向性,31、51和73位点的修饰物可以将倾向性浓度提高至40ng/ml,并具有较高的保留活性;76和79位点可以将倾向性浓度提高至200ng/ml,但较其余位点对活性影响更明显;b.不同位点,不同分子量的peg修饰对treg靶向性影响;c.yt细胞系模型验证,野生型wt细胞仅表达il-2rβ和γ,用于模拟效应细胞;通过基因改造使其表达不同程度的il-2rα(yt-cd25low和yt-cd25high)用于模拟treg;d.20位点修饰不同分子量peg对treg靶向性和il-2活性的影响。可见20位点修饰可以同时显著降低treg和cd8 t的相应,但更影响cd8 t,在极高的浓度范围内(0.2-5ug/ml)使修饰产物具有treg靶向性。
[0037]
图4所示为il-2的多位点组合修饰.a.对il-2的31/51位点进行10kda-,20kda-peg以及对il-2的20/31/51位点进行5kda-peg组合修饰产物的sds-page和考马斯亮蓝染色分析;b.对组合修饰物进行人外周血的pstat5磷酸化监测。可见在31/51位点进行组合修饰,10kda和20kda的peg修饰产物可分别将treg显著偏向性浓度提高至1和5ug/ml,并且修饰产物具有一定的保留活性。
[0038]
图5所示为修饰物对treg及cd8 t激活标志物的检测.将不同修饰的il-2衍生物分别与pbmc作用72小时,多色流式分别检测treg的cd25和foxp3,以及cd8 t细胞的cd25和cd49d。靶向性结果与磷酸化一致。
[0039]
图6所示为修饰后的peg化il-2衍生物对分离纯的免疫细胞亚群激活检测。检测结果与使用cd8 t一致,20-20k对多种免疫细胞不敏感,对treg有较高相应;31-20k对treg的相应高于其它多种免疫细胞,并和wt对treg的相应程度一致;31/51-20k组合修饰产物在明显不激活其它免疫细胞的同时,对treg保持有较高水平的激活。
[0040]
图7所示为人源和鼠源的il-2修饰产物对鼠脾淋巴细胞的pstat5体外活性检测。a.人和鼠源的野生型il-2对鼠脾淋巴细胞中treg和cd8 t细胞的激活检测;b.不同位点修饰20kda-peg的产物对鼠脾淋巴细胞中treg和cd8 t细胞的激活检测;c.待测产物在小鼠体内的treg激活靶向性检测.不同处理组小鼠脾淋巴细胞中treg、cd8 t,tconv中细胞个数和细胞比例分析;d.不同处理组小鼠脾淋巴细胞中treg和cd8 t上激活标志物分析。
[0041]
图8所示为20-20k在小鼠体内的treg激活靶向性检测.a.不同剂量20-20k处理组的treg激活比例检测;b.不同20-20k给药剂量处理组的treg、cd8 t,tconv中细胞个数和细胞比例分析;c.不同20-20k给药剂量处理组的小鼠脾淋巴细胞中treg和cd8 t上激活标志物分析。
[0042]
图9位h16-20k在小鼠体内靶向激活treg活性检测。a.h16-20k、pbs、和wt-il-2体内激活treg占cd4 t细胞百分比以及体内激活cd3 cd8 t细胞百分比流式数据;b.16-20k、pbs、和wt-il-2体内激活treg百分比、cd8 t细胞百分比、及treg/cd8 t细胞分析。
[0043]
图10所示为il-2修饰物在移植物抗宿主免疫病模型中的应用.a.给药模式图。重度免疫缺陷小鼠第一天给予刺激后的人pbmc。wt-il-2一天给药一次,给药5次;peg化的il-2隔天给药一次,给药3次;b.流式圈门方式,检测脾中人源的treg,cd8 t与tconv;c.2μg给药组小鼠脾脏中treg比例,cd8 t数量,以及treg和cd8 t表面激活物分析;d.不同剂量的各样品处理组激活移植物中的treg、cd8 t,tconv细胞个数和细胞比例分析;e.移植物抗宿主免疫病的治疗效果。分别观察wt-il-2和31/51-20k(d-20k)在不同给药剂量下对移植物抗宿主免疫病模型小鼠的存活率影响。
[0044]
图11所示为il-2修饰物在cia模型中的有效性评价.a.不同组小鼠给药设计模式图;b.不同样品处理组在观测终点时的脚踝关节切片分析;c.不同样品处理组中treg、cd8 t,th17细胞个数和细胞比例分析;d.不同样品处理组的关节炎评分;e.peg-il-2产物对cia的预防治疗作用。在第二次免疫胶原前一周给予wt-il-2和31/51-20k(d-20k),可见d-20k较wt-il-2可以更有效的预防cia的发生和发展。
[0045]
图12所示为il-2修饰物在狼疮模型鼠中的评价.a.wt-il-2和31/51-20k(d-20k)不同剂量处理9周龄mrl/lpr自发狼疮鼠的抗核抗体,抗双链dna抗体,以及蛋白尿变化;b.免疫原性评价。elisa法检测不同样品和剂量处理组小鼠中il-2特异性抗体产生量。
具体实施方式
[0046]
以下实施例用于说明本发明,但不用来限制本发明的范围。
[0047]
实施例1可修饰位点的选择及该位点含有叠氮基团非天然氨基酸的hil-2的制备
[0048]
根据il-2的晶体结构,il-2与其受体的结合位点,本发明的发明人选取了几个适合位点进行修饰,其主要基于以下因素:1.氨基酸暴露于蛋白表面以方便偶联;2.屏蔽免疫原区;3.屏蔽蛋白酶解区。通过更详细的文献资料查阅[eleonora trotta et al,nat med.2018jul;24(7):1005-1014;spangler jb.et al,immunity.2015may 19;42(5):815-25],发明人选取了不同程度影响il-2与il-2rα、β、γ亚基结合位点,包括第h16位、d20位、y31位、t51位、a73位、k76位、h79位(图1)。针对每个位点,发明人分别设计能够使编码所述氨基酸的密码子突变为琥珀密码子的引物,然后利用定点突变试剂盒(lightning site-directed mutagenesis kits,catalog#210518),按说明书操作,并以野生型il-2表达载体pet21a-il-2(wt)为模板,将il-2的相应位置突变为琥珀终止密码子,得到突变型il-2的表达质粒。将上述带有氨苄青霉素抗性的表达质粒和带有氯霉素抗性的辅助质粒同时转化大肠杆菌origamib(de3),经氯霉素和氨苄青霉素双抗性平板筛选出共转化的阳性菌株,即得到同时转化有两个质粒的表达菌株。将上述步骤获得的表达菌株在含有34μg/ml氯霉素和100μg/ml氨苄青霉素的2*yt培养基中37℃培养12-16小时后,再经二级扩增至菌液od值到0.6-1.0时,加入非天然氨基酸至终浓度1mm,37℃继续扩增30分钟,加入iptg至终浓度0.5mm,阿拉伯糖至终浓度0.1%,24℃诱导表达12小时后收集菌体。将收集的菌体用ni-nta-bind-buffer平衡重悬,经超高压匀质破碎机1200bar,2循环破碎后,高速离心去除细胞碎片,经过ni-nta金属螯合亲和层析,用ni-nta-wash-buffer充分洗涤,最后用ni-nta-elute-buffer洗脱,得到初步纯化的干扰素样品,纯度约为90%。产物经sds-page和考马斯亮蓝检测,确认特定位点插入了该非天然氨基酸。
[0049]
实施例2定点修饰peg的il-2制备
[0050]
将上述含有叠氮基团非天然氨基酸的il-2突变体与含有环辛炔的peg修饰剂偶联,利用非天然氨基酸上的叠氮基团与环辛炔进行环紧张力的偶联反应,得到特定位点修饰peg的il-2衍生物。反应后的复合物经过除盐,再经过离子交换(source 15s,20mm乙酸钠ph=4.5,0-250mm nacl梯度)和分子排阻色谱的纯化,可以获得》95%纯度的特定位点修饰peg的il-2衍生物,如图2所示。
[0051]
实施例3提高il-2靶向激活treg的修饰位点、及其对应的最佳修饰剂的获得
[0052]
修饰后的il-2衍生物对不同il-2r受体亚基的亲和力将决定其对特定免疫细胞的靶向性,通过分别检测不同位点,不同peg大小修饰的il-2衍生物与il-2rα和il-2rβ亲和力变化,来确定靶向treg的最佳修饰位点和对应的peg修饰剂。
[0053]
(1)生物膜干涉实验(bli):
[0054]
il-2通过结合细胞表面的il-2r受体复合物发挥生物学作用,il-2r是由α、β、γ三分子亚基组成,其中α链(cd25)不具备信号传递功能,仅能与β和γ链一起,作为三分子复合物与il-2形成高亲和力结合(kd=10pm);而β链(cd122)和γ(cd132)链都属于i型细胞因子受体超家族,两者可以在缺失α链的前提下,与il-2形成中亲和力结合(kd=1nm),进而传导下游信号。生物膜干涉技术的原理为一束可见光穿过光纤,在传感器末端的光学膜层的两个界面会形成两束反射光谱,叠加形成一束干涉光谱;而分子的结合会导致膜层厚度变化,
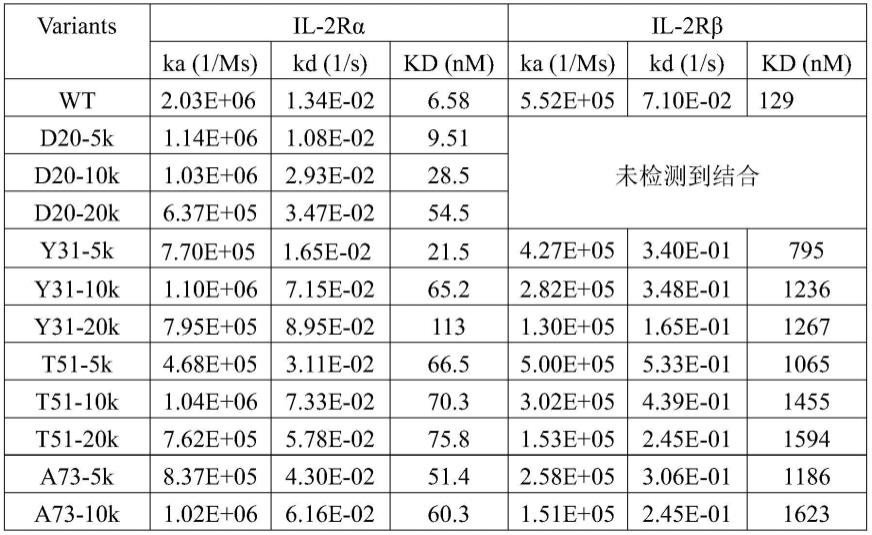
并通过干涉光谱的位移值而体现,以此来获得被分析物的浓度、亲和力、动力学常数和特异性等信息。具体过程如下:将fc融合的il-2rα和il-2rβ偶联在sa传感器上,并流过peg-il-2s样品,解离时间120s。通过流过不同浓度样品,由软件拟合kd值,量化不同位点修饰不同分子量peg对il-2与受体亲和力的影响,如表1所示。结果表明,在上述选择位点进行il-2的定点peg化,使il-2与il-2rβ和il-2rα的结合都受到影响,且对il-2rβ的影响大于对il-2rα的影响。所检测位点为il-2rα亲和力的影响程度为:d20》t51》a73~y31》h79》k76;对il-2rβ亲和力的影响程度为y31》t51》a73》h79~k76》20。对31、73、76位点,修饰对il-2rα的影响随peg分子量的增加而显著增加;对73位点,修饰对il-2rβ的影响随peg分子量的增加而显著增加。
[0055]
表1不同位点修饰不同分子量peg对il-2与受体亲和力的影响
[0056][0057][0058]
(2)人外周血pbmc的pstat5磷酸化实验:
[0059]
分离人外周血单核细胞(pbmc),用待测样品体外刺激50分钟,经过固定破膜后,用荧光抗体进行表面抗体染色:anti-cd3-apc/cy7,anti-cd4-pe/cy7,anti-cd25-apc,anti-cd8-fitc,anti-cd127-pe,anti-pstat5-pacific blue。检测treg和cd8 t细胞的磷酸化水平,用于评价不同样品的treg/cd8 t细胞激活水平,具体细胞分型为:treg(cd3 cd8 cd25hi-cd127low),cd8 t(cd3 cd8 )。我们首先评价在相同位点修饰20kda-peg分子的修饰效果。结果表明(图3a),在各位点修饰20kda-peg均可显著提高treg的靶向性:未修饰的
野生型il-2仅在最低浓度1.6ng/ml时具有treg靶向激活作用;在y31,t51和a73修饰20k的peg可提高在1.6ng/ml时的靶向作用,并使靶向浓度提高至40ng/ml;在k76和h79修饰20k的peg较其余位点可较大程度提高treg靶向性,并使靶向浓度提高至200ng/ml。另一方面,y31和t51位点对peg修饰具有较好的耐受性,保留了较高的生物学活性。我们随后检测了不同位点修饰不同分子量peg对靶向性的影响,结果表明,随着peg分子量的提高,对treg靶向性作用也有明显提高,y31和t51对peg修饰有较好的耐受性,适合高分子量peg的修饰,具有最高的treg靶向性;a73,k76和h79的活性对peg修饰较敏感,适合进行10k或20k分子量的peg修饰(图3b)。我们还进行了yt细胞模型的验证,野生型yt细胞表达有il-2rβ和γ,用于模拟效应细胞,工程化的yt细胞转入了il-2rα,用于模拟treg。结果表明,peg分子量的提高确实有助于修饰产物treg靶向性的提高,并且是由细胞上il-2rα表达量不同所引起的(图3c)。更进一步的,20位点的修饰对il-2活性影响较大,其明显影响了其对treg的活性,但是更严重,甚至封闭了il-2对效应细胞的活性(图3d)。
[0060]
实施例4提高il-2靶向激活treg能力的组合修饰及效果
[0061]
基于实施例3的筛选位点及效果,通过对il-2上的特定位点进行多点组合修饰,可以更精细的对il-2的treg靶向作用进行调节和提高。发明人对il-2的31/51位点,以及20/31/51位点进行了多位点的组合修饰,得到了31/51位点分别偶联有10kda-,20kda-peg修饰分子的组合修饰产品,以及20/31/51位点分别偶联有5kda-peg修饰分子的组合修饰产品,并对这些组合产品进行了pstat5磷酸化检测及受体亲和力检测。结果表明,在31/51位点修饰peg的组合产品,其随着peg分子量的增加,对il-2rα和β的亲和力具有明显下降的趋势。较wt-il-2而言,在31/51位点的组合修饰显著降低了修饰物对il-2rβ的结合,并一定程度影响了其与il-2rα的结合;而在20/31/51位点分别偶联5kda-peg修饰较少影响了其与il-2rα的结合,但屏蔽了其与il-2rβ的结合。对修饰产物进行pstat5磷酸化活性的检测,结果表明,对il-2的进行组合修饰,显著增加了其靶向treg的有效浓度:对il-2的31/51位点进行10kda-和20kda的peg修饰,修饰产物激活treg的有效浓度分别达到了1μg/ml和5μg/ml;对il-2的20/31/51位点进行5kda-的peg修饰,在不明显激活cd8 t细胞的前提下,在1μg/ml的浓度下可以靶向性激活treg,结果如图4和表2所示。
[0062]
表2多位点组合修饰的il-2衍生物与il-2rα和β的亲和力检测
[0063][0064]
实施例5修饰物对treg及cd8 t激活标志物的检测
[0065]
对treg及cd8 t细胞激活标记物的检测可以更明确的确认修饰物的靶向性激活效果,与磷酸化检测形成互补。通过将不同后补产物与pbmc共同刺激48小时后,再对刺激后细胞固定,破膜,并进行多色抗体的流式检测。具体标记抗体如下:anti-cd3-apc/cy7,anti-cd4-pe/cy7,anti-cd8-fitc,anti-cd25-apc,anti-foxp3-pacific blue,anti-cd26-pe,anti-cd49d-bv605,分别检测激活后treg细胞的cd25和foxp3,以及cd8 t细胞的cd25和
cd49d。实验结果和pstat5磷酸化结果一致:peg修饰后的il-2可以显著性的靶向性提高treg激活标志物。更具体的,在31,51,79位点修饰20k的peg的il-2衍生物,在20位点修饰10k和20k的peg衍生物,以及在31/51,20/31/51位点组合修饰的衍生物,在检测浓度范围内(0.04-1μg/ml),可以达到更有效的treg靶向性激活作用,结果如图5所示。
[0066]
实施例6修饰后的peg化il-2衍生物对分离纯的免疫细胞亚群激活检测
[0067]
为了更明确的验证修饰后的peg化il-2衍生物对treg的靶向性激活作用,发明人通过磁珠分选法,分别分离了人原代treg,nk,记忆型cd4 t(mp-cd4),记忆型cd8 t(mp-cd8),幼稚型cd4 t(cd4),幼稚型cd8 t细胞(cd8),并分别检测了不同后补产物对这些免疫细胞亚群的pstat5激活作用。结果表明,在筛选出的位点或位点组合进行修饰,相比于wt-il-2,在检测浓度范围内可以显著提高treg激活,而较低水平,甚至不激活包括nk,mp-cd4,mp-cd8,cd4,cd8在内的其它效应细胞。更具体的,在20位点修饰20k-peg的il-2衍生物以及在20/31/51三位点同时修饰5k-peg的il-2衍生物,可以明显的封闭其它效应细胞,较低活性的靶向性激活treg;在31位点修饰20k-peg的il-2衍生物,可以较高水平的偏向性激活treg,对其它效应细胞有中等的封闭效果;在31和51双位点同时修饰20k-peg的il-2衍生物,在高水平偏向性激活treg的同时,较高程度的封闭了其它效应细胞。结果如图6所示。
[0068]
实施例7修饰后peg化il-2衍生物的药代动力学检测
[0069]
peg的修饰可以提高蛋白分子体积,降低肾小球滤过,屏蔽抗原位点,进而提高修饰后il-2在体内的稳定性,延长半衰期。另一方面,延长半衰期的il-2衍生物,因为有着更长的体内暴露时间,可以在安全的浓度范围持续性激活treg,起到更安全有效的作用效果。发明人评价了不同位点、不同分子范围的peg修饰对il-2体内半衰期的影响。结果表明,不同位点随peg修饰分子量的增加,体内稳定性显著性提高。更具体的,较wt-il-2而言,在20位点修饰5-、10-、20kda-peg可将半衰期分别提高1.6倍、7.8倍、17倍;在31位点修饰5-、10-、20kda-peg可将半衰期分别提高3.2倍、6.7倍、8.3倍;在51、73、79位点修饰20kda-peg可将半衰期分别提高7.8、7.2和16倍;另一方面,在31和51位点同时修饰20kda-peg,可以大幅度提高修饰物半衰期,相比wt提高约41倍;在20、31和51位点同时修饰5kda-peg可以达到单点修饰20kda-peg水平,提高约8倍,结果如表3-5所示。
[0070]
表3 il-2的第20位点修饰5-、10-、20kda-peg的药代动力学分析
[0071][0072]
[0073]
表4 il-2的第31位点修饰5-、10-、20kda-peg的药代动力学分析
[0074][0075]
表5不同位点修饰20kda-peg及位点组合修饰的药代动力学分析
[0076][0077]
实施例8 il-2修饰物在小鼠体内的treg靶向性检测
[0078]
选取dba/1小鼠,对其分别注射1μg和5μg的wt-hil-2、h31-20k、31/51-20k、m103-20k修饰的il-2衍生物。其中wt-hil-2一天注射一次,共注射5次;peg修饰的il-2隔天注射一次共注射3次。注射完后的第三天,分离小鼠脾淋巴细胞进行细胞激活标志物的多色流式检测,标记抗体如下:anti-mouse-cd3-apc/cy7,anti-mouse-cd4-pe/cy7,anti-mouse-cd8-fitc,anti-mouse-cd25-apc,anti-mouse-foxp3-pacific blue,anti-mouse-cd103-percp/cy5.5,anti-mouse-ctla4-bv605。结果表明,31位点修饰20kda-peg的修饰产物和31/51双位点修饰20kda-peg的修饰产物可以在低剂量(1μg)和高剂量(5μg)的注射计量下,显著性激活treg,较少程度激活cd8 t和tconv,提高treg/cd8 t和treg/tconv;31-20k在低剂量注射条件下,treg/cd8 t和treg/tconv较wt分别提高2.4倍和2倍;在高剂量注射下分别提高1.8倍和2.2倍;31/51-20k在低剂量注射条件下,treg/cd8 t和treg/tconv较wt分别提高6.8倍和5.4倍;在高剂量注射下分别提高5.8倍和4.6倍。鼠源103位点修饰20k的样品在低剂量下较wt而言对激活treg细胞无明显靶向性,但在高浓度下treg/cd8 t和treg/tconv较wt分别提高5.3倍和5倍;细胞表面激活标志物的检测结果与细胞个数检测结果一致,在有效靶向激活浓度下,peg修饰的il-2衍生物较wt-il-2而言,可以有效激活treg表面
cd25,cd103和ctla4,但与wt-il-2同等水平激活cd8 t细胞的cd25,结果如图7所示。
[0079]
实施例9 h16位点和d20位点修饰的il-2在小鼠体内的treg靶向性检测
[0080]
根据上述研究结果,降低il-2对il-2rβ的结合,将有助于il-2降低il-2rβ受体的依赖性,降低对效应细胞的激活,提高treg靶向性。h16和d20位点是il-2与il-2rβ受体结合的两个关键性位点。人il-2在20位点的修饰产物具有显著的treg靶向性,但体外保留活性较低。发明人对此位点进行了不同剂量的体内评价。结果表明,20-20k在1ug和5ug注射条件下,treg较wt不但没有明显增加,反而明显受到了抑制,treg占cd4细胞的百分比分别为wt的66%和56%;在1μg和5μg注射条件下,treg/cd8 t较wt的百分比分别为84%和77%;treg/tconv较wt的百分比分别为63%和53%;当注射剂量上升到更高浓度50μg时,将起到明显的treg激活靶向性:treg/cd8 t和treg/tconv较wt分别增加了1.2倍和1.4倍。treg和cd8 t细胞上的激活标记分子结果和细胞比例分析检测结果一致:50μg的注射可以明显激活treg上cd25的活性,但不激活cd8 t,结果如图8所示。
[0081]
发明人随后进行了在h16位点修饰peg的il-2在体内对treg靶向性的评价。结果表明,注射了h16-20k(5μg)的小鼠,较注射了wt-il-2和pbs组的小鼠而言,treg显著性扩增,而cd8 t细胞基本保持不变。treg/cd8比例大幅度增高,结果如图9所示。
[0082]
实施例10 il-2修饰物在移植物抗宿主免疫病模型中的应用
[0083]
异基因造血干细胞移植是根治多种血液病、遗传疾病及实体瘤的主要临床手段之一。其主要机制是通过由供者来源的干细胞在体内帮助受者重建免疫和造血系统,产生移植物抗白血病效应以杀灭肿瘤细胞。然而在临床治疗中,因供者和受者主要组织相容复合物或次要组织相容复合物存在差异,很多患者在进行血细胞移植后,会发生不同程度的移植物抗宿主病。临床上,移植物抗宿主病是一种表现为自身免疫性疾病样的综合征,导致多器官、多组织细胞的炎症反应和纤维样病变损伤,是治疗失败的主要原因和并发后遗症。作为免疫病的一种,移植物抗宿主病的治疗以广泛的免疫抑制以及非选择性清除免疫细胞为主,而通过treg的靶向激活,则可以长久改善此类问题带来的危害。发明人通过检测后补产物对小鼠移植激活的人来源外的周血单核细胞中treg的靶向激活作用,来评估修饰后的il-2衍生物对移植物抗宿主病的治疗作用。分离人pbmc,用anti-human-cd3/cd28磁珠刺激过夜。选取nod免疫缺陷小鼠,第二天每只小鼠尾静脉注射3
×
107pbmc,并对其分别注射0.4μg、2μg、10μg-wt-il-2、20-20k、31-20k、31/51-20k样品;其中wt-hil-2一天注射一次,共注射5次;peg修饰的il-2隔天注射一次共注射3次。注射完后的第三天,分离小鼠脾淋巴细胞进行细胞激活标志物的多色流式检测,标记抗体如下:anti-human-cd3-apc/cy7,anti-human-cd4-pe/cy7,anti-human-cd8-fitc,anti-human-cd25-bv605,anti-human-foxp3-pe。结果表明,31位点修饰20kda-peg的修饰产物和31/51双位点修饰20kda-peg的修饰产物可以在所检测剂量范围内,显著性激活treg,较少程度激活cd8 t和tconv,提高treg/cd8 t和treg/tconv;31-20k在低剂量(0.4μg)注射条件下,treg/cd8 t和treg/tconv较wt分别提高2.5倍和3.6倍;在中等剂量(2μg)注射条件下,treg/cd8 t和treg/tconv较wt分别提高4.6倍和4.2倍;在高剂量(10μg)注射条件下,treg/cd8 t和treg/tconv较wt分别提高1.5倍和2.5倍;31/51-20k在低剂量(0.4μg)注射条件下,treg/cd8 t和treg/tconv较wt分别提高4.1倍和1.2倍;在中等剂量(2μg)注射条件下,treg/cd8 t和treg/tconv较wt分别提高6倍和1.13倍;在高剂量(10μg)注射条件下,treg/cd8 t和treg/tconv较wt分别提高2.4倍和
1.4倍;treg和cd8 t细胞上的激活标记分子结果和细胞比例分析检测结果一致:31位点修饰20kda-peg的修饰产物和31/51双位点修饰20kda-peg的修饰产物在检测范围内可以较wt更有效激活treg上cd25和foxp3,但对cd8 t无明显区别(图10abcd)。更进一步的,我们评价了31/51-20k对移植物抗宿主病的治疗效果。结果表明,对老鼠注射31/51-20k可以显著抵抗老鼠死于移植物抗宿主病,效果优于野生型il-2和pbs对照组,结果如图10e所示。
[0084]
实施例11 il-2修饰物在胶原诱导关节炎模型中的有效性评价
[0085]
胶原诱导的关节炎(collagen induced arthritis,cia)模型由trentham于1977年首次报道,被国内外广泛的用于类风湿关节炎的发病机制和药物筛选研究。发明人通过检测后补产物对cia模型小鼠的免疫细胞亚群激活及治疗作用,来评估修饰后的il-2衍生物对类风湿关节炎的治疗作用。首先将牛ii型胶原(coii)与完全弗氏佐剂(cfa)混合,选取dba/1小鼠,每只小鼠尾根部注射100μg coii;注射后的第21天,每只小鼠再次注射100μg coii混合非完全弗氏佐剂(ifa)作为激活,诱发小鼠产生关节炎。第二次coii注射后,对各组小鼠分别注射pbs、1μg-wt-il-2、1μg-31-20k、1μg-m103-20k以及0.2μg-31/51-20k样品,其中wt-hil-2一天注射一次,共注射5次;peg修饰的il-2隔天注射一次共注射3次。隔天对小鼠关节炎严重情况进行评分:0=无红肿;1=小趾关节稍肿;2=趾关节和足趾肿胀;3=踝关节以下的足爪肿胀;4=包括踝关节在内的全部足爪肿胀。注射完后的第三天,取每组3只小鼠,分离脾淋巴细胞进行多色流式检测,标记抗体如下:anti-mouse-cd3-apc/cy7,anti-mouse-cd4-pe/cy7,anti-mouse-cd8-fitc,anti-mouse-cd25-apc,anti-mouse-foxp3-pacific blue,anti-mouse-cd103-percp/cy5.5,anti-mouse-ctla4-bv605;其中,一半脾淋巴细胞刺激过夜后,进行th17细胞检测,标记抗体如下:anti-mouse-cd3-apc/cy7,anti-mouse-cd4-pe/cy7,anti-mouse-il-17-pe。结果表明,注射31-20k,31/51-20k以及m103-20k的实验组小鼠treg细胞显著高于wt和pbs处理组,th17细胞低于wt和pbs处理组,treg/cd8 t和treg/th17水平都明显高于wt和pbs处理组,并且可以有效的防治关节炎的发生发展,结果如图11abcd所示。进一步的,发明人评价了31/51-20k对cia的预防治疗效果,在注射第二次胶原前一周,对各组小鼠分别注射pbs,不同剂量的wt-il-2和31/51-20k。结果表明,较wt和pbs组,31/51-20k可以有效的延迟关节炎的病发时间和发病严重程度,具有明显的预防和治疗效果(图11e)。
[0086]
实施例12 il-2修饰物在系统性红斑狼疮模型鼠中的有效性评价及免疫原性评价
[0087]
mrl/lpr模型小鼠是由lg/j、akr/j、c3h/di及c57bl/6品系小鼠复杂交配产生,因fas基因出现凋亡相关突变,会出现全身淋巴结肿大,以及侵蚀性关节炎,抗dna、抗sm、抗su、抗核苷p抗体,高滴度ana等类似人系统性红斑狼疮症状,是目前应用广泛,认可度较高的狼疮药物评价模型。发明人给予即将发病的mrl/lpr小鼠pbs以及不同剂量的31/51-20k和wt-il-2,定期取血,检测不同给药组对mrl/lpr小鼠狼疮指标的影响。实验结果表明,给予31/51-20k的小鼠较wt-il-2和pbs组小鼠在狼疮指标上有明显下降,具体为抗核抗体减少,抗双链dna抗体减少,蛋白尿降低,提示31/51-20k较wt-il-2而言对系统性红斑狼疮有更好的治疗效果(图12a)。
[0088]
治疗涉及长期给药,wt一周给药3次,共给药3周;31/51-20k一周给药一次,共给药3周。免疫原性是影响蛋白质药物长期给药疗效的关键因素之一,因此发明人还评价了wt-il-2和31/51-20k在长期给药中的免疫原性。结果表明,31/51-20k较wt-il-2具有低水平的
免疫原性,其诱导小鼠产生的针对il-2的总igg,igg1,igga2明显低于wt组,证明31/51-20k在长期给药中具有较低的免疫原性。
[0089]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
