1.本发明涉及药物分析技术领域,具体涉及一种米拉贝隆缓释片的体外溶出方法。
背景技术:
2.米拉贝隆,分子式为c
21h24
n4o2s,是一种新型的、特异性的β3肾上腺素能受体的激动剂,通过刺激腺苷酸环化酶(ac),产生camp诱导膀胱逼尿肌产生松弛,从而促进膀胱充盈,增加膀胱容量,进而减轻尿频,尿急等症状,但不影响膀胱收缩排尿功能,用于治疗括尿失禁、尿急、尿频症状在内的膀胱过度活动症。米拉贝隆缓释片空腹状态下经口服后迅速被吸收,约4 h达峰浓度,但生物利用度低;在体内分布广泛,与人血浆蛋白结合率达71%;米拉贝隆的消除半衰期长达50 h,经尿排泄呈剂量依赖性,一部分以原形药及代谢物经尿排泄,一部分以原形药形式经粪便排出体外。
3.溶出度试验是一种模拟口服固体制在胃肠道内的崩解和溶出的体外试验法,用于控制药物制剂质量的体外检测方法。原研由日本安斯泰来(astellas)生产的米拉贝隆缓释片于2017年在中国上市,近五年间,国内仅有一家制药企业研制的米拉贝隆缓释片通过一致性评价,由于制剂研发本身的复杂性,制剂处方组合比例等在一定程度上影响着药物的释放过程,安全性及有效性变得不可预估。
4.药典收录的溶出方法包括篮法、浆法、往复筒法和流通池法。fda推荐的米拉贝隆缓释片的溶出方法为篮法,中国药典暂无对其收录。目前国内关于其溶出度/释放度及体内外相关性方面的报道较少,相关报道(梁胜群, 邹梅娟. 米拉贝隆缓释片自制制剂与参比制剂体外溶出一致性评价[j]. 中国处方药, 2017, 15(8): 32-34;倪冬胜,孙井龙,丁钢,等. 米拉贝隆缓释片自研品与参比制剂体外释放一致性评价研究[j]. 药物分析杂志,2020,40(6):1058-1068;王丽双,陈秋,章晓骅. 米拉贝隆缓释片光纤释放度检测方法开发及应用[j]. 山东化工,2022,51(7):126-129.)一般是采用篮法将自研制剂与参比制剂在四条曲线下进行溶出试验(即以ph 1.2盐酸溶液、ph 4.5醋酸盐缓冲液、ph 6.8磷酸盐缓冲液和水4种溶液作为溶出介质进行溶出试验),利用相似因子进行相似性比较,但是对于传统溶出方法其机械装置运动单一并不能近似于模拟体内胃肠道的层流状态及流体力学等动态过程,无法真实模拟吸收漏槽条件及反映体内释放情况,即使在推荐方法或是四条曲线下达到溶出趋势一致,相似因子高于50,其实体外溶出与体内结果相差甚远;此外,利用相似因子比较制剂间差异过于片面,无高区分力。
[0005]
溶出检查的最终目的是反映和控制药物制剂的体内溶出/释放行为,因此,无论在药物产品的开发阶段还是常规的质量控制阶段,均应使溶出方法具有一定的体内外相关性。基于米拉贝隆缓释片的研发难度,溶出方法预测的准确度,有必要选择一种合适的具有区分力并有良好预测能力的体外溶出方法指导制剂开发和处方优化,为be试验增加成功几率。
技术实现要素:
[0006]
本发明的目的在于提供一种米拉贝隆缓释片的体外溶出方法,所得溶出曲线具有区分力,实现体内外相关,本发明方法通过真实模拟体内吸收过程,测定米拉贝隆缓释片的溶出浓度,以有效的区分参比制剂与不同受试制剂间的质量差异、工艺差异,实现对米拉贝隆缓释制剂间相似性及质量一致性评估。
[0007]
为了解决现有技术存在的问题,本发明采用如下技术方案:一种米拉贝隆缓释片的体外溶出方法,米拉贝隆缓释片通过微分溶出仪进行溶出,具体步骤为:1) 溶出介质通过恒流泵输送至溶出容器,米拉贝隆缓释片在溶胀和侵蚀过程释放出的药物随溶出介质以同样恒定流速从溶出容器内持续泵出,在固定时间点收集样品;2) 利用高效液相色谱仪对各个时间点的米拉贝隆样品进行浓度检测,绘制米拉贝隆的浓度-时间曲线,该曲线为平均微分溶出曲线,经数值积分转换为累积溶出百分数-时间曲线;所述数值积分转换的公式为: 其中,%dissolved为累积溶出百分数,n为体外溶出试验取样点数量,t i
为0-n中的第i个整数时间点,t i-1
为0-n中的第i-1个整数时间点,ci为t i
取样时间点浓度;c
i-1
为 t i-1
取样时间点浓度;flowrate为溶出介质流速;dosage为制剂主成分总含量。
[0008]
进一步的,还包括采用非模型依赖法,即相似因子法(f2),计算米拉贝隆缓释片的参比制剂和受试制剂二者间的相似因子f
2 ,当二者 f2大于等于50不超过100时,即认为二者的溶出度表现为相似;所述非模型依赖法的公式为:其中,n为体外溶出试验取样点数量,r
t
与t
t
为t时间参比制剂与受试制剂的累积溶出百分数。
[0009]
进一步的,还包括建立制剂的体内外相关性模型,以米拉贝隆缓释片的体外累积溶出百分数(fdiss%)为自变量,以同一时间点对应的体内吸收百分数(fabs%)为因变量,进行最小二乘法线性回归,得到体内外相关性曲线;根据拟合优度和方程回归系数检验和评估体内外相关性的优劣性,当拟合优度大于0.9、方程回归系数接近于1,则认为二者的溶出可较好反映出体内的吸收,体内外相关性良好。
[0010]
进一步的,还包括根据体内外相关性模型,利用卷积分方法,预测米拉贝隆缓释片药动学参数;所述卷积分公式如下:
其中,c
t
为t时间点浓度;(xa)
t
为t时间药物吸收的总量;(xp)
t-1
为t-1时间周边室的药量;vc为中央室表观分布容积;c
t-1
为t-1时间点浓度;k
12
与k
21
为药物在中央室与周边室间转运的一级速率常数;k
el
为药物从中央室消除的一级速率常数;δ
t
为t时间与t-1时间的差值。
[0011]
当每个制剂的平均预测误差小于15%,所有不同释放速率的制剂的平均预测误差小于10%时,ivivc模型符合要求;所述平均预测误差的计算公式为:其中predicted errors为预测误差,observed parameter为实测值,predicted parameter为预测值。
[0012]
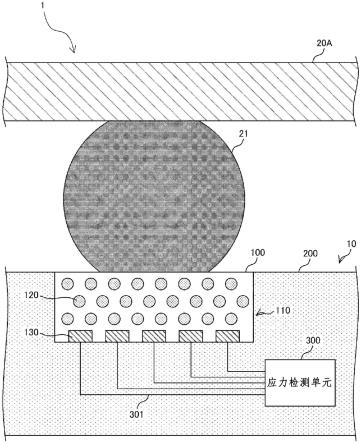
进一步的,所述微分溶出仪的具体结构参照专利cn207263738u的记载,此处不再赘述,专利cn207263738u中所述溶媒为本发明中的溶出介质。
[0013]
进一步的,所述米拉贝隆缓释片包括米拉贝隆缓释片参比制剂r、受试制剂t1与受试制剂t2(规格均50 mg);所述溶出介质的温度控制在37
±
0.5℃。
[0014]
进一步的,所述溶出介质为水和/或ph 6.8磷酸盐缓冲液。
[0015]
进一步的,所述溶出介质流速为4~6 ml/min,优选为4、5或6 ml/min。
[0016]
进一步地,所述溶胀过程为自然溶胀。进一步地,所述溶胀的时间选自:0~2 h,进一步可选为:0、1 h、1.5 h或2 h甚至更长。所述溶胀过程表示没有溶出介质的内循环过程,但是溶出介质依旧处于泵入和流出过程,有竖直方向的流动动力,即本发明所述的自然溶胀。
[0017]
进一步地,所述侵蚀过程为溶出介质以100 ml/min流速进行内循环。进一步的,所述侵蚀的时间选自:1~8 h,进一步可选为: 1 h、1.5 h、2 h、3 h、4 h、5 h、6 h、6.5 h、7 h或8 h,甚至更长。所述侵蚀过程包括溶出介质的内循环过程、以及溶出介质的泵入和流出过程,有竖直方向和水平方向的流动搅拌动力。
[0018]
优选地,所述溶出介质为水、流速为4 ml/min,米拉贝隆缓释片第0~1.5 h自然溶胀、第1.5~8 h溶出介质以100 ml/min流速进行内循环。
[0019]
进一步地,所述溶胀和侵蚀过程的总时长为8h或更长。
[0020]
进一步的,所述固定时间点范围为0~8 h,固定时间点范围可适当延长,直至米拉贝隆缓释片溶出完成,本发明实施例中举例的具体取样时间点为0、30、60、90、120、150、180、210、240、270、300、360、480 min。
[0021]
进一步的,所述高效液相色谱仪的色谱条件:色谱柱条件:c18柱;流动相a为0.05 mol/l乙酸铵,流动相b为乙腈,流动相a和流动相b的体积比为7:3;流速:1 ml/min;波长:248 nm;柱温:30℃;进样量:10 ul。
[0022]
与现有技术相比,本发明的有益效果为:本发明建立了一种有良好区分力的溶出测试方法,采用特定的溶出介质,配合溶出条件,能够真实模拟米拉贝隆缓释片在体内释放和吸收过程,可有效的区分米拉贝隆缓释片参比制剂与不同受试制剂间的质量差异、工艺差异,实现对米拉贝隆缓释片制剂间相似性及质量一致性评估。
[0023]
本发明采用流通池法测得米拉贝隆缓释片的溶出曲线,建立制剂的体内外相关性模型,得到体内外相关性曲线,根据曲线的拟合优度和方程回归系数检验和评估体内外相关性的优劣性,结合f2因子双重分析制剂差异,较单纯利用f2因子分析制剂差异更为准确。用该模型来预测药动学参数,与真实值相比误差小于10%,可提高生物等效性试验的成功率,降低研发风险,节约研发成本。
附图说明
[0024]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0025]
图1 米拉贝隆参比制剂在不同介质条件下的累积溶出百分数-时间曲线及体内的吸收百分数-时间曲线。
[0026]
图2 米拉贝隆参比制剂在不同介质条件下的体内外相关性曲线。
[0027]
图3 米拉贝隆参比制剂在不同流速条件下的累积溶出百分数-时间曲线及体内的吸收百分数-时间曲线。
[0028]
图4 米拉贝隆参比制剂在不同流速条件下的体内外相关性曲线。
[0029]
图5 米拉贝隆参比制剂在a) 溶出介质以100 ml/min流速进行内循环、b)第0~1.5 h自然溶胀、第1.5~6 h溶出介质以100 ml/min流速进行内循环两种条件下的体内外相关性曲线。
[0030]
图6 米拉贝隆参比制剂在第0~1 h自然溶胀、第1~8 h溶出介质以100 ml/min流速进行内循环条件下的体内外相关性曲线。
[0031]
图7 米拉贝隆参比制剂在第0~1.5 h自然溶胀、第1.5~8 h溶出介质以100 ml/min流速进行内循环条件下的体内外相关性曲线。
[0032]
图8 米拉贝隆参比制剂在第0~2 h自然溶胀、第2~8 h溶出介质以100 ml/min流速进行内循环条件下的体内外相关性曲线。
[0033]
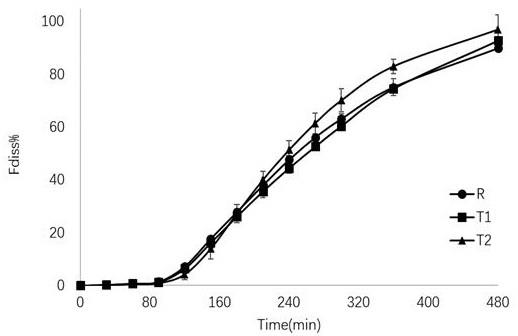
图9 米拉贝隆缓释片在实施例4的方法下的平均微分溶出曲线。
[0034]
图10 米拉贝隆缓释片在实施例4的方法下的累积溶出百分数-时间曲线。
[0035]
图11 米拉贝隆缓释片r\t1\t2三制剂间的ivivc模型。
[0036]
图12 米拉贝隆缓释片参比制剂和受试制剂t2人体平均药-时曲线。
具体实施方式
[0037]
下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明的范围。
[0038]
在本发明一个具体实施例中,米拉贝隆缓释片包括米拉贝隆缓释片参比制剂r及受试制剂t1与受试制剂t2(规格为50 mg),采用流通池法溶出,温度控制在37
±
0.5℃条件下的溶出介质通过恒流泵输送至溶出容器,药物在溶胀和侵蚀过程随恒流泵以同样恒定流速从溶出容器内持续泵出,在固定时间点收集样品;利用高效液相色谱仪对各个时间点的米拉贝隆样品进行浓度检测,计算f2比较参比制剂与受试制剂间的相似性,建立ivivc模型
得到米拉贝隆的溶出曲线及体内外相关性;使用ivivc模型预测t1、t2与r的药动学参数,并通过临床试验验证这一预测结果。
[0039]
上述具体时间点为0、30、60、90、120、150、180、210、240、270、300、360、480 min。
[0040]
实施例中高效液相色谱分析条件:色谱柱条件:c18柱;流动相:水相为0.05 mol/l乙酸铵、有机相为乙腈,以体积比7:3等度洗脱;流速:1 ml/min;波长:248 nm;柱温:30℃;进样量:10 ul。
[0041]
实施例中累积溶出百分数-时间曲线的绘制:高效液相色谱仪对各个时间点的米拉贝隆样品进行浓度检测,经流通池法溶出所得到米拉贝隆的平均微分溶出曲线,经数值积分转换为累积溶出百分数-时间曲线;其中,%dissolved为累积溶出百分数,n为体外溶出试验取样点数量,ti为0-n中的第i个整数时间点,t
i-1
为0-n中的第i-1个整数时间点,ci为t i
取样时间点浓度;c
i-1
为t
i-1
取样时间点浓度;flowrate为溶出介质流速;dosage为制剂主成分总含量。
[0042]
实施例中参比制剂体内吸收-时间曲线绘制:其中,c
t
为t时间点浓度;(x
p
)
t
为血管外给药t时间点内周边室的药物量; vc为中央室表观分布容积;k
10
为静脉给药中央室消除速率常数;与表示0
→
t与0
→
∞时间内的药物浓度和时间围成的曲线下面积。
[0043]
实施例中f2的计算:采用非模型依赖法(即相似因子法),计算二者的f2,当二者f2大于等于50不超过100时,即认为二者的溶出度表现为相似;其中,n为体外溶出试验取样点数量,r
t
与t
t
为t时间参比制剂与受试制剂的累积溶出百分数。
[0044]
实施例中体内外相关性模型建立,建立点对点相关,以米拉贝隆缓释片的体外累积溶出百分数(fdiss%)为自变量,以同一时间点对应的体内吸收百分数(fabs%)为因变量,进行最小二乘法线性回归,绘制体内外相关性曲线。根据拟合优度和方程回归系数检验和评估体内外相关性的优劣性,当拟合优度大于0.9、方程回归系数接近于1,则认为二者的溶出可较好反映出体内的吸收,体内外相关性良好。
[0045]
实施例中药动学参数的预测:根据r、t1、t2三制剂的体内外相关性模型,通过卷积
分方法获得r、t1、t2三制剂的药动学参数auc
0-8h
值对其进行内部验证,卷积分参数如下:其中,c
t
为t时间点浓度;(xa)
t
为t时间药物吸收的总量;(xp)
t-1
为t-1时间周边室的药量;vc为中央室表观分布容积;c
t-1
为t-1时间点浓度;k
12
与k
21
为药物在中央室与周边室间转运的一级速率常数;k
el
为药物从中央室消除的一级速率常数;δ
t
为t时间与t-1时间的差值。当每个制剂的平均预测误差小于15%,所有不同释放速率的制剂的平均预测误差小于10%时,ivivc模型符合要求;所述平均预测误差的计算公式为:其中predicted errors为预测误差,observed parameter为实测值,predicted parameter为预测值。
[0046]
以下通过实施例对本发明做进一步的介绍。
[0047]
实施例1对溶出介质进行优化。
[0048]
米拉贝隆缓释片参比制剂在水、ph 6.8磷酸盐缓冲液的两种不同介质条件下,溶出介质的流速4 ml/min;溶出过程为第0~1.5 h自然溶胀、第1.5~8 h溶出介质以100 ml/min流速进行内循环,经时8 h溶出试验。
[0049]
利用高效液相色谱仪对各个时间点的米拉贝隆样品进行浓度检测,得到溶出曲线及体内外相关性曲线。
[0050]
试验结果如图1~2所示,试验结果表明,在480 min时,参比制剂在水及ph 6.8磷酸盐缓冲液的两种不同溶出介质条件下的累积溶出度分别为89.87%、97.50%,以水为介质时累积溶出度与体内吸收度(85.73%)更为接近。从体内外相关性曲线来看,以水、ph 6.8磷酸盐缓冲缓冲液为溶出介质条件下,其回归系数分别为0.9763、0.8937;以水为溶出介质的回归系数更接近于1,其拟合优度也是接近于1。因此以水作为溶出介质时米拉贝隆缓释片显示出更好的体内外相关性。
[0051]
实施例2对溶出介质流速进行优化。
[0052]
根据实施例1结论可知,以水作为溶出介质时,米拉贝隆缓释片显示出更好的体内外相关性,因此在本实施例中,以水作为溶出介质,溶出介质的流速为4或6 ml/min,溶出过程为第0~1.5 h自然溶胀、第1.5~8 h溶出介质以100 ml/min流速进行内循环,经时8 h溶出试验,对比溶出介质不同流速时的体内外相关性。
[0053]
试验结果如图3~4所示,试验结果表明,在480 min时,参比制剂在溶出介质流速为4 ml/min和6 ml/min的两种不同条件下的累积溶出度分别为89.87%、100.15%,溶出介质流速为4 ml/min时,累积溶出度与体内吸收度(85.73%)更为接近。从体内外相关性曲线来看,
6 ml/min流速条件下回归系数为0.8406、拟合优度为0.9813;4 ml/min流速条件下回归系数为0.9763,拟合优度为0.9879;可见,4 ml/min流速条件下回归系数及拟合优度均更接近于1。因此,4 ml/min流速条件下米拉贝隆缓释片显示出更好的体内外相关性。
[0054]
实施例3根据实施例1和2的最优试验条件,进一步优化溶出过程。
[0055]
米拉贝隆缓释片参比制剂在水为溶出介质,溶出介质的流速4 ml/min,对比不同溶出过程对体内外相关性的影响;首先,在两种溶出条件下进行试验:a)第0~6 h溶出介质以100 ml/min流速进行内循环;b)第0~1.5 h自然溶胀、第1.5~6 h溶出介质以100 ml/min流速进行内循环。
[0056]
试验结果如图5所示,在360 min时,a)、b)溶出条件下体外累积溶出百分数分别为80.32%、75.10%,二者数值均与此时的体内吸收百分数(77.82%)接近;但在溶出前期,a)条件下的体外溶出速度远大于药物在体内的吸收速度,可见该溶出方法不具体内外相关性。从相关性曲线来看,a)、b)条件下线性回归系数分别为0.7776、0.9849,拟合优度分别为0.7911、0.9833;在b)条件下回归系数和拟合优度都是更接近于1的,说明有自然溶胀的溶出方法更具体内外相关性,能更好的模拟药物在体内的溶出过程。
[0057]
进一步优化溶胀时长,溶出过程分别为c)第0~1 h自然溶胀、第1~8 h溶出介质以100 ml/min流速进行内循环,d)第0~1.5 h自然溶胀、第1.5~8 h溶出介质以100 ml/min流速进行内循环,e)第0~2 h自然溶胀、第2~8 h溶出介质以100 ml/min流速进行内循环。
[0058]
试验结果依次如图6~图8所示,溶出过程c)、d)、e)条件下体内外相关性曲线的回归系数分别为0.9036、0.9763、0.9357;可以看出溶出过程d)条件下的回归系数比其他两个条件下的更接近于1,显示出更好的体内外相关性。
[0059]
实施例4采用水为溶出介质,4 ml/min的流速,第0~1.5 h自然溶胀、第1.5~8 h溶出介质以100 ml/min流速进行内循环的米拉贝隆缓释片的溶出方法,计算f2比较参比制剂与受试制剂间的相似性,建立ivivc模型得到米拉贝隆的溶出曲线及体内外相关性;使用ivivc模型预测t1、t2与r的药动学参数。
[0060]
在该条件下,试验得出三种制剂的溶出情况(图9-10)及体内外相关性(图11),8 h内三制剂的累积溶出度分别为89.87%、92.81%、96.96%;根据微分溶出曲线(图9)可看出t2快于r,此结果与后续体内试验结果趋势一致;t1与r溶出速度趋势相似,累积溶出度接近,但t1稍慢于r。t1与r两者间的f2为82,若排除仪器或是操作误差,可认为两者相似,这与后续体内试验结果相吻合;无论从微分溶出曲线还是累积溶出曲线,受试制剂t2与其他两制剂相比有较明显的区分。
[0061]
在本实施例溶出方法下,三制剂间的ivivc模型(图11):fa = 0.95fd 0.7711、r
²ꢀ
= 0.9872,回归系数接近于1,拟合优度大于0.95,溶出限速的缓释剂型下,体外溶出能够反应出体内吸收情况,体外溶出和体内吸收满足点对点的a级水平相关。通过ivivc模型预测米拉贝隆受试制剂t1、t2与参比制剂r的auc
0-8h
值,并计算预测的t1、t2与r的auc
0-8h
值的比值(见表1);表1 米拉贝隆缓释片药动学参数预测误差
通过实测值与预测值比较,t1、t2与r的auc
0-8h
值预测误差分别为0.25%、0.37%、4.13%,t1、t2与r的auc
0-8h
值的比值分别为4.05%、4.70%,均小于10%,说明建立的ivivc 模型具有良好的预测能力,实现体内外相关。
[0062]
同时,基于上述建立的ivivc模型,还通过两项独立的临床试验来验证预测结果。
[0063]
一项采用随机、开放、两制剂、两周期、自身交叉试验设计对16例健康受试者进行空腹的生物等效性研究,周期间清洗期为14天。每周期志愿者分别服用米拉贝隆缓释片参比制剂或受试制剂1片,受试者于给药前及给药后0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h、4.5 h、5 h、5.5 h、6 h、7 h、8 h、10 h、12 h、24 h、48 h、72 h、96 h、120 h分别采集静脉血约4 ml,血样在4℃,以1700 g,离心10 min,取血浆后保存至-80℃超低温冰箱,采用经验证的lc-ms/ms法测定血浆样本中米拉贝隆的浓度。其中参比制剂为米拉贝隆缓释片,avara pharmaceutical technologies,50 mg;受试制剂为米拉贝隆缓释片(t2),50 mg。其药-时曲线如图12所示,参比制剂达峰时间约3.68 h,auc、cmax均低于受试制剂t2。
[0064]
生物等效性试验结果显示:空腹条件下暂未显示出受试制剂t2与参比制剂的吸收动力学一致。
[0065]
一项为采用随机、开放、三制剂、三周期对30例受试者进行空腹生物等效性试验,周期间清洗期为14天。每周期志愿者分别服用米拉贝隆缓释片参比制剂或受试制剂1片,周期间的清洗期为14天。在给药前0 h和给药后0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h、4.5 h、5 h、6 h、8 h、10 h、12 h、24 h、48 h、72 h、96 h采集血样,血样在4℃,以1700 g,离心10 min,取血浆后保存至-80℃超低温冰箱,采用经验证的lc-ms/ms法测定血浆样本中米拉贝隆的浓度。其中参比制剂为米拉贝隆缓释片,avara pharmaceutical technologies,50 mg;受试制剂为米拉贝隆缓释片(t1),50 mg;生物等效性试验结果显示(见表2):米拉贝隆受试制剂t1与参比制剂r的c
max
、auc
0-t
、auc
0-∞
的几何均值比的90%置信区间在80%~125%范围内,空腹状态下生物等效。
[0066]
两项独立的临床试验验证了本技术提供的溶出度方法能有效评价的两个受试制剂与参比制剂的质量。说明本技术方法测定的米拉贝隆缓释片溶出曲线能实现体内外相关。
[0067]
表2 30例受试者空腹口服米拉贝隆缓释片r与t1后的生物等效性评价
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。