molecules from tmv p126 and cp genes confers resistance against tmv in tobacco[j].planta,2016,244(4):961-969.)通过体外合成p126(tmv rna沉默抑制)和外壳蛋白(cp)基因的dsrna,与tmv(tobacco mosaic virus,烟草花叶病毒)混合接种烟草后,烟株获得了tmv抗性,外源的dsrna同样诱导了烟株本身的系统性rnai,在未接种的其他叶片组织中也检测到了rnai效应。澳大利亚学者(mitter n,worrall ea,robinson ke,et al.clay nanosheets for topical delivery of rnai for sustained protection against plant viruses[j].nature plants,2017,3:16207.)通过将cmv病毒2b基因的dsrna分子与黏土纳米颗粒ldh紧密结合,能够让dsrna长时间停留在植物叶面,从而将rnai沉默基因的作用时间可以延长到20天以上,大幅降低了利用dsrna进行病虫害防治的成本。因此,基于dsrna的基因沉默技术在烟草cmv病毒绿色防控领域具有非常光明的应用前景及切实可行的操作性。
技术实现要素:
[0005]
本发明提供了一种特异性抗烟草cmv病毒的dsrna,用于防治烟草中的cmv病毒;并通过体外合成的方法制备了该dsrna,成功将其用于烟草cmv病毒防治技术中。建立了一种高效、简便的烟草cmv病毒防治技术,同时也为其他植物防治cmv病毒提供了新思路。
[0006]
本发明第一个目的是提供一种特异性抗烟草cmv病毒的dsrna,所述dsrna的核苷酸序列如seq id no.1所示。
[0007]
本发明第二个目的是提供一种用于体外合成权利要求1所述的特异性抗烟草cmv病毒的dsrna的引物对,其特征在于,正向引物cmp-f的核苷酸序列如seq id no.2所示,反向引物cmp-r的核苷酸序列如seq id no.3所示。
[0008]
优选的,分别在所述正向引物和所述反向引物的5'端添加了t7启动子序列;添加了t7启动子序列的正向引物cmp-t7f的核苷酸序列如seq id no.4所示,添加了t7启动子序列的反向引物cmp-t7r的核苷酸序列如seq id no.5所示。
[0009]
本发明第三个目的是提供所述dsrna的制备方法,具体包括以下步骤:
[0010]
s1、从感染cmv病毒的烟株叶片中提取烟草cmv病毒的总rna,以所述总rna为模板,反转录获得病毒样本的cdna;
[0011]
s2、以步骤s1所得cdna为模板进行pcr扩增,纯化回收目的片段;
[0012]
s3、将步骤s2纯化回收的目的片段连接至载体上,再将载体转入感受态细胞中,培养、扩增、诱导表达,挑取阳性克隆的mp蛋白进行测序,得到如seq id no.6所示的mp蛋白的核苷酸序列;
[0013]
s4、将如seq id no.6所示的mp蛋白的核苷酸序列与已有的cmv病毒的mp蛋白的核苷酸序列进行比对,选取保守性较高区域的核苷酸序列作为模板,设计如seq id no.2和seq id no.3所示的引物对,然后转录合成正义链ssrna和反义链ssrna,将所述正义链ssrna和反义链ssrna退火、纯化得到所述dsrna。
[0014]
步骤s1中采用常规的植物rna快速提取试剂盒,按照试剂盒相应的说明书进行提取步骤;例如采用imagene genepure多糖多酚植物rna快速提取试剂盒。再利用琼脂糖凝胶电泳分析技术,分析总rna降解程度以及是否被污染;使用thermo scientific nanodrop分光光度计检测rna的纯度(od260/280比值)及浓度;利用总rna反转录时,采用目前行业内常
用的植物rna反转录试剂盒,例如takara primescript rt reagent kit反转录试剂盒。
[0015]
步骤s3中所使用的载体可采用行业内的常规合适的载体,例如pmd-19t载体,将纯化回收的目的片段连接到pmd-19t载体上的连接体系,可以参照pmd-19t vector clonging kit试剂盒说明书中的要求进行。
[0016]
步骤s4中将克隆获得的cmv病毒靶基因序列(即mp的基因序列)与ncbi网站上已有cmv病毒的mp基因序列进行比对,选取保守性较高区域的核苷酸序列,设计、评估、筛选转录合成dsrna的引物;选用行业内常用的转录反应体系,例如promega t7 ribomax express rnai system(试剂盒采购自promega公司)反应体系,分别转录合成靶序列的正义链和反义链ssrna后,混合退火成dsrna,再经过核酶消化去除dna及ssrna后,纯化获得大量靶基因目标片段的dsrna。通过纯化后成功制备靶向cmv病mp基因的dsrna(cmp dsrna)如seq id no.1所示,片段大小为490bp。
[0017]
优选的,步骤s2中pcr扩增的引物对为核苷酸序列如seq id no.7所示的正向引物cmv-mp-f和核苷酸序列如seq id no.8所示的反向引物cmv-mp-r。
[0018]
优选的,步骤s3中所述重组载体的构建方法包括:将步骤s2中pcr扩增的反应体系为:5μl含mgcl2的10
×
pcr buffer,1μl 10μmol/l dntps,1μl 10μmol/l正向引物,1μl 10μmol/l反向引物,2μl cdna,4u taq dna聚合酶,加灭菌ddh2o补至总体积为50μl;pcr扩增程序为:94℃预变性5min,94℃变性1min,58℃退火45s,72℃延伸1min,循环30次后72℃延伸10min。
[0019]
优选的,步骤s3的方法具体为:将步骤2中得到的目的片段连接至pmd-19t载体上,在16℃反应4h,将得到的重组载体转入dh5α感受态细胞中,冰上孵育30min后,在42℃下热激转化90s,加入液体lb培养液,置于37℃下200rpm的摇床中摇菌2h;吸取菌液至含有100mg/ml氨苄西林的lb固体培养基中,37℃培养过夜;挑取阳性克隆进行测序,得到如seq id no.6所示的mp蛋白的核苷酸序列。
[0020]
本发明第四个目的是将所述dsrna用于防治烟草cmv病毒。
[0021]
优选的,取所述特异性抗烟草cmv病毒的dsrna与用于cmv病毒接种的缓冲液混合配制成dsrna溶液,将所述dsrna溶液通过喷施或涂抹的方式接种到烟叶上。
[0022]
进一步优选的,所述dsrna溶液的用法为:以dsrna质量计,按照每片烟叶20μgdsrna的量将所述dsrna溶液喷施于烟叶上。
[0023]
本发明的有益效果是:
[0024]
本发明利用rna沉默的原理,利用cmv病毒自身mp基因提供了一种能够特异性抗cmv病毒的dsrna,为烟草cmv病毒防治提供了新思路,避免了化学用药的诸多弊端;该方法简单有效,不存在转基因安全风险,更容易进行大田推广应用;后期可以结合细胞工厂化生产dsrna,可为烟草病毒病防治提供一种简单、有效和廉价的新方法,也可为其它植物病毒病防治提供借鉴。
附图说明
[0025]
图1为实施例1中cmv病毒的mp基因经pcr扩增后的凝胶电泳图;
[0026]
图2为实施例1中体外合成的cmp-dsrna的凝胶电泳图;
[0027]
图3为实施例2中实验组和对照组烟株叶片中mp基因表达量的对比图;
[0028]
图4为实施例2中实验组和对照组烟株在接种30天后的生长状况图。
具体实施方式
[0029]
以下结合实施例对本发明技术方案进行清楚、完整的描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施例,都属于本发明所保护的范围。本领域技术人员依据以下实施方式所作的任何等效变换或替代,均属于本发明的保护范围之内。
[0030]
以下具体实施方式的实验过程均于2021年在郑州烟草研究院国家烟草基因研究中心完成。
[0031]
以下实施例中,使用的烟草cmv病毒由国家烟草基因研究中心保存;栽培烟草k326,烟株均在人工气候室中培养,条件为光周期l:d=16h:8h,25℃,相对湿度约70%;供试大肠杆菌dh5α购自北京全式金生物技术有限公司;大肠杆菌ht115、l4440质粒由中国科学院微生物所馈赠。t7 ribomax express rnai system试剂盒购自promega公司。imagene genepure多糖多酚植物rna快速提取试剂盒购自北京密码子生物科技有限公司。takara primescript rt reagent kit反转录试剂盒购自takara公司。takara pmd-19t vector clonging kit克隆试剂盒购自takara公司。
[0032]
实施例1
[0033]
本实施例提供了烟草cmv病毒中靶基因(mp的编码基因)的dsrna在体外合成的方法,具体步骤如下:
[0034]
1、烟草cmv病毒rna的提取及cdna合成
[0035]
参考imagene genepure多糖多酚植物rna快速提取试剂盒的说明书中的方法,利用genepure多糖多酚植物rna快速提取试剂盒提取感染cmv病毒病烟株的叶片样本总rna,再用1%琼脂糖凝胶电泳分析该总rna降解程度以及是否有污染,使用thermo scientific nanodrop分光光度计检测该总rna的纯度(od
260
/od
280
比值)及浓度。
[0036]
用提取的总rna作为模板,再用takara primescript rt reagent kit反转录试剂盒进行反转录,获得病毒样本的cdna。
[0037]
2、烟草cmv病毒靶基因(mp蛋白的编码基因,简称为mp基因)的克隆
[0038]
根据ncbi网站序列比对得到的cmv病毒的移动蛋白mp的核苷酸序列,以nc_001440.1的mrna序列为模板,设计、筛选克隆引物,得到正向引物cmv-mp-f(seq id no.7):tttccaaggtaccagtaggactt,反向引物cmv-mp-r(seq id no.8):ctaaagaccgttaaccacctgc。
[0039]
以步骤1中得到的cdna为模板,按照以下反应体系和程序进行pcr扩增:
[0040]
反应体系:10
×
pcr buffer(含mgcl2):5μl,
[0041]
dntps(10μmol/l):1μl,
[0042]
正向引物cmv-mp-f(10μmol/l):1μl,
[0043]
反向引物cmv-mp-r(10μmol/l):1μl,
[0044]
cdna:2μl,
[0045]
taq dna聚合酶:4u,
[0046]
加灭菌ddh2o补至总体积为50μl;
[0047]
反应程序:94℃预变性5min,94℃变性1min,58℃退火45s,72℃延伸1min,循环30次后72℃延伸10min。
[0048]
反应完毕取5μl扩增产物进行1%琼脂糖凝胶电泳检测,检测结果如图1所示,剩余的扩增产物进行纯化回收,得到目的片段。
[0049]
3、mp蛋白的诱导表达
[0050]
将步骤2中得到的目的片段连接至pmd-19t载体上,连接体系参照takara pmd-19t vector clonging kit克隆试剂盒的说明书,反应条件为16℃连接4h。将得到的重组载体转入dh5α感受态细胞中,冰上孵育30min后,在42℃下热激转化90s,加入液体lb培养液,置于37℃下200rpm的摇床中摇菌2h。摇菌后,吸取菌液至含有100mg/ml氨苄西林的lb固体培养基中,在37℃培养过夜。挑取阳性克隆进行氨基酸测序,再根据氨基酸序列得到cmv移动蛋白mp的基因(记为cmp)序列如seq id no.6所示。
[0051]
4、靶向mp编码基因的dsrna的体外合成
[0052]
将步骤3中获得的cmv病毒的mp基因序列(seq id no.6)和ncbi网站中已有的cmv病毒的mp基因序列进行比对,选取保守性较高区域的核苷酸序列即为dsrna序列,根据该序列设计、筛选dsrna引物。最终得到的引物序列见表1,表1中cmp-f(seq id no.2)、cmp-r(seq id no.3)为体外合成dsrna的引物对,cmp-t7f(seq id no.4)、cmp-t7r(seq id no.5)分别为在cmp-f、cmp-r的5'端加入t7启动子序列得到的引物对。
[0053]
表1靶基因dsrna体外合成的引物序列
[0054]
引物名称引物序列(5'-3')cmp-facccatggtcgtattgcttccmp-rtcaattgcgacttcaacaggcmp-t7fggatcctaatacgactcactataggacccatggtcgtattgcttccmp-t7rggatcctaatacgactcactataggtcaattgcgacttcaacagg
[0055]
参照promega t7 ribomax express rnai system试剂盒的说明书中的步骤分别转录合成靶基因的正义链ssrna和反义链ssrna,然后经过退火、纯化得到dsrna。反应体系如下:
[0056]
ribomax
tm
express t7 2
×
buffer:10μl,
[0057]
linear dna template(~1μg total):1~8μl,
[0058]
nuclease-free water:0~7μl,
[0059]
enzyme mix,t7 express:2.0μl,
[0060]
final volume:20.0μl;
[0061]
将上述反应体系轻微震荡混匀,于37℃温浴4h,温浴结束后将反应液于70℃水浴10min,然后缓慢降至室温;向冷却至室温后的反应体系中加入1μl rnase a溶液(将1μl rnase溶液加入到199μl rna-free water中稀释后得到)和1μl rq1 rnase-free dnase,于37℃孵育30min;孵育结束后,向反应体系中加入2μl 3m醋酸钠,50μl冰乙醇,冰浴10min;于16000g离心力下离心10min,可见离心管底有白色沉淀,吸去上清,用500μl预冷的70%乙醇洗涤沉淀2次,弃去上清,室温下晾干15min,待沉淀物干燥后,加入50μl rna-free water溶解,测定dsrna浓度和核苷酸序列(如seq id no.1所示),并使用1%琼脂糖凝胶进行电泳分析,测得纯化后的cmv病毒移动蛋白的靶基因dsrna(记为cmp dsrna)的片段大小为490bp
(如图2所示),将得到的cmp dsrna置于-20℃保存。
[0062]
实施例2
[0063]
本实施例研究了cmv病毒移动蛋白的靶基因dsrna(cmp dsrna)外源施用时对cmv的抗性,具体包括以下步骤:
[0064]
1、靶基因dsrna与cmv病毒的共接种
[0065]
实验组利用体外转录合成的靶向cmv病毒mp基因的cmp dsrna,进行dsrna和cmv病毒共接种实验。选取4-6叶期品种为k326的健康烟株,选取大小一致的同叶位叶片,分别涂抹cmp dsrna(以dsrna质量计,dsrna用量为20μg/叶,将dsrna用pbs缓冲液配制成溶液);然后将感染cmv病毒的烟草病叶与0.01mol/l磷酸缓冲液(ph=7.0,含0.1%β-巯基乙醇)按质量比1:5混合,加入适量金刚砂研磨;通过摩擦接种cmv病毒(常规接种技术,也可参考中国授权专利cn101037673b-烟草病毒病砂纸摩擦接种法中公开的方法),每个处理进行10次生物学重复;同时设置只接种cmv病毒的空白对照组,同样进行10次生物学重复。
[0066]
将实验组和对照组接种后的烟株置于防虫罩中,放置于黑暗条件下生长24h后,转入植物生长间在25℃、16h/d光照进行培养,按时观察发病症状。
[0067]
2、研究cmp dsrna对cmv致病力的影响
[0068]
分别在接种后7天、14天、30天取步骤1中实验组和对照组烟株的烟叶,利用imagene genepure多糖多酚植物rna快速提取试剂盒提取样本总rna,再用1%琼脂糖凝胶电泳分析该总rna降解程度以及是否有污染,使用thermo scientific nanodrop分光光度计检测该总rna的纯度(od
260
/od
280
比值)及浓度。以该总rna作为模板,利用takara primescript rt reagent kit反转录试剂盒进行反转录,获得样本的cdna。以β-actin基因作为内参,设计荧光定量检测引物(见表2)。利用bio-rad荧光定量pcr仪cfx96分别对不同样本的靶基因转录水平进行相对定量分析,以接种3天后对照样本中靶基因表达值为标准1,用相对ct法公式2-δδct
,比较实验组和对照组叶片中相对rna积累量。
[0069]
表2实时荧光定量pcr检测的引物
[0070][0071][0072]
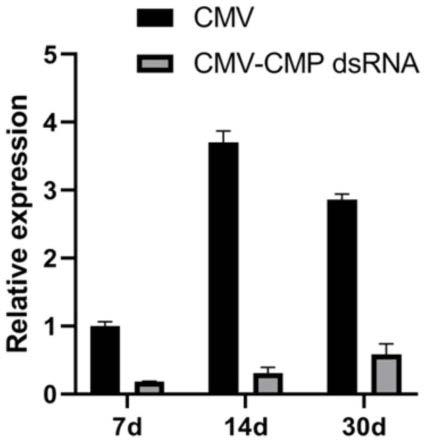
对cmv的mp基因分析发现,在接种7天、14天和30天后,cmv病毒含量急剧上升,而共接种了cmp dsrna的实验组叶片中mp基因表达量与只接种cmv病毒的对照组叶片相比显著降低(如图3所示)。这表明cmp dsrna对烟叶中cmv病毒的mp基因产生了抑制作用。
[0073]
在接种30天后,观察实验组和对照组烟株的症状,结果如图4所示。从图4中可以看出,只接种cmv病毒的对照组烟株出现矮化现象,新叶明显表现出花叶现象,新生叶出现严重畸形;而实验组烟株生长正常,接种叶上枯斑数量明显少于对照组烟株,仅在新生叶上出现轻微花叶现象。这说明cmp dsrna能够有效促进cmv病毒mp基因的rnai,一定程度上减缓
cmv病毒的侵染和危害,具有烟草cmv病毒病生物防治的潜力。
[0074]
综上所述,本发明提供了一种利用rna干涉技术,在烟草上体外应用dsrna介导cmv病毒抗性的方法。通过对克隆得到的cmv病毒mp基因序列分析,设计了一段dsrna序列,通过体外合成的方式获得纯化的cmp dsrna。经对烟叶外源喷施后,取得了较好的cmv病毒防治效果。后期可以通过构建带有t7启动子的rnai干扰载体,转化rnase iii缺陷型大肠杆菌ht115(de3)菌株,有望在低成本的基础上实现dsrna的高效量产。
[0075]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明的保护范围。对于任何熟悉本领域的技术人员来说,本发明可以有各种更改和变化。任何依据本发明申请保护范围及说明书内容所作的简单的等效变化和修饰,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。