一种具有二肽基肽酶ⅳ抑制活性的生物活性肽
技术领域
1.本发明涉及一种发酵马乳中具有dpp
‑ⅳ
抑制活性的生物活性肽,属于生物活性肽生物技术领域。
背景技术:
2.随着社会经济的发展,人们生活方式的改变,全球糖尿病的发病形势越来越严峻,发病人群日益年轻化的同时,还会引起很多慢性并发症。糖尿病是由体内胰岛素缺陷或其生物学效应降低,或两者同时存在而导致血糖过高,出现糖尿,进而引起脂肪和蛋白质代谢紊乱的一种内分泌代谢疾病(who,2006)。所有的糖尿病类型中,2型糖尿病的发病率最高,占所有糖尿病的90-95%。在其发病机制中因dpp
‑ⅳ
能迅速灭活肠促胰岛素胰高血糖素样肽-1和糖依赖性胰岛素释放肽等多种激素,导致血糖上升,已成为治疗2型糖尿病的新靶点。目前dpp
‑ⅳ
抑制剂也已成为糖尿病药物开发的一个重要方向,常用的药物包括:维格列汀(vitagliptin)、沙格列汀(saxagliptin)、阿洛列汀(aloliptin)以及利拉列汀(lilaridine)。长期服用这些化学合成的dpp
‑ⅳ
抑制剂药物可能会产生如过敏反应、心率失调、上呼吸道感染、胃肠不适等副作用。
3.在乳源生物活性肽的降糖尿病的相关研究中,牛乳及其相关制品已被广泛研究。与牛乳相比,马乳中的酪蛋白仅有1.05%,可溶性蛋白高达1.03%,属于白蛋白性乳类,更容易消化吸收,可应用于功能性食品、保健品领域,具有广泛的市场应用前景。
技术实现要素:
4.本发明提供了一种来源于发酵马乳的生物活性肽,该生物活性肽氨基酸序列为ile-ala-phe-pro,其具有二肽基肽酶ⅳ抑制活性。
5.本发明以鲜马乳为原料,使用乳酸菌和乳源酵母菌共发酵制备发酵马乳;使用截留膜、葡聚糖凝胶和反向高效液相进行分离、纯化,获得具有dpp
‑ⅳ
抑制活性的生物活性肽,其氨基酸序列为:异亮氨酸-丙氨酸-苯丙氨酸-脯氨酸(iafp),分子量为500.6 da,对dpp
‑ⅳ
的半抑制浓度为0.001mol/l,并具有显著提高高糖诱导胰岛素抵抗hepg2细胞模型活性,显著改善高糖诱导的胰岛素抵抗细胞hepg2的葡萄糖消耗与葡萄糖摄取的能力。
6.本发明从经乳酸菌和酵母菌共发酵的马乳中分离纯化获得了能显著抑制dpp
‑ⅳ
活性的小分子肽iafp。
7.本发明的dpp
‑ⅳ
抑制肽的制备工艺如下:(1)菌种活化:乳酸菌按体积百分比0.5~2%的接种量接种于mrs液体培养基中,在25~42℃下静置培养8~20h,活化后菌液的活菌数不少于109cfu/ml,酵母菌按体积百分比0.5~3%的接种量接种至ypd液体培养基中,在20~35℃、100~300rpm下培养8~48h,活化后菌液的活菌数不少于108cfu/ml;两种菌均连续增殖2~4代,备用;(2)鲜马乳通过过滤或离心净乳,60~150℃灭菌2s~30min;(3)马乳降温至20~40℃时接种活化好的乳酸菌和酵母菌,接种量均为0.1%~5%,
接种后马乳中的活菌数为106~9cfu/ml;(4)马乳进行发酵,发酵条件为:20~40℃、搅拌转速20~200rpm、通气量10~200vvm的条件下发酵4~60h;(5)马乳发酵结束后离心获取上清,调节上清ph至6~9,再次离心去除蛋白;离心条件为:2~10℃ 、9000g~12000g 离心10~30min;(6)获取的上清进行真空冷冻干燥或旋转蒸发浓缩;(7)上清浓缩物用水溶解后,使用不同截留分子量的超滤截留膜对溶液进行分离,获得含不同组分的液体,并测定不同液体的dpp
‑ⅳ
抑制活性;(8)选择抑制活性最好的液体使用葡聚糖凝胶进行层析,获取不同时段的层析液,并测定不同层析液的dpp
‑ⅳ
抑制活性;(9)选择抑制活性最好的层析液使用反向高效液相色谱(rp-hplc)进行分离纯化;分离纯化使用安捷伦色谱柱,规格为:c18,5μm,250
×
4.6id,100a;分离纯化条件为:进样量1 ml,流速2 ml/min,检测波长215 nm;流动相a含0.1%(v/v)三氟乙酸(tfa)的超纯水,流动相b为含0.1%(v/v)tfa的乙腈,洗脱条件:用流动相a和b梯度洗脱(0-5 min,10%b;5-40 min,10-50%b;40-50 min,50-80%b;50-60 min,80-10%b;60-70 min,10%b);(10)选择rp-hplc纯化后具有dpp
‑ⅳ
抑制活性的肽进行lc-ms鉴定,鉴定后获得的肽序列在biopep数据库进行dpp
‑ⅳ
抑制活性预测,选择预测活性最好的进行固相合成验证,最终获得本发明的小分子肽;上述步骤中使用酶标法测定样品的dpp
‑ⅳ
抑制活性。
8.本发明的优点和积极效果如下:1、本发明证实了乳酸菌和酵母菌共发酵的马乳可制备具有dpp
‑ⅳ
抑制活性的小分子肽;2、本发明公开的制备方法可从发酵马乳中制备具有dpp
‑ⅳ
抑制活性的生物活性肽,其序列为:异亮氨酸-丙氨酸-苯丙氨酸-脯氨酸(iafp),分子量为:500.6 da,可显著抑制dpp-iv活性(ic
50
=0.001 m);3、本发明公开的生物活性肽iafp可显著提高高糖诱导胰岛素抵抗细胞模型hepg2的葡萄糖消耗与葡萄糖摄取的能力,从而改善了hepg2的胰岛素抵抗;4、本发明公开的发酵马乳中具有dpp
‑ⅳ
抑制活性的生物活性肽的制备方法简单,活性稳定,可应用于功能性食品、保健品领域,具有广泛的市场应用前景。
附图说明
9.图1为超滤截留后含不同分子量物质的溶液对dpp
‑ⅳ
抑制活性结果;图2为葡聚糖凝胶层析色谱分峰结果示意图;图3 为葡聚糖凝胶层析色谱分离后获得的层析液的dpp
‑ⅳ
抑制活性检测结果;图4为采用rp-hplc分离后分离峰示意图;图5为rp-hplc分离后分离峰对应的组分的dpp
‑ⅳ
抑制活性检测结果;图6为20~25min内9个分离峰对应的组分的dpp
‑ⅳ
抑制活性检测结果;图7为2号峰样品的高效液相色谱图;图8为活性肽的质谱鉴定图;
图9为生物活性肽iafp的酶抑制动力学实验结果;图10为生物活性肽iafp与dpp
‑ⅳ
分子对接结果示意图;图11为生物活性肽iafp对hepg2细胞活性的影响,其中metformin为二甲双胍,nt为阴性对照,ir为模型组,其余为生物活性肽组;图12为生物活性肽iafp对高糖诱导的胰岛素抵抗hepg2细胞葡萄糖消耗的影响,其中metformin为二甲双胍,nt为阴性对照,其余为生物活性肽组;图13为生物活性肽iafp对高糖诱导的胰岛素抵抗hepg2细胞葡萄糖摄取的影响,其中metformin为二甲双胍,nt为阴性对照,ir为模型组,其余为生物活性肽组。
具体实施方式
10.下面通过实施例对本发明的技术方案作进一步详细说明,但本发明的内容并不局限于此,本实施例中方法如无特殊说明均为常规方法,所用材料、试剂等如无特殊说明均从商业途径所得到;下述实施例中所用的菌种如下:解脂耶氏酵母(yarrowia lipolytica)y7在“唐蓉等.酵母菌与乳酸菌发酵马乳产ace 抑制肽的研究,食品科学,2021”中公开过,乳酸乳球菌(lactococcus lactis)购买于科汉森公司;实施例中酶标法测定样品的dpp
‑ⅳ
抑制活性方法如下:取25μl 2mmol/l gpp(甘氨酰脯氨酸对硝基苯胺)和25μl样品于96孔板中,充分混匀,37℃孵育10min,再加入50μl 0.025u/ml dpp
‑ⅳ
混匀,37℃充分反应60min后,加入100μl ph4.0的1mmol/l的乙酸-乙酸钠溶液终止反应,使用酶标仪测定405nm处的吸光值,每个样品三个平行;dpp
‑ⅳ
和甘氨酰脯氨酸对硝基苯胺(gpp)使用ph8.0的100mmol/l tris-hcl缓冲液配制成相应浓度。
11.dpp
‑ⅳ
抑制活性的计算公式:)
×
100%a
样品组
(dpp
‑ⅳ
样品 gpp):加入多肽样品后测定的多肽样品的pnp吸光度;a
样品对照组
(缓冲液 样品 gpp):多肽样品的吸光度;a
酶活性组
(缓冲液 dpp
‑ⅳꢀ
gpp):不加样品时测定的pnp吸光度;a
酶空白组
(缓冲液 gpp):用缓冲液代替酶测定的pnp吸光度。
12.实施例1:具有dpp
‑ⅳ
抑制活性的生物活性肽的获取(1)将乳酸乳球菌按体积百分比2%的接种量接种至mrs液体培养基中,在35℃下静置培养12h;解脂耶氏酵母按体积百分比2%的接种量接种至ypd液体培养基中,在29℃、200rpm下培养12h;两种菌均连续增殖2代,活化后乳酸菌和酵母菌的活菌数分别不少于109cfu/ml和108cfu/ml,备用;(2)鲜马乳通过离心净乳,95℃灭菌10min;(3)马乳降温至30℃时接种活化后的解脂耶氏酵母和乳酸乳球菌,接种后马乳中的活菌数为106~8cfu/ml;(4)马乳进行发酵,发酵条件为:30℃、搅拌转速150rpm、通气量40vvm的条件下发
酵16h;(5)发酵马乳9000g离心30min,获取上清,使用氢氧化钠调节上清的ph至8.0,再次离心获取上清;(6)上清在室温下平衡0.5h,4℃预冻0.5h,-20℃预冻1h,-80℃预冻1 h,然后在4pa,-52℃条件下冷冻干燥12h,制得冻干粉;(7)使用双蒸水溶解上述冻干粉至50mg/ml的溶液,用截留量为10kda及3kda的超滤截留膜过滤,得到含有分子量》10kda、3-10kda、《3kda组分的溶液,并分别测定各组分的dpp
‑ⅳ
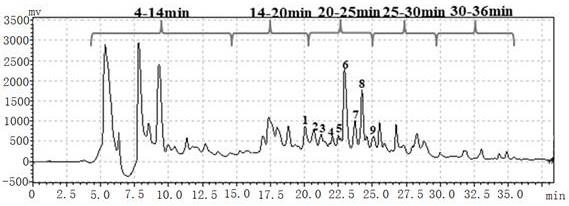
抑制活性,结果见图1,选择抑制活性最好的含有分子量《3kda组分的溶液,使用sephadexg10的葡聚糖凝胶层析,用0.5ml/min的双蒸水洗脱,280nm监测洗脱液的吸光度值变化,收集分离峰对应的层析液1、2、3、4,分别冷冻干燥,冻干粉用蒸馏水配制成浓度10mg/ml的溶液,并测定各组分的dpp
‑ⅳ
抑制活性(图3),选取活性最好的层析液1用rp-hplc进一步分离(图4),收集不同时间段的分离液体先进行旋转蒸发,再进行冷冻干燥制得冻干粉,用水配制成浓度10mg/ml的溶液,测定不同溶液的dpp
‑ⅳ
抑制活性,结果见图5,从中选择活性最高的20-25min时段对应的液体使用rp-hplc进行下一步分离,收集分离峰对应的9个液体先进行旋转蒸发,再进行冷冻干燥制得冻干粉,用水配制成浓度5mg/ml的溶液,测定不同溶液的dpp
‑ⅳ
抑制活性,结果见图6,图中显示2号峰的液体活性最高,2号峰液体的高效液相色谱图见图7,从图中看出纯化后获得活性较高的纯净峰;其中rp-hplc条件为:c18,5μm,250
×
4.6id,100a,进样量1 ml,流速2 ml/min,检测波长215 nm;流动相a含0.1%(v/v)三氟乙酸(tfa)的超纯水,流动相b为含0.1%(v/v)tfa的乙腈,洗脱条件:用流动相a和b梯度洗脱(0-5 min,10%b;5-40 min,10-50%b;40-50 min,50-80%b;50-60 min,80-10%b;60-70 min,10%b); (7)将2号峰组分进行lc-ms鉴定,分析时长:35min。检测方式:正离子。小分子肽和小分子肽的碎片的质量电荷比按照下列方法采集:每次全扫描(full scan)后采集10个碎片图谱(ms2 scan);质谱测试原始文件(raw file)用软件mascot2.2 检索相应的数据库(equus caballus),最后得到蛋白质鉴定结果,结果见图8,从图中可以得到相应碎片的相应强度与荷质比,通过数据库母序列比对,确认小分子肽序列为iafp,如seq id no:1所示;通过上海生工合成纯度≥98%的小分子肽iafp,梯度溶解为不同浓度的小分子肽溶液,检测不同浓度小分子肽的dpp
‑ⅳ
抑制活性,通过计算得到小分子肽iafp半抑制浓度(ic
50
)为0.001mol/l。
13.实施例2:生物活性肽iafp的dpp
‑ⅳ
的酶抑制动力学研究(1)使用0.1mol/l tris-hcl缓冲液(ph8.0)配制酶活力为80u/l的dpp
‑ⅳ
溶液,溶液浓度为0.4mmol/l、0.6mmol/l、0.8mmol/l、1.2mmol/l、1.6mmol/l、2 mmol/l的gly-pro-pna底物溶液(gpp);(2)配制浓度范围在0~2000mmol/l的生物活性肽iafp溶液;(3)采用酶标法测定样品的dpp
‑ⅳ
抑制活性,测定不同浓度生物活性肽iafp在不同浓度gpp下的dpp
‑ⅳ
抑制活性,获得反应初速度;(4)采用lineweaver-burk双倒数作图,确定生物活性肽iafp对dpp
‑ⅳ
的抑制作用类型;结果见图9,从图中可以看出生物活性肽iafp是通过反竞争性抑制作用于dpp
‑ⅳ
。
14.实施例3:小分子肽iafp与二肽基肽酶ⅳ分子对接
在rcbs pdb蛋白质数据库(https://www.rcsb.org/)中下载相应的dpp
‑ⅳ
(1n1m)模型。采用chem draw 19.0 绘制小分子肽模型,添加nm2力场,使其能量最小化。使用gold 5.3.0 进行柔性分子对接,对受体进行配体提取,去除水分子,添加极性氢,使用gold score评分系统进进行对接模型筛选。利用moe2019.10软件进行对接分子复合物的可视化分析,结果见图10,由图10可知,iafp与dpp
‑ⅳ
形成三个氢键,结合位点靠近dpp
‑ⅳ
s’2电荷口袋。
15.实验例4:生物活性肽iafp的功能评价1、高糖诱导的胰岛素抵抗细胞模型hepg2的构建(1)使用含有10% fbs及1%青霉素-链霉素的高糖dmem培养基培养hepg2细胞;培养条件为:37 ℃、含5 % co2的培养箱;(2)上述细胞培养至融合度为90%,用0.25 %的胰酶进行消化,按照1:3进行传代,每2d更换一次培养基;(3)将hepg2细胞按1.5
×
104个细胞/孔接种至96孔板中,待细胞铺板后弃上清,用含36mmol/l葡萄糖的dmem培养基诱导胰岛素抵抗模型;(4)按如下不同实验组处理细胞,实验组处理24h后进行后续实验;实验分组如下:阴性对照组(nt):含5.5mmol/l葡萄糖的dmem培养基培养hepg2细胞;样品组:含不同浓度生物活性肽iafp(200μg/ml、100μg/ml、50μg/ml、10μg/ml)和36mmol/l葡萄糖的dmem培养细胞;阳性对照组(metformin):含50μmol/l二甲双胍和36mmol/l葡萄糖的dmem培养基培养细胞;模型组(ir):含36mmol/l葡萄糖的dmem培养基培养细胞;2、cck8细胞活性检测步骤1中各实验组处理完后,在各组的每孔中加入10μl cck8试剂,继续培养4h,然后在450nm处测定吸光度,每组设置4个副孔作为对照,结果见图11,由图11可知,生物活性肽iafp对hepg2细胞无毒副作用且可提高细胞活性并呈剂量依赖性;3、葡萄糖消耗(1)按上述1中的各实验组处理完后,弃去原培养基,每孔加入100μl含100nmol/l胰岛素的dmem培养基于37℃、5% co2的细胞培养箱内培养10min;(2)培养10min后弃去上清,加入100μl含11mmol/l葡萄糖的dmem无血清培养基培养24 h;(3)采用god-pod葡萄糖检测试剂盒检测培养基中的葡萄糖浓度;检测方法如下:96孔板每孔加入3μl待测样品与300μl工作试剂(酚试剂与酶试剂按照1:1混匀),37 ℃孵育15min,使用酶标仪在505nm处测定吸光度;每组设置4个副孔作为对照,结果见图12,由图12可知,生物活性肽iafp可显著改善hepg2细胞模型的葡萄糖消耗能力,并且对hepg2细胞模型胰岛素抵抗有显著的改善作用。
16.4、葡萄糖摄取检测(1)按上述1中的各实验组处理完后,弃去培养基,每孔加入1ml含100nmol/l胰岛
素的dmem培养基于37℃、5% co2的细胞培养箱内培养10 min;(2)培养10 min后弃去上清,每孔加入1ml含100nmol/l的2-nbdg无血清dmem培养基在37℃细胞培养箱中培养1h;(3)培养结束后使用1
×
pbs冲洗两遍细胞以停止反应,使用荧光酶标仪检测葡萄糖摄取,激发波长为475nm,发射波长为535nm,每组设置4个副孔作为对照;结果见图13,由图13可知,生物活性肽iafp。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
