1.本发明涉及纳米材料领域,特别涉及一种银纳米@碳点复合协同抗菌材料、其应用及抗菌药物。
背景技术:
2.随着细菌对抗生素的耐药性不断增加,细菌感染已变得越来越普遍,并成为全球主要的健康问题之一。全世界每年估计有70万人死于耐药菌感染。每年治疗耐药性感染的社会成本约为200亿美元。由于基因突变导致细菌对抗生素产生了耐药性,而不合理使用抗菌药物更是加剧了这一危机。因此,设计有效的、生物相容的抗菌材料来减少耐药菌的传播是非常重要的。
3.当常规抗菌药物失效时,纳米材料已成为一种创新的抗药性细菌替代疗法。与传统的块状固体材料相比,随着尺寸减小到纳米级(10-9
m),纳米材料的抗菌效果随着比表面积的增大而增强。在这一新的抗菌领域中包括许多纳米材料,如金属纳米球、氧化石墨烯、树枝状大分子等。其中银基纳米材料因其在许多致病性和耐药性感染中的巨大潜力和重要的抗菌应用而引起了广泛关注。它们对大约650种的广谱微生物(包括细菌、酵母菌和病毒)都具有非常高的抗菌作用。由于其优异的抗菌性能,银纳米粒子已被应用于许多医疗保健领域,包括治疗药物的输送、皮肤伤口愈合、光催化剂和骨移植等。而由于常规银纳米粒子易聚集和较差的溶解性能而限制了其应用。因此,开发一种针对病原微生物具备高效杀伤作用的纳米材料具有重要意义和广泛的应用前景。
技术实现要素:
4.本发明所要解决的技术问题在于针对上述现有技术中的不足,提供一种银纳米@碳点复合协同抗菌材料、其应用及抗菌药物。
5.为解决上述技术问题,本发明采用的技术方案是:一种银纳米@碳点复合协同抗菌材料,其通过以下方法制备得到:
6.1)制备碳点;
7.2)配制溶液a:将葡萄糖和聚乙烯吡咯烷酮加入超纯水中超声溶解,加热,得到溶液a;
8.3)配制溶液b:利用步骤1)得到的碳点制备碳点溶液,将硝酸银溶解于水和碳点溶液的混合液中,搅拌均匀,得到溶液b;
9.4)将溶液a和溶液b混合,搅拌反应,反应结束后离心,干燥,得到该银纳米@碳点复合协同抗菌材料。
10.优选的是,所述步骤1)包括:将青蒿素溶于乙酸和超纯水的混合液中,超声并搅拌,然后将所得溶液转移至反应釜中,加热条件下反应,反应结束后,待溶液冷却至室温,先用滤纸初步过滤,然后离心,去除沉淀,离心液用水相滤膜过滤,再透析,透析液冷冻干燥,得到碳点固体。
11.优选的是,所述步骤1)包括:将青蒿素溶于乙酸和超纯水的混合液中,超声并搅拌,然后将所得溶液转移至聚四氟乙烯为内衬的反应釜中,在烘箱200℃下持续反应6个小时,反应结束后,待溶液冷却至室温,先用滤纸初步过滤,然后在10000转/分钟下离心,去除沉淀,离心液用0.22μm的水相滤膜过滤,再透析,透析液冷冻干燥,得到碳点固体。
12.优选的是,所述步骤1)包括:将0.03g青蒿素溶于含5ml乙酸和25ml超纯水的混合液中,超声并搅拌,然后将所得溶液转移至体积为50ml的聚四氟乙烯为内衬的反应釜中,在烘箱200℃下持续反应6个小时,反应结束后,待溶液冷却至室温,先用滤纸初步过滤,然后在10000转/分钟下离心,去除沉淀,离心液用0.22μm的水相滤膜过滤,再透析,透析液冷冻干燥,得到碳点固体。
13.优选的是,所述步骤2)具体包括:将1g葡萄糖和0.5g聚乙烯吡咯烷酮加入50超纯水中超声溶解,加热到100℃中保持5分钟,得到溶液a。
14.优选的是,所述步骤3)具体包括:取步骤1)得到的碳点制备成浓度为0.1mg/ml的碳点溶液,将0.3g硝酸银溶解于含1ml水和1ml碳点溶液的混合液中,搅拌均匀,得到溶液b。
15.优选的是,所述步骤4)具体包括:将溶液a和溶液b加入三颈烧瓶中混合,机械搅拌3小时,反应结束后30000rpm/min下离心,干燥,得到该银纳米@碳点复合协同抗菌材料。
16.本发明还提供一种如上所述的银纳米@碳点复合协同抗菌材料在杀伤革兰氏阴性菌和/或革兰氏阳性菌中的应用。
17.本发明还提供一种如上所述的银纳米@碳点复合协同抗菌材料在制备抗菌药物中的应用,所述抗菌药物用于杀伤革兰氏阴性菌和/或革兰氏阳性菌。
18.本发明还提供一种抗菌药物,其包括如上所述的银纳米@碳点复合协同抗菌材料以及药学上可接受的辅料。
19.本发明的有益效果是:本发明提供的银纳米@碳点复合协同抗菌材料具有比单独碳点和银纳米粒子更高的氧化还原能力,表现出了对革兰氏阳性菌和革兰氏阴性菌优异的协同抗菌性能,该银纳米@碳点复合协同抗菌材料以碳点作为封端剂,制备方法简单;该银纳米@碳点复合协同抗菌材料介导的活性氧诱导产生的氧化应激进一步证实了其在抗菌方面的良好应用前景。
附图说明
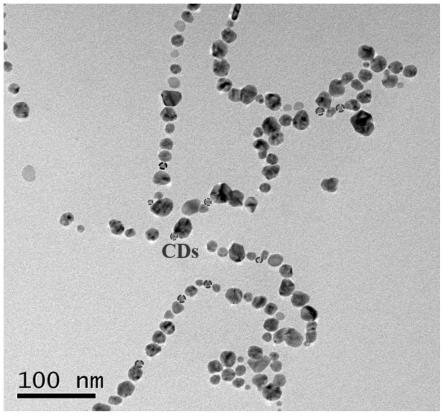
20.图1为实施例1制备的银纳米@碳点复合协同抗菌材料的透射电镜照片;
21.图2为银纳米粒子、实施例1制备的碳点、银纳米@碳点复合协同抗菌材料的紫外-可见吸收光谱图;
22.图3为各组材料与加入细菌后的表面电势;
23.图4为实施例1制备的银纳米@碳点复合协同抗菌材料的xps图谱;
24.图5为不同材料的抗菌性能对比结果;
25.图6为不同浓度下的实施例1制备的银纳米@碳点复合协同抗菌材料的抗菌效果;
26.图7为银纳米@碳点复合协同抗菌材料的抗菌机理示意;
27.图8为实施例1制备的银纳米@碳点复合协同抗菌材料与商业化纳米粒子的抗菌效果对比结果。
具体实施方式
28.下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
29.应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不排除一个或多个其它元件或其组合的存在或添加。
30.实施例1
31.本实施例提供一种银纳米@碳点复合协同抗菌材料,其通过以下方法制备得到:
32.1)制备碳点:
33.将0.03g青蒿素溶于含5ml乙酸和25ml超纯水的混合液中,超声并搅拌,然后将所得溶液转移至体积为50ml的聚四氟乙烯为内衬的反应釜中,在烘箱200℃下持续反应6个小时,反应结束后,待溶液冷却至室温,先用滤纸初步过滤,然后在10000转/分钟下离心,去除沉淀,离心液用0.22μm的水相滤膜过滤,再透析(本实施例中,截断分子量为1000),透析液冷冻干燥,得到碳点固体。
34.2)配制溶液a:将1g葡萄糖和0.5g聚乙烯吡咯烷酮加入50ml超纯水中超声溶解,加热到100℃中保持5分钟,得到溶液a。
35.3)配制溶液b:取步骤1)得到的碳点制备成浓度为0.1mg/ml的碳点溶液,将0.3g硝酸银溶解于含1ml水和1ml碳点溶液的混合液中,搅拌均匀,得到溶液b;
36.4)将溶液a和溶液b加入三颈烧瓶中混合,机械搅拌3小时,反应结束后超高速离心(30000rpm/min),干燥(其中,本步骤中超高速离心后的所有产物均干燥,无固液分离),得到该银纳米@碳点复合协同抗菌材料。
37.实施例2
38.本实施例提供一种实施例1的银纳米@碳点复合协同抗菌材料在杀伤革兰氏阴性菌和/或革兰氏阳性菌中的应用。
39.本实施例还提供一种实施例1的银纳米@碳点复合协同抗菌材料在制备抗菌药物中的应用,所述抗菌药物用于杀伤革兰氏阴性菌和/或革兰氏阳性菌。
40.本实施例还进一步提供一种抗菌药物,其包括实施例1的银纳米@碳点复合协同抗菌材料以及药学上可接受的其他辅料。
41.实施例3
42.本实施例对实施例1制得的银纳米@碳点复合协同抗菌材料进行相关性能测试,并对实施例2提供的磷光碳点的应用进行举例,以对本发明做进一步说明。
43.1、参照图1,为实施例1制备的银纳米@碳点复合协同抗菌材料的透射电镜照片;从图中可以看出,该纳米粒子呈线装排列,单个粒子呈现圆球状,从尺寸上看,碳点与银纳米粒子交替排列,其中碳点尺寸主要分布在5-7nm范围内,银纳米粒子主要分布在15nm左右。
44.2、参照图2,为银纳米粒子(agnps,图2b)、实施例1制备的碳点(cds,图2a)、银纳米@碳点复合协同抗菌材料(agnps/cds,图2b)的紫外-可见吸收光谱图;从图中可以看出,碳点在200-300nm区间都有吸收,最大的吸收峰位于244nm处;银纳米粒子的吸收峰较宽,在350-700nm范围内都有吸收,在422nm处达到最大值;而银纳米@碳点复合协同抗菌材料的最大吸收峰位于460nm处,相较于银纳米粒子,吸收峰位置的红移也表明成功合成了银纳米粒子@碳点复合材料。
45.3、参照图3,为各组材料与加入细菌后的表面电势;从图中可以看出碳点(cds)与银纳米粒子(agnps)容易因为自身所带电荷的不同而引起的静电相互作用而交联,而细菌表面多为负电荷,带正电的银纳米@碳点复合协同抗菌材料(agnps/cds)也更加容易聚集在细菌表面,从而抑制细菌生长。
46.4、参照图4,为实施例1制备的银纳米@碳点复合协同抗菌材料的xps图谱;通过元素上分析显示,该复合材料主要包括c,o,ag和n等元素;结构上包括位于287.1ev处的c=o,位于286.0ev处的c-o,位于284.8ev处的c-c和位于532ev处的c-o-h,该键能部分对应碳点的结构特征;银纳米@碳点复合协同抗菌材料中也存在两种银元素特征。以上结果也证实了银纳米@碳点复合协同抗菌材料的成功合成。
47.5、参照图5,为不同材料的抗菌性能对比结果;本实施例中,采用大肠杆菌和金黄色葡萄球菌(109cfu/ml)研究银纳米@碳点复合协同抗菌材料的协同抗菌作用。通过使用lb培养基,用碳点、银纳米粒子和银纳米@碳点复合协同抗菌材料(浓度均为100μg/ml)处理后的抗菌活性结果如图5所示。很明显,加入碳点(cds)的lb培养基组中观察到大量细菌克隆,表明碳点浓度为100μg/ml时对金黄色葡萄球菌和大肠杆菌抗菌作用较差;而在用加入银纳米粒子(agnps)培养的培养基中有一些活的细菌菌落,这表明银纳米粒子在浓度为100μg/ml具有一定的抗菌作用。然而,在加入银纳米@碳点复合协同抗菌材料(agnps/cds)组中没有观察到细菌菌落的存在,这表明银纳米@碳点复合协同抗菌材料具有优异的抗菌性能。
48.6、参照图6,为不同浓度下的实施例1制备的银纳米@碳点复合协同抗菌材料的抗菌效果。本实施例中,为了确定银纳米@碳点复合协同抗菌材料的最小抑菌浓度(mic),将大肠杆菌和金黄色葡萄球菌与不同浓度下的银纳米粒子@碳点材料(0,2.5,5,10,20,40μg/ml)在lb培养基中共同培养。结果如图6所示,表明40μg/ml的银纳米@碳点复合协同抗菌材料可高效率地抑制所有致病微生物。值得注意的是,银纳米@碳点复合协同抗菌材料在2.5μg/ml时对金黄色葡萄球菌的抗菌能力优于大肠杆菌,在材料浓度为20μg/ml时金黄色葡萄球菌的生长受到完全抑制。
49.上述5和6中进行银纳米@碳点复合协同抗菌材料抗菌实验的具体步骤为:
50.(1)细菌培养
51.首先称取适量的lb培养基,溶解在超纯水中,高温高压灭菌后,用接种环接入代表革兰氏阴性和革兰氏阳性的大肠杆菌和金黄色葡萄球菌;在细菌摇床中培养过夜;用移液枪将含有细菌的lb液体培养基滴加到固体培养基上,涂板均匀,在37℃,200转每分摇床中培养过夜,计数,最终稀释细菌浓度大约在107cfu/ml。
52.(2)细菌与银纳米@碳点复合协同抗菌材料共培养
53.在计数好的含有细菌的培养液中加入银纳米@碳点复合协同抗菌材料(如50,100ug/ml),充分混合摇匀,转移到固体培养基中,涂布,在37℃,200转每分摇床中培养过夜,用相机记录复合材料的抗菌作用,从而确定大致的抑菌浓度范围。
54.(3)确定复合材料的最小抑菌浓度
55.将不同浓度的银纳米@碳点复合协同抗菌材料(0,2.5,5,10,20,40μg/ml)与液体培养基中的细菌混合,涂布在固体培养基中,培养过夜,用相机记录细菌生长情况,以观察不到细菌菌落时的最低浓度作为该材料的最小抑菌浓度。
56.7、参照图7,为银纳米@碳点复合协同抗菌材料的抗菌机理示意:金属介导的活性
氧(ros)引起的氧化应激是银纳米粒子抗菌作用的主要原因之一。一方面,表面具有大量官能团的碳点促进了复合材料上电子和空穴的有效分离;另一方面,具有链状结构的银纳米@碳点复合协同抗菌材料交联成片状,电子转移能力加快,从而刺激产生更多的活性氧,抑制细菌生长。如图7所示,带正电的银纳米@碳点复合协同抗菌材料很容易富集在带负电的细菌表面,然后银离子被释放,刺激产生的大量活性氧导致细菌死亡,从而细菌的活性被银纳米@碳点复合协同抗菌材料所抑制。
57.8、参照图8,为实施例1制备的银纳米@碳点复合协同抗菌材料与商业化纳米粒子的抗菌效果对比结果;为了进一步探索本发明的银纳米@碳点复合协同抗菌材料的协同抗菌活性,本实施例中使用lb培养基比较了银纳米@碳点复合协同抗菌材料与商业化的银纳米粒子和金纳米粒子(本实施例的银纳米粒子、金纳米粒子均购买于中先丰纳米,货号分别为:04482688、04482715)对大肠杆菌(革兰氏阴性菌)和金黄色葡萄球菌(革兰氏阳性菌)的抑制作用。在抗菌实验测试中,当用30μg/ml的商业纳米材料处理大肠杆菌和金黄色葡萄球菌时,在商业化银纳米粒子实验组的培养基中有大量的细菌菌落存在,在金纳米粒子组中计算出部分细菌菌落(图8所示)。然而,在与本发明合成的银纳米@碳点复合协同抗菌材料孵育的大肠杆菌和金黄色葡萄球菌的样品中没有观察到细菌菌落,这表明银纳米@碳点复合协同抗菌材料的抗菌活性优于商业化纳米材料。上述结果也进一步证明了银纳米@碳点复合协同抗菌材料在抗菌方面的优异应用潜力。
58.尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。