1.本发明属于生物工程技术领域,涉及一种肺炎克雷伯菌噬菌体裂解酶,其制备方法,以及在制备药物中的应用。
背景技术:
2.噬菌体裂解酶是双链dna噬菌体所特有的,在病毒复制晚期合成的一类细胞壁水解酶。其能通过穿孔素在细胞膜形成的孔洞,抵达细胞壁上的肽聚糖靶点,对肽聚糖中的重要化学键进行切割水解,最终导致细菌裂解、死亡。噬菌体裂解酶可以选择性地快速杀灭特定的细菌,且不易产生抗性,不破坏机体的正常菌群,是“精准型”抗菌物质。
3.针对革兰氏阳性菌的裂解酶研究已经取得较满意的进展,而针对革兰氏阴性菌的裂解酶研究仍面临着较大的难题。主要原因在于,革兰氏阴性菌的细胞壁肽聚糖层外面包裹的外膜阻碍了裂解酶与肽聚糖的接触。该难题有望通过以下途径克服或解决:(1)鉴定识别能穿透外膜的天然裂解酶;(2)将裂解酶与外膜渗透剂如edta、柠檬酸、苹果酸和阳离子多肽、抑菌剂等协同作用;(3)将裂解酶与一段能渗透外膜的多肽进行融合表达等。
技术实现要素:
4.着眼于上述问题,本发明的目的之一在于提供一种噬菌体裂解酶,能够在无外膜渗透剂的情况下单独发挥作用,对革兰氏阴性菌表现出强烈的抑菌活性;目的之二在于提供一种所述噬菌体裂解酶的制备方法;目的之三在于提供所述噬菌体裂解酶在制备药物中的应用。
5.经研究,本发明提供如下技术方案:
6.1.肺炎克雷伯菌噬菌体裂解酶,氨基酸序列如seq id no.1所示。
7.2.所述肺炎克雷伯菌噬菌体裂解酶的编码基因。
8.进一步,所述编码基因的核苷酸序列如seq id no.2所示。
9.3.含有所述编码基因的重组表达载体。
10.进一步,所述重组表达载体是将核苷酸序列如seq id no.2所示的肺炎克雷伯菌噬菌体裂解酶编码基因克隆入原核表达载体pⅱsa的zsumo标签序列与egfp标签序列之间而得到。
11.4.含有所述重组表达载体的工程菌。
12.进一步,所述工程菌是将所述重组表达载体转入大肠杆菌bl21(de3)中而得到。
13.5.利用所述工程菌制备肺炎克雷伯菌噬菌体裂解酶的方法,包括以下步骤:
14.将所述工程菌接种于含有氨苄青霉素即amp的lb液体培养基中,37℃振荡培养过夜,次日取菌悬液按体积比1:100接入含amp的lb液体培养基中,37℃振荡培养至od
600
=0.6,加入iptg至终浓度为0.5mm,16℃振荡诱导培养16h,4℃离心收集菌体,用ph8.0 pbs缓冲液重悬,加入蛋白酶抑制剂pmsf至终浓度为1mm,冰浴条件下超声波间歇破碎菌体,4℃离心,上清液用孔径0.45μm的过滤器过滤,滤液于4℃条件下以流速1ml/min上ni-ted柱,用
500mm咪唑溶液按1%~100%浓度配比进行梯度洗脱,收集洗脱液,于4℃条件下用ph7.4 pbs缓冲液透析,即得肺炎克雷伯菌噬菌体裂解酶,加入甘油至终浓度为20%,-20℃保存。
15.6.所述肺炎克雷伯菌噬菌体裂解酶在制备抗革兰氏阴性菌的药物中的应用。
16.进一步,所述抗革兰氏阴性菌的药物可在无外膜渗透剂条件下单独发挥抗革兰氏阴性菌的作用。
17.进一步,所述革兰氏阴性菌为大肠杆菌和铜绿假单胞菌。
18.本发明的有益效果在于:本发明从肺炎克雷伯菌噬菌体dp上克隆得到裂解酶编码基因,采用原核表达方式,诱导表达可溶解的裂解酶;所得裂解酶重组蛋白在无外膜渗透剂的情况下可以穿过革兰氏阴性菌的细胞外膜,水解细胞壁肽聚糖层,对铜绿假单胞菌和大肠杆菌等革兰氏阴性菌表现出强烈的抑菌活性,可用于制备抗革兰氏阴性菌的药物,为治疗和抑制革兰氏阴性菌疾病提供有力支持;此外,该裂解酶的制备方法简单,适于工业化大规模生产。
附图说明
19.图1是裂解酶基因和原核表达载体基因的pcr扩增图;其中marker为dna分子量标准,piisa-zsumo-egfp为原核表达载体基因,endolysin为裂解酶基因。
20.图2是重组表达载体在外部引物(external primers)存在下的pcr扩增图;其中marker为dna分子量标准,piisa-zsumo-egfp为原核表达载体,piisa-zsumo-endolysin-egfp为重组表达载体。
21.图3是裂解酶重组蛋白的大量表达纯化过程图;其中marker为蛋白质分子量标准,total为超声破菌后的溶液,supernatant为超声破菌后离心所得上清液,precipitation为超声破菌后离心所得沉淀,flow through为上样滤液,elution为洗脱液,his-zsumo-endolysin-egfp为裂解酶重组蛋白。
22.图4是裂解酶重组蛋白及对照蛋白的sds-page结果图;其中marker为蛋白质分子量标准,his-zsumo-egfp为对照蛋白,his-zsumo-endolysin-egfp为裂解酶重组蛋白。
23.图5是裂解酶重组蛋白切除his-zsumo标签的sds-page结果图;其中marker为蛋白质分子量标准,his-zsumo-endolysin-egfp为裂解酶重组蛋白,endolysin-egfp为切除his-zsumo标签的裂解酶重组蛋白。
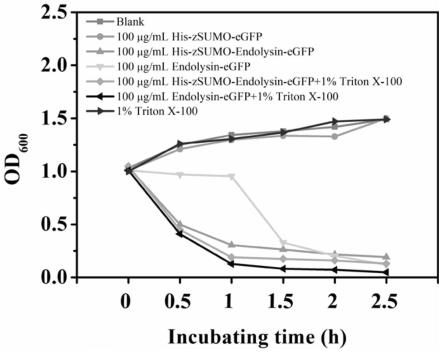
24.图6是裂解酶重组蛋白在不同条件下对大肠杆菌的抗菌活性图;其中blank为空白对照,his-zsumo-egfp为对照蛋白,his-zsumo-endolysin-egfp为裂解酶重组蛋白,endolysin-egfp为切除his-zsumo标签的裂解酶重组蛋白,triton x-100为曲拉通x-100。
25.图7是裂解酶重组蛋白对铜绿假单胞菌的抗菌活性图;其中blank为空白对照,his-zsumo-endolysin-egfp为裂解酶重组蛋白。
26.图8是裂解酶重组蛋白对大肠杆菌(e.coli)及铜绿假单胞菌(p.aeruginosa)的抑菌圈图。
27.图9是裂解酶突变体蛋白的sds-page结果图;其中marker为蛋白质分子量标准,load为超声破菌后的溶液,flow through为上样滤液,elution为洗脱液。
28.图10是裂解酶突变体蛋白对大肠杆菌的活性验证图;其中blank为空白对照,his-zsumo-endolysin-egfp为裂解酶重组蛋白,his-zsumo-endolysin-egfp(e53a、e62a)为裂
解酶突变体蛋白,wild type为裂解酶重组蛋白,mutant为裂解酶突变体蛋白。
具体实施方式
29.为了使本发明的目的、技术方案和有益效果更加清楚,下面对本发明的优选实施例进行详细的描述。优选实施例中未注明具体条件的实验方法,通常按照常规条件或试剂制造厂商所建议的条件进行。
30.实验材料:
31.肺炎克雷伯菌噬菌体dp保藏于陆军军医大学微生物教研室。
32.大肠杆菌dh5α感受态细胞和大肠杆菌bl21(de3)感受态细胞购自北京擎科生物科技有限公司。
33.原核表达载体pⅱsa保藏于西南大学淡水鱼类资源与生殖发育教育部重点实验室。
34.pcr引物均由生工生物工程(上海)股份有限公司合成。
35.实施例1裂解酶重组蛋白的制备
36.1.裂解酶编码基因及原核表达载体基因的pcr扩增
37.裂解酶编码基因(核苷酸序列如seq id no.2所示)的pcr扩增,以肺炎克雷伯菌噬菌体dp基因组dna为模板,所用引物序列为:正向引物:aacagattggaggaagcttgaaacttacgctggaacaactcaacaaa(seq id no.3);反向引物:cttgctcaccatagaggttagaacagattttgcctttttgtagtatg(seq id no.4)。
38.原核表达载体基因的pcr扩增,以原核表达载体pⅱsa(其中包含用于镍柱纯化的his标签序列、用于提高目的蛋白稳定性的zsumo标签序列以及用于蛋白示踪的egfp标签序列)为模板,所用引物序列为:正向引物:aaatctgttctaacctctatggtgagcaagggcgagg(seq id no.5);反向引物:cgtaagtttcaagcttcctccaatctgttcctgatacac(seq id no.6)。
39.上述pcr扩增产物经1%琼脂糖凝胶电泳验证,得到与预期大小552bp、4648bp相符的的目的条带(图1)。使用sanprep柱式dna胶回收试剂盒回收pcr扩增产物,分别得到具有粘性末端的裂解酶编码基因endolysin和原核表达载体基因piisa-zsumo-egfp。
40.2.裂解酶重组表达载体的构建
41.将具有粘性末端的裂解酶编码基因endolysin和原核表达载体基因piisa-zsumo-egfp进行连接,将连接产物加入100μl大肠杆菌dh5α感受态细胞,轻轻混匀,冰浴30min,42℃水浴热激60s,迅速置冰上2min,加入预热的lb培养基1ml,37℃培养60min,3000rpm离心2min,弃去800μl上清后重悬菌液,取200μl菌液涂布于含有amp的lb固体平板,待液体完全吸收后37℃倒置过夜培养,随机挑取平板上的单菌落,接种到含有amp的lb肉汤培养基中培养,通过pcr鉴定阳性克隆。结果如图2所示,在外部引物的存在下,阳性克隆组出现明显的条带,其分子量大小与裂解酶基因大小相符。将pcr鉴定出的阳性克隆菌液委托华大基因进行测序,结果显示,重组表达载体的基因与目标基因序列一致,即裂解酶编码基因已成功克隆入原核表达载体pⅱsa的zsumo标签序列与egfp标签序列之间,将所得重组表达载体命名为piisa-zsumo-endolysin-egfp。
42.3.裂解酶重组表达工程菌的构建
43.挑取含裂解酶重组表达载体piisa-zsumo-endolysin-egfp的dh5α大肠杆菌,划线
接种于含有amp的lb琼脂平板上,37℃培养过夜,次日取单个菌落接种于lb液体培养基中,37℃振荡培养10~16小时,离心收集菌液,抽提质粒,转化大肠杆菌bl21(de3)感受态细胞,筛选阳性克隆,获得含有裂解酶重组表达载体piisa-zsumo-endolysin-egfp的bl21(de3)工程菌。
44.4.裂解酶重组表达工程菌的诱导表达与纯化
45.随机挑取含有裂解酶重组表达载体piisa-zsumo-endolysin-egfp的bl21(de3)工程菌单克隆,接种于100ml含有100μg/ml amp的液体lb肉汤中,37℃摇床培养过夜,次日取菌悬液按体积比1:100接入1l含有100μg/ml amp的液体lb肉汤中,37℃摇床培养至od
600
=0.6,加入iptg至终浓度为0.5mm,16℃摇床继续诱导培养16h,4℃、4000g离心20min,收集菌体,用pbs(ph 8.0)缓冲液重悬,加入蛋白酶抑制剂pmsf至终浓度为1mm,冰浴条件下超声波间歇破碎菌体(超声条件:300w,10~15min,每超声3s间隔7s),4℃、12000g离心30min,上清液用孔径为0.45μm的过滤器过滤,滤液在4℃条件下通过akta purifier蛋白纯化系统联合ni-ted柱以1ml/min的流速上样,用500mm咪唑溶液按1%~100%浓度配比进行梯度洗脱,收集洗脱液,在4℃条件下用10mm pbs(ph7.4)缓冲液透析,即得裂解酶重组蛋白his-zsumo-endolysin-egfp,加入甘油至终浓度为20%,-20℃保存。
46.裂解酶重组蛋白的大量表达纯化过程sds-page结果如图3所示,在58kda分子量附近出现了目的条带,再结合洗脱液带有绿色荧光,可以确定其为裂解酶重组蛋白his-zsumo-endolysin-egfp。裂解酶重组蛋白his-zsumo-endolysin-egfp所带的his标签用于镍柱纯化;zsumo标签是一种促溶标签,发挥稳定伴侣蛋白并增加伴侣蛋白水溶性的作用,自身没有裂解作用;egfp标签为绿色荧光蛋白,用于示踪蛋白,自身没有裂解活性;endolysin的氨基酸序列如seq id no.1所示。
47.按照上述相同方法,本实施例还使用空载质粒制备了对照蛋白his-zsumo-egfp,其sds-page结果如图4所示。使用ulp1蛋白酶对裂解酶重组蛋白his-zsumo-endolysin-egfp的zsumo标签进行切割,得到了不带his-zsumo标签的裂解酶重组蛋白endolysin-egfp(图5)。
48.实施例2裂解酶重组蛋白的体外抑菌活性测定
49.本实施例选择铜绿假单胞菌和大肠杆菌这两种典型的革兰氏阴性菌来验证裂解酶的抑菌活性。
50.将对数生长期的大肠杆菌经过离心收集并使用pbs洗涤2次后,用pbs重悬菌体并调节吸光度od
600
约1.0;在各组菌液中分别加入终浓度为100μg/ml的重组蛋白his-zsumo-endolysin-egfp、endolysin-egfp,并以his-zsumo-egfp为对照蛋白;37℃培养,之后每30min测量od
600
数值,绘制随时间变化的曲线。同时,为考察外加外膜渗透剂对裂解酶抑菌活性的影响,还在菌液中加入终浓度为1%的曲拉通x-100(外膜渗透剂)进行对比实验。结果如图6所示,his-zsumo-egfp对照组以及1%曲拉通x-100组与空白对照组一样,都不能使细菌的吸光度下降,说明his-zsumo-egfp以及1%曲拉通x-100均无裂解活性;his-zsumo-endolysin-egfp组和endolysin-egfp组的结果表明,裂解酶重组蛋白上的其余标签对裂解酶的杀菌活性无太大影响;his-zsumo-endolysin-egfp组和his-zsumo-endolysin-egfp 1%triton x-100组的结果表明,裂解酶重组蛋白在不存在1%曲拉通x-100的情况下能单独发挥杀灭革兰氏阴性菌的作用。
51.在对数早期的铜绿假单胞菌中加入终浓度为200μg/ml的裂解酶重组蛋白his-zsumo-endolysin-egfp,设置空白对照组并在37℃培养,每隔2h测量od
600
数值。结果如图7所示,相比于空白对照组,裂解酶重组蛋白有明显降低菌液浊度的效果。
52.同时,采用抑菌圈实验来证明裂解酶对铜绿假单胞菌和大肠杆菌的抑菌活性。将经过不同浓度(0.9375、1.875、3.75、7.5mg/ml)的裂解酶重组蛋白his-zsumo-endolysin-egfp溶液浸润的圆纸片贴在涂布有细菌的lb固体平板上,同时设置对照组,37℃培养12小时后观察抑菌圈的直径。结果如图8所示,随着裂解酶重组蛋白浓度的增加,在平板上所产生的抑菌圈逐渐增大。这再次证明了裂解酶在无外加外膜渗透剂的情况下能单独发挥杀灭革兰氏阴性菌的作用。
53.实施例3裂解酶催化活性位点验证
54.通过定点突变实验,将裂解酶(氨基酸序列如seq id no.1所示)第53位和第62位的谷氨酸(e)突变为丙氨酸(a)。将突变体质粒按照实施例1所述方法进行转化及蛋白诱导表达与纯化,得到裂解酶突变体蛋白his-zsumo-endolysin-egfp(e53a、e62a),其sds-page结果如图9所示。
55.采用大肠杆菌验证裂解酶突变体蛋白his-zsumo-endolysin-egfp(e53a、e62a)的抑菌活性。在大肠杆菌溶液中分别加入突变前及突变后的裂解酶蛋白,设置空白对照组并在37℃培养,每隔1h测量od
600
数值。同时将与蛋白作用后的细菌进行平板计数,通过平板上的菌落数判断突变前后蛋白活性的差异。结果如图10所示,裂解酶突变体蛋白较突变前失去抑菌活性,不能使细菌浊度降低;平板计数实验结果可以直观地判断裂解酶突变体蛋白无杀菌活性,从而证明了裂解酶的催化活性位点为第53位和第62位的谷氨酸。
56.最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。