检测肿瘤发展的系统和方法
1.本技术是申请日为2016年11月17日、申请号为“201680003762.4”、发明名称为“检测肿瘤发展的系统和方法”的发明专利申请的分案申请。
技术领域
2.本发明主要涉及精准医疗领域,特别涉及通过测试患者血液样本中的定制循环肿瘤 dna来监测患者肿瘤负荷的系统和方法,并优选与治疗相关的基因突变的检测相结合进行。
背景技术:
3.依据达尔文进化理论,人类癌症发展,遗传或表观遗传变异会改变个体细胞中的分子表型。随着肿瘤生长,突变发生,大量不同遗传特征的细胞种群出现。因此,肿瘤诊断通常包括多个基因型不同的细胞群或克隆,这些细胞群或克隆与系统发育相关,并且作为肿瘤微环境中筛选或治疗干预的底物。能够适应新药物的肿瘤细胞变得对治疗耐受,能生存并扩张。很难阻止这个过程,因为癌症随着岁月的推移在身体内部不断进化。这就需要对肿瘤特异性突变和自适应过程有全面的了解,以便拼凑出更准确的癌症演变图片,揭示抗性的根源,并找出办法解决这些问题。
4.目前的技术无法捕捉到肿瘤发展过程中的肿瘤突变的精确进化过程。例如,组织活检是侵入性的,且由于组织解剖的局限性,往往受空间和时间限制。目前的非侵入性的循环肿瘤dna测序方法不能解决不同患者各种不同的肿瘤特异性突变问题,且检测程序繁琐。因此,需要开发新的技术,以采用非侵入性的,精准的,和先进的方式来监测肿瘤细胞突变。
技术实现要素:
5.本发明的第一方面提供一种监测患者的肿瘤负荷的方法。该方法包括以下步骤:(a) 从来自患者的肿瘤组织样品提取的dna中选择预定数量的生物标志基因以形成生物标志基因簇(“定制基因簇customized genes”);(b)从患者的身体液体(也称为体液)样品中分离循环的游离细胞dna;(c)从游离细胞dna片段中富集含有生物标志基因的dna 序列;(d)对富集的dna进行测序;(e)对富集dna中读取的突变dna和正常dna 序列分别计数;和(f)获得患者的肿瘤负荷。
6.在一些实施例中,生物标志基因簇至少包含5个生物标志基因。在另一些实施例中,生物标志基因簇包含5-10个生物标志基因。在其他实施例中,生物标志基因簇包含11-20 个生物标志基因。在优选实施例中,生物标志基因簇包含21-30个生物标志基因。在其他优选实施例中,生物标志基因簇包含31-50个生物标志基因。
7.在一些实施例中,富集步骤包括以下步骤:采用对生物标志基因簇中生物标志基因特异性的引物进行多重pcr扩增;且加入接头到扩增的dna,中以得到dna文库。
8.在一些实施例中,测序步骤是在ion s5 ngs平台上进行。在其他实施例中,检测肿瘤负荷的方法还包括步骤:基于获得的患者游离细胞肿瘤负荷数据来指导患者的治疗方
案。
9.在优选实施例中,检测肿瘤负荷的方法,步骤b-f可以定期重复进行。在一些实施例中,每1-3个月重复一次步骤b-f。
10.在一些实施例中,该方法还包括通过以下步骤选择预定数目的生物标志基因簇:(a) 确定患者的肿瘤组织样本中提取的dna中的体细胞突变;(b)对每种体细胞突变计算体细胞突变的克隆比率(cr);(c)对所有的体细胞突变的体细胞突变克隆比率进行排名;和(d)从排名最高的体细胞突变中选择预定数量的体细胞突变作为生物标志基因。
11.在一些实施例中,对体细胞突变的克隆比率计数的步骤包括:(a)确定肿瘤组织中肿瘤细胞百分比(tp);(b)对每种体细胞突变确定体细胞突变等位基因比率(sa);(c) 就每种体细胞突变,确定正常组织中与体细胞突变连锁的预定数量的胚系杂合体单核苷酸多态性(true germline hyterozygosis snps)的平均分或者平均值(plg);(d)确定每种体细胞突变的拷贝数量变化值(cnvr);和(e)通过公式计算体细胞突变克隆比:
[0012][0013]
在一些实施例中,获得患者肿瘤负荷的步骤包括:(a)就每个生物标志基因簇中的生物标志基因,通过以下步骤从循环肿瘤dna测试中获得体细胞突变等位基因比率,包括步骤:(i)对循环dna总数计数;(ii)对具有体细胞突变等位基因的循环dna进行计数; (iii)用具有体细胞突变等位基因的循环dna数量除以循环dna总数,以获得体细胞突变等位基因比率;(b)就每个生物标志基因簇中的生物标志基因,获得上述(如权利要求12) 所述的体细胞突变克隆比率;和(c)以每种体细胞突变等位基因比率与相应的体细胞突变克隆比比率的比值的平均值为基础,获得肿瘤负荷数据。
[0014]
在一些实施例中,确定肿瘤组织中肿瘤细胞百分比(肿瘤纯度)的步骤包括:(a) 从正常组织中常见的单核苷酸多态性(snps)中选择胚系杂合体snps位点(ths);(b) 检测肿瘤组织中的ths;(c)绘制ths等位基因的密度曲线;和(d)依据肿瘤组织中检测到的ths,计算肿瘤组织中肿瘤细胞的百分比。
[0015]
在一些实施例中,检测肿瘤组织中ths的步骤包括:(a)在肿瘤组织中调用每个ths 等位基因评分;(b)使用一种算法来平滑评分组密度曲线;(c)在密度与肿瘤组织th 等位基因比图谱上确定两个小肩峰的位置;(d)通过公式tp=((100-(a b))/2 a)/100,确定肿瘤组织中肿瘤细胞百分比,所述a为识别的第一个小肩峰的位置,所述b是识别的第二个小肩峰的位置。
[0016]
在一些实施例中,检测肿瘤负荷的方法还包括检测与治疗相关的基因(“药物靶向基因”)突变。在一些实施例中,检测药物敏感性相关的基因突变的步骤包括(a)富集游离细胞循环dna中包含药物靶向基因的dna序列;(b)对富集dna进行测序;(c)对突变dna和所有富集dna序列分别计数。
[0017]
在一些实施例中,检测药物靶向基因中的突变的富集、测序和计数步骤,与基于定制基因簇获得肿瘤负荷的富集、测序和计数步骤同时进行。在一些实施例中,药物靶向基因突变为erbb2,met,egfr,kras,pik3ca,braf,kit,nras,alk,ros1,和ret。在一实施例中,药物靶向基因突变可以包括单核苷酸的变化,拷贝数的变化,插入,缺失,融合和倒置。
附图说明
[0018]
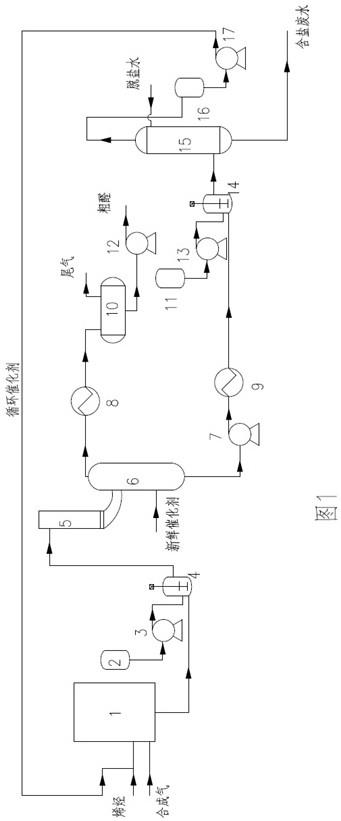
图1为表示监测肿瘤演化的过程的流程图。
[0019]
图2为表示循环肿瘤dna分析的简化过程的流程图。
[0020]
图3为表示胚系杂合体snps等位基因比率为50%的图像。
[0021]
图4为表示胚系杂合体snps等位基因比率为72.5%和23.75%的图像。
[0022]
图5为表示与一体细胞突变位点相关的snp等位基因比率的图。
[0023]
图6a,6b,6c,6d,和6e说明在不同情况下的体细胞突变克隆比率(cr)。tp:肿瘤的纯度;sa,体细胞突变等位基因比;plg,四个连锁的胚系杂合体snps的平均数;cnvr:拷贝数量变异。
[0024]
图7为在三个时间点从同一患者的三个样本的循环肿瘤dna中获得的肿瘤负荷图。
[0025]
图8a和8b表示ca199肿瘤标志物的数量,肿瘤患者的治疗时间从2015年2月3日到 2016年5月26日期间。过去的治疗:2015年2月根治性结肠癌切除术;2015年3月18 日奥沙利铂(oxaliplatin)200mgd1 卡培他滨(capecitabine)1500mg bid d1-14/q3w;2015 年4月8日奥沙利铂200mgd1 卡培他滨1500mg bid d1-14 贝伐单抗(bevacizumab)d1/ q3w;2015年4月29日奥沙利铂200mgd1 卡培他滨1500mg bid d1-14 贝伐单抗d1/ q3w;2015年6月14日卡培他滨1500mg bid d1-14 贝伐单抗的、d1/q3w;2015年7月 8日,卡培他滨1500mg bid d1-14 中药/q3w;2016年1月20日至2月20日,克唑替尼胶囊(crizotinib capsules)250mg两次/日;2016年3月8日和2016年4月19日tace栓塞。
具体实施方式
[0026]
本发明涉及通过检测循环肿瘤dna来监测肿瘤细胞进化的新的系统和方法。该系统和方法是部分基于我们的新发现,体细胞突变的克隆比可从肿瘤组织的外显子测序中获得,肿瘤特异性突变可以被选择作为定制基因簇,根据肿瘤突变克隆比率的排名,具有较高克隆比代表更特异的肿瘤突变。当与体细胞突变的克隆比结合时,每个体细胞突变的循环dna的等位基因的比率可用于获得患者肿瘤负荷,从而以一种非侵入性的,精确的,和进步的方式监测肿瘤突变。
[0027]
在第一方面,本发明公开了一种从患者肿瘤组织样品提取的dna中选择预定数量的生物标志基因以形成生物标志基因簇(“定制基因簇”)来检测患者肿瘤负荷的方法;从患者体液样品中分离循环的游离细胞dna;从游离细胞dna片段中富集含有生物标志基因的dna序列;对富集的dna进行测序;对富集dna中的突变dna和正常dna序列分别计数;和获得患者的肿瘤负荷。在一些实施例中,体液为血液,血清,羊水,脊髓液,结膜液,唾液液,阴道液,粪便,精液,尿液或汗液。
[0028]
在一实施例中,如图1中的流程图所示,基于组织样本的外显子组测序数据,选择一定制基因或者包括20个突变生物标志的生物标志基因簇;对每个生物标志都设计了引物;生物标志通过引物进行多重pcr被富集;将接头添加到扩增产物中以制备测序文库;最后制备好的文库在二代测序平台上进行测序。
[0029]
在一些实施例中,组织样本可以是福尔马林固定、石蜡包埋(ffpe)的组织,新鲜冰冻(ff)组织,或者保存核酸或蛋白质分子的溶液中的组织。样品是不受限制的,可以是新鲜,冷冻或固定。样本可以与相关的信息相关联,如年龄,性别和个体的临床症状;样品的来
源;收集方法和样本的存储方法。样本通常是从一个体获得的。
[0030]
在其他一些实施例中,组织样本是来自活检的样本。活检可包括摘除组织样本进行诊断或预后评估的过程,以及组织标本本身。本领域已知的活检技术均可应用于本发明的方法中。可以根据评估的组织类型(例如,结肠,前列腺,肾脏,膀胱,淋巴结,肝,骨髓,血细胞,肺,乳腺等),肿瘤的大小和类型(如固体或悬浮,血液或腹水)等因素来应用活检技术。代表性的活检技术包括,但不限于,切除活检,切取活检、穿刺活检、手术活检,骨髓活检。“切除活检”指的是切除周围带有少量正常组织的整个肿瘤,。“切开活检”指的是切去一个楔形的组织,它包括横截面直径大小的肿瘤组织。分子分析可以采用对肿瘤的“空芯针穿刺活检”,或“细针穿刺活检”,该方法一般从肿瘤组织内获得悬浮细胞。活检技术被论述,例如,在哈里森的内科原理,kasper等主编,第十六版,2005,第70章,在整个第五部分。
[0031]
在本领域已知的富集标准分子生物学技术方法和没有具体说明的方法一般按照萨姆布鲁克等著(sambrook et al.),分子克隆实验指南,冷泉港实验室出版社,纽约(1989),以及奥苏贝尔等著(ausubel et al.),分子生物学实验原理,约翰威立出版社,巴尔的摩,马里兰州(1989),及perbal,分子克隆实验指南,约翰威立出版社(john wiley and sons),纽约(1988),和沃森等著,重组dna,美国科学丛书,纽约和比伦等著;基因组分析:实验室手册系列,1-4卷,冷泉港实验室出版社,纽约(1998)和在美国专利第4,666, 828号;4,683,202;4,801,531;5,192,659和5,272,057中的方法和本文的参考文献均可以引用作为参考。聚合酶链反应(pcr)一般按照以下pcr文献进行pcr方法:方法和应用指南,学术出版社,圣地亚哥,加利福尼亚州(1990)。
[0032]
在一实施例中,选择预定数量的生物标志基因是选择肿瘤特异性突变。在一些实施例中,是依据肿瘤细胞中突变的表达频率来选择肿瘤特异性突变。肿瘤细胞具有一突变的百分比越高,这一突变针对肿瘤的特异性就越强。在所有肿瘤细胞中存在一突变的肿瘤细胞的百分比被称为肿瘤突变的克隆比率。克隆比越高,该肿瘤突变对该肿瘤的特异性越高。例如,在一方法中,首次发现患者肿瘤组织样本中提取的dna的体细胞突变;接着对每个体细胞突变的体细胞突变克隆比(cr)进行计算;所有的体细胞突变的克隆比从高到底排名;这些体细胞突变中,排名位置最高的体细胞突变被选择组成生物标志基因的体细胞突变组。该生物标志基因簇在本发明中也被称为定制基因簇。
[0033]
肿瘤组织中肿瘤细胞百分比(肿瘤纯度,或tp)可以通过胚系杂合体snps的分析确定。在一实施例中,可以从正常组织中常规snps中选择胚系杂合体snps来获得tp;检测肿瘤组织中的ths;绘制ths等位基因密度图;和基于肿瘤组织中检测到的ths计算肿瘤组织中肿瘤细胞百分比。如图3所示,对于胚系杂合体snps,密度峰在50%左右。
[0034]
在实施例中,肿瘤组织中ths检测包括以下步骤:(i)给肿瘤组织的每种ths等位基因打分;(ii)采用算法以使评分组密度曲线平滑;(iii)确定肿瘤组织的密度与th等位基因比曲线上两个小肩峰的位置;(iv)通过公式tp=((100-(a b))/2 a)/100,来确定肿瘤组织中肿瘤细胞百分比,所述a为识别的第一个小肩峰的位置,所述b是识别的第二个小肩峰的位置。图4中为一实施例,肿瘤的胚系杂合体等位基因密度从23.75%到72.5%。由于多元化,tp计算下来为25.652%。
[0035]
在某些实施例中,对体细胞突变的克隆比计数的步骤包括:(i)确定肿瘤组织中肿瘤细胞百分比(肿瘤纯度,或tp);(ii)对每种体细胞突变确定体细胞突变等位基因比率
(sa); (iii)就每种体细胞突变,对正常组织中与体细胞突变连锁的预定数量的胚系杂合体snps 确定平均分或者平均值(plg);(iv)就每种体细胞突变,确定拷贝数量变化值(cnvr);和(v)通过公式计算体细胞突变克隆比:
[0036][0037]
在一些实施例中,如图5所示,plg源自正常组织中与体细胞突变位点连锁的四个胚系杂合子的单核苷酸多态性的平均分或者平均值。(plg=(80.3% 82.3% 81.2% 78.5%)/4=80.56%).
[0038]
图6a,6b,6c,6d,and6e说明一些假设的典型场景,来展示如何从外显子组测序数据获得克隆比率。红条指体细胞突变等位基因(标记为sa)。蓝条(标记为nths)是指连锁的杂合子snps.。
[0039]
如图6a的场景1所示,肿瘤纯度(tp)为100%,意味着组织中所有细胞均为肿瘤细胞;体细胞等位基因比率(sa)为50%,即肿瘤细胞中50%等位基因发生了突变;plg 为50%;和cnvr为1,即拷贝数量无变化。在场景1中,根据cr计算公式,体细胞突变克隆比(cr)为100%,说明所有肿瘤细胞均发生体细胞突变。
[0040]
如图6b场景2所示,tp为2/3,即2/3肿瘤组织细胞实际为肿瘤细胞;sa为1/3,即肿瘤组织细胞中1/3等位基因是突变体;plg为50%;cnvr为1。在场景2中,cr将为100%,即所有肿瘤细胞均发生体细胞突变。
[0041]
如图6c场景3所示,tp为2/3,即2/3肿瘤组织细胞实际为肿瘤细胞;sa为4/8,即肿瘤组织细胞中4/8等位基因是突变体;plg为5/8;cnvr为8/6,意味着有二个染色体重复。在场景3中,cr将为100%,即所有肿瘤细胞均发生体细胞突变。
[0042]
如图6d场景4所示,tp为2/3,即2/3肿瘤组织细胞实际为肿瘤细胞;sa为2/8,即肿瘤组织细胞中2/8等位基因是突变体;plg为5/8;cnvr为8/6,意味着有二个染色体重复。在场景4中,cr将为50%,即一半肿瘤细胞发生体细胞突变。
[0043]
如图6e场景5所示,tp为2/3,即2/3肿瘤组织细胞实际为肿瘤细胞;sa为3/8,即肿瘤组织细胞中3/8等位基因是突变体;plg为7/8;cnvr为8/6,意味着有二个染色体重复。在场景5中,cr将为50%,即一半肿瘤细胞发生体细胞突变。
[0044]
由于克隆比是通过肿瘤组织样本的外显子测序获得的,获得患者肿瘤负荷首先要获得每个生物标志基因的循环肿瘤dna体细胞突变等位基因比,具体步骤如下:(i)对所有循环dna计数;(ii)对具有体细胞突变等位基因的循环dna计数;和(iii)具有体细胞突变等位基因的循环dna数量除以所有循环dna数量,获得体细胞突变等位基因比率;然后依据每个体细胞突变等位基因比与相应的体细胞突变克隆比的比值的平均值来获得肿瘤负荷。
[0045]
基于克隆比选择的生物标志基因数量是可变的。在一些实施例中,定制基因簇包括至少5个生物标志基因。在其他实施例中,定制基因簇包括5-10个生物标志基因。在另一些实施例中,定制基因簇包括11-20个生物标志基因。在优选实施例中,定制基因簇包括 21-30个生物标志基因。更优选的,定制基因簇包括30个以上生物标志基因。
[0046]
在一些实施例中,在肿瘤发展进程中,周期性地从患者身上采集样本。根据上述方法,检测循环肿瘤dnas以获得肿瘤负荷。在一些实施例中,每1-3个月采集一次样本。在其他
实施例中,如必要,每1-3周采集一次样本。
[0047]
在一些实施例中,肿瘤特异性突变的肿瘤负荷的检测与治疗相关的基因突变的检测同时进行。这些基因本文中称为药物靶向基因。药物靶向基因簇可以包括已知或将来被发现与治疗癌症或肿瘤相关的任何基因。
[0048]
在一实施例中,检测药物靶向基因包括以下步骤:富集游离细胞循环dna中包含药物靶向基因的dna序列;对富集dna进行测序;和对突变dna和所有富集dna序列分别计数。在一些实施例中,为这些药物靶向基因设计了引物,并用于在扩增反应中富集药物靶向基因。药物靶向基因的扩增反应与定制基因簇的扩增反应可以分开进行。在实施例中,二个扩增产物可以在测序和计算步骤组合在一起进行,以便简化定制基因和药物靶向基因的检测程序。
[0049]
在一些实施例中,药物靶向基因为与治疗相关的erbb2,met,egfr,kras,pik3ca, braf,kit,nras,alk,ros1,和ret。例如,存在kras基因突变,g13d,表明肿瘤是帕尼单抗(panitumumab)耐受的。存在pik3ca基因突变,e545k,表明肿瘤对依维莫司(everolimus)敏感。更多的信息见下表3。
[0050]
在一些实施例中,药物靶向基因和定制基因的突变包括单个核苷酸变化,拷贝数量变化,插入,缺失,融合和倒置。
[0051]
在另一方面,本发明涉及一种循环肿瘤dna分析的简化方法。在循环肿瘤dna分析的简化方法的一实施例中,如图2所示,可以通过strcl游离dna试管采集血浆来进行采样,该方法可实现核酸提取的高效和成本优化。然后提取的核酸用于生成20个生物标志基因的个体化文库,该文库在ion s5 ngs平台上进行随后的测序(fubsequent sequening)。
[0052]
在本技术中,包括所附的权利要求中,术语“大约”,特别是在指特定数量时,是指包括正负百分之十的范围。
[0053]
如本文使用的,单数形式“一”“一个”“这”包含复数,除非内容上另外清楚明确,且可以与“至少一个”“一个或多个”互换使用。
[0054]
文中,术语“包括”、“包括着”、“包含”、“包含着”“含”、“含有”,及其任何变形,是指非排他性的包含,比如一种工艺流程,方法,方法限定的产品,或者组合物包括,包含,或含一成分或一系列成分,并不仅包括这些成分,还可以包括未明确列出的成分或这些工艺流程,方法,方法限定的产品或组合物固有的其他成分。
[0055]
实施例
[0056]
1.用循环肿瘤dna监测肿瘤负荷
[0057]
本实施例说明用循环肿瘤dna监测人体肿瘤负荷。特别的,患者55岁,女性,转移性结肠癌,做了3次循环肿瘤dna(ctdna)的检测。她2015年2月行结肠切除术。病理检查证实,iv期转移腺癌(pt4n2m1))和wes表明kras野生型和无braf v600e 突变。患者术后自2015年3月起接受化疗,每3周一轮治疗
×
3,术后卡培他滨/奥沙利铂联合贝伐单抗治疗。在发生肝转移前,卡培他滨和贝伐单抗联合治疗的方案持续了9个月。然后采用奥沙利铂经导管肝动脉化疗栓塞。
[0058]
对福尔马林固定,石蜡包埋(ffpe)组织,肿瘤样本和匹配的患者的正常的血液样本进行外显子基因测序。dna通过麦克斯韦(maxwell)仪器提取,promega的dna自动抽提系统,根据制造商的指示操作。maxwell rsc dna ffpe试剂盒和maxwell rsc全血 dna
试剂盒(promega)用于从ffpe组织和正常外周血白细胞中分别分离dna。纯高分子量基因组dna样本在琼脂糖凝胶进行质量检测和用qubit 3.0(thermo fishers)做量化分析。
[0059]
dna样本用covaris s220进行剪切。根据制造商的说明,使用安捷伦sureselect人类全外显子v5试剂盒(agilent technologies)制备文库。对200bp dna片段进行测序,使用配对末端 150bp,hiseqx(illumina)读取序列,获得平均深度》=200
×
肿瘤dna和》=100
×
正常dna。
[0060]
然后,每个读数与ucsc基因组浏览器的hg19(2009年2月grch37/hg19)一致,以默认参数宽带无线接入(burrows wheeler aligner)。胚系细胞和体细胞突变被gatk(基因组分析工具1.6)标准版调用。用loh区域的常规dbsnps(dbsnp 142数据库)可以容易估算出肿瘤组织的肿瘤纯度。获得肿瘤组织的肿瘤细胞百分比后,可以直接计算出每个体细胞突变位点的突变克隆比(所有肿瘤细胞被突变肿瘤细胞除)。根据从高到低的克隆比排名,我们选择最高频的30个体细胞突变位点,其中23个体细胞突变位点被成功设计出pcr引物。
[0061]
如表1所示,选定23个体细胞肿瘤突变标志。为23个突变生物标志基因的每个基因设计了引物,但17个突变生物标志在最终基因簇中,设计率为74%。引物通过网上工具ion ampliseq designer(https://ampliseq.com)设计。根据网站向导,显示每个突变的基因组坐标的csv格式的文件被上传。应用类型为dna热点设计。参照基因组为人类基因 (hg19)。在几个小时程序运行后,设计结果已就绪,表2列出了引物序列。
[0062]
表1.外显子测序中确定的体细胞肿瘤突变
[0063][0064]
[0065]
根据以下步骤进行多重pcr扩增目的生物标志的实验。首先,dna用qubit dsdna hs 检测试剂盒和荧光定量仪qubit 3.0定量检测。然后扩增反应方法如下。(y=10/c,c 是每个ctdna样品浓度(ng/ul))。在这个的实施例中,三个ctdna样品的浓度分别为 0.178ng/μl,0.283ng/μl,and 0.334ng/μl。因此,相应的,所有的三个y值超过50ul,那么所有剩下的反应体积均被ctdnas占据,如,y=13和不添加无核酸酶的水。
[0066][0067]
表2定制基因生物标志的引物
[0068]
[0069][0070]
对药物相关池进行单独的扩增反应。在药物相关的池中,有11个与治疗相关的基因突变,如下表3所示。所使用的引物列于表4。
[0071]
表3药物池基因
[0072]
[0073][0074]
表4药物池基因的引物.
[0075]
[0076]
[0077][0078]
药物池的反应混合物按照以下方法制备。
[0079][0080]
这二个pcr反应按照以下步骤操作。
[0081][0082][0083]
扩增的目标生物标志随后按照下述反应步骤进行终端修复。
[0084][0085]
端部修复反应的混合物在室温下孵育20分钟。然后用磁珠纯化dna产物。具体而言,试剂150μl(1.5倍样品的体积)被添加到经剪切的dna样本中,并与磁珠悬浮液彻底混合,之后在室温下孵育5分钟。然后试管被放置在一个磁力架里,如dynamag
tm
2磁力架中3分钟或至从一定角度看,溶液呈澄清的褐色为止。在不扰动磁珠颗粒的情况下除去上清液。不从磁力中取出试管,用500μl新鲜制备的70%乙醇洗涤磁珠两次。磁珠干燥后,用42μl的无核酸酶的水洗脱dna。接头连接反应随后进行,混合40μl含洗脱dna的上清液与5μl连接缓冲液,1μl barcode x,1μl p1接头,1μl10mm dntps、1μl t4连接酶和1μl taq聚合酶。反应混合物放置在一个热循环仪中,程序设置为22℃20分钟,72℃10分钟,10℃保温备用。反应产物随后用磁珠纯化。然后扩增文库,添加pcr混合物(25ul 2
×
phusion hf pcr master mix,1ul文库扩增引物和24ul 无核酸酶的水)到有接头连接dna产品的风干的磁珠上,混合物再在室温下孵育2分钟。然后将上清液移入一个新的试管,并放置在一个热循环仪中以便进行下一步操作。
[0086][0087]
之后用磁珠纯化扩增的文库dna,并根据生产商的手册,用qubit 3.0荧光计进行荧光定量。然后稀释文库dna至15ng/ml,以准备模板。按照制造商的标准指令,将稀释的文库、ion 520芯片,耗材和试剂装入ion chef仪器,进行乳液pcr(emulsion pcr)和富集离子球颗粒。然后将准备好的芯片放入ion s5测序仪,开始测序。三个ctdna的突变率检测结果
见下表5所列。
[0088]
首先,我们应用肿瘤纯度估计模块工具csmt-tools来计算肿瘤组织中肿瘤细胞的百分比。如后面的图显示的,结果是54.1%。其次,我们计算了表5中每种体细胞突变的突变克隆比。最后,根据总游离细胞dna中每种游离细胞肿瘤体细胞突变dna片段的比例,应用加权平均法(克隆比、和cr分值加权法)对该患者三个不同时间点的肿瘤负荷进行监测。结果如图7所示。
[0089]
表5三个dna样本的突变率
[0090]
本实施例中,我们获得了患者s1的三份血液样本,进行了定制基因池和药物靶向基因池的检测。投入的dna分别是2.3ng,3.68ng and 4.3ng。如图7所示,监测结果显示外周
[0091][0092]
血中ctdna的比率,从2016年1月0.1显著增加到2016年2月的11.0,然后从2016年 2月的11.0显著降低到2016年5月的0.4。如图8a和8b所示,这种波动与患者肿瘤标记ca199
的变化趋势相关。
[0093]
第二个样本的药物池的测序结果显示有一帕尼单抗耐受突变kras,g13d和一依维莫司敏感突变pik3ca e545k。这些药物敏感突变的检测可指导患者将要进行的治疗计划。这位患者将用帕尼单抗和/或依维莫司治疗。具体参见下表6的突变。
[0094]
表6药物池的突变
[0095]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。