1.本发明属于酶催化手性合成领域,具体涉及一类亚胺还原酶pmir突变体及其在催化合成手性2-芳基吡咯烷中的应用。
背景技术:
2.手性2-芳基吡咯烷是合成拉罗替尼的关键中间体,专利wo 2018077246 a1报道使用s-叔丁基亚磺酰胺生成(r)-2-(2,5-二氟苯基)吡咯烷,然而亚胺的还原、关环反应需要在低温下进行。2019年,lundrigan t等使用鏻离子手性化合物不对称催化5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯获得76%ee的手性胺化合物,通过(r)-苹果酸进行手性拆分后产物收率79%,94%ee,虽然没有使用贵金属进行催化氢化,但ee值仍不够高,而且进行手性拆分导致收率下降。
3.2020年,shi等通过ru过渡金属的不对称催化氢化反应、重结晶、lialh4还原步骤,获得手性2-芳基吡咯烷。该反应路线使用昂贵金属钌作手性催化剂,在该步获得手性胺的ee并不高,反应需要高压、h2,这提高设备成本,而且酮还原步骤使用了易燃易爆炸的lialh4,导致反应危险系数增加。
4.与化学法合成手性的2-芳基吡咯烷相比较,亚胺还原酶不对称催化氢化合成具有条件温和、立体选择性的特有优势,但该方面的报道很少。2020年,zhang等报道使用来源于streptomyces clavuligerus的scir不对称催化氢化底物载量5.4g/l的5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯生成》99%ee的(r)-2-(2,5-二氟苯基)吡咯烷。然而,报道的scir的底物载量低,其实际应用价值较低。
5.综上所述,化学法合成手性的2-芳基吡咯烷立体选择性偏低,而且需要苛刻的反应条件,如h2、高压,或使用危险系数大的lialh4,要获得高ee产物还需要经过拆分,这降低了原子利用率。相较于化学法,亚胺还原酶不对称催化生成手性的2-芳基吡咯烷具有立体选择性高,反应条件温和的特点,但是目前还没有达到工业生产指标的工程酶突变体的报道。
技术实现要素:
6.本发明针对现有技术不足,以5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯为底物,通过筛选构建的亚胺还原酶酶库,筛选得到高(r)立体选择性的亚胺还原酶pmir。经过工程化改造的pmir突变体相对于现有技术公开的亚胺还原酶具有更高的时空产率、底物催化范围。通过进一步对pmir结构模型的活性口袋选取一系列位点构建饱和突变体,发现了多个对酶活与立体选择性有促进作用的位点,进一步进行了组合突变筛选,获得一类亚胺还原酶pmir突变体。
7.本发明具体技术方案如下:
8.一类亚胺还原酶pmir突变体,所述突变体包含如seq id no:1所示的亚胺还原酶
氨基酸序列的第138位、第140位、第190位、第191位、第249位、第251位、第258位中的一个或多个位点氨基酸突变。
9.优选的,所述突变体第138位的谷氨酰胺突变为甲硫氨酸、丙氨酸、半胱氨酸,和/或突变体第140位的脯氨酸突变为丙氨酸、甘氨酸、丝氨酸,和/或第190位谷氨酰胺突变为丙氨酸、甲硫氨酸、酪氨酸、丝氨酸、半胱氨酸、组氨酸,和/或第191位甲硫氨酸突变为亮氨酸、缬氨酸、半胱氨酸,和/或第228位丝氨酸突变为丙氨酸、缬氨酸、半胱氨酸、苏氨酸,和/或第249位缬氨酸突变为亮氨酸、异亮氨酸、甲硫氨酸,和/或第251位精氨酸突变为天冬酰胺、半胱氨酸、丝氨酸、苏氨酸、丙氨酸、赖氨酸、组氨酸,和/或第258位丝氨酸突变为缬氨酸、丙氨酸、组氨酸、半胱氨酸、甲硫氨酸。
10.优选的,所述突变体第140位的脯氨酸突变为丙氨酸,和/或第190位谷氨酰胺突变为丝氨酸,和/或第251位精氨酸突变为天冬酰胺。
11.本发明一个具体的示例,所述突变体为p140a/q190s/r251n,氨基酸序列如seq id no:3所示。
12.本发明另一目的在于公开编码所述的亚胺还原酶pmir突变体氨基酸序列。
13.本发明另一目的在于公开包含所述亚胺还原酶pmir突变体基因的重组载体或所述重组载体的转化体。
14.本发明另一目的在于公开项所述的亚胺还原酶pmir突变体或其活性片段在催化合成手性2-芳基吡咯烷中的应用。
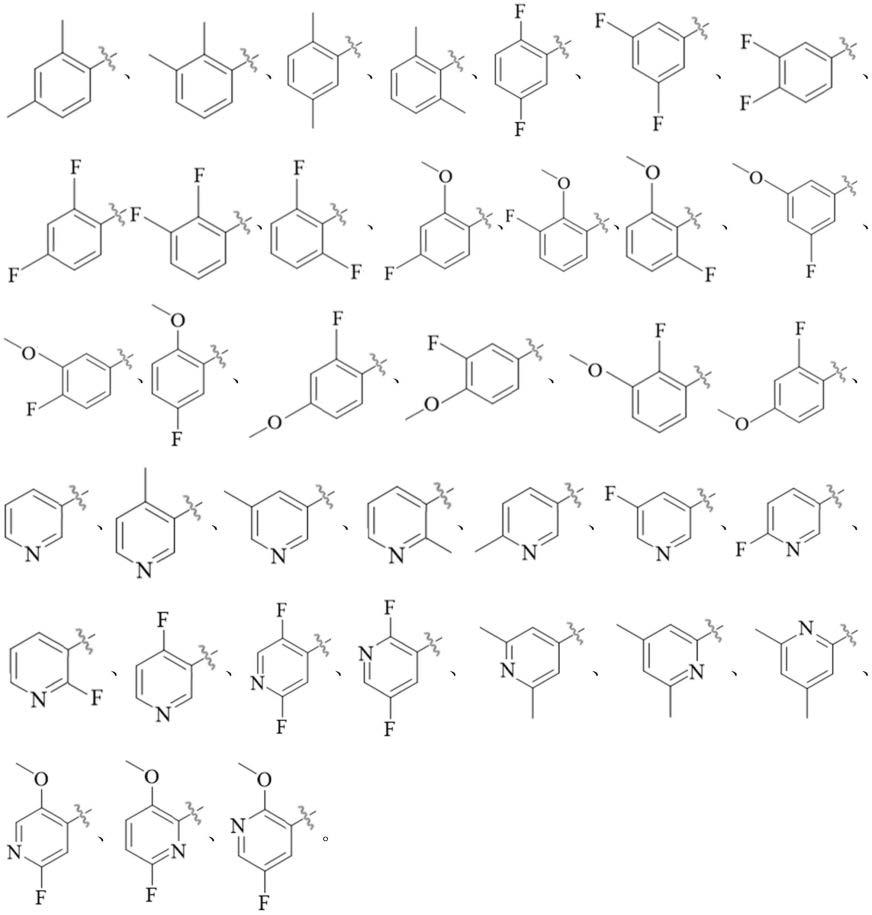
15.本发明一个具体的示例,所述亚胺还原酶pmir突变体能够将5-芳基-3,4-二氢-2h-吡咯催化还原为(r)-2-芳基吡咯烷。所述芳基选自取代或非取代的苯基或者取代或非取代的吡啶基。优选的,所述苯基或吡啶基中的一个或多个取代位被h、f、cl、br、i、羟基、氨基、硝基、c1-c10的烷基(例如甲基、乙基、丙基、异丙基、叔丁基、正丁基)、c1-c10的烷氧基(例如甲氧基、乙氧基)中的一个或多个取代。
16.具体的,所述芳基可以选自具体的,所述芳基可以选自
17.本发明一个具体的应用,利用亚胺还原酶pmir突变体催化还原5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,获得(r)-2-(2,5-二氟苯基)吡咯烷,进一步合成拉罗替尼。
18.本发明优点:
19.本发明前期研究筛选构建亚胺还原酶酶库,获得了具有手性催化活性的亚胺还原酶pmir。通过同源建模,获得了含有nadph的pmir结构模型。对pmir q138、v139、p140、q190、m191、f194、w195、e224、t225、k231、f232、f235、v249、d250、r251、m254、s258进行丙氨酸扫描以及饱和突变,发现了第138位、第140位、第190位、第191位、第249位、第251位、第258位对酶活性提高有促进作用。进一步将每个饱和突变文库筛选到的活性、立体选择性最好的突变体进行排列组合,通过筛选,获得多个对2-芳基吡咯烷催化活性提高的突变体。底物普适性实验结果表明,pmir通过酶工程改造后,多个突变体催化底物谱范围变宽,活性提高。其中,在底物浓度为72.48g/l的25ml反应体系中,本发明的突变体可以在8h内以100%转化率完成不对称催化还原5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯,总收率80.7%,产物ee值100%,具备工业应用价值。
附图说明
20.图1为野生型pmir基因序列的pet-28a质粒模板。
21.图2为丙氨酸扫描文库突变体活性(左)及对映体过量(右)检测结果。
22.图3为p140突变文库突变体转化率(左)及对映体过量(右)的检测结果。
23.图4为q190突变文库突变体转化率(左)及对映体过量(右)的检测结果。
24.图5为r251突变文库突变体转化率(左)及对映体过量(右)的检测结果。
25.图6为突变体pmir-3t催化还原400mm 5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯的反应进程曲线。
具体实施方式
26.以下通过实施例说明本发明的具体步骤,但不受实施例限制。
27.在本发明中所使用的术语,除非另有说明,一般具有本领域普通技术人员通常理解的含义。
28.下面结合具体实例并参照数据进一步详细描述本发明。应理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
29.在以下实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
30.实施例1pmir建模及突变位点分析
31.应用swiss-model(在线网址:https://swissmodel.expasy.org/)同源建模得到一个二聚体形式的亚胺还原酶pmir晶体结构模型,使用discovery studio将pdb id为4oqy的晶体结构和pmir晶体模型进行结构叠加,将nadph复制到晶体模型上,获得含nadph的pmir结构模型。
32.使用软件autodock tools将pmir晶体模型和化合物5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯设置为柔性后,使用软件autodock vina进行全柔性分子对接,根据位置最合理、能量最低选取对接构象,根据对接结果,从结合口袋选取了17个指向活性口袋的氨基酸位点进行丙氨酸扫描或饱和突变构建(q138、v139、p140、q190、m191、f194、w195、e224、t225、k231、f232、f235、v249、d250、r251、m254、s258)。
33.实施例2突变体表达及筛选
34.以野生型pmir基因序列(seq id no:2)的pet-28a质粒为模板(图1),进行丙氨酸扫描文库的构建、表达及筛选。在pcr反应管中按表1加入pcr反应组分,按照表2设置pcr反应条件。反应结束后,加入dpni酶1.5μl,于37℃水浴环境下1.5h,切掉模板质粒。取一定量酶切产物加到e.coil dh5α感受态细胞中,混匀,在冰中静置30min后,42℃热激90秒,迅速取出并置于冰上冷却2~3min。加入900μl无抗生素的液体lb培养基,于37℃、150rpm的摇床环境下,培养45min后取出离心(8000rpm,2min),去除部分上清液,留100-200μl液体,使用移液枪吸打混匀,并将菌液涂布于含卡那霉素抗生素(50μg/ml)的lb琼脂固体培养基的平板上,于37℃培养箱培养16h,得到包含突变株的转化子。每一个突变挑3个单菌落到含卡那霉素抗生素的400μl液体lb培养基中,于37℃、200rpm的摇床环境下培养14h后,将其送去金唯智公司测序。将获得的正确突变株质粒取一定量转化至e.coil bl21(de3)感受态细胞中,涂布于含卡那霉素抗生素的lb琼脂固体培养基的平板后获得突变体。挑单菌落至含卡那霉素抗生素的400μl液体lb培养基中,于37℃、200rpm的摇床环境下培养14h后,取30μl菌
液至含卡那霉素抗生素的3ml液体lb培养基中,于37℃、200rpm的摇床环境下培养od
600
=0.6~0.8,加入iptg(终浓度0.1mm),于20℃、200rpm下诱导表达20h,表达结束后离心得到菌体,使用生理盐水洗涤1次,离心后除净水分,使用100mm磷酸盐缓冲液ph7.0配置成静息细胞(50mg/ml)。
35.野生型及突变体粗酶液:使用10ml的100mm磷酸盐缓冲液(ph6.0)将0.5g的菌体重悬浮,破碎(2%功率,20min),冷冻离心后获得的粗酶液加入5ml甘油混匀。
36.表1 pcr反应体系
[0037][0038]
pcr反应组分加完后,使用pcr反应仪进行pcr反应,按表2设置pcr反应所需温度、时间和循环次数。
[0039]
表2 pcr反应温度循环设置
[0040][0041]
突变体催化500μl反应体系:以5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯为模式底物。突变体静息细胞(50mg/ml)250μl,葡萄糖脱氢酶静息细胞(10mg/ml)100μl,500mm葡萄糖溶液50μl,2.5mm nadp
溶液50μl,100mm 5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯的甲醇溶液50μl,于30℃、200rpm反应1h后,加入1ml ipa灭活,离心后取上清液,使用hplc检测ee值和转化率。
[0042]
样品的hplc手性分析条件如下:
[0043]
手性分析柱=ad-h;流动相=正己烷(0.1%二乙胺):异丙醇(95:5,v/v);流速=
1ml/min;温度=30℃,检测波长=254nm。r对映体保留时间为4.858(min),s对映体保留时间为5.322min。
[0044]
其中,丙氨酸突变文库筛选结果如图2所示。结果显示氨基酸位点140、190、251对pmir活性提高有利,且r立体选择性不发生明显改变,突变体m191a、f194a、f232a、f235a的催化能力弱,w195a、d250a无活性。根据丙氨酸扫描文库筛选出活性提高的p140、q190、r251,构建饱和突变文库。方法参考丙氨酸扫描文库的构建、表达及筛选。筛选结果如图3、图4、图5所示。
[0045]
根据饱和突变文库筛选到的突变体p140a、q190s、r251n进行组合突变,pmir突变体的转化率测定结果如表3所示。结果显示突变体pmir-3t(p140a/q190s/r251n),与野生型pmir相比,在同等反应条件下,pmir-3t不对称催化还原10mm浓度的5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯的转化率由22.33
±
0.58%提高到94.33
±
0.58%,对映体过量值由97.00
±
1.00%提高到100.00
±
0.00%。pmir突变体活性对比结果如表4所示。结果显示本发明中突变体相较于野生型pmir的提高倍数以如下方式表示:“ ”表示活性提高约150%倍;“ ”表示活性提高了约200%;“ ”表示活性提高了300%及以上。
[0046]
表3 pmir突变体的转化率测定
[0047][0048][0049]
[a]
hplc检测,转化率=产物峰面积/(产物峰面积 底物峰面积);
[b]
hplc检测。
[0050]
表4 pmir突变体活性提高倍数
[0051][0052]
实施例3野生型pmir与突变体pmir-3t底物谱测定
[0053]
亚胺还原酶筛选反应体系如下:
[0054][0055]
在200μl检测体系下依次往96孔板加入100mm磷酸盐缓冲液ph6.0、pmir或突变体pmir-3t纯酶液、5mm nadph(终浓度1mm),紧接着放入30℃酶标仪预测1次,结束后迅速加入50mm亚胺底物(1~11a)的甲醇溶液(终浓度2.5mm),读取340nm处吸光值的变化,以1min以内吸光值变化计算酶活力。
[0056]
2ml离心管依次加入pmir或突变体粗酶液300μl,葡萄糖脱氢酶甘油粗酶液75μl,500mm葡萄糖溶液50μl,2.5mm nadp
溶液25μl,200mm亚胺底物(1~11a)的甲醇溶液50μl。于30℃、220rpm下反应24h后,加入100μl 6m naoh溶液,使用乙酸乙酯萃取三次,合并后真空抽干。加入300μl ipa溶解样品,使用hplc检测ee值。
[0057]
样品的hplc手性分析条件如下:
[0058]
手性分析柱=ad-h;流动相=正己烷(0.1%二乙胺):异丙醇(95:5,v/v);流速=1ml/min;温度=30℃,检测波长=254nm。底物谱手性分析条件如表4所示。
[0059]
表4手性分析条件
[0060]
[0061][0062]
[a]
流速:1ml/min;温度:30℃;检测波长254nm。
[0063]
野生型pmir和突变体pmir-3t底物谱测定结果如表5所示。结果表明pmir经过酶工程改造获得的突变体,底物适用范围拓宽,且对底物的活力得到提升。
[0064]
表5 pmir-3t与野生型pmir催化效果的比较
[0065][0066]
[a]
nd:not detected。
[0067]
实施例4酶法制备克级(r)-2-(2,5-二氟苯基)吡咯烷
[0068]
表6 400mm底物反应投料体系
[0069][0070]
在25ml反应体系下,以100mm磷酸盐缓冲液ph6.0作为缓冲液,反应温度为30℃,使用pmir-3t不对称催化还原底物浓度为72.5g/l的5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯。使用6m naoh将反应液调ph至10左右,离心取上清液,使用meoh洗涤菌体2次,离心取上清液,合并,旋掉meoh,剩余水相使用ea萃取四次,使用无水na2so4干燥后旋蒸,收率80.7%,ee 100%。其核磁表征数据如下:
[0071][0072]
棕色油状物,总收率80.7%。
[0073]1h-nmr(400mhz,cdcl3):δ(ppm)7.24
–
7.19(m,1h),6.95
–
6.88(m,1h),6.85
–
6.79(m,1h),4.36(t,j=7.6hz,1h),3.15
–
3.10(m,1h),3.05
–
2.98(m,1h),2.27
–
2.18(m,2h),1.90
–
1.77(m,2h),1.63
–
1.53(m,2h).
13
c-nmr(101mhz,cdcl3):δ(ppm)160.15(d,j=1.8hz),157.69(dd,j=10.6,1.8hz),155.25(d,j=2.1hz),134.43(dd,j=16.3,6.9hz),116.05(dd,j=25.0,8.6hz),114.12(ddd,j=24.3,10.0,7.1hz),55.54,46.84,33.22,25.55。
[0074]
催化还原400mm 5-(2,5-二氟苯基)-3,4-二氢-2h-吡咯的反应进程曲线如图6所示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
