一种基于工程大肠杆菌的mers-cov病毒检测系统
技术领域
1.本发明涉及基因工程领域,特别是涉及一种基于工程大肠杆菌的mers-cov病毒检测系统。
背景技术:
2.mers病毒是一种β属c亚群冠状病毒,全名为中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus,简称mers-cov),感染后引发中东呼吸综合征(middle east respiratory syndrome,简称mers),据世界卫生组织统计报道该病毒致死率约为34.4%。对此的病原学检查主要包括病毒核酸检测、抗体检测以及病毒分离。病毒核酸检测可以用于早期诊断,病毒分离为实验室检测的“金标准”。
3.核酸检测,即提取病原体的核酸并进行反转录和qpcr检测。目前针对中东呼吸综合征冠状病毒(mers-cov)检测主要是采用的是qpcr(real time quantitative pcr,实时荧光定量pcr)中的taqman水解探针法,基本流程是,使用咽拭子、鼻拭子等方法采集样品,然后进行病毒灭活,降低感染风险,再进行rna提取、逆转录和qpcr检测,根据检测结果判定感染情况。但这种方法对实验条件要求严格,需要有精准的实验仪器和洁净的实验环境,且所需时长平均为两小时以上。
4.抗体检测,即对于病原体侵入后机体产生的抗体的检测。抗体检测是有滞后性的,需要免疫细胞呈递抗原,产生抗体;抗体主要存在于体液循环系统中;一些感染力弱的病毒,譬如hpv病毒有时甚至是血液中难以检测出足够的抗体浓度的。另外抗体检测对快速变异病毒的特异性也很难定论。
5.除此之外,近两年来爆发的新型冠状病毒促使了基于crispr/cas检测病毒的研究,该方法显然可以推广至其它病毒的检测中。目前广为人知的是crispr/cas9系统,随着研究的深入,crispr/cas系统越来越多样,目前在核酸检测中应用最多的系统是靶向双链dna的crispr/cas12a和靶向rna的crispr/cas13。其中,张峰等使用crispr/cas13系统开发了sherlock核酸检测系统,其原理是crispr-cas13a-sgrna与靶基因(rna)结合,激活cas13a的rnase活性;doudna,j.等则基于crispr-cas12a(cpf1)-sgrna与靶基因(dna)结合,激活cas12a的ssdnase活性,开发了detectr核酸检测系统。在反应体系中存在sgrna的靶向dna或rna时,可以激活cas的核酸酶活性,通过降解标记的探针,可以实现对目标核酸的检测。然而,仅使用crispr检测技术通常达不到临床检验的灵敏度,所以一般需要结合一些扩增技术来提高检测的灵敏度。
6.如上这些检测方法均对检测条件有一定要求,因此无法实现环境中病毒的实时监测。
技术实现要素:
7.本发明的目的是提供一种基于工程大肠杆菌的mers-cov病毒检测系统,以解决上述现有技术存在的问题,本发明通过对大肠杆菌进行改造,使其可以识别mres-cov的刺突
蛋白(spike protein)并发出荧光信号,并对其做安全防护处理使其可以实现病毒的检测。
8.为实现上述目的,本发明提供了如下方案:
9.本发明提供一种用于病毒检测的工程菌,该工程菌包括pmra/pmrb双组分系统和luxi/luxr群体感应系统;其中,所述pmra/pmrb双组分系统的跨膜蛋白pmrb的胞外部分替换为待测病毒识别蛋白的受体。
10.进一步地,跨膜蛋白pmrb的fe(ⅲ)敏感域替换为待测病毒识别蛋白受体的核心结构域。
11.进一步地,所述待测病毒识别蛋白为mers-cov包膜上的spike蛋白,所述spike蛋白的rbd为gln471到asp580。
12.进一步地,所述待测病毒识别蛋白的受体为人类细胞二肽基肽酶4,所述人类细胞二肽基肽酶4的核心结构域位于gly260和asp330之间。
13.进一步地,该工程菌还包括转录信号放大器,所述转录信号放大器为hrp放大器。
14.进一步地,所述待测病毒为mres-cov,所述工程菌为大肠杆菌工程菌。
15.本发明还提供一种上述的用于病毒检测的工程菌的用途,用于mers-cov检测或用于环境中mers-cov的实时监测。
16.本发明还提供一种非诊断目的的mers-cov检测方法,包括:在上述的工程菌菌液中加入iptg诱导,加入待测样品,培养,检测荧光强度即可。
17.本发明公开了以下技术效果:
18.本发明发明可用于mers-cov的检测以及环境中该病毒的实时监测。
19.与传统的qpcr等检测方法相比,该技术不需要严格的实验条件和精准的实验仪器,大大降低了检测成本并且提高了检测的简便性。该技术还可实现其他的多类病毒检测,本发明构建出一套完整的基础质粒,仅需将跨膜蛋白pmrb中胞外受体序列改为不同目标病毒受体,即可实现多病毒检测。
20.本发明的工程菌在一定安全处理条件下可较为长期的用于环境中的病毒监测,目前实验数据显示,该工程菌在实验条件中激活的状态下,可实现近10小时的监测功能,在2-8小时的监测效果最为显著。该技术应用于生物实验室可用于检测生物病毒污染,谨防实验室生物安全问题。应用于医院、机场等人流密集的公共场所,可实时检测环境中的不同种类的病毒,可预防大型公共卫生安全事件的爆发。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1为本发明病毒检测系统的设计示意图;
23.图2为egfp荧光强度;数值代表平均sem;**p《0.01与对照组比较,以及***p《0.001与对照组比较;ctrl:检测细菌;iptg:检测菌 iptg;iptg s pr:检测菌 iptg s蛋白;
24.图3为无群体感应和有群体感应工程菌的荧光强度;
25.图4为检测mers-cov的spike蛋白的质粒;
26.图5为以petduet-1和pacycduet-1为载体构建的两个质粒,共转化大肠杆菌bl21(de3),验证qs体系;
27.图6为以pacycduet-1为载体构建的质粒,探讨ahl的浓度阈值;
28.图7为不同ahl浓度下工程菌的荧光强度。
具体实施方式
29.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
30.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
31.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
32.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
33.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
34.本发明根据冠状病毒通过表面刺突蛋白与人体细胞表面受体结合介导进一步感染的感染机制,以大肠杆菌为底盘菌,选用沙门氏菌中的pmra/pmrb双组分系统和革兰氏阴性菌中的luxi/luxr群体感应系统(quorum sensing)构建工程大肠杆菌以检测冠状病毒(图1)。
35.pmra/pmrb是存在于沙门氏菌中的双组分调控系统,该系统最初是一个对fe(iii)敏感的调节系统。跨膜蛋白pmrb上包含一个组氨酸激酶(hk),在感应到胞外信号后发生自磷酸化,随后将磷酸基团转移至胞内调节因子pmra中保守的天冬氨酸残基,最终使得pmra激活pmrc启动子,表达下游的基因。天然的pmrb蛋白是一种fe
3
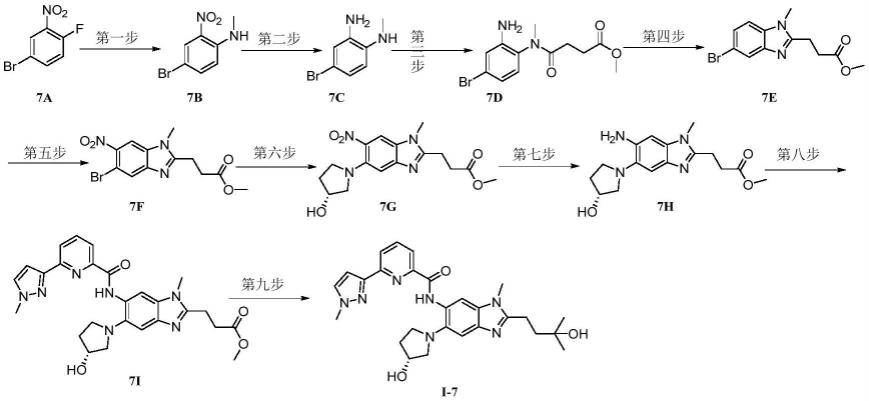
敏感型蛋白,其胞外部分具有fe
3
结合位点。将pmrb胞外部分换为冠状病毒spike蛋白的受体,即可实现对不同病毒的检测。
36.根据冠状病毒感染机制,设计用病毒受体的核心结构域替换pmrb原有的fe(iii)敏感域,以接受病毒刺突蛋白的刺激。
37.mers-cov包膜上的spike protein可与人类细胞二肽基肽酶4(hdpp4)结合。hdpp4的核心结合域位于gly260和asp330之间,s蛋白的rbd为gln471到asp580。
38.为解决环境中病毒浓度低,检测效果不明显的问题,加以群体感应系统提高检测的灵敏性。群体感应(quorum sensing,qs),用以描述细菌中以种群规模进行特定交流的方
式;通过这一机制,细菌以多细胞形式发挥不同生物学功能,产生信号分子并释放到环境中去;当环境中的信号分子达到一定的阈值浓度后,便诱导细菌中依赖细胞密度的特定基因表达,从而使细菌在群体规模上展现出新的行为特征,如生物发光、胞外多糖形成等。
39.在由luxi/luxr组成ahl介导的群体感应系统中,细菌中luxi同源基因负责合成qs信号分子ahl,而luxr同源物作为该信号分子受体被激活,从而调控下游基因的转录。在该设计中,当工程菌识别病毒s蛋白后,pmrc启动下游基因luxi等的表达。ahl开始持续合成,ahl浓度达到阈值后与luxr蛋白结合成luxr-ahl复合物,激活相应的启动子plux_hs,表达报告基因egfp。
40.通过加入群体感应系统,当少数工程菌检测到病毒时,可以通过信号分子ahl的介导将信息传递给其他工程菌,最终群体都表达报告基因egfp,使检测结果显著。
41.为进一步放大检测信号提高检测系统的灵敏度,还在该工程菌中添加了转录信号放大器,hrp放大器。天然的hrp调控网络包含转录因子hrpr和hrps,两者可形成灵敏的复合物hrprs,以激活启动子hrpl,该系统已被广泛证明具有较强的放大信号作用。
42.实施例1
43.1、工程菌的构建
44.以petduet-1和pacycduet-1为载体构建质粒形成以下基因回路(图5),并导入大肠杆菌bl21。pmrb跨膜蛋白胞外受体为mers-cov病毒受体hdpp4。
45.在该技术设计中,iptg诱导t7启动pmrb和pmra的表达。当工程菌通过pmra/pmrb系统识别病毒后,激活pmrc,启动下游luxi和luxr的表达。在luxi的催化下,ahl开始持续合成,其中一部分会穿透细胞膜到细胞外。当细胞外ahl的浓度达到阈值时,它重新进入细胞,并与luxr结合形成luxr-ahl共复合体,共复合体可以激活相应的启动子plux_hs并表达绿色荧光蛋白基因egfp。当少数工程菌检测出病毒时,信息可以通过信号分子ahl传递给其他工程菌,最后菌群均表达绿色荧光蛋白egfp,使得检测效果显著。
46.具体实验操作如下:
47.(1)基因片段扩增
48.按下表将试剂加至pcr管底部并混匀(模板和引物均由生物公司合成)。
49.模板1(pmrb(dpp4),片段1):
50.atgcgttttcggcaaagagcgatgacccttcgccagcgtttaatgctgacaattgggctcattctgctgatattccagttaatcagcaccttctggctaggagctgtgaatccaactgtaaagttctttgttgtaaatacagactctctcagctcagtcaccaatgcaacttccatacaaatcactgctcctgcttctatgttgataggggatcactacttgtgtgatgtgacatgggcaacacaagaaagaatttctttgcagtggctcaggaggattcagaactattcggtcatggatatttgtgactatgatgcggtcgccagtctgatcgtccctggcgtatttatggttagcctgacgctgctgatttgctaccaggcggtacggcgtattacccgcccgctggccgatctgcaaaaagagctggaagcacgaacggcagacaatctggcgccaatcgctattcacagctccacacttgagattgagtccgtcgtctccgcgctcaatcaactggtgacgcgcttgaccaccacgctcgacaatgaacgcctttttaccgccgatgtagcccatgagctacgtaccccactggcgggggtgcgtttgcatctggagttattgtcaaaatcccacaatattgatgtcgcgccgcttatcgcccgtcttgaccagatgatggatagtgtctcccaacttctgcaactggcgcgcgtgggccagtcattctcttccggtaattatcaggaagtaaaactgctggaagatgtgattctcccctcctacgatgagctgaacaccatgctggaaacgcgccagcaaacgctattgctgccggaaagcgcggcggatgtggtggtacgcggcgacgcgacgttactgcgtatgctgctgcgaaacc
tggtagaaaatgcgcaccgctacagtccggaaggaacccatatcaccctccatattagcgccgatcccgacgctatcatggcggtcgaagacgaggggccaggtattgatgaaagcaaatgcgggaagttaagcgaggcgtttgtacgaatggacagccgttatggcggtattgggctgggactaagcatcgttagccgcatcactcaactgcatcagggacagtttttcctgcaaaaccgtaccggtacaacaggcacccgcgcctgggtgctgttgaaaaaagcataa
51.引物1:agctgaattcatgcgttttcggcaaag
52.引物2:gggcgagctcgcttaatttctcctctttaattat
53.模板2(egfp,片段2):
54.atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggacggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctacggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccaccctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaagcagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttcttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctggtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcacaagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaacggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgccgaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccactacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtcctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaag
55.引物3:atatggtaccatggtgagcaagggc
56.引物4:catctcgagttacttgtacagctcgtcc
57.模板3(luxi,片段3):
58.atgactataatgataaaaaaatcggattttttggcaattccatcggaggagtataaaggtattctaagtcttcgttatcaagtgtttaagcaaagacttgagtgggacttagttgtagaaaataaccttgaatcagatgagtatgataactcaaatgcagaatatatttatgcttgtgatgatactgaaaatgtaagtggatgctggcgtttattacctacaacaggtgattatatgctgaaaagtgtttttcctgaattgcttggtcaacagagtgctcccaaagatcctaatatagtcgaattaagtcgttttgctgtaggtaaaaatagctcaaagataaataactctgctagtgaaattacaatgaaactatttgaagctatatataaacacgctgttagtcaaggtattacagaatatgtaacagtaacatcaacagcaatagagcgatttttaaagcgtattaaagttccttgtcatcgtattggagacaaagaaattcatgtattaggtgatactaaatcggttgtattgtctatgcctattaatgaacagtttaaaaaagcagtcttaaatgctgcaaacgacgaaaactacgctttagtagcttaataactctgatagtgctagtgtagatctc引物5:agctgagctcagatctatgacga
59.引物6:atcaagcttggtaccctcctt
60.模板4(luxr,片段4):
61.atgaaaaacataaatgccgacgacacatacagaataattaataaaattaaagcttgtagaagcaataatgatattaatcaatgcttatctgatatgactaaaatggtacattgtgaatattatttactcgcgatcatttatcctcattctatggttaaatctgatatttcaatcctagataattaccctaaaaaatggaggcaatattatgatgacgctaatttaataaaatatgatcctatagtagattattctaactccaatcattcaccaattaattggaatatatttgaaaacaatgctgtaaataaaaaatctccaaatgtaattaaagaagcgaaaacatcaggtcttatcactgggtttagtttccctattcatacggctaacaatggcttcggaatgcttagttttgcacattcagaaaaagacaactatatagatagtttatttttacatgcgtgtatgaacataccattaattgttccttctctagttgataattatcgaaaaataaatatagcaaataataaatcaaacaacgatttaaccaaaagagaaaaagaatgtttagcgtgggcatgcgaaggaaaaagctct
tgggatatttcaaaaatattaggttgcagtgagcgtactgtcactttccatttaaccaatgcgcaaatgaaactcaatacaacaaaccgctgccaaagtatttctaaagcaattttaacaggagcaattgattgcccatactttaaaaattaataacactgatagtgctagtgtagatcac
62.引物7:gcgcaagcttatgaaaaacataaatgccgacga
63.引物8:atatgcggccgcgtgatcta
64.模板《1μl上游引物2μl下游引物2μl2x mastermix25μlddh2o加至50μl总体积50μl
65.pcr程序设置如下:
[0066][0067]
(2)基因片段&载体酶切
[0068]
酶切反应体系如下:
[0069]
限制酶(两种)各1μl片段或载体1μl10x neb buffer5μl(1x)总体积50μl反应温度37℃反应时间5-15分钟
[0070]
以下为连接相应的片段所使用的限制酶:
[0071]
片段片段名称限制酶1限制酶2片段1pmrb(dpp4)ecorisacii片段2egfpsacihindiii片段3luxisacihindiii片段4luxrhindiiinoti
[0072]
以下为片段及载体:
[0073]
片段1:pmrb(dpp4),详细序列如上模板1;
[0074]
片段2:egfp,详细序列如上模板2;
[0075]
片段3:luxi,详细序列如上模板3;
[0076]
片段4:luxr,详细序列如上模板4;
[0077]
载体1:petduet-1;
[0078]
载体2:pacycduet-1。
[0079]
(3)载体与片段连接
[0080]
连接反应体系如下:
[0081]
t4 dna连接酶1μl片段37.5ng载体50ng10x neb buffer2μl(1x)总体积20μl反应温度37℃反应时间5-15分钟
[0082]
连接反应终止条件:65℃20分钟。
[0083]
(4)连接体系转化至大肠杆菌dh5α
[0084]
1)拿取感受态细胞置于冰上。
[0085]
2)将40μl感受态细胞与连接体系混合。
[0086]
3)将混合物放在冰上10分钟以上。
[0087]
4)将混合物在42℃下加热90秒。
[0088]
5)取混合物放在冰上2分钟。
[0089]
6)用移液枪将混合物移入1ml lb培养基中,在37℃下以200~220rpm的转速培养15-60分钟。
[0090]
7)以3000rpm的转速离心5分钟。
[0091]
8)用相应的耐药平板筛选转化菌。
[0092]
9)加热三角板涂抹棒,冷却4分钟以上。
[0093]
10)将150μl的菌液均匀涂抹在平板上,并在37℃培养箱中倒置培养。
[0094]
(5)质粒扩增及提取
[0095]
1)从lba(k)培养基中选择单个菌落。在37℃下放置于摇瓶中过夜。
[0096]
2)在3000r下离心,5分钟,丢弃上清液,吸出多余的液体。
[0097]
3)添加250μl溶液i(组分浓度25mm tris-hcl(ph8.0),10mm edta,50mm葡糖糖(glucose)),将其转移至干净的1.5ml微量离心管中。
[0098]
4)添加250μl溶液ii(组分浓度250mm naoh,1%(w/v)sds(十二烷基硫酸钠)),轻轻旋转试管数次,以获得清晰的裂解液。
[0099]
5)添加350μl溶液iii(组分浓度3m醋酸钾(potassium acetate),5m醋酸),并倒置数次,直到形成沉淀。
[0100]
6)13000rpm离心15分钟,取750μl上清液于2ml ep管中。
[0101]
7)13000rpm离心1分钟,并丢弃下面的液体。
[0102]
8)添加700μl洗涤缓冲液,并在13000rpm下离心1分钟,两次。
[0103]
9)丢弃下面的液体,并在13000rpm下离心空管,静置2分钟,弃下管。
[0104]
10)加入50μl洗脱缓冲液,在3000rpm下离心1分钟。
[0105]
11)将其转移至干净的1.5ml微量离心管中,室温下静置1分钟,测浓度,-20℃保存。
[0106]
(6)质粒转化至大肠杆菌bl21(de3)
[0107]
1)拿取感受态细胞置于冰上。
[0108]
2)将40μl感受态细胞与15μl质粒(约10ng/μl)混合。
[0109]
3)将混合物放在冰上10分钟以上。
[0110]
4)将混合物在42℃下加热90秒。
[0111]
5)取混合物放在冰上2分钟。
[0112]
6)用移液枪将混合物移入1ml lb培养基中,在37℃下以200~220rpm的转速培养15-60分钟。
[0113]
7)以3000rpm的转速离心5分钟。
[0114]
8)用相应的耐药平板筛选转化菌。
[0115]
9)加热三角板涂抹棒,冷却4分钟以上。
[0116]
10)将150μl的菌液均匀涂抹在平板上,并在37℃培养箱中倒置培养。
[0117]
2、病毒蛋白的获取
[0118]
通过大肠杆菌bl21表达并提取不同病毒刺突蛋白的受体结合域来模拟不同冠状病毒。mers-cov刺突蛋白的受体结合域为gln471到asp580。
[0119]
具体实验操作如下:
[0120]
(1)蛋白诱导表达
[0121]
1)挑取表达his标签重组蛋白的单克隆,接种到3ml或10-20ml含适当抗生素的lb培养液中,培养过夜。
[0122]
2)按照1:20的比例取培养过夜的菌液,接种到预热至37℃并含适当抗生素的lb培养液中。例如取5ml培养过夜的菌液接种到100ml预热至37℃并含适当抗生素的lb培养液中。具体的培养体积视需要纯化的蛋白量而定,初步的鉴定培养3-10ml即可;常规的表达纯化,通常可考虑培养100-200ml;制备型的纯化,培养体积可以达到1l或更大。如果希望取得更好的表达效果,建议按照1:100的比例接种过夜培养的菌液,但后续培养至相应的od值需要更长的时间。
[0123]
3)37℃常规培养约30-60分钟或更长时间,至菌液的od600达到0.5-0.7,并且od600最好接近0.6。
[0124]
4)加入iptg至终浓度为1mm,继续培养4-5小时。
[0125]
注:可以在加入iptg前取出少量菌液同样培养4-5小时后作为未诱导的对照,也可以在加入iptg前直接取出少量菌液作为未诱导的对照。对于特定蛋白的诱导表达,最佳的iptg浓度、诱导温度、和诱导时间需要通过实验确定。
[0126]
5)收集菌液至离心管中,4℃4000g离心20分钟或4℃15000g离心1分钟,弃上清,收集沉淀。随后即可进入细菌裂解步骤,也可以在-20℃或-80℃冻存备用。冷冻保存的菌体使用前需置于冰上解冻15分钟。
[0127]
(2)蛋白(his-tag)提取及纯化
iptg诱导,第三组菌液中加入1mm iptg和提取的病毒刺突蛋白受体结合域。分别诱导表达0.5小时,1小时,2小时,4小时,6小时,8小时,10小时,12小时,通过酶标仪测得菌液荧光强度和吸光度。如图2为诱导4小时的实验结果,实验结果显示,与对照组相比,接受iptg诱导和相应病毒蛋白刺激的工程菌可成功表达报告基因绿色荧光蛋白(egfp),第三组的荧光强度显著高于前者。证明重组pmrcab系统可以实现不同种病毒的检测功能。
[0146]
具体实验操作:
[0147]
1)从添加有相应抗生素的lb培养基中挑取单菌落至新的液体lb培养基中(添加相应的抗生素,比例为1000:1),置于200rpm,37℃摇床过夜。
[0148]
2)转大摇,将细菌溶液稀释至od=0.2,并添加相应抗生素。
[0149]
3)摇床培养约4小时,直到od在0.4至0.6之间。
[0150]
4)加入iptg和spike蛋白并继续培养。
[0151]
5)0.5小时,1小时,2小时,4小时,6小时,8小时,10小时,12小时测量荧光强度和od(该步骤在96孔板上完成,以便于测量)。
[0152]
6)制涂片并在荧光显微镜下观察。
[0153]
实施例3验证群体感应系统
[0154]
以仅具有pmrcab系统和具有pmrcab和群体感应系统的两组工程菌为实验组,含空载质粒的工程菌为对照。加入等量的iptg和等量提取的病毒刺突蛋白受体结合域,分别诱导表达0.5小时,1小时,2小时,4小时,6小时,8小时,10小时,12小时,通过酶标仪测得菌液荧光强度和吸光度。如图3为诱导4小时的实验结果,结果显示添加了群体感应系统的实验组在不同iptg浓度条件下荧光强度均高于未添加该系统的。可证明群体系统具有增强检测信号提高检测灵敏度的效果。
[0155]
具体实验操作:
[0156]
1)从添加有相应抗生素的lb培养基中挑取相应单菌落至新的液体lb培养基中(添加相应的抗生素,比例为1000:1),置于200rpm,37℃摇床过夜。
[0157]
2)转大摇,将细菌溶液稀释至od=0.2,并添加相应抗生素。
[0158]
3)摇床培养约4小时,直到od在0.4至0.6之间。
[0159]
4)加入不同浓度的iptg诱导表达,浓度梯度如下:0mmol/l、10-5
mmol/l、10-4
mmol/l、10-3
mmol/l、10-2
mmol/l、10-1
mmol/l、1mmol/l,加入定量spike蛋白刺激工程菌。
[0160]
5)0.5小时,1小时,2小时,4小时,6小时,8小时,10小时,12小时测量荧光强度和od(该步骤在96孔板上完成,以便于测量)。
[0161]
6)制涂片并在荧光显微镜下观察。
[0162]
实施例4验证群体感应奏效的最低阈值及范围
[0163]
将如图6的质粒转化入工程菌,设置不同浓度梯度ahl测试最低阈值,结果如图7所示,结果显示ahl浓度从2μmol/l开始随着浓度的增加,荧光强度稳定增加,群体感应效应不断增强,当浓度达到9μmol/l,荧光强度出现不稳定变化。
[0164]
具体实验操作:
[0165]
1)从添加有相应抗生素的lb培养基中挑取相应单菌落至新的液体lb培养基中(添加相应的抗生素,比例为1000:1),置于200rpm,37℃摇床过夜。
[0166]
2)转大摇,将细菌溶液稀释至od=0.2,并添加相应抗生素。
[0167]
3)摇床培养约4小时,直到od在0.4至0.6之间。
[0168]
4)加入不同浓度的ahl诱导表达,浓度设置如下:0μmol/l、1μmol/l、2μmol/l、3μmol/l、4μmol/l、5μmol/l、6μmol/l、7μmol/l、8μmol/l、9μmol/l、10μmol/l、11μmol/l、12μmol/l、13μmol/l诱导工程菌。
[0169]
5)0.5小时,1小时,2小时,4小时,6小时,8小时,10小时,12小时测量荧光强度和od(该步骤在96孔板上完成,以便于测量)。
[0170]
6)制涂片并在荧光显微镜下观察。
[0171]
综上所述,本发明通过各种实验验证了该技术的设计多个实验验证了各个部件的有效性以及整个系统的可行性。
[0172]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。