1.本发明属于生物标记技术领域,具体涉及一种多重荧光标记活细胞样品的制备方法。
背景技术:
2.随着荧光探针以及生物标记技术的发展,研究人员可利用荧光显微成像技术实时地监测到活细胞中分子的相关信息。将多重荧光标记结合荧光多色显微成像应用于细胞学,可揭示细胞器之间的相互作用,实时监测活细胞中特定细胞器的数量、体积、空间分布以及定性或定量监测参与生化反应的分子浓度变化等。
3.目前应用于活细胞与活体检测的荧光分子探针主要包括:基因编码的探针(如荧光蛋白与荧光素酶)、有机小分子荧光染料系列以及荧光纳米颗粒。常见的荧光标记技术包括直接荧光标记、免疫荧光标记以及荧光蛋白共定位技术。直接荧光标记是指将荧光染料分子直接与被标记物进行共价结合,这种方法实验操作简便,但较难实现特异性标记;免疫荧光标记则是将偶联了荧光染料的特异性抗体在组织细胞原位通过抗原抗体反应实现特异性标记,这种方式实验操作较为复杂,且实验成本较高;荧光蛋白共定位技术则指通过设计合适的质粒实现荧光蛋白与待标记靶标的蛋白融合,再借助转染技术将dna导入细胞中实现荧光表达,从而实现特异性标记。为了在细胞水平探索生命过程,探究胞内不同物质以及细胞器间的相互作用,需要在活细胞状态下实现多重特异性荧光标记,现国内外报道的活细胞样品中能同时实现特异性标记的荧光团种类尚未超过6种,同时观测荧光标记物质以及细胞器的数量受到限制。
技术实现要素:
4.本发明解决的技术问题为:提供一种多重荧光标记活细胞样品的制备方法,使得活细胞样品内可同时观测的目标种类增加至九种,实现活细胞九色荧光显微成像。
5.本发明提供的具体解决方案如下:
6.本发明提供了一种多重荧光标记活细胞样品的制备方法,包括如下步骤:
7.s1、基因融合:分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与丙酮酸脱氢酶(pyruvate dehydrogenase基因)相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与唾液酸转移酶(sit-15)基因相连形成重组mclover3基因;
8.s2、构建质粒:将所述重组mcerulean基因和重组mkate基因插入真核表达载体,构建用于共表达青色荧光蛋白mcerulean和红色荧光蛋白mkate的第一质粒;将所述重组tagbfp基因和重组mametrine基因插入真核表达载体,构建用于共表达蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine第二质粒;将所述lssmcherry基因和重组mclover3基因
插入真核表达载体,构建用于共表达红色荧光蛋白lssmcherry和绿色荧光蛋白mclover3的第三质粒;将ebfp2.0基因插入真核表达载体,构建用于表达深蓝色荧光蛋白ebfp2.0的第四质粒。
9.s3、细胞转染:采用脂质体转染试剂,将所述第一质粒和第二质粒共转染第一靶细胞获得能够表达荧光蛋白mcerulean、mkate、tagbfp和mametrine的第一细胞株,将第三质粒和第四质粒共转染第二靶细胞获得能够表达荧光蛋白lssmcherry、mclover3和ebfp2.0的第二细胞株;
10.s4、细胞cfse染色:使用第一荧光染料cfse对第三靶细胞进行直接荧光标记得到第三细胞株;
11.s5、混合接种:将第一细胞株、第二细胞株和第三细胞株分别经胰蛋白酶消化,消化后混合,然后培养5~12h,得到第四细胞株;
12.s6、细胞cy3染色:使用第二荧光染料cy3对所述第四细胞株进行直接荧光标记得到多重荧光标记的活细胞。
13.在上述方案的基础上,本发明还可以进行如下改进:
14.进一步,s1中通过基因编辑技术制备各重组基因。
15.进一步,所述真核表达载体选自pcag系列中的一种,所述脂质体转染试剂采用lipofectamine
tm
3000。
16.进一步,s3中具体步骤如下:充分混合脂质体转染试剂、第一质粒、第二质粒,室温下孵育5~30min,然后加入第一细胞株中,在35~38℃的二氧化碳培养箱中孵育5~10h,得到表达荧光蛋白mcerulean、mkate、tagbfp和mametrine的第一细胞株;充分混合脂质体转染试剂、第三质粒和第四质粒,室温下5~30min,然后加入第二细胞株中,在35~38℃的二氧化碳培养箱中孵育5~10h,得到表达lssmcherry、mclover3和ebfp2.0的所述第二细胞株。
17.进一步,s4中将所述第三靶细胞置于含cfse的pbs缓冲液中,在35~38℃的二氧化碳培养箱中孵育10~30min,得到所述第四细胞株,所述pbs缓冲液中cfse的浓度为2~10μmol/l。
18.进一步,s5中第一细胞株、第二细胞株以及第三细胞株的胰蛋白酶消化过程分别包括:在细胞株中加入胰酶进行消化,然后在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后加入完全培养基,使细胞株悬起。
19.进一步,s6中将所述第三靶细胞置于含cy3的pbs缓冲液中,在35~38℃的二氧化碳培养箱中孵育5~15min,得到多重荧光标记的活细胞,所述pbs缓冲液中cy3的浓度为2~10μmol/l。
20.进一步,所述第二荧光染料cy3偶连有亲脂性基团,便于cy3与细胞膜结合。
21.基于本发明的技术方案,具有如下有益效果:
22.(1)本发明筛选出九种可同时使用并能实现分辨的荧光团,设计并优化了亚细胞结构标记策略,结合特定的双光子选择激发荧光显微成像系统,结合直接荧光标记以及荧光蛋白原位标记技术,可同时在活细胞样品中实现九重荧光标记,从而可在一次成像中同时观察最多九种目标结构,实现活细胞九色荧光显微成像。
23.本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变
得明显,或通过本发明的实践了解到。
附图说明
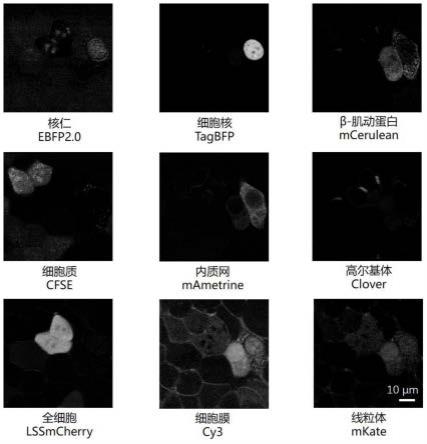
24.图1为实施例1中得到的活细胞样品的荧光显微成像结果。
具体实施方式
25.下面详细描述本发明的实施例,下面描述的实施例旨在用于解释本发明,而不能理解为对本发明的限制。
26.实验材料:若无特别说明,本发明实施例和对比例所用的试剂和材料均市购得到。其中,脂质体转染试剂采用lipofectamine
tm
3000(thermofisher),脂质体转染试剂的具体配置方法参照lipo3000的使用手册;减血培养基型号为opti-mem
tm
(thermofisher公司);所用真核真核表达载体为pcag-flep。荧光染色试剂cfse(sigma公司,5(6)-羧基二乙酸荧光素琥珀酰亚胺酯),使用dmso溶解,制成浓度为5mmol的cfse贮藏液;荧光染色试剂cy3染料为cy3-nhs-ester染料(absin公司),使用dmso溶解,制成浓度为5mmol的cy3贮藏液。
27.基于本发明的多重荧光标记活细胞样品的制备方法,包括如下步骤:
28.s1、基因融合:分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与唾液酸转移酶(sit-15)基因相连形成重组mclover3基因;
29.s2、构建质粒:将所述重组mcerulean基因和重组mkate基因插入真核表达载体,构建用于共表达青色荧光蛋白mcerulean和红色荧光蛋白mkate的第一质粒;将所述重组tagbfp基因和重组mametrine基因插入真核表达载体,构建用于共表达蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine第二质粒(记为tag-ma);将所述lssmcherry基因和重组mclover3基因插入真核表达载体,构建用于共表达红色荧光蛋白lssmcherry和绿色荧光蛋白mclover3的第三质粒(记为lss-clo);将ebfp2.0基因插入真核表达载体,构建用于表达深蓝色荧光蛋白ebfp2.0的第四质粒。
30.s3、细胞转染:采用脂质体转染试剂,将所述第一质粒和第二质粒共转染第一靶细胞获得能够表达荧光蛋白mcerulean、mkate、tagbfp和mametrine的第一细胞株,将第三质粒和第四质粒共转染第二靶细胞获得能够表达荧光蛋白lssmcherry、mclover3和ebfp2.0的第二细胞株;
31.s4、细胞cfse染色:使用第一荧光染料cfse对第三靶细胞进行直接荧光标记得到第三细胞株;
32.s5、混合接种:将第一细胞株、第二细胞株和第三细胞株分别经胰蛋白酶消化,消化后混合,然后培养5~12h,得到第四细胞株;
33.s6、细胞cy3染色:使用第二荧光染料cy3对所述第四细胞株进行直接荧光标记得到多重荧光标记的活细胞。
34.由于现有的荧光团的发射光谱普遍较宽(光谱半高全宽在40~50nm),并且常规荧
光分子的斯托克斯位移差别不大(一般为10~20nm),实现多重荧光特异性标记的荧光团种类受到限制;同时,为了在同一个细胞中实现尽可能多的荧光标记,通常选择在一个质粒中尽可能多的融合多种荧光蛋白,但是质粒越大对细胞的毒性越强,导致细胞转染效率过低,从而容易导致凋亡,且为了使所有荧光蛋白都表达到细胞内,首先考虑共转染(即在同一个细胞中转染多种质粒)的方法,但由于细胞的负载能力有限,且质粒在细胞内表达时还会遇到某些质粒优先表达的问题,同一细胞无法同时表达过多从外部导入的质粒,因此,同一细胞内能够同时观测到的荧光标记物质以及细胞器的数量受到限制。本发明通过一系列实验条件筛选以及实验设计,将活细胞样品内可同时观测目标的种类增加至九种,具体包括:
35.荧光团的选择:首先先筛选出了能够同时成像并且能分辨的九种荧光团,在发射波长为450nm附近、550nm附近、650nm附近三个波段的荧光团中分别选取3种双光子激发峰相距较远的荧光团(ebfp2.0、tagbfp、mcerulean;mametrine、mclover3、mkate;lssmcherry、cfse和cy3),上述九种可通过多通道荧光信号探测以及双光子激发波长调谐实现所有标记靶标的荧光显微成像。如表1所示,所选荧光团包括荧光蛋白ebfp2.0、tagbfp、mcerulean、mametrine、mclover3、mkate和lssmcherry以及荧光染料:cfse和cy3。
36.标记靶标选择:对于荧光蛋白,可以使用蛋白融合的方式,构建相应质粒,借助脂质体转染的方法,使基因片段进入细胞,在细胞内特定蛋白上表达出荧光,从而实现亚细胞结构标记。通过将红色荧光蛋白ebfp2.0基因与纤维蛋白基因相连,可使ebfp2.0在细胞核仁处表达;将蓝色荧光蛋白tagbfp基因与组蛋白基因相连,可使其在细胞核处表达;将青色荧光蛋白mcerulean与β-肌动蛋白基因相连,使其表达于细胞骨架上;通过将绿色荧光蛋白mametrine与网状蛋白基因相连,可使其表达于内质网;通过将绿色荧光蛋白基因mclover3与唾液酸转移酶(sit-15)基因相连,可使其表达于高尔基体;通过将红色荧光蛋白mkate与丙酮酸脱氢酶(pyruvate dehydrogenase)基因相连,可使其表达于线粒体;将红色荧光蛋白lssmcherry表达于整个细胞;另外选择荧光染料cfse与cy3进行荧光标记,cfse可用于细胞质标记,cfse能够轻易穿透细胞膜,在活细胞内与胞内蛋白共价结合,水解后释放出绿色荧光,在细胞分裂增殖过程中,其荧光强度会随着细胞的分裂而逐级递减,标记荧光可平均分配至两个子代细胞中,因此荧光强度是亲代细胞的一半,根据这一特性,可用于检测细胞增殖,细胞周期的估算方面,cy3-nhs-ester可直接与细胞膜结合,用于展示细胞膜状态。
37.表1、各荧光团及其单光子激发波长、双光子激发波长、荧光发射波长及其细胞定位。
[0038][0039]
*下划线表示为荧光染料名称,其他均为荧光蛋白名称
[0040]
本发明筛选出九种可同时使用并能实现分辨的荧光团,设计并优化了亚细胞结构标记策略,结合特定的双光子选择激发荧光显微成像系统,结合了直接荧光标记以及荧光蛋白原位标记技术,可同时在活细胞样品中实现九重荧光标记,从而可在一次成像中同时观察最多九种目标结构,实现活细胞九色荧光显微成像。
[0041]
基于本发明实施例的多重荧光标记活细胞样品的制备方法,s1中通过基因编辑技术制备各重组基因。
[0042]
基于本发明实施例的多重荧光标记活细胞样品的制备方法,所述真核表达载体选pcag系列中的一种,如pcag-flep,所述脂质体转染试剂采用lipofectamine
tm
3000(thermofisher)。
[0043]
基于本发明实施例的多重荧光标记活细胞样品的制备方法,s3中具体步骤如下:充分混合脂质体转染试剂、第一质粒、第二质粒,室温下孵育5~30min,然后加入第一细胞株中,在35~38℃的二氧化碳培养箱中孵育5~10h,得到表达荧光蛋白mcerulean、mkate、tagbfp和mametrine的第一细胞株;充分混合脂质体转染试剂、第三质粒和第四质粒,室温下5~30min,然后加入第二细胞株中,在35~38℃的二氧化碳培养箱中孵育5~10h,得到表达lssmcherry、mclover3和ebfp2.0的所述第二细胞株。
[0044]
基于本发明实施例的多重荧光标记活细胞样品的制备方法,s4中将所述第三靶细胞置于含cfse的pbs缓冲液中,在35~38℃的二氧化碳培养箱中孵育10~30min,得到所述第四细胞株,所述pbs缓冲液中cfse的浓度为2~10μmol/l。
[0045]
基于本发明实施例的多重荧光标记活细胞样品的制备方法,s5中第一细胞株、第二细胞株以及第三细胞株的胰蛋白酶消化过程分别包括:在细胞株中加入胰酶进行消化,然后在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后加入完全培养基,使细胞株悬起。
[0046]
基于本发明实施例的多重荧光标记活细胞样品的制备方法,s6中将所述第三靶细胞置于含cy3的pbs缓冲液中,在35~38℃的二氧化碳培养箱中孵育5~15min,得到多重荧光标记的活细胞,所述pbs缓冲液中cy3的浓度为2~10μmol/l。
[0047]
基于本发明实施例的多重荧光标记活细胞样品的制备方法,所述第二荧光染料cy3偶连有亲脂性基团,例如cy3-nhs-ester,便于cy3与细胞膜结合。
[0048]
实施例1
[0049]
多重荧光标记活细胞样品的制备方法包括如下步骤:
[0050]
1、细胞接种:将细胞瓶中培养的hela细胞消化、收集、离心,去除上清后,使用完全培养基dmem将细胞重悬制成单细胞悬液,在96孔板中每孔接种2~4
×
104个细胞,接种3个孔备用,分别编号为a、b、c,培养过夜。
[0051]
2、基因融合:采用基因编辑技术,分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase基因相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与sit-15基因相连形成重组mclover3基因。
[0052]
3、构建质粒:将所述重组mcerulean基因和重组mkate基因插入真核表达载体pcag-flep,构建用于共表达青色荧光蛋白mcerulean和红色荧光蛋白mkate的第一质粒(记为mc-mk),将所述重组tagbfp基因和重组mametrine基因插入真核表达载体,构建用于共表达蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine第二质粒(记为tag-ma),将所述lssmcherry基因和重组mclover3基因插入真核表达载体,构建用于共表达红色荧光蛋白lssmcherry和绿色荧光蛋白mclover3的第三质粒(记为lss-clo),将ebfp2.0基因插入真核表达载体,构建用于表达深蓝色荧光蛋白ebfp2.0的第四质粒。
[0053]
4、细胞转染:将96孔板从培养箱中取出,使用微量移液枪吸出a/b两孔中培养基,并使用pbs清洗一次后加入减血清培养基opti-mem,然后参照脂质体转染试剂lipo3000(lipofectamine
tm
3000)的使用手册使用减血清培养基配置2管脂质体稀释液,编号a、b,之后a管中加入等量mk-mc与tag-ma质粒,b管中加入lss-clo质粒与ebfp2.0质粒,使用微量移液枪在每支离心管中淬打30下,充分混合脂质体与dna,室温下孵育15分钟后,将a、b两管中的dna-脂质体复合物分别加入a、b两孔细胞中,37℃二氧化碳培养箱中孵育6小时后,将a、b孔内培养基吸出,并使用完全培养基替换减血清培养基。
[0054]
5、细胞cfse染色:将96孔板c孔内完全培养基吸出,使用pbs清洗残留血清,取1ml pbs于离心管中,加入1μl cfse贮藏液,混合均匀制成5μmol的cfse稀释液,然后取100μl cfse稀释液加入c孔,将孔板放入培养箱孵育30min后将cfse稀释液完全吸出,使用pbs冲洗2次,替换完全培养基,此时可以在汞灯下可观察到细胞质已经被标记上cfse荧光。
[0055]
6、细胞混合接种:向15mm共聚焦成像小皿中间的孔中加入200ul完全培养基后,放入培养箱进行平衡,将a、b、c孔细胞中原有培养基取出,并用适量pbs冲洗,每孔中加入适量胰酶进行消化,在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后向每孔中加入100ul完全培养基,并将孔中细胞悬起,再将3种细胞全部加入一只1ml离心管中,充分吹打混合,将完全混合的单细胞悬液加入平衡好的共聚焦成像小皿中,放入培养箱,培养箱中过夜培养。
[0056]
7、细胞cy3染色:将前一天接种的共聚焦成像小皿内完全培养基吸出,使用pbs清洗一次,然后取1ml pbs于离心管中,并加入1μl cy3-nhs-ester贮藏液,混合均匀制成5μ
mol的cy3稀释液,取200μl cy3稀释液加入成像小皿中,室温下孵育10min,孵育完成后将cy3稀释液完全吸出,然后使用pbs冲洗3次,此时可以在汞灯下可观察到所有细胞的细胞膜已经被标记上cy3荧光,得到九色荧光标记的活细胞样品。
[0057]
实施例2
[0058]
多重荧光标记活细胞样品的制备方法包括如下步骤:
[0059]
步骤一、细胞接种:将细胞瓶中培养的b16细胞消化、收集、离心,去除上清后,使用完全培养基1640将细胞重悬制成单细胞悬液,在96孔板中每孔接种2~4
×
104个细胞,接种3个孔备用,分别编号为a、b、c,培养过夜。
[0060]
步骤二、基因融合:采用基因编辑技术,分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase基因相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与sit-15基因相连形成重组mclover3基因。
[0061]
步骤三、构建质粒:将所述重组mcerulean基因和重组mkate基因插入真核表达载体pcag-flep,构建用于共表达青色荧光蛋白mcerulean和红色荧光蛋白mkate的第一质粒(记为mc-mk),将所述重组tagbfp基因和重组mametrine基因插入真核表达载体,构建用于共表达蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine第二质粒(记为tag-ma),将所述lssmcherry基因和重组mclover3基因插入真核表达载体,构建用于共表达红色荧光蛋白lssmcherry和绿色荧光蛋白mclover3的第三质粒(记为lss-clo),将ebfp2.0基因插入真核表达载体,构建用于表达深蓝色荧光蛋白ebfp2.0的第四质粒。
[0062]
步骤四、细胞转染:将96孔板从培养箱中取出,使用微量移液枪吸出a/b两孔中培养基,并使用pbs清洗一次后加入减血清培养基opti-mem,然后参照脂质体转染试剂lipo3000的使用手册使用减血清培养基配置2管脂质体稀释液,编号a、b,之后a管中加入等量mk-mc与tag-ma质粒,b管中加入lss-clo质粒与ebfp2.0质粒,使用微量移液枪在每支离心管中淬打30下,充分混合脂质体与dna,室温下孵育15分钟后,将a、b两管中的dna-脂质体复合物分别加入a、b两孔细胞中,37℃二氧化碳培养箱中孵育6小时后,将a、b孔内培养基吸出,并使用完全培养基替换减血清培养基。
[0063]
步骤五、细胞cfse染色:将96孔板c孔内完全培养基吸出,使用pbs清洗残留血清,取1ml pbs于离心管中,加入cfse贮藏液,混合均匀制成2μmol的cfse稀释液,然后取100μl cfse稀释液加入c孔,将孔板放入培养箱孵育20min后将cfse稀释液完全吸出,使用pbs冲洗2次,替换完全培养基,此时可以在汞灯下可观察到细胞质已经被标记上cfse荧光。
[0064]
步骤六、细胞混合接种:向15mm共聚焦成像小皿中间的孔中加入200ul完全培养基后,放入培养箱进行平衡,将a、b、c孔细胞中原有培养基取出,并用适量pbs冲洗,每孔中加入适量胰酶进行消化,在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后向每孔中加入100ul完全培养基,并将孔中细胞悬起,再将3种细胞全部加入一只1ml离心管中,充分吹打混合,将完全混合的单细胞悬液加入平衡好的共聚焦成像小皿中,放入培养箱,培养箱中过夜培养。
[0065]
步骤七、细胞cy3染色:将前一天接种的共聚焦成像小皿内完全培养基吸出,使用
pbs清洗一次,然后取1ml pbs于离心管中,并加入cy3-nhs-ester贮藏液,混合均匀制成2μmol的cy3稀释液,取200μl cy3稀释液加入成像小皿中,室温下孵育15min,孵育完成后将cy3稀释液完全吸出,然后使用pbs冲洗3次,此时可以在汞灯下可观察到所有细胞的细胞膜已经被标记上cy3荧光,得到九色荧光标记的活细胞样品。
[0066]
实施例3
[0067]
多重荧光标记活细胞样品的制备方法包括如下步骤:
[0068]
步骤一、细胞接种:将细胞瓶中培养的hela细胞消化、收集、离心,去除上清后,使用完全培养基dmem将细胞重悬制成单细胞悬液,在96孔板中每孔接种2~4
×
104个细胞,接种3个孔备用,分别编号为a、b、c,培养过夜。
[0069]
步骤二、基因融合:采用基因编辑技术,分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase基因相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与sit-15基因相连形成重组mclover3基因。
[0070]
步骤三、构建质粒:将所述重组mcerulean基因和重组mkate基因插入真核表达载体pcag-flep,构建用于共表达青色荧光蛋白mcerulean和红色荧光蛋白mkate的第一质粒(记为mc-mk),将所述重组tagbfp基因和重组mametrine基因插入真核表达载体,构建用于共表达蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine第二质粒(记为tag-ma),将所述lssmcherry基因和重组mclover3基因插入真核表达载体,构建用于共表达红色荧光蛋白lssmcherry和绿色荧光蛋白mclover3的第三质粒(记为lss-clo),将ebfp2.0基因插入真核表达载体,构建用于表达深蓝色荧光蛋白ebfp2.0的第四质粒。
[0071]
步骤四、细胞转染:将96孔板从培养箱中取出,使用微量移液枪吸出a/b两孔中培养基,并使用pbs清洗一次后加入减血清培养基opti-mem,然后参照脂质体转染试剂lipo3000的使用手册使用减血清培养基配置2管脂质体稀释液,编号a、b,之后a管中加入等量mk-mc与tag-ma质粒,b管中加入lss-clo质粒与ebfp2.0质粒,使用微量移液枪在每支离心管中淬打30下,充分混合脂质体与dna,室温下孵育15分钟后,将a、b两管中的dna-脂质体复合物分别加入a、b两孔细胞中,37℃二氧化碳培养箱中孵育10小时后,将a、b孔内培养基吸出,并使用完全培养基替换减血清培养基。
[0072]
步骤五、细胞cfse染色:将96孔板c孔内完全培养基吸出,使用pbs清洗残留血清,取1ml pbs于离心管中,加入cfse贮藏液,混合均匀制成10μmol的cfse稀释液,然后取100μl cfse稀释液加入c孔,将孔板放入培养箱孵育10min后将cfse稀释液完全吸出,使用pbs冲洗2次,替换完全培养基,此时可以在汞灯下可观察到细胞质已经被标记上cfse荧光。
[0073]
步骤六、细胞混合接种:向15mm共聚焦成像小皿中间的孔中加入200ul完全培养基后,放入培养箱进行平衡,将a、b、c孔细胞中原有培养基取出,并用适量pbs冲洗,每孔中加入适量胰酶进行消化,在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后向每孔中加入100ul完全培养基,并将孔中细胞悬起,再将3种细胞全部加入一只1ml离心管中,充分吹打混合,将完全混合的单细胞悬液加入平衡好的共聚焦成像小皿中,放入培养箱,培养箱中过夜培养。
[0074]
步骤七、细胞cy3染色:将前一天接种的共聚焦成像小皿内完全培养基吸出,使用pbs清洗一次,然后取1ml pbs于离心管中,并加入cy3-nhs-ester贮藏液,混合均匀制成10μmol的cy3稀释液,取200μl cy3稀释液加入成像小皿中,室温下孵育5min,孵育完成后将cy3稀释液完全吸出,然后使用pbs冲洗3次,此时可以在汞灯下可观察到所有细胞的细胞膜已经被标记上cy3荧光,得到九色荧光标记的活细胞样品。
[0075]
对比例1
[0076]
一种荧光标记活细胞样品的制备方法,包括如下步骤:
[0077]
步骤一、细胞接种:将细胞瓶中培养的hela细胞消化、收集、离心,去除上清后,使用完全培养基dmem将细胞重悬制成单细胞悬液,在96孔板中每孔接种2~4
×
104个细胞,接种3个孔备用,编号为a、b、c,培养过夜。
[0078]
步骤二、基因融合:采用基因编辑技术,分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase基因相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与sit-15基因相连形成重组mclover3基因。
[0079]
步骤三、将重组mcerulean基因、重组mkate基因、重组tagbfp基因和重组mametrine基因插入同一真核表达载体(pcag-flep),构建用于共表达青色荧光蛋白mcerulean、红色荧光蛋白mkate、蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine的第一质粒(记为mc-mk-tag-ma),将lssmcherry基因与重组mclover3插入真核表达载体,构建用于共表达荧光蛋白lssmcherry和荧光蛋白mclover3的第二质粒(记为lss-clo),将ebfp2.0基因单独构建质粒(记为ebfp2.0)。
[0080]
步骤四、细胞转染:将96孔板从培养箱中取出,使用微量移液枪分别吸出a、b两孔中培养基,并使用pbs清洗一次后加入减血清培养基,然后参照lipo3000的使用手册使用减血清培养基配置2管脂质体稀释液,编号a、b,之后a管中加入mc-mk-tag-ma质粒,b管中加入lss-clo质粒与ebfp2.0质粒,使用微量移液枪在每支离心管中淬打30下,充分混合脂质体与dna,室温下孵育15分钟后,将a、b两管dna-脂质体复合物分别加入a、b两孔细胞中,37℃二氧化碳培养箱中孵育6小时后,将a、b孔内培养基吸出,并使用完全培养基替换减血清培养基。
[0081]
步骤五、细胞cfse染色:将96孔板c孔内完全培养基吸出,使用pbs清洗残留血清;取1ml pbs于离心管中,加入1μl cfse贮藏液,混合均匀制成5μmol的cfse稀释液,然后取100μl cfse稀释液加入c孔,将孔板放入培养箱孵育30min后将cfse稀释液完全吸出,使用pbs冲洗2次,替换完全培养基,此时可以在汞灯下可观察到细胞质已经被标记上cfse荧光。
[0082]
步骤六、细胞混合接种:向15mm共聚焦成像小皿中间的孔中加入200ul完全培养基后,放入培养箱进行平衡,将a、b、c孔细胞中原有培养基取出,并用适量pbs冲洗,每孔中加入适量胰酶进行消化,在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后向每孔中加入100ul完全培养基,并将孔中细胞悬起,再将3种细胞细胞全部加入一只1ml离心管中,充分吹打混合,将完全混合的单细胞悬液加入平衡好的共聚焦成像小皿中,放入培养箱,培养箱种过夜培养。
[0083]
步骤七、细胞cy3染色:将前一天接种的共聚焦成像小皿内完全培养基吸出,使用pbs清洗一次,然后取1ml pbs于离心管中,并加入1μl cy3-nhs-ester贮藏液,混合均匀制成5μmol的cy3稀释液,取200μl cy3稀释液加入成像小皿中,室温下孵育10min,孵育完成后将cy3稀释液完全吸出,然后使用pbs冲洗3次,此时可以在汞灯下可观察到所有细胞的细胞膜已经被标记上cy3荧光,得到荧光标记的活细胞样品。
[0084]
对比例2
[0085]
一种荧光标记活细胞样品的制备方法,包括如下步骤:
[0086]
步骤一、细胞接种:将细胞瓶中培养的hela细胞消化、收集、离心,去除上清后,使用完全培养基dmem将细胞重悬制成单细胞悬液,在96孔板中每孔接种2~4
×
104个细胞,接种3个孔备用,编号为a、b、c,培养过夜。
[0087]
步骤二、基因融合:采用基因编辑技术,分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase基因相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与sit-15基因相连形成重组mclover3基因。
[0088]
步骤三、构建质粒:将所述重组mcerulean基因和重组mkate基因插入真核表达载体(pcag-flep),构建用于共表达青色荧光蛋白mcerulean和红色荧光蛋白mkate的第一质粒(记为mc-mk),将所述重组tagbfp基因和重组mametrine基因插入真核表达载体,构建用于共表达蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine第二质粒(记为tag-ma),将所述lssmcherry基因、重组mclover3基因、ebfp2.0基因插入真核表达载体,构建用于共表达红色荧光蛋白lssmcherry、绿色荧光蛋白mclover3和深蓝色荧光蛋白ebfp2.0的第三质粒(记为lss-clo-ebfp2.0)。
[0089]
步骤四、细胞转染:将96孔板从培养箱中取出,使用微量移液枪分别吸出a、b两孔中培养基,并使用pbs清洗一次后加入减血清培养基,参照lipo3000的使用手册使用减血清培养基配置2管脂质体稀释液,编号a、b,之后a管中加入等量mk-mc质粒与tag-ma质粒,b管中加入lss-clo-ebfp2.0质粒,使用微量移液枪在每支离心管中淬打30下,充分混合脂质体与dna,室温下孵育15分钟后,将a、b两管dna-脂质体复合物分别加入a、b两孔细胞中,37℃二氧化碳培养箱中孵育6小时后,将a、b孔内培养基吸出,并使用完全培养基替换减血清培养基。
[0090]
步骤五、细胞cfse染色:将96孔板c孔内完全培养基吸出,使用pbs清洗残留血清;取1ml pbs于离心管中,加入1μl cfse贮藏液,混合均匀制成5μmol的cfse稀释液,然后取100μl cfse稀释液加入c孔,将孔板放入培养箱孵育30min后将cfse稀释液完全吸出,使用pbs冲洗2次,替换完全培养基,此时可以在汞灯下可观察到细胞质已经被标记上cfse荧光。
[0091]
步骤六、细胞混合接种:向15mm共聚焦成像小皿中间的孔中加入200ul完全培养基后,放入培养箱进行平衡,将a、b、c孔细胞中原有培养基取出,并用适量pbs冲洗,每孔中加入适量胰酶进行消化,在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后向每孔中加入100ul完全培养基,并将孔中细胞悬起,再将3种细胞细胞全部加入一只1ml离心管中,充分吹打混合,将完全混合的单细胞悬液加入平衡好的共聚焦成像小皿中,
放入培养箱,培养箱中过夜培养。
[0092]
步骤七、细胞cy3染色:将前一天接种的共聚焦成像小皿内完全培养基吸出,使用pbs清洗一次,然后取1ml pbs于离心管中,并加入1μl cy3-nhs-ester贮藏液,混合均匀制成5μmol的cy3稀释液,取200μl cy3稀释液加入成像小皿中,室温下孵育10min,孵育完成后将cy3稀释液完全吸出,然后使用pbs冲洗3次,此时可以在汞灯下可观察到所有细胞的细胞膜已经被标记上cy3荧光,得到荧光标记的活细胞样品。
[0093]
对比例3
[0094]
一种荧光标记活细胞样品的制备方法,包括如下步骤:
[0095]
步骤一、细胞接种:将细胞瓶中培养的hela细胞消化、收集、离心,去除上清后,使用完全培养基dmem将细胞重悬制成单细胞悬液。在96孔板中每孔接种2~4
×
104个细胞,接种3个孔备用,编号为a、c,培养过夜。
[0096]
步骤二、基因融合:分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase基因相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与sit-15基因相连形成重组mclover3基因;
[0097]
步骤三、构建质粒:将所述重组mcerulean基因和重组mkate基因插入真核表达载体pcag-flep,构建用于共表达青色荧光蛋白mcerulean和红色荧光蛋白mkate的第一质粒(记为mc-mk);将所述重组tagbfp基因和重组mametrine基因插入真核表达载体pcag-flep,构建用于共表达蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine第二质粒(记为tag-ma);将所述lssmcherry基因和重组mclover3基因插入真核表达载体,构建用于共表达红色荧光蛋白lssmcherry和绿色荧光蛋白mclover3的第三质粒(记为lss-clo);将ebfp2.0基因插入真核表达载体,构建用于表达深蓝色荧光蛋白ebfp2.0的第四质粒(记为ebfp2.0)。
[0098]
步骤四、细胞转染:将96孔板从培养箱中取出,使用微量移液枪吸出a/b两孔中培养基,并使用pbs清洗一次后加入减血清培养基,参照lipo3000的使用手册使用减血清培养基配置2管脂质体稀释液,编号a,之后a管中加入等量mk-mc质粒、tag-ma质粒、lss-clo质粒和ebfp2.0质粒,使用微量移液枪在每支离心管中淬打30下,充分混合脂质体与dna,室温下孵育15分钟后,将a管中dna-脂质体复合物加入a孔细胞中,37℃二氧化碳培养箱中孵育6小时后,将a孔内培养基吸出,并使用完全培养基替换减血清培养基,。
[0099]
步骤五、细胞cfse染色:将96孔板c孔内完全培养基吸出,使用pbs清洗残留血清,取1ml pbs于离心管中,加入1μl cfse贮藏液,混合均匀制成5μmol的cfse稀释液,然后取100μl cfse稀释液加入c孔,将孔板放入培养箱孵育30min后将cfse稀释液完全吸出,使用pbs冲洗2次,替换完全培养基,此时可以在汞灯下可观察到细胞质已经被标记上cfse荧光。
[0100]
步骤六、细胞混合接种:向15mm共聚焦成像小皿中间的孔中加入200ul完全培养基后,放入培养箱进行平衡,将a、c孔细胞中原有培养基取出,并用适量pbs冲洗,每孔中加入适量胰酶进行消化,在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后向每孔中加入100ul完全培养基,并将孔中细胞悬起;将2种细胞细胞全部加入一只1ml离心管中,充分吹打混合,将完全混合的单细胞悬液加入平衡好的共聚焦成像小皿中,放入培
养箱,培养箱中过夜培养。
[0101]
步骤七、细胞cy3染色:将前一天接种的共聚焦成像小皿内完全培养基吸出,使用pbs清洗一次,然后取1ml pbs于离心管中,并加入1μl cy3-nhs-ester贮藏液,混合均匀制成5μmol的cy3稀释液,取200μl cy3稀释液加入成像小皿中,室温下孵育10min,孵育完成后将cy3稀释液完全吸出,然后使用pbs冲洗3次,此时可以在汞灯下可观察到所有细胞的细胞膜已经被标记上cy3荧光,至此,完成活细胞标记,得到荧光标记的活细胞样品。
[0102]
对比例4
[0103]
一种荧光标记活细胞样品的制备方法,包括如下步骤:
[0104]
步骤一、细胞接种:将细胞瓶中培养的hela细胞消化、收集、离心,去除上清后,使用完全培养基dmem将细胞重悬制成单细胞悬液。在96孔板中每孔接种2~4
×
104个细胞,接种3个孔备用,编号为a、b、c,培养过夜。
[0105]
步骤二、基因融合:分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase基因相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与sit-15基因相连形成重组mclover3基因;
[0106]
步骤三、构建质粒:将所述重组mcerulean基因、重组mkate基因、lssmcherry基因插入真核表达载体pcag-flep,构建用于共表达青色荧光蛋白mcerulean、红色荧光蛋白mkate和红色荧光蛋白lssmcherry的质粒(记为mc-mk-lss);将所述重组tagbfp基因、重组mametrine基因、重组mclover3基因和ebfp2.0基因插入真核表达载体,构建用于共表达蓝色荧光蛋白tagbfp、绿色荧光蛋白mametrine、绿色荧光蛋白mclover3和深蓝色荧光蛋白ebfp2.0的第二质粒(记为tag-ma-clo-ebfp2.0)。
[0107]
步骤四、细胞转染:将96孔板从培养箱中取出,使用微量移液枪吸出a/b两孔中培养基,并使用pbs清洗一次后加入减血清培养基opti-mem,然后参照lipo3000的使用手册使用减血清培养基配置2管脂质体稀释液,编号a、b,之后a管中加入mc-mk-lss质粒,b管中加入tag-ma-clo-ebfp2.0质粒,使用微量移液枪在每支离心管中淬打30下,充分混合脂质体与dna,室温下孵育15分钟后,将a、b两管中的dna-脂质体复合物分别加入a、b两孔细胞中,37℃二氧化碳培养箱中孵育6小时后,将a、b孔内培养基吸出,并使用完全培养基替换减血清培养基。
[0108]
步骤五、细胞cfse染色:将96孔板c孔内完全培养基吸出,使用pbs清洗残留血清,取1ml pbs于离心管中,加入1μl cfse贮藏液,混合均匀制成5μmol的cfse稀释液,然后取100μl cfse稀释液加入c孔,将孔板放入培养箱孵育30min后将cfse稀释液完全吸出,使用pbs冲洗2次,替换完全培养基,此时可以在汞灯下可观察到细胞质已经被标记上cfse荧光。
[0109]
步骤六、细胞混合接种:向15mm共聚焦成像小皿中间的孔中加入200ul完全培养基后,放入培养箱进行平衡,将a、b孔细胞中原有培养基取出,并用适量pbs冲洗,每孔中加入适量胰酶进行消化,在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后向每孔中加入100ul完全培养基,并将孔中细胞悬起,再将2种细胞细胞全部加入一只1ml离心管中,充分吹打混合,将完全混合的单细胞悬液加入平衡好的共聚焦成像小皿中,放入
培养箱,培养箱中过夜培养。
[0110]
步骤七、细胞cy3染色:将前一天接种的共聚焦成像小皿内完全培养基吸出,使用pbs清洗一次,然后取1ml pbs于离心管中,并加入1μl cy3-nhs-ester贮藏液,混合均匀制成5μmol的cy3稀释液,取200μl cy3稀释液加入成像小皿中,室温下孵育10min,孵育完成后将cy3稀释液完全吸出,然后使用pbs冲洗3次,此时可以在汞灯下可观察到所有细胞的细胞膜已经被标记上cy3荧光,至此,完成活细胞标记,得到荧光标记的活细胞样品。
[0111]
对比例5
[0112]
一种荧光标记活细胞样品的制备方法,包括如下步骤:
[0113]
步骤一、细胞接种:将细胞瓶中培养的hela细胞消化、收集、离心,去除上清后,使用完全培养基dmem将细胞重悬制成单细胞悬液,在96孔板中每孔接种2~4
×
104个细胞,接种3个孔备用,编号为a、b、c,培养过夜。
[0114]
步骤二、基因融合:分别将深蓝色荧光蛋白ebfp2.0基因与纤维蛋白基因相连形成重组ebfp2.0基因,将红色荧光蛋白mkate基因与pyruvate dehydrogenase基因相连形成重组mkate基因,将蓝色荧光蛋白tagbfp基因与组蛋白基因相连形成重组tagbfp基因,将绿色荧光蛋白mametrine基因与网状蛋白基因相连形成重组mametrine基因,将青色荧光蛋白mcerulean基因与β-肌动蛋白基因相连形成重组mcerulean基因,将绿色荧光蛋白mclover3基因与sit-15基因相连形成重组mclover3基因。
[0115]
步骤三、构建质粒:将所述重组mcerulean基因和重组mkate基因插入真核表达载体pcag-flep,构建用于共表达青色荧光蛋白mcerulean和红色荧光蛋白mkate的第一质粒(记为mc-mk);将所述重组tagbfp基因和重组mametrine基因插入真核表达载体,构建用于共表达蓝色荧光蛋白tagbfp和绿色荧光蛋白mametrine第二质粒(记为tag-ma);将所述lssmcherry基因和重组mclover3基因插入真核表达载体,构建用于共表达红色荧光蛋白lssmcherry和绿色荧光蛋白mclover3的第三质粒(记为lss-clo);将ebfp2.0基因插入真核表达载体,构建用于表达深蓝色荧光蛋白ebfp2.0的第四质粒(记为ebfp2.0)。
[0116]
步骤四、细胞转染:将96孔板从培养箱中取出,使用微量移液枪吸出a、b两孔中培养基,并使用pbs清洗一次后加入opti-mem,参照lipo3000的使用手册使用减血清培养基配置2管脂质体稀释液,编号a、b,之后a管中加入等量mk-mc质粒与tag-ma质粒,b管中加入lss-clo质粒与ebfp2.0质粒,使用微量移液枪在每支离心管中淬打30下,充分混合脂质体与dna,室温下孵育5分钟后,将a、b两管dna-脂质体复合物分别加入a、b两孔细胞中,37℃二氧化碳培养箱中孵育6小时后,将a、b孔内培养基吸出,并使用完全培养基替换减血清培养基。
[0117]
步骤五、细胞cfse染色:将96孔板c孔内完全培养基吸出,使用pbs清洗残留血清,取1ml pbs于离心管中,加入1μl cfse贮藏液,混合均匀制成5μmol的cfse稀释液,然后取100μl cfse稀释液加入c孔;将孔板放入培养箱孵育30min后将cfse稀释液完全吸出;使用pbs冲洗2次,替换完全培养基,此时可以在汞灯下可观察到细胞质已经被标记上cfse荧光。
[0118]
步骤六、细胞cy3染色:将将96孔板c孔内完全培养基吸出,使用pbs清洗一次,然后取1ml pbs于离心管中,并加入1μl cy3-nhs-ester贮藏液,混合均匀制成5μmol的cy3稀释液,取200μl cy3稀释液加入成像小皿中,室温下孵育10min,孵育完成后将cy3稀释液完全吸出,然后使用pbs冲洗3次,此时可以在汞灯下可观察到所有细胞的细胞膜已经被标记上
cy3荧光。
[0119]
步骤七、细胞混合接种:将a、b、c孔细胞中原有培养基取出,并用适量pbs冲洗,每孔中加入适量胰酶进行消化,在显微镜下观察细胞状态,细胞逐渐皱缩变圆后,立即将胰酶吸出,然后向每孔中加入100ul完全培养基,并将孔中细胞悬起,再将3种细胞细胞全部加入一只1ml离心管中,充分吹打混合,将完全混合的单细胞悬液加入平衡好的共聚焦成像小皿中,放入培养箱,培养箱中过夜培养,至此,完成活细胞标记,得到荧光标记的活细胞样品。
[0120]
对实施例、对比例1、对比例2、对比例3、对比例4以及多比例5中得到的活细胞样品分别进行双光子激发荧光显微成像。实施例1中九色荧光标记的活细胞样品双光子激发荧光显微成像结果如图1所示,结合特定的双光子激发波长,可在细胞中分别观察到九种类型的目标结构(核仁、细胞核、β-肌动蛋白、细胞质、内质网、高尔基体、全细胞结构、细胞膜、线粒体),实现了活细胞九重荧光标记,可进行活细胞九色荧光显微成像。对对比例1中得到的荧光标记的活细胞样品进行双光子激发荧光显微成像,结果发现,将mcerulean、mkate、tagbfp和mametrine四种荧光蛋白基因直接构建于同一质粒中,转染后表达荧光的细胞较少,成像实验中可观察到mcerulean、mkate、lssmcherry、mclover、ebfp2.0、cfse和cy3的荧光,未能观察到来自tagbfp和mametrine的荧光。对对比例2中得到的荧光标记的活细胞样品进行双光子激发荧光显微成像,结果发现将lssmcherry、mclover3和ebfp2.0三种荧光蛋白基因构建于同一质粒中,转染后表达荧光的细胞较少,成像实验中可观察到mcerulean、mkate、tagbfp、mametrine、lssmcherry、mclover、cfse和cy3的荧光,未能观察到来自ebfp2.0的荧光。对对比例3中得到的荧光标记的活细胞样品进行双光子激发荧光显微成像,结果发现,将四种质粒(mc-mk,tag-ma,lss-clo,ebfp2.0)混合后同时转染到细胞中,转染后只能观察到mcerulean、mkate、tagbfp和mametrine四种荧光蛋白顺利定位于所设计的细胞结构中,另外三种荧光蛋白(lssmcherry、mclover3和ebfp2.0)均未观察到。对对比例4中得到的荧光标记的活细胞样品进行双光子激发荧光显微成像,结果发现,将mcerulean、mkate和lssmcherry三种荧光蛋白构建于同一质粒,将tagbfp、mametrine、mclover3和ebfp2.0四种荧光蛋白构建于同一质粒,转染后表达荧光的细胞很少,且lssmcherry、mclover3和ebfp2.0的荧光均未能观察到。对对比例5得到的荧光标记的活细胞样品进行双光子激发荧光显微成像,结果发现,cy3与细胞膜的结合很不稳定,cy3染色若干小时候就会被细胞代谢到培养基里,最终无法观察到明显的cy3荧光。
[0121]
本发明基于一系列实验发现,将mcerulean和mkate构建于同一质粒(记为mc-mk),将tagbfp和mametrine构建于同一质粒(记为tag-ma),lssmcherry与mclover3构建于同一质粒(记为lss-clo),ebfp2.0单独构建质粒,所构建的四个质粒均能在转染时在特定蛋白部位表达出荧光,且具有较高的转染效率,然后将mc-mk质粒与tag-ma质粒共转染,将lss-clo质粒与ebfp2.0质粒共转染时,七种荧光都能在细胞中观察到,且表达荧光蛋白的细胞较多;cy3与细胞膜的结合很不稳定,染色若干小时候就会被细胞代谢到培养基里,因此,cy3细胞膜标记在观测前进行,即先进行转染,后续再进行细胞质和细胞膜的染色,最后进行显微镜观测。基于本发明的多重荧光标记活细胞样品的制备方法,结合了直接荧光标记以及荧光蛋白原位标记技术,可同时在活细胞样品中实现九重荧光标记,可在一次成像中同时观察最多九种目标结构,实现至多九色活细胞荧光显微成像。
[0122]
尽管上面已经详细描述了本发明的实施例,本领域的普通技术人员可以理解:在
不脱离本发明的原理和宗旨的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。