1.本发明属于植株培育技术领域,尤其涉及一种栀子体细胞胚胎发生及植株再生方法。
背景技术:
2.栀子属于茜草科栀子属常绿灌木,是卫生部颁布的第一批药食同源植物资源。栀子叶、花、果均可观赏,花和果亦可食用,果实的活性成分具有药用价值,是集绿化、蜜源、食用、药用及生态修复为一体的多功能树种。目前多为野生资源,人为破坏非常严重,导致栀子优良种质资源严重流失,制约了栀子产业的健康发展,因此寻求一种高效优质的资源繁育与保育途径来保护栀子优良种质资源、提升栀子苗木数量与质量势在必行。
3.目前栀子快繁多采用扦插快繁以及“以芽繁芽”的组培快繁模式,但扦插繁殖系数小、周期长、易变异,“以芽繁芽”的组培模式操作繁琐、成本高。体细胞胚胎发生作为组培快繁技术的一种,不仅能够实现优良资源数十倍甚至上百倍的快速繁殖,而且能够保持植株的优良遗传性状,充分弥补了以上繁殖方式的不足,是一种比较理想的繁殖方式。
技术实现要素:
4.本发明实施例的目的在于提供一种栀子体细胞胚胎发生及植株再生方法,旨在解决上述背景技术中提出的问题。
5.为实现上述目的,本发明提供如下技术方案:
6.一种栀子体细胞胚胎发生及植株再生方法,包括以下步骤:
7.步骤s1:外植体选择与预处理:将未成熟的果实用温水加洗洁剂浸泡,然后刷洗干净,再放于流水下冲洗备用,将洗干净的果实放于超净工作台,用无菌水洗涤,之后浸泡于75%的酒精溶液中30s,用无菌水冲洗,然后用0.1%的升汞浸泡10min,用无菌水冲洗,最后用无菌滤纸吸干果实表面的水分,
8.为实现上述目的,本发明提供如下技术方案:
9.一种栀子体细胞胚胎发生及植株再生方法,包括以下步骤:
10.步骤s1:外植体选择与预处理:将未成熟的果实用温水加洗洁剂浸泡,然后刷洗干净,再放于流水下冲洗备用,将洗干净的果实放于超净工作台,用无菌水洗涤,之后浸泡于75%的酒精溶液中30s,用无菌水冲洗,然后用0.1%的升汞浸泡10min,用无菌水冲洗,最后用无菌滤纸吸干果实表面的水分,去除果皮备用;
11.步骤s2:胚性愈伤组织的诱导:在无菌条件下,将消毒处理过的未成熟果实切成薄片放入胚性愈伤组织诱导培养基中培养;所述胚性愈伤组织诱导培养基以改良ms为基本培养基,依次加入60g/l的香蕉泥、50~80g/l的椰乳、0.65%琼脂粉和3%的白砂糖,分别添加0.1~0.25mg/l的6-ba和0.05~0.15mg/l的2,4-d,培养基的ph值为5.8,置于灭菌锅中,取出后,在无菌条件下,利用过滤灭菌的方法加入1ml浓度为20mg/ml的茶皂素溶液,混合均匀后,分装到接种瓶中,接种处理好的栀子果实薄片;
12.步骤s3:体细胞胚胎分化及增殖培养:以改良ms为基本培养基,依次加入60g/l的香蕉泥、50~80g/l的椰乳、0.65%琼脂粉和3%的白砂糖,分别添加0.25~0.5mg/l的6-ba、0.1~0.25mg/l的2,4-d和6mg/l的核黄素vb2,培养基的ph值为5.8,置于灭菌锅中,将诱导出的胚性愈伤组织在无菌条件下接种到体细胞胚胎分化和增殖培养基上;
13.步骤s4:体细胞胚胎萌发培养:以改良ms为基本培养基,依次加入60g/l的马铃薯汁、0.65%琼脂粉和1.5%的白砂糖,添加垂柳浸提液20ml/l和3mg/l的vb2,培养基的ph值为5.8,置于灭菌锅中,将诱导分化出的体细胞胚在无菌条件下转入此培养基中。
14.进一步的,所述改良ms培养基为:基础ms培养基 0.16~0.18g/l硝酸钙 0.01~0.03g/l硫酸钠。
15.进一步的,所述灭菌锅的灭菌温度为121℃,灭菌时间为15min。
16.进一步的,所述步骤s2中,将消毒处理过的未成熟果实切成薄片放入胚性愈伤组织诱导培养基中培养,培养条件为弱蓝光,光照强度为1500lx,培养温度为20~26℃。
17.进一步的,所述步骤s2中,茶皂素溶液的制备方法为:称取茶皂素5g,用乙醇溶解并用无菌水定容至250ml的容量瓶中待用。
18.进一步的,所述步骤s4中,将诱导分化出的体细胞胚在无菌条件下转入培养基中,暗培养15d,后转入led光照培养,培养温度为20~26℃,光照12h/d,光照强度为2000lx。
19.进一步的,所述步骤s4中,垂柳浸提液的制备方法为:取垂柳1年生新鲜枝条,用粉碎机粉碎,取500g垂柳枝粉浸泡于500ml蒸馏水中,浸泡1天,再利用功率为100w的超声波超声浸提2h,之后离心取上清液,备用。
20.与现有技术相比,本发明的有益效果是:
21.(1)使用植物材料少,不受季节限制,生产周期短,可以在较短时间内达到繁殖系数的最大化,不仅能够提高育苗效率,节约生产成本,而且操作简单易行,可重复性强,适宜于周年试验或生产;
22.(2)本发明提供的快繁体系是通过体细胞胚胎发生的途径构建的,无菌苗的生根都没有经过愈伤组织培养阶段,苗木根系粗壮、不会脱落且呈辐射状分布,确保了苗木的移栽成活率,保证了苗木质量;
23.(3)本发明所使用的植物外源激素及抑菌剂多采用植物提取液且所需植物资源分布广、易获取,不仅实现了绿色生产,同时也降低了生产成本,优化了栀子苗木生产流程,利于该技术的进一步推广应用。
附图说明
24.图1为本发明体细胞胚胎萌发成苗率的示意图。
具体实施方式
25.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
26.以下结合具体实施例对本发明的具体实现进行详细描述。
27.本发明一个实施例提供的一种栀子体细胞胚胎发生及植株再生方法,包括以下步
骤:
28.步骤s1:外植体选择与预处理:将未成熟的果实用温水加洗洁剂浸泡,然后刷洗干净,再放于流水下冲洗备用,将洗干净的果实放于超净工作台,用无菌水洗涤,之后浸泡于75%的酒精溶液中30s,用无菌水冲洗,然后用0.1%的升汞浸泡10min,用无菌水冲洗,最后用无菌滤纸吸干果实表面的水分,去除果皮备用;
29.步骤s2:胚性愈伤组织的诱导:在无菌条件下,将消毒处理过的未成熟果实切成薄片放入胚性愈伤组织诱导培养基中培养;所述胚性愈伤组织诱导培养基以改良ms为基本培养基,依次加入60g/l的香蕉泥、50~80g/l的椰乳、0.65%琼脂粉和3%的白砂糖,分别添加0.1~0.25mg/l的6-ba和0.05~0.15mg/l的2,4-d,培养基的ph值为5.8,置于灭菌锅中,取出后,在无菌条件下,利用过滤灭菌的方法加入1ml浓度为20mg/ml的茶皂素溶液,混合均匀后,分装到接种瓶中,接种处理好的栀子果实薄片;
30.步骤s3:体细胞胚胎分化及增殖培养:以改良ms为基本培养基,依次加入60g/l的香蕉泥、50~80g/l的椰乳、0.65%琼脂粉和3%的白砂糖,分别添加0.25~0.5mg/l的6-ba、0.1~0.25mg/l的2,4-d和6mg/l的核黄素vb2,培养基的ph值为5.8,置于灭菌锅中,将诱导出的胚性愈伤组织在无菌条件下接种到体细胞胚胎分化和增殖培养基上;
31.步骤s4:体细胞胚胎萌发培养:以改良ms为基本培养基,依次加入60g/l的马铃薯汁、0.65%琼脂粉和1.5%的白砂糖,添加垂柳浸提液20ml/l和3mg/l的vb2,培养基的ph值为5.8,置于灭菌锅中,将诱导分化出的体细胞胚在无菌条件下转入此培养基中。
32.在本发明实施例中,步骤s1中,选择生长健壮、无病虫害的栀子优良种质作为母株。于9月上旬,果实未成熟,采摘带回实验室。用25℃的温水加洗洁剂浸泡30min,然后用软毛刷刷洗干净,再放于流水下冲洗备用。将洗干净的果实放于超净工作台,用无菌水洗涤2~3次,之后浸泡于75%的酒精溶液中30s,用无菌水冲洗2~3次,最后用0.1%的升汞浸泡10min,用无菌水冲洗4~5次,用无菌滤纸吸干果实表面的水分,去除果皮,备用;步骤s2中,将消毒处理过的未成熟果实切成2~3mm厚的薄片放入胚性愈伤组织诱导培养基中培养;步骤s3中,将诱导出的胚性愈伤组织在无菌条件下接种到体细胞胚胎分化和增殖培养基上,培养条件与胚性愈伤组织诱导过程相同。
33.作为本发明的一种优选实施例,所述改良ms培养基为:基础ms培养基 0.16~0.18g/l硝酸钙 0.01~0.03g/l硫酸钠。
34.在本发明实施例中,改良ms培养基为:将ms基本培养基中的硫酸锌调整为8.75mg/l,同时添加0.16~0.18g/l硝酸钙和0.01~0.03g/l硫酸钠。
35.作为本发明的一种优选实施例,所述灭菌锅的灭菌温度为121℃,灭菌时间为15min。
36.作为本发明的一种优选实施例,所述步骤s2中,将消毒处理过的未成熟果实切成薄片放入胚性愈伤组织诱导培养基中培养,培养条件为弱蓝光,光照强度为1500lx,培养温度为20~26℃。
37.作为本发明的一种优选实施例,所述步骤s2中,茶皂素溶液的制备方法为:称取茶皂素5g,用乙醇溶解并用无菌水定容至250ml的容量瓶中待用。
38.在本发明实施例中,所述步骤s2中,香蕉泥的制备方法为:香蕉去皮,放入破壁机中制成香蕉泥;椰乳的制备方法为:将椰子果洗净,钻孔,将椰子汁先吸出置于容器中,再用
工具打开椰子果壳,取出果肉,将椰子汁和果肉一起放入破壁机中制成浓稠椰乳。
39.作为本发明的一种优选实施例,所述步骤s4中,将诱导分化出的体细胞胚在无菌条件下转入培养基中,暗培养15d,后转入led光照培养,培养温度为20~26℃,光照12h/d,光照强度为2000lx。
40.作为本发明的一种优选实施例,所述步骤s4中,垂柳浸提液的制备方法为:取垂柳1年生新鲜枝条,用粉碎机粉碎,取500g垂柳枝粉浸泡于500ml蒸馏水中,浸泡1天,再利用功率为100w的超声波超声浸提2h,之后离心取上清液,备用。
41.在本发明实施例中,步骤s4中,马铃薯汁的制备方法为:利用破壁机将削皮后的新鲜马铃薯制成浆后,再过滤得到汁液。
42.对比实验
43.1.1实验方法
44.1.1.1方法ⅰ:本发明的方法。
45.1.1.2方法ⅱ:
46.(1)外植体选择与预处理办法同本发明。
47.(2)胚性愈伤组织的诱导
48.在无菌条件下,将消毒处理过的未成熟果实切成2~3mm厚的薄片放入胚性愈伤组织诱导培养基中培养,培养条件为弱蓝光(1500lx),培养温度20~26℃。
49.胚性愈伤组织诱导培养基以改良ms为基本培养基,加入0.65%琼脂粉,3%的白砂糖,分别添加0.1~0.25mg/l的6-苄基氨基嘌呤(6-ba)和0.05~0.15mg/l的2,4-二氯苯氧乙酸(2,4-d),培养基ph值为5.8,置于灭菌锅中,在121℃的高温下灭菌15min。无菌条件下接种处理好的栀子果实薄片。
50.改良ms培养基同本发明。
51.(3)体细胞胚胎分化及增殖培养
52.以改良ms为基本培养基,加入0.65%琼脂粉,3%的白砂糖,分别添加0.25~0.5mg/l的6-ba、0.1~0.25mg/l的2,4-d,培养基ph值为5.8,121℃的高温下灭菌15min,将诱导出的胚性愈伤组织在无菌条件下接种到体细胞胚胎分化和增殖培养基上,培养条件与胚性愈伤组织诱导过程相同。
53.(4)体细胞胚胎萌发培养
54.以改良ms为基本培养基,加入0.65%琼脂粉,1.5%的白砂糖,添加0.5mg/l的aba和0.5mg/l的ga3,培养基ph值为5.8,121℃的高温下灭菌15min,将诱导分化出的体细胞胚在无菌条件下转入此培养基中,培养条件同本发明。
55.1.1.3方法ⅲ:
56.(1)外植体选择与预处理办法同本发明。
57.(2)胚性愈伤组织的诱导
58.在无菌条件下,将消毒处理过的未成熟果实切成2~3mm厚的薄片放入胚性愈伤组织诱导培养基中培养,培养条件为弱led光(1500lx),培养温度20~26℃。
59.胚性愈伤组织诱导培养基以ms为基本培养基,其他同方法ⅱ。
60.(3)体细胞胚胎分化及增殖培养
61.除光照条件为弱led光(1500lx)以及基本培养基为ms培养基外,其他条件同方法
ⅱ
。
62.(4)体细胞胚胎萌发培养
63.以ms为基本培养基,加入0.65%琼脂粉,1.5%的白砂糖,培养基ph值为5.8,121℃的高温下灭菌15min。将诱导分化出的体细胞胚在无菌条件下转入此培养基中,培养条件同本发明。
64.1.2统计方法
65.(1)胚性愈伤组织的诱导
66.方法ⅰ、方法ⅱ和方法ⅲ每种方法接种30瓶,重复3次,共270瓶,接种30天后,分别统计不同方法的感染率与诱导率,求平均值,具体见表1。
67.(2)体细胞胚胎分化及增殖培养
68.培养30天后,分别统计方法ⅰ、方法ⅱ和方法ⅲ的体细胞胚胎的分化情况及增殖倍数。每种方法随机统计30瓶,取分化率和增殖倍数的平均值,具体见表2。
69.(3)体细胞胚胎萌发培养
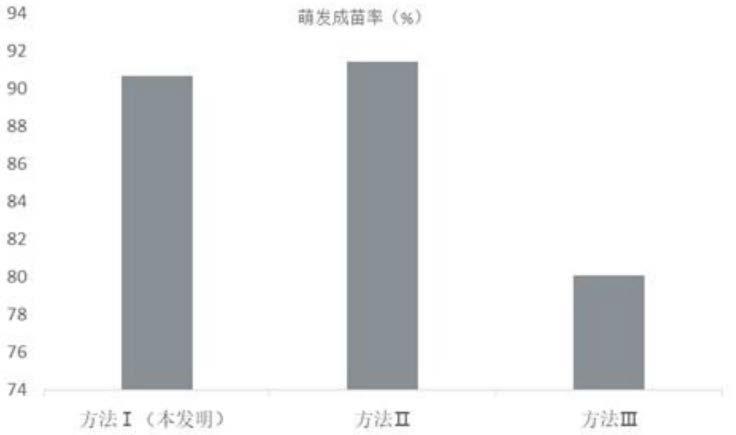
70.培养30天后,分别统计方法ⅰ、方法ⅱ和方法ⅲ的体细胞胚胎萌发成苗率。每种方法随机统计30瓶,取萌发成苗率的平均值,具体见图1。
71.1.3分析与结果
72.(1)胚性愈伤组织的诱导
73.表1胚性愈伤组织诱导率及感染率
74.实验方法感染率(%)诱导率(%)方法ⅰ(本发明)9.12
±
1.2491.68
±
3.14方法ⅱ31.66
±
0.3767.39
±
2.55方法ⅲ33.99
±
0.8458.26
±
2.95
75.根据表1可以看出,3种方法胚性愈伤组织培养中,均有感染,感染率最低的处理为本发明,仅为9.12%,与方法ⅱ和方法ⅲ相比,分别降低了22.54和24.87个百分点;3种方法的胚性愈伤组织诱导率存在较大差异,其中诱导率最高的依然为本发明,可达91.68%,其次是方法ⅱ(诱导率67.39%),方法ⅲ的胚性愈伤组织诱导率最小,仅为58.26%。
76.(2)体细胞胚胎分化及增殖培养
77.表2体细胞胚胎分化及增殖比较
78.实验方法分化率(%)增殖倍数方法ⅰ(本发明)81.02
±
2.375.7
±
0.5方法ⅱ75.45
±
1.264.93
±
1.05方法ⅲ50.16
±
0.952.96
±
0.89
79.根据表2可以看出,3种方法对体细胞胚胎分化和增殖的效果存在较大差异,分化率由大到小依次为方法ⅰ(本发明)>方法ⅱ>方法ⅲ,增殖倍数也存在同样的变化趋势。方法ⅰ分化率和增殖倍数分别为81.02%和5.7倍,稍微优于方法ⅱ,但与方法ⅲ相比,分化率高出近20个百分点,增殖倍数也增加2.74倍。可见,方法ⅰ(本发明)无论是对体细胞胚胎分化还是增殖均具有较好的效果。
80.(3)体细胞胚胎萌发培养
81.根据图1可以看出,3种体细胞胚胎萌发培养方法中方法ⅰ和方法ⅱ的体细胞胚胎
萌发成苗率均达到了90%以上,比方法ⅲ的体细胞胚胎萌发成苗率高出10%左右。方法ⅰ(本发明)和方法ⅱ体细胞胚胎萌发成苗率虽然差异不显著,但本发明所用萌发激素为植物提取液,绿色环保,获取简单,成本低,所以本发明在推广应用中更具有竞争力。
82.综合以上可以看出,本发明在栀子体细胞胚胎发生及植株再生的各培养阶段均表现出其优越性,是栀子体细胞胚胎发生及植株再生的理想方法。
83.以上仅是本发明的优选实施方式,应当指出,对于本领域的技术人员来说,在不脱离本发明构思的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些均不会影响本发明实施的效果和专利的实用性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。