枯草芽孢杆菌zf-1及其在抑制非洲猪瘟病毒中的应用
技术领域
1.本发明属于畜禽抗病毒微生态制剂技术领域,具体涉及枯草芽孢杆菌zf-1及其在抑制非洲猪瘟病毒中的应用。
背景技术:
2.非洲猪瘟(african swine fever,asf)是由非洲猪瘟病毒(african swine fever virus,asfv)感染引起的猪的一种急性、热性、高度接触性传染病。主要症状表现为高热、皮肤发绀、淋巴结和内脏器官严重出血,病死率高达100%,对养猪业危害巨大。1921年在肯尼亚首次发现,所有品种和年龄的猪均可被感染,是全球养猪业的头号威胁。猪群一旦感染,只能通过快速扑杀进行防控。经济安全有效的抗病毒药物可提供有效保护作用,有利于提高疫情的防控效果、减少经济损失。因此,在非洲猪瘟疫苗尚未攻克的前提下,抗asfv药物制剂的开发也是应对非洲猪瘟疫情的重要措施。来自人类药物研发的成功案例表明,一些化合物制剂具有良好的抗病毒作用乃至完全能够清除患者体内感染的病原。而这些药物往往需要花费高昂的研发成本和生产成本,益生菌或微生物种类繁多,来源广泛,是开发具有抗asfv药物的良好途径。此外益生菌具有无毒、无抗药性、无残留、促生长、绿色安全等众多优点。
3.非洲猪瘟的防控是世界养猪业急需要解决的重要难题,目前主要以生物安全防控为主。尽管国内外开展了大量针对asfv疫苗的研发,也取得了一定的成果,但目前为止仍未研制出安全高效的商业化疫苗。故急需研发有效保护猪群免于非洲猪瘟病毒感染的生物药物制剂。
4.尽管有一些研究报道了芽孢杆菌具有抗轮状病毒、pedv等的作用,但针对抗asfv的研究还未见报道,由于asfv的特殊性,其疫苗研发和药物研发都存在较大的困难,益生菌能否抵抗asfv的感染,尚未见报道。本技术通过大量筛选,首次发现具有抗非洲猪瘟病毒感染的芽孢杆菌菌株,并且体内、体外研究结果均表明其能够拮抗非洲猪瘟病毒,降低afsv在细胞中的增殖,服用功能性芽孢杆菌培养物后,能抵抗非洲猪瘟强毒的感染。将枯草芽孢杆菌制备成生物制剂,具有成本低、抗逆性强,储存、运输、使用方便,经济有效,为非洲猪瘟的防控提供了新的手段和工具。
技术实现要素:
5.本发明的目的是针对非洲猪瘟病毒(asfv)感染难以预防和治疗的问题,提供了一株可抑制非洲猪瘟病毒的枯草芽孢杆菌(bacillus subtilis)zf-1,所述的枯草芽孢杆菌的保藏编号为:cctcc no:m2022185。
6.本发明的另一个目的在于提供了枯草芽孢杆菌zf-1在制备预防或治疗非洲猪瘟病毒感染的药物中的应用。
7.为了达到上述目的,本发明采用以下技术措施:
8.申请人自95株自保留的菌株中,筛选到一株对非洲猪瘟病毒有抑制作用的枯草芽
孢杆菌,该菌株已于2022年3月3日送至中国典型培养物保藏中心(cctcc),分类命名:bacillus subtilis zf-1,保藏编号为cctcc no:m2022185,地址:中国武汉武汉大学。
9.枯草芽孢杆菌(bacillus subtilis)zf-1在制备防控非洲猪瘟病毒感染的药物中的应用,包括利用枯草芽孢杆菌(bacillus subtilis)zf-1制备成非洲猪瘟病毒(asfv)的抑制剂,或是制备成抗非洲猪瘟病毒感染的预防药物或是治疗药物。
10.以上所述的应用中,所述的枯草芽孢杆菌(bacillus subtilis)zf-1包括枯草芽孢杆菌(bacillus subtilis)zf-1菌体或发酵上清液。
11.与现有技术相比,本发明优点如下:
12.本发明中用益生菌枯草芽孢杆菌(bacillus subtilis)zf-1进行asfv在细胞水平和动物机体水平的抗感染研究,发现其在体内和体外均具有显著抗asfv的作用,枯草芽孢杆菌作为潜在的抗病毒微生态制剂与疫苗和传统的抗病毒化学药物相比较具有如下优点:
13.1、枯草芽孢杆菌生产成本低、抗逆性强,储存、运输、使用方便。
14.2、无毒副作用、无残留、抗病毒、促生长、绿色安全。
15.3、具有使用方便、安全、无免疫应激、经济效益高等优点。
16.4、本发明中的枯草芽孢杆菌(bacillus subtilis)zf-1发酵液,在细胞水平,能够降低asfv对细胞的感染活性,抑制asfv对细胞的入侵和感染,降低病毒在细胞上的增殖,可用于预防和控制非洲猪瘟病毒感染。
17.5、本发明中的枯草芽孢杆菌(bacillus subtilis)zf-1制剂,灌服试验猪,能有效保护asfv感染导致的发病和死亡,对照组的猪100%死亡,灌服枯草芽孢杆菌制剂组的猪存活率达到100%;显著抑制asfv排毒,减少对环境的污染,能够减轻asfv感染对组织器官的损伤,能够有效控制asfv感染对机体造成的不良影响,可用于非洲猪瘟的防控。
附图说明
18.图1为不同益生菌发酵液在细胞水平对非洲猪瘟病毒(asfv)增殖的影响。
19.图2位枯草芽孢杆菌制剂对asfv感染存活率的影响。
20.图3为枯草芽孢杆菌制剂对asfv感染猪体温的影响;
21.其中a为感染asfv阳性对照组,b为灌服枯草芽孢杆菌制剂试验组。
22.图4为枯草芽孢杆菌制剂对asfv感染猪肛拭子病毒含量的影响;
23.其中a为感染asfv阳性对照组,b为灌服枯草芽孢杆菌制剂试验组。
24.图5为枯草芽孢杆菌制剂对asfv感染猪咽拭子病毒含量的影响;
25.其中a为感染asfv阳性对照组,b为灌服枯草芽孢杆菌制剂试验组。
26.图6为枯草芽孢杆菌制剂对asfv感染猪鼻拭子病毒含量的影响;
27.其中a为感染asfv阳性对照组,b为灌服枯草芽孢杆菌制剂试验组。
28.图7为枯草芽孢杆菌制剂对asfv感染猪组织器官病变的影响;
29.其中a为心脏,b为肝脏,c为脾脏,d为肺脏、e为肾脏,f为下颌淋巴结和腹股沟淋巴结,g为肠系膜淋巴结。
具体实施方式
30.为了更好地理解本发明的内容,下面结合具体实施例对本发明内容作进一步说
明,但本发明的保护内容不局限于以下实施例。本发明实施例中的试验方法和条件如无特殊说明,均为常规方法。本发明所述的技术方案,如无特殊说明,均为领域的常规方案;所述试剂或材料如无特殊说明,均来源于商业渠道。
31.实施例1:
32.抗asfv病毒感染的益生菌菌株筛选
33.1.猪原代肺泡巨噬细胞(pam)的分离和培养
34.将猪处死后打开胸腔,将肺、心脏和气管(至喉头处)一起取下,取下后结扎心脏防止血液流入肺中,去除喉头和气管周围其它组织,以方便灌肺操作,在喉头与气管交界处用高压灭菌的绳结扎,防止细菌从喉头进入肺内,放入高压灭菌的塑料袋中。肺取回后,用75%酒精将塑料袋表面和袋口处消毒,转入生物安全柜,将肺取出,置于已消毒的托盘中。用无菌pbs冲洗肺外部,洗去血液等物质,用剪刀将喉头气管周围多余的组织剪掉,并修剪喉头处,以便后续液体的倒出以及避免污染倒出的液体。用移液管不断通过喉头向肺中注入含rpmi 1640培养基,同时用手轻轻按摩各个肺叶,促进培养基充分进入肺泡。待灌满时将肺中的液体倒入50ml离心管中。在倒入之前,使用吸水纸擦干肺表面的液体,防止在倾倒过程中肺表面的血液等进入含pam细胞的培养基中。随后进行第1次离心,在4℃条件下,500
×
g离心7min,弃上清,每管中加入20ml的rpmi 1640培养基重悬细胞,将两管合并成一管,离心管数量减半。如此离心3次,第4次离心,在4℃条件下,500xg离心5min,弃上清,每管中加入少量的rpmi 1640培养基重悬细胞,将所有离心管中的液体吸出至一个离心管中。使用70μm滤膜过滤,除去黏液等其他物质,转移至新的50ml离心管中,取20μl细胞液,加至计数板中使用自动细胞计数仪计数。计数后补充10%fbs、rpmi 1640培养液,以5
×
105个细胞/ml铺24孔板,置于37℃、5%co2培养箱中培养。
35.2.益生菌发酵液制备
36.将申请人实验室保存的平板复壮的益生菌接种于50ml lb液体培养基中,37℃培养24h,5000转离心10min,取上清4℃保存备用。
37.3.益生菌发酵液处理asfv病毒感染的pam细胞
38.将接种于24孔板的pam细胞培养24h,弃去培养基,接种0.1moi的asfv,37℃孵育1h,用pbs清洗三遍,随后分别加入含不同益生菌株发酵上清的rpmi 1640完全培养液,其中益生菌发酵液的浓度为1μl/ml,同时设计不含有益生菌发酵液处理的病毒对照组。处理后的24孔板置于37℃、5%co2培养箱中继续培养72h。
39.4.细胞培养液中asfv病毒含量的测定
40.上述处理的pam细胞培养72h后终止培养,收集细胞上清检测病毒含量。按照oie推荐的实时荧光定量pcr方法进行检测。所使用的引物序列f:5'-ctgctcatggtatcaatcttatcga-3',r:5'-gataccacaagatcrgccgt-3',探针引物为5'-fam-ccacgggaggaataccaacccagtg-tamra-3',反应程序为50℃2min,95℃10min,40个循环包括95℃15s,58℃1min。
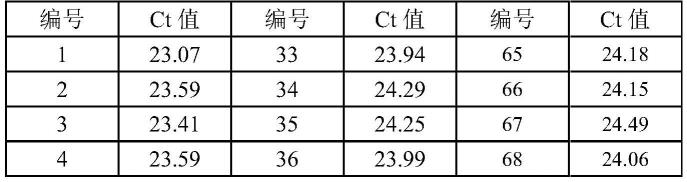
41.结果如表1和图1所示,在筛选的95株益生菌株中,和病毒阳性对照组比较,发现9号株菌对非洲猪瘟病毒(asfv)的增殖具有显著抑制作用。p《0.01且ct值相比较对照组高3.74。
42.5.具有抗非洲猪瘟病毒活性9号菌株生物学特性及鉴定
43.9号菌株为革兰氏阳性杆菌,有芽孢形成、不运动;在na培养基上菌落直径2-4mm;菌落呈不规则圆形。最适生长温度30-37℃,最适生长ph6-7。对其16s rrna基因进行pcr扩增并测序,结果在ncbi进行blast比对,发现9号菌株与枯草芽孢杆菌相似度最高99.9%。
44.本发明中申请人将其命名为枯草芽孢杆菌(bacillus subtilis)zf-1,该菌株已于2022年3月3日送至中国典型培养物保藏中心(cctcc),分类命名:bacillus subtilis zf-1,保藏编号为cctcc no:m2022185,地址:中国武汉武汉大学。
45.表1益生菌发酵液对asfv在细胞上增殖的影响
[0046][0047]
[0048]
实施例2:
[0049]
益生菌制剂在猪体内对非洲猪瘟病毒(asfv)感染的影响
[0050]
1.抗asfv感染的益生菌制剂制备方法
[0051]
将冻存的枯草芽孢杆菌(bacillus subtilis)zf-1进行复苏,用接种环挑取适量冻干菌粉接种于na固体平板培养基上进行划线复壮,37℃条件下培养18-24小时。将平板复壮的枯草芽孢杆菌接种于nb液体培养基,37℃、160rpm培养24h,平板计数,调整菌悬液浓度使其活菌数为2
×
108cfu/ml,作为抗asfv的益生菌制剂,4℃保存备用。
[0052]
2.动物实验设计
[0053]
将10头猪(23日龄断奶仔猪)随机分为2组,试验组和对照组,每组5头。对照组5头猪的编号分别为51、52、53、54、55,试验组5头猪的编号为72、73、74、75、76,所有动物均在动物生物安全三级实验室(absl-3)中进行饲养。试验组灌服枯草芽孢杆菌zf-1制剂,每头猪每天灌服含量为2
×
108cfu/ml活菌制剂5ml;对照组灌服空白nb液体培养基,每头猪每天5ml。口服感染50had
50
剂量的asfv,分别于感染前10天和感染后21天连续灌服益生菌制剂或空白培养基。试验分组见表2
[0054]
表2.抗asfv感染益生菌制剂动物试验分组
[0055]
分组-10天0天1-21天试验组109cfu/头/天口服50had
50
病毒109cfu/头/天对照组等量培养基/头/天口服50had
50
病毒等量培养基/头/天
[0056]
3.枯草芽孢杆菌制剂对asfv感染猪死亡率的影响
[0057]
asfv感染后每天观察猪的健康状态,结果如图2所示:对照组的猪在攻毒后第8天死亡1头、第9天死亡2头、第10天死亡1头、第15天死亡1头,死亡率为100%,而灌服枯草芽孢杆菌组的猪未出现发病及死亡,100%健活。
[0058]
4.枯草芽孢杆菌制剂对asfv感染猪体温的影响
[0059]
asfv感染后每天测量猪的体温,共监测28天,对照组的猪在第15天时全部死亡,对照组猪在死亡后立刻解剖观察内脏病变情况;实验组猪在第28天实验结束时全部解剖观察内脏情况。
[0060]
结果如表3和图3所示,55号和54号猪感染后第5天体温超过40℃直至第8天、第9天死亡;52号和53号感染后第6天体温超过40℃直至第9天、第10天死亡;51号猪在第10天体温超过40℃直至第15天死亡。灌服枯草芽孢杆菌制剂组的猪体温都稳定在40℃以下。
[0061]
表3.枯草芽孢杆菌制剂对asfv感染猪体温的影响
[0062][0063][0064]
5.枯草芽孢杆菌制剂对asfv感染猪肛拭子病毒含量的影响
[0065]
asfv感染后每天采集猪的肛拭子,共采集28天,使用oie推荐的实时荧光定量pcr方法检测肛拭子中asfv含量。结果如表4和图4所示。
[0066]
对照组的猪在感染后第3天肠道开始排毒,54号肛拭子排毒量ct值在感染后第6天最低达到17.54,对照组的猪在死亡前几天肛拭子排毒量均较高。
[0067]
灌服枯草芽孢杆菌制剂组的猪在第5天开始排毒,且肛拭子中病毒含量显著低于对照组,第8天75号ct值为26.24,但第9天之后ct值都大于30直至第19天检测不到ct值。图4中无ct值用0表示。结果表明使用枯草芽孢杆菌zf-1制剂能够降低感染猪肛拭子中非洲猪瘟病毒含量,减少感染猪肠道和粪便的排毒量。
[0068]
表4.枯草芽孢杆菌制剂对asfv感染猪肛拭子排毒量(ct值)的影响
[0069]
[0070]
6.枯草芽孢杆菌制剂对asfv感染猪咽拭子病毒含量的影响
[0071]
asfv感染后每天采集猪的咽拭子,共采集28天,使用oie推荐的实时荧光定量pcr方法检测咽拭子中asfv含量。
[0072]
结果如表5和图5所示,对照组猪在感染后第3天上呼吸道开始排毒,54号在感染后第8天咽拭子排毒量ct值最低达到21.67,对照组的猪在死亡前几天咽拭子排毒量均较高。枯草芽孢杆菌制剂组的猪在第4天开始排毒,且咽拭子中病毒含量显著低于对照组,第8天73号ct值为27.92,之后ct值都大于30或无ct值,试验组的猪在感染21天后对咽拭子检测均无ct值,图5中无ct值用0表示。结果表明使用枯草芽孢杆菌zf-1制剂能够降低感染猪咽拭子中非洲猪瘟病毒含量,减少感染猪上呼吸道的排毒。
[0073]
表5.枯草芽孢杆菌制剂对asfv感染猪咽拭子排毒量(ct值)的影响
[0074]
[0075][0076]
7.枯草芽孢杆菌制剂对asfv感染猪鼻拭子病毒含量的影响
[0077]
asfv感染后每天采集猪的鼻拭子,共采集28天,使用oie推荐的实时荧光定量pcr方法检测鼻拭子中asfv含量。
[0078]
结果如表6和图6所示,对照组的猪在感染后第3天鼻腔开始排毒,54号在感染后第7天鼻拭子排毒量ct值最低达到18.27,对照组的猪在死亡前几天鼻拭子排毒量均较高。枯草芽孢杆菌制剂组的猪在第4天开始排毒,且鼻拭子中病毒含量显著低于对照组,第7天76号ct值为28.29,之后ct值都大于30或无ct值;实验组的猪在感染20天后对咽拭子检测均无ct值,图6中无ct值用0表示。结果表明使用枯草芽孢杆菌zf-1制剂能够降低感染猪鼻拭子中非洲猪瘟病毒含量,减少感染猪鼻腔排毒。
[0079]
表6.枯草芽孢杆菌制剂对asfv感染猪鼻拭子排毒量(ct值)的影响
[0080]
[0081][0082]
8、枯草芽孢杆菌制剂对asfv感染猪组织病变的影响
[0083]
对照组的猪在感染asfv死亡后,立即对其进行解剖;灌服枯草芽孢杆菌制剂的试验组的猪在感染后观察到第28天时解剖,同时解剖同日龄未感染非洲猪瘟病毒的正常猪。采集以下组织样品进行观察:心脏、肝脏、脾脏、肺脏、肾脏、下颌淋巴结、肠系膜淋巴结、腹股沟淋巴结。如图7所示,感染asfv对照组的猪心脏有明显的出血,而试验组和正常阴性对照组的猪心脏未见异常;感染asfv对照组的猪肝脏出血严重,灌服枯草芽孢杆菌制剂的试验组的猪有极轻微出血;脾脏肿大也是asfv感染的典型症状,感染asfv对照组的猪脾脏出血肿大,长度为240cm,而试验组和未感染正常对照组的猪脾脏未出现出血肿大,且长度都基本一致为190cm;感染asfv对照组的猪肺脏出现肉变,但试验组和正常对照组的猪肺脏未见异常;感染asfv对照组的猪肾脏出现针尖状的出血点,而试验组和正常对照组的猪肾脏未出现异常;感染asfv对照组的猪下颌淋巴结,肠系膜淋巴结和腹股沟淋巴结都出现了充血,而试验组和正常对照组的猪三种淋巴结未见异常。综上所述,灌服枯草芽孢杆菌制剂能够显著降低asfv引起的组织器官损伤程度。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。