1.本发明属于有机合成技术领域,具体涉及一种环丁烷稠合螺环吲哚啉类化合物及其制备方法和应用。
背景技术:
2.有机含氮化合物广泛存在于具有生物活性的生物碱、氨基酸等药物分子中,在农药、染料和精细化学品中的应用也受到了广泛关注。环丁烷稠合吲哚类生物碱由于在分子中含有刚性环丁烷结构,往往能够调控吲哚类生物碱的生理活性功能。目前,常将四元环和吲哚啉支架作为药物分子的重要结构,从而提高药物分子的活性。
3.在开发抗癌药物中,ptp1b(蛋白酪氨酸磷酸酶)是开发抗癌药物的重要靶点,而分子结构中具有多种活性结构的稠合多环吲哚啉化合物的目前合成困难且复杂,从而限制了这类化合物医药等用途。
4.因此,亟需开发一种有效针对ptp1b(蛋白酪氨酸磷酸酶)重要靶点、安全性能高、活性好且制备简单、环保的吲哚啉类化合物。
技术实现要素:
5.本发明的目的之一在于提供一种环丁烷稠合螺环吲哚啉类化合物。
6.本发明的目的之二在于提供上述环丁烷稠合螺环吲哚啉类化合物的制备方法。
7.本发明的目的之三在于提供上述环丁烷稠合螺环吲哚啉类化合物的应用。
8.为了实现上述目的,本发明所采取的技术方案是:
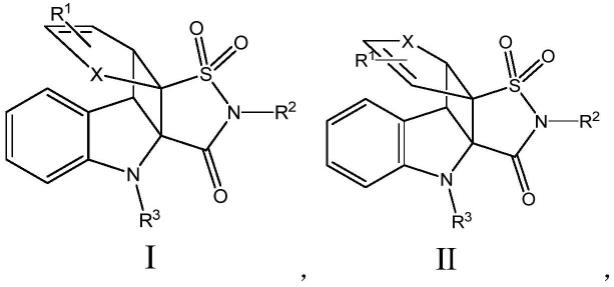
9.第一方面,本发明提供了一种环丁烷稠合螺环吲哚啉类化合物结构式如式ⅰ或式ⅱ所示:
[0010][0011]
其中,x选自-o-、-s-、-ch=ch-中的一种;
[0012]
r1选自-h、卤素基团、醚基、芳基、硅氧烷基、烷基中的一种;
[0013]
r2选自烷基、硅氧烷基、炔基、杂环基中的一种;
[0014]
r3选自乙酰基、对甲氧基苄基、甲硫甲基、特戊酰基、苄氧羰基、叔丁氧羰基、苄基、对甲氧苯基中的一种。
[0015]
优选的,所述硅氧烷基为含有硅氧键和碳氢键的化合物。
[0016]
进一步优选的,所述硅氧烷基中含有叔丁基二甲基硅氧基。
[0017]
优选的,所述杂环基为含有o原子、n原子、s原子中的一种或多种的杂环基。
[0018]
具体地,式ⅰ或式ⅱ式中的r1可以通过单取代或双取代的方式连接至含有x的环状结构上。
[0019]
优选的,所述r1选自-h、卤素基团、醚基、苯基、苄基、硅氧烷基、c1~c
10
的烷基中的一种。
[0020]
进一步优选的,所述r1选自-h、卤素基团、c1~c
10
的醚基、苯基、苄基、硅氧烷基、c1~c
10
的直链型烷基、c1~c
10
的环烷基中的一种。
[0021]
优选的,所述环丁烷稠合螺环吲哚啉类化合物选自如下结构式中的任意一种:
[0022][0023]
其中,r2选自烷基、硅氧烷基、炔基、杂环基中的一种;
[0024]
r3选自乙酰基、对甲氧基苄基、甲硫甲基、特戊酰基、苄氧羰基、叔丁氧羰基、苄基、对甲氧苯基中的一种。
[0025]
优选的,所述r2为c
1-10
的烷基、c
1-10
的硅氧烷基、c
1~5-炔基或含氧原子的杂环基。
[0026]
优选的,所述c
1-10
的硅氧烷基中连接有叔丁基二甲基硅氧基。
[0027]
优选的,所述含氧原子的杂环基为
[0028]
具体地,表示取代或者与母体连接的位置。
[0029]
优选的,所述r3为乙酰基、叔丁氧羰基、特戊酰基或苯甲酰基。
[0030]
进一步优选的,所述r3为乙酰基。
[0031]
进一步优选的,所述环丁烷稠合螺环吲哚啉类化合物选自如下结构式中的任意一种:
[0032][0033]
具体地,所述环丁烷稠合螺环吲哚啉类化合物中的的展开式为ac表示乙酰基,乙酰基的结构式为ch3co-;et表示乙基;otbs或tbso为叔丁基二甲基硅氧基。
[0034]
第二方面,本发明提供第一方面所述的环丁烷稠合螺环吲哚啉类化合物的制备方法,其具体包括如下步骤:将化合物a、催化剂和溶剂混合,得到反应液,再进行光照反应,得到环丁烷稠合螺环吲哚啉类化合物;
[0035]
其中,化合物a的结构结构式为:
[0036]
x选自-o-、-s-、-ch=ch-中的一种;
[0037]
r1选自-h、卤素基团、醚基、芳基、硅氧烷基、烷基、苄基中的一种;
[0038]
r2选自烷基、硅氧烷基、炔基、杂环基中的一种;
[0039]
r3选自乙酰基、对甲氧基苄基、甲硫甲基、特戊酰基、苄氧羰基、叔丁氧羰基、苄基、对甲氧苯基中的一种。
[0040]
优选的,所述环丁烷稠合螺环吲哚啉类化合物的制备方法还包括:过滤和柱层析分离的步骤。
[0041]
优选的,所述过滤为减压过滤。
[0042]
优选的,所述柱层析分离采用的分离液为石油醚与乙酸乙酯。
[0043]
优选的,所述催化剂为fac-三(2-苯基吡啶)合铱、(oc-6-22)-三[5-甲基-2-(2-吡啶基)苯基]铱、三[2-(4,6-二氟苯基)吡啶-c2,n]铱、(4,4'-二叔丁基-2,2'-二吡啶基)-双-(4,5
’‑
二叔丁基-2-苯基吡啶(-1h))-铱六氟磷酸盐、双(4,6-二氟苯基吡啶-n,c2)吡啶甲酸合铱、二氯四[2-(2-吡啶基)苯基]二铱、[4,4'-双(1,1-二甲基乙基)-2,2'-联吡啶基-κn,κn]双[5-氟-2-(5-甲基-2-吡啶基-κn)苯基κc]铱六氟磷酸、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联吡啶]铱二(六氟磷酸)盐、(2,2'-联吡啶)双[2-(4-氟苯基)吡啶]铱六氟磷酸盐、[2,2'-联(4-叔丁基吡啶)]双[2-(4-氟苯基)吡啶]铱六氟磷酸盐、[2,2'-联(4-叔丁基吡啶)]双[2-(2,4-二氟苯基)吡啶]六氟磷酸盐、二[2-(2,4-二氟苯基)-5-甲基吡啶][2,2'-联(四叔丁基吡啶)]铱二(六氟磷酸)盐、4,4'-双(三氟甲基)-2,2'-联吡啶、双[3,5-二氟-2-[5-甲基-2-吡啶基)苯基]铱(iii)六氟磷酸盐、[5,5'-双(三氟甲基)-2,2'-联吡啶-κn,κn]双[3,5-二氟-2-[5-(三氟甲基)-2-吡啶基-κn]苯基]铱六氟磷酸盐、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][1,10-菲罗啉]铱六氟磷酸盐、二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐、4,4'-二(叔丁基-2,2'-联吡啶]二[5-甲基-2-(4-甲基-2-吡啶基-κn)苯基-κc]六氟磷酸铱中的一种或多种。
[0044]
进一步优选的,所述催化剂为二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐。
[0045]
优选的,所述催化剂和化合物a的摩尔比为1:1000~1:5
[0046]
进一步优选的,所述催化剂和化合物a的摩尔比为1:200~1:15。
[0047]
优选的,所述反应液中的化合物a的浓度为0.01mol/l~10mol/l。
[0048]
进一步优选的,所述反应液中的化合物a的浓度为0.02mol/l~0.5mol/l。
[0049]
优选的,所述溶剂为苯、甲苯、邻二甲苯、氯苯、氟苯、二氯甲烷、二氯乙烷、乙腈、二甲基亚砜、二甲基甲酰胺、二甲基乙酰胺、乙酸乙酯、乙酸叔丁酯、四氢呋喃、乙醚、1,4-二氧六环、六氟异丙醇、1-甲基2-吡咯烷酮、丁酸甲酯中一种或多种。
[0050]
优选的,所述光照反应的温度为0℃~100℃。
[0051]
进一步优选的,所述光照反应的温度为5℃~50℃。
[0052]
更进一步优选的,所述光照反应的温度为15℃~80℃。
[0053]
优选的,所述光照反应的时间为1h~60h。
[0054]
进一步优选的,所述光照反应的时间为6h~50h。
[0055]
优选的,所述光照反应采用的是波长为380~460nm的蓝光。
[0056]
进一步优选的,所述光照反应采用的是波长为450nm的蓝光。
[0057]
优选的,所述光照反应采用的是功率为15w的蓝光。
[0058]
第三方面,本发明还提供了第一方面所述环丁烷稠合螺环吲哚啉类化合物在制备抗癌药物中的应用。
[0059]
优选的,所述环丁烷稠合螺环吲哚啉类化合物在细胞水平的作用浓度为2μg/ml~300μg/ml。
[0060]
进一优选的,所述环丁烷稠合螺环吲哚啉类化合物在细胞水平的作用浓度为3.1μg/ml~37.5μg/ml。
[0061]
优选的,所述环丁烷稠合螺环吲哚啉类化合物对于癌细胞的抑制率为69%-92%。
[0062]
本发明的有益效果是:本发明的环丁烷稠合螺环吲哚啉类化合物中具有刚性的环丁烷结构、异噻唑啉酮及其衍生物的结构、桥环结构、螺环结构等结构,能有效、安全地抑制癌细胞,且该化合物制备简单、条件温和、环保,适合规模化制备。具体为:
[0063]
(1)本发明的环丁烷稠合螺环吲哚啉类化合物中的异噻唑啉酮骨架对于ptp1b(蛋白酪氨酸磷酸酶)具有活性,从而说明其具有抗癌药物的重要靶点;
[0064]
(2)本发明的环丁烷稠合螺环吲哚啉类化合物中的环丁烷稠合吲哚啉骨架,由于在分子中含有刚性环丁烷结构,能够与吲哚啉结构协同地调控吲哚啉的生理活性功能,能够实现在低浓度的条件下有效作用于癌细胞,且具有安全性,有利于将其应用于制备抗癌药物中;
[0065]
(3)本发明的环丁烷稠合螺环吲哚啉类化合物的制备方法,通过巧妙地设计仅采用一步光照法就能够得到具有刚性的环丁烷结构、异噻唑啉酮及其衍生物的结构、吲哚啉结构的稠合多环化合物;
[0066]
(4)本发明的环丁烷稠合螺环吲哚啉类化合物的制备方法,运用光诱导环加成策略来制备含异噻唑啉酮的环丁烷稠合螺环吲哚啉化合物,该方法具有简单、环保、条件温和等优势,适合实际应用;
[0067]
(5)本发明的环丁烷稠合螺环吲哚啉类化合物通过活性测试发现能够在3μg/ml~300μg/ml的浓度范围下有效抑制癌细胞(例如人乳腺鳞状癌细胞)的增值。
附图说明
[0068]
图1为本发明的环丁烷稠合螺环吲哚啉类化合物的合成流程图。
[0069]
图2为本发明实施例4中的化合物4的核磁共振氢谱图和核磁共振碳谱图。
[0070]
图3为本发明实施例5中的化合物5的核磁共振氢谱图和核磁共振碳谱图。
[0071]
图4为本发明实施例6中的化合物6的核磁共振氢谱图和核磁共振碳谱图。
[0072]
图5为本发明实施例8中的化合物8的核磁共振氢谱图和核磁共振碳谱图。
[0073]
图6为本发明实施例9中的化合物9的核磁共振氢谱图和核磁共振碳谱图。
[0074]
图7为本发明实施例12中的化合物12的核磁共振氢谱图和核磁共振碳谱图。
[0075]
图8为本发明实施例15中的化合物15的核磁共振氢谱图和核磁共振碳谱图。
[0076]
图9为本发明实施例17中的化合物17的核磁共振氢谱图和核磁共振碳谱图。
[0077]
图10为本发明实施例1~18中的化合物1~18在癌细胞水平的抑制活性测试结果图。
[0078]
图11为本发明实施例4中的化合物4的作用浓度与癌细胞增值率的关系图。
[0079]
图12为本发明实施例6中的化合物6的作用浓度与癌细胞增值率的关系图。
[0080]
图13为本发明实施例9中的化合物9的作用浓度与癌细胞增值率的关系图。
具体实施方式
[0081]
以下通过具体的实施例对本发明的内容作进一步详细的说明。
[0082]
本发明的环丁烷稠合螺环吲哚啉类化合物的合成流程图,如图1所示。由图1可知:实施例1~22中的环丁烷稠合螺环吲哚啉类化合物通过简单的一步光照诱导化合物a自身形成具有刚性环丁烷结构、异噻唑啉酮的类似结构、螺环结构和桥环结构的吲哚啉类化合物。
[0083]
实施例1
[0084]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0085]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a1,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物1(收率:95%)。
[0086]
其中,化合物a1的结构式为:化合物1的结构式为:ac表示乙酰基,乙酰基的结构式为ch3co-。
[0087]
化合物1的结构表征:1hnmr(500mhz,dccl3)δ7.37-7.0(m,4h),6.1-6.0(m,1h),5.49-5.47(m,1h),5.2-5.1(m,1h),4.7-4.6(m,1h),3.67-3.37(m,4h),3.28(s,3h),1.93(s,3h)。
13
cnmr(126mhz,cdc l3)δ80.82,169.86,143.43,136.21,130.82,128.33,126.11,124.54,123.12,116.83,68.59,74.18,68.86,58.64,42.11,40.37,39.31,24.94。
[0088]
实施例2
[0089]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0090]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a2,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物2(收率:92%)。
[0091]
其中,化合物a2的结构式为:化合物2的结构式为:ac表示乙酰基,otbs表示叔丁基二甲基硅氧基。
[0092]
化合物2的结构表征:1h nmr(400mhz,cdcl3)δ7.37-7.25(m,2h),7.09-7.05(m,2h),5.90-5.88(m,1h),5.29-5.27(m,1h),4.82-4.79(m,1h),4.40(d,j=8.2hz,1h),3.99-3.69(m,4h),2.53(s,3h),2.15-2.02(m,2h),0.92(s,9h),0.08(s,6h)。
13
c nmr(101mhz,cdcl3)δ168.0,163.8,143.5,129.3,128.9,128.0,127.3,124.0,120.3,113.4,78.9,76.1,60.2,56.1,47.2,38.3,31.2,25.9,24.2,18.2,-5.34,-5.35。
[0093]
实施例3
[0094]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0095]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a3,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应,然后减压过滤,旋干,柱层析分离纯化,得到化合物3(收率:90%)。
[0096]
其中,化合物a3的结构式为:化合物3的结构式为:ac表示乙酰基。
[0097]
化合物3的结构表征:1h nmr(400mhz,cdcl3)δ7.37-7.25(m,2h),7.09-7.05(m,2h),5.90-5.88(m,1h),5.29-5.27(m,1h),4.82-4.79(m,1h),4.40-3.99(m,5h),2.53(s,3h),2.15-2.02(m,4h)。
[0098]
13
c nmr(101mhz,cdcl3)δ168.0,163.8,143.5,129.3,128.9,128.0,127.3,124.0,120.3,113.4,78.9,76.1,78.5,67.6,46.4,42.5,39.8,33.2,25.6,23.8。
[0099]
实施例4
[0100]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0101]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a4,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物4(收率:21%)。
[0102]
其中,化合物a4的结构式为:化合物4的结构式为:ac表示乙酰基。
[0103]
化合物4的核磁共振谱图,如图2所示,图2中a为核磁共振氢谱(1h nmr),图2中b核磁共振碳谱(
13
c nmr)。
[0104]
化合物4的结构表征(参见图2):1h nmr(400mhz,cdcl3)δ7.36-7.21(m,2h),7.05-7.02(m,2h),5.94-5.89(m,1h),5.24-5.27(m,1h),4.82-4.79(m,1h),4.40-3.70(s,2h),2.53(s,3h),2.15(m,1h)。
13
c nmr(101mhz,cdcl3)δ169.3,163.5,144.5,128.3,127.9,126.0,125.3,124.0,121.3,114.4,80.1,78.9,76.1,73.43,31.32。
[0105]
实施例5
[0106]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0107]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a5,抽除空气并且充入氩气,如此反复三次后,50.0ml加入苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物5(收率:87%)。
[0108]
其中,化合物a5的结构式为:化合物5的结构式为:ac表示乙酰基。
[0109]
化合物5的核磁共振谱图,如图3所示,图3中a为核磁共振氢谱(1h nmr),图3中b核磁共振碳谱(
13
c nmr)。
[0110]
化合物5的结构表征(参见图3):1h nmr(400mhz,cdcl3)δ7.31-7.20(m,2h),7.15-7.12(m,2h),5.84-5.77(m,1h),5.14-5.16(m,1h),4.84-4.79(m,1h),2.78(m,2h),2.58(s,3h),1.60-1.40(m,11h)。
13
c nmr(101mhz,cdcl3)δ169.3,163.5,144.5,128.3,127.9,126.0,125.3,124.0,121.3,114.4,80.1,78.9,46.11,42.11,39.43,31.32,30.7,26.78,25.55。
[0111]
实施例6
[0112]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0113]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟
甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a6,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物6(收率:87%)。
[0114]
其中,化合物a6的结构式为:化合物6的结构式为:ac表示乙酰基。
[0115]
化合物6的核磁共振谱图,如图4所示,图4中a为核磁共振氢谱(1h nmr),图4中b核磁共振碳谱(
13
c nmr)。
[0116]
化合物6的结构表征(参见图4):1h nmr(400mhz,cdcl3)δ7.36-7.21(m,6h),7.05-7.02(m,2h),5.94-5.89(m,1h),5.24-5.27(m,1h),4.82-4.79(m,1h),4.40-3.70(s,2h),3.69-3.55(m,2h),2.85-2.77(m,2h),2.53(s,3h),1.90-1.86(m,2h)。
13
c nmr(101mhz,cdcl3)δ169.3,163.5,144.5,144.0,128.3,129.2,127.9,127.1,126.5,126.0,125.8,125.3,124.9,124.0,121.3,114.4,81.9,80.1,78.9,76.1,46.9,43.43,31.32,25.9,25.3,24.3,23.9,22.9。
[0117]
实施例7
[0118]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0119]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a7,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物7(收率:76%)。
[0120]
其中,化合物a7的结构式为:化合物7的结构式为:ac表示乙酰基。
[0121]
化合物7的结构表征:1h nmr(400mhz,cdcl3)δ7.36-7.21(m,2h),7.05-7.02(m,2h),5.94-5.89(m,1h),5.24-5.27(m,1h),4.82-4.79(m,1h),4.40-3.70(s,2h),2.53(s,3h),2.15-1.98(m,5h)。
13
c nmr(101mhz,cdcl3)δ168.3,167.5,143.4,127.2,127.1,126.9,125.6,124.3,121.7,114.8,81.7,79.9,42.43,31.32,22.9,20.8,4.7,4.1。
[0122]
实施例8
[0123]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0124]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a8,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物8(收率:93%)。
[0125]
其中,化合物a8的结构式为:化合物8的结构式为:ac表示乙酰基。
[0126]
化合物8的核磁共振谱图,如图5所示,图5中a为核磁共振氢谱(1h nmr),图5中b核磁共振碳谱(
13
c nmr)。
[0127]
化合物8的结构表征(参见图5):1h nmr(500mhz,dccl3)δ7.85(d,j=10.5hz,1h),7.67(dd,j=6.0hz,1.5hz,1h),7.62(dd,j=5.0hz,2.0hz,1h),7.59(d,j=10.0hz,1h),7.399-7.442(m,1h),7.284-7.323(m,1h),7.07(dd,j=6hz,5hz,1h),6.73(s,1h),3.76-3.80(m,2h),2.67(s,3h),1.80-1.90(m,2h),0.93(t,j=19hz,3h)。
13
c nmr(125mhz,dccl3)δ168.4,163.4,139.2,135.3,134.9,133.9,132.3,129.0,127.2,126.6,123.9,122.5,114.6,112.1,49.4,25.9,22.4,11.27。
[0128]
实施例9
[0129]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0130]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a9,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物9(收率:95%)。
[0131]
其中,化合物a9的结构式为:化合物9的结构式为:ac表示乙酰基。
[0132]
化合物9的核磁共振谱图,如图6所示,图6中a为核磁共振氢谱(1h nmr),图6中b核磁共振碳谱(
13
c nmr)。
[0133]
化合物9的结构表征(参见图6):1h nmr(500mhz,dccl3)δ7.65-7.34(m,2h),7.05-7.10(m,2h),5.89(d,j=6.0hz,1h),5.28(dd,j=6.0hz,3.5hz,1h),4.79-4.81(m,1h),
4.40(d,j=8.0,1h),3.68-3.78(m,2h),2.53(s,3h),1.84-1.95(m,2h),1.03(t,j=14.5,3h)。
13
c nmr(125mhz,dccl3)δ168.4,163.4,139.2,135.3,134.9,133.9,132.3,129.0,127.2,126.6,123.9,122.5,114.6,112.1,49.4,25.9,22.4,11.27。
[0134]
实施例10
[0135]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0136]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a10,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;光照下反应48小时停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物10(收率:40%)。
[0137]
其中,化合物a10的结构式为:化合物10的结构式为:ac表示乙酰基。
[0138]
化合物10的结构表征:1h nmr(500mhz,dccl3)δ7.34(m,1h),7.22(d,j=7.5,1h),7.15-7.10(m,4h),6.88(d,j=7.5hz,1h),6.84(d,j=8.5hz,1h),5.27(d,j=8.0,1h),4.39(d,j=8.0,1h),3.74-3.86(m,2h),2.35(s,3h),1.92-2.04(m,2h),1.09(t,j=14.5,3h)。
13
c nmr(125mhz,dccl3)δ168.1,163.9,146.4,142.8,131.1,129.4,128.9,128.7,126.9,126.1,125.0,123.6,122.3,112.8,80.0,76.8,50.5,48.3,42.4,24.4,21.8,11.3。
[0139]
实施例11
[0140]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0141]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a11,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物11(收率:46%)。
[0142]
其中,化合物a11的结构式为:化合物11的结构式为:ac表示乙酰基。
[0143]
化合物11的结构表征:1h nmr(500mhz,dccl3)δ7.88(d,j=10.5,1h),7.62(s,1h),7.57(d,j=9.5,1h),7.42(m,1h),7.29(t,j=19hz,1h),6.89(t,j=4.5,1h),6.67(s,1h),
6.49(q,j=2,1h),3.85(t,j=19.0,2h),2.68(s,3h),1.86(m,2h),0.97(t,j=18.5,3h)。
13
c nmr(125mhz,dccl3)δ168.4,163.2,147.0,135.4,132.1,128.8,126.6,123.8,122.4,119.0,114.7,112.3,111.5,49.0,25.9,22.2,11.2。
[0144]
实施例12
[0145]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0146]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a12,抽除空气并且充入氩气,如此反复三次后,加入苯50.0ml,光照下反应48小时停止反应。然后减压过滤,旋干,柱层析分离纯化,得到化合物12(收率:87%)。
[0147]
其中,化合物a12的结构式为:化合物12的结构式为:ac表示乙酰基。
[0148]
化合物12的核磁共振谱图,如图7所示,图7中a为核磁共振氢谱(1h nmr),图7中b核磁共振碳谱(
13
c nmr)。
[0149]
化合物12的结构表征(参见图7):1h nmr(500mhz,cdcl3)δ8.69-8.67(m,1h),8.56(d,j=8.0,1h),8.44-8.42(m,1h),8.00(s,1h),7.75-7.68(m,3h),7.44-7.38(m,2h),7.27-7.16(m,3h),7.10-7.07(t,j=15,1h),6.43(s,1h).4.18-4.15(m,2h),2.22(s,3h),2.06-1.98(m,2h),1.08(t,j=14.5,3h)。
13
c nmr(126mhz,cdcl3)δ167.7,163.2,134.7,134.6,132.1,131.7,131.0,130.9,130.5,130.2,128.6,128.6,128.0,127.8,127.5,126.4,125.6,125.0,123.6,123.3,122.3,122.1,114.1,113.2,77.3,77.0,76.8,48.8,25.4,22.5,11.4。
[0150]
实施例13
[0151]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0152]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a13,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物a13(收率:67%)。
[0153]
其中,化合物a13的结构式为:化合物13的结构式为:
ac表示乙酰基。
[0154]
化合物13的结构表征:1hnmr(400mhz,cdcl3)δ8.09和7.12-6.82(m,8h),5.07(d,j=7.9hz,1h),4.59(a pair of d,j=10.0,1h),3.87-3.71(m,2h),2.48和2.20(a pair of s,3h),2.02-1.89(m,2h),1.08(t,j=7.4hz,3h)。
13
cnmr(101mhz,cdcl3)δ168.0,163.0,160.8,143.1,129.8,129.2,127.8,127.1,126.2,123.9,123.1,122.9,113.1,110.7,96.2,77.2,73.0,49.1,45.8,42.1,24.2,21.8,11.2。
[0155]
实施例14
[0156]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0157]
在100mlschlenk(施兰克)管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a14,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物14(收率:98%)。
[0158]
其中,化合物a14的结构式为:化合物14的结构式为:ac表示乙酰基。
[0159]
化合物14的结构表征:1hnmr(400mhz,cdcl3)δ7.36(t,j=7.8hz,1h),7.30(d,j=8.2hz,1h),7.12(t,j=7.4hz,1h),7.06(d,j=7.5hz,1h),5.26(d,j=3.5hz,1h),4.77(dd,j=8.1hz,3.5hz,1h),4.40(d,j=8.1hz,1h),3.80-3.68(m,2h),2.56(s,3h),1.94-1.80(m,2h),1.02(t,j=7.4hz,3h)。
13
cnmr(101mhz,cdcl3)δ168.2,163.4,143.3,130.1,129.7,127.5,127.3,124.4,117.5,113.6,79.5,76.1,54.8,47.8,42.6,24.2,21.7,11.1.ir(thinfilm):vmax(cm-1)=2829,1589,1484,1352,1170,1062,758,573。
[0160]
实施例15
[0161]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0162]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a15,抽除空气并且充入氩气,如此反复三次后,加入苯50.0ml,光照下反应48小时停止反应。然后减压过滤,旋干,柱层析分离纯化,得到化合物a15(收率:97%)。
[0163]
其中,化合物a15的结构式为:化合物15的结构式为:
ac表示乙酰基。
[0164]
化合物15的核磁共振谱图,如图8所示,图8中a为核磁共振氢谱(1h nmr),图8中b核磁共振碳谱(
13
c nmr)。
[0165]
化合物15的结构表征(参见图8):1hnmr(400mhz,cdcl3)δ7.36(t,j=7.8hz,1h),7.29(d,j=8.2hz,1h),7.12(t,j=7.4hz,1h),7.05(d,j=7.5hz,1h),5.39(d,j=3.5hz,1h),4.71(dd,j=8.1,3.5hz,1h),4.39(d,j=8.1hz,1h),3.80-3.63(m,2h),2.56(s,3h),1.94-1.80(m,2h),1.02(t,j=7.4hz,3h)。
13
cnmr(101mhz,cdcl3)δ168.2,163.4,143.3,129.7,127.5,127.3,124.4,121.7,115.1,113.6,80.5,76.1,56.2,47.6,42.6,24.2,21.7,11.2。
[0166]
实施例16
[0167]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0168]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a16,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物16(收率:91%)。
[0169]
其中,化合物a16的结构式为:化合物16的结构式为:ac表示乙酰基。
[0170]
化合物16的结构表征:1hnmr(500mhz,cdcl3)δ7.88(d,j=8.5hz,1h),7.59(d,j=7.8hz,1h),7.41(m,2h),7.30(t,j=7.5hz,1h),6.72(m,2h),3.83-3.69(m,2h),2.67(s,3h),2.54(s,3h),1.89
–
1.79(m,2h),0.93(t,j=7.4hz,3h)。
13
cnmr(126mhz,cdcl3)δ168.3,163.4,139.6,135.1,135.0,132.0,130.1,129.0,126.6,123.9,122.6,122.4,114.4,112.0,49.5,25.9,22.6,11.2。
[0171]
实施例17
[0172]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0173]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a17,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物a17(收率:65%)。
[0174]
其中,化合物a17的结构式为:化合物17的结构式为:ac表示乙酰基。
[0175]
化合物17的核磁共振谱图,如图9所示,图9中a为核磁共振氢谱(1h nmr),图9中b核磁共振碳谱(
13
c nmr)。
[0176]
化合物17的结构表征(参见图9):1hnmr(400mhz,cdcl3)δ8.39和7.37-7.27(m,3h),7.13-6.97(m,2h),5.43(a pair of s,1h),5.37-5.27(m,1h),4.89-4.76(m,1h),4.65和4.40(a pair of d,j=8.0hz,1h),3.81-3.66(m,4h),3.60-3.50(m,1h),3.42-3.31(m,1h),2.55(s,3h),1.97-1.83(m,2h),1.04(t,j=7.4hz,3h)。
13
cnmr(101mhz,cdcl3)δ168.3,163.4,139.6,135.1,135.0,132.0,130.1,129.0,126.6,123.9,122.6,122.4,114.4,112.0,49.5,25.9,22.6,11.2。
[0177]
实施例18
[0178]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0179]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a18,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物18(收率:88%)。
[0180]
其中,化合物a18的结构式为:化合物18的结构式为:ac表示乙酰基,tbso,即otbs表示叔丁基二甲基硅氧基。
[0181]
化合物18的结构表征:1hnmr(500mhz,cdcl3)δ8.54和7.48-7.40(m,2h),7.28-7.11(m,2h),5.33-5.25(m,1h),5.02-4.93(m,1h),4.65(a pair of d,j=8.2hz,1h),4.21(s,2h),3.98-3.84(m,2h),2.70和2.17(a pair of s,3h),2.14-2.00(m,2h),1.21(t,j=7.4hz,3h),0.98(s,9h),0.07(d,j=12.5hz,6h)。
13
cnmr(126mhz,cdcl3)δ168.0,164.0,147.6,143.6,129.2,128.2,127.3,124.0,113.6,113.4,78.5,75.9,60.3,56.0,47.3,42.5,25.6,24.1,21.7,18.1,11.2,-5.61,-5.62。
[0182]
实施例19
[0183]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0184]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟
甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a19,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物19(收率:87%)。
[0185]
其中,化合物a19的结构式为:化合物19的结构式为:ac表示乙酰基。
[0186]
化合物19的结构表征:1hnmr(500mhz,cdcl3)δ7.40(t,j=7.9hz,1h),7.15(dt,j=17.0,7.2hz,5h),7.06(d,j=7.4hz,1h),6.58(d,j=6.8hz,2h),5.01(s,1h),4.78(d,j=8.2hz,1h),4.34(d,j=8.2hz,1h),3.78
–
3.66(m,2h),3.50(d,j=15.7hz,1h),3.21(d,j=15.7hz,1h),2.30(s,3h),1.93
–
1.81(m,2h),1.01(t,j=7.5hz,3h)。
13
cnmr(126mhz,cdcl3)δ168.0,163.9,146.1,143.7,136.6,129.2,128.5,128.4,128.3,127.3,126.7,124.0,116.2,113.8,79.2,76.2,55.9,47.4,42.5,36.7,23.9,21.7,11.1。
[0187]
实施例20
[0188]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0189]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a20,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,以的得到化合物20(收率:90%)。
[0190]
其中,化合物a20的结构式为:化合物20的结构式为:ac表示乙酰基。
[0191]
化合物20的结构表征:1hnmr(400mhz,cdcl3)δ7.33-7.27(m,1h),7.24(d,j=8.2hz,1h),7.08(t,j=6.9hz,1h),7.02(d,j=7.3hz,1h),4.86(d,j=3.2hz,1h),4.76(dd,j=8.0,3.2hz,1h),4.60和4.35(d,j=8.1hz,1h),3.78
–
3.68(m,2h),2.53(s,3h),1.90(m,2h),1.03(t,j=7.4hz,3h),0.86(s,9h)。
13
cnmr(101mhz,cdcl3)δ167.9,164.0,157.8,143.7,129.1,128.4,127.4,123.7,113.3,111.8,78.5,76.2,55.9,47.7,42.4,34.8,29.6,24.3,21.7,11.2。
[0192]
实施例21
[0193]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步
骤:
[0194]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a21,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物21(收率:81%)。
[0195]
其中,化合物a21的结构式为:化合物21的结构式为:ac表示乙酰基,et表示乙基。
[0196]
化合物21的结构表征:1hnmr(400mhz,cdcl3)δ8.39和7.34-7.28(m,2h),7.14-6.98(m,2h),5.20和5.17(a pair of d,j=3.1hz,1h),4.91和4.87(a pair of dd,j=8.3,3.1hz,1h),4.65和4.40(apair of d,j=8.2hz,1h),3.86-3.68(m,2h),2.97-2.89(m,1h),2.65-2.57(m,1h),2.54(s,3h),2.12-1.86(m,6h),1.60-1.52(m,1h),1.30-1.20(m,1h),1.05(m,6h)。
13
cnmr(101mhz,cdcl3)δ167.9,164.0,152.5,143.8,129.3,128.4,127.5,123.9,115.2,113.4,78.3,77.8,76.2,58.4,56.2,47.5,42.5,33.1,32.3,24.2,21.7,15.4,12.8,11.2。
[0197]
实施例22
[0198]
本实施例提供一种环丁烷稠合螺环吲哚啉类化合物的制备方法,具体包括以下步骤:
[0199]
在100mlschlenk(施兰克)反应管中加入0.05mmol二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐,5.0mmol化合物a22,抽除空气并且充入氩气,如此反复三次后,加入50.0ml苯;在光照下反应48小时,停止反应;然后减压过滤,旋干,柱层析分离纯化,得到化合物22(收率:87%)。
[0200]
其中,化合物a22的结构式为:化合物22的结构式为:ac表示乙酰基,et表示乙基。
[0201]
化合物22的结构表征:1hnmr(400mhz,cdcl3)δ8.40和7.35-7.28(m,2h),7.15-6.97(m,2h),5.07(a pair of d,j=3.1hz,1h),4.85(a pair of dd,j=8.3,3.3hz,1h),4.61和4.36(a pair of d,j=8.3hz,1h),3.75(m,2h),2.96
–
2.85(m,1h),2.55(m,4h),0.92-2.03(m,20h)。
13
cnmr(101mhz,cdcl3)δ167.8,164.1,155.2,143.9,129.2,128.5,127.4,123.9,115.8,113.6,79.8,77.5,76.0,57.4,56.5,47.3,42.4,31.9,31.7,28.1,27.8,
24.4,24.2,21.7,21.0,20.5,15.6,11.2。
[0202]
如无特殊说明,化合物1~22的结构表征中的a pair of d表示有一对d(双)峰,a pair of dd表示有一对dd(双二重峰)峰,a pair of s表示有一对s(单)峰,且这些峰的出现是化合物的异构体造成的。实施例1~22中光照反应采用的均为蓝色led灯,15w、波长为450nm的光源。
[0203]
活性测试
[0204]
实验材料:hcc1806细胞(人乳腺鳞状癌细胞,上海卓强生物科技有限公司),1640培养基(hyclone sh30809.01b),fbs(胎牛血清,hyclone sh30088.03),100x青霉素-链霉素溶液(上海生工e607011-0100),0.25%胰酶(碧云天c0201),mtt(噻唑蓝,sigma m5655),dmso(二甲基亚砜,sigma rnbc7099),实施例1~18中的化合物1~18。
[0205]
实验仪器:酶标检测仪(thermo mk3),摇床(qilinbeier ts-1000),细胞培养箱(thermo scientific 8000),光学显微镜(上海精密仪器仪表有限公司xds-1a),倒置显微镜(olympus,ix71),超净工作台(上海沪净医疗器械有限公司sw-cj-2d)。
[0206]
实验步骤(mtt法检测):
[0207]
1)将hcc1806细胞扩培,收集细胞,接种于96孔板中,使细胞密度为1
×
104cells/孔,每孔加入100μl 1640完全培养基,37℃,5%co2培养箱内培养24h;
[0208]
2)药物配制(实验组):制备的药物分子(化合物1~22)分别加入500μl dmso(二甲基亚砜),超声波助溶,每种药物稀释7个浓度梯度(7个浓度梯度的在5μmol~800μmol的范围中)并分别加入至细胞中,48h后分别检测吸光度值,检测时每孔加入20μl的mtt,37℃,5%co2培养箱内培养避光孵育4h;
[0209]
对照组:加入500μldmso,超声波助溶,加入至细胞中,48h后分别检测吸光度值,检测时每孔加入20μl的mtt,37℃,5%co2培养箱内培养避光孵育4h;
[0210]
3)用酶标仪在492nm波长测出od值(光密度值)。
[0211]
实施例1~18中的化合物1~18在癌细胞水平的抑制活性测试结果,如图10和表1所示,图10中的“*”表示p《0.05,“**”表示p《0.01(与ck组进行比较),表明实验测试数值的可信度高。
[0212]
表1在细胞水平下的化合物1~18的活性测试结果
[0213]
[0214][0215]
注:表1中的抑制率(%)=1-(加药组od值/对照组od值),药指的是化合物1~18,最佳用药浓度的评判标准为得到最佳抑制率需要的药物浓度,但此次的“最佳”不能作为限制本发明的化合物应用和效果的依据。
[0216]
由图10和表1可知:化合物1~18均能够在细胞测试水平中表现出明显抑制癌细胞和有效降低癌细胞的增值率的效果。同时,化合物1~18的最佳用药浓度在300μg/ml以下,甚至是100μg/ml以下都能明显表现出对于癌细胞抑制作用。
[0217]
本发明实施例4、实施例6和实施例9中的环丁烷稠合螺环吲哚啉类化合物在不同的作用浓度测得的癌细胞增值率,如图11、图12和图13所示。
[0218]
由图11、图12和图13可知:通过在不同化合物4、化合物6和化合物9的加入量测得其关于细胞增值率的数据,可以发现在在较低的环丁烷稠合螺环吲哚啉类化合物浓度(3~100μg/ml)下就能有较好的癌细胞增殖抑制,也能够说明其具有较好的安全性,适于制药。
[0219]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。