抗gdf15抗体
技术领域
1.本技术要求国际申请号pct/jp2019/047956的优先权,在此通过参照将其整体整合到本说明书中。
2.本发明涉及抗gdf15抗体及其用途。
背景技术:
3.恶病质是与慢性疾病相伴随的、以体重减轻和肌无力为特征的复合代谢性疾病。其中,癌症恶病质可见于大多数进展期癌症患者,会导致患者的预后、qol变差,因此需要积极治疗。但是,恶病质的病情较为复杂,发生机制尚有较多不明之处,目前不存在有效的治疗药。
4.gdf15(growth differentiation factor 15,生长分化因子15)为tgf-β超家族的分泌蛋白,据报道与癌症、糖尿病等各种疾病有关。已存在很多关于血中gdf15浓度的临床研究报道,例如报道了癌症患者的血中和癌组织的gdf15水平高、癌症患者的血中gdf15水平与预后相关。另外,已知gdf15作用于脑部摄食中枢而引发食欲不振、与恶病质的发病有关。
技术实现要素:
5.发明所要解决的问题
6.本发明的目的在于,提供对与gdf15相关的疾病或症状的处置有用的抗gdf15抗体。
7.用于解决问题的方法
8.本发明在一个方式中提供抗hgdf15抗体,其与包含氨基酸序列dhcplgpgrccrlh(序列号3)的hgdf15的表位结合。
9.本发明在另一个方式中提供抗hgdf15抗体,其含有重链可变区和轻链可变区,
10.所述重链可变区含有:
11.含有序列号4的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
12.含有序列号4的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
13.含有序列号4的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
14.所述轻链可变区含有:
15.含有序列号5的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
16.含有序列号5的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
17.含有序列号5的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
18.本发明在另一个实施方式中提供抗hgdf15抗体,其含有重链可变区和轻链可变区,
19.所述重链可变区含有:
20.含有序列号18的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
21.含有序列号19的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
22.含有序列号20的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
23.所述轻链可变区含有:
24.含有序列号21的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
25.含有序列号22的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
26.含有序列号23的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
27.本发明在另一个方式中提供抗hgdf15抗体,其含有重链可变区和轻链可变区,
28.所述重链可变区含有与序列号8的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号8的氨基酸序列、或序列号8的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列,
29.所述轻链可变区含有与序列号9的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号9的氨基酸序列、或序列号9的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列。
30.本发明在另一个方式中提供抗hgdf15抗体,其含有重链可变区和轻链可变区,
31.所述重链可变区含有:
32.含有序列号133的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
33.含有序列号133的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
34.含有序列号133的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
35.所述轻链可变区含有:
36.含有序列号134的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
37.含有序列号134的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
38.含有序列号134的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸
序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
39.本发明在另一个方式中提供抗hgdf15抗体,其含有重链可变区和轻链可变区,
40.所述重链可变区含有:
41.含有序列号137的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
42.含有序列号138的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
43.含有序列号139的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
44.所述轻链可变区含有:
45.含有序列号140的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
46.含有序列号141的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
47.含有序列号142的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
48.本发明在另一个方式中提供抗hgdf15抗体,其含有重链可变区和轻链可变区,
49.所述重链可变区含有:
50.含有序列号135的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
51.含有序列号135的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
52.含有序列号135的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
53.所述轻链可变区含有:
54.含有序列号136的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
55.含有序列号136的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
56.含有序列号136的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
57.本发明在另一个方式中提供抗hgdf15抗体,其含有重链可变区和轻链可变区,
58.所述重链可变区含有:
59.含有序列号143的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
60.含有序列号144的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
61.含有序列号145的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
62.所述轻链可变区含有:
63.含有序列号146的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
64.含有序列号147的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
65.含有序列号148的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
66.本发明在另一个方式中提供抗hgdf15抗体,其与上述任意抗体竞争与hgdf15结合。
67.本发明在另一个方式中提供编码上述任意抗体的多核苷酸、含有上述多核苷酸的表达载体、或含有上述多核苷酸的转化细胞。
68.本发明在另一个方式中提供含有上述任意抗体的药物组合物。
69.发明效果
70.本发明的抗hgdf15抗体识别不同于现有抗hgdf15抗体的表位,对与gdf15相关的疾病或症状的处置有用。
附图说明
71.图1示出使用4种抗hgdf15单克隆抗体(humab2、mab17、hu01g06-127、mab957)的竞争试验的结果。
72.图2a示出humab2的fab与hgdf15的共晶的立体结构分析的结果。
73.图2b示出由humab2的fab与hgdf15的共晶的立体结构分析所得到的表位和互补位的分析结果。
74.图3为humab2的fab与hgdf15的结合的立体结构分析结果。hgdf15形成均二聚体,用下划线示出humab2所结合的氨基酸中的、存在于一个hgdf15单体(monomer1)中的氨基酸,用双下划线示出humab2所结合的氨基酸中的、存在于另一个单体(monomer2)中的氨基酸(71d72t)。用粗体示出对于结合而言重要的氨基酸,用箭头示出结合特别强的氨基酸。
75.图4示出hgdf15或dhcplgpgrccrlh(序列号3)的合成肽与humab2的结合试验的结果。
76.图5a示出humab2突变体与hgdf15的结合(h链改变的抗体1/2)。
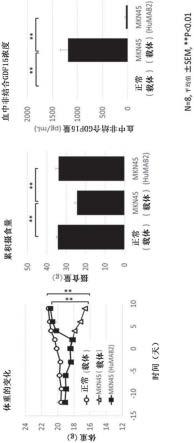
77.图5b示出humab2突变体与hgdf15的结合(h链改变的抗体2/2)。
78.图5c示出humab2突变体与hgdf15的结合(l链改变的抗体1/2)。
79.图5d示出humab2突变体与hgdf15的结合(l链改变的抗体2/2)。
80.图6示出利用humab2和mab17捕获血中hgdf15。
81.图7示出抗hgdf15抗体对荷瘤小鼠模型的血中非结合hgdf15浓度的效果。
82.图8示出humab2对荷瘤小鼠模型的体重减轻、累积摄食量和血中非结合hgdf15浓度的效果。
83.图9示出humab2对荷瘤小鼠模型的活动性(昼夜节律)的效果。
84.图10示出humab2突变体与hgdf15的结合。
85.图11示出由具有突变的h链(h49r、h49d、h48s、h71y、h83r或h120f)和l链(l48k、
l112d、l72f或l24h)构成的humab2突变体与hgdf15的结合。
86.图12示出评价抗gdf15抗体对gdf15与gfral形成复合物的抑制活性的示意图。
87.图13示出评价humab2对gdf15、gfral与ret形成复合物的抑制活性的示意图及其评价结果。
88.图14示出mab1对荷瘤小鼠模型的体重减轻、累积摄食量和血中非结合hgdf15浓度的效果。
具体实施方式
89.只要没有特别的具体规定,则本说明书中使用的术语具有有机化学、医学、药学、分子生物学、微生物学等领域的本领域技术人员通常所理解的含义。以下记载本说明书中使用的一些术语的定义,这些定义在本说明书中优先于常规理解。
90.本发明中,数值带有“约”这一术语时,旨在包含该值的
±
10%的范围。例如,“约20”包含“18~22”。数值的范围包含两端点之间的全部数值和两端点的数值。关于范围的“约”是应用于该范围的两端点的。因此,例如“约20~30”包含“18~33”。
91.本说明书中,氨基酸残基用以下的缩写表示。
92.ala或a:丙氨酸
93.arg或r:精氨酸
94.asn或n:天冬酰胺
95.asp或d:天冬氨酸
96.cys或c:半胱氨酸
97.gln或q:谷氨酰胺
98.glu或e:谷氨酸
99.gly或g:甘氨酸
100.his或h:组氨酸
101.ile或i:异亮氨酸
102.leu或l:亮氨酸
103.lys或k:赖氨酸
104.met或m:甲硫氨酸
105.phe或f:苯丙氨酸
106.pro或p:脯氨酸
107.ser或s:丝氨酸
108.thr或t:苏氨酸
109.trp或w:色氨酸
110.tyr或y:酪氨酸
111.val或v:缬氨酸
112.本说明书中,某氨基酸序列中的氨基酸残基有时以表示其位置的数字和表示氨基酸残基的缩写(例如,将第13位的精氨酸残基记作“13r”)来示出。
113.gdf15(growth differentiation factor 15,生长分化因子15)是tgf-β超家族的分泌蛋白,也称为mic-1、plab、pdf、nag-1。gdf15基因表达作为前体的前gdf15,该前gdf15
被膜型内切金属蛋白酶切断,生成成熟gdf15。一般认为,gdf15为可溶型,形成二聚体而被作为其受体的gfral识别。除了特别记载的情况以外,本说明书中的gdf15这一术语表示成熟gdf15。
114.本说明书中,gdf15这一术语以包括所有物种的gdf15的含义来使用。一个实施方式中,gdf15为人gdf15(hgdf15)。将前hgdf15的代表性氨基酸序列示于序列号1。前hgdf15为包含由29个氨基酸构成的信号肽(下划线)、由167个氨基酸构成的前肽和由112个氨基酸构成的成熟肽(双下划线、hgdf15)这308个氨基酸的多肽。将hgdf15的代表性氨基酸序列示于序列号2,本发明中的hgdf15不限于包含序列号2的氨基酸序列的hgdf15。
115.前hgdf15(序列号1)
[0116][0117]
hgdf15(序列号2)
[0118][0119]
本说明书中的“抗体”这一术语是指对抗原具有结合性的、包含免疫球蛋白或其一部分的分子,以不仅包括天然免疫球蛋白形态的分子、而且包括嵌合抗体、人源化抗体、多特异性抗体、抗体片段等各种结构的分子的含义使用。本说明书中的“单克隆”这一术语是为了与作为分别针对不同表位的多种抗体的混合物的“多克隆抗体”区分而使用的,是指由单一种类的抗体群体得到的抗体。因此,“单克隆抗体”这一术语可表示例如嵌合抗体、人源化抗体、人抗体、多特异性抗体和抗体片段。抗体片段是指含有免疫球蛋白的一部分作为构成要素的分子,例如,非限定性例子可列举抗体的重链和轻链可变区(vh和v
l
)、f(ab')2、fab'、fab、fv、二硫键连接的fv(sdfv)、单链fv(scfv)和它们的聚合物。抗体的种属没有特别限定,可列举例如来自小鼠、大鼠、兔、山羊、人的抗体。
[0120]
本说明书中,“单离”这一术语表示某种生物学上的分子(例如抗体或多核苷酸)与天然环境中的其它成分实质上分离开。
[0121]
抗体的免疫球蛋白类型是基于重链恒定区来确定的。作为免疫球蛋白类型,可列
举iga、igd、ige、igg和igm,这些所对应的重链分别称为α链、δ链、ε链、γ链和μ链。免疫球蛋白类型可以进一步被分成亚类(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。本说明书中的抗体的免疫球蛋白类型和亚类没有特别限定。一个实施方式中,免疫球蛋白类型为igg。抗体的轻链基于其恒定区可分为κ链和λ链,本说明书中的抗体可以具有κ链和λ链中的任意一者。
[0122]
抗体的可变区通常由夹在4个框架区(framework region)(也记作fr)中的3个互补决定区(complementarity determining region)(也记作cdr)构成。fr和cdr通常在轻链和重链中以fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4的顺序存在。已报道了多种定义抗体的可变区、cdr的方法,例如,kabat的定义(sequences of proteins of immunological interest,5th ed.,public health service,national institutes of health,bethesda,md.1991)、chothia的定义(chothia et al.,j.mol.biol.,1987;196:901-917)、abm的定义(martin et al.,proc.natl.acad.sci.usa,1989;86:9268-9272)、contact的定义(maccallum et al.,j.mol.biol.1996;262:732-745)和imgt的定义(lefranc et al.,dev comp immunol.2003;27(1):55-77)等。本说明书中,除了特别记载的情况以外使用kabat的定义。
[0123]
本说明书中,抗hgdf15抗体是指:以足以发挥期望效果的亲和性与hgdf15结合的抗体。本发明的抗hgdf15抗体可以使用hgdf15或其一部分作为免疫原利用常规方法获得。免疫原可利用通常的肽合成法、例如利用基因工程技术或化学合成来制作。或者,本发明的抗体也可以通过使用基因工程技术制作含有抗体基因的表达载体、并使其在细胞中表达而得到。
[0124]
多克隆抗体可通过“antibodies:a laboratory manual,lane,h.d.et al.eds.,cold spring harbor laboratory press,new york,1989”等中记载的常规方法来制作。具体而言,可通过利用上述免疫原免疫大鼠、小鼠、兔、山羊、马等哺乳动物而制作。
[0125]
单克隆抗体可通过制作产生抗体的杂交瘤的方法、使用基因工程技术制作含有抗体基因的表达载体并使其在细胞中表达的方法等公知的方法而获得。
[0126]
分泌单克隆抗体的杂交瘤可基于kohler et al.,nature 256:495,1975中记载的方法而制作。首先,将免疫原与用于提高抗原性的合适物质(例如钥孔血蓝蛋白、牛血清白蛋白等)和根据需要使用的免疫激活剂(弗氏完全佐剂或不完全佐剂等)一起混合,免疫大鼠、小鼠、兔、山羊、马等非人哺乳动物。通常,以3~10天的间隔对免疫动物进行多次免疫,给予1~100μg作为免疫原的肽。接着,从经过多次免疫后的免疫动物中回收免疫活性细胞(免疫动物中具有抗体产生能力的细胞),与无自身抗体产生能力的骨髓瘤细胞(例如来自小鼠、大鼠、豚鼠、仓鼠、兔或人等哺乳动物的细胞)进行细胞融合。细胞融合可使用聚乙二醇法、电融合法等。进而,基于融合细胞所具有的选择标记选择出成功进行了细胞融合的细胞,通过后述的免疫测定法等确认所选择的细胞产生的抗体对免疫源的反应性,由此得到产生目标单克隆抗体的杂交瘤。单克隆抗体可从体外培养所得杂交瘤而得到的培养上清中单离。另外,也可以在小鼠、大鼠、豚鼠、仓鼠或兔等的腹水中等进行体内培养并从腹水中单离。
[0127]
单克隆抗体还可以通过制作含有抗体基因的表达载体、并使其在宿主细胞中表达而得到(p.j.delves.,antibody production essential techniques.,1997wiley;
al.proc.natl.acad.sci.usa 89:4285(1992);presta et al.j.immunol.151:2623(1993))。
[0134]
人抗体例如可通过在体外用期望的抗原致敏人淋巴细胞、接着使致敏淋巴细胞与人骨髓瘤细胞融合而获得(日本特公平1-59878号公报)。进行融合的另一方即人骨髓瘤细胞可利用例如u266等。另外,人抗体也可通过用期望的抗原免疫具有全部人抗体基因的储备库的转基因动物而获得(lonberg,nat.biotech.23:1117-1125,2005)。进而,还已知使用人抗体文库通过淘选获得人抗体的技术(antibody phage display:methods and protocols,methods in molecular biology 178,2001)。例如,利用噬菌体展示法使人抗体的可变区以单链抗体(scfv)形式在噬菌体的表面表达,选择出与抗原结合的噬菌体,对所选择的噬菌体的基因进行分析,从而可确定编码与抗原结合的人抗体的可变区的dna序列。接着,将该可变区序列与人抗体恒定区的序列以框内方式连接,插入合适的表达载体,将该表达载体导入宿主并使其表达,由此可获得人抗体。
[0135]
多特异性抗体为与至少2个不同的部位结合的抗体。作为多特异性抗体,可列举双特异性抗体、三特异性抗体等。一个实施方式中,多特异性抗体与hgdf15和1种以上其它抗原结合。多特异性抗体例如可通过基因工程技术制作,或通过将识别抗原不同的2种以上抗体结合而制作。
[0136]
抗体片段例如可通过利用木瓜蛋白酶、胃蛋白酶等蛋白酶消化抗体而得到。或者,可通过将含有编码抗体片段的多核苷酸的表达载体导入宿主细胞并使其表达而得到(例如co,m.s.et al.,j.immunol.(1994)152,2968-2976;better,m.and horwitz,a.h.,methods enzymol.(1989)178,476-496;pluckthun,a.and skerra,a.,methods enzymol.(1989)178,497-515;lamoyi,e.,methods enzymol.(1986)121,652-663;rousseaux,j.et al.,methods enzymol.(1986)121,663-669;bird,r.e.and walker,b.w.,trends biotechnol.(1991)9,132-137;hudson et al.,nat.med.,(2003)9,129-134)。
[0137]
如上所述,抗体可通过将含有编码该抗体的多核苷酸的表达载体导入细胞并使其表达而得到。具体而言,构建表达载体,使得编码抗体的序列在增强子、启动子等表达控制区控制下表达,用该表达载体转化宿主细胞使其表达抗体。
[0138]
即,本发明还提供编码抗hgdf15抗体的多核苷酸、含有上述多核苷酸的表达载体和含有能表达上述抗体的多核苷酸的转化细胞。
[0139]
作为宿主细胞,例如,可使用动物细胞、植物细胞、真菌细胞等真核细胞。作为动物细胞,可列举哺乳类细胞(例如cho、cos、nih3t3、骨髓瘤、bhk(baby hamster kidney,叙利亚仓鼠肾细胞)、hela、vero)、两栖动物类细胞(例如非洲爪蟾卵母细胞)或昆虫细胞(例如sf9、sf21、tn5)。作为真菌细胞,可列举酵母(例如,酵母(saccharomyces)属,例如酿酒酵母(saccharomyces cerevisiae))、丝状菌(例如曲霉(aspergillus)属、例如黑曲霉(aspergillus niger))等。另外,也可以使用大肠杆菌(e.coli)(例如jm109、dh5α、hb101等)、枯草杆菌等原核细胞作为宿主细胞。载体向宿主细胞的导入例如可利用磷酸钙法、deae葡聚糖法、电穿孔法、脂质体转染等方法来进行。
[0140]
得到的抗体与抗原的结合可通过酶免疫测定法(eia)(包括elisa)、放射免疫测定法(ria)、化学发光免疫测定法(cia)、荧光免疫测定法(fia)等免疫测定法、biacore(注册商标)表面等离子共振测定等来确认。抗体与抗原的结合还可通过竞争试验来确认。例如,
可通过调查所得抗体是否与已确认可与hgdf15结合的抗hgdf15抗体进行竞争来进行确认。
[0141]
本说明书中,与规定的抗hgdf15抗体(即,参照抗体)进行竞争的抗体是指:在实施例记载的条件下进行测定时,使参照抗体与hgdf15的结合显著减少的抗体。一个实施方式中,本发明的抗体使参照抗体与hgdf15的结合减少10%、20%、30%、40%、50%、60%、70%、80%、90%、或95%以上。
[0142]
一个实施方式中,本发明的抗hgdf15抗体与包含氨基酸序列dhcplgpgrccrlh(序列号3)的hgdf15的表位结合。序列号3的氨基酸序列相当于序列号2的第5~18位的氨基酸残基。可通过调查是否与包含含有序列号8的氨基酸序列的重链可变区和含有序列号9的氨基酸序列的轻链可变区的抗体竞争与hgdf15结合,来确认是否与包含氨基酸序列dhcplgpgrccrlh(序列号3)的表位结合。
[0143]
另一个实施方式中,本发明的抗hgdf15抗体与规定的抗hgdf15抗体竞争与hgdf15结合。一个实施方式中,本发明的抗体与包含含有序列号8的氨基酸序列的重链可变区和含有序列号9的氨基酸序列的轻链可变区的抗体竞争与hgdf15结合。
[0144]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0145]
所述重链可变区含有:
[0146]
含有序列号4的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0147]
含有序列号4的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0148]
含有序列号4的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0149]
所述轻链可变区含有:
[0150]
含有序列号5的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0151]
含有序列号5的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0152]
含有序列号5的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3;
[0153]
本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0154]
所述重链可变区含有:
[0155]
含有序列号133的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0156]
含有序列号133的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0157]
含有序列号133的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0158]
所述轻链可变区含有:
[0159]
含有序列号134的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0160]
含有序列号134的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0161]
含有序列号134的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3;或者,
[0162]
本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0163]
所述重链可变区含有:
[0164]
含有序列号135的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0165]
含有序列号135的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0166]
含有序列号135的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0167]
所述轻链可变区含有:
[0168]
含有序列号136的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0169]
含有序列号136的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0170]
含有序列号136的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
[0171]
本实施方式中,cdr可利用任何方法来确定。规定的重链可变区或轻链可变区所含的cdr是指:由利用任一方法从上述规定的重链可变区或轻链可变区中确定的氨基酸序列构成的cdr,含有该cdr的重链可变区或轻链可变区中,cdr以外的序列可以与上述规定的重链可变区或轻链可变区不同。本领域技术人员可以考虑各种条件通过合适的方法来确定cdr。一个实施方式中,cdr由选自kabat、chothia、abm、contact和imgt中的任一定义来确定。
[0172]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0173]
所述重链可变区含有:
[0174]
含有序列号18的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0175]
含有序列号19的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0176]
含有序列号20的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0177]
所述轻链可变区含有:
[0178]
含有序列号21的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0179]
含有序列号22的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0180]
含有序列号23的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改
变的氨基酸序列的cdr3。
[0181]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0182]
所述重链可变区含有:
[0183]
含有选自序列号18、38~44和149~150中的任一氨基酸序列的cdr1;
[0184]
含有选自序列号19、45~48、52~66和151~153中的任一氨基酸序列的cdr2;和
[0185]
含有选自序列号20、49、50和67~80中的任一氨基酸序列的cdr3,
[0186]
所述轻链可变区含有:
[0187]
含有选自序列号21、81~89、100~104和154中的任一氨基酸序列的cdr1;
[0188]
含有选自序列号22、90、106~115和155~157中的任一氨基酸序列的cdr2;和
[0189]
含有选自序列号23、91~99和118~132中的任一氨基酸序列的cdr3。
[0190]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0191]
所述重链可变区含有:
[0192]
含有选自序列号18、38~42和149~150中的任一氨基酸序列的cdr1;
[0193]
含有选自序列号19、46~48、52~66和151~152中的任一氨基酸序列的cdr2;和
[0194]
含有选自序列号20、71、73、77和79中的任一氨基酸序列的cdr3,
[0195]
所述轻链可变区含有:
[0196]
含有选自序列号21、81~83、85~89、100~104和154中的任一氨基酸序列的cdr1;
[0197]
含有选自序列号22、90、106、108~111、113~115和155~157中的任一氨基酸序列的cdr2;和
[0198]
含有选自序列号23、93、95~99、121、122、124、125、131和132中的任一氨基酸序列的cdr3。
[0199]
另一个实施方式中,本发明的抗hgdf15抗体含有选自下述(1)~(3)中的任一重链可变区以及选自下述(4)~(6)中的任意轻链可变区:
[0200]
(1)重链可变区,其含有:
[0201]
含有选自序列号18、38~44和149~150中的任一氨基酸序列的cdr1;
[0202]
含有序列号19的氨基酸序列的cdr2;和
[0203]
含有序列号20的氨基酸序列的cdr3;
[0204]
(2)重链可变区,其含有:
[0205]
含有序列号18的氨基酸序列的cdr1;
[0206]
含有选自序列号19、45~48、52~66和151~153中的任一氨基酸序列的cdr2;和
[0207]
含有序列号20的氨基酸序列的cdr3;
[0208]
(3)重链可变区,其含有:
[0209]
含有序列号18的氨基酸序列的cdr1;
[0210]
含有序列号19的氨基酸序列的cdr2;和
[0211]
含有选自序列号20、49、50和67~80中的任一氨基酸序列的cdr3;
[0212]
(4)轻链可变区,其含有:
[0213]
选自序列号21、81~89、100~104和154中的任一氨基酸序列的cdr1;
[0214]
含有序列号22的氨基酸序列的cdr2;和
[0215]
含有序列号23的氨基酸序列的cdr3;
[0216]
(5)轻链可变区,其含有:
[0217]
含有序列号21的氨基酸序列的cdr1;
[0218]
含有选自序列号22、90、106~115和155~157中的任一氨基酸序列的cdr2;和
[0219]
含有序列号23的氨基酸序列的cdr3;
[0220]
(6)轻链可变区,其含有:
[0221]
含有序列号21的氨基酸序列的cdr1;
[0222]
含有序列号22的氨基酸序列的cdr2;和
[0223]
含有选自序列号23、91~99和118~132中的任一氨基酸序列的cdr3。
[0224]
另一个实施方式中,本发明的抗hgdf15抗体含有选自下述(1)~(3)中的任一重链可变区以及选自下述(4)~(6)中的任一轻链可变区:
[0225]
(1)重链可变区,其含有:
[0226]
含有选自序列号18、38~42和149~150中的任一氨基酸序列的cdr1;
[0227]
含有序列号19的氨基酸序列的cdr2;和
[0228]
含有序列号20的氨基酸序列的cdr3;
[0229]
(2)重链可变区,其含有:
[0230]
含有序列号18的氨基酸序列的cdr1;
[0231]
含有选自序列号19、46~48、52~66和151~152中的任一氨基酸序列的cdr2;和
[0232]
含有序列号20的氨基酸序列的cdr3;
[0233]
(3)重链可变区,其含有:
[0234]
含有序列号18的氨基酸序列的cdr1;
[0235]
含有序列号19的氨基酸序列的cdr2;和
[0236]
含有选自序列号20、71、73、77和79中的任一氨基酸序列的cdr3;
[0237]
(4)轻链可变区,其含有:
[0238]
含有选自序列号21、81~83、85~89、100~104和154中的任一氨基酸序列的cdr1;
[0239]
含有序列号22的氨基酸序列的cdr2;和
[0240]
含有序列号23的氨基酸序列的cdr3;
[0241]
(5)轻链可变区,其含有:
[0242]
含有序列号21的氨基酸序列的cdr1;
[0243]
含有选自序列号22、90、106、108~111、113~115和155~157中的任一氨基酸序列的cdr2;和
[0244]
含有序列号23的氨基酸序列的cdr3;
[0245]
(6)轻链可变区,其含有:
[0246]
含有序列号21的氨基酸序列的cdr1;
[0247]
含有序列号22的氨基酸序列的cdr2;和
[0248]
含有选自序列号23、93、95~99、121、122、124、125、131和132中的任一氨基酸序列的cdr3。
[0249]
另一个实施方式中,本发明的抗hgdf15抗体含有选自下述(1)~(3)中的任一重链可变区以及选自下述(4)~(6)中的任一轻链可变区:
[0250]
(1)重链可变区,其含有:
[0251]
含有选自序列号18、38和39中的任一氨基酸序列的cdr1;
[0252]
含有序列号19的氨基酸序列的cdr2;和
[0253]
含有序列号20的氨基酸序列的cdr3;
[0254]
(2)重链可变区,其含有:
[0255]
含有序列号18的氨基酸序列的cdr1;
[0256]
含有选自序列号19、52和66中的任一氨基酸序列的cdr2;和
[0257]
含有序列号20的氨基酸序列的cdr3;
[0258]
(3)重链可变区,其含有:
[0259]
含有序列号18的氨基酸序列的cdr1;
[0260]
含有序列号19的氨基酸序列的cdr2;和
[0261]
含有选自序列号20和77中的任一氨基酸序列的cdr3;
[0262]
(4)轻链可变区,其含有:
[0263]
含有选自序列号21和85中的任一氨基酸序列的cdr1;
[0264]
含有序列号22的氨基酸序列的cdr2;和
[0265]
含有序列号23的氨基酸序列的cdr3;
[0266]
(5)轻链可变区,其含有:
[0267]
含有序列号21的氨基酸序列的cdr1;
[0268]
含有选自序列号22、155和157中的任一氨基酸序列的cdr2;和
[0269]
含有序列号23的氨基酸序列的cdr3;
[0270]
(6)轻链可变区,其含有:
[0271]
含有序列号21的氨基酸序列的cdr1;
[0272]
含有序列号22的氨基酸序列的cdr2;和
[0273]
含有选自序列号23和95中的任一氨基酸序列的cdr3。
[0274]
另一个实施方式中,本发明的抗hgdf15抗体含有:
[0275]
(i)重链可变区,其含有:
[0276]
含有选自序列号18、38~44和149~150中的任一氨基酸序列的cdr1;
[0277]
含有序列号19的氨基酸序列的cdr2;和
[0278]
含有序列号20的氨基酸序列的cdr3,以及,
[0279]
轻链可变区,其含有:
[0280]
含有序列号21的氨基酸序列的cdr1;
[0281]
含有序列号22的氨基酸序列的cdr2;和
[0282]
含有序列号23的氨基酸序列的cdr3;
[0283]
(ii)重链可变区,其含有:
[0284]
含有序列号18的氨基酸序列的cdr1;
[0285]
含有选自序列号19、45~48、52~66和151~153中的任一氨基酸序列的cdr2;和
[0286]
含有序列号20的氨基酸序列的cdr3,以及,
[0287]
轻链可变区,其含有:
[0288]
含有序列号21的氨基酸序列的cdr1;
[0289]
含有序列号22的氨基酸序列的cdr2;和
[0290]
含有序列号23的氨基酸序列的cdr3;
[0291]
(iii)重链可变区,其含有:
[0292]
含有序列号18的氨基酸序列的cdr1;
[0293]
含有序列号19的氨基酸序列的cdr2;和
[0294]
含有选自序列号20、49、50和67~80中的任一氨基酸序列的cdr3,以及,
[0295]
轻链可变区,其含有:
[0296]
含有序列号21的氨基酸序列的cdr1;
[0297]
含有序列号22的氨基酸序列的cdr2;和
[0298]
含有序列号23的氨基酸序列的cdr3;
[0299]
(iv)重链可变区,其含有:
[0300]
含有序列号18的氨基酸序列的cdr1;
[0301]
含有序列号19的氨基酸序列的cdr2;和
[0302]
含有序列号20的氨基酸序列的cdr3,以及,
[0303]
轻链可变区,其含有:
[0304]
含有选自序列号21、81~89、100~104和154中的任一氨基酸序列的cdr1;
[0305]
含有序列号22的氨基酸序列的cdr2;和
[0306]
含有序列号23的氨基酸序列的cdr3;
[0307]
(v)重链可变区,其含有:
[0308]
含有序列号18的氨基酸序列的cdr1;
[0309]
含有序列号19的氨基酸序列的cdr2;和
[0310]
含有序列号20的氨基酸序列的cdr3,以及,
[0311]
轻链可变区,其含有:
[0312]
含有序列号21的氨基酸序列的cdr1;
[0313]
含有选自序列号22、90、106~115和155~157中的任一氨基酸序列的cdr2;和
[0314]
含有序列号23的氨基酸序列的cdr3,或者,
[0315]
(vi)重链可变区,其含有:
[0316]
含有序列号18的氨基酸序列的cdr1;
[0317]
含有序列号19的氨基酸序列的cdr2;和
[0318]
含有序列号20的氨基酸序列的cdr3,以及,
[0319]
轻链可变区,其含有:
[0320]
含有序列号21的氨基酸序列的cdr1;
[0321]
含有序列号22的氨基酸序列的cdr2;和
[0322]
含有选自序列号23、91~99和118~132中的任一氨基酸序列的cdr3。
[0323]
另一个实施方式中,本发明的抗hgdf15抗体含有:
[0324]
(i)重链可变区,其含有:
[0325]
含有选自序列号18、38~42和149~150中的任一氨基酸序列的cdr1;
[0326]
含有序列号19的氨基酸序列的cdr2;和
[0327]
含有序列号20的氨基酸序列的cdr3,以及,
[0328]
轻链可变区,其含有:
[0329]
含有序列号21的氨基酸序列的cdr1;
[0330]
含有序列号22的氨基酸序列的cdr2;和
[0331]
含有序列号23的氨基酸序列的cdr3;
[0332]
(ii)重链可变区,其含有:
[0333]
含有序列号18的氨基酸序列的cdr1;
[0334]
含有选自序列号19、45~48、52~66和151~152中的任一氨基酸序列的cdr2;和
[0335]
含有序列号20的氨基酸序列的cdr3,以及,
[0336]
轻链可变区,其含有:
[0337]
含有序列号21的氨基酸序列的cdr1;
[0338]
含有序列号22的氨基酸序列的cdr2;和
[0339]
含有序列号23的氨基酸序列的cdr3;
[0340]
(iii)重链可变区,其含有:
[0341]
含有序列号18的氨基酸序列的cdr1;
[0342]
含有序列号19的氨基酸序列的cdr2;和
[0343]
含有选自序列号20、71、73、77和79中的任一氨基酸序列的cdr3,以及,
[0344]
轻链可变区,其含有:
[0345]
含有序列号21的氨基酸序列的cdr1;
[0346]
含有序列号22的氨基酸序列的cdr2;和
[0347]
含有序列号23的氨基酸序列的cdr3;
[0348]
(iv)重链可变区,其含有:
[0349]
含有序列号18的氨基酸序列的cdr1;
[0350]
含有序列号19的氨基酸序列的cdr2;和
[0351]
含有序列号20的氨基酸序列的cdr3,以及,
[0352]
轻链可变区,其含有:
[0353]
含有选自序列号21、81~83、85~89、100~104和154中的任一氨基酸序列的cdr1;
[0354]
含有序列号22的氨基酸序列的cdr2;和
[0355]
含有序列号23的氨基酸序列的cdr3;
[0356]
(v)重链可变区,其含有:
[0357]
含有序列号18的氨基酸序列的cdr1;
[0358]
含有序列号19的氨基酸序列的cdr2;和
[0359]
含有序列号20的氨基酸序列的cdr3,以及,
[0360]
轻链可变区,其含有:
[0361]
含有序列号21的氨基酸序列的cdr1;
[0362]
含有选自序列号22、90、106、108~111、113~115和155~157中的任一氨基酸序列的cdr2;和
[0363]
含有序列号23的氨基酸序列的cdr3,或者,
[0364]
(vi)重链可变区,其含有:
[0365]
含有序列号18的氨基酸序列的cdr1;
[0366]
含有序列号19的氨基酸序列的cdr2;和
[0367]
含有序列号20的氨基酸序列的cdr3,
[0368]
轻链可变区,其含有:
[0369]
含有序列号21的氨基酸序列的cdr1;
[0370]
含有序列号22的氨基酸序列的cdr2;和
[0371]
含有选自序列号23、93、95~99、121、122、124、125、131和132中的任一氨基酸序列的cdr3。
[0372]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0373]
所述重链可变区含有:
[0374]
含有序列号137的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0375]
含有序列号138氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0376]
含有序列号139的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0377]
所述轻链可变区含有:
[0378]
含有序列号140的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0379]
含有序列号141的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0380]
含有序列号142的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
[0381]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0382]
所述重链可变区含有:
[0383]
含有序列号143的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0384]
含有序列号144的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0385]
含有序列号145的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0386]
所述轻链可变区含有:
[0387]
含有序列号146的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0388]
含有序列号147的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0389]
含有序列号148的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
[0390]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0391]
所述重链可变区含有:
[0392]
与序列号8的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸
序列、或序列号8的氨基酸序列、或序列号8的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列;
[0393]
所述轻链可变区含有:
[0394]
与序列号9的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号9的氨基酸序列、或序列号9的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列。
[0395]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0396]
所述重链可变区含有:
[0397]
序列号8的氨基酸序列、或序列号8的氨基酸序列中包含选自h48r、h49r、h49d、h50r、h50s、h50f、h52r、h52q、h72r、h73d、h73r、h73y、h119r、h119f、h48s、h71y、h72a、h72l、h72n、h72t、h72w、h75h、h75l、h75n、h75q、h79h、h79k、h79q、h79r、h83r、h117q、h119e、h119h、h119k、h119n、h119q、h119s、h119t、h120a、h120d、h120f、h120n、h120q、h122f、h54t、h54n、h71r、h71h和h77i中的任意氨基酸置换的氨基酸序列;
[0398]
所述轻链可变区含有:
[0399]
序列号9的氨基酸序列、或序列号9的氨基酸序列中包含选自l47r、l48e、l48r、l48s、l48k、l50d、l50r、l50f、l50y、l73r、l111f、l111y、l112e、l112r、l112d、l112f、l113d、l113r、l113f、l48h、l48y、l50q、l50w、l51q、l69y、l70f、l70h、l72d、l72e、l72r、l72y、l73k、l73n、l73y、l75q、l87k、l87n、l111a、l111n、l111s、l112h、l112q、l112t、l112y、l113s、l114f、l114h、l114i、l114n、l114y、l116h、l116y、l51y、l72f、l73q和l74h中的任意氨基酸置换的氨基酸序列。
[0400]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0401]
所述重链可变区含有:
[0402]
序列号8的氨基酸序列、或序列号8的氨基酸序列中包含选自h49r、h49d、h50r、h50s、h50f、h73d、h73r、h73y、h48s、h71y、h72a、h72l、h72n、h72t、h72w、h75h、h75l、h75n、h75q、h79h、h79k、h79q、h79r、h83r、h119n、h119s、h120f、h120q、h54t、h54n、h71r和h71h中的任意氨基酸置换的氨基酸序列;
[0403]
所述轻链可变区含有:
[0404]
序列号9的氨基酸序列、或序列号9的氨基酸序列中包含选自l47r、l48e、l48r、l48k、l50d、l50r、l50f、l50y、l73r、l112e、l112d、l112f、l113d、l113r、l113f、l48h、l48y、l50q、l50w、l51q、l70f、l72d、l72e、l72r、l72y、l73n、l73y、l75q、l112h、l112q、l112y、l113s、l116h、l116y、l51y、l72f、l73q和l74h中的任意氨基酸置换的氨基酸序列。
[0405]
另一个实施方式中,本发明的抗hgdf15抗体含有重链可变区和轻链可变区,
[0406]
所述重链可变区含有:
[0407]
序列号8的氨基酸序列、或序列号8的氨基酸序列中包含选自h49r、h49d、h48s、h71y、h83r和h120f中的任意氨基酸置换的氨基酸序列;
[0408]
所述轻链可变区含有:
[0409]
序列号9的氨基酸序列、或序列号9的氨基酸序列中包含选自l48k、l112d、l72f和l74h中的任意氨基酸置换的氨基酸序列。
[0410]
这些实施方式中,氨基酸置换以表示置换前的氨基酸残基的缩写、表示其位置的
数字和表示置换后的氨基酸残基的缩写来示出。例如,“h48r”表示第48位的组氨酸残基被置换为精氨酸残基。
[0411]
另一个实施方式中,本发明的抗hgdf15抗体包含含有序列号8的氨基酸序列的重链可变区以及含有序列号9的氨基酸序列的轻链可变区。
[0412]
另一个实施方式中,本发明的抗hgdf15抗体含有:
[0413]
重链可变区,其含有与序列号4的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号4的氨基酸序列、或序列号4的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列,以及,
[0414]
轻链可变区,其含有与序列号5的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号5的氨基酸序列、或序列号5的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列;
[0415]
重链可变区,其含有与序列号6的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号6的氨基酸序列、或序列号6的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列,以及,
[0416]
轻链可变区,其含有与序列号7的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号7的氨基酸序列、或序列号7的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列;
[0417]
重链可变区,其含有与序列号133的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号133的氨基酸序列、或序列号133的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列,以及,
[0418]
轻链可变区,其含有与序列号134的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号134的氨基酸序列、或序列号134的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列;或者,
[0419]
重链可变区,其含有与序列号135的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号135的氨基酸序列、或序列号135的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列,以及,
[0420]
轻链可变区,其含有与序列号136的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号136的氨基酸序列、或序列号136的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列。
[0421]
本说明书中,氨基酸的改变包括氨基酸的缺失、置换、插入和添加。改变可以为缺失、置换、插入和添加中的任一种,也可以为这些中的2种以上的组合。改变的数量没有限定,例如为1~20个、1~15个、1~10个、1~5个或1~3个。一个实施方式中,氨基酸的改变为氨基酸的置换。另一个实施方式中,氨基酸的改变为1~3个氨基酸的改变。另一个实施方式中,氨基酸的改变为1个氨基酸的置换。
[0422]
本说明书中,“含有”规定的氨基酸序列的氨基酸序列包括在该规定的氨基酸序列中添加1个以上氨基酸残基而成的氨基酸序列、以及由该规定的氨基酸序列构成的序列。
[0423]
本说明书中,包含与规定的重链可变区或轻链可变区的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列的重链可变区或轻链可变区、以及包含规定的重链可变区或轻链可变区的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或
1~3个氨基酸残基发生了改变的氨基酸序列的重链可变区或轻链可变区包括该规定的重链可变区或轻链可变区的氨基酸序列中的cdr未发生改变的重链可变区或轻链可变区。
[0424]
本说明书中的、关于氨基酸序列的“序列一致性”,是指以比较对象序列整个区域达到最佳状态(一致性达到最大的状态)来排列的2个序列间的、一致的氨基酸残基的比例。在此,比较对象序列在2个序列的最佳排列中可具有添加或缺失(例如空位等)。序列一致性可使用公共数据库(例如ddbj(http://www.ddbj.nig.ac.jp))所提供的fasta、blast、clustal w等程序来计算。或者,也可以使用市售的序列分析软件(例如vector nti(注册商标)软件、genetyx(注册商标)ver.12)来求出。
[0425]
作为改变氨基酸序列而得到具有期望特性的抗体的方法,已知有各种方法。例如,改善了结合亲和性的突变体可利用基于噬菌体展示的方法得到。该方法中,例如可利用丙氨酸扫描诱变法鉴定影响抗体与抗原的相互作用的氨基酸残基、或分析抗原抗体复合物的晶体结构来鉴定抗体与抗原之间的接触点等,从而确定突变导入部位。利用易错pcr、定点诱变等制作该部位的氨基酸发生了改变的突变体,对得到的突变体文库进行筛选,由此可得到具有期望特性的突变体。
[0426]
本发明的抗体具有降低血中gdf15浓度的作用。可如下确认是否具有该作用:如实施例记载那样,对于移植了表达gdf15的癌细胞的动物,评价与对照抗体相比血中gdf15浓度是否显著减少。虽然不受任何理论约束,但是认为本发明的抗体通过抑制前gdf15的切断来降低血中gdf15浓度。本发明的抗体另外可能具有与成熟gdf15结合、抑制自gdf15起的信号转导的作用。
[0427]
本发明的抗体可通过降低血中gdf15浓度(有时还通过抑制gdf15的信号转导)而发挥改善体重减轻、食欲不振、昼夜节律障碍等症状的作用。
[0428]
关于抗体,为了调节抗体依赖性细胞杀伤(adcc)活性、补体依赖性细胞杀伤(cdc)活性或体内代谢,可以选择免疫球蛋白亚类,也可以改造fc区的氨基酸序列或糖链。例如,可选择igg4以降低补体活化能力。另外,可进行降低或增强与fc受体或c1q的结合性的改造,可进行提高与fcrn的结合亲和性的改造等以延长血中半衰期。
[0429]
另外,抗体可以与例如聚乙二醇(peg)、聚丙二醇、聚氧化烯、或聚乙二醇与聚丙二醇的共聚物等聚合物结合,以延长抗体的血中半衰期或改善抗体的稳定性等。
[0430]
另外,抗体可以与化学疗法药、毒性肽、放射性同位素等结合。作为化学疗法药,可列举:顺铂、卡铂、奥沙立铂、氮芥、环磷酰胺、苯丁酸氮芥和异环磷酰胺等烷基化剂;硫唑嘌呤和巯基嘌呤等代谢拮抗剂;长春花碱(例如长春新碱、长春碱、长春瑞滨和长春地辛)、紫衫烷(紫衫醇、多西紫衫醇)、依托泊苷和替尼泊苷等生物碱;喜树碱(例如伊替立康和拓扑替康)等拓扑异构酶抑制剂;放线菌素、蒽环类、阿霉素、柔红霉素、伐柔比星、伊达比星、表柔比星、博来霉素、普卡霉素和丝裂霉素等细胞毒性抗生素等。
[0431]
本发明的抗体可作为药物组合物的有效成分使用。本发明的抗体具有降低血中gdf15浓度的作用(有时还具有抑制gdf15的信号转导的作用),对与gdf15相关的疾病或症状的处置有用。作为与gdf15相关的疾病或症状,可列举体重减轻、食欲不振、肌肉减少、活动性下降、昼夜节律障碍、脑垂体激素分泌异常、体温调节功能障碍、恶病质、癌症、糖尿病、肾衰竭、心力衰竭、aids、copd、多发性硬化、类风湿性关节炎、败血症、结核、肌肉减少症、癌症骨转移、抗癌剂引起的恶心呕吐、妊娠剧吐、慢性骨髓增生性疾病(例如骨髓纤维化、真性
红细胞增多、原发性血小板血症)、神经性厌食症、双向情感障碍、线粒体病、icu相关肌无力等。
[0432]
一个实施方式中,恶病质为与癌症、糖尿病、肾衰竭、心力衰竭、aids、copd、多发性硬化、类风湿性关节炎、败血症、或结核相伴随的恶病质。另一个实施方式中,恶病质为癌症恶病质。恶病质的处置包括选自体重减轻、食欲不振、肌肉减少、活动性下降、昼夜节律障碍、脑垂体激素分泌异常和体温调节功能障碍中的1种以上症状的改善。
[0433]
作为癌症,没有限定,可列举胃癌、食道癌、大肠癌、肺癌、胰腺癌、肾癌、前列腺癌、卵巢癌、乳腺癌、宫颈癌、子宫体癌、睾丸癌、膀胱癌、甲状腺癌、肝细胞癌、肝内胆管癌、头颈部癌、白血病、多发性骨髓瘤、淋巴瘤、脑瘤、神经胶质瘤、黑素瘤等。
[0434]
本发明的抗体可以以能发挥期望效果(例如与gdf15相关的疾病或症状的治疗)的量(本说明书中称为有效量)给药于对象。抗体的给药量可根据给药方法、给药对象的年龄、体重、健康状态等适宜选择。例如,可按成人1天10μg/kg~100mg/kg、100μg/kg~10mg/kg、或1mg/kg~10mg/kg每天给药、或者数天、1周、数周、1个月或数月1次给药,但是不限于此。抗体的给药方法也可根据给药对象的年龄、体重、健康状态等适宜选择。给药方法可以为经口给药,也可以为非经口给药,优选非经口给药。作为非经口给药,可列举皮下给药、皮内给药、肌肉内给药、静脉内给药等,优选静脉内给药。
[0435]
本说明书中,“对象”为哺乳动物。作为哺乳动物,可列举例如小鼠、大鼠、兔、猫、狗、绵羊、猪、马、牛、猴和人,但不限定为这些。一个实施方式中,对象为人。
[0436]
药物组合物可按照常规方法制剂化。药物组合物中,除了抗体以外还可含有灭菌水、生理盐水、稳定剂、赋形剂、抗氧化剂、缓冲剂、防腐剂、表面活性剂、螯合剂、结合剂等药物上允许的载体或添加剂。
[0437]
本发明的抗体可以与其它治疗药组合使用。本说明书中,组合使用2种以上有效成分时,可以在同一组合物中含有其全部或一部分有效成分,也可以使全部药剂包含在不同的组合物中。另外,2种以上有效成分的给药日程可以相同也可以不同。
[0438]
一个实施方式中,本发明的抗体与癌症治疗药组合使用。作为癌症治疗药,没有限定,可列举:顺铂、卡铂、奥沙立铂、氮芥、环磷酰胺、苯丁酸氮芥和异环磷酰胺等烷基化剂;硫唑嘌呤和巯基嘌呤等代谢拮抗剂;长春花碱(例如长春新碱、长春碱、长春瑞滨和长春地辛)、紫衫烷(紫衫醇、多西紫衫醇)、依托泊苷和替尼泊苷等生物碱;喜树碱(例如伊替立康和拓扑替康)等拓扑异构酶抑制剂;放线菌素、蒽环类、阿霉素、柔红霉素、伐柔比星、伊达比星、表柔比星、博来霉素、普卡霉素和丝裂霉素等细胞毒性抗生素;egfr抑制剂、her2抑制剂、alk抑制剂、vegfr抑制剂等分子靶向药;抗pd-1抗体、抗pd-l1抗体等免疫检查点抑制剂。
[0439]
以下记载本发明的例示性实施方式。
[0440]
[1]
[0441]
一种抗hgdf15抗体,其与包含氨基酸序列dhcplgpgrccrlh(序列号3)的hgdf15的表位结合。
[0442]
[2]
[0443]
根据上述1所述的抗体,其含有重链可变区和轻链可变区,
[0444]
所述重链可变区含有:
[0445]
含有序列号4的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0446]
含有序列号4的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0447]
含有序列号4的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0448]
所述轻链可变区含有:
[0449]
含有序列号5的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0450]
含有序列号5的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0451]
含有序列号5的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
[0452]
[3]
[0453]
根据上述1或2所述的抗体,其含有重链可变区和轻链可变区,
[0454]
所述重链可变区含有:
[0455]
含有序列号18的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0456]
含有序列号19的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0457]
含有序列号20的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0458]
所述轻链可变区含有:
[0459]
含有序列号21的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0460]
含有序列号22的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0461]
含有序列号23的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
[0462]
[4]
[0463]
一种抗hgdf15抗体,其含有重链可变区和轻链可变区,
[0464]
所述重链可变区含有:
[0465]
含有序列号4的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0466]
含有序列号4的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0467]
含有序列号4的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0468]
所述轻链可变区含有:
[0469]
含有序列号5的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0470]
含有序列号5的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0471]
含有序列号5的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
[0472]
[5]
[0473]
一种抗hgdf15抗体,其含有重链可变区和轻链可变区,
[0474]
所述重链可变区含有:
[0475]
含有序列号18的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0476]
含有序列号19的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0477]
含有序列号20的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0478]
所述轻链可变区含有:
[0479]
含有序列号21的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0480]
含有序列号22的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0481]
含有序列号23的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
[0482]
[6]
[0483]
根据上述2~5中任一项所述的抗体,其中,上述1~3个氨基酸残基的改变为1个氨基酸残基的改变。
[0484]
[7]
[0485]
根据上述2~6中任一项所述的抗体,其中,上述氨基酸残基的改变为氨基酸残基的置换。
[0486]
[8]
[0487]
根据上述2~7中任一项所述的抗体,其中,上述1~3个氨基酸残基的改变为1个氨基酸残基的置换。
[0488]
[9]
[0489]
根据上述1~8中任一项所述的抗体,其含有重链可变区,所述重链可变区包含含有序列号20的氨基酸序列的cdr3。
[0490]
[10]
[0491]
根据上述1~9中任一项所述的抗体,其含有轻链可变区,所述轻链可变区包含含有序列号23的氨基酸序列的cdr3。
[0492]
[11]
[0493]
根据上述1~10中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0494]
所述重链可变区含有:
[0495]
含有选自序列号18、38~44和149~150中的任一氨基酸序列的cdr1;
[0496]
含有选自序列号19、45~48、52~66和151~153中的任一氨基酸序列的cdr2;和
[0497]
含有选自序列号20、49、50和67~80中的任一氨基酸序列的cdr3,
[0498]
所述轻链可变区含有:
[0499]
含有选自序列号21、81~89、100~104和154中的任一氨基酸序列的cdr1;
[0500]
含有选自序列号22、90、106~115和155~157中的任一氨基酸序列的cdr2;和
[0501]
含有选自序列号23、91~99和118~132中的任一氨基酸序列的cdr3。
[0502]
[12]
[0503]
根据上述1~11中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0504]
所述重链可变区含有:
[0505]
含有选自序列号18、38~42和149~150中的任一氨基酸序列的cdr1;
[0506]
含有选自序列号19、46~48、52~66和151~152中的任一氨基酸序列的cdr2;和
[0507]
含有选自序列号20、71、73、77和79中的任一氨基酸序列的cdr3,
[0508]
所述轻链可变区含有:
[0509]
含有选自序列号21、81~83、85~89、100~104和154中的任一氨基酸序列的cdr1;
[0510]
含有选自序列号22、90、106、108~111、113~115和155~157中的任一氨基酸序列的cdr2;和
[0511]
含有选自序列号23、93、95~99、121、122、124、125、131和132中的任一氨基酸序列的cdr3。
[0512]
[13]
[0513]
根据上述1~12中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0514]
所述重链可变区含有:
[0515]
含有选自序列号18和38~44中的任一氨基酸序列的cdr1;
[0516]
含有选自序列号19、45~48和52~66中的任一氨基酸序列的cdr2;和
[0517]
含有选自序列号20、49、50和67~80中的任一氨基酸序列的cdr3,
[0518]
所述轻链可变区含有:
[0519]
含有选自序列号21、81~89和100~104中的任一氨基酸序列的cdr1;
[0520]
含有选自序列号22、90和106~115中的任一氨基酸序列的cdr2;和
[0521]
含有选自序列号23、91~99和118~132中的任一氨基酸序列的cdr3。
[0522]
[14]
[0523]
根据上述1~13中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0524]
所述重链可变区含有:
[0525]
含有选自序列号18和38~42中的任一氨基酸序列的cdr1;
[0526]
含有选自序列号19、46~48和52~66中的任一氨基酸序列的cdr2;和
[0527]
含有选自序列号20、71、73、77和79中的任一氨基酸序列的cdr3,
[0528]
所述轻链可变区含有:
[0529]
含有选自序列号21、81~83、85~89和100~104中的任一氨基酸序列的cdr1;
[0530]
含有选自序列号22、90、106、108~111和113~115中的任一氨基酸序列的cdr2;和
[0531]
含有选自序列号23、93、95~99、121、122、124、125、131和132中的任一氨基酸序列的cdr3。
[0532]
[15]
[0533]
根据上述1~14中任一项所述的抗体,其含有选自下述(1)~(3)中的任一重链可变区以及选自下述(4)~(6)中的任一轻链可变区:
[0534]
(1)重链可变区,其含有:
[0535]
含有选自序列号18、38~44和149~150中的任一氨基酸序列的cdr1;
[0536]
含有序列号19的氨基酸序列的cdr2;和
[0537]
含有序列号20的氨基酸序列的cdr3;
[0538]
(2)重链可变区,其含有:
[0539]
含有序列号18的氨基酸序列的cdr1;
[0540]
含有选自序列号19、45~48、52~66和151~153中的任一氨基酸序列的cdr2;和
[0541]
含有序列号20的氨基酸序列的cdr3;
[0542]
(3)重链可变区,其含有:
[0543]
含有序列号18的氨基酸序列的cdr1;
[0544]
含有序列号19的氨基酸序列的cdr2;和
[0545]
含有选自序列号20、49、50和67~80中的任一氨基酸序列的cdr3;
[0546]
(4)轻链可变区,其含有:
[0547]
含有选自序列号21、81~89、100~104和154中的任一氨基酸序列的cdr1;
[0548]
含有序列号22的氨基酸序列的cdr2;和
[0549]
含有序列号23的氨基酸序列的cdr3;
[0550]
(5)轻链可变区,其含有:
[0551]
含有序列号21的氨基酸序列的cdr1;
[0552]
含有选自序列号22、90、106~115和155~157中的任一氨基酸序列的cdr2;和
[0553]
含有序列号23的氨基酸序列的cdr3;
[0554]
(6)轻链可变区,其含有:
[0555]
含有序列号21的氨基酸序列的cdr1;
[0556]
含有序列号22的氨基酸序列的cdr2;和
[0557]
含有选自序列号23、91~99和118~132中的任一氨基酸序列的cdr3。
[0558]
[16]
[0559]
根据上述1~15中任一项所述的抗体,其含有选自下述(1)~(3)中的任一重链可变区以及选自下述(4)~(6)中的任一轻链可变区:
[0560]
(1)重链可变区,其含有:
[0561]
含有选自序列号18、38~42和149~150中的任一氨基酸序列的cdr1;
[0562]
含有序列号19的氨基酸序列的cdr2;和
[0563]
含有序列号20的氨基酸序列的cdr3;
[0564]
(2)重链可变区,其含有:
[0565]
含有序列号18的氨基酸序列的cdr1;
[0566]
含有选自序列号19、46~48、52~66和151~152中的任一氨基酸序列的cdr2;和
[0567]
含有序列号20的氨基酸序列的cdr3;
[0568]
(3)重链可变区,其含有:
[0569]
含有序列号18的氨基酸序列的cdr1;
[0570]
含有序列号19的氨基酸序列的cdr2;和
[0571]
含有选自序列号20、71、73、77和79中的任一氨基酸序列的cdr3;
[0572]
(4)轻链可变区,其含有:
[0573]
含有选自序列号21、81~83、85~89、100~104和154中的任一氨基酸序列的cdr1;
[0574]
含有序列号22的氨基酸序列的cdr2;和
[0575]
含有序列号23的氨基酸序列的cdr3;
[0576]
(5)轻链可变区,其含有:
[0577]
含有序列号21的氨基酸序列的cdr1;
[0578]
含有选自序列号22、90、106、108~111、113~115和155~157中的任一氨基酸序列的cdr2;和
[0579]
含有序列号23的氨基酸序列的cdr3;
[0580]
(6)轻链可变区,其含有:
[0581]
含有序列号21的氨基酸序列的cdr1;
[0582]
含有序列号22的氨基酸序列的cdr2;和
[0583]
含有选自序列号23、93、95~99、121、122、124、125、131和132中的任一氨基酸序列的cdr3。
[0584]
[17]
[0585]
隔绝上述1~16中任一项所述的抗体,其含有选自下述(1)~(3)中的任一重链可变区以及选自下述(4)~(6)中的任一轻链可变区:
[0586]
(1)重链可变区,其含有:
[0587]
含有选自序列号18、38和39中的任一氨基酸序列的cdr1;
[0588]
含有序列号19的氨基酸序列的cdr2;和
[0589]
含有序列号20的氨基酸序列的cdr3;
[0590]
(2)重链可变区,其含有:
[0591]
含有序列号18的氨基酸序列的cdr1;
[0592]
含有选自序列号19、52和66中的任一氨基酸序列的cdr2;和
[0593]
含有序列号20的氨基酸序列的cdr3;
[0594]
(3)重链可变区,其含有:
[0595]
含有序列号18的氨基酸序列的cdr1;
[0596]
含有序列号19的氨基酸序列的cdr2;和
[0597]
含有选自序列号20和77中的任一氨基酸序列的cdr3;
[0598]
(4)轻链可变区,其含有:
[0599]
含有选自序列号21和85中的任一氨基酸序列的cdr1;
[0600]
含有序列号22的氨基酸序列的cdr2;和
[0601]
含有序列号23的氨基酸序列的cdr3;
[0602]
(5)轻链可变区,其含有:
[0603]
含有序列号21的氨基酸序列的cdr1;
[0604]
含有选自序列号22、155和157中的任一氨基酸序列的cdr2;和
[0605]
含有序列号23的氨基酸序列的cdr3;
[0606]
(6)轻链可变区,其含有:
[0607]
含有序列号21的氨基酸序列的cdr1;
[0608]
含有序列号22的氨基酸序列的cdr2;和
[0609]
含有选自序列号23和95中的任一氨基酸序列的cdr3。
[0610]
[18]
[0611]
根据上述1~17中任一项所述的抗体,其含有:
[0612]
(i)重链可变区,其含有:
[0613]
含有选自序列号18、38~44和149~150中的任一氨基酸序列的cdr1;
[0614]
含有序列号19的氨基酸序列的cdr2;和
[0615]
含有序列号20的氨基酸序列的cdr3,以及,
[0616]
轻链可变区,其含有:
[0617]
含有序列号21的氨基酸序列的cdr1;
[0618]
含有序列号22的氨基酸序列的cdr2;和
[0619]
含有序列号23的氨基酸序列的cdr3;
[0620]
(ii)重链可变区,其含有:
[0621]
含有序列号18的氨基酸序列的cdr1;
[0622]
含有选自序列号19、45~48、52~66和151~153中的任一氨基酸序列的cdr2;和
[0623]
含有序列号20的氨基酸序列的cdr3,以及,
[0624]
轻链可变区,其含有:
[0625]
含有序列号21的氨基酸序列的cdr1;
[0626]
含有序列号22的氨基酸序列的cdr2;和
[0627]
含有序列号23的氨基酸序列的cdr3;
[0628]
(iii)重链可变区,其含有:
[0629]
含有序列号18的氨基酸序列的cdr1;
[0630]
含有序列号19的氨基酸序列的cdr2;和
[0631]
含有选自序列号20、49、50和67~80中的任一氨基酸序列的cdr3,以及,
[0632]
轻链可变区,其含有:
[0633]
含有序列号21的氨基酸序列的cdr1;
[0634]
含有序列号22的氨基酸序列的cdr2;和
[0635]
含有序列号23的氨基酸序列的cdr3;
[0636]
(iv)重链可变区,其含有:
[0637]
含有序列号18的氨基酸序列的cdr1;
[0638]
含有序列号19的氨基酸序列的cdr2;和
[0639]
含有序列号20的氨基酸序列的cdr3,以及,
[0640]
轻链可变区,其含有:
[0641]
含有选自序列号21、81~89、100~104和154中的任一氨基酸序列的cdr1;
[0642]
含有序列号22的氨基酸序列的cdr2;和
[0643]
含有序列号23的氨基酸序列的cdr3;
[0644]
(v)重链可变区,其含有:
[0645]
含有序列号18的氨基酸序列的cdr1;
[0646]
含有序列号19的氨基酸序列的cdr2;和
[0647]
含有序列号20的氨基酸序列的cdr3,以及,
[0648]
轻链可变区,其含有:
[0649]
含有序列号21的氨基酸序列的cdr1;
[0650]
含有选自序列号22、90、106~115和155~157中的任一氨基酸序列的cdr2;和
[0651]
含有序列号23的氨基酸序列的cdr3;或者,
[0652]
(vi)重链可变区,其含有:
[0653]
含有序列号18的氨基酸序列的cdr1;
[0654]
含有序列号19的氨基酸序列的cdr2;和
[0655]
含有序列号20的氨基酸序列的cdr3,以及,
[0656]
轻链可变区,其含有:
[0657]
含有序列号21的氨基酸序列的cdr1;
[0658]
含有序列号22的氨基酸序列的cdr2;和
[0659]
含有选自序列号23、91~99和118~132中的任一氨基酸序列的cdr3。
[0660]
[19]
[0661]
根据上述1~18中任一项所述的抗体,其含有:
[0662]
(i)重链可变区,其含有:
[0663]
含有选自序列号18、38~42和149~150中的任一氨基酸序列的cdr1;
[0664]
含有序列号19的氨基酸序列的cdr2;和
[0665]
含有序列号20的氨基酸序列的cdr3,以及,
[0666]
轻链可变区,其含有:
[0667]
含有序列号21的氨基酸序列的cdr1;
[0668]
含有序列号22的氨基酸序列的cdr2;和
[0669]
含有序列号23的氨基酸序列的cdr3;
[0670]
(ii)重链可变区,其含有:
[0671]
含有序列号18的氨基酸序列的cdr1;
[0672]
含有选自序列号19、45~48、52~66和151~152中的任一氨基酸序列的cdr2;和
[0673]
含有序列号20的氨基酸序列的cdr3,以及,
[0674]
轻链可变区,其含有:
[0675]
含有序列号21的氨基酸序列的cdr1;
[0676]
含有序列号22的氨基酸序列的cdr2;和
[0677]
含有序列号23的氨基酸序列的cdr3;
[0678]
(iii)重链可变区,其含有:
[0679]
含有序列号18的氨基酸序列的cdr1;
[0680]
含有序列号19的氨基酸序列的cdr2;和
[0681]
含有选自序列号20、71、73、77和79中的任一氨基酸序列的cdr3,以及,
[0682]
轻链可变区,其含有:
[0683]
含有序列号21的氨基酸序列的cdr1;
[0684]
含有序列号22的氨基酸序列的cdr2;和
[0685]
含有序列号23的氨基酸序列的cdr3;
[0686]
(iv)重链可变区,其含有:
[0687]
含有序列号18的氨基酸序列的cdr1;
[0688]
含有序列号19的氨基酸序列的cdr2;和
[0689]
含有序列号20的氨基酸序列的cdr3,以及,
[0690]
轻链可变区,其含有:
[0691]
含有选自序列号21、81~83、85~89、100~104和154中的任一氨基酸序列的cdr1;
[0692]
含有序列号22的氨基酸序列的cdr2;和
[0693]
含有序列号23的氨基酸序列的cdr3;
[0694]
(v)重链可变区,其含有:
[0695]
含有序列号18的氨基酸序列的cdr1;
[0696]
含有序列号19的氨基酸序列的cdr2;和
[0697]
含有序列号20的氨基酸序列的cdr3,以及,
[0698]
轻链可变区,其含有:
[0699]
含有序列号21的氨基酸序列的cdr1;
[0700]
含有选自序列号22、90、106、108~111、113~115和155~157中的任一氨基酸序列的cdr2;和
[0701]
含有序列号23的氨基酸序列的cdr3;或者,
[0702]
(vi)重链可变区,其含有:
[0703]
含有序列号18的氨基酸序列的cdr1;
[0704]
含有序列号19的氨基酸序列的cdr2;和
[0705]
含有序列号20的氨基酸序列的cdr3,以及,
[0706]
轻链可变区,其含有:
[0707]
含有序列号21的氨基酸序列的cdr1;
[0708]
含有序列号22的氨基酸序列的cdr2;和
[0709]
含有选自序列号23、93、95~99、121、122、124、125、131和132中的任一氨基酸序列的cdr3。
[0710]
[20]
[0711]
根据上述1~19中任一项所述的抗体,其含有:
[0712]
(i)重链可变区,其含有:
[0713]
含有选自序列号18和38~44中的任一氨基酸序列的cdr1;
[0714]
含有序列号19的氨基酸序列的cdr2;和
[0715]
含有序列号20的氨基酸序列的cdr3,以及,
[0716]
轻链可变区,其含有:
[0717]
含有序列号21的氨基酸序列的cdr1;
[0718]
含有序列号22的氨基酸序列的cdr2;和
[0719]
含有序列号23的氨基酸序列的cdr3;
[0720]
(ii)重链可变区,其含有:
[0721]
含有序列号18的氨基酸序列的cdr1;
[0722]
含有选自序列号19、45~48和52~66中的任一氨基酸序列的cdr2;和
[0723]
含有序列号20的氨基酸序列的cdr3,以及,
[0724]
轻链可变区,其含有:
[0725]
含有序列号21的氨基酸序列的cdr1;
[0726]
含有序列号22的氨基酸序列的cdr2;和
[0727]
含有序列号23的氨基酸序列的cdr3;
[0728]
(iii)重链可变区,其含有:
[0729]
含有序列号18的氨基酸序列的cdr1;
[0730]
含有序列号19的氨基酸序列的cdr2;和
[0731]
含有选自序列号20、49、50和67~80中的任一氨基酸序列的cdr3,以及,
[0732]
轻链可变区,其含有:
[0733]
含有序列号21的氨基酸序列的cdr1;
[0734]
含有序列号22的氨基酸序列的cdr2;和
[0735]
含有序列号23的氨基酸序列的cdr3;
[0736]
(iv)重链可变区,其含有:
[0737]
含有序列号18的氨基酸序列的cdr1;
[0738]
含有序列号19的氨基酸序列的cdr2;和
[0739]
含有序列号20的氨基酸序列的cdr3,以及,
[0740]
轻链可变区,其含有:
[0741]
含有选自序列号21、81~89和100~104中的任一氨基酸序列的cdr1;
[0742]
含有序列号22的氨基酸序列的cdr2;和
[0743]
含有序列号23的氨基酸序列的cdr3;
[0744]
(v)重链可变区,其含有:
[0745]
含有序列号18的氨基酸序列的cdr1;
[0746]
含有序列号19的氨基酸序列的cdr2;和
[0747]
含有序列号20的氨基酸序列的cdr3,以及,
[0748]
轻链可变区,其含有:
[0749]
含有序列号21的氨基酸序列的cdr1;
[0750]
含有选自序列号22、90和106~115中的任一氨基酸序列的cdr2;和
[0751]
含有序列号23的氨基酸序列的cdr3;或者,
[0752]
(vi)重链可变区,其含有:
[0753]
含有序列号18的氨基酸序列的cdr1;
[0754]
含有序列号19的氨基酸序列的cdr2;和
[0755]
含有序列号20的氨基酸序列的cdr3,以及,
[0756]
轻链可变区,其含有:
[0757]
含有序列号21的氨基酸序列的cdr1;
[0758]
含有序列号22的氨基酸序列的cdr2;和
[0759]
含有选自序列号23、91~99和118~132中的任一氨基酸序列的cdr3。
[0760]
[21]
[0761]
根据上述1~20中任一项所述的抗体,其含有:
[0762]
(i)重链可变区,其含有:
[0763]
含有选自序列号18和38~42中的任一氨基酸序列的cdr1;
[0764]
含有序列号19的氨基酸序列的cdr2;和
[0765]
含有序列号20的氨基酸序列的cdr3,以及,
[0766]
轻链可变区,其含有:
[0767]
含有序列号21的氨基酸序列的cdr1;
[0768]
含有序列号22的氨基酸序列的cdr2;和
[0769]
含有序列号23的氨基酸序列的cdr3;
[0770]
(ii)重链可变区,其含有:
[0771]
含有序列号18的氨基酸序列的cdr1;
[0772]
含有选自序列号19、46~48和52~66中的任一氨基酸序列的cdr2;和
[0773]
含有序列号20的氨基酸序列的cdr3,以及,
[0774]
轻链可变区,其含有:
[0775]
含有序列号21的氨基酸序列的cdr1;
[0776]
含有序列号22的氨基酸序列的cdr2;和
[0777]
含有序列号23的氨基酸序列的cdr3;
[0778]
(iii)重链可变区,其含有:
[0779]
含有序列号18的氨基酸序列的cdr1;
[0780]
含有序列号19的氨基酸序列的cdr2;和
[0781]
含有选自序列号20、71、73、77和79中的任一氨基酸序列的cdr3,以及,
[0782]
轻链可变区,其含有:
[0783]
含有序列号21的氨基酸序列的cdr1;
[0784]
含有序列号22的氨基酸序列的cdr2;和
[0785]
含有序列号23的氨基酸序列的cdr3;
[0786]
(iv)重链可变区,其含有:
[0787]
含有序列号18的氨基酸序列的cdr1;
[0788]
含有序列号19的氨基酸序列的cdr2;和
[0789]
含有序列号20的氨基酸序列的cdr3,以及,
[0790]
轻链可变区,其含有:
[0791]
含有选自序列号21、81~83、85~89和100~104中的任一氨基酸序列的cdr1;
[0792]
含有序列号22的氨基酸序列的cdr2;和
[0793]
含有序列号23的氨基酸序列的cdr3;
[0794]
(v)重链可变区,其含有:
[0795]
含有序列号18的氨基酸序列的cdr1;
[0796]
含有序列号19的氨基酸序列的cdr2;和
[0797]
含有序列号20的氨基酸序列的cdr3,以及,
[0798]
轻链可变区,其含有:
[0799]
含有序列号21的氨基酸序列的cdr1;
[0800]
含有选自序列号22、90、106、108~111和113~115中的任一氨基酸序列的cdr2;和
[0801]
含有序列号23的氨基酸序列的cdr3;或者,
[0802]
(vi)重链可变区,其含有:
[0803]
含有序列号18的氨基酸序列的cdr1;
[0804]
含有序列号19的氨基酸序列的cdr2;和
[0805]
含有序列号20的氨基酸序列的cdr3,以及,
[0806]
轻链可变区,其含有:
[0807]
含有序列号21的氨基酸序列的cdr1;
[0808]
含有序列号22的氨基酸序列的cdr2;和
[0809]
含有选自序列号23、93、95~99、121、122、124、125、131和132中的任一氨基酸序列的cdr3。
[0810]
[22]
[0811]
根据上述1~21中任一项所述的抗体,其含有:
[0812]
重链可变区,其含有包含序列号18的氨基酸序列的cdr1、包含序列号19的氨基酸序列的cdr2以及包含序列号20的氨基酸序列的cdr3,以及,
[0813]
轻链可变区,其含有包含序列号21的氨基酸序列的cdr1、包含序列号22的氨基酸序列的cdr2以及包含序列号23的氨基酸序列的cdr3。
[0814]
[23]
[0815]
上述1~22中任一项所述的抗体,其包含含有序列号4的氨基酸序列的重链可变区所含的cdr1、cdr2和cdr3、以及含有序列号5的氨基酸序列的轻链可变区所含的cdr1、cdr2和cdr3。
[0816]
[24]
[0817]
根据上述1所述的抗体,其含有重链可变区和轻链可变区,
[0818]
所述重链可变区含有:
[0819]
含有序列号133的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0820]
含有序列号133的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0821]
含有序列号133的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0822]
所述轻链可变区含有:
[0823]
含有序列号134的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0824]
含有序列号134的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0825]
含有序列号134的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
[0826]
[25]
[0827]
根据上述1或24所述的抗体,其含有重链可变区和轻链可变区,
[0828]
所述重链可变区含有:
[0829]
包含序列号137的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0830]
包含序列号138的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0831]
包含序列号139的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0832]
所述轻链可变区含有:
[0833]
包含序列号140的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0834]
包含序列号141的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0835]
包含序列号142的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
[0836]
[26]
[0837]
一种抗hgdf15抗体,其含有重链可变区和轻链可变区,
[0838]
所述重链可变区含有:
[0839]
含有序列号133的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0840]
含有序列号133的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0841]
含有序列号133的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0842]
所述轻链可变区含有:
[0843]
含有序列号134的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0844]
含有序列号134的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0845]
含有序列号134的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
[0846]
[27]
[0847]
一种抗hgdf15抗体,其含有重链可变区和轻链可变区,
[0848]
所述重链可变区含有:
[0849]
包含序列号137的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0850]
包含序列号138的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0851]
包含序列号139的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0852]
所述轻链可变区含有:
[0853]
包含序列号140的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0854]
包含序列号141的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0855]
包含序列号142的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
[0856]
[28]
[0857]
根据上述24~27中任一项所述的抗体,其中,上述1~3个氨基酸残基的改变为1个氨基酸残基的改变。
[0858]
[29]
[0859]
根据上述28所述的抗体,其中,上述氨基酸残基的改变为氨基酸残基的置换。
[0860]
[30]
[0861]
根据上述28或29所述的抗体,其中,上述1~3个氨基酸残基的改变为1个氨基酸残基的置换。
[0862]
[31]
[0863]
根据上述1和24~30中任一项所述的抗体,其含有重链可变区,所述重链可变区包含含有序列号139的氨基酸序列的cdr3。
[0864]
[32]
[0865]
根据上述1和24~31中任一项所述的抗体,其含有轻链可变区,所述轻链可变区包含含有序列号142的氨基酸序列的cdr3。
[0866]
[33]
[0867]
根据上述1和24~32中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0868]
所述重链可变区含有:
[0869]
含有序列号137的氨基酸序列的cdr1;
[0870]
含有序列号138的氨基酸序列的cdr2;和
[0871]
含有序列号139的氨基酸序列的cdr3,
[0872]
所述轻链可变区含有:
[0873]
含有序列号140的氨基酸序列的cdr1;
[0874]
含有序列号141的氨基酸序列的cdr2;和
[0875]
含有序列号142的氨基酸序列的cdr3。
[0876]
[34]
[0877]
根据上述1和24~33中任一项所述的抗体,其包含:含有序列号133的氨基酸序列的重链可变区所含的cdr1、cdr2和cdr3,以及含有序列号134的氨基酸序列的轻链可变区所含的cdr1、cdr2和cdr3。
[0878]
[35]
[0879]
根据上述1所述的抗体,其含有重链可变区和轻链可变区,所述重链可变区含有:
[0880]
含有序列号135的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0881]
含有序列号135的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0882]
含有序列号135的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0883]
所述轻链可变区含有:
[0884]
含有序列号136的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0885]
含有序列号136的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0886]
含有序列号136的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
[0887]
[36]
[0888]
根据上述1或35所述的抗体,其含有重链可变区和轻链可变区,
[0889]
所述重链可变区含有:
[0890]
包含序列号143的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0891]
包含序列号144的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0892]
包含序列号145的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0893]
所述轻链可变区含有:
[0894]
包含序列号146的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0895]
包含序列号147的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0896]
包含序列号148的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
[0897]
[37]
[0898]
一种抗hgdf15抗体,其含有重链可变区和轻链可变区,
[0899]
所述重链可变区含有:
[0900]
含有序列号135的氨基酸序列的重链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0901]
含有序列号135的氨基酸序列的重链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0902]
含有序列号135的氨基酸序列的重链可变区所含的cdr3、或由上述cdr3的氨基酸
序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3,
[0903]
所述轻链可变区含有:
[0904]
含有序列号136的氨基酸序列的轻链可变区所含的cdr1、或由上述cdr1的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr1;
[0905]
含有序列号136的氨基酸序列的轻链可变区所含的cdr2、或由上述cdr2的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr2;和
[0906]
含有序列号136的氨基酸序列的轻链可变区所含的cdr3、或由上述cdr3的氨基酸序列中1~3个氨基酸残基发生了改变的氨基酸序列构成的cdr3。
[0907]
[38]
[0908]
一种抗hgdf15抗体,其含有重链可变区和轻链可变区,
[0909]
所述重链可变区含有:
[0910]
包含序列号143的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0911]
包含序列号144的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0912]
包含序列号145的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3,
[0913]
所述轻链可变区含有:
[0914]
包含序列号146的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr1;
[0915]
包含序列号147的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr2;和
[0916]
包含序列号148的氨基酸序列或上述氨基酸序列中的1~3个氨基酸残基发生了改变的氨基酸序列的cdr3。
[0917]
[39]
[0918]
根据上述35~38中任一项所述的抗体,其中,上述1~3个氨基酸残基的改变为1个氨基酸残基的改变。
[0919]
[40]
[0920]
根据上述39所述的抗体,其中,上述氨基酸残基的改变为氨基酸残基的置换。
[0921]
[41]
[0922]
根据上述39或40所述的抗体,其中,上述1~3个氨基酸残基的改变为1个氨基酸残基的置换。
[0923]
[42]
[0924]
根据上述1和35~41中任一项所述的抗体,其含有重链可变区,所述重链可变区包含含有序列号145的氨基酸序列的cdr3。
[0925]
[43]
[0926]
根据上述1和35~42中任一项所述的抗体,其含有轻链可变区,所述轻链可变区包含含有序列号148的氨基酸序列的cdr3。
[0927]
[44]
[0928]
根据上述1和35~43中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0929]
所述重链可变区含有:
[0930]
含有序列号143的氨基酸序列的cdr1;
[0931]
含有序列号144的氨基酸序列的cdr2;和
[0932]
含有序列号145的氨基酸序列的cdr3,
[0933]
所述轻链可变区含有:
[0934]
含有序列号146的氨基酸序列的cdr1;
[0935]
含有序列号147的氨基酸序列的cdr2;和
[0936]
含有序列号148的氨基酸序列的cdr3。
[0937]
[45]
[0938]
根据上述1和35~44中任一项所述的抗体,其包含:含有序列号135的氨基酸序列的重链可变区所含的cdr1、cdr2和cdr3,以及含有序列号136的氨基酸序列的轻链可变区所含的cdr1、cdr2和cdr3。
[0939]
[46]
[0940]
根据上述1~45中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0941]
所述重链可变区含有与序列号8的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号8的氨基酸序列、或序列号8的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列,
[0942]
所述轻链可变区含有与序列号9的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号9的氨基酸序列、或序列号9的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列。
[0943]
[47]
[0944]
一种抗hgdf15抗体,其含有重链可变区和轻链可变区,
[0945]
所述重链可变区含有与序列号8的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号8的氨基酸序列、或序列号8的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列,
[0946]
所述轻链可变区含有与序列号9的氨基酸序列具有80%、85%、90%或95%以上的序列一致性的氨基酸序列、或序列号9的氨基酸序列、或序列号9的氨基酸序列中的1~20个、1~15个、1~10个、1~5个、或1~3个氨基酸残基发生了改变的氨基酸序列。
[0947]
[48]
[0948]
根据上述1~47中任一项所述的抗体,其包含含有序列号8的氨基酸序列的重链可变区和含有序列号9的氨基酸序列的轻链可变区。
[0949]
[49]
[0950]
根据上述1~48中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0951]
所述重链可变区含有序列号8的氨基酸序列、或在序列号8的氨基酸序列中含有选自h48r、h49r、h49d、h50r、h50s、h50f、h52r、h52q、h72r、h73d、h73r、h73y、h119r、h119f、h48s、h71y、h72a、h72l、h72n、h72t、h72w、h75h、h75l、h75n、h75q、h79h、h79k、h79q、h79r、h83r、h117q、h119e、h119h、h119k、h119n、h119q、h119s、h119t、h120a、h120d、h120f、h120n、h120q、h122f、h54t、h54n、h71r、h71h和h77i中的任意氨基酸置换的氨基酸序列;
[0952]
所述轻链可变区含有序列号9的氨基酸序列、或在序列号9的氨基酸序列中含有选自l47r、l48e、l48r、l48s、l48k、l50d、l50r、l50f、l50y、l73r、l111f、l111y、l112e、l112r、l112d、l112f、l113d、l113r、l113f、l48h、l48y、l50q、l50w、l51q、l69y、l70f、l70h、l72d、l72e、l72r、l72y、l73k、l73n、l73y、l75q、l87k、l87n、l111a、l111n、l111s、l112h、l112q、l112t、l112y、l113s、l114f、l114h、l114i、l114n、l114y、l116h、l116y、l51y、l72f、l73q和l74h中的任意氨基酸置换的氨基酸序列。
[0953]
[50]
[0954]
根据上述1~49中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0955]
所述重链可变区含有序列号8的氨基酸序列、或在序列号8的氨基酸序列中含有选自h49r、h49d、h50r、h50s、h50f、h73d、h73r、h73y、h48s、h71y、h72a、h72l、h72n、h72t、h72w、h75h、h75l、h75n、h75q、h79h、h79k、h79q、h79r、h83r、h119n、h119s、h120f、h120q、h54t、h54n、h71r和h71h中的任意氨基酸置换的氨基酸序列,
[0956]
所述轻链可变区含有序列号9的氨基酸序列、或在序列号9的氨基酸序列中含有选自l47r、l48e、l48r、l48k、l50d、l50r、l50f、l50y、l73r、l112e、l112d、l112f、l113d、l113r、l113f、l48h、l48y、l50q、l50w、l51q、l70f、l72d、l72e、l72r、l72y、l73n、l73y、l75q、l112h、l112q、l112y、l113s、l116h、l116y、l51y、l72f、l73q和l74h中的任意氨基酸置换的氨基酸序列。
[0957]
[51]
[0958]
根据上述1~50中任一项所述的抗体,其含有重链可变区和轻链可变区,
[0959]
所述重链可变区含有序列号8的氨基酸序列、或在序列号8的氨基酸序列中含有选自h49r、h49d、h48s、h71y、h83r和h120f中的任意氨基酸置换的氨基酸序列,
[0960]
所述轻链可变区含有序列号9的氨基酸序列、或在序列号9的氨基酸序列中含有选自l48k、l112d、l72f和l74h中的任意氨基酸置换的氨基酸序列。
[0961]
[52]
[0962]
根据上述1~51中任一项所述的抗体,其与包含含有序列号8的氨基酸序列的重链可变区和含有序列号9的氨基酸序列的轻链可变区的抗hgdf15抗体竞争与hgdf15结合。
[0963]
[53]
[0964]
根据上述1~52中任一项所述的抗体,其为单克隆抗体。
[0965]
[54]
[0966]
一种抗hgdf15抗体,其与上述1~53中任一项所述的抗体竞争与hgdf15结合。
[0967]
[55]
[0968]
根据上述54所述的抗体,其与包含含有序列号8的氨基酸序列的重链可变区和含有序列号9的氨基酸序列的轻链可变区的抗hgdf15抗体进行竞争。
[0969]
[56]
[0970]
根据上述54或55所述的抗体,其降低血中gdf15浓度。
[0971]
[57]
[0972]
根据上述54~56中任一项所述的抗体,其抑制前gdf15的切断。
[0973]
[58]
[0974]
根据上述54~56中任一项所述的抗体,其为单克隆抗体。
[0975]
[59]
[0976]
一种多核苷酸,其编码上述1~58中任一项所述的抗体。
[0977]
[60]
[0978]
根据上述59所述的多核苷酸,其含有序列号24和/或25的核酸序列。
[0979]
[61]
[0980]
一种表达载体,其含有上述59或60所述的多核苷酸。
[0981]
[62]
[0982]
一种转化细胞,其含有上述59或60所述的多核苷酸。
[0983]
[63]
[0984]
一种药物组合物,其含有上述1~58中任一项所述的抗体。
[0985]
[64]
[0986]
根据上述63所述的药物组合物,其用于处置与gdf15相关的疾病或症状。
[0987]
[65]
[0988]
根据上述64所述的药物组合物,其中,与gdf15相关的疾病或症状为癌症。
[0989]
[66]
[0990]
根据上述64所述的药物组合物,其中,与gdf15相关的疾病或症状为恶病质。
[0991]
[67]
[0992]
根据上述66所述的药物组合物,其中,恶病质为癌症恶病质。
[0993]
[68]
[0994]
根据上述63所述的药物组合物,其用于降低血中gdf15浓度。
[0995]
[69]
[0996]
根据上述1~58中任一项所述的抗体,其用于处置与gdf15相关的疾病或症状。
[0997]
[70]
[0998]
根据述1~58中任一项所述的抗体,其用于降低血中gdf15浓度。
[0999]
[71]
[1000]
一种处置与gdf15相关的疾病或症状的方法,其包括下述步骤:向需要处置的对象给药有效量的上述1~58中任一项所述的抗体。
[1001]
[72]
[1002]
一种用于降低血中gdf15浓度的方法,其包括下述步骤:向需要上述降低的对象给药有效量的上述1~58中任一项所述的抗体。
[1003]
[73]
[1004]
上述1~58中任一项所述的抗体在制造用于处置与gdf15相关的疾病或症状的药物中的应用。
[1005]
[74]
[1006]
上述1~58中任一项所述的抗体在制造用于降低血中gdf15浓度的药物中的应用。
[1007]
通过以下实施例进一步说明本发明,但是在任何意义下本发明都不受本实施例限定。
[1008]
实施例
[1009]
i.抗体制作(1)
[1010]
a.抗hgdf15抗体的制作
[1011]
1对动物进行免疫
[1012]
日程
[1013]
第1天:首次免疫(25μg/针/只、abisco-100、ip(腹腔注射))
[1014]
第10天:第2次免疫(25μg/针/只、abisco-100、ip)
[1015]
第17天:第3次免疫(25μg/针/只、abisco-100、ip)
[1016]
第21天:滴度确认
[1017]
第24天:末次加强(25μg/针/只、abisco-100、ip)
[1018]
第27天:摘出脾、细胞融合
[1019]
试剂
[1020]
·
重组人gdf15(rhgdf15)、r&d、957-gd-025/cf、25μg
[1021]
·
abisco-100(isconova)
[1022]
动物
[1023]
·
3h/hej jms slc-lpr/lpr(5w、日本slc、雌性)
[1024]
步骤
[1025]
1.将50μl的hgdf15(0.5mg/ml)、25μl的abisco-100、175μl的pbs混合,给药于小鼠的腹腔内(首次免疫)。
[1026]
2.首次免疫起10和17天后,也腹腔内给药与首次免疫同样制备的hgdf15溶液。
[1027]
3.首次免疫起21天后,用毛细管采血管从小鼠的尾部采血,通过离心分离得到血浆。
[1028]
4.将血浆稀释100倍、1000倍和10000倍,使用固相化有hgdf15的96孔板进行elisa,确认对hgdf15的抗体效价上升。
[1029]
5.首次免疫起24天后,腹腔内给药与首次免疫同样制备的hgdf15溶液。
[1030]
6.首次免疫起27天后,在麻醉下摘出脾,进行细胞融合。
[1031]
2细胞融合和hat选择
[1032]
细胞
[1033]
·
sp2/o-14ag(以下记作sp2/o细胞、atcc#crl-1581)
[1034]
以不超过3
×
105个细胞/ml的方式进行传代
[1035]
试剂
[1036]
·
dmem(gibco、10313-021)
[1037]
·
fbs(56℃下灭活处理30分钟后)
[1038]
·
青霉素-链霉素-谷氨酰胺(invitrogen、10378-016)
[1039]
·
胰岛素(funakoshi、bt-243),制备为10mg/ml
[1040]
·
55mm 2-巯基乙醇(1000x)(invitrogen、21985-023)
[1041]
·
ril-6
[1042]
·
pbs
[1043]
·
turk’s液
[1044]
·
台盼蓝
[1045]
·
红细胞裂解缓冲液(sigma、r7757)
[1046]
·
peg1500(罗氏、108014)
[1047]
·
hat培养基添加剂(50
×
)hybri-max(sigma、h0262)
[1048]
·
ht培养基添加剂(50
×
)hybri-max(sigma、h0137)
[1049]
器具
[1050]
·
6孔板(bd、353046)
[1051]
·
悬浮细胞培养用大烧瓶
[1052]
·
手术用镊子(3个)
[1053]
·
手术用剪刀(3把)
[1054]
·
50mlfalcon管
[1055]
·
1ml注射器
[1056]
·
23g注射针
[1057]
·
细胞滤网40μm(bd、352340)
[1058]
培养基组成
[1059]
·
sp2/o培养用培养基
[1060]
dmem500ml
[1061]
fbs55ml(终浓度10%)
[1062]
青霉素-链霉素-谷氨酰胺(100
×
)5ml(终浓度1
×
)
[1063]
·
细胞融合用培养基
[1064]
dmem
[1065]
·
杂交瘤用培养基
[1066][1067][1068]
·
hat选择培养基
[1069]
杂交瘤用培养基
[1070]
50
×
hat适量(终浓度1
×
)
[1071]
步骤
[1072]
·
骨髓瘤的准备(细胞融合前1周)
[1073]
1.将冷冻保存的sp2/o细胞(约1
×
106个细胞/瓶)解冻,悬浮于预先分注于15mlfalcon管的10mlsp2/o用培养基,以1500rpm离心分离3分钟,清洗,除去上清。
[1074]
2.将沉淀物(sp2/o细胞)悬浮于4mlsp2/o用培养基。
[1075]
3.向6孔板的各孔加入4mlsp2/o用培养基,将2.中悬浮的sp2/o细胞稀释成2倍系列。
[1076]
4.在37℃、5.5%co2下培养1~2天。
[1077]
5.通过显微镜观察而回收状态良好的孔的细胞,在悬浮细胞培养用大烧瓶(或中烧瓶)中扩大培养。在细胞融合前2天进行传代。(细胞融合当天达到5
×
105个细胞/ml左右的细胞密度。)
[1078]
·
从小鼠摘出脾
[1079]
1.对小鼠诱导麻醉,充分喷洒70%乙醇后,在安全柜内切开腹部。为了在无菌条件下摘出脾,按照外皮用和腹腔内用来准备灭菌后的镊子、剪刀。
[1080]
2.在麻醉下从腹主动脉采全血后,摘出脾。
[1081]
3.将脾放入预先加入有pbs的50mlfalcon管,在冰上放置至细胞融合为止。
[1082]
·
细胞融合(杂交瘤的作成)
[1083]
将dmem(无血清)和peg在37℃细胞培养箱中预热,进行以下操作。
[1084]
1.回收sp2/o细胞,对细胞数进行计数。仅使用1
×
106个细胞/ml以下的烧瓶中的细胞。
[1085]
2.向6孔falcon板的1个孔加入10ml左右pbs,向其中放入所摘出的脾,除去周边残留的脂肪组织。
[1086]
3.向剩余孔中的一个中重新加入pbs 10ml,将脾转移过来。用灭菌后的镊子和剪刀将脾切成两半。
[1087]
4.在1ml注射器上安装23g的注射针,吸入pbs,注入到对半切开的脾中,将脾细胞挤出到pbs中。重复该操作直至脾变成白色。
[1088]
5.在50ml falcon管上部放置灭菌后的滤网,使含有脾细胞的pbs通过滤网而除掉脾细胞以外的组织。添加细胞融合用培养基,使得总量达到40ml。
[1089]
6.以1500rpm离心分离3分钟,除去上清。
[1090]
7.将脾细胞悬浮于20ml细胞融合用培养基,用turk’s液染色(turk’s液:悬浮液=10:1),对白细胞进行计数。(通常为1
×
108个细胞、5
×
106个细胞/ml左右。)
[1091]
8.以1500rpm离心分离3分钟,除去上清。
[1092]
9.悬浮于3ml红细胞裂解缓冲液,在冰上静置3分钟。
[1093]
10.添加17ml细胞融合用培养基,以1500rpm离心分离3分钟,回收脾细胞。
[1094]
11.添加含有sp2/o细胞的培养基,使得以细胞数计脾细胞:sp2/o细胞=5:1,由此进行悬浮。
[1095]
12.以1500rpm离心分离3分钟,除去上清。
[1096]
13.通过叩打使沉淀细胞再次悬浮。
[1097]
14.边缓慢地搅拌边用1分钟滴加peg1500 1ml。
[1098]
15.再继续搅拌1分钟。
[1099]
16.与14同样地滴加细胞融合用培养基1ml。
[1100]
17.再用3分钟滴加细胞融合用培养基3ml。
[1101]
18.再用1分钟加入细胞融合用培养基10ml。
[1102]
19.37℃下静置10分钟。
[1103]
20.添加细胞融合用培养基,使得总量达到40ml。
[1104]
21.以1500rpm离心分离3分钟,除去上清。
[1105]
22.悬浮于杂交瘤用培养基,使得以脾细胞数计达到1
×
106个细胞/ml,以每孔100
μl向96孔平底板中播种杂交瘤。
[1106]
23.在37℃、co
2 5.5%下进行o/n培养
[1107]
24.以100μl/孔添加2
×
hat选择培养基,继续培养。
[1108]
25.每隔1天除去100μl上清并添加100μl1
×
hat选择培养基,从而进行培养基交换。
[1109]
3抗体的筛选
[1110]
产生抗hgdf15抗体的杂交瘤的选择中,在用96孔板开始培养起5天后,使用杂交瘤上清通过elisa进行测定,将测得的与hgdf15的结合强度作为指标如下进行筛选。
[1111]
向固相化有hgdf15(r&d systems、957-gd-025/cf)的96孔板的各孔中添加100μl的培养上清,室温下反应2小时。清洗孔之后,加入检测用二抗(hrp标记抗小鼠igg抗体(promega、w402b)),室温下反应1小时。清洗孔之后,用tmb溶液(sigma、t2885)显色,用酶标仪测定450nm处吸光度。
[1112]
将450nm的吸光度为1.0以上的孔的杂交瘤进一步通过有限稀释法单克隆化。最终得到16个克隆。培养从得到的16个克隆中去除作为igm的1个克隆和与多种蛋白显示非特异性结合的2个克隆而得的13个克隆。
[1113]
使用hitrap rprotein a ff(ge healthcare life sciences、17508001),从培养上清中纯化抗体。使用nanodrop(thermo scientific)计测280nm吸光度,从而计测纯化抗体的浓度。
[1114]
利用elisa如下测定纯化而得的各抗体与hgdf15的结合亲和性。以100μl/孔向孔中加入浓度为200ng/ml的hgdf15。向固相化有hgdf15的96孔板中,使从0.39ng/ml起以25ng/ml阶梯稀释的纯化抗体以100μl/孔反应之后,用hrp缀合二抗检测hgdf15-抗hgdf15抗体复合物。对于显色,测定450nm的吸光度,使用4参数逻辑曲线计算浓度为5ng/ml的抗体量的值。将克隆mab17的值设为100,计算各抗体的结合值的相对值。
[1115]
将hgdf15与得到的抗hgdf15抗体的亲和性的结果示于表1。对显示出远远强于mab17的结合的mab2进行人源化。
[1116]
[表1]
[1117]
克隆将mab17的值设为100的相对值mab372.3mab444.2mab536.4mab668.1mab133.6mab1112.0mab1236.2mab1350.1mab73.1mab1525.1mab1426.4mab17100.0
mab2350.9
[1118]
4人源化抗体的制作
[1119]
·
细胞
[1120]
细胞株名:expicho
[1121]
来源:中华仓鼠
[1122]
细胞供应商:thermo fisher scientific(a29127)
[1123]
培养液:expicho表达培养基
[1124]
培养液供应商:thermo fisher scientific(a2910001)
[1125]
·
表达载体
[1126]
载体名:pcdna-3.1
[1127]
cdna来源:全合成
[1128]
供应商:thermo fisher scientific
[1129]
·
重组蛋白
[1130]
蛋白质名:人gdf15
[1131]
来源:cho细胞
[1132]
供应商:r&d systems(957-gd-025/cf)
[1133]
·
嵌合抗体序列的设计
[1134]
将小鼠源抗体mab2的包含cdr序列的可变区与贝伐单抗(bevacizumab)的恒定区连接,作为嵌合抗体序列。
[1135]
·
人源化抗体序列的设计
[1136]
通过blast检索,检索到与mab2类似性高的人抗体。对这些人抗体进行cdr序列置换而制作可变区,连接贝伐单抗的恒定区,由此制作全长人源化抗体。另外,对于从结构予测来看认为对结构维持而言重要的氨基酸,使小鼠抗体的氨基酸原样保留,作为人源化抗体的一部分。
[1137]
·
抗体的制作和纯化
[1138]
对重链基因和轻链基因进行全合成,分别整合到表达载体中。在24孔板中播种expicho细胞,次日利用transit-cho试剂盒(takara、v2170)将重链表达载体和轻链表达载体导入(co-transfection,共转染),使重链和轻链共表达。5天后,将含有所产生的抗体的培养上清全部回收,用hitrap rproteina ff柱(ge healthcare、17-5080-01)纯化抗体。
[1139]
·
抗体浓度的测定
[1140]
利用人igg eia试剂盒(takara、mk136)按照附带的说明书测定上清中的抗体浓度。纯化抗体则利用nanodrop(thermo fisher scientific)测定280nm的吸光度,由此确定浓度。
[1141]
·
对hgdf15的结合量的测定(elisa)
[1142]
向96孔板中加入100μl人gdf15溶液(0.4μg/ml),静置到次日早晨,由此制作elisa板。用1%bsa进行1小时板的封闭,含有抗体的培养上清以公比3制作稀释系列,向elisa板中各添加100μl,静置2小时。二抗的反应中,以100μl添加稀释20000倍的hrp复合抗人igg抗体(gene tex、gtx26759)并反应1小时。显色反应中使用tmb(sigma、t-0440),反应终止液使用2当量的硫酸。测定450nm的吸光度。
[1143]
·
使用blitz测定结合亲和性
[1144]
使用作为生物体分子间相互作用分析系统的blitz(pall fortebio)测定抗体的结合亲和性。使用anti-his(pall fortebio、18-5114)作为传感器芯片,使用fortebio样品稀释剂(pall fortebio、18-1048)作为清洗液。关于测定程序,hgdf15向传感器芯片的吸附设为60秒,抗体的结合设为120秒,解离设为120秒。
[1145]
b.序列决定
[1146]
1试验方法
[1147]
由在10cm培养盘中培养的杂交瘤制备总rna,使用smarter race 5’/3’试剂盒(takara、634858)合成cdna。将合成的cdna整合到pcr4blunt-topo载体中,使用大肠杆菌进行扩增,纯化质粒dna。使用bigdye
tm terminator v3.1循环测序试剂盒(thermo fisher scientific,4337454)和m13引物,利用abi 3130xl genetic analyzer(applied biosystems)进行dna测序。
[1148]
2结果
[1149]
将mab17、mab2和humab2的氨基酸序列示于表2,将cdr序列示于表3,将humab2的cdna序列示于表4。cdr按照kabat的定义来确定。
[1150]
[表2-1]
[1151][1152]
[表2-2]
[1153][1154]
[表3]
[1155][1156]
[表4-1]
[1157]
[1158]
[表4-2]
[1159][1160]
[表4-3]
[1161][1162]
c.与现有抗hgdf15抗体的比较
[1163]
1试验材料和方法
[1164]
抗hgdf15抗体
[1165]
将与humab2的反应性的比较中使用的抗体示于表5。
[1166]
[表5]
[1167][1168]
1)人源化抗hgdf15抗体(wo2014/100689)
[1169]
2)r&d systems、mab957、lot no:udc1014011
[1170]
3)r&d systems、dy957
[1171]
试验方法
[1172]
在以100μl/孔添加humab2和表5所示的抗gdf15单克隆抗体(2μg/ml)到96孔板并分别固相化的板中,使从1ng/ml的浓度起阶梯稀释的hgdf15(r&d systems、957-gd-025/cf)以100μl/孔进行反应。使用利用ez-link micro nhs-peg4-bitinylation kit(thermo fisher scientific、21955)进行了生物素化的humab2作为检测抗体(1μg/ml,100μl/孔)。使用人gdf15 elisa试剂盒(r&d systems、dy957)附带的链霉亲和素-hrp缀合物来检测是否建立了夹心elisa。作为夹心elisa的阳性对照抗体(pc),使用能够与任何单克隆抗体实现夹心的人gdf15 elisa试剂盒(r&d systems、dy957)附带的检测抗体(表5)。
[1173]
2结果
[1174]
一般认为,当固相化抗体和生物素化抗体识别类似的表位时,会发生竞争性抑制,而二者识别不同的表位时,不含发生竞争性抑制。如图1所示,humab2能够与其它抗体同时识别hgdf15。该结果提示,humab2识别不同于其它抗体的表位。
[1175]
如上所述,明确了humab2与现有抗体不发生竞争。因此,通过与上述相同的方法对此次得到的其它抗体是否与humab2竞争这一点进行了试验。以抑制%来计算结果,将结果示于表6。获知所试验的8个克隆中有4个克隆(mab1、mab11、mab12和mab13)以70%以上抑制humab2与hgdf15的结合。
[1176]
[表6]
[1177]
各hgdf15单克隆抗体的竞争试验结果
[1178]
克隆抑制%mab311mab446mab545mab622mab182mab1173mab1273mab1379mab170humab280
[1179]
d.hgdf15与humab2 fab的复合物的结晶化
[1180]
1试验材料和方法
[1181]
对于hgdf15(r&d systems、9279-gd-050),以摩尔比1∶1、浓度达到5mg/ml的方式混合humab2 fab(含有由序列号8的氨基酸序列构成的多肽和由序列号9的氨基酸序列构成的多肽)(20ml tris-hcl、200mm nagl、ph7.2),由此制备复合物的蛋白溶液。通过坐滴蒸气扩散法进行humab2结晶化。将蛋白溶液与池液的混合比设为1∶1。使用利用筛选试剂盒crystal screen 2(hampton research、hr2-112)得到的晶体,以分辨率确定复合物的晶体结构。通过分子取代法进行相位确定。
[1182]
2结果
[1183]
通过立体结构分析获知,hgdf15形成均二聚体,hgdf15的二聚体上结合有2分子的humab2的fab(图2a)。排列在humab2与hgdf15的结合界面处的氨基酸被分别鉴定为了互补位和表位(图2b)。表7中,用下划线示出了所鉴定的hgdf15的表位和对于结合而言重要的humab2上的氨基酸。
[1184]
[表7]
[1185][1186]
将使用moe(molecular operating envirounment,分子操作环境)分析出的hgdf15表位示于图3。明确了humab2结合于一个hgdf15单体(monomer1)上的n端侧第5位的天冬氨酸至第18位的组氨酸这14个氨基酸、第45位的异亮氨酸(45i)和第46位的甘氨酸(46g)上,以及另一个单体(monomer2)上的第71位的天冬氨酸(71d)和第72位的苏氨酸(72t)上。
[1187]
使用moe的蛋白质接触计(protein contacts)计算了表位中推测与humab2的相互作用有极强相关性的氨基酸残基(表8)。结果表明,图3所示的氨基酸与humab2特别强烈地结合。
[1188]
[表8]
[1189]
抗体hgdf15e(kcal/mol)l asn112arg13-6.5h asp119arg16-3.4h phe71his6-1.6h tyr69his6-1.4l asn51thr72-1.2l tyr70thr72-1.1h ile75his6-1.1h tyr120leu17-0.91l trp116gly10-0.76
h tyr52cys 7-0.72
[1190]
*示出前10位
[1191]
e.抗hgdf15抗体对hgdf15和突变hgdf15的反应性
[1192]
1试验材料和方法
[1193]
试验材料
[1194]
将与humab2抗体的反应性的比较中使用的抗体示于表9。
[1195]
[表9]
[1196][1197]
1)人源化抗hgdf15抗体(w02014/100689)
[1198]
2)r&d systems、mab957、lotno:udc1014011
[1199]
3)r&d systems、dy957
[1200]
试验方法
[1201]
试验概要
[1202]
将突变hgdf15表达用构建体转染到expicho-s细胞中,培养后回收培养上清。利用市售的gdf15测定用elisa试剂盒确认回收的培养上清中表达了各突变hgdf15后,通过elisa法评价humab2对各突变hgdf15的反应性。在鉴定表位中特别重要的氨基酸残基时,通过elisa和生物分子间相互作用分析系统这2种方法评价humab2对导入了突变的gdf15的反应性。humab2与其它抗hgdf15抗体间的、由表位的不同所带来的差异的检验,通过利用夹心elisa法比较其它抗hgdf15抗体与突变hgdf15的反应性以及humab2与突变hgdf15的反应性来进行。
[1203]
突变hgdf15的制备
[1204]
将导入了各突变hgdf15基因的pcdna-3.1载体(thermo fisher scientific),用expicho
tm
表达系统试剂盒(thermo fisher scientific、a29133)转染到试剂盒中所含的expicho-s(thermo fisher scientific)细胞中。将转染后第10天的培养上清在4℃下以8000rpm离心分离30分钟,回收培养上清。回收的培养上清冷冻(设定温度-20℃)保存。
[1205]
突变hgdf15的表达确认
[1206]
使用人gdf15 elisa试剂盒(r&d systems、dy957),按照试剂盒附带的说明书来测定回收的培养上清中的突变hgdf15,进行了表达的确认和浓度测定。
[1207]
gdf15抗体对突变hgdf15的反应性的评价
[1208]
野生型(wild-type:wt)hgdf15使用重组人gdf15(r&d systems、957-gd-025/cf)。在固相化有各hgdf15抗体的板中,使阶梯稀释的wt和突变hgdf15反应,使用人gdf15 elisa试剂盒(r&d systems、dy957)的检测抗体(表9)来检测发生了结合的wt和突变hgdf15。
[1209]
利用生物分子间相互作用分析系统评价humab2对导入了突变的gdf15的反应性
[1210]
使用在琼脂糖(ge healthcare、17-0906-01)上固定有mab17的亲和柱来纯化各突
变hgdf15。利用生物分子间相互作用分析系统的评价使用octet qke(fortebio)来进行。wt的gdf15使用重组人gdf15(r&d systems、957-gd-025/cf)。使wt和突变hgdf15与生物传感器ni-nta(fortebio、18-5101)结合,接着使阶梯稀释的humab2反应,评价突变hgdf15与humab2间的相互作用。使用动力学方法实施分析。
[1211]
2结果
[1212]
将野生型(wt)hgdf15和突变hgdf15的氨基酸序列示于表10。用下划线示出将野生型hgdf15的氨基酸置换为丙氨酸的位点。
[1213]
[表10]
[1214][1215]
表11示出4种抗hgdf15抗体与hgdf15和突变hgdf15的结合。humab2或者不与突变hgdf15结合、或者相较于与野生型hgdf15的结合而言结合得较弱,其它抗hgdf15抗体与hgdf15的结合未受到突变的影响。由该结果可知,humab2的hgdf15的表位中,n末端侧的5dhcplgpgrccrlh18(序列号3)对于结合而言重要,13r和16r对于humab2的结合特别重要。
另外,该结果也支持了mab17、hu01g06-127和mab957与humab2的表位不同。
[1216]
[表11]
[1217][1218]
将抗gdf15抗体与500pg/ml的hgdf15的结合量设为100,以相对值示出与各突变hgdf15的结合。n=3。数值为平均值
±
sd。
[1219]
f.humab2抗体与表位区域肽的反应性的评价
[1220]
1试验方法
[1221]
由于已经明确了hgdf15的第5位的天冬酰胺残基至第18位的组氨酸残基的14个残基(dhcplgpgrccrlh、序列号3)对于humab2的结合而言重要,因此委托genscript公司合成了该序列的肽(表12)。肽1的两末端均未修饰,肽2的该区域在hgdf15中为内部区域,因此为了模仿其状态而以使氨基末端乙酰化、使羧基末端酰胺化的方式进行了合成。以100μl/孔向固相化的96孔板中添加10μg/ml的肽溶液,以100μl/孔添加humab2抗体(10μg/ml),使其反应(3小时,25℃)。以100μl/孔添加5000倍稀释的抗人igg-hrp(jackson immunoresearch、109-035-008),在25℃下反应1小时,由此检测发生了结合的humab2抗体。作为平板的对照,使用固相化有hgdf15(r&dsystems、957-gd-025/cf)的板。作为与肽进行反应的阳性对照抗体,使用人gdf15 elisa试剂盒(r&d systems、dy957)的检测抗体(表9),作为阴性对照抗体,使用人igg1同种型对照(abcam、ab206198)。
[1222]
[表12]
[1223]
合成肽
[1224][1225]
2结果
[1226]
如图4所示,作为阳性对照抗体的抗hgdf15多克隆抗体与2种肽和hgdf15均发生了反应。与此相对地,humab2仅与hgdf15反应,对于2种合成肽,与作为阴性对照抗体的人igg1
同种型对照(higg1)同样地未显示出反应。该结果表明,humab2与hgdf15表位的结合中重要的是周边的序列或立体结构。
[1227]
g.通过cdr中的氨基酸置换得到的humab2突变体与hgdf15的结合
[1228]
1试验材料和方法
[1229]
试验系
[1230]
细胞
[1231]
1)细胞株名:expicho
[1232]
2)来源:中华仓鼠
[1233]
3)细胞供应商:thermo fisher scientific(a29127)
[1234]
4)培养液:expicho表达培养基
[1235]
5)培养液供应商:thermo fisher scientific(a2910001)
[1236]
抗体表达载体
[1237]
1)载体名:pcdna-3.1
[1238]
2)cdna来源:全合成
[1239]
3)供应商:thermo fisher scientific
[1240]
重组蛋白
[1241]
1)蛋白质名:人gdf15(hgdf15)
[1242]
2)来源:cho细胞
[1243]
3)供应商:r&d systems(957-gd-025/cf)
[1244]
试验方法
[1245]
表达载体的设计
[1246]
根据由humab2与hgdf15的晶体结构分析得到的信息,设计了使排列在抗体与抗原的结合界面的氨基酸为互补位和表位、在humab2的重链或轻链中插入了氨基酸突变的表达载体。表13中示出了突变抗体的列表(用下划线示出所改变的氨基酸)。重链和轻链均从n末端起按照fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4的顺序排列。
[1247]
表达载体的细胞导入
[1248]
向24孔板中播种cho细胞,次日按照重链的轻链的组合利用transit-cho kit(takara、v2170)对表13的突变抗体的表达载体进行基因导入。5天后回收全部上清,在设为-20℃的冰箱中保存至使用。
[1249]
与hgdf15的结合量的测定
[1250]
向96孔板中加入100μl的hgdf15溶液(0.4μg/ml),在4℃下静置到次日早晨,由此制作elisa板。加入1%bsa封闭1小时,将含有突变的抗体的培养上清从30倍稀释起制作稀释系列(稀释倍率的公比为3),向elisa板中各添加100μl,静置2小时。添加hrp缀合抗人igg抗体(gene tex、gtx26759)(20000倍稀释)作为二抗,静置1小时。显色反应中使用tmb(sigma、t-0440),反应终止液使用2当量的硫酸。测定450nm的吸光度。
[1251]
使用octet测定抗体浓度
[1252]
使用生物分子间相互作用分析系统octet qke(pall fortebio)测定培养上清中的抗体浓度。使用protein l(pall fortebio、18-5085)作为传感器芯片,使用10mm甘氨酸(ph1.1)作为传感器芯片的再生液,使用fortebio样品稀释剂(pall fortebio、18-1048)作
为清洗液。作为标品,以50mg/ml、10mg/ml、1mg/ml和0.1mg/ml使用来自人血清的试剂级igg(sigma-aldrich、i12511-10mg),待测定的培养上清用样品稀释剂(pall fortebio、18-1104)2倍稀释后使用。测定程序中,将传感器芯片的再生设为5秒,将清洗设为5秒,将再生和清洗重复3个循环,将抗体浓度测定设为120秒。
[1253]
与humab2的结合量的比较
[1254]
在excel中计算抗体5ng/ml时与人hgdf15的结合量,以相对值示出将humab2与hgdf15的结合量设为100时的、各突变抗体的结合量。进行3次独立试验,求出平均值
±
标准误差。因引入了突变而不再表达抗体时,将抗体的结合量设为0。将结果示于图5a~d。
[1255]
2结果
[1256]
发现了5种相对结合量为humab2的1.5倍以上的抗体。另一方面,观察到30种结合量下降到50%以下的抗体。图5a的“h链改变的抗体1/2”中,示出了“h50s-l7”的2种结果,这些是为了确认培养和elisa中的孔间误差而设置的同一载体的结果。两者为同程度的值,这表明试验体系稳定。
[1257]
在作为重链突变抗体的h48s-l7、h83r-l7和h120f-l7、作为轻链突变抗体的h3-l48k和h3-l112d的情况下,与humab2相比结合力提高了约1.5倍。另一方面,humab2轻链的第111位的甘氨酸(111g)的突变体和第114位的亮氨酸(114l)的突变体均观察到结合量下降,因此表明这些氨基酸为对于与hgdf15的结合和维持humab2的cdr序列的结构而言重要的部位。
[1258]
[表13-1]
[1259][1260]
[表13-2]
[1261][1262]
[表13-3]
[1263][1264]
ii.药理试验(1)
[1265]
a.血中hgdf15的捕捉
[1266]
1试验材料和方法
[1267]
动物
[1268]
1)种属/品系:小鼠/balb-c slc-nu/nu
[1269]
2)微生物学等级:无特定病原(spf)
[1270]
3)供应商:日本slc
[1271]
4)性:雌
[1272]
5)周龄:6周龄(hgdf15、抗体给药时)
[1273]
6)饲养条件
[1274]
在设为下述条件的环境下饲养动物。
[1275]
a)温度:23
±
2℃
[1276]
b)湿度:60
±
10%
[1277]
c)照明:照明时间:午前7时~午后7时
[1278]
关灯时间:午后7时~午前7时
[1279]
d)饲料和水:自由摄取,crf-1(oriental yeast co.,ltd.),自来水
[1280]
试验日程
[1281]
表14示出将抗体给药日设为第0天的试验日程。
[1282]
[表14]
[1283][1284]
动物的饲养方法
[1285]
从搬入日起3天后,将小鼠分到各个笼子。为了使其适应单独饲养,将至分组为止的驯化期设为5天。
[1286]
分组
[1287]
基于体重以每组6只分为总计6组,利用实验数据收集处理系统(sas institute japan、r9.3)进行分组。
[1288]
抗hgdf15抗体的给药
[1289]
将rhgdf15、humab2抗体和mab17抗体以10ml/kg腹腔内给药。作为对照组,以10ml/kg给药杜尔贝科磷酸盐缓冲液(dpbs)。将组构成示于表15。
[1290]
[表15]
[1291] 处置只数1dpbs62rhgdf15 0.3mg/kg63rhgdf15 1mg/kg64rhgdf15 3mg/kg65rhgdf15 3mg/kg mab17 3mg/kg66rhgdf15 3mg/kg humab2 3mg/kg6
[1292]
体重和摄食量的测定
[1293]
在分组日和给药第0天、第1天、第2天、第3天后测定体重和摄食量。
[1294]
采血
·
解剖
[1295]
在抗体给药后第3天,从异氟烷吸入麻醉小鼠的后大静脉采血。使用edta2k采血管制成血浆,在设为-80℃的冰箱中保存至使用。采血后的小鼠在麻醉下通过切开腹部后大静
脉而放血安乐死。
[1296]
血中非结合hgdfl5浓度
[1297]
为了测定血中的未与抗体结合的hgdf15(非结合hgdf15),按照以下步骤除去抗原抗体复合物。将5μl蛋白a/g琼脂糖珠(thermo scientific、20421)、50μl的小鼠血浆和145μl的pbs混合,在4℃下混和2小时。离心分离后,将上清转移到新的eppen管。在设为-80℃的冰箱中保存至使用。此后的血中gdf15测定使用gdf15测定elisa试剂盒(r&d systems、dy957),步骤按照试剂盒的说明书。对于检测限以下的被检体,将血中gdf15浓度设为0pg/ml。
[1298]
统计分析方法
[1299]
对于血中非结合gdf15浓度,进行威尔科克森秩和检验。统计分析使用sas软件(sas institute japan、r9.3)。
[1300]
2结果
[1301]
将结果示于图6。hgdf15的血中浓度依赖于rhgdf15的给药量而增加,mab17和humab2均捕捉血中的gdf15。
[1302]
b.荷瘤小鼠模型的血中gdf15浓度的减少
[1303]
1试验材料和方法
[1304]
受试物质
[1305]
·
humab2
[1306]
·
mab1
[1307]
·
mab13
[1308]
对照物质
[1309]
·
mab17
[1310]
·
mab957(r&d systems)
[1311]
·
hu01g06-127(wo2014/100689)
[1312]
受试物质和对照物质的制备
[1313]
将全部抗体用dpbs制备成1mg/ml,在设定为-80℃的冰箱中保存至给药日。
[1314]
试验体系
[1315]
细胞
[1316]
1)细胞株名:mkn45
[1317]
2)来源:人胃癌症
[1318]
3)供应商:jcrb(japanese collection of research bioresources)细胞库
[1319]
4)培养条件:37℃、5%co2[1320]
a)培养液:rpmi1640
[1321]
i)供应商:life technologies
[1322]
b)血清:fetal bovine serum
[1323]
i)浓度:10%
[1324]
ii)供应商:tissue culture biology
[1325]
动物
[1326]
5)种属/品系:小鼠/balb-c slc-nu/nu
[1327]
6)微生物学等级:无特定病原(spf)
[1328]
7)供应商:日本slc
[1329]
8)性:雌
[1330]
9)周龄:7周龄(细胞移植时)
[1331]
10)在上述“a.血中hgdf15的捕捉”中记载的环境下进行动物的饲养。
[1332]
组构成
[1333]
[表16]
[1334][1335]
1)r&d systems、mab957、lot no:udc1014011
[1336]
2)人源化hgdf15抗体(wo2014/100689)
[1337]
[表17]
[1338][1339]
试验方法
[1340]
动物的饲养方法
[1341]
从搬入日起3天后,将小鼠分到各个笼子。为了使其适应单独饲养,将至移植mkn45为止的驯化期设为5天。
[1342]
细胞的制备和向动物的细胞移植
[1343]
在150mm的培养盘中培养mkn45细胞,移植当天通过0.25%胰蛋白酶-edta(sigma、t6689)处理回收细胞,利用离心分离(1200rpm、5分钟)除去上清。以5
×
106个细胞/ml悬浮于dpbs,向异氟烷吸入麻醉小鼠的腹部皮下移植0.2ml/只(1
×
106个细胞/只)。
[1344]
分组
[1345]
试验1中,在mkn45移植前,从42只小鼠中随机选择5只,设为正常(载体)组,向剩余的37只中移植mkn45。mkn45移植起12天后,利用sas软件(sas institute japan、r9.4)基于体重以每组5只分成总计6组,由此进行分组,分配到mkn45(载体)组、mkn45(mab17)组、mkn45(mab957)组、mkn45(hu01g06-127)组和mkn45(humab2)组。同样,在试验2中也以每组5只分配为正常(载体)组、mkn45(载体)组、mkn45(mab17)组、mkn45(mab1)组和mkn45(13)组。
分组后,对剩余动物在异氟烷麻醉下放血安乐死。
[1346]
dpbs和抗体的给药
[1347]
在mkn45移植起14天后(分组起2天后),腹腔内给药dpbs和抗体(10ml/kg)。试验1中,在抗体给药开始后第7天也给药dpbs和抗体。
[1348]
采血
[1349]
抗体给药开始后第14天(试验1)或7天后(试验2),从异氟烷吸入麻醉小鼠的后大静脉采血。使用edta2k的采血管制成血浆,在设为-80℃的冰箱中保存至使用。采血后的小鼠在麻醉下通过切开腹部后大静脉而放血安乐死。
[1350]
血中非结合hgdf15浓度
[1351]
为了测定血中的未与抗体结合的hgdf15(非结合hgdf15),按照以下步骤除去抗原抗体复合物。将5μl蛋白a/g琼脂糖珠(thermo scientific、20421)、50μl的小鼠血浆和145μl的pbs混合,在4℃下混和2小时。离心分离后,将上清转移到新的eppen管。在设为-80℃的冰箱中保存至使用。此后的血中gdf15测定使用gdf15测定elisa试剂盒(r&d systems、dy957),步骤按照试剂盒的说明书。对于检测限以下的被检体(62.5pg/ml以下),将血中gdf15浓度设为0pg/ml。
[1352]
统计分析方法
[1353]
对于抗体给药开始起第14天(试验1)或7天后(试验2)的血中非结合hgdf15浓度,进行威尔科克森秩和检验
を
行
った
。统计分析使用sas软件(sas institute japan、r9.4)。
[1354]
2结果
[1355]
试验1中,移植了mkn45细胞的mkn45组的血中hgdf15浓度为约2000pg/ml。向移植了mkn45细胞的模型小鼠给药抗体的组中,mab17、mab957、hu01g06-127抗体给药组与溶剂给药组相比观察到血中hgdf15浓度的上升。另一方面,humab2给药组中,血中hgdf15浓度减少(图7)。
[1356]
表18示出试验2中将溶剂给药组的血中hgdf15浓度设为100时的相对值。与humab2同样地,观察到由mab1和mab13引起的血中hgdf15浓度降低。
[1357]
[表18]
[1358]
组名血中gdf15量的相对值mkn45(载体)100mkn45(mab17)302.6mkn45(mab1)72.1mkn45(mab13)85.8
[1359]
上述结果与给药重组hgdf15的试验(图6)中的mab17的结果不同。作为其原因之一,可列举humab2与试验中使用的其它3种抗体的表位不同。hgdf 15是前hgdf15被蛋白质水解酶切断而产生的(a.r.bauson et al.cancer res.2005;65(6):2320-2336)。认为,humab2的表位存在于该切断部位附近,可能通过在此结合而抑制了hgdf15的产生。以外报道了某些抗ccl-2中和抗体(abn912)不改善类风湿性关节炎患者的病情,而是使其恶化,认为血中ccl-2浓度呈抗体用量依赖性上升是该恶化的原因之一,由此提示了降低血中抗原浓度的重要性(j.j.haringman et al.arthritis&rheumatism 2006;54(8):2387-2392)。根据这些,预期humab2之类可减少血中gdf15量的抗gdf15抗体与增加血中hgdf15的抗体相
比在临床上更有用。
[1360]
c.荷瘤小鼠模型的恶病质症状改善(1)
[1361]
1试验材料和方法
[1362]
1.1受试物质的制备
[1363]
将humab2用dpbs制备成1mg/ml,在设定为-80℃的冰箱中保存至给药日。
[1364]
1.2试验体系
[1365]
1.2.1细胞
[1366]
1)细胞株名:mkn45
[1367]
2)来源:人胃癌症
[1368]
3)供应商:jcrb(japanese collection of research bioresources)细胞库
[1369]
4)培养条件:37℃、5%co2[1370]
a)培养液:rpmi 1640
[1371]
i)供应商:life technologies
[1372]
b)血清:fetal bovine serum
[1373]
i)浓度:10%
[1374]
ii)供应商:tissue culture biology
[1375]
1.2.2动物
[1376]
1)种属/品系:mouse/balb-c slc-nu/nu
[1377]
2)微生物学等级:无特定病原(spf)
[1378]
3)供应商:日本slc
[1379]
4)性:雌
[1380]
5)周龄:7周龄(细胞移植时)
[1381]
6)饲养条件
[1382]
在设为下述条件的环境下饲养动物。
[1383]
a)温度:23
±
2℃
[1384]
b)湿度:60
±
10%
[1385]
c)照明:照明时间:午前7时~午后7时
[1386]
关灯时间:午后7时~午前7时
[1387]
d)饲料和水:自由摄取,crf-1(oriental yeast co.,ltd.),自来水
[1388]
1.2.3组构成
[1389]
[表19]
[1390] 组名细胞移植给药物质(用量)只数1正常(载体)无dpbs82mkn45(载体)mkn45dpbs83mkn45(humab2)mkn45humab2(10mg/kg)8
[1391]
1.3试验方法
[1392]
1.3.1试验日程
[1393]
表20示出将抗体给药日设为第0天的试验日程。
[1394]
[表20]
[1395][1396]
1.3.2动物的饲养方法
[1397]
从搬入日起3天后,将小鼠分到各个笼子。为了使其适应单独饲养,将至移植mkn45为止的驯化期设为5天和。
[1398]
1.3.3细胞的制备和对动物的细胞移植
[1399]
在150mm的培养盘中培养mkn45细胞,移植当天通过0.25%胰蛋白酶-edta(sigma、t6689)处理回收细胞,通过离心分离(1200rpm、5分钟)除去上清。以5
×
106个细胞/ml悬浮于dbps,以0.2ml/只(1
×
106个细胞/只)移植到异氟烷吸入麻醉小鼠的腹部皮下。
[1400]
1.3.4分组
[1401]
在mkn45移植前,从32只小鼠中随机选出8只,设为正常组,向剩余的24只中移植mkn45。mkn45移植起12天后,通过实验数据收集处理系统(edcs、ver.2.1)基于体重以每组8只分为总计2组,由此进行分组,分配为mkn45组和humab2组。分组后,剩余动物在异氟烷麻醉下放血安乐死。
[1402]
1.3.5 dpbs和humab2的给药
[1403]
mkn45移植起14天后(分组起2天后)给药dpbs和humab2。以10ml/kg腹腔内给药dpbs和humab2。
[1404]
1.3.6体重和摄食量的测定
[1405]
从mkn45移植日起至抗体给药日,每3天测定体重和摄食量。抗体给药日起,在给药第0天、第2天、第4天、第7天后进行测定。
[1406]
1.3.7采血
·
解剖
[1407]
抗体给药后第7天,从异氟烷吸入麻醉小鼠的后大静脉采血。使用edta2k采血管制成血浆,在设为-80℃的冰箱中保存至使用。采血后的小鼠在麻醉下通过切开腹部后大静脉而放血安乐死。切开肿瘤部的皮肤,用手术刀收集肿瘤,测定重量。
[1408]
1.4统计分析方法
[1409]
对于抗体给药7天后的体重和肿瘤重量、抗体给药日起至第7天的累积摄食量,在正常组与mkn45组、mkn45组与humab2组之间分别进行非配对t检验。对于血中非结合gdf15浓度,进行威尔科克森秩和检验。统计分析使用sas软件(sas institute japan、r9.3)。
[1410]
2结果
[1411]
使用荷瘤(移植mkn45细胞)小鼠研究humab2对于作为癌症性恶病质症状的体重变化和摄食量变化的效果,还研究了对血中非结合gdf15量的影响。图8示出体重的变化、抗体给药后7天的累积摄食量、抗体给药7天后的血中非结合gdf15浓度。与正常组相比,mkn45组的抗体给药7天后的体重减少了4g左右,观察到了由移植mkn45细胞引起的显著的体重减轻(p《0.01)。另一方面,humab2组在抗体给药后观察到了体重减轻的恢复,观察到与mkn45组
相比体重显著增加(p《0.01)。同样,对于抗体给药后7天的累积摄食量,mkn45组显著减少(p《0.01),humab2组与mkn45组相比观察到显著的增大(p《0.01)。关于血中非结合gdf15浓度,正常组中未检测到,mkn45组中显著上升,达到了1500pg/ml左右(p《0.01),与图7的结果同样地,humab2组显著减少至二十分之一左右(p《0.01)。由这些结果可确认,移植mkn45小鼠的恶病质样症状(体重减轻、摄食量)通过给药humab2得以恢复。
[1412]
d.荷瘤小鼠模型的恶病质症状的改善(2)
[1413]
1试验材料和方法
[1414]
1.1受试物质的制备
[1415]
将humab2用dpbs制备成1mg/ml,在设定为-80℃的冰箱中保存至给药日。
[1416]
1.2试验体系
[1417]
1.2.1细胞
[1418]
1)细胞株名:mkn45
[1419]
1)来源:人(人胃癌组织)
[1420]
2)供应商:jcrb(japanese collection of research bioresources)
[1421]
3)培养条件:37℃5%co
2 预培养条件:37℃5%co2[1422]
a)培养液:rpmi1640
[1423]
i)供应商:life technologies
[1424]
b)血清:胎牛血清
[1425]
i)浓度:10%
[1426]
ii)供应商:tissue culture biology
[1427]
1.2.2动物
[1428]
1)种属/品系:小鼠/balb-c slc-nu/nu
[1429]
2)微生物学等级:无特定病原(spf)
[1430]
3)供应商:日本slc
[1431]
4)性:雌
[1432]
5)周龄:6-12周龄
[1433]
6)饲养条件
[1434]
在设为下述条件的环境下饲养动物。
[1435]
a)温度:23
±
2℃
[1436]
b)湿度:60
±
10%
[1437]
c)照明:照明时间:午前7时~午后7时
[1438]
关灯时间:午后7时~午前7时
[1439]
d)饲料和水:自由摄取(试验1的配对组每天给予规定量的饲料),crf-1(oriental yeast co.,ltd.),自来水
[1440]
1.2.3组构成
[1441]
[表21]
[1442] 组名细胞移植给药物质(用量)只数1正常(载体)无dpbs52mkn45(载体)mkn45dpbs4
3mkn45(humab2)mkn45humab2(10mg/kg)4
[1443]
1.3试验方法
[1444]
1.3.1模型的制作
·
分组
·
抗体的给药
[1445]
首先,随机选出5只作为正常组。恶病质模型制作按照上述c的记载进行,腹腔内给药抗体(图9)。
[1446]
1.3.2自主活动量的测定
[1447]
自主活动量测定中,在笼子内设置无线转轮(brain science idea、env-044),测定转轮的转速作为自主活动量。测定值在明亮期(午前7时至午后7时)和暗期(午后7时至午前7时)每12小时进行统计。
[1448]
1.4评价项目
[1449]
·
体重
[1450]
·
自主活动量
[1451]
1.5统计分析方法
[1452]
对于分组,以体重为指标一维进行。对于分组和检验,使用sas软件(sas institute japan、r9.3)。
[1453]
2结果
[1454]
为了评价由gdf15诱导的恶病质样症状,在笼子内放入转轮,测定自主活动量。图9示出试验日程。与正常组相比,mkn45组的活动量减少到十分之一左右。明确了该活动量减少在给药humab2后3天左右基本恢复到与正常组同等程度。另外明确了,mkn45组不仅活动量减少,而且活动方式也有所不同。正常组可观察到在暗期变得活泼、在明亮期活动性下降的夜行性动物特征,而mkn45组的该活动方式明显被颠倒。另外,给药抗体的humab2组中该模式也恢复到与正常组相同。
[1455]
iii.抗体制作(2)
[1456]
a.序列确定
[1457]
对于mab1和mab13(表1),与mab2同样地确定氨基酸序列。将h链和l链可变区的氨基酸序列示于表22,将cdr序列示于表23。
[1458]
[表22]
[1459][1460]
[表23]
[1461][1462]
b.突变抗体的制作
[1463]
与上述“i.抗体制作(1)g.通过cdr中的氨基酸置换得到的humab2突变体与hgdf15的结合”同样地,制作表24所示的进一步的humab2突变体。图10示出将humab2与hgdf15的结合量设为100时各突变抗体的结合量。得到了多个显示出与humab2同等或更高的结合量的抗体。
[1464]
[表24]
[1465][1466]
进而,将与hgdf15的结合力高的humab2突变体的h链(h49r、h49d、h48s、h71y、h83r、或h120f)与l链(l48k、l112d、l72f、或l74h)(表25)组合,调查所得到的抗体与hgdf15的结合。将结果示于图11。得到了多个显示与humab2同等或更高的结合量的抗体。
[1467]
[表25]
[1468][1469]
c.对gdf15、gfral和ret的复合物的形成的抑制活性的评价
[1470]
gdf15与作为受体的gfral和作为共受体的ret形成复合物,并转导细胞内信号。因此,研究了humab2对gdf15、gfral和ret的复合物的形成的影响。
[1471]
首先研究了对gdf15与gfral与的复合物的形成的影响(图12)。使利用ez-link micro nhs-peg4-bitinylation kit(thermo fisher scientific,21955)生物素化的gdf15(r&d systems,957-gd/cf)和抗gdf15单克隆抗体(表26)的阶梯稀释液与固相化有gfral(r&dsystems,9697-gr)的板反应。作为阴性对照用抗体,使用人igg1,kappa同种型对照(abcam)。使用pierce高灵敏度链霉亲和素-hrp(thermo fisher scientific,21130)检测与gfral结合的gdf15。显色使用tmb1-component microwell peroxidase substrate,
sureblue(seracarelifesciences),添加终止液(wako)而使反应停止。使用emax(moleculardevices)测定450nm(od450)的吸光度。将未添加抗体时的od450值作为对照,由添加各抗体时的od450值使用式-1计算相对于对照的百分比值。使用式-2由得到的相对于对照的百分比值计算抑制率,使用excel的ic50计算宏求出ic50值。
[1472]
相对于对照的百分比=添加抗体的样品的od450值
÷
未添加抗体时的od450值
×
100(式-1)
[1473]
抑制率=100-相对于对照的百分比(式-2)
[1474]
如表26所示,除humab2的抗gdf15抗体抑制gdf15与gfral的复合物的形成,而humab2对此没有抑制。认为该差异基于这些抗体的表位差异。
[1475]
[表26]
[1476][1477]
1)人源化抗hgdf15抗体(wo2014/100689)
[1478]
2)r&dsystems、mab957、lotno:udc1014011
[1479]
3)人igg1,kappa-同种型对照(abcam)
[1480]
然后,研究了对gdf15、gfral和ret的复合物的形成的影响。向固相化有30nm的gfral(r&dsystems)的elisa板中,添加50nm的gdf15(r&dsystems,9279-gd)、30nm的ret(r&dsystems,1168-cr)和humab2的阶梯稀释液(0-500nm)的混合液。作为阴性对照用抗体,使用人igg1,kappa同种型对照(abcam)。使用抗his过氧化物酶缀合抗体(r&dsystems,mab050h)检测所形成的gdf15/gfral/ret复合物。显色中使用tmb1-componentmicrowellperoxidasesubstrate,sureblue(seracarelifesciences),添加终止液(wako)而使反应停止。使用emax(moleculardevices)测定450nm的吸光度。将抗体浓度(0nm)(未添加抗体时)的od450值作为对照,由添加各抗体时的od450值使用式-1计算相对于对照的百分比值。由得到的相对于对照的百分比值,使用式-2计算抑制率,使用excel的ic50计算宏求出ic50值。
[1481]
humab2对于gdf15/gfral复合物的形成不显示抑制活性(表26),对gdf15/gfral/ret复合物的形成显示抑制活性(图13)。由这些结果认为,humab2通过抑制具有将信号转导到细胞内的功能的、与ret的复合物的形成来发挥抑制gdf15功能的活性。
[1482]
vi.药理试验(2)
[1483]
a.荷瘤小鼠模型的恶病质症状的改善(3)
[1484]
与上述“ii.药理试验(1)c.荷瘤小鼠模型的恶病质症状的改善(1)”同样地,使用荷瘤(移植mkn45细胞)小鼠研究mab1对体重、摄食量和血中非结合gdf15量的影响。将组构
成示于表27。
[1485]
[表27]
[1486] 组名细胞移植给药物质(用量)只数1正常(载体)无dpbs82mkn45(载体)mkn45dpbs83mkn45(mab17)mkn45mab17(10mg/kg)84mkn45(mab1)mkn45mab1(10mg/kg)8
[1487]
图14示出体重的变化、抗体给药后7天的累积摄食量和抗体给药7天后的血中非结合gdf15浓度。mkn45组中观察到体重减轻,与此相对地,mab1组在给药抗体后观察到了体重减轻的恢复。抗体给药后7天的累积摄食量方面,mab1组与mkn45组相比可见增大倾向。由于移植mkn45而增大的血中非结合gdf15浓度方面,与humab2(图8)同样地也因mab1而减少。由这些结果可确认,移植mkn45的小鼠的恶病质样症状(体重减轻、摄食量)因mab1的给药而得以恢复。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。