cd138人源化抗体分子及其用途
1.相关申请的交叉引用
2.本技术要求2019年6月17日提交的美国临时申请号62/862,457和2020年6月5日提交的美国临时申请号63/035,323的权益。上述申请的内容通过引用的方式全文纳入本文。
3.序列表
4.本技术包含以ascii格式电子提交的序列表并通过引用其全部内容纳入本文。在12.06.20创建的所述ascii拷贝命名为p2029-7029wo_sl.txt,大小为128,635字节。
背景技术:
5.多发性骨髓瘤(mm)是恶性浆细胞形成的癌症。这些肿瘤通常在骨骼中发展,但偶尔也发现于其它组织中。具有单个浆细胞瘤的疾病被称为分离的(或孤立的)浆细胞瘤。当存在多于一个浆细胞瘤时,称为多发性骨髓瘤。在美国,2017年估计新病例约为30,000例,预计有10,000多人死亡。尽管在多发性骨髓瘤治疗方面有治疗进展,但多发性骨髓瘤在大多数患者中仍是无法治愈的疾病。
6.需要开发用于治疗、预防和诊断多发性骨髓瘤和具有相似疾病机制的其它疾病的新方法。
技术实现要素:
7.本公开内容至少部分提供与cd138(例如人cd138)结合的人源化抗体分子,其包含本文公开的一种或多种性质,例如,一种或多种功能、生物物理和结构性质。例如,本文所述的人源化抗体分子可具有降低的免疫原性、更大的治疗疗效(例如,更低的肿瘤负荷和/或增加的总体存活率)、改进的靶结合(例如,亲和力)、改进的体外或体内稳定性,以及更高的哺乳动物重组表达水平。在一个实施方式中,所述抗体分子能够在表达cd138的细胞上引起效应物功能(例如,抗体依赖性细胞毒性(adcc)活性)。在一个实施方式中,对比可溶性cd138,所述抗体分子优先结合至膜结合的(membrane-bound)cd138。在一个实施方式中,抗体分子结合至cd138的胞外区域中的表位,其在跨膜结构域近处。在一个实施方式中,抗体分子不结合至cd138的整合素结合结构域(ibd)。在一个实施方式中,抗体分子不仅结合至cd138的ibd。不意在受理论限制,据信在一个实施方式中,通过靶向细胞膜近处的膜结合的cd138上的某些胞外区域,可实现改善的或最佳的细胞毒性。
8.在一个实施方式中,抗体分子选自表1,或与选自表1的抗cd138单克隆抗体竞争结合至cd138。在一个实施方式中,抗体分子结合至与被选自表1的抗cd138单克隆抗体识别的表位相同或重叠的表位。在一个实施方式中,抗体分子包含表1中所述的一个或多个重链可变区(vh)和/或一个或多个轻链可变区(vl)。在一个实施方式中,抗体分子包含表6-8中所述的重链(hc)和轻链(lc)。在一个实施方式中,抗体分子包含表1、7或8中所述的一个或多个重链cdr和/或一个或多个轻链cdr。
9.在一个实施方式中,抗体分子包含重链可变区(vh),其包含从表2中选择的氨基酸序列,或与包含从表2中选择的氨基酸序列的vh的抗cd138单克隆抗体竞争与cd138结合。在
一个实施方式中,抗体分子包含轻链可变区(vl),其包含从表2中选择的氨基酸序列,或与包含从表2中选择的氨基酸序列的vl的抗cd138单克隆抗体竞争与cd138结合。在一个实施方式中,抗体分子包含vh和vl,各自包含从表2中选择的氨基酸序列,或与包含从表2中选择的氨基酸序列的vh和vl的抗cd138单克隆抗体竞争与cd138结合。在一个实施方式中,抗体分子结合至与包含从表2中选择的氨基酸序列的vh和/或vl的抗cd138单克隆抗体识别的表位相同或重叠的表位。在一个实施方式中,抗体分子包含表2中所述的一个或多个(例如,1、2或3个)重链cdr和/或一个或多个(例如,1、2或3个)轻链cdr。
10.在一个实施方式中,抗体分子包含重链(hc),其包含从表6或7中选择的氨基酸序列,或与包含从表6或7中选择的氨基酸序列的hc的抗cd138单克隆抗体竞争与cd138结合。在一个实施方式中,抗体分子包含轻链(lc),其包含从表6或8中选择的氨基酸序列,或与包含从表6或8中选择的氨基酸序列的lc的抗cd138单克隆抗体竞争与cd138结合。在一个实施方式中,抗体分子包含hc和lc,各自包含从表6或7或者表6或8中选择的氨基酸序列,或与包含从表6或7或者表6或8中选择的氨基酸序列的hc和lc的抗cd138单克隆抗体竞争与cd138结合。在一个实施方式中,抗体分子结合至与包含从表6或7或者表6或8中选择的氨基酸序列的hc和/或lc的抗cd138单克隆抗体识别的表位相同或重叠的表位。在一个实施方式中,抗体分子包含表7或8中所述的一个或多个(例如,1、2或3个)重链cdr和/或一个或多个(例如,1、2或3个)轻链cdr。
11.在一个实施方式中,还提供了抗体分子-药物偶联物(adc),编码抗体分子的核酸分子,表达载体,宿主细胞,组合物(例如,药物组合物),试剂盒,容器,和用于制备抗体分子的方法。本文公开的抗体分子可(单独或与其它试剂或治疗方式联合)用于治疗、预防和/或诊断与cd138相关的疾病,例如癌症或癌前病症(例如多发性骨髓瘤或冒烟型骨髓瘤)。
12.因此,在某些方面,本公开内容提供人源化抗体分子,例如本文所述的人源化抗体分子,其具有以下性质a)-dd)中的一种或多种(例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29种或全部):
13.a)以高亲和性(例如,解离常数(kd)小于约100nm,通常约10nm,更通常约10-0.001nm,约10-0.01nm,约5-0.01nm,约3-0.05nm,约1-0.1nm,或更强,例如小于约80、70、60、50、40、30、20、10、8、6、4、3、2、1、0.5、0.2、0.1、0.05、0.01、0.005或0.001nm)结合至cd138(例如人cd138),
14.b)以高亲和性(例如,解离常数(kd)小于约100nm,通常约10nm,更通常约10-0.001nm,约10-0.01nm,约5-0.01nm,约3-0.05nm,约1-0.1nm,或更强,例如小于约80、70、60、50、40、30、20、10、8、6、4、3、2、1、0.5、0.2、0.1、0.05、0.01、0.005或0.001nm)结合至膜结合的cd138,
15.c)i)以高亲和性(例如,解离常数(kd)小于约100nm,通常约10nm,更通常约10-0.001nm,约10-0.01nm,约5-0.01nm,约3-0.05nm,约1-0.1nm,或更强,例如小于约80、70、60、50、40、30、20、10、8、6、4、3、2、1、0.5、0.2、0.1、0.05、0.01、0.005或0.001nm);或ii)以低亲和性(例如,解离常数(kd)大于约100nm,例如大于约200、300、400或500nm),结合至可溶性cd138,
16.d)结合至膜结合的cd138或cd138的完整胞外域,i)优选优于可溶性cd138,例如,对膜结合的cd138或cd138的完整胞外域的结合亲和性比对可溶性cd138的结合亲和性高至
少2、3、4、5、6、7、8、9或10倍;或ii)结合亲和性与对可溶性cd138的结合亲和性类似,例如,对膜结合的cd138或完整的cd138胞外域的结合亲和性比对可溶性cd138的结合亲和性高不到约10%、20%、30%、40%、50%、60%、70%、80%、90%或100%,
17.e)结合至cd138跨膜结构域近处的胞外区域中的一个或多个(例如2、3、4、5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50、55、60、65、70、75或更多个)cd138氨基酸残基,例如,在从跨膜结构域n末端起算的75、70、65、60、55、50、45、40、35、30、25、20、15、10或5个氨基酸内,
18.f)i)结合至远离跨膜结构域的cd138胞外区域,例如,该区域的c末端与跨膜结构域的n末端相距至少100、110、120、130、140、150、160、170、180、190或200个氨基酸;或ii)不结合或以低亲和性结合至远离跨膜结构域的cd138胞外区域,例如,该区域的c末端与跨膜结构域的n末端相距至少100、110、120、130、140、150、160、170、180、190或200个氨基酸,
19.g)结合至cd138的整合素结合结构域(ibd)或idb的n末端区域;或ii)不结合或以低亲和性结合至cd138的ibd或idb的n末端区域,
20.h)结合至包含跨膜结构域近处的胞外区域(例如,包含seq id no:1-3或450中任一个的氨基酸176-250(例如,176-214或210-250)的区域)中四个或更多个(例如,5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50、55、60、65、70、75个或更多个)连续氨基酸残基的cd138表位,任选地,其中所述表位还包含远离跨膜结构域的胞外区域(例如,包含seq id no:1-3或450中任一个的氨基酸23-50、51-95、88-121、88-102或111-150的区域)中的四个或更多个(例如,5、6、7、8、9、10、11、12、13、14、15、20、25、30、35或更多个)连续氨基酸残基,
21.i)结合至cd138中两个或更多个不同区域,例如,包含两组相同或基本相同的vh-vl对(其各自结合至相同的两个或更多个区域)或包含不同组的vh-vl对(其各自独立地结合至不同区域)的多价(例如,二价、三价或四价)抗体分子,
22.i)不结合至包含远离跨膜结构域的胞外区域(例如,包含seq id no:1-3或450中任一个的氨基酸23-50、51-95、88-121、88-101或111-150的区域)中四个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、15、20、25、30、35或更多个)连续氨基酸残基的cd138表位,
23.k)以高亲和性结合至表达cd138的癌细胞或癌前细胞(例如,骨髓瘤细胞),
24.1)结合至免疫细胞(例如,自然杀伤(nk)细胞、巨噬细胞、单核细胞或嗜酸性粒细胞)表面上的fc受体(fcr)(例如,fcγri、fcγriia、fcγriib、fcγriic、fcγriiia或fcγriiib之一或多者),
25.m)在表达cd138的靶细胞上引起效应物功能(例如adcc活性),
26.n)结合至c1q并在表达cd138的靶细胞上引起补体依赖性细胞毒性(cdc),
27.o)介导一种或多种cd138表达型细胞的同型粘附,
28.p)抑制蛋白酶对膜结合的cd138的作用,例如减少cd138的脱落;
29.q)体外、离体或体内降低(例如抑制)cd138表达型细胞的一种或多种生物活性,
30.r)体外、离体或体内降低(例如抑制)cd138的一种或多种功能(例如cd138与配体的结合),
31.s)减少(例如抑制)cd138表达型癌细胞或癌前细胞的增殖,
32.t)结合至cd138上与本文所述的抗cd138单克隆抗体识别的表位相同、相似或重叠
的表位,
33.u)与本文所述的抗cd138单克隆抗体显示相同或相似的结合亲和性或特异性,或两者兼具,
34.v)与包含本文所述的重链可变区和/或轻链可变区(例如,本文所述的任何抗cd138单克隆抗体的重链可变区和/或轻链可变区)的人源化抗体分子显示相同或相似的结合亲和性或特异性,或两者兼具,
35.w)显示与包含本文所述的一个或多个(例如,两个或三个)重链cdr和/或一个或多个(例如,两个或三个)轻链cdr(例如本文所述的任何抗cd138单克隆抗体的一个或多个(例如,两个或三个)重链cdr和/或一个或多个(两个或三个)轻链cdr)的人源化抗体分子相同或相似的结合亲和性或特异性,或两者兼具,
36.x)显示与包含本文所述的氨基酸序列的人源化抗体分子相同或相似的结合亲和性或特异性,或两者兼具,
37.y)显示与包含由本文所述的核苷酸序列编码的氨基酸序列的人源化抗体分子相同或相似的结合亲和性或特异性,或两者兼具,
38.z)抑制(例如竞争性抑制)第二抗体分子与cd138的结合,其中第二抗体分子是本文所述的人源化抗体分子,
39.aa)与第二抗体分子竞争与cd138结合,其中所述第二抗体分子是本文所述的人源化抗cd138单克隆抗体,
40.bb)具有本文所述的人源化抗cd138单克隆抗体的一种或多种生物学性质,
41.cc)具有本文所述的人源化抗cd138单克隆抗体的一种或多种结构性质,或
42.dd)具有本文所述的人源化抗cd138单克隆抗体的一种或多种药代动力学性质。
43.一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
44.(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与本文公开的抗cd138单克隆抗体(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中的任一个,例如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述抗cd138抗体的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述抗cd138抗体的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
45.(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与所述抗cd138抗体的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述抗cd138抗体的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述抗cd138抗体的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
46.在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述抗cd138抗体的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述抗cd138抗体的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述抗cd138抗体的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
47.在一个实施方式中,vh包含:(i)hcdr1,其包含所述抗cd138抗体的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述抗cd138抗体的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述抗cd138抗体的hcdr3的氨基酸序列。
48.在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述抗cd138抗体的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述抗cd138抗体的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述抗cd138抗体的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
49.在一个实施方式中,vl包含:(i)lcdr1,其包含所述抗cd138抗体的lcdr1的氨基酸序列;(ii)lcdr2,其包含所述抗cd138抗体的lcdr2的氨基酸序列;和(iii)lcdr3,其包含所述抗cd138抗体的lcdr3的氨基酸序列。
50.在一个实施方式中,抗体分子包含:
51.(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述抗cd138抗体的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述抗cd138抗体的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述抗cd138抗体的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
52.(a)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述抗cd138抗体的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述抗cd138抗体的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述抗cd138抗体的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
53.在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述抗cd138抗体的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述抗cd138抗体的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述抗cd138抗体的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,其包含所述抗cd138抗体的lcdr1的氨基酸序列;(ii)lcdr2,其包含所述抗cd138抗体的lcdr2的氨基酸序列;和(iii)lcdr3,其包含所述抗cd138抗体的lcdr3的氨基酸序列。
54.在一个实施方式中,vh所含的氨基酸序列与抗cd138抗体的vh的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含所述抗cd138抗体的vh的氨基
酸序列。
55.在一个实施方式中,vl所含的氨基酸序列与抗cd138抗体的vl的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含抗cd138抗体的vl的氨基酸序列。
56.在一个实施方式中,(a)vh所含的氨基酸序列与所述抗cd138抗体的vh的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与所述抗cd138抗体的vl的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
57.在一个实施方式中,vh包含抗cd138抗体的vh的氨基酸序列,而vl包含抗cd138抗体的vl的氨基酸序列。
58.在一个实施方式中,抗体分子包含fc区(例如,本文所述的fc区)。在一个实施方式中,抗体分子包含igg,例如,igg1的重链恒定区。在一个实施方式中,抗体分子还包含κ的轻链恒定区。
59.在一个实施方式中,抗体分子包含重链(hc),其包含与抗cd138抗体的hc的氨基酸序列相差不超过1,2,3,4,5,6,7,8,9,10,11,12,13,14或15个氨基酸残基,或与其具有至少85,90,95,99或100%同源性的氨基酸序列。在一个实施方式中,hc包含抗cd138抗体的hc的氨基酸序列。
60.在一个实施方式中,抗体分子包含轻链(lc),其包含与抗cd138抗体的lc的氨基酸序列相差不超过1,2,3,4,5,6,7,8,9,10,11,12,13,14或15个氨基酸残基,或与其具有至少85,90,95,99或100%同源性的氨基酸序列。在一个实施方式中,lc包含抗cd138抗体的lc的氨基酸序列。
61.在一个实施方式中,抗体分子包含:(a)重链(hc),其所含的氨基酸序列与所述抗cd138抗体的hc的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)轻链(lc),其所含的氨基酸序列与所述抗cd138抗体的lc的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。在一个实施方式中,hc包含抗cd138抗体的hc的氨基酸序列,而lc包含抗cd138抗体的lc的氨基酸序列。
62.在一个实施方式中,抗体分子包含:(a)重链(hc),其所含的氨基酸序列与seq id no:527的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)轻链(lc),其所含的氨基酸序列与seq id no:528的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。在一个实施方式中,hc包含seq id no:527的氨基酸序列或者lc包含seq id no:528的氨基酸序列。在一个实施方式中,hc包含seq id no:527的氨基酸序列并且lc包含seq id no:528的氨基酸序列。
63.一方面,本公开内容的特征在于一种抗体分子,其与本文所述的人源化抗cd138单克隆抗体(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中任一个)竞争结合至cd138。
64.一方面,本公开内容的特征在于一种抗体分子,其结合、或基本上结合至与本文所
述的人源化抗cd138单克隆抗体(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中任一个)的表位完全或部分重叠的表位。
65.一方面,本公开内容的特征在于一种抗体-分子药物偶联物(adc),其包含本文所述的人源化抗体分子,任选地包含细胞毒性剂,还任选地包含接头。
66.一方面,本公开内容的特征在于一种组合物,其包含本文所述的人源化抗体分子或本文所述的adc,任选地,其中所述组合物是药物组合物。
67.在一个实施方式中,组合物还包含药学上可接受的运载体。
68.一方面,本公开内容的特征在于编码本文所述的人源化抗体分子的重链可变区(vh)、轻链可变区(vl)或两者的核酸分子。
69.在一个方面中,本公开特征之一在于一种载体,其包含本文所述的核酸分子。
70.一方面,本公开内容的特征在于一种细胞,其包含本文所述的核酸分子或本文所述的载体,任选地,其中所述细胞是分离的细胞。
71.一方面,本公开内容的特征在于一种试剂盒,其包含本文所述的人源化抗体分子、本文所述的adc或本文所述的组合物,以及所述抗体分子或组合物的使用说明。
72.一方面,本公开内容的特征在于一种容器,其包含本文所述的人源化抗体分子、本文所述的adc或本文所述的组合物。
73.一方面,本公开内容的特征在于产生人源化抗cd138抗体分子的方法,该方法包括在允许产生所述人源化抗体分子的条件下培养本文所述的细胞,从而产生所述抗体分子。
74.在一个实施方式中,该方法还包括分离或纯化抗体分子。
75.一方面,本公开内容的特征在于本文所述的人源化抗体分子、本文所述的adc或本文所述的组合物,其用于治疗对象的癌症的方法。
76.在一个实施方式中,所述癌症是血液癌症。在一个实施方式中,癌症是多发性骨髓瘤。在一个实施方式中,癌症是实体瘤,例如本文所述的实体瘤。在一个实施方式中,抗体分子降低对象,例如患有多发性骨髓瘤的对象中的肿瘤负荷。
77.在一个实施方式中,将抗体分子,adc或组合物静脉内给予对象。在一个实施方式中,将抗体分子腹膜内给予对象。
78.在一个实施方式中,抗体分子、adc或组合物以以下剂量给予对象:0.1mg/kg-50mg/kg、0.2mg/kg-25mg/kg、0.5mg/kg-10mg/kg、0.5mg/kg-5mg/kg、0.5mg/kg-3mg/kg、0.5mg/kg-2.5mg/kg、0.5mg/kg-2mg/kg、0.5mg/kg-1.5mg/kg、0.5mg/kg-1mg/kg、1mg/kg-1.5mg/kg、1mg/kg-2mg/kg、1mg/kg-2.5mg/kg、1mg/kg-3mg/kg、1mg/kg-2.5mg/kg,或1mg/kg-5mg/kg。在一个实施方式中,抗体分子、adc或组合物以以下剂量给予:1-50mg/kg,例如1-40mg/kg,1mg/kg-30mg/kg,1mg/kg-20mg/kg,1mg/kg-10mg/kg,或1mg/kg-5mg/kg。在一个实施方式中,抗体分子以约4mg/kg,例如约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20mg/kg的剂量给予。
79.在一个实施方式中,抗体分子、adc或组合物以以下固定剂量给予对象:10mg-1000mg、10mg-500mg、10mg-250mg、10mg-150mg、10mg-100mg、10mg-50mg、250mg-500mg、150mg-500mg、100mg-500mg、50mg-500mg、25mg-250mg、50mg-150mg、50mg-100mg、100mg-150mg、100mg-200mg,或150mg-250mg。
80.在一个实施方式中,抗体分子、adc或组合物每周一次,每周两次,每两周一次,每三周一次或每四周一次给予。
81.在一个实施方式中,用途还包括确定来自对象的样品中cd138的水平。在一个实施方式中,用途还包括向所述对象给予针对癌症的第二种疗法。
82.一方面,本公开内容的特征在于本文所述的人源化抗体分子、本文所述的adc或本文所述的组合物,其用于治疗癌前病症或预防癌症的方法。
83.在一个实施方式中,癌前病症是冒烟型骨髓瘤或意义未明的单克隆丙种球蛋白血症(mgus)。在一个实施方式中,癌症是多发性骨髓瘤。
84.一方面,本公开内容的特征在于一种引起adcc活性的方法,该方法包括使细胞或对象接触本文所述的人源化抗体分子、本文所述的adc或本文所述的组合物,从而引起adcc活性。
85.一方面,本公开内容的特征在于一种治疗癌症的方法,该方法包括向有此需要的对象给予有效量的本文所述的人源化抗体分子、本文所述的adc或本文所述的组合物,从而治疗癌症。
86.在一个方面,本公开内容的特征在于一种治疗癌前病症或预防癌症的方法,该方法包括向有此需要的对象给予有效量的本文所述的人源化抗体分子、本文所述的adc或本文所述的组合物,从而治疗癌前病症或预防癌症。
87.一方面,本公开内容的特征是一种检测抗cd138分子的方法,该方法包括使细胞或对象与本文所述的人源化抗体分子接触,从而检测cd138分子。
88.在一个实施方式中,抗体分子与可检测标记物偶联。在一个实施方式中,体外、离体或体内检测cd138分子。
89.本公开包涵任何一个或多个前述方面和/或实施方式的所有组合,以及与详细描述和实施例中所提供的任何一个或多个实施方式的组合。
90.通过说明书和附图以及权利要求书不难了解本文组合物和方法的其它特征、目的和优点。
91.附图简要说明
92.图1显示了不同剂量的人源化抗cd138抗体与cd138 多发性骨髓瘤细胞系u266的结合。
93.图2显示了不同剂量的人源化抗cd138抗体靶向cd138 淋巴母细胞性骨髓瘤细胞的adcc活性。在adcc作用机制(moa)分析中,使用生物发光报告测定来定量抗体对途径活化的生物活性,从而评估adcc活性。该生物测定包括稳定表达fcγriiia受体的工程化jurkat细胞,以及驱动萤火虫萤光素酶表达的nfat反应元件,作为效应细胞。
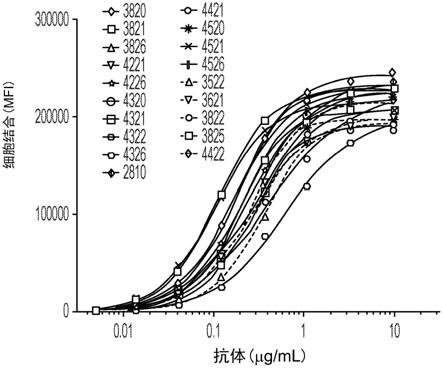
94.图3a-3c是显示人源化抗cd138抗体与三种多发性骨髓瘤细胞系mm1.s、lp-1和rpmi 8226的剂量依赖性结合的一系列图表。
95.图4a-4d是显示人源化抗cd138抗体在四种多发性骨髓瘤细胞系u266、mm1.s、lp-1和rpmi 8226中诱导adcc的一系列图表。
96.图5a-5d是显示单克隆抗cd138抗体2810体内功效的一系列图表。显示了在特定时间点通过ivis成像定量播散性多发性骨髓瘤的平均bli
±
95%ci(图5a)。通过多重t检验比较治疗组的统计数据(bonferroni dunn)。载剂组和单克隆抗体2810组小鼠全身肿瘤负荷
的比较(还显示了平均值加最小值-最大值)(图5b)。处死后第42天离体成像的骨骼组织中,在脊柱(图5c)和后肢(图5d)中肿瘤负荷的生物发光(bli)。通过未配对t检验来确定统计学数据。在对数标尺上绘制bli数据。
97.图6a-6c是显示单克隆抗cd138抗体体内功效的一系列图表。显示了在特定时间点和剂量水平通过ivis成像定量播散性多发性骨髓瘤的平均bli
±
标准误差(图6a)。通过双向anova(徒吉多重比较)进行的统计学分析。在载剂对照人源化抗cd138抗体mab 4320和小鼠嵌合抗cd138 mab 2810治疗组中,个体小鼠全身肿瘤负荷的比较(图6b)。平均值 最小值-最大值也以条形图的形式显示中值。在对数标尺上绘制bli数据。载剂组动物对比用抗cd138抗体mab 2810和4320治疗的动物的存活百分比(图6c)。存活率或存活百分比界定为存活到与疾病相关的发病率相关的预定安乐死标准(如体重减轻超过20%,中枢神经系统功能严重受损或运动严重受损或翻正反射丧失)的小鼠。对数秩检验(mantel-cox)用于比较存活曲线(vc对比用抗cd138抗体治疗的动物)。
98.图7是通过差示扫描荧光(dsf)分析评估抗cd138抗体热稳定性的一系列图表。热熔解(thermal melting)曲线显示为热扫描的一阶导数变换(d(荧光)/d(温度))。热转变(tm1和tm2)用垂直线表示,并在表4中总结。
99.图8是显示转基因人fcrn半合子小鼠品系tg 276中单剂量给药的小鼠血清中抗cd138抗体的相对水平的图表。尾静脉注射给予抗cd138单克隆抗体,剂量水平为2.5mg/kg。通过elisa(用于检测人igg1 fc)测定注射后约65小时采集的血清样品中的抗体滴度,并绘制为在给药后早期时间点(1小时)测量的标准化至血清抗体滴度的剩余抗体百分比。用虚线标出嵌合抗体mab2810(白色条)和人源化抗cd138mab 4320(黑色条)的水平。为便于比较,本分析中还包括抗rsv抗体莫维珠单抗(motavizumab)(mvz)。
100.图9a-9b是一系列图表,显示了人源化抗体mab 4320和参考抗体bb4的比较剂量依赖性细胞结合和fc效应物介导的adcc活性。通过流式细胞术(图9a)测定,细胞与人淋巴母细胞系u266(表达cd138)结合。结合到细胞表面cd138的抗体被定量为平均荧光强度。使用jurkat报告物生物测定法测量adcc活性,将人fcrγiiia转基因作为效应细胞(图9b)。数据标准化为相对于负抗体对照的诱导倍数。
101.图10总结了人源化抗cd138抗体mab 4320和参考抗体bb4与不同浓度的人cd138和选择cd138衍生肽的可溶性胞外结构域的差异结合。通过配体捕获elisa定量蛋白质和肽结合。标注对应于整合素结合域(指定为肽2a)或膜近端区域(指定为肽6a)的cd138肽。
102.图11是用于评估mab 4320治疗效果的体内多发性骨髓瘤播散(异种移植)模型的示意图。实验概述列出了小鼠背景(cb.17scid小鼠)、人类mm1.s(luc)细胞系、成像分析(活体成像/全身发光以测量肿瘤负荷)和给药计划(静脉注射,每周两次,超过8周)。治疗组(n=8只小鼠/组)包括载剂对照、mab 2810(4mg/kg)和mab 4320可变剂量(4、8和16mg/kg)。在实验设计图中,指出了三个阶段:分期阶段、给药阶段(有疗效)和存活阶段。bli,生物发光。
103.图12是用所示抗体分子治疗多发性骨髓瘤异种移植模型小鼠后的群体疗效数据。播散性肿瘤负荷显示为在特定时间点和剂量水平通过ivis成像定量播散性多发性骨髓瘤的平均bli
±
标准误差。疗效部分由时间-评估大小(bli等于1x109p/s)确定,并用水平虚线表示。采用双向anova(徒吉多重比较)进行统计分析,以将mab 4320治疗组与其他治疗组进行比较。p值的计算基于交互作用作为方差来源。在对数标尺上绘制bli数据。
104.图13是显示用所示抗体分子治疗后多发性骨髓瘤异种移植模型中个体小鼠的疗效数据的图表。载剂对照组对比抗体治疗组小鼠全身肿瘤负荷的比较。平均bli值用水平条表示。
105.图14是一系列显示从多发性骨髓瘤异种移植研究生物发光(bli)结果的图像。如图所示,显示在肿瘤植入后第35天,比较mab 4320、mab 2810和载剂组的个体小鼠的bli图像。
106.图15显示了多发性骨髓瘤异种移植研究的群体存活率结果。所示为载剂组动物对比经抗cd138抗体mab 2810和mab 4320治疗的动物的kaplan-meier存活曲线。存活率或存活百分比界定为存活到与疾病相关的发病率相关的预定安乐死标准(如体重减轻超过20%,中枢神经系统功能严重受损或运动严重受损或翻正反射丧失)的小鼠。通过mantel-cox检验计算vc与mab 4320治疗(对数秩检验)比较的p值。
107.图16是显示多发性骨髓瘤异种移植研究中动物体重变化的图表。体重的百分比变化被绘制为平均值的标准误差。与mab 4320治疗组相对应的动物用空心符号标注;与载剂对照(vc)相对应的动物用实心圆圈表示。载剂对照组动物的体重变化最大,表明与疾病进展相关。
108.图17以抗体分子血清滴度的形式显示了多发性骨髓瘤异种移植研究的药代动力学(pk)结果。每周采集一次血清样品(n=4只小鼠组)。通过elisa优化检测人igg1 fc,对抗体血清滴度进行定量。以vc组血清作为阴性对照。插图:第13天mab 4320的抗体分子血清滴度对比剂量水平(抗体浓度)的曲线图。
109.图18a-18b是一系列图表,显示了mab 4320和硼替佐米治疗的疗效。在第0天通过静脉注射给药途径向cb17 scid小鼠注射mm1.s(luc)细胞,并在第14天分期,这也与载剂对照、mab 4320(4mg/kg)、硼替佐米(1mg/kg)或mab 4320和硼替佐米的组合给药的第一天相对应。n=9只小鼠/治疗组。肿瘤负荷通过全身生物发光(bli)进行评估,并通过ivis成像进行定量,如方法(第3.2节)所述。在第53天(给药阶段)停止治疗,然后进行为期三周的冲洗期,研究结束于第73天。(a)组疗效数据。播散性肿瘤负荷报告为生物发光(bli)
±
每个时间点平均值的标准误差。(b)个体小鼠。
110.图19a-19d是一系列代表性的生物发光(bli)图像,这些图像是在第36天根据其接近bli中值的情况,选择给予指定治疗的个体小鼠的生物发光(bli)图像。为了标准化(最小值为1.0x106;最大值为3.0x108),对图像强度进行了调整,但这并不意味着在第14天(分期当天和第一次给药之前)没有肿瘤负荷。载剂对照组的所有动物在第53天之前处死。
111.图20是以kaplan-meier生存曲线的形式显示了给予指定治疗的小鼠随时间的存活率的图表。治疗在第53天中止。存活率定义为小鼠存活到与疾病相关的发病率相关的预定安乐死标准,如体重减轻超过20%,中枢神经系统功能严重受损或运动严重受损或翻正反射丧失。
112.图21是显示了在给予指定治疗后动物体重的变化的图表。体重的百分比变化被绘制为平均值的标准误差。载剂对照组动物的体重变化最大,表明与疾病进展相关。硼替佐米单药治疗组也观察到体重减轻,这可能是由于药物毒性所致。
具体实施方式
113.本文公开了结合至cd138(例如人cd138)的人源化抗体分子。有利地,至少几种本文所述的人源化抗体分子具有改善的抑制表达cd138的细胞的能力,例如通过引发效应物功能来实现。不意在受理论限制,据信在一个实施方式中,与本文所述的所需表位结合的抗cd138抗体具有增强的效应物功能和与膜相关形式的cd138的优先结合。有效地靶向cd138可以导致对骨髓瘤和其它癌症的广泛活性和有利治疗指数。
114.与亲代非人源化抗体分子相比,本文所述的人源化抗体分子可以具有一种或多种改进的性质,例如,本文所述的一种或多种性质。例如,改进的性质可以包括但不限于治疗疗效、免疫原性的缓解、生物物理、物理化学和药物性质的改善、靶向结合的改善、生物活性的改善、以及在用于抗体生产的哺乳动物细胞系中的更高重组表达。在不希望受到理论约束的情况下,相信在一个实施方式中,本文所述的人源化抗体分子比非人源化抗体分子更适合用于人类的治疗或药物用途。在一个实施方式中,人源化抗体分子具有更高的治疗效果(例如,更低的肿瘤负荷和/或更高的存活率)。在一个实施方式中,人源化抗体分子具有增加的稳定性(体外和/或体内)。在一个实施方式中,人源化抗体分子具有更高的表达水平(例如,在细胞系中)。在一个实施方式中,与亲代非人源化抗体相比,人源化抗体分子具有相当或改进的cd138结合亲和力、效应物功能(例如,adcc活性)或两者。
115.本文所述的抗cd138抗体分子(例如,人源化抗cd138抗体分子)可用于治疗多种疾病,例如多发性骨髓瘤和其他肿瘤适应症。在不希望受到理论约束的情况下,相信在一个实施方式中,疾病涉及cd138阳性癌细胞和/或cd138介导的与疾病病理生理学相关的生物活性。例如,cd138在以胰腺导管腺癌为例的各种癌的肿瘤发生和耐药性背后的kras驱动途径中起着重要作用。
116.本文所述的抗cd138抗体分子(例如,人源化抗cd138抗体分子)可具有特别适合于治疗人类疾病的生物活性。例如,示例性的人源化抗cd138抗体分子mab 4320表现出与其免疫介导的治疗作用机制相关的强大体外活性。例如,这些属性包括与cd138 骨髓瘤细胞的亚纳摩尔结合,以及针对几种mm细胞系的抗体依赖性细胞介导的细胞毒性(adcc),例如,使用人源性nk细胞进行的基于生物学相关的自然杀伤(nk)细胞的adcc分析中评估的。这种有效的细胞杀伤活性既有剂量依赖性,也有靶向依赖性,已被证明对许多可变表达的cd138多发性骨髓瘤细胞系(包括耐药的mm细胞系,例如对硼替佐米或来那度胺有耐药性的繁殖的稳定细胞系)非常有效,这两种一线疗法通常结合使用,作为患者的标准护理,用于诱导、巩固或维持治疗。mab 4320可有效杀死对此类治疗无反应的复发/难治患者的自体源性骨髓瘤细胞。其他相关的作用机制,如抗体依赖性细胞吞噬(adcp)、直接抑制骨髓瘤细胞存活和阻断整合素结合,也可能存在。在涉及使用cb.17小鼠中播散性mm1.s肿瘤的鼠异种移植疾病模型中,mab 4320作为单一药物或与蛋白酶体抑制剂(例如硼替佐米)组合以实现协同效应的体内疗效也已被证明。
117.还提供了抗体-药物偶联物(adc),编码抗体分子的核酸分子,表达载体,宿主细胞,组合物(例如药物组合物),试剂盒和用于制备抗体分子的方法。可将本文公开的抗体分子和药物组合物(单独或与其它试剂或治疗方式联合)用于治疗、预防和/或诊断疾病和病症,例如与cd138有关的疾病和病症,例如癌症或癌前病症。
118.定义
119.本文使用冠词“一个”和“一种”表示一个/种或一个/种以上的(即至少一个/种)该冠词语法上的宾语。
120.除非上下文明确作出不同指示,本文所用术语“或/或者”是指“和/或”,并可与其互换使用。
[0121]“约”和“近似”应通常表示在考虑测量的性质或精度的情况下测得量的可接受的误差度。示例性误差程度在给定值范围或值的20%内,通常在10%内,更通常在5%内。当在一系列数字或范围之前存在“约”或“近似”时,应理解“约”或“近似”可修饰该系列或范围中的每个数字。类似地,当在一系列数字或范围之前出现“至少”,“大于”,“不大于”,“小于”,“不小于”或“在
……
之内”时,应理解为“至少”,“大于”,“不大于”,“小于”,“不小于”或“在
……
之内”可修饰该系列或范围内的每个数字。如本文所用,范围包括上限和下限。
[0122]
本文所述的组合物和方法包括具有指定序列的多肽和核酸,或具有与指定序列基本相同或与其相似(例如与指定序列至少85%、90%、95%或更高相同性)的序列的多肽和核酸。
[0123]
在描述氨基酸序列的情况下,用于本文的术语“基本相同”是指第一氨基酸含有足够或最少数量的如下氨基酸残基:i)与第二氨基酸序列中的比对氨基酸残基相同,或ii)第二氨基酸序列中的比对氨基酸残基的保守取代,从而第一和第二氨基酸序列可具有共有的结构域和/或共同的功能活性。例如,包含与参比序列(例如本文所提供的序列)具有至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同性的共有结构域的氨基酸序列。
[0124]
在描述核苷酸序列的情况下,本文所用术语“基本相同”是指第一核酸序列包含足够或最少数量的与第二核酸序列中的比对核苷酸相同的核苷酸,从而第一和第二核苷酸序列编码具有相同功能活性的多肽、或编码共有结构多肽结构域或共有功能性多肽活性。例如,包含与参比序列(例如本文所提供的序列)具有至少约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同性的核苷酸序列。
[0125]
术语“功能性变体”是指与天然序列具有基本相同氨基酸序列或由基本相同的核苷酸序列编码、且能够具有天然序列一种或多种活性的多肽。
[0126]
序列间的同源性或序列相同性(这些术语在本文中可互换使用)的计算如下进行。
[0127]
为了确定两条氨基酸序列或两条核酸序列的百分比相同性,可以为了最佳比较目的而对序列进行比对(例如,可以在第一和第二氨基酸或核酸序列的之一或两条中引入缺口以达到最佳对齐,并且出于比较目的可以不考虑非同源序列)。在一个典型的实施方式中,用于比较目的比对的参比序列长度为该参比序列长度的至少30%,例如至少40%、50%、60%,例如至少70%、80%、90%、100%。然后比较对应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当第一序列中某位置上占据的氨基酸残基或核苷酸与第二序列中相应位置上的相同时,则这些分子在该位置是相同的。
[0128]
考虑到用于两个序列的最佳比对而需要引入的缺口数和每个缺口的长度,两条序列之间的百分比相同性与序列共有相同位置的数目相关。
[0129]
序列的比较和两个序列之间百分比同一性的确定可以使用数学算法来完成。在一些实施方式中,两条氨基酸序列之间的百分比相同性可以使用needleman和wunsch(j.mol.biol.(48):444-453(1970))算法确定,该算法已经结合到gcg软件包中的gap程序
中(可从gcg.com获得),使用blossum 62矩阵或pam250矩阵,缺口权重为16、14、12、10、8、6或4,长度权重为1、2、3、4、5或6。在某些实施方式中,两条核苷酸序列之间的相同性百分比使用gcg软件包中的gap程序(可从gcg.com获得),采用nwsgapdna.cmp矩阵和40、50、60、70或80的缺口权重,1、2、3、4、5或6的长度权重进行计算。一组合适的参数(以及除非另有说明而应采用的参数组)为blossum 62评分矩阵,其缺口罚分为12,缺口延伸罚分为4,译码缺口罚分为5。
[0130]
两条氨基酸或核苷酸序列之间的相同性百分比也可以使用e.meyers和w.miller(cabios,4:11-17(1989))的算法确定,该算法已被并入align程序(版本2.0),使用pam120权重残基表,缺口长度罚分为12,缺口罚分为4。
[0131]
本文公开的核酸和蛋白质序列还可以用作“查询序列”来对公共数据库进行搜索,以例如鉴定其他家族组成部分或相关序列。这类搜索可使用altschul等,1990,j.mol.biol.,215:403-10的nblast和xblast程序(2.0版本)来运行。可以使用nblast程序进行blast核苷酸搜索,评分=100,字长=12,以获得与本文所述核酸同源的核苷酸序列。可利用xblast程序进行blast蛋白质搜索,评分=50,字长=3,以获得与本文所述蛋白质分子同源的氨基酸序列。为了获得出于比较目的的缺口比对结果,可如altschul等,1997,nucleic acids res.,25:3389-3402所述利用缺口blast。利用blast和缺口blast程序时,可使用各程序(例如xblast和nblast)的默认参数。参见ncbi.nlm.nih.gov。
[0132]
如本文所用,术语“在低严格、中等严格、高严格或极高严格条件下杂交”是指杂交和洗涤的条件。进行杂交反应的指导可见于current protocols in molecular biology(《新编分子生物学实验指南》,约翰威利父子出版公司(john wiley&sons),纽约州(1989),6.3.1-6.3.6),纳入本文作为参考。该参考文献中描述了水性和非水性方法,可采用这两种方法中的任一种。本文涉及的特定杂交条件如下:1)低严格杂交条件,在约45℃的6x氯化钠/柠檬酸钠(ssc)中,然后在0.2x ssc、0.1%sds中至少50℃下进行两次洗涤(洗涤温度可提高至55℃适用于低严格条件);2)中等严格杂交条件,在约45℃左右的6x-ssc中,然后在0.2x ssc、0.1%sds(60℃)中进行一次或多次洗涤;3)高严格杂交条件,在约45℃左右的6x-ssc中,然后在0.2x ssc、0.1%sds(65℃)中进行一次或多次洗涤,和优选4)极高严格杂交条件是0.5m磷酸钠,7%sds,65℃,然后在0.2x ssc、1%sds(65℃)中进行一次或多次洗涤。极高严格条件4)是合适的条件,且为应采用的条件(除非另有说明)。
[0133]
应理解,本文所述分子可具有其它保守或非必需的氨基酸取代,其不对分子功能产生实质性影响。
[0134]
术语“氨基酸”涵盖了包含氨基官能团和酸官能团且能够被包含于天然存在氨基酸形成的聚合物的所有分子,不论其为天然或合成分子。示例性氨基酸包括天然存在的氨基酸;其类似物、衍生物及同类物;具有变体侧链的氨基酸类似物;以及前述中任意的所有立体异构体。如本文所用,术语“氨基酸”包括d-和l-镜像异构体和模拟肽。
[0135]“保守性氨基酸取代”是其中一个氨基酸残基被具有相似侧链的另一个氨基酸残基替代的情况。本领域已定义具有带相似侧链的氨基酸残基家族。这些家族包括:具有碱性侧链的氨基酸(如赖氨酸、精氨酸、组氨酸)、具有酸性侧链的氨基酸(如天冬氨酸、谷氨酸)、具有不带电极性侧链的氨基酸(如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、具有非极性侧链的氨基酸(如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨
酸、甲硫氨酸、色氨酸)、具有β-分支侧链的氨基酸(如苏氨酸、缬氨酸、异亮氨酸)和具有芳族侧链的氨基酸(如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。
[0136]
术语“多肽”、“肽”和“蛋白质”(若为单链)在本文中可互换使用,指任何长度的氨基酸的聚合物。聚合物可以是线性或支化聚合物,可以包含经修饰的氨基酸,并且可间插有非氨基酸。该术语也包括修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它操作,如与标记组分偶联。多肽可从天然来源分离,可采用重组技术由原核或真核宿主产生,或者可为合成方法的产品。
[0137]
术语“核酸”、“核酸序列”、“核苷酸序列”或“多核苷酸序列”和“多核苷酸”在本文中可互换使用。它们指任何长度的核苷酸聚合形式,不论是脱氧核糖核苷酸或核糖核苷酸或它们的类似物。多核苷酸可以是单链或双链,并且如果是单链,可以是编码链或非编码(反义)链。多核苷酸可包括修饰的核苷酸,如甲基化的核苷酸和核苷酸类似物。核苷酸序列可间插有非核苷酸组分。多核苷酸聚合后可被进一步修饰,如通过与标记性组分偶联。核酸可为重组多核苷酸、或基因组、cdna、半合成或合成来源的多核苷酸,即非天然存在或以非天然排列方式与另一多核苷酸相联。
[0138]
本文所用术语“分离的”指,某一物质是从其原生或天然环境(例如,若其是天然产生的,则从天然环境)脱离。例如,活体动物中存在的天然多核苷酸或多肽不是分离的,但与天然系统中的某些或所有共存物质分离的该多核苷酸或多肽则是分离的。此类多核苷酸可为载体的部分和/或此类多核苷酸或多肽可为组合物的部分,但其仍为分离的,这是因为该载体或组合物不是该多核苷酸或多肽天然存在环境的一部分。
[0139]
如本文所用,术语“治疗”病症(例如骨髓瘤)是指,在一个实施方式中,具有病症(例如骨髓瘤)和/或经历了病症(例如骨髓瘤)症状的对象(例如人类)在接受了抗体分子的情况下将比未曾接受该抗体分子的情况经受更轻的严重程度的症状和/或恢复得更快。在一个实施方式中,当治疗骨髓瘤时,在对骨髓瘤进行有效治疗之后,骨髓活检将显示较少的克隆浆细胞。例如,在给予本文所述的抗体分子以有效治疗骨髓瘤后,诊断测定法将在对象的生物样品中检测到较少的克隆浆细胞。其它测定法,尿液检查或血液检查也可用于监测患者的治疗,或在治疗骨髓瘤后检测对象中骨髓瘤症状的存在情况,例如存在减少(或不存在)。在一个实施方式中,当治疗骨髓瘤时,在有效治疗骨髓瘤之后,血清或尿液中β2微球蛋白(β2m)的水平将降低。治疗可为例如部分或完全减轻、改善、缓解、抑制或降低病症的严重性和/或减少发病率,以及可任选地延迟病症(例如骨髓瘤)的一种或多种后果或症状、特征和/或病因的显现或发作。在一个实施方式中,对于不显示病症(例如骨髓瘤)的某些迹象的对象和/或仅显示病症的早期迹象(例如肾病)的对象进行治疗。在一个实施方式中,治疗针对具有病症(例如骨髓瘤)的一种或多种已确定迹象的对象进行。在一个实施方式中,治疗被诊断为患有疾病(例如骨髓瘤)的对象。
[0140]
如本文所用,术语“预防”疾病(例如骨髓瘤)是指如果对象(例如人)接受抗体分子,则该对象(例如人)不太可能患上该疾病(例如骨髓瘤)。
[0141]
下文中进一步详细描述了本文所述组合物和方法的各个方面。在整个说明书中提供了其他定义。
[0142]
cd138
[0143]
cd138是一种蛋白质,其在人类中由sdc1基因编码。cd138也称为多配体聚糖
(syndecan)1,多配体聚糖蛋白聚糖1,cd138抗原,synd1,sdc,多配体聚糖-1或多配体聚糖。
[0144]
cd138是跨膜(i型)硫酸乙酰肝素蛋白聚糖(hspg),是多配体聚糖蛋白聚糖家族的成员。cd138在分化浆细胞(pc)上高度表达,是多发性骨髓瘤(mm)的主要诊断生物标志物,也是临床预后不良的指标。cd138在多发性骨髓瘤细胞上也稳定且显著过度表达,这些细胞来源于疾病进展的多个阶段的患者,其中超过70%的患者在自体来源于新鲜bm抽吸物的mm细胞上表现出cd138细胞表面表达增加。cd138基因在患者来源的mm细胞中的表达也比来自健康患者对照组的“正常”浆细胞增加数倍。在不希望受到理论约束的情况下,相信在一个实施方式中,cd138是mm免疫治疗的靶点,包括但不限于冒烟型骨髓瘤,这是一种可接受早期治疗干预的相对早期且基本无症状的疾病阶段。在不希望受到理论约束的情况下,相信在一个实施方式中,基于其作为骨髓瘤细胞生长、粘附和存活的促进剂的关键功能以及骨髓瘤生物学的其他关键方面,靶向cd138可以提供附加的治疗益处。多配体聚糖介导细胞结合,细胞信号转导和细胞骨架组织,而多配体聚糖受体是hiv-1tat蛋白内化所必需的。cd138作为一种完整的膜蛋白起作用,并通过其胞外基质蛋白的受体参与细胞增殖,细胞迁移和细胞-基质相互作用。已在几种不同的肿瘤类型中检测到cd138表达变化。
[0145]
cd138的核心包括三个主要结构域:1)短胞质结构域;2)跨质膜的疏水结构域;3)长的胞外结构域。cd138结构域的功能描述于,例如,stepp等.adv wound care(新罗谢尔).2015;4(4):235-249)。胞质结构域可以传递信号,还可以与锚定分子(包括pdz家族成员)结合。cd138的硫酸乙酰肝素链也具有重要的生物学功能。在哺乳动物中,cd138是上皮细胞上具有高水平表达的主要硫酸乙酰肝素蛋白聚糖(hspg)(fuki等.j clin invest.1997;100(6):1611-1622)。不意在受理论限制,据信cd138的hspg允许蛋白聚糖与许多ecm蛋白、生长因子、细胞因子和其它蛋白质上存在的肝素结合位点结合(stepp等,adv wound care(新罗谢尔).2015;4(4):235-249)。
[0146]
例如,对于人cd138蛋白(例如,seq id no:1-3或450中任一个),信号肽包含残基1-22;胞外结构域包含残基23-254;跨膜结构域包含残基255-275;胞质结构域包含残基276-310;或整合素结合结构域(ibd)包含残基88-122。
[0147]
在一个实施方式中,本文所述的抗cd138抗体分子可调节(例如抑制)cd138和与cd138的胞外域相互作用(例如直接或间接结合)的一种或多种蛋白质的结合。在一个实施方式中,本文所述的抗cd138抗体分子可调节(例如,抑制)和与cd138的胞外结构域相互作用(例如,直接或间接结合)的蛋白质相关的功能。在一个实施方式中,与cd138相互作用的蛋白质直接结合至cd138的胞外结构域。在一个实施方式中,与cd138相互作用的蛋白质通过糖胺聚糖(gag)链结合至cd138的胞外结构域。
[0148]
与cd138相互作用的蛋白质及其功能的示例描述于,例如stepp等.adv wound care(新罗谢尔).2015;4(4):235-249,其内容通过引用其全文的方式纳入本文。
[0149]
例如,能够直接或间接与cd138的细胞外结构域相互作用的蛋白质包括但不限于基质蛋白质(例如层粘连蛋白、纤维连接蛋白、血小板反应蛋白、胶原、纤维蛋白、hb-gam、生腱蛋白、玻连蛋白、原纤维蛋白或原弹性蛋白),蛋白酶(如mmp7、mmp9、adamts4、mt1-ppt、中性粒细胞弹性蛋白酶、组织蛋白酶g或羧肽酶)、受体(如整合素、αvβ3、αvβ5、α6β4、α2β1、α3β1、或αmβ2),细胞因子或生长因子(例如,形态发生素(例如,激活素、bmp-2、bmp-4、腱蛋白、音猬因子、卷毛相关蛋白、发芽肽、wnt1至wnt13中的任一种)、抗血管生成因子(例如,血管生成
抑素或内皮抑素),生长因子(例如,双调蛋白、巴他西林、hb-egf、神经调节蛋白、fgf1至fgf23中的任一种、pdgf、gdnf、vegf、hgf、tgf β1、tgf β2、tpa或pai-1)、或细胞因子(例如,gm-csf、il-2、il-3、il-4、il-5、il-7、il-12、干扰素、tnf-α、cc趋化因子或cxc趋化因子),与能量平衡相关的蛋白质(例如,apob、apoe或脂蛋白脂肪酶)、补体或凝血蛋白(例如抗凝血酶ii、组织因子(tf)、途径抑制剂、因子ix、因子x、因子xi或因子xii),或病毒或寄生虫衣壳蛋白(例如,hiv-1-tat、hiv-1 gp41、hiv-1 gp120、hsv gb、hsv gc、hsv gd、hhv-6或hhv-8衣壳蛋白或rsv的g-蛋白)。
[0150]
在细胞表面表达的cd138可以被特定的蛋白酶切割,而脱落的cd138负责介导旁分泌和自分泌功能。脱落的cd138在血液和基质中是可溶的且分泌的胞外域(ecd)。脱落的cd138是多发性骨髓瘤患者不良预后和骨髓瘤小鼠模型中肿瘤进展增强的指标。通常,不认为脱落的cd138是造成该疾病的主要原因。cd138向细胞核的易位可与某些肿瘤细胞的分化和增殖相关。在一个实施方式中,与可溶性cd138相比,本文所述的抗cd138抗体分子优先靶向膜相关的cd138。
[0151]
cd138一般不存在于b淋巴细胞上,且在浆细胞分化开始后表达。cd138在恶性浆细胞(骨髓瘤)上高表达,且在疾病进展中有因果作用。cd138与多种生物学功能有关。例如,它可以与细胞外蛋白、生长因子和趋化因子结合;聚集时,结合并激活αvβ3和αvβ5整合素;调节外显体的生物发生;并调节支持骨髓瘤生长和转移的骨髓微环境。多个信号可通过靶向cd138而被衰减。
[0152]
cd138在多发性骨髓瘤中上调(tassone等.blood.104(12):3688-3696)。它在恶性浆细胞上过表达。多发性骨髓瘤细胞通常表达高50-200倍水平的cd138。可溶性cd138(scd138)的水平通常是从正常血清中的60ng/ml到多发性骨髓瘤患者血清中的200-1500ng/ml。cd138在约80%的多发性骨髓瘤患者中过表达。
[0153]
cd138可用作多发性骨髓瘤的主要诊断标志物。血清中脱落的cd138水平升高与肿瘤负荷增加和不良预后有关。cd138 骨髓瘤细胞显示出较高的增殖,而cd138 骨髓瘤患者的总生存率较低。cd138 骨髓瘤细胞异常表达血管生成因子,例如hgf,il-15,ang,april,ctgf或tgfa(hose等.blood.2009;114(1):128-143)。cd138的表达水平及其释放的胞外结构域与实体瘤和血液肿瘤的肿瘤恶性、表型和转移潜能相关。cd138的表达因癌症类型而异,但是上皮和基质隔室中正常细胞与癌细胞之间的差异表达特征与肿瘤的侵袭性和患者的临床结果及生存率直接相关联。
[0154]
人cd138的示例性氨基酸和核苷酸序列描述于,例如,mali等.j biol chem.1990;265(12):6884-6889;lories等.j biol chem.1992;267(2):1116-1122;和图1中。
[0155]
示例性人cd138前体的氨基酸序列(seq id no:1)如下提供。
[0156]
mrraalwlwlcalalslqpalpqivatnlppedqdgsgddsdnfsgsgagalqditlsqqtpstwkdtqlltaiptspeptgleataaststlpagegpkegeavvlpevepgltareqeatprprettqlptthqastttattaqepatshphrdmqpghhetstpagpsqadlhtphtedggpsateraaedgassqlpaaegsgeqdftfetsgentavvavepdrrnqspvdqgatgasqglldrkevlggviagglvglifavclvgfmlyrmkkkdegsysleepkqanggayqkptkqeefya
[0157]
示例性人cd138前体变体(q136l)的氨基酸序列(seq id no:2)如下提供。
[0158]
mrraalwlwlcalalslqpalpqivatnlppedqdgsgddsdnfsgsgagalqditlsqqtpstwkdtq
lltaiptspeptgleataaststlpagegpkegeavvlpevepgltareqeatprprettqlptthlastttattaqepatshphrdmqpghhetstpagpsqadlhtphtedggpsateraaedgassqlpaaegsgeqdftfetsgentavvavepdrrnqspvdqgatgasqglldrkevlggviagglvglifavclvgfmlyrmkkkdegsysleepkqanggayqkptkqeefya
[0159]
示例性人cd138前体变体(t76m)的氨基酸序列(seq id no:3)如下提供。
[0160]
mrraalwlwlcalalslqpalpqivatnlppedqdgsgddsdnfsgsgagalqditlsqqtpstwkdtqlltaipmspeptgleataaststlpagegpkegeavvlpevepgltareqeatprprettqlptthqastttattaqepatshphrdmqpghhetstpagpsqadlhtphtedggpsateraaedgassqlpaaegsgeqdftfetsgentavvavepdrrnqspvdqgatgasqglldrkevlggviagglvglifavclvgfmlyrmkkkdegsysleepkqanggayqkptkqeefya
[0161]
信号肽包括seq id no:1-3中任一个的氨基酸1-22。成熟肽包括seq id no:1-3中任一个的氨基酸23-310。胞外结构域包括seq id no:1-3中任一个的氨基酸23-254。跨膜结构域包括seq id no:1-3中任一个的氨基酸255-275。胞质结构域包括seq id no:1-3中任一个的氨基酸276-310。
[0162]
人cd138的示例性编码核苷酸序列(seq id no:4)如下提供。该核苷酸序列编码seq id no:1的氨基酸序列。
[0163]
atgaggcgcgcggcgctctggctctggctgtgcgcgctggcgctgagcctgcagccggccctgccgcaaattgtggctactaatttgccccctgaagatcaagatggctctggggatgactctgacaacttctccggctcaggtgcaggtgctttgcaagatatcaccttgtcacagcagaccccctccacttggaaggacacgcagctcctgacggctattcccacgtctccagaacccaccggcctggaggctacagctgcctccacctccaccctgccggctggagaggggcccaaggagggagaggctgtagtcctgccagaagtggagcctggcctcaccgcccgggagcaggaggccaccccccgacccagggagaccacacagctcccgaccactcatcaggcctcaacgaccacagccaccacggcccaggagcccgccacctcccacccccacagggacatgcagcctggccaccatgagacctcaacccctgcaggacccagccaagctgaccttcacactccccacacagaggatggaggtccttctgccaccgagagggctgctgaggatggagcctccagtcagctcccagcagcagagggctctggggagcaggacttcacctttgaaacctcgggggagaatacggctgtagtggccgtggagcctgaccgccggaaccagtccccagtggatcagggggccacgggggcctcacagggcctcctggacaggaaagaggtgctgggaggggtcattgccggaggcctcgtggggctcatctttgctgtgtgcctggtgggtttcatgctgtaccgcatgaagaagaaggacgaaggcagctactccttggaggagccgaaacaagccaacggcggggcctaccagaagcccaccaaacaggaggaattctatgcctga
[0164]
人cd138的另一个示例性编码核苷酸序列(seq id no:5)提供如下。该核苷酸序列也编码seq id no:1的氨基酸序列。
[0165]
atgaggcgcgcggcgctctggctctggctgtgcgcgctggcgctgagcctgcagccggccctgccgcaaattgtggctactaatttgccccctgaagatcaagatggctctggggatgactctgacaacttctccggctcaggtgcaggtgctttgcaagatatcaccttgtcacagcagaccccctccacttggaaggacacgcagctcctgacggctattcccacgtctccagaacccaccggcctggaggctacagctgcctccacctccaccctgccggctggagaggggcccaaggagggagaggctgtagtcctgccagaagtggagcctggcctcaccgcccgggagcaggaggccaccccccgacccagggagaccacacagctcccgaccactcatcaggcctcaacgaccacagccaccacggcccaggagcccgccacctcccacccccacagggacatgcagcctggccaccatgagacctcaacccctgcaggacccagccaagctgaccttcacactccccacacagaggatggaggtccttctgccaccgagagggctgctgaggatggagcctccagtcagctcccagcagc
agagggctctggggagcaggacttcacctttgaaacctcgggggagaatacggctgtagtggccgtggagcctgaccgccggaaccagtccccagtggatcagggggccacgggggcctcacagggcctcctggacaggaaagaggtgctgggaggggtcattgccggaggcctcgtggggctcatctttgctgtgtgcctggtgggtttcatgctgtaccgcatgaagaagaaggacgaaggcagctactccttggaggagccgaaacaagccaacggcggggcctaccagaagcccaccaaacaggaggaattctatgcctga
[0166]
如本文所用,当抗cd138抗体分子结合或基本上结合至人cd138时,其结合或基本上结合至人cd138的一种或多种同种型。在一个实施方式中,抗体分子结合或基本上结合至具有本文所述氨基酸序列或由本文所述核苷酸序列编码的人cd138。在一个实施方式中,抗体分子结合或基本上结合至包含seq id no:1-3中任一个的氨基酸23-254的人cd138。
[0167]
小鼠cd138的示例性氨基酸和核苷酸序列描述于,例如,saunders等.j cell biol.1989;108(4):1547-1556;和vihinen等.j biol chem.1993;268(23):17261-17269。
[0168]
示例性小鼠cd138前体的氨基酸序列(seq id no:6)如下提供。
[0169]
mrraalwlwlcalalrlqpalpqivavnvppedqdgsgddsdnfsgsgtgalpdtlsrqtpstwkdvwlltatptapeptssntetaftsvlpagekpeegepvlhveaepgftardkekevttrpretvqlpitqrastvrvttaqaavtshphggmqpglhetsaptapgqpdhqpprvegggtsvikevvedgtanqlpagegsgeqdftfetsgentavaavepglrnqppvdegatgasqslldrkevlggviagglvglifavclvafmlyrmkkkdegsysleepkqanggayqkptkqeefya
[0170]
信号肽包括seq id no:6的氨基酸1-22。成熟肽包括seq id no:6的氨基酸23-311。胞外结构域包括seq id no:6的氨基酸23-255。跨膜结构域包括seq id no:4的氨基酸256-276。胞质结构域包括seq id no:6的氨基酸277-311。
[0171]
小鼠cd138的示例性编码核苷酸序列(seq id no:7)如下提供。
[0172]
atgagacgcgcggcgctctggctctggctctgcgcgctggcgctgcgcctgcagcctgccctcccgcaaattgtggctgtaaatgttcctcctgaagatcaggatggctctggggatgactctgacaacttctctggctctggcacaggtgctttgccagatactttgtcacggcagacaccttccacttggaaggacgtgtggctgttgacagccacgcccacagctccagagcccaccagcagcaacaccgagactgcttttacctctgtcctgccagccggagagaagcccgaggagggagagcctgtgctccatgtagaagcagagcctggcttcactgctcgggacaaggaaaaggaggtcaccaccaggcccagggagaccgtgcagctccccatcacccaacgggcctcaacagtcagagtcaccacagcccaggcagctgtcacatctcatccgcacgggggcatgcaacctggcctccatgagacctcggctcccacagcacctggtcaacctgaccatcagcctccacgtgtggagggtggcggcacttctgtcatcaaagaggttgtcgaggatggaactgccaatcagcttcccgcaggagagggctctggagaacaagacttcacctttgaaacatctggggagaacacagctgtggctgccgtagagcccggcctgcggaatcagcccccggtggacgaaggagccacaggtgcttctcagagccttttggacaggaaggaagtgctgggaggtgtcattgccggaggcctagtgggcctcatctttgctgtgtgcctggtggctttcatgctgtaccggatgaagaagaaggacgaaggcagctactccttggaggagcccaaacaagccaatggcggtgcctaccagaaacccaccaagcaggaggagttctacgcctga
[0173]
如本文所用,当抗cd138抗体分子结合或基本上结合至小鼠cd138时,其结合或基本上结合至小鼠cd138的一种或多种同种型。在一个实施方式中,抗体分子结合或基本上结合至具有本文所述氨基酸序列或由本文所述核苷酸序列编码的人cd138。在一个实施方式中,抗体分子结合或基本上结合至包含seq id no:6的氨基酸23-255的小鼠cd138。
[0174]
表位
[0175]
本文所述的人源化抗体分子能结合至cd138(例如人cd138)上的表位。例如,本文描述的人源化抗体分子结合的表位可包括本文描述的一个或多个表位接触点。
[0176]
不意在受理论限制,据信在一个实施方式中,结合至ibd(例如,seq id no:1-3或450中任一个的残基88-122)或cd138的远离膜的任何区域的抗体可能对nk细胞活化的信号转导无效和/或可能无法高效递送分子(穿孔素和/或颗粒酶)供于细胞毒性。在一个实施方式中,抗体分子结合到包含膜近端区域的cd138表位。在一个实施方式中,抗体分子结合到包含至少两个不同肽区(例如,包含肽2a和/或6a和/或其部分)的cd138表位。在一个实施方式中,抗体分子结合cd138的表位,该表位不同于抗体bb4结合的表位。
[0177]
在一个实施方式中,抗体分子与cd138(例如,人cd138)结合,其亲和力相对于参考抗cd138抗体(例如,抗体bb4)至少提高10%(例如,至少10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、70%、80%或90%),例如,如通过本文所述的细胞结合分析确定的。在一个实施方式中,cd138与膜相关。在一个实施方式中,抗体分子与可溶性cd138结合,例如可溶性cd138的胞外结构域(例如,具有seq id no∶1的氨基酸18-251的序列)。在一个实施方式中,抗体分子结合至人cd138的肽2a。在某些实施方式中,抗体分子结合至人cd138的肽6a。
[0178]
在一些实施方式中,本文所述的抗cd138抗体分子具有一种、两种或全部以下性质:表位与细胞膜的最佳距离(例如,不在idb的n-末端上);fc区供于cd16接合的合适取向;或,允许cd16在nk细胞上簇集的适当cd138接合(例如,以克服对cd138分子的大量糖基化作用,该作用可能会限制nk细胞的接近)。
[0179]
不意在受理论限制,据信在一个实施方式中,改变抗体表位的位置可改变参与的某些效应物机制。例如,抗体依赖性细胞毒性(adcc)和补体依赖性细胞毒性(cdc)可能更有利于膜近处的表位(对比膜远侧表位)(cleary等.j immunol.2017;198(10):3999-4011)。在一个实施方式中,可通过改变抗体表位的位置(例如,表位与膜的距离)来选择设计成通过特定效应物机制去除靶细胞的抗体。
[0180]
在一个实施方式中,接合方式可能会影响抗体介导效应物功能的能力。例如,在结合至相同肽表位的抗体之间,与抗体结合胞外环相对于膜表面的角度可能不同(例如,平行于或垂直于膜表面)。
[0181]
在一个实施方式中,本文所述的抗cd138抗体分子结合至具有以下一种、两种或全部特性的表位:细胞膜近处;不受糖胺聚糖(gag)链的限制或阻塞;或,优先存在于膜相关的cd138上。在一个实施方式中,本文所述的抗cd138抗体分子可结合至所需的表位区域并相对于膜以最佳姿势接合。在一个实施方式中,表位是线性表位。在一个实施方式中,抗体分子结合至远离跨膜区域的cd138胞外区域。在一个实施方式中,表位是非连续或构象表位。
[0182]
用于识别抗cd138抗体所需表位的肽如pct公开号wo 2019/070726或美国专利申请公开号us 2019/0100588的图2所示。不意在受理论限制,据信在一个实施方式中,本文所述的抗cd138抗体分子靶向人cd138的残基gly217至glu251之间的肽区域,例如,如pct公开号wo 2019/070726或美国专利申请公开号us 2019/0100588的图1所示。期望该区域具有线性无规卷曲构象。在一个实施方式中,抗cd138抗体分子结合至前述区域中的至少一个线性四肽。在一个实施方式中,抗cd138抗体分子结合至前述区域中的线性四肽的组合(例如,两个、三个、四个或更多个相邻的四肽)。
[0183]
上述肽的氨基酸序列示于表3。
[0184]
表3.用于鉴定cd138表位的肽
[0185][0186]
在表3中,肽之间的重叠氨基酸以粗体显示;bb4表位残基以斜体显示;带有丝氨酸残基的糖胺聚糖(硫酸乙酰肝素、硫酸软骨素)链标有下划线。术语“肽”和“pep”在本文可互换使用。对于肽名称,小写字母和大写字母意在具有相同的含义。例如,术语肽“1a”,“肽1a”,“pep1a”和“pep1a”可用于指相同的肽。
[0187]
用于识别抗cd138抗体所需表位的其他示例性肽如pct公开号wo 2019/070726或美国专利申请公开号us 2019/0100588的图13和22c所示。
[0188]
在一个实施方式中,抗体分子接触(例如结合或基本上结合至)cd138中与pct公开号wo 2019/070726或美国专利申请公开号us 2019/0100588的表3、图13或22c中描述的一种或多种肽相对应的区域。在一个实施方式中,肽是pep6。在一个实施方式中,肽是pep6a。在一个实施方式中,肽是pep5。在一个实施方式中,肽是pep4。在一个实施方式中,抗体分子
接触pep6或pep6a而不接触pep4。在一个实施方式中,抗体分子不接触pepla,peplb,pep2a,pep2b,pep3,pep4或pep5中任一个。在一个实施方式中,抗体分子不接触pep2a。在一个实施方式中,抗体分子接触pep2a,但不结合至与bb4相同的表位。
[0189]
在一个实施方式中,抗体分子接触pep2a和pep6。在一个实施方式中,抗体分子接触pep2a和pep2c。在一个实施方式中,抗体分子接触pep6b。在一个实施方式中,抗体分子接触pep2a,pep2c和pep6b。在一个实施方式中,抗体分子不接触pep6e。在一个实施方式中,抗体分子接触pep6b且不接触pep6e。在一个实施方式中,抗体分子接触pep2a和pep2c且不接触pep6e。在一个实施方式中,抗体分子接触pep2a,pep2c和pep6b且不接触pep6e。
[0190]
在一个实施方式中,抗体分子接触pep2a和pep2d。在一个实施方式中,抗体分子接触pep6b和pep6f。在一个实施方式中,抗体分子接触pep2a,pep2d,pep6b和pep6f。
[0191]
在一个实施方式中,抗体分子在cd138的跨膜结构域近处的胞外区域中结合至或基本上结合至cd138。在一个实施方式中,跨膜结构域近处的胞外区域的c末端处于自跨膜结构域n末端起70、65、60、55、50、45、40、35、30、25、20、15、10或5个氨基酸内。在一个实施方式中,跨膜结构域近处的胞外区域的n末端处于自跨膜结构域n末端起75、70、65、60、55、50、45、40、35、30、25、20、15、10或5个氨基酸内。
[0192]
在一个实施方式中,抗体分子结合至cd138上的表位,所述表位包含跨膜结构域近处的胞外区域中四个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50、55、60、65、70、75或更多个)连续氨基酸残基。
[0193]
在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含跨膜结构域近处的胞外区域中五个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含跨膜结构域近处的胞外区域中六个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含跨膜结构域近处的胞外区域中七个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含跨膜结构域近处的胞外区域中八个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含跨膜结构域近处的胞外区域中九个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含跨膜结构域近处的胞外区域中十个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含跨膜结构域近处的胞外区域中十一个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含跨膜结构域近处的胞外区域中十二个或更多个连续的氨基酸残基。
[0194]
在一个实施方式中,跨膜结构域近处的胞外区域对应于(例如,包含或由其组成)pep6。在一个实施方式中,跨膜结构域近处的胞外区域对应于(例如,包含或由其组成)pep6a,6b,6e和/或6f。在一个实施方式中,跨膜结构域近处的胞外区域对应于(例如,包含或由其组成)pep5。
[0195]
在一个实施方式中,抗体分子接触pep6中的四个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41个)连续氨基酸残基。在一个实施方式中,抗体分子接触pep6a中的四个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25或26个)连续氨基酸残基。
[0196]
在一个实施方式中,抗体分子接触以下肽(例如来自pep6a)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36或37个):dftf(seq id no:18);ftfe(seq id no:19);tfet(seq id no:20);fets(seq id no:21);etsg(seq id no:22);tsge(seq id no:23);sgen(seq id no:24);gent(seq id no:25);enta(seq id no:26);ntav(seq id no:27);tavv(seq id no:28);avva(seq id no:29);vvav(seq id no:30);vave(seq id no:31);avep(seq id no:32);vepd(seq id no:33);epdr(seq id no:34);pdrr(seq id no:35);drrn(seq id no:36);rrnq(seq id no:37);rnqs(seq id no:38);nqsp(seq id no:39);qspv(seq id no:40);spvd(seq id no:41);pvdq(seq id no:42);vdqg(seq id no:43);dqga(seq id no:44);qgat(seq id no:45);gatg(seq id no:46);atga(seq id no:47);tgas(seq id no:48);gasq(seq id no:49);asqg(seq id no:50);sqgl(seq id no:51);qgll(seq id no:52);glld(seq id no:53);lldr(seq id no:54);或ldrk(seq id no:55)。
[0197]
在一个实施方式中,抗体分子接触pep6a中的五个或更多个(例如6、7、8、9、10、11、12、13、14、15、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41个)连续氨基酸残基。
[0198]
在一个实施方式中,抗体分子接触以下肽(例如来自pep6a)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36或37个):dftfe(seq id no:56);ftfet(seq id no:57);tfets(seq id no:58);fetsg(seq id no:59);etsge(seq id no:60);tsgen(seq id no:61);sgent(seq id no:62);genta(seq id no:63);entav(seq id no:64);ntavv(seq id no:65);tavva(seq id no:66);avvav(seq id no:67);vvave(seq id no:68);vavep(seq id no:69);avepd(seq id no:70);vepdr(seq id no:71);epdrr(seq id no:72);pdrrn(seq id no:73);drrnq(seq id no:74);rrnqs(seq id no:75);rnqsp(seq id no:76);nqspv(seq id no:77);qspvd(seq id no:78);spvdq(seq id no:79);pvdqg(seq id no:80);vdqga(seq id no:81);dqgat(seq id no:82);qgatg(seq id no:83);gatga(seq id no:84);atgas(seq id no:85);tgasq(seq id no:86);gasqg(seq id no:87);asqgl(seq id no:88);sqgll(seq id no:89);qglld(seq id no:90);glldr(seq id no:91);或lldrk(seq id no:92)。
[0199]
在一个实施方式中,抗体分子接触pep6a中的六个或更多个(例如7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40或41个)连续氨基酸残基。
[0200]
在一个实施方式中,抗体分子接触以下肽(例如来自pep6a)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35或36个):dftfet(seq id no:93);ftfets(seq id no:94);tfetsg(seq id no:95);fetsge(seq id no:96);etsgen(seq id no:97);tsgent(seq id no:98);sgenta(seq id no:99);gentav(seq id no:100);entavv(seq id no:101);ntavva(seq id no:102);tavvav(seq id no:103);avvave(seq id no:104);vvavep(seq id no:105);vavepd(seq id no:106);avepdr(seq id no:107);vepdrr(seq id no:108);epdrrn(seq id no:109);pdrrnq(seq id no:110);drrnqs(seq id no:111);rrnqsp(seq id no:
112);rnqspv(seq id no:113);nqspvd(seq id no:114);qspvdq(seq id no:115);spvdqg(seq id no:116);pvdqga(seq id no:117);vdqgat(seq id no:118);dqgatg(seq id no:119);qgatga(seq id no:120);gatgas(seq id no:121);atgasq(seq id no:122);tgasqg(seq id no:123);gasqgl(seq id no:124);asqgll(seq id no:125);sqglld(seq id no:126);qglldr(seq id no:127);或glldrk(seq id no:128)。
[0201]
在一个实施方式中,抗体分子接触pep5中的四个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35或36个)连续氨基酸残基。
[0202]
在一个实施方式中,抗体分子接触以下肽(例如,来自pep5)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35或36个):htph(seq id no:129)、tpht(seq id no:130)、phte(seq id no:131)、hted(seq id no:132)、tedg(seq id no:133)、edgg(seq id no:134)、dggp(seq id no:135)、ggps(seq id no:136)、gpsa(seq id no:137)、psat(seq id no:138)、sate(seq id no:139)、ater(seq id no:140)、tera(seq id no:141)、eraa(seq id no:142)、raae(seq id no:143)、aaed(seq id no:144)、aedg(seq id no:145)、edga(seq id no:146)、dgas(seq id no:147)、gass(seq id no:148)、assq(seq id no:149)、ssql(seq id no:150)、sqlp(seq id no:151)、qlpa(seq id no:152)、lpaa(seq id no:153)、paae(seq id no:154)、aaeg(seq id no:155)、aegs(seq id no:156)、egsg(seq id no:157)、gsge(seq id no:158)、sgeq(seq id no:159)、geqd(seq id no:160)、eqdf(seq id no:161)、qdft(seq id no:162)、dftf(seq id no:18)或ftfe(seq id no:19)。
[0203]
在一个实施方式中,抗体分子接触pep5中的五个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35个)连续氨基酸残基。
[0204]
在一个实施方式中,抗体分子接触以下肽(例如,来自pep5)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35个):htpht(seq id no:163)、tphte(seq id no:164)、phted(seq id no:165)、htedg(seq id no:166)、tedgg(seq id no:167)、edggp(seq id no:168)、dggps(seq id no:169)、ggpsa(seq id no:170)、gpsat(seq id no:171)、psate(seq id no:172)、sater(seq id no:173)、atera(seq id no:174)、teraa(seq id no:175)、eraae(seq id no:176)、raaed(seq id no:177)、aaedg(seq id no:178)、aedga(seq id no:179)、edgas(seq id no:180)、dgass(seq id no:181)、gassq(seq id no:182)、assql(seq id no:183)、ssqlp(seq id no:184)、sqlpa(seq id no:185)、qlpaa(seq id no:186)、lpaae(seq id no:187)、paaeg(seq id no:188)、aaegs(seq id no:189)、aegsg(seq id no:190)、egsge(seq id no:191)、gsgeq(seq id no:192)、sgeqd(seq id no:193)、geqdf(seq id no:194)、eqdft(seq id no:195)、qdftf(seq id no:196)或dftfe(seq id no:56)。
[0205]
在一个实施方式中,抗体分子接触pep5中的六个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33或34个)连续氨基酸残基。
[0206]
在一个实施方式中,抗体分子接触以下肽(例如,来自pep5)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33或34个):htphte(seq id no:197)、tphted(seq id no:198)、phtedg(seq id no:199)、htedgg(seq id no:200)、tedggp(seq id no:201)、edggps(seq id no:202)、dggpsa(seq id no:203)、ggpsat(seq id no:204)、gpsate(seq id no:205)、psater(seq id no:206)、satera(seq id no:207)、ateraa(seq id no:208)、teraae(seq id no:209)、eraaed(seq id no:210)、raaedg(seq id no:211)、aaedga(seq id no:212)、aedgas(seq id no:213)、edgass(seq id no:214)、dgassq(seq id no:215)、gassql(seq id no:216)、assqlp(seq id no:217)、ssqlpa(seq id no:218)、sqlpaa(seq id no:219)、qlpaae(seq id no:220)、lpaaeg(seq id no:221)、paaegs(seq id no:222)、aaegsg(seq id no:223)、aegsge(seq id no:224)、egsgeq(seq id no:225)、gsgeqd(seq id no:226)、sgeqdf(seq id no:227)、geqdft(seq id no:228)、eqdftf(seq id no:229)或qdftfe(seq id no:230)。
[0207]
在一个实施方式中,抗体分子不结合或以低亲和性结合至远离跨膜结构域的cd138的胞外区域。在一个实施方式中,抗体分子不结合至包含远离跨膜结构域的胞外区域中四个或更多个(例如,5、6、7、8、9、10、11、12、13、14、15、20、25、30、35或更多个)连续氨基酸残基的cd138表位。在一个实施方式中,远离跨膜结构域的胞外区域的c末端距该跨膜结构域的n末端至少100、110、120、130、140、150、160、170、180、190或200个氨基酸。在一个实施方式中,远离跨膜结构域的胞外区域对应于pepla,pep1b,pep2a,pep2b,pep2c,pep2d,pep3,pep4或其组合。在一个实施方式中,抗体分子不结合或以低亲和性结合至cd138的整合素结合结构域(ibd)。在一个实施方式中,所述抗体分子不结合或以低亲和性结合至cd138的ibd的n末端区域。
[0208]
在一个实施方式中,抗体分子结合或基本上结合至远离跨膜结构域的cd138胞外区域。在一个实施方式中,远离跨膜结构域的胞外区域的c末端距该跨膜结构域的n末端至少100、110、120、130、140、150、160、170、180、190或200个氨基酸。在一个实施方式中,远离跨膜结构域的胞外区域对应于pep1a,pep1b,pep2a,pep2b,pep2c,pep2d,pep3,pep4或其组合。在一个实施方式中,抗体分子结合或基本上结合至cd138的整合素结合结构域(ibd)。在一个实施方式中,抗体分子结合或基本上结合至cd138的ibd的n末端区域。在一个实施方式中,抗体分子不结合或以低亲和性结合至bb4的表位。
[0209]
在一个实施方式中,抗体分子结合至cd138上的表位,所述表位包含远离跨膜结构域的胞外区域中四个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、20、25、30、35、40、45、50、55、60、65、70、75或更多个)连续氨基酸残基。
[0210]
在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含远离跨膜结构域的胞外区域中五个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含远离跨膜结构域的胞外区域中六个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含远离跨膜结构域的胞外区域中七个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含远离跨膜结构域的胞外区域中八个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含远离跨膜结构域的胞外区域中九个或更
多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含远离跨膜结构域的胞外区域中十个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含远离跨膜结构域的胞外区域中十一个或更多个连续的氨基酸残基。在一个实施方式中,抗体分子与cd138上的表位结合,该表位包含远离跨膜结构域的胞外区域中十二个或更多个连续的氨基酸残基。
[0211]
在一个实施方式中,远离跨膜结构域的胞外区域对应于(例如,包含或由其组成)pep2a。
[0212]
在一个实施方式中,抗体分子接触pep2a中的四个或更多个(例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33或34个)连续氨基酸残基。
[0213]
在一个实施方式中,抗体分子接触以下肽(例如,来自pep2a)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或31个):asts(seq id no:231)、stst(seq id no:232)、tstl(seq id no:233)、stlp(seq id no:234)、tlpa(seq id no:235)、lpag(seq id no:236)、page(seq id no:237)、ageg(seq id no:238)、gegp(seq id no:239)、egpk(seq id no:240)、gpke(seq id no:241)、pkeg(seq id no:242)、kege(seq id no:243)、egea(seq id no:244)、geav(seq id no:245)、eavv(seq id no:246)、avvl(seq id no:247)、vvlp(seq id no:248)、vlpe(seq id no:249)、lpev(seq id no:250)、peve(seq id no:251)、evep(seq id no:252)、vepg(seq id no:253)、epgl(seq id no:254)、pglt(seq id no:255)、glta(seq id no:256)、ltar(seq id no:257)、tare(seq id no:258)、areq(seq id no:259)、reqe(seq id no:260)或eqea(seq id no:261)。在一个实施方式中,抗体分子不接触lpev(seq id no:250)。
[0214]
在一个实施方式中,抗体分子接触pep2a中的五个或更多个(例如6、7、8、9、10、11、12、13、14、15、17、18、19、20、21、22、23、24、25、26、27、28、29或30个)连续氨基酸残基。
[0215]
在一个实施方式中,抗体分子接触以下肽(例如,来自pep2a)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32或33个):asts(seq id no:231)、stst(seq id no:232)、tstl(seq id no:233)、stlp(seq id no:234)、tlpa(seq id no:235)、lpag(seq id no:236)、page(seq id no:237)、ageg(seq id no:238)、gegp(seq id no:239)、egpk(seq id no:240)、gpke(seq id no:241)、pkeg(seq id no:242)、kege(seq id no:243)、egea(seq id no:244)、geav(seq id no:245)、eavv(seq id no:246)、avvl(seq id no:247)、vvlp(seq id no:248)、vlpe(seq id no:249)、lpev(seq id no:250)、peve(seq id no:251)、evep(seq id no:252)、vepg(seq id no:253)、epgl(seq id no:254)、pglt(seq id no:255)、glta(seq id no:256)、ltar(seq id no:257)、tare(seq id no:258)、areq(seq id no:259)、reqe(seq id no:260)或eqea(seq id no:261)。在一个实施方式中,抗体分子不接触包含lpev(seq id no:250)的肽。
[0216]
在一个实施方式中,抗体分子接触pep2a中的六个或更多个(例如7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28或29个)连续氨基酸残基。
[0217]
在一个实施方式中,抗体分子接触以下肽(例如,来自pep2a)中的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、
29、30、31或32个):asts(seq id no:231)、stst(seq id no:232)、tstl(seq id no:233)、stlp(seq id no:234)、tlpa(seq id no:235)、lpag(seq id no:236)、page(seq id no:237)、ageg(seq id no:238)、gegp(seq id no:239)、egpk(seq id no:240)、gpke(seq id no:241)、pkeg(seq id no:242)、kege(seq id no:243)、egea(seq id no:244)、geav(seq id no:245)、eavv(seq id no:246)、avvl(seq id no:247)、vvlp(seq id no:248)、vlpe(seq id no:249)、lpev(seq id no:250)、peve(seq id no:251)、evep(seq id no:252)、vepg(seq id no:253)、epgl(seq id no:254)、pglt(seq id no:255)、glta(seq id no:256)、ltar(seq id no:257)、tare(seq id no:258)、areq(seq id no:259)、reqe(seq id no:260)、eqea(seq id no:261)。在一个实施方式中,抗体分子不接触包含lpev(seq id no:250)的肽。
[0218]
在一个实施方式中,抗体分子结合或基本上结合至跨膜结构域近处的cd138胞外区域(例如,本文所述的胞外区域)和远离跨膜结构域的cd138胞外区域(例如,本文所述的胞外区域)。在一个实施方式中,抗体分子结合至跨膜结构域近处的cd138胞外区域的结合亲和性高于(例如,高至少2、3、4、5、6、7、8、9、10、20、30、40、50、100、200、300、400或500倍)对远离跨膜结构域的cd138胞外区域的结合亲和性。在一个实施方式中,抗体分子结合至远离跨膜结构域的cd138胞外区域的结合亲和性高于(例如,高至少2、3、4、5、6、7、8、9、10、20、30、40、50、100、200、300、400或500倍)对跨膜结构域近处的cd138胞外区域的结合亲和性。
[0219]
抗体分子
[0220]
本文公开了结合至cd138(例如本文公开的cd138分子)的人源化抗体分子。
[0221]
如本文所用术语“抗体分子”是指包含至少一种免疫球蛋白可变结构域序列的蛋白质,例如免疫球蛋白链或其片段。术语“抗体分子”包括例如全长、成熟抗体以及抗体的抗原结合片段。例如,抗体分子可包含重(h)链可变区序列(本文中缩写为vh)和轻(l)链可变区序列(本文中缩写为vl)。在另一个实例中,抗体分子包两条重(h)链可变结构域序列和两条轻(l)链可变结构域序列,从而形成两个抗原结合位点,如fab、fab’、f(ab’)2、fc、fd、fd’、fv、单链抗体(如scfv)、单可变结构域抗体、双抗体(dab)(二价且双特异性)以及嵌合(如人源化)抗体,且可通过修饰完整抗体或采用重组dna技术从头合成的那些产生。这些功能性抗体片段保留了选择性结合其相应抗原或受体的能力。抗体和抗体片段可来自任何抗体类型(包括但不限于igg、iga、igm、igd和ige),并来自任何抗体亚型(例如iggl、igg2、igg3和igg4)。抗体分子可以是单克隆或多克隆的。抗体分子还可为人、人源化、cdr移植或体外产生的抗体。抗体分子可具有选自igg1、igg2、igg3或igg4的重链恒定区。抗体分子还可具有选自κ或λ的轻链。术语“免疫球蛋白(ig)”与本文中的术语“抗体”可互换使用。
[0222]
抗原结合片段的例子包括:(i)fab片段,由vl、vh、cl和ch1结构域组成的单价片段;(ii)f(ab
′
)2片段,包含在铰链区通过二硫桥联接的两个fab片段的二价片段;(iii)fd片段,其由vh和ch1结构域组成;(iv)fv片段,其由抗体单臂的vl和vh结构域组成;(v)双抗体(diabody,dab)片段,其由vh结构域组成;(vi)骆驼或骆驼源化可变结构域;(vii)单链fv(scfv),参见例如bird等,(1988)science 242:423-426;以及huston等,(1988)proc.natl.acad.sci.usa 85:5879-5883);(viii)单域抗体。这些抗体片段可通过任何合适的方法(包括本领域普通技术人员所知的多种常规技术)获得,并且筛选与完整抗体具有相同应用的片段。
[0223]
术语“抗体”包括完整分子及其功能性片段。可改变(例如突变)抗体恒定区以修饰该抗体的性能,例如增加或提高或减少或降低如下一项或多项:fc受体结合、抗体糖基化、半胱氨酸残基数、效应细胞功能或补体功能。
[0224]
抗体分子可为单链抗体。可对单链抗体(scfv)进行工程改造(参见例如,colcher等.(1999)ann n y acad sci 880:263-280;和reiter与pastan(1996)clin cancer res 2:245-252)。单链抗体可二聚化或多聚化以产生对相同靶蛋白上不同表位具有特异性的多价抗体。
[0225]
本文所述的抗体分子还可为单域抗体。单域抗体可包括其互补决定区为单域多肽一部分的抗体。实例包括但不限于:重链抗体、天然缺失轻链的抗体、衍生自常规4链抗体的单域抗体、工程改造的抗体和非衍生自抗体的单结构域骨架。单域抗体可为本领域中任何单域抗体或任何未来的单域抗体。单域抗体可衍生自任何物种,包括但不限于:小鼠、人、骆驼、大羊驼、鱼、鲨鱼、羊、兔和牛。根据有些方面,单域抗体是已知为缺失轻链的重链抗体的天然存在单域抗体。此类单域抗体公开于例如wo94/04678。清楚起见,衍生自天然缺失轻链的重链抗体的该可变结构域在本文中称为vhh或纳米抗体以区别于四链免疫球蛋白的常规vh。该vhh分子可衍生自骆驼科(camelidae)物种中生长的抗体,例如衍生自骆驼、大羊驼、单峰驼、羊驼和驮马。除了骆驼科,其他物种也可产生天然缺失轻链的重链抗体;本文也包括了这些vhh。
[0226]
vh和vl区可进一步细分为超变区,称为“互补决定区(cdr)”,其间间插更保守的被称为“框架区(fr或fw)”的区。本文所用术语“互补决定区”和“cdr”是指抗体可变区内赋予抗原特异性和结合亲和性的氨基酸序列。本文所用术语“框架”,“fw”和“fr”可以互换使用。
[0227]
已采用多种方法精确来划定框架区和cdr的范围(参见kabat,e.a.,等,(1991)sequences of proteins of immunological interest(《热门免疫学蛋白质序列》,第5版,美国公共卫生署,国立卫生研究院,公开号91-3242;chothia,c.等,(1987)j.mol.biol.196:901-917;以及采用牛津分子abm抗体造模软件(oxford molecular’s abm antibody modeling software)所用的abm定义。总体上参见例如“protein sequence and structure analysis of antibody variable domains”(《抗体可变结构域的蛋白质序列和结构分析》)。于:《抗体工程实验室手册》(antibody engineering lab manual)(duebel,s.和kontermann,r.编,springer-verlag,heidelberg)。在一个实施方式中,使用以下定义:重链可变结构域cdr1的abm定义以及对其他cdr的kabat定义。在一个实施方式中,将kabat定义用于所有cdr。此外,用kabat或abm cdr描述的实施方式也可采用chothia超变环来实施。各vh和vl通常包含三个cdr和四个fr,从氨基端到羧基端按照以下顺序排列:fr1,cdr1,fr2,cdr2,fr3,cdr3和fr4。
[0228]
如本文所用,“免疫球蛋白可变结构域序列”是指能形成免疫球蛋白可变结构域结构的氨基酸序列。例如,该序列可包括天然存在可变结构域氨基酸序列的全部或部分。例如,该序列可包含或不包含一个、两个或更多给n-或c-末端氨基酸,或可包含与蛋白质结构形成相容的其他改变。
[0229]
术语“抗原结合区”是指包含形成与抗原(例如,cd138)或其表位结合界面的决定簇的抗体分子部分。就蛋白质(或蛋白质模拟物)而言,抗原结合区通常包含形成抗原(例如cd138)结合界面的一个或多个环(例如至少4个氨基酸或氨基酸模拟物的环)。通常,抗体分
子的抗原结合区包含至少一个或两个cdr和/或超变环,或更通常为至少三个、四个、五个或六个cdr和/或超变环。
[0230]
术语“竞争”或“交叉竞争”在本文中可互换使用,指抗体分子干扰抗cd138抗体分子(例如,本文提供的抗cd138抗体分子)与靶标(例如,cd138)的结合的能力。对结合的干扰可以是直接的或间接的(例如通过抗体分子或目标的变构调控)。抗体分子干扰其他抗体分子与目标结合的程度且由此其是否能被称为竞争,可采用竞争性结合测试(例如facs测试、elisa或biacore测试)确定。在一个实施方式中,竞争性结合测试是定量竞争性测试。在一个实施方式中,在竞争性结合测试(例如本文所述的竞争性测试)中,第一抗cd138抗体分子与目标的结合有如下减少时,认为该第一抗lps抗体分子与第二抗cd138抗体分子竞争性结合所述目标:减少10%或更多,例如20%或更多,30%或更多,40%或更多,50%或更多,55%或更多,60%或更多,65%或更多,70%或更多,75%或更多,80%或更多,85%或更多,90%或更多,95%或更多,98%或更多,99%或更多。
[0231]
本文所用术语“单克隆抗体”或“单克隆抗体组合物”是指具有单一分子组成的抗体分子制备物。单克隆抗体组合物针对具体表位显示单一的结合特异性和亲和性。单克隆抗体的制备可采用杂交瘤技术或不采用杂交瘤技术的方法(例如重组法)。
[0232]“有效/效果上的人(effectively human)”蛋白是不引发中和性抗体应答(例如人抗鼠抗体(hama)应答)的蛋白质。hama在许多情况下(例如若抗体分子在例如治疗慢性或复发性疾病症状时被反复施用的情况下)会造成问题。hama应答可造成反复给予抗体因血清抗体清除率提高(参见例如saleh等,cancer immunol.immunother.32:180-190(1990))且也因潜在的过敏反应(参见例如lobuglio等,hybridoma,5:5117-5123(1986))而可能不起作用。
[0233]
抗体分子可为多克隆或单克隆抗体。在一些实施方式中,可重组产生抗体,例如通过任何合适的噬菌体展示或重组方法来产生。
[0234]
各种用于生成抗体的噬菌体展示和组合方法是本领域已知的(如下所述,例如,ladner等,美国专利号5,223,409;kang等,国际公开号wo 92/18619;dower等,国际公开号wo 91/17271;winter等,国际公开号wo 92/20791;markland等,国际公开号wo 92/15679;breitling等,国际公开号wo 93/01288;mccafferty等,国际公开号wo 92/01047;garrard等,国际公开号wo 92/09690;ladner等,国际公开号wo 90/02809;fuchs等,(1991)bio/technology 9:1370 1372;hay等,(1992)hum antibod hybridomas 3:81-85;huse等,(1989)science 246:1275-1281;griffths等,(1993)同上;hawkins等,(1992)j mol biol 226:889;clackson等,(1991)nature 352:624;gram等,(1992)pnas 89:3576-3580;garrad等,(1991)bio/technology 9:13731377;hoogenboom等,(1991)nuc acid res 19:4133-4137;和barbas等,(1991)pnas 88:7978-7982,其内容在此全部引入以供参考)。
[0235]
在一个实施方式中,抗体分子是完全人抗体(例如由小鼠产生的抗体,该小鼠在已通过基因工程化改造以产生源自人免疫球蛋白序列的抗体)、或非人抗体,例如啮齿类(小鼠或大鼠)、羊、灵长类(例如猴)、骆驼抗体。在一个实施方式中,非人抗体是啮齿类抗体(小鼠或大鼠抗体)。制备啮齿类抗体的方法是本领域已知的。
[0236]
人单克隆抗体可采用携带人免疫球蛋白基因的转基因小鼠而不是小鼠体系产生。来自用感兴趣抗原免疫的这些转基因小鼠的脾细胞被用于产生分泌人mab的杂交瘤,这些
人mab对来自人蛋白质的表位具有结合特异性(参见例如,wood等,国际申请号wo 91/00906,kucherlapati等,pct公开号wo 91/10741;lonberg等,国际申请号wo 92/03918;kay等,国际申请号92/03917;lonberg等,1994 nature 368:856-859;green,l.l.等,1994 nature genet.7:13-21;morrison,s.l.等,1994 proc.natl.acad.sci.usa 81:6851-6855;bruggeman等,1993 year immunol 7:33-40;tuaillon等,1993 pnas 90:3720-3724;bruggeman等,1991 eur j immunol 21:1323-1326)。
[0237]
抗体可为其中的可变区或其部分(例如cdr)在非人生物(例如大鼠或小鼠)中产生的抗体。嵌合、cdr移植以及人源化抗体均包含在本发明中。本发明包括在非人生物(例如大鼠或小鼠)中产生并随后(例如在可变框架或恒定区中)进行修饰以降低人体内抗原性的抗体。
[0238]
可采用任何合适的重组dna技术产生嵌合抗体。本领域中已知多种方法(参见robinson等,国际专利公开号pct/us86/02269;akira,等,欧洲专利申请公开号184,187;taniguchi,m.,欧洲专利申请公开号171,496;morrison等,欧洲专利申请公开号173,494;neuberger等,国际专利申请公开号wo 86/01533;cabilly等,美国专利号4,816,567;cabilly等,欧洲专利申请公开号125,023;better等,(1988 science240:1041-1043);liu等,(1987)pnas 84:3439-3443;liu等,1987,j.immunol.139:3521-3526;sun等,(1987)pnas 84:214-218;nishimura等,1987,canc.res.47:999-1005;wood等,(1985)nature 314:446-449;和shaw等,1988,j.natl cancer inst.80:1553-1559)。
[0239]
人源化或cdr移植抗体中(免疫球蛋白重链或轻链的)至少一个或两个但通常为全部三个受者cdr被供者cdr替代。抗体可用至少部分非人cdr进行替换,或仅一些cdr可用非人cdr替换。仅需要替换人源化抗体结合脂多糖所需的cdr数。在一个实施方式中,供者可为啮齿类抗体,例如大鼠或小鼠抗体,而受者可为人框架或人共有框架。通常,提供cdr的免疫球蛋白被称“供者”,而提供框架区的免疫球蛋白被称作“受者”。在一些实施方式中,供者免疫球蛋白是非人的(例如,啮齿类)。受者框架通常为天然存在(例如人)的框架或共有框架,或与其约85%或更高例如90%、95%、99%或更高相同性的序列。
[0240]
如本文所用,术语“共有序列”是指由相关序列家族中最高频存在氨基酸(或核苷酸)组成的序列(参见例如,winnaker,从基因到克隆(from genes to clones),verlagsgesellschaft出版公司,德国威因海姆(weinheim,germany),1987)。在某一蛋白家族中,共有序列中的各位置上是该家族中该位置处出现频率最高的氨基酸。如果两种氨基酸出现频率相同,可将其中任一种包含于共有序列中。“共有框架”是指共有免疫球蛋白序列中的框架区。
[0241]
可采用任何合适的方法将抗体人源化,本领域中已知许多此类方法(参见例如,morrison,s.l.,1985,science 229:1202-1207,oi等,1986,biotechniques 4:214,以及queen等,us 5,585,089、us 5,693,761和us 5,693,762,其全部内容作为参考纳入本文)。
[0242]
可采用cdr移植或cdr取代来产生人源化或cdr移植抗体,可替换免疫球蛋白链中的一个、两个或全部cdr。参见例如美国专利号5,225,539;jones等,1986 nature 321:552-525;verhoeyan等,1988 science 239:1534;beidler等,1988 j.immuno1.141:4053-4060;winter us5,225,539,其全部内容作为参考纳入本文。winter描述了可用于制备人源化抗体的cdr移植方法(英国专利申请gb 2188638a,提交于1987年3月26日;winter us5,225,
539),其全部内容作为参考纳入本文。
[0243]
还提供了其中特定氨基酸被取代、缺失或插入的人源化抗体。从供者中选择氨基酸的标准描述于例如us5,585,089,例如us5,585,089的第12-16栏,其内容通过参考纳入本文。使抗体人源化的其他技术描述于padlan等ep519596 a1(公开于1992年12月23日)。
[0244]
在一个实施方式中,抗体分子所具有的重链恒定区选自例如:iggl、igg2(例如igg2a)、igg3、igg4、igm、iga1、iga2、igd和ige的重链恒定区;具体而言,选自例如igg1、igg2、igg3和igg4的(例如人的)重链恒定区。在一个实施方式中,抗体分子包含igg(例如m3同种异型)的重链恒定区。在另一个实施方式中,抗体分子所具有的轻链恒定区选自例如κ或λ(例如人的)轻链恒定区。在一个实施方式中,抗体分子还包含κ的轻链恒定区(例如,κ恒定*01)。在一个实施方式中,抗体分子包含igg1的重链恒定区和κ的轻链恒定区。可改变(例如突变)恒定区以修饰该抗体分子的性能(例如以增加或减少如下一项或多项:fc受体结合、抗体糖基化、半胱氨酸残基数、效应细胞功能和/或补体功能)。在一个实施方式中,抗体分子具有效应功能且能够固定补体。在另一个实施方式中,抗体分子不募集效应细胞或固定补体。在某些实施方式中,抗体分子结合fc受体的能力降低或不具备该能力。例如,抗体可以是不支持与fc受体结合的同种型或亚型、片段或其他突变体,例如其具有经诱变的fc受体结合区或缺失fc受体结合区。
[0245]
在一个实施方式中,抗体分子的恒定区被改变。改变抗体恒定区的方法是本领域中已知的。具有改变的功能(例如对效应体配体(如细胞上的fcr)或补体的c1成分的亲和力改变)的抗体分子可通过将该抗体恒定部分中的至少一个氨基酸残基替换为不同的残基来产生(参见例如ep388,15ia1、美国专利号5,624,821和美国专利号5,648,260,其全部内容通过引用纳入本文)。还包括了使抗体结构稳定的氨基酸突变,例如人igg4中的s228p(eu命名法,kabat命名法中的s241p)。可描述相似类型的改变,其若应用于鼠或其他物种免疫球蛋白将减弱或消除这些功能。
[0246]
在一个实施方式中,抗体分子包含包含表9所述突变或突变组合的一个或多个(例如,2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25或更多)的fc区域。
[0247]
表9.示例性fc突变
[0248]
[0249]
[0250]
[0251]
[0252]
[0253]
[0254]
[0255]
[0256]
[0257]
[0258]
[0259]
[0260]
[0261]
[0262]
[0263]
[0264][0265]
在一个实施方式中,fc区包括fcmut001。在一个实施方式中,fc区包括fcmut002。在一个实施方式中,fc区包括fcmut003。在一个实施方式中,fc区包括fcmut004。在一个实施方式中,fc区包括fcmut005。在一个实施方式中,fc区包括fcmut006。在一个实施方式中,fc区包括fcmut007。在一个实施方式中,fc区包括fcmut008。在一个实施方式中,fc区包括fcmut009。在一个实施方式中,fc区包括fcmut010。在一个实施方式中,fc区包括fcmut011。在一个实施方式中,fc区包括fcmut012。在一个实施方式中,fc区包括fcmut013。在一个实施方式中,fc区包括fcmut014。在一个实施方式中,fc区包括fcmut015。在一个实施方式中,fc区包括fcmut016。在一个实施方式中,fc区包括fcmut017。在一个实施方式中,fc区包括fcmut018。在一个实施方式中,fc区包括fcmut019。在一个实施方式中,fc区包括fcmut020。在一个实施方式中,fc区包括fcmut021。在一个实施方式中,fc区包括fcmut022。在一个实施方式中,fc区包括fcmut023。在一个实施方式中,fc区包括fcmut024。在一个实施方式中,fc区包括fcmut026。在一个实施方式中,fc区包括fcmut027。在一个实施方式中,fc区包括fcmut028。在一个实施方式中,fc区包括fcmut029。在一个实施方式中,fc区包括fcmut030。在一个实施方式中,fc区包括fcmut031。在一个实施方式中,fc区包括fcmut032。在一个实施方式中,fc区包括fcmut033。在一个实施方式中,fc区包括fcmut034。在一个实施方式中,fc区包括fcmut035。在一个实施方式中,fc区包括fcmut036。在一个实施方式中,fc区包括fcmut037。在一个实施方式中,fc区包括fcmut038。在一个实施方式中,fc区包括fcmut039。在一个实施方式中,fc区包括fcmut040。在一个实施方式中,fc区包括fcmut041。在一个实施方式中,fc区包括fcmut042。在一个实施方式中,fc区包括fcmut043。在一个实施方式中,fc区包括fcmut044。在一个实施方式中,fc区包括fcmut045。在一个实施方式中,fc区包括fcmut046。在一个实施方式中,fc区包括fcmut047。在一个实施方式中,fc区包括fcmut048。在一个实施方式中,fc区包括fcmut049。在一个实施方式中,fc区包括fcmut050。在一个实施方式中,fc区包括fcmut051。在一个实施方式中,fc区包括fcmut052。在一个实施方式中,fc区包括fcmut053。在一个实施方式中,fc区包括fcmut067。在一个实施方式中,fc区包括fcmut068。在一个实施方式中,fc区包括fcmut069。在一个实施方式中,fc区包括fcmut070。在一个实施方式中,fc区包括fcmut071。在一个实施方式中,fc区包括fcmut072。在一个实施方式中,fc区包括fcmut073。在一个实施方式中,fc区包括fcmut074。在一个实施方式中,fc区包括fcmut075。在一个实施方式中,fc区包括fcmut076。在一个实施方式中,fc区包括fcmut077。在一个实施方式中,fc区包括fcmut078。在一个实施方式中,fc区包括fcmut079。在一个实施方式中,fc区包括fcmut080。在一个实施方式中,fc区包括fcmut081。在一个实施方式中,fc区包括fcmut082。在一个实施方式中,fc区包括fcmut083。在一个实施方式中,fc区包括fcmut084。在一个实施方式中,fc区包括fcmut085。在一个实施方式中,fc区包括fcmut086。在一个实施方式中,fc区包括fcmut087。在一个实施方式中,fc区包括fcmut088。在一个实施方式中,fc区包括fcmut089。在一个实施方式中,fc区包括fcmut090。在一个实施方式中,fc区包括fcmut091。在一个实施方式中,fc区包括fcmut093。在一个实施方式中,fc区包括fcmut094。在一个实施方式中,fc区包括fcmut095。在一个实施方式中,fc区包括
fcmut096。在一个实施方式中,fc区包括fcmut097。在一个实施方式中,fc区包括fcmut098。在一个实施方式中,fc区包括fcmut099。在一个实施方式中,fc区包括fcmut100。在一个实施方式中,fc区包括fcmut101。在一个实施方式中,fc区包括fcmut102。在一个实施方式中,fc区包括fcmut103。在一个实施方式中,fc区包括fcmut104。在一个实施方式中,fc区包括fcmut105。在一个实施方式中,fc区包括fcmut106。在一个实施方式中,fc区包括fcmut107。在一个实施方式中,fc区包括fcmut108。在一个实施方式中,fc区包括fcmut109。在一个实施方式中,fc区包括fcmut110。在一个实施方式中,fc区包括fcmut111。在一个实施方式中,fc区包括fcmut112。在一个实施方式中,fc区包括fcmut113。在一个实施方式中,fc区包括fcmut114。在一个实施方式中,fc区包括fcmut115。在一个实施方式中,fc区包括fcmut116。在一个实施方式中,fc区包括fcmut117。在一个实施方式中,fc区包括fcmut118。在一个实施方式中,fc区包括fcmut119。在一个实施方式中,fc区包括fcmut120。在一个实施方式中,fc区包括fcmut121。在一个实施方式中,fc区包括fcmut122。在一个实施方式中,fc区包括fcmut123。在一个实施方式中,fc区包括fcmut124。在一个实施方式中,fc区包括fcmut125。在一个实施方式中,fc区包括fcmut126。在一个实施方式中,fc区包括fcmut127。在一个实施方式中,fc区包括fcmut128。在一个实施方式中,fc区包括fcmut129。在一个实施方式中,fc区包括fcmut130。在一个实施方式中,fc区包括fcmut131。在一个实施方式中,fc区包括fcmut132。在一个实施方式中,fc区包括fcmut133。在一个实施方式中,fc区包括fcmut134。在一个实施方式中,fc区包括fcmut135。在一个实施方式中,fc区包括fcmut136。在一个实施方式中,fc区包括fcmut137。在一个实施方式中,fc区包括fcmut138。在一个实施方式中,fc区包括fcmut139。在一个实施方式中,fc区包括fcmut140。在一个实施方式中,fc区包括fcmut141。在一个实施方式中,fc区包括fcmut142。在一个实施方式中,fc区包括fcmut143。在一个实施方式中,fc区包括fcmut144。在一个实施方式中,fc区包括fcmut145。在一个实施方式中,fc区包括fcmut146。在一个实施方式中,fc区包括fcmut147。在一个实施方式中,fc区包括fcmut148。在一个实施方式中,fc区包括fcmut149。在一个实施方式中,fc区包括fcmut150。在一个实施方式中,fc区包括fcmut151。在一个实施方式中,fc区包括fcmut152。在一个实施方式中,fc区包括fcmut153。在一个实施方式中,fc区包括fcmut154。在一个实施方式中,fc区包括fcmut155。在一个实施方式中,fc区包括fcmut156。在一个实施方式中,fc区包括fcmut157。在一个实施方式中,fc区包括fcmut158。在一个实施方式中,fc区包括fcmut159。在一个实施方式中,fc区包括fcmut160。在一个实施方式中,fc区包括fcmut161。在一个实施方式中,fc区包括fcmut162。在一个实施方式中,fc区包括fcmut163。在一个实施方式中,fc区包括fcmut164。在一个实施方式中,fc区包括fcmut165。在一个实施方式中,fc区包括fcmut166。在一个实施方式中,fc区包括fcmut167。在一个实施方式中,fc区包括fcmut168。在一个实施方式中,fc区包括fcmut169。在一个实施方式中,fc区包括fcmut170。在一个实施方式中,fc区包括fcmut171。在一个实施方式中,fc区包括fcmut172。在一个实施方式中,fc区包括fcmut173。在一个实施方式中,fc区包括fcmut174。在一个实施方式中,fc区包括fcmut175。在一个实施方式中,fc区包括fcmut176。在一个实施方式中,fc区包括fcmut177。在一个实施方式中,fc区包括fcmut178。在一个实施方式中,fc区包括fcmut179。在一个实施方式中,fc区包括fcmut180。在一个实施方式中,fc区包括fcmut181。在一个实施方式中,fc区包括fcmut182。在一个实施方式中,fc区包括fcmut183。在一个实施方式中,
fc区包括fcmut184。在一个实施方式中,fc区包括fcmut185。在一个实施方式中,fc区包括fcmut186。在一个实施方式中,fc区包括fcmut187。在一个实施方式中,fc区包括fcmut188。在一个实施方式中,fc区包括fcmut189。在一个实施方式中,fc区包括fcmut190。在一个实施方式中,fc区包括fcmut191。在一个实施方式中,fc区包括fcmut192。在一个实施方式中,fc区包括fcmut193。在一个实施方式中,fc区包括fcmut194。在一个实施方式中,fc区包括fcmut195。在一个实施方式中,fc区包括fcmut196。在一个实施方式中,fc区包括fcmut197。在一个实施方式中,fc区包括fcmut198。在一个实施方式中,fc区包括fcmut199。在一个实施方式中,fc区包括fcmut200。在一个实施方式中,fc区包括fcmut201。在一个实施方式中,fc区包括fcmut202。在一个实施方式中,fc区包括fcmut203。在一个实施方式中,fc区包括fcmut204。在一个实施方式中,fc区包括fcmut205。在一个实施方式中,fc区包括fcmut206。在一个实施方式中,fc区包括fcmut207。在一个实施方式中,fc区包括fcmut208。在一个实施方式中,fc区包括fcmut209。在一个实施方式中,fc区包括fcmut210。在一个实施方式中,fc区包括fcmut211。在一个实施方式中,fc区包括fcmut212。在一个实施方式中,fc区包括fcmut213。在一个实施方式中,fc区包括fcmut214。在一个实施方式中,fc区包括fcmut215。在一个实施方式中,fc区包括fcmut216。在一个实施方式中,fc区包括fcmut217。在一个实施方式中,fc区包括fcmut218。在一个实施方式中,fc区包括fcmut219。在一个实施方式中,fc区包括fcmut220。在一个实施方式中,fc区包括fcmut221。在一个实施方式中,fc区包括fcmut222。在一个实施方式中,fc区包括fcmut223。在一个实施方式中,fc区包括fcmut224。在一个实施方式中,fc区包括fcmut225。在一个实施方式中,fc区包括fcmut226。在一个实施方式中,fc区包括fcmut227。在一个实施方式中,fc区包括fcmut228。在一个实施方式中,fc区包括fcmut229。在一个实施方式中,fc区包括fcmut230。在一个实施方式中,fc区包括fcmut231。在一个实施方式中,fc区包括fcmut232。在一个实施方式中,fc区包括fcmut233。在一个实施方式中,fc区包括fcmut234。在一个实施方式中,fc区包括fcmut242。在一个实施方式中,fc区包括fcmut243。在一个实施方式中,fc区包括fcmut244。
[0266]
其他示例性fc突变描述于,例如,国际申请公开号wo2018/052556,美国专利申请公开号us2018/0037634,和booth等,mabs.2018;10(7):1098-1110,其全部内容通过引用纳入本文。
[0267]
在一个实施方式中,改变fc区以延长半衰期。例如,fc区可包含以下一个或多个:fcmut183(t256d-q311v-a378v)、fcmut197(h285n-t307q-n315d)、fcmut213(h285d-t307q-a378v)、fcmut215(t307q-q311v-a378v)或fcmut228(t256d-n286d-t307r-q311v-a378v)(全部根据eu编号)。
[0268]
在一个实施方式中,改变fc区以增强adcc。例如,fc区可包含以下的一个或多个:a330l-i332e-s239d,f243l-r292p-y300l-v305i-p396l,或s298a-e333a-k334a在一个实施方式中,可通过在敲除岩藻糖基转移酶(fuct8)的细胞系(如cho)中表达来实现去岩藻糖基化。
[0269]
在一个实施方式中,改变fc区以增强cdc。例如,fc区包含s267e-h268f-s324t。
[0270]
在一个实施方式中,改变fc区以增强抗体依赖性细胞吞噬作用(adcp)。例如,fc区包含s239d-i332e-a330l。
[0271]
在一个实施方式中,抗体分子中的氨基酸仅为标准氨基酸。在一个实施方式中,抗体分子包含天然存在的氨基酸;其类似物、衍生物及同类物;具有变体侧链的氨基酸类似
物;和/或前述中任意的所有立体异构体。抗体分子可包含肽模拟物和氨基酸的d-或l-光学异构体。
[0272]
本文所述抗体分子的多肽可为线性或分支型,其可包含经修饰的氨基酸,且可间插有非氨基酸。还可修饰抗体分子;例如,通过二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它操作,如与标记组分偶联来修饰。多肽可从天然来源分离,可采用重组技术由原核或真核宿主产生,或者可为合成方法的产品。
[0273]
本文所述的抗体分子可以非偶联形式单独使用,或可与某些物质结合,所述物质为例如毒素或部分(例如治疗药物;发出辐射的化合物;植物、真菌或细菌源性分子;或生物蛋白(例如蛋白毒素)或颗粒(例如重组病毒颗粒(例如通过病毒包被蛋白))。例如,抗cd138抗体可与放射性同位素(如α-、β-或γ-放射物或β-和γ-放射物)偶合。
[0274]
抗体分子可衍生化为或联接其他功能性分子(例如另一肽或蛋白质)。如本文所用,“衍生化”抗体分子是已被修饰的抗体分子。衍生化的方法包括但不限于:添加荧光部分、放射性核苷酸、毒素、酶或亲和配体(如生物素)。因此,抗体分子包括本文所述抗体的衍生化和其他修饰形式,包括免疫粘附分子。例如,抗体分子可与一个或多个其他分子实体功能性联接(通过化学偶联、遗传融合、非共价关联或其他),所述其他分子实体为例如另一抗体(例如双特异性抗体或双抗体)、检测剂、毒素、药剂和/或能介导该抗体或抗体部分与其他分子(如链霉亲和素核心区或多聚组氨酸标签)关联的蛋白质或肽。
[0275]
某些类型的衍生化抗体分子可通过交联两个或多个抗体(相同类型或不同类型,例如用以产生双特异性抗体)来产生。合适的交联剂包括具有通过合适间隔子分隔的两个不同反应基团的异双官能性交联剂(例如间-马来酰亚胺苯甲酰基-n-羟基琥珀酰亚胺酯)或同双官能性(例如二琥珀酰亚胺基辛二酸酯)交联剂。此类交联剂可获自皮尔斯化学品公司(pierce chemical company)(伊利诺斯州罗克福德)。
[0276]
可用于衍生化(或标记)抗cd138抗体分子的有用的可检测剂包括荧光化合物、各种酶、辅基、发光材料、生物发光材料、荧光发射金属原子(例如铕(eu)和其他镧系原子)以及放射性材料(如下文所述)。示例性荧光检测剂包括荧光素、荧光素异硫氰酸酯、罗丹明、5-二甲基胺-1-萘磺酸氯、藻红蛋白等。还可用可检测酶衍生化抗体,所述酶可为例如碱性磷酸酶、辣根过氧化酶、β-半乳糖苷酶、乙酰胆碱酯酶、葡萄糖氧化酶等。用可检测酶衍生抗体时,可采用加入该酶用来产生可检测反应产物的其他试剂来检测该抗体。例如,当存在检测剂辣根过氧化酶时,加入过氧化氢和二氨基联苯胺产生可检测的颜色反应产物。也可用辅基(例如链霉亲和素/生物素和亲和素/生物素)来衍生抗体分子。例如,可用生物素衍生抗体,并通过亲和素或链霉亲和素结合的间接测定来检测该抗体。合适荧光材料的例子包括伞形酮、荧光素、荧光素异硫氰酸酯、罗丹明、二氯三嗪基胺荧光素、丹磺酰氯或藻红蛋白;发光材料的例子包括鲁米诺;生物发光材料的例子包括萤光素酶、荧光素和水母发光蛋白。
[0277]
可例如诊断性和/或试验性地应用标记的抗体分子,包括(i)用于通过标准技术(如亲和层析或免疫沉淀)分离预定抗原;(ii)用于检测(例如细胞裂解物或细胞上清液中的)预定抗原以评价蛋白质的表达模式和丰度;(iii)用于监测组织中蛋白水平作为临床试验的一部分来例如用于测定给定治疗方案的功效。
[0278]
抗体分子可与其他分子实体偶联,所述分子实体通常为标记物或治疗剂(例如抗
微生物剂(例如抗细菌剂或杀细菌剂)、免疫调节剂、免疫刺激剂、细胞毒剂或细胞抑制剂)或部分。可将放射性同位素用于检测或治疗应用中。可与抗体分子偶联的放射性同位素包括但不限于α-、β-或γ-放射体,或者β-和γ-放射体。此类放射性同位素包括但不限于:碘(
131
i或
125
i)、钇(
90
y)、镥(
177
lu)、锕(
225
ac)、镨、砹(
211
at)、铼(
186
re)、铋(
212
bi或
213
bi)、铟(
111
in)、锝(
99
mtc)、磷(
32
p)、铑(
188
rh)、硫(
35
s)、碳(
14
c)、氚(3h)、铬(
51
cr)、氯(
36
cl)、钴(
57
co或
58
co)、铁(
59
fe)、硒(
75
se)或镓(
67
ga)。可用作治疗剂的放射性同位素包括:钇(
90
y)、镥(
177
lu)、锕(
225
ac)、镨、砹(
211
at)、铼(
186
re)、铋(
212
bi或
213
bi)和铑(
188
rh)。可用作标记物例如用于诊断的放射性同位素包括:碘(
131
i或
125
i)、铟(
111
in)、锝(
99
mtc)、磷(
32
p)、碳(
14
c)和氚(3h),或以上所列治疗用同位素中的一种或多种。
[0279]
本公开提供了放射性标记的抗体分子及其标记方法。在一个实施方式中,公开了标记抗体分子的方法。该方法包括使抗体分子接触螯合剂从而产生偶联抗体。该偶联抗体被放射性同位素(例如
111
铟、
90
钇和
177
镥)放射性标记从而产生标记的抗体分子。
[0280]
在一个方面中,本公开提供了制备本文所公开的人源化抗体分子的方法。该方法包括:提供抗原(例如,cd138)或其片段;获得特异性结合该抗原的人源化抗体分子;评估该抗体分子在调控该抗原活性和/或生物表达该抗原(例如,cd138)中的功效。该方法还可进一步包括给予对象(例如人)该抗体分子,包括其衍生物(例如人源化抗体分子)。
[0281]
本公开提供了编码上述抗体分子的分离的核酸分子、及其载体和宿主细胞。核酸分子包括但不限于rna、基因组dna和cdna。
[0282]
表1描述了示例性抗体分子的氨基酸序列。表2描述了示例性vh和vl的氨基酸和核苷酸序列。表2所述的任何vh可与表2所述的任何vl配对以形成示例性的人源化抗cd138抗体分子。抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422在本文中有时也称为mab 3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422。
[0283]
其他示例性抗体分子描述于pct公开号wo 2019/070726或美国专利申请公开号us 2019/0100588,其全文通过引用纳入本文。
[0284]
表1.示例性抗cd138抗体。重链可变区(vh)和轻链可变区(vl)的氨基酸序列如下提供。指示了根据kabat或chothia系统定义的cdr。
[0285]
[0286]
[0287]
[0288]
[0289]
[0290]
[0291]
[0292]
[0293]
[0294]
[0295][0296][0297]
表2.示例性重链可变区(vh)和轻链可变区(vl)的氨基酸和核苷酸序列。根据kabat系统定义的cdr带下划线并加粗,而根据chothia系统定义的cdr为斜体。
[0298]
[0299]
[0300]
[0301]
[0302]
[0303]
[0304]
[0305]
[0306][0307]
在一个实施方式中,抗体分子包含本文(例如,表1或2中)所述抗体分子vh区的一个、两个或三个cdr(采用kabat或chothia的cdr定义)。在一个实施方式中,抗体分子包含本文(例如,表1或2中)所述抗体分子vl区的一个、两个或三个cdr(采用kabat或chothia的cdr定义)。在一个实施方式中,采用kabat或chothia的cdr定义,抗体分子包含本文(例如,表1或2中)所述抗体分子vh区的一个或多个(例如两个或三个)cdr和vl区的一个或多个(例如两个或三个)cdr。
[0308]
在一个实施方式中,抗体分子包含表1或2中所述的一个,两个或三个hcdr。在一个实施方式中,抗体分子包含表1或2中所述的一个,两个或三个lcdr。在一个实施方式中,抗体分子包含表1或2中所述的一个或多个(例如,两个或三个)hcdr和一个或多个(例如,两个或三个)lcdr。
[0309]
在一个实施方式中,抗体分子包含表1或2所述抗体分子vh区的一个、两个、三个或四个框架。在一个实施方式中,抗体分子包含表1或2所述抗体分子vl区的一个、两个、三个或四个框架。在一个实施方式中,该抗体分子包含表1或2中描述的抗体分子的vh区的一个或多个(例如,两个,三个或四个)框架和vl区的一个或多个(例如,两个,三个或四个)框架。
[0310]
在一个实施方式中,抗体分子包含本文(例如,表1或2中)所述的抗体分子的vh。在一个实施方式中,抗体分子包含本文(例如,表1或2中)所述的抗体分子的vl。在一个实施方式中,抗体分子包含本文(例如,表1或2中)所述的抗体分子的vh和vl。
[0311]
在一个实施方式中,抗体分子包含的vh具有表1或2中所述的氨基酸序列或与其基本上相同的氨基酸序列(例如,与其相差不超过1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基,或与其具有至少85、90、95或99%的相同性)。在一个实施方式中,抗体分子包含的vl具有表1或2中所述的氨基酸序列或与其基本上相同的氨基酸序列(例如,与其相差不超过1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基,或与其具有至少85、90、95或99%的相同性)。在一个实施方式中,抗体分子包含具有表1或2中描述的氨基酸序列(或与其基本相同的氨基酸序列)的vh和具有表1或2中描述的氨基酸序列(或与其基本相同的氨基酸序列)的vl。
[0312]
在一个实施方式中,抗体分子包含由表2中所述的核苷酸序列或与其基本相同的核苷酸序列(例如,与其相差不超过3、6、15、30或45个核苷酸,或至少约85%,90%,95%或99%相同)编码的vh。在一个实施方式中,抗体分子包含由表2中所述的核苷酸序列或与其基本相同的核苷酸序列(例如,与其相差不超过3、6、15、30或45个核苷酸,或至少约85%,90%,95%或99%相同)编码的vl。在一个实施方式中,抗体分子包含由表2中所述的核苷酸序列(或与其基本相同的核苷酸序列)编码的vh和由表2中所述的核苷酸序列(或与其基本相同的核苷酸序列)编码的vl。
[0313]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0314]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0315]
在一个实施方式中,vh包含氨基酸序列seq id no:466。在一个实施方式中,vl包
含氨基酸序列seq id no:475。在一个实施方式中,vh包含氨基酸序列seq id no:466,且vl包含氨基酸序列seq id no:475。
[0316]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0317]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0318]
在一个实施方式中,vh包含氨基酸序列seq id no:466。在一个实施方式中,vl包含氨基酸序列seq id no:476。在一个实施方式中,vh包含氨基酸序列seq id no:466,且vl包含氨基酸序列seq id no:476。
[0319]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0320]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨
id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0326]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnyaqkfqg(seq id no:513);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnyaqkfqg(seq id no:513);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0327]
在一个实施方式中,vh包含氨基酸序列seq id no:470。在一个实施方式中,vl包含氨基酸序列seq id no:481。在一个实施方式中,vh包含氨基酸序列seq id no:470,且vl包含氨基酸序列seq id no:481。
[0328]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0329]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0330]
在一个实施方式中,vh包含氨基酸序列seq id no:471。在一个实施方式中,vl包含氨基酸序列seq id no:475。在一个实施方式中,vh包含氨基酸序列seq id no:471,且vl包含氨基酸序列seq id no:475。
[0331]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0332]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0333]
在一个实施方式中,vh包含氨基酸序列seq id no:471。在一个实施方式中,vl包含氨基酸序列seq id no:476。在一个实施方式中,vh包含氨基酸序列seq id no:471,且vl包含氨基酸序列seq id no:476。
[0334]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0335]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);
(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0336]
在一个实施方式中,vh包含氨基酸序列seq id no:471。在一个实施方式中,vl包含氨基酸序列seq id no:477。在一个实施方式中,vh包含氨基酸序列seq id no:471,且vl包含氨基酸序列seq id no:477。
[0337]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0338]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0339]
在一个实施方式中,vh包含氨基酸序列seq id no:471。在一个实施方式中,vl包含氨基酸序列seq id no:481。在一个实施方式中,vh包含氨基酸序列seq id no:471,且vl包含氨基酸序列seq id no:481。
[0340]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gytftsy(seq id no:322);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytftsy(seq id no:322);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列
qqlvqypyt(seq id no:511)。
[0341]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0342]
在一个实施方式中,vh包含氨基酸序列seq id no:472。在一个实施方式中,vl包含氨基酸序列seq id no:476。在一个实施方式中,vh包含氨基酸序列seq id no:472,且vl包含氨基酸序列seq id no:476。
[0343]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gynfasy(seq id no:517);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gynfasy(seq id no:517);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0344]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0345]
在一个实施方式中,vh包含氨基酸序列seq id no:473。在一个实施方式中,vl包含氨基酸序列seq id no:475。在一个实施方式中,vh包含氨基酸序列seq id no:473,且vl包含氨基酸序列seq id no:475。
[0346]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gynfasy(seq id no:517);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)
hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gynfasy(seq id no:517);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0347]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0348]
在一个实施方式中,vh包含氨基酸序列seq id no:473。在一个实施方式中,vl包含氨基酸序列seq id no:476。在一个实施方式中,vh包含氨基酸序列seq id no:473,且vl包含氨基酸序列seq id no:476。
[0349]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gynfasy(seq id no:517);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gynfasy(seq id no:517);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0350]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssqsllykdgktyln
(seq id no:512);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0351]
在一个实施方式中,vh包含氨基酸序列seq id no:473。在一个实施方式中,vl包含氨基酸序列seq id no:481。在一个实施方式中,vh包含氨基酸序列seq id no:473,且vl包含氨基酸序列seq id no:481。
[0352]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:356);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:356);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0353]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syyih(seq id no:518);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syyih(seq id no:518);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfqg(seq id no:514);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0354]
在一个实施方式中,vh包含氨基酸序列seq id no:463。在一个实施方式中,vl包含氨基酸序列seq id no:477。在一个实施方式中,vh包含氨基酸序列seq id no:463,且vl包含氨基酸序列seq id no:477。
[0355]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0356]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列
syyih(seq id no:518);(ii)hcdr2,包含氨基酸序列tihpsdstanyaqkfqg(seq id no:519);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);或(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syyih(seq id no:518);(ii)hcdr2,包含氨基酸序列tihpsdstanyaqkfqg(seq id no:519);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列kssksllykdgktyln(seq id no:510);(ii)lcdr2,包含氨基酸序列vvstras(seq id no:353);和(iii)lcdr3,包含氨基酸序列qqlvqypyt(seq id no:511)。
[0357]
在一个实施方式中,vh包含氨基酸序列seq id no:464。在一个实施方式中,vl包含氨基酸序列seq id no:476。在一个实施方式中,vh包含氨基酸序列seq id no:464,且vl包含氨基酸序列seq id no:476。
[0358]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0359]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0360]
在一个实施方式中,vh包含氨基酸序列seq id no:466。在一个实施方式中,vl包含氨基酸序列seq id no:477。在一个实施方式中,vh包含氨基酸序列seq id no:466,且vl包含氨基酸序列seq id no:477。
[0361]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gysfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rssqsllykdgktyln(seq id no:520);(ii)lcdr2,包含氨基酸序列
vlstras(seq id no:521);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytfssy(seq id no:355);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rssqsllykdgktyln(seq id no:520);(ii)lcdr2,包含氨基酸序列vlstras(seq id no:521);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0362]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rssqsllykdgktyln(seq id no:520);(ii)lcdr2,包含氨基酸序列vlstras(seq id no:521);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdstanynqkfkg(seq id no:509);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rssqsllykdgktyln(seq id no:520);(ii)lcdr2,包含氨基酸序列vlstras(seq id no:521);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0363]
在一个实施方式中,vh包含氨基酸序列seq id no:466。在一个实施方式中,vl包含氨基酸序列seq id no:480。在一个实施方式中,vh包含氨基酸序列seq id no:466,且vl包含氨基酸序列seq id no:480。
[0364]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列gytftsy(seq id no:322);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列gytftsy(seq id no:322);(ii)hcdr2,包含氨基酸序列hpsdst(seq id no:351);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0365]
在一个实施方式中,vh包含以下的一个、两个或全部:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);或(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含以下的一个、两个或全部:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);或(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。在一个实施方式中,vh包含:(i)hcdr1,包含氨基酸序列syymh(seq id no:380);(ii)hcdr2,包含氨基酸序列tihpsdsttnynqkfkg(seq id no:382);和(iii)hcdr3,包含氨基酸序列fvy(seq id no:508);和vl包含:(i)lcdr1,包含氨基酸序列rasksllykdgktyln(seq id no:515);(ii)lcdr2,包含氨基酸序列vvsslqs(seq id no:516);和(iii)lcdr3,包含氨基酸序列qqlveypyt(seq id no:354)。
[0366]
在一个实施方式中,vh包含氨基酸序列seq id no:472。在一个实施方式中,vl包含氨基酸序列seq id no:477。在一个实施方式中,vh包含氨基酸序列seq id no:472,且vl包含氨基酸序列seq id no:477。
[0367]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0368]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh38、vh43或vh45(例如如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0369]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl20的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0370]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0371]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0372]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0373]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0374]
在一个实施方式中,抗体分子包含:
[0375]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比
具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0376]
(b)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0377]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0378]
在一个实施方式中,vh所含的氨基酸序列与vh38、vh43或vh45的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh38、vh43或vh45的氨基酸序列。
[0379]
在一个实施方式中,vl所含的氨基酸序列与vl20的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl20的氨基酸序列。
[0380]
在一个实施方式中,(a)vh所含的氨基酸序列与vh38、vh43或vh45的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl20的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0381]
在一个实施方式中,vh包含vh38、vh43或vh45的氨基酸序列并且vl包含vl20的氨基酸序列。
[0382]
在一个实施方式中,抗体分子包含fc区。
[0383]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0384]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh38、vh42、vh43、vh44、vh45或vh36(例如如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具
有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0385]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl21的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0386]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0387]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0388]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0389]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0390]
在一个实施方式中,抗体分子包含:
[0391]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0392]
(a)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0393]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0394]
在一个实施方式中,vh所含的氨基酸序列与vh38、vh42、vh43、vh44、vh45或vh36的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh38、vh42、vh43、vh44、vh45或vh36的氨基酸序列。
[0395]
在一个实施方式中,vl所含的氨基酸序列与vl21的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl21的氨基酸序列。
[0396]
在一个实施方式中,(a)vh所含的氨基酸序列与vh38、vh42、vh43、vh44、vh45或vh36的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl21的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0397]
在一个实施方式中,vh包含vh38、vh42、vh43、vh44、vh45或vh36的氨基酸序列并且vl包含vl21的氨基酸序列。
[0398]
在一个实施方式中,抗体分子包含fc区。
[0399]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0400]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh38、vh42、vh43或vh45(例如如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0401]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl26的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0402]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸
序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0403]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0404]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0405]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0406]
在一个实施方式中,抗体分子包含:
[0407]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0408]
(a)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0409]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0410]
在一个实施方式中,vh所含的氨基酸序列与vh38、vh42、vh43或vh45的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh38、vh42、vh43或vh45的氨基酸序列。
[0411]
在一个实施方式中,vl所含的氨基酸序列与vl26的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl26的氨基酸序列。
[0412]
在一个实施方式中,(a)vh所含的氨基酸序列与vh38、vh42、vh43或vh45的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至
少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl26的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0413]
在一个实施方式中,vh包含vh38、vh42、vh43或vh45的氨基酸序列并且vl包含vl26的氨基酸序列。
[0414]
在一个实施方式中,抗体分子包含fc区。
[0415]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0416]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh43、vh35、vh38或vh44(例如如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0417]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl22的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0418]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0419]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0420]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0421]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0422]
在一个实施方式中,抗体分子包含:
[0423]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0424]
(b)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0425]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0426]
在一个实施方式中,vh所含的氨基酸序列与vh43、vh35、vh38或vh44的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh43、vh35、vh38或vh44的氨基酸序列。
[0427]
在一个实施方式中,vl所含的氨基酸序列与vl22的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl22的氨基酸序列。
[0428]
在一个实施方式中,(a)vh所含的氨基酸序列与vh43、vh35、vh38或vh44的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl22的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0429]
在一个实施方式中,vh包含vh43、vh35、vh38或vh44的氨基酸序列并且vl包含vl22的氨基酸序列。
[0430]
在一个实施方式中,抗体分子包含fc区。
[0431]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0432]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh38的hcdr1(例如如表1或2所列)的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差
异或至少85、90、95、99或100%的同源性;或
[0433]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl20、vl21或vl26的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0434]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0435]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0436]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0437]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0438]
在一个实施方式中,抗体分子包含:
[0439]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0440]
(b)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0441]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的
hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0442]
在一个实施方式中,vh所含的氨基酸序列与vh38的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh38的氨基酸序列。
[0443]
在一个实施方式中,vl所含的氨基酸序列与vl20、vl21或vl26的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl20、vl21或vl26的氨基酸序列。
[0444]
在一个实施方式中,(a)vh所含的氨基酸序列与vh38的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl20、vl21或vl26的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0445]
在一个实施方式中,vh包含vh38的氨基酸序列并且vl包含vl20、vl21或vl26的氨基酸序列。
[0446]
在一个实施方式中,抗体分子包含fc区。
[0447]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0448]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh42(例如如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0449]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl26的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0450]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0451]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0452]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0453]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0454]
在一个实施方式中,抗体分子包含:
[0455]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0456]
(b)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0457]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0458]
在一个实施方式中,vh所含的氨基酸序列与vh42的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh42的氨基酸序列。
[0459]
在一个实施方式中,vl所含的氨基酸序列与vl21或vl26的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl21或vl26的氨基酸序列。
[0460]
在一个实施方式中,(a)vh所含的氨基酸序列与vh42的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl21或vl26的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0461]
在一个实施方式中,vh包含vh42的氨基酸序列并且vl包含vl21或vl26的氨基酸序列。
[0462]
在一个实施方式中,抗体分子包含fc区。
[0463]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0464]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh43(例如如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0465]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl20、vl21、vl26或vl22的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0466]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0467]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0468]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0469]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0470]
在一个实施方式中,抗体分子包含:
[0471]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或
100%的同源性,和
[0472]
(a)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0473]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0474]
在一个实施方式中,vh所含的氨基酸序列与vh43的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh43的氨基酸序列。
[0475]
在一个实施方式中,vl所含的氨基酸序列与vl20、vl21、vl26或vl22的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl20、vl21、vl26或vl22的氨基酸序列。
[0476]
在一个实施方式中,(a)vh所含的氨基酸序列与vh43的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl20、vl21、vl26或vl22的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0477]
在一个实施方式中,vh包含vh43的氨基酸序列并且vl包含vl20、vl21、vl26或vl22的氨基酸序列。
[0478]
在一个实施方式中,抗体分子包含fc区。
[0479]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0480]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh45(例如如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0481]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl20、vl21或vl26的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基
酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0482]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0483]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0484]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0485]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0486]
在一个实施方式中,抗体分子包含:
[0487]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0488]
(b)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0489]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0490]
在一个实施方式中,vh所含的氨基酸序列与vh45的氨基酸序列相比具有不多于1、
2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh45的氨基酸序列。
[0491]
在一个实施方式中,vl所含的氨基酸序列与vl20、vl21或vl26的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl20、vl21或vl26的氨基酸序列。
[0492]
在一个实施方式中,(a)vh所含的氨基酸序列与vh45的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl20、vl21或vl26的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0493]
在一个实施方式中,vh包含vh45的氨基酸序列并且vl包含vl20、vl21或vl26的氨基酸序列。
[0494]
在一个实施方式中,抗体分子包含fc区。
[0495]
一方面,本公开内容的特征在于一种人源化抗cd138抗体分子,其包含以下一或两者:
[0496]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其所含氨基酸序列与vh38(例如如表1或2中所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0497]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其所含氨基酸序列与vl22或vl25的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0498]
在一个实施方式中,vh包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0499]
在一个实施方式中,vh包含:(i)hcdr1,包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,包含所述vh的hcdr3的氨基酸序列。
[0500]
在一个实施方式中,vl包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨
基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0501]
在一个实施方式中,vl包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0502]
在一个实施方式中,抗体分子包含:
[0503]
(a)vh,其包含:(i)hcdr1,其所含氨基酸序列与所述vh的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)hcdr2,其所含氨基酸序列与所述vh的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)hcdr3,其所含氨基酸序列与所述vh的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0504]
(b)vl,其包含:(i)lcdr1,其所含氨基酸序列与所述vl的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;(ii)lcdr2,其所含氨基酸序列与所述vl的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和(iii)lcdr3,其所含氨基酸序列与所述vl的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0505]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含所述vh的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述vh的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述vh的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,包含所述vl的lcdr1的氨基酸序列;(ii)lcdr2,包含所述vl的lcdr2的氨基酸序列;和(iii)lcdr3,包含所述vl的lcdr3的氨基酸序列。
[0506]
在一个实施方式中,vh所含的氨基酸序列与vh38的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,抗体分子vh包含vh38的氨基酸序列。
[0507]
在一个实施方式中,vl所含的氨基酸序列与vl22或vl25的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。在一个实施方式中,vl包含vl22或vl25的氨基酸序列。
[0508]
在一个实施方式中,(a)vh所含的氨基酸序列与vh38的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和(b)vl所含的氨基酸序列与vl22或vl25的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0509]
在一个实施方式中,vh包含vh38的氨基酸序列并且vl包含vl22或vl25的氨基酸序列。
[0510]
在一个实施方式中,抗体分子包含fc区。
[0511]
在一个实施方式中,抗cd138抗体分子包括:
[0512]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其包含g-y-n/s/t-f-a/s/t-s-y(seq id no:438)的氨基酸序列;(ii)hcdr2,其包含h-p-s-d-s-t(seq id no:351)的氨基酸序列;或(iii)hcdr3,其包含f-v-y(seq id no:508)的氨基酸序列;和
[0513]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其包含k/r-a/s-s-k/q-s-l-l-y-k-d-g-k-t-y-l-n(seq id no:522)的氨基酸序列;(ii)lcdr2,其包含v-l/v-s-s/t-l/r-a/q-s(seq id no:523)的氨基酸序列;或(iii)lcdr3,其包含q-q-l-v-e/q-y-p-y-t(seq id no:524)的氨基酸序列。
[0514]
在一个实施方式中,抗cd138抗体分子包括:
[0515]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其包含s-y-y-i/m-h(seq id no:525)的氨基酸序列;(ii)hcdr2,其包含t-i-h-p-s-d-s-t-a/t-n-y-a/n-q-k-f-k/q-g(seq id no:526)的氨基酸序列;或(iii)hcdr3,其包含f-v-y(seq id no:508)的氨基酸序列;和
[0516]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其包含k/r-a/s-s-k/q-s-l-l-y-k-d-g-k-t-y-l-n(seq id no:522)的氨基酸序列;(ii)lcdr2,其包含v-l/v-s-s/t-l/r-a/q-s(seq id no:523)的氨基酸序列;或(iii)lcdr3,其包含q-q-l-v-e/q-y-p-y-t(seq id no:524)的氨基酸序列。
[0517]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含抗体3820,3821,3826,4221,4226,4320,4321,4322,4326,4421,4520,4521,4526,3522,3621,3822,3825和4422的hcdr1序列的共有氨基酸序列,或其亚组;(ii)hcdr2,其包含相同抗体的hcdr2序列的共有氨基酸序列;和(iii)hcdr3,其包含相同抗体的hcdr3序列的共有氨基酸序列,和(b)vl,其包含:(i)lcdr1,其包含相同抗体的lcdr1的氨基酸序列的共有氨基酸序列;(ii)lcdr2,其包含相同抗体的lcdr2的氨基酸序列的共有氨基酸序列;和(iii)lcdr3,其包含相同抗体的lcdr3的氨基酸序列的共有氨基酸序列。
[0518]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含抗体3820,3821,3826,4221,4226,4320,4321,4322,4326,4421,4520,4521,4526,3522,3621,3822,3825和4422的hcdr1序列的共有氨基酸序列;(ii)hcdr2,其包含相同抗体的hcdr2序列的共有氨基酸序列;和(iii)hcdr3,其包含相同抗体的hcdr3序列的共有氨基酸序列,和(b)vl,其包含:(i)lcdr1,其包含相同抗体的lcdr1的氨基酸序列的共有氨基酸序列;(ii)lcdr2,其包含相同抗体的lcdr2的氨基酸序列的共有氨基酸序列;和(iii)lcdr3,其包含相同抗体的lcdr3的氨基酸序列的共有氨基酸序列。
[0519]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含本文所述的抗cd138抗体(例如,选自抗体3820,3821,3826,4221,4226,4320,4321,4322,4326,4421,4520,4521,4526,3522,3621,3822,3825或4422)的,或如表1所列的hcdr1的氨基酸序列;(ii)hcdr2,其包含抗cd138抗体的hcdr2的氨基酸序列;和(iii)hcdr3,其包含抗cd138抗体
的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,其包含所述抗cd138抗体的lcdr1的氨基酸序列;(ii)lcdr2,其包含所述抗cd138抗体的lcdr2的氨基酸序列;和(iii)lcdr3,其包含所述抗cd138抗体的lcdr3的氨基酸序列。
[0520]
在一个实施方式中,抗cd138抗体分子包括:
[0521]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其包含g-y-n/s/t-f-a/s/t-s-y(seq id no:438)的氨基酸序列;(ii)hcdr2,其包含h-p-s-d-s-t(seq id no:351)的氨基酸序列;或(iii)hcdr3,其包含f-v-y(seq id no:508)的氨基酸序列;和
[0522]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其包含k/r-a/s-s-k/q-s-l-l-y-k-d-g-k-t-y-l-n(seq id no:522)的氨基酸序列;(ii)lcdr2,其包含v-l/v-s-s/t-l/r-a/q-s(seq id no:523)的氨基酸序列;或(iii)lcdr3,其包含q-q-l-v-e/q-y-p-y-t(seq id no:524)的氨基酸序列。
[0523]
在一个实施方式中,hcdr1包含seq id no:355、322、517或356的氨基酸序列,hcdr2包含seq id no:351的氨基酸序列,且hcdr3包含f-v-y(seq id no:508)的氨基酸序列。在一个实施方式中,lcdr1包含seq id no:352、510、512、515或520的氨基酸序列,lcdr2包含seq id no:353、516或521的氨基酸序列,且lcdr3包含seq id no:354或511的氨基酸序列。在一个实施方式中,hcdr1包含seq id no:355、322、517或356的氨基酸序列,hcdr2包含seq id no:351的氨基酸序列,且hcdr3包含f-v-y(seq id no:508)的氨基酸序列,lcdr1包含seq id no:352、510、512、515或520的氨基酸序列,lcdr2包含seq id no:353、516或521的氨基酸序列,且lcdr3包含seq id no:354或511的氨基酸序列。
[0524]
在一个实施方式中,抗cd138抗体分子包括:
[0525]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其包含s-y-y-i/m-h(seq id no:525)的氨基酸序列;(ii)hcdr2,其包含t-i-h-p-s-d-s-t-a/t-n-y-a/n-q-k-f-k/q-g(seq id no:526)的氨基酸序列;或(iii)hcdr3,其包含f-v-y(seq id no:508)的氨基酸序列;和
[0526]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其包含k/r-a/s-s-k/q-s-l-l-y-k-d-g-k-t-y-l-n(seq id no:522)的氨基酸序列;(ii)lcdr2,其包含v-l/v-s-s/t-l/r-a/q-s(seq id no:523)的氨基酸序列;或(iii)lcdr3,其包含q-q-l-v-e/q-y-p-y-t(seq id no:524)的氨基酸序列。
[0527]
在一个实施方式中,hcdr1包含seq id no:380或518的氨基酸序列,hcdr2包含seq id no:382、509、513、514或519的氨基酸序列,且hcdr3包含f-v-y(seq id no:508)的氨基酸序列。在一个实施方式中,lcdr1包含seq id no:352、510、512、515或520的氨基酸序列,lcdr2包含seq id no:353、516或521的氨基酸序列,且lcdr3包含seq id no:354或511的氨基酸序列。在一个实施方式中,hcdr1包含seq id no:380或518的氨基酸序列,hcdr2包含seq id no:382、509、513、514或519的氨基酸序列,且hcdr3包含f-v-y(seq id no:508)的
氨基酸序列,lcdr1包含seq id no:352、510、512、515或520的氨基酸序列,lcdr2包含seq id no:353、516或521的氨基酸序列,且lcdr3包含seq id no:354或511的氨基酸序列。
[0528]
在一个实施方式中,抗体分子包含:(a)vh,其包含:(i)hcdr1,其包含本文所述的抗cd138抗体,例如,选自抗体3820,3821,3826,4221,4226,4320,4321,4322,4326,4421,4520,4521,4526,3522,3621,3822,3825或4422的hcdr1的氨基酸序列;(ii)hcdr2,其包含抗cd138抗体的hcdr2的氨基酸序列;和(iii)hcdr3,其包含抗cd138抗体的hcdr3的氨基酸序列,和(b)vl,其包含:(i)lcdr1,其包含所述抗cd138抗体的lcdr1的氨基酸序列;(ii)lcdr2,其包含所述抗cd138抗体的lcdr2的氨基酸序列;和(iii)lcdr3,其包含所述抗cd138抗体的lcdr3的氨基酸序列。
[0529]
在一个实施方式中,vh包含抗cd138抗体的vh的氨基酸序列,而vl包含抗cd138抗体的vl的氨基酸序列。
[0530]
在一个实施方式中,抗体分子包含两个vh和两个vl。
[0531]
在一个实施方式中,抗体分子是合成抗体分子。在一个实施方式中,抗体分子是分离的抗体分子。在一个实施方式中,抗体分子是人源化抗体分子。在一个实施方式中,抗体分子包含源自人框架种系序列的一个或多个框架区。
[0532]
在一个实施方式中,抗体分子包含vh区,该vh区包含相对于本文所述的抗cd138抗体的一个或多个突变(例如,抗体2810、3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422)。
[0533]
在一个实施方式中,抗体分子结合至cd138的胞外结构域。在一个实施方式中,抗体分子结合至跨膜结构域近处的cd138胞外区域。在一个实施方式中,抗体分子能够结合至以下肽中的一种或多种(例如,两种,三种或全部):包含氨基酸序列entavvavepdrrnqspvdqgatgasqglldrkevlg(seq id no:440)的肽,包含氨基酸序列tavvavepdrrnqspvdqgatgasq (seq id no:441)的肽,包含氨基酸序列entavvavepdrrnqspvdqgatg(seq id no:442)的肽,或包含氨基酸序列entavvavepdrrnq(seq id no:443)的肽。在一个实施方式中,抗体分子能够结合以下肽中的一种或多种(例如,两种或全部):包含氨基酸序列entavvavepdrrnqspvdqgatgasqglldrkevlg(seq id no:440)的肽,包含氨基酸序列rnqspvdqgatgasqglldrkevlg(seq id no:444)的肽,或包含氨基酸序列entavvavepdrrnq(seq id no:443)的肽。
[0534]
在一个实施方式中,抗体分子还结合至远离跨膜结构域的cd138胞外区域,例如,对应于或处于cd138的整合素结合结构域(ibd)近处的区域。在一个实施方式中,抗体分子能够结合至以下一种或两种肽:包含氨基酸序列aststlpagegpkegeavvlpevepgltareqea(seq id no:10)的肽,或包含氨基酸序列geavvlpevepglta(seq id no:445)的肽。
[0535]
在一个实施方式中,抗体分子是合成抗体分子。在一个实施方式中,抗体分子是分离的抗体分子。在一个实施方式中,抗体分子是人源化抗体分子。在一个实施方式中,抗体分子包含源自人框架种系序列的一个或多个框架区。
[0536]
在一个实施方式中,抗体分子是igg抗体。在一个实施方式中,抗体分子包含选自igg1,igg2,igg3或igg4的igg的重链恒定区。在一个实施方式中,抗体分子包含κ或λ轻链的轻链恒定区。
[0537]
在一个实施方式中,抗体分子包含fc区,其包含一个或多个突变以增加与新生受
体fcrn的结合亲和性和/或抗体分子的半衰期。在一个实施方式中,抗体分子包含fc区,该fc区包含本文所述的一个或多个突变,例如,以增加半衰期,adcc,cdc或adcp中的一项或多项。
[0538]
在一个实施方式中,抗体分子是igg抗体。在一个实施方式中,抗体分子包含选自igg1,igg2,igg3或igg4的igg的重链恒定区。在一个实施方式中,抗体分子包含κ或λ轻链的轻链恒定区。
[0539]
在一个实施方式中,抗体分子包含fc区,其包含一个或多个突变以增加与新生受体fcrn的结合亲和性和/或抗体分子的半衰期。在一个实施方式中,抗体分子包含fc区,该fc区包含本文所述的一个或多个突变,例如,以增加半衰期,adcc,cdc或adcp中的一项或多项。在一个实施方式中,例如,通过本文所述的方法确定,相对于参考抗cd138抗体(例如,抗体bb4),所述抗体分子诱导的adcc活性要大至少10%(例如,至少15%、20%、25%、30%、35%或40%)。
[0540]
在一个实施方式中,抗体分子还包含重链恒定区。在一个实施方式中,重链恒定区是igg1恒定区或其功能部分。在另一个实施方式中,重链恒定区是igg2恒定区或其功能部分。在一个实施方式中,抗体分子还包含轻链恒定区。在一个实施方式中,抗体分子还包含重链恒定区和轻链恒定区。在一个实施方式中,抗体分子包含本文表1或2中所述抗体分子的重链恒定区、轻链恒定区、以及重链和轻链可变区。在某些实施方式中,抗体分子包含重链恒定区,轻链恒定区和可变区,其包含表1或2中所述的抗体分子的一个,两个,三个,四个,五个或六个cdr。
[0541]
示例性的重链恒定区描述如下。
[0542]
igg1 hc恒定区:
[0543]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkrvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:446)
[0544]
igg2 hc恒定区:
[0545]
astkgpsvfplapcsrstsestaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssnfgtqtytcnvdhkpsntkvdktverkccvecppcpappvagpsvflfppkpkdtlmisrtpevtcvvvdvshedpevqfnwyvdgvevhnaktkpreeqfnstfrvvsvltvvhqdwlngkeykckvsnkglpapiektisktkgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppmldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk(seq id no:447)
[0546]
在一个实施方式中,抗体分子包含表6中所列的重链序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。在一个实施方式中,抗体分子包含重链,其包含表b中所列序列中的一个或多个(例如,1、2、3、4或5个),或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的一个或多个氨基酸序列。在一个实施方式中,抗体分子包含表6中所列的轻链序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。在一个实施方式中,抗体分子包含轻链,其包含表8中所列序列中的一个或多个
(例如,1、2或3个),或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的一个或多个氨基酸序列。
[0547]
在一个实施方式中,抗体分子包含表7中所列的重链恒定区序列(例如,ch1、ch2或ch3)(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)中的一个、两个或全部。在一个实施方式中,抗体分子包含表7中所列的ch1、ch2和ch3序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)的全部。在一个实施方式中,抗体分子还包含表7中所列的重链恒定铰链区序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。
[0548]
在一个实施方式中,抗体分子包含表8中所列的轻链恒定区序列(例如,cl)(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。在一个实施方式中,抗体分子还包含表8中所列的轻链恒定铰链区序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。
[0549]
在一个实施方式中,抗体分子包含表7中所列的重链恒定区序列(例如,ch1、ch2或ch3)(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)中的一个、两个或全部,和表8中所列的轻链恒定区序列(例如,cl)(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。在一个实施方式中,抗体分子包含表7中所列的全部ch1、ch2和ch3序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列),和表8中所列的轻链恒定铰链区序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。在一个实施方式中,抗体分子包含表7中所列的重链恒定铰链区序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列),和表8中所列的轻链恒定铰链区序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。
[0550]
在一个实施方式中,抗体分子包含seq id no:529、531或532的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)中的一个、两个或全部。在一个实施方式中,抗体分子包含seq id no:529、531和532的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)中的全部。在一个实施方式中,抗体分子还包含seq id no:530的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。
[0551]
在一个实施方式中,抗体分子包含seq id no:534的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。在一个实施方式中,抗体分子还包含seq id no:533的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。
[0552]
在一个实施方式中,抗体分子包含seq id no:534的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)和
seq id no:529、531或532的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)中的一个、两个或全部。在一个实施方式中,抗体分子包含seq id no:534的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)和seq id no:529、531和532的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)中的全部。在一个实施方式中,抗体分子还包含seq id no:530的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)和/或seq id no:533的氨基酸序列(或与其具有至少75%、80%、85%、90%、95%、96%、97%、98%、99%或100%序列相同性的氨基酸序列)。
[0553]
在一个实施方式中,抗体分子包含seq id no:529-534的氨基酸序列中的一个、两个、三个、四个、五个或全部。在一个实施方式中,抗体分子包含seq id no:529-534的氨基酸序列。
[0554]
表6.mab 4320重链和轻链序列
[0555][0556][0557]
表7.mab 4320重链序列的注释
[0558][0559]
通过chothia定义的可变区(vh)中的cdr带下划线。重链恒定区是智人免疫球蛋白重链恒定γ1(m3同种异型)。本文所述的任何人源化抗cd138抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422)可包含恒定ch1、铰链、ch2和/或ch3序列,如表7所述。
[0560]
表8.mab 4320轻链序列的注释
[0561][0562]
通过chothia定义的可变区(vl)中的cdr带下划线。轻链是智人κ恒定*01。本文所述的任何人源化抗cd138抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422)可包含恒定cl和/或铰链序列,如表8所述。
[0563]
在一个实施方式中,抗体分子是多价(例如,二价,三价或四价)抗体分子。在一个实施方式中,抗体分子结合至cd138中的两个或更多个(例如三个或四个)不同区域。例如,抗体分子可包含两组或更多组相同或基本相同的vh-vl对,其中每个vh-vl对结合至cd138中的两个或更多个不同区域。作为另一实例,抗体分子可包含两组或更多组不同的vh-vl对,其中每个vh-vl对结合至cd138中的不同区域。
[0564]
在一个实施方式中,抗体分子是多特异性(例如,双特异性,三特异性或四特异性)抗体分子。在一个实施方式中,抗体分子具有对cd138的第一结合特异性和不同于cd138的第二结合特异性。例如,抗体分子可包含两组或更多组相同或基本相同的vh-vl对,其中每个vh-vl对具有第一结合特异性和第二结合特异性。作为另一个实例,抗体分子可包含两组或更多组不同的vh-vl对,其中每个vh-vl对具有不同的结合特异性。
[0565]
在一个实施方式中,如通过本文所述的方法确定,与参考抗体分子,例如,相关的非人源化抗体分子相比,人源化抗体分子在体外要更稳定至少10%、20%、30%、40%、50%、60%、70%、80%或90%,或至少1、2、3、4、5、6、7、8、9或10倍。在一个实施方式中,人源化抗体分子具有至少约62℃,例如,约65℃至约70℃(例如,约65℃、66℃、67℃、68℃、69℃或70℃)的第一热转变温度,例如,通过差示扫描量热法荧光(dsf)所确定。在一个实施方式中,人源化抗体分子具有至少约70℃,例如,约75℃至约80℃(例如,约75℃、76℃、77℃、78℃、79℃或80℃)的第二热转变温度,例如,通过dsf所确定。
[0566]
在一个实施方式中,如通过本文所述的方法确定,与参考抗体分子,例如,相关的非人源化抗体分子相比,人源化抗体分子在体内更稳定至少10%、20%、30%、40%、50%、60%、70%、80%或90%,或至少1、2、3、4、5、6、7、8、9或10倍。在一个实施方式中,如通过本
文所述的方法确定,与参考抗体分子,例如,相关的非人源化抗体分子相比,抗体分子的血清半衰期(在人或在动物模型中)要长至少10%、20%、30%、40%、50%、60%、70%、80%或90%,或至少1、2、3、4、5、6、7、8、9或10倍。
[0567]
抗体分子-药物偶联物
[0568]
如本文所用,术语“抗体分子-药物偶联物”或adc是指与非抗体部分,例如治疗剂或标记物(例如细胞毒性剂)偶联的抗体分子。抗体分子可以直接或间接地,例如通过接头与非抗体部分偶联。
[0569]
在一个实施方式中,抗体分子通过共价键与非抗体部分偶联。在一个实施方式中,抗体分子通过肽键与非抗体部分偶联。在一个实施方式中,抗体分子通过非肽键与非抗体部分偶联。在一个实施方式中,抗体分子不通过非肽键与非抗体部分偶联。在一个实施方式中,非抗体部分也称为“荷载物”。
[0570]
在一个实施方式中,非抗体部分与抗体分子的主链偶联。在另一个实施方式中,非抗体部分与抗体分子的侧链偶联。在一个实施方式中,两个或更多个(例如,三个,四个,五个,六个,七个,八个或更多个)非抗体部分与抗体分子偶联。
[0571]
在一个实施方式中,adc包含与cd138结合的抗体分子,例如本文所述的人源化抗cd138抗体分子。
[0572]
在一个实施方式中,adc包含表1中所述的抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中的任一个)的vh区的一个,两个或三个cdr,使用kabat或chothia的cdr定义。在一个实施方式中,adc包含表1中所述的抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中的任一个)的vl区的一个,两个或三个cdr,使用kabat或chothia的cdr定义。在一个实施方式中,adc包含表1或2中所述的抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中的任一个)的vh区的一个或多个(例如,两个或三个)cdr和/或vl区的一个或多个(例如,两个或三个)cdr,使用kabat或chothia的cdr定义。
[0573]
在一个实施方式中,adc包含表1或2中所述的一个,两个或三个vh cdr。在一个实施方式中,adc包含表1或2中所述的一个,两个或三个vl cdr。在一个实施方式中,adc包含表1或2中所述的一个或多个(例如,两个或三个)vh cdr和/或一个或多个(例如,两个或三个)vl cdr。
[0574]
在一个实施方式中,adc包含表1或2中所述的抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中的任一个)的vh区的一个,两个、三个或四个框架区。在一个实施方式中,adc包含表1或2中所述的抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中的任一个)的vl区的一个,两个、三个或四个框架区。在一个实施方式中,adc包含(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422)的vh区的一个或多个(例如,两个、三个或四个)框架区和/或vl区的一个或多个(例如,两个、三个或四个)框架区。
[0575]
在一个实施方式中,adc包含表1或2中所述的抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中任一个)的重链可变区。在一个实施方式中,adc包含表1或2中所述的抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中任一个)的轻链可变区。在一个实施方式中,adc包含表1或2中所述的抗体分子(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中任一个)的重链可变区和轻链可变区。
[0576]
在一个实施方式中,adc包含具有表1或2中所述氨基酸序列的重链可变区。在一个实施方式中,adc包含具有表1或2中所述氨基酸序列的轻链可变区。在一个实施方式中,adc包含具有表1或2中所述氨基酸序列的重链可变区和具有表1或2中所述氨基酸序列的轻链可变区。
[0577]
在一个实施方式中,抗体分子包含由表2中所述的核苷酸序列编码的重链可变区。在一个实施方式中,抗体分子包含由表2中所述的核苷酸序列编码的轻链可变区。在一个实施方式中,抗体分子包含由表2中所述的核苷酸序列编码的重链可变区和由表2中所述的核苷酸序列编码的轻链可变区。
[0578]
在一个实施方式中,adc包含重链恒定区。在一个实施方式中,adc包含轻链恒定区。在一个实施方式中,adc包含重链恒定区和轻链恒定区。在一个实施方式中,adc包含本文表1或2中所述抗体分子的重链恒定区、轻链恒定区、以及重链和轻链可变区。在某些实施方式中,adc包含重链恒定区,轻链恒定区和可变区,其包含表1或2中所述的抗体分子的一个,两个,三个,四个,五个或六个cdr。
[0579]
在一个实施方式中,adc包含表7中所列的重链恒定区序列(例如,ch1、ch2或ch3)中的一个、两个或全部。在一个实施方式中,adc包含表7中所列的ch1、ch2和ch3中的全部。在一个实施方式中,adc还包含表7中所列的重链恒定铰链区序列。在一个实施方式中,adc包含表8中所列的轻链恒定区序列(例如,cl)。在一个实施方式中,adc还包含表8中所列的轻链恒定铰链区序列。
[0580]
在一个实施方式中,adc包含表8中所列的轻链恒定区序列(例如,cl)和表7中所列的重链恒定区序列(例如,ch1、ch2或ch3)中的一个、两个或全部。在一个实施方式中,adc包含表8中所列的轻链恒定铰链区序列和表7中所列的ch1、ch2和ch3中的全部。在一个实施方式中,adc还包含表7中所列的重链恒定铰链区序列和/或表8中所列的轻链恒定铰链区序列。
[0581]
在一个实施方式中,adc包含包含表6或8中所述氨基酸序列的重链。在一个实施方式中,adc包含包含表6或7中所述氨基酸序列的轻链。在一个实施方式中,adc包含包含表6或8中所述氨基酸序列的重链和包含表6或7中所述氨基酸序列的轻链。
[0582]
在一个实施方式中,非抗体分子包含细胞毒性剂(例如,对癌症有活性的任何细胞毒性剂)。在一个实施方式中,细胞毒性剂选自微管蛋白聚合酶抑制剂(例如,瑞奥西汀),与微管蛋白解聚相关的试剂(例如,美登素),与dna裂解相关的试剂(例如,加利车霉素),dna小沟烷基化剂(例如杜卡霉素),dna小沟交联剂(例如pbd二聚体)或rna聚合酶ii抑制剂(例如α-鹅膏蕈碱)。
[0583]
在一个实施方式中,细胞毒性剂是α-鹅膏蕈碱。α-鹅膏蕈碱是一种双环八肽,属于
一大类原生质蘑菇毒素,称为鹅膏毒素。α-鹅膏蕈碱与rna聚合酶ii的桥联螺旋结合,抑制清空该位点进行下一轮合成所需的rna和dna的易位,从而降低转录速率。α-鹅膏蕈碱及其在adc中的用途描述于,例如,moldenhauer等.j natl cancer inst.2012;104(8):622-634。α-鹅膏蕈碱的结构如下:
[0584][0585]
在一个实施方式中,细胞毒性剂是念珠藻素类似物。念珠藻素是一组蓝藻缩肽,其对多重耐药性(mdr)癌细胞具有显著的生物学活性。念珠藻素通过与微管蛋白相互作用来消耗微管,由此防止细胞分裂。它们能够诱导凋亡,除了通过微管抑制介导的凋亡外,还可能通过其它机制。念珠藻素、类似物及其在adc中的用途描述于例如shih和teicher.curr pharm des.2001;7(13):1259-1276;eggen和georg.med res rev.2002;22(2):85-101。念珠藻素类似物的结构如下:
[0586][0587]
在一个实施方式中,细胞毒性剂是加利车霉素(也称为ll-e33288)。加利车霉素接触dna并引起bergman环化,从而导致dna裂解,从而破坏细胞。加利车霉素及其在adc中的用途描述于例如maiese等.j antibiot(东京).1989;42(4):558-563;watanabe等.chem biol.2002;9(2):245-251;ricart和tolcher.nat clin pract oncol.2007;4:245-255。加利车霉素的结构如下。
[0588][0589]
在一个实施方式中,细胞毒性剂是森坦霉素(centanamycin)。森坦霉素也被称为ml-970,as-1-145,nsc 716970或n-[4-氨基-1-(2-氯乙基)-2-萘基]-5,6,7-三甲氧基-1h-吲哚-2-羧酰胺)。森坦霉素结合富含a-t的dna小沟并使dna烷基化。森坦霉素及其在adc中的用途描述于,例如,rayburn等.cancer chemother pharmacol.2012;69(6):1423-31。
[0590]
在一个实施方式中,细胞毒性剂是尾海兔素(dolastatin)。在一个实施方式中,所
述尾海兔素是尾海兔素10或尾海兔素15。尾海兔素类非竞争性地抑制长春新碱与长春花/肽区域的微管蛋白结合。尾海兔素的类似物包括例如新罗他汀(symplostatin)1,新罗他汀3和瑞奥西汀。尾海兔素、类似物及其用途描述于,例如,amador等.annals of oncology.2003;14:1607-1615;kijjoa和sawangwong.mar drugs.2004;2(2):73-82;luesch等.j nat prod.2001;64(7):907-910;luesch等.j nat prod.2002;65(1):16-20。尾海兔素10的结构如下:
[0591][0592]
尾海兔素15的结构如下:
[0593][0594]
在一个实施方式中,细胞毒性剂是杜卡霉素(duocarmycin)类似物。杜卡霉素类似物是dna小沟,at序列选择性和腺嘌呤n3烷基化剂。杜卡霉素,类似物及其在adc中的用途描述于,例如,tietze和krewer.chem biol drug des.2009;74(3):205-211;cacciari等.expert opinion on therapeutic patents.2000;10(12):1853-1871;tercel等.angew chem int ed engl.2013;52(21):5442-5446。示例性的杜卡霉素和类似物包括,例如,杜卡霉素a,杜卡霉素b1,杜卡霉素b2,杜卡霉素c1,杜卡霉素c2,杜卡霉素d,杜卡霉素sa和cc-1065。杜卡霉素a的结构如下:
[0595][0596]
在一个实施方式中,细胞毒性剂是美登素。美登素(一种苯并金刚烷内酯)是一种高效的靶向微管的化合物,可诱导有丝分裂阻滞并杀伤亚纳摩尔浓度的肿瘤细胞。美登素及其类似物(美登素类化合物dm1和dm4)是有效的靶向微管的化合物,可抑制有丝分裂时细胞的增殖。美登素描述于,例如,lopus等.mol cancer ther.2010;9(10):2689-2699;widdison等.j med chem.2006;49(14):4392-4408;liu等.j mass spectrom.2005;40(3):389-399;tassone等.cancer res.2004;64(13):4629-4636;sawada等.bioconjug chem.1993;4(4):284-289。美登素的结构如下:
[0597][0598]
在一个实施方式中,细胞毒性剂是单甲基瑞奥西汀e(mmae,维多汀)。mmae是一种高效的抗有丝分裂剂,可通过阻止微管蛋白的聚合来抑制细胞分裂。mmae及其在adc中的用途描述于,例如,francisco等.blood.2003;102(4):1458-1465;junutula等.nat biotechnol.2008;26(8):925-932;asundi等.clin cancer res.2011;17(5):965-975;younes等.j clin oncol.2012;30(18):2183-2189;pettit等.anticancer drug des.1995;10(7):529-544;doronina等.nat biotechnol.2003;21(7):778-784。mmae的结构如下:
[0599][0600]
在一个实施方式中,细胞毒性剂是单甲基瑞奥西汀f(mmaf)。mmaf是一种抗微管蛋白剂,可通过阻止微管蛋白的聚合来抑制细胞分裂。它是一种带电荷的c末端苯丙氨酸的瑞奥西汀衍生物,与其不带电荷的对应物,单甲基瑞奥西汀e(mmae)相比,其细胞毒性活性减弱。当通过蛋白酶裂解型接头与靶向内化的、肿瘤特异性细胞表面抗原的单克隆抗体偶联时,mmaf可诱导有效的抗肿瘤作用。例如,连接至单克隆抗体的接头在胞外液中是稳定的,但是一旦偶联物进入肿瘤细胞,组织蛋白酶就可将其裂解,从而活化抗有丝分裂机制。mmaf及其在adc中的用途描述于,例如,smith等.mol cancer ther.2006 5;1474-1482;doronina等.,bioconjug chem.2006;17(1):114-24;oflazoglu等.clin cancer res.2008;14(19):6171-6180;nilsson等.cancer.2010;116(4增刊):1033-1042。mmaf的结构如下:
[0601][0602]
在一个实施方式中,细胞毒性剂是吡咯并苯并二氮杂(pbd)。pbd是一类序列选择性dna小沟结合交联剂。pbd的作用机制与其在小沟中形成加合物的能力有关,从而干扰了dna加工。属于吡咯并苯并二氮杂卓类抗生素的示例性试剂包括但不限于蒽霉素、赤霉素、芝加霉素、dc-81、甲基氨茴霉素、新茴霉素a、新茴霉素b、罗红霉素、普拉卡素
usa.2002;99:1509-1514;adams等.nature.1985;318:533-538;chesi等.blood.2012;120:376-385);eμ-xbp-1s模型(carrasco等.cancer cell.2007;11(4):349-360);l-gp130模型(dechow等.j clin invest.2014;124(12):5263-5274)。
[0611]
各种鼠和人骨髓瘤细胞系以及原代人骨髓瘤细胞可用于临床前体内模型。可用于移植的示例性鼠和人骨髓瘤细胞系包括但不限于5t骨髓瘤细胞(radl等.am j pathol.1988;132:593-597),人淋巴母细胞arh-77细胞(huang等.cancer res.1993;53(6):1392-1396),人jjn3骨髓瘤细胞系(hjorth-hansen等.j bone miner res.1999;14(2):256-263),和il-6依赖性骨髓瘤细胞系(tsunenari等.blood.1997;90(6):2437-2444)。可基于例如肿瘤植入的速度、特定肿瘤类型的特征(例如发生溶解性骨损伤的倾向)或所产生的单克隆蛋白的类型来选择所需的细胞系。
[0612]
骨髓瘤(例如多发性骨髓瘤)的其它动物模型描述于,例如,lwin等.bonekey rep.2016;5:772;libouban等.morphologie.2015;99(325):63-72;campbell等.curr protoc pharmacol.2008;第14章单元14.9。
[0613]
药物组合物和试剂盒/药盒
[0614]
在一个方面,本公开内容提供组合物,例如药学上可接受的组合物,其包括本文所述的人源化抗cd138抗体分子或包含本文所述的人源化抗cd138抗体分子的adc,其与药学上可接受的运载体一起配制。
[0615]
如本文所用,“药学上可接受的运载体”包括生理上相容的任何和所有溶剂、分散介质、等渗剂和吸收延迟剂等等。运载体可适于静脉内、肌肉内、皮下、肠胃外、直肠、脊柱或表皮给予(例如,通过注射或输注)。在某些实施方式中,药物组合物中少于约5%(例如少于约4%、3%、2%或1%)的抗体分子以聚集物形式存在。在另一些实施方式中,药物组合物中至少约95%(例如至少约96%、97%、98%、98.5%、99%、99.5%、99.8%或更多)的抗体分子以单体形式存在。在一些实施方式中,聚集物或单体水平通过色谱法(例如高效尺寸排阻色谱(hp-sec))测定。
[0616]
本文所述组合物可为各种形式。这些包括例如,液体、半固体和固体剂型,如液体溶液(例如可注射和可输注溶液)、分散体或悬浮体、脂质体以及栓剂。合适的形式取决于目标给药模式以及治疗应用。通常合适的组合物为可注射或可输注溶液形式。合适的给药模式之一是胃肠道外(例如静脉内、皮下、腹膜内、肌肉内)。在一些实施方式中,抗体分子通过静脉内输注或注射来给予。在某些实施方式中,抗体通过肌内或皮下注射给予。
[0617]
本文所用术语“胃肠道外给药”和“经胃肠道外给予”表示除肠道和局部给药外的给药形式,通常通过注射,包括但不限于静脉内、肌肉内、动脉内、鞘内、囊内、眼内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下(subcapsular)、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注给药。
[0618]
在制备和储存条件下,治疗性组合物通常应无菌和稳定。可将组合物配制成溶液、微乳剂、分散体、脂质体或适合高抗体浓度的其他有序结构。可根据需要将在合适溶剂中的所需量活性化合物(即抗体或抗体部分)与上述组分中的一种或组合掺混,然后进行过滤灭菌,从而制备无菌注射液。通常,分散系可通过将活性活化物加入含有碱性分散介质和上述其它所需成分的无菌载剂中来制备。在制备无菌注射液的无菌粉剂时,优选的制备方法是真空干燥和冷冻干燥,由之前无菌过滤的溶液得到活性组分和任何其它所需组分的粉末。
可维持溶液的合适流动性,例如通过使用诸如卵磷脂的涂层、在分散剂情况下通过保持所需粒度以及通过使用表面活性剂。通过在组合物中包含延迟吸收的物质,例如单硬脂酸盐和明胶,可以实现可注射组合物的延长吸收。
[0619]
本文描述的抗体分子可通过多种方法给予。本领域中已知数种,并且对于许多治疗性、预防性或诊断性应用,适当的给药途径/模式是静脉内注射或输注。例如,抗体分子通过静脉内输注给药的速度可小于10毫克/分钟;优选小于或等于5毫克/分钟来达到约1~100毫克/平方米的剂量,优选约5~50毫克/平方米,约7~25毫克/平方米,更优选约10毫克/平方米。本领域技术人员会明白,给药途径和/或方式根据所需结果而有所不同。在某些实施方式中,活性化合物可与运载体一起制备,该运载体将保护该化合物不被迅速释放,如控释制剂,包括植入体、透皮贴片和微包封递送系统。可利用生物可降解的、生物相容的聚合物,例如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。制备此类制剂的许多方法已获得专利或为本领域技术人员熟知。参见例如,sustained and controlled release drug delivery systems (《缓控释药物递送系统》),j.r.robinson编,marcel dekker公司,纽约,1978。
[0620]
在某些实施方式中,可口服给予(例如与惰性稀释剂或可吸收食用运载体一起)抗体分子。抗体分子(以及按需的其他组分)也可容纳在硬或软壳明胶胶囊里、压缩成片剂、或直接掺混入对象的膳食中。对于口服治疗性给药,可将抗体分子与赋形剂混合,并以可摄取的片剂、口颊含片、锭剂、胶囊、酏剂、悬浮剂、糖浆、薄片等形式使用。为了通过非胃肠道外给药途径的其他形式来给予抗体分子,可能需要用材料包覆化合物或将某种材料与该化合物共同给药,以防止该化合物失活。还可采用医疗装置来给予治疗性、预防性或诊断性组合物,本领域中已知数种此类装置。
[0621]
给药方案经调整能提供所需反应(例如治疗、预防或诊断反应)。例如,可以是一次推注,按时间分次给药或根据治疗情况的紧急性成比例地降低或增加剂量。尤其有利的是配制成单位剂型的胃肠道外组合物以便于给药和剂量均一性。本文中单位剂型指作为单个剂量用于待治疗对象的物理上离散的单位,每个单位包含预定量的活性化合物与所需药物运载体,该预定量经测算能够产生所需治疗效果。本发明中剂量单位形式的规格取决于或直接依赖于(a)抗体的独特特性和待实现的具体治疗、预防或诊断效果,以及(b)此抗体分子配制相关领域关于应对个体敏感性的固有限制。
[0622]
抗体分子的治疗、预防或诊断有效量的示例性非限制性范围为约0.1~50mg/kg对象体重,例如,约0.1~30mg/kg,例如,约1~30、1~15、1~10、1~5、5~10或1~3mg/kg,例如约1、2、3、4、5、6、7、8、9、10、15、20、30、40或50mg/kg。例如,抗体分子通过静脉内输注给药,速度可小于10毫克/分钟,例如小于或等于5毫克/分钟来达到约1~100毫克/平方米的剂量,例如约5~50毫克/平方米,约7~25毫克/平方米,约10毫克/平方米。需要注意的是,剂量值可能会根据待缓解病症的种类和严重程度而不同。需要理解,对于每个具体对象,应当随着时间根据个体需求以及给予组合物或监管组合物给予的人的专业判断来调节具体剂量方案,本文所列的剂量范围仅仅是示例性的,并不意在对所要求权利的组合物的范围或实施方式构成限制。
[0623]
本文的药物组合物可包含“治疗有效量”、“预防有效量”或“诊断有效量”的本文所述的抗体分子。
[0624]“治疗有效量”指的是以必要的剂量和持续时间段实现所需治疗结果的有效的量。抗体分子的治疗有效量可根据诸如个体的疾病状态、年龄、性别和体重等因素以及抗体或抗体部分在个体中引起所需反应的能力而不同。治疗有效量,抗体分子的治疗有益效果胜过任何毒性或有害效果。相对于未治疗对象,“治疗有效剂量”通常使可测参数被抑制至少约20%,例如至少约40%,至少约60%或至少约80%。可测参数可以是例如血尿,有色尿,泡沫尿,疼痛,手脚肿胀(浮肿)或高血压。可以在用于预测治疗或预防骨髓瘤疗效的动物模型系统中评价抗体分子抑制可测参数的能力。或者,可以(例如通过体外测定)来检查抗体分子抑制cd138的能力来评价组合物的这种性质。
[0625]“预防有效量”指的是以必要的剂量和持续时间段实现所需预防结果的有效的量。通常,由于在疾病的早期阶段或之前在对象中使用预防剂量,预防有效量会比治疗有效量低。
[0626]“诊断有效量”指按照一定剂量和必要时程能够实现所需诊断效果的量。通常,诊断有效量是其中可以体外、离体或体内诊断出病症,例如本文所述的病症(例如骨髓瘤)的量。
[0627]
本公开内容还包括包含本文所述抗体分子的试剂盒/药盒。试剂盒/药盒可包括一种或多种其他要件,包括:使用说明;其他试剂,例如标记物、治疗剂、可用于将抗体分子螯合或偶联于标记物或治疗剂的试剂、辐射防护组合物/组分;用于制备用于给药的抗体分子的装置或其他材料;药学上可接受的运载体;以及用于向对象给药的装置或其他材料。
[0628]
核酸
[0629]
如本文所述,本发明的特征还在于包含编码人源化抗cd138抗体分子(例如,抗体分子的重链和轻链可变区和cdr)的核苷酸序列的核酸。
[0630]
例如,本公开内容的特征在于分别编码选自本文公开的一种或多种抗体分子的抗体分子(例如表1、2或6的抗体分子)或抗体分子的部分(例如表1或2的可变区)的重链和轻链可变区的第一和第二核酸。核酸可包含编码本文表中任何一个氨基酸序列的核苷酸序列,或与其基本相同的序列(例如,序列与本文表中所示序列至少约85%,90%,95%,99%或更多相同,或与其相差不超过3,6,15,30或45个核苷酸)。
[0631]
在某些实施方式中,核酸可包含编码来自重链可变区的至少一个,两个或三个cdr的核苷酸序列,所述重链可变区具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或具有一个或多个取代,例如保守取代)。在一些实施方式中,核酸可包含编码来自轻链可变区的至少一个,两个或三个cdr的核苷酸序列,所述重链可变区具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或具有一个或多个取代,例如保守取代)。在一些实施方式中,核酸可包含编码来自重链和轻链可变区的至少一个,两个,三个,四个,五个或六个cdr的核苷酸序列,所述重链可变区具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或具有一个或多个取代,例如保守取代)。
[0632]
在某些实施方式中,核酸可包含编码重链可变区的核苷酸序列,所述重链可变区具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或具有一个或多个取代,例如保守取代)。在一些实施方式中,核酸可包含编码轻链可变区的核苷酸序列,所述重链可变区具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的
序列,和/或具有一个或多个取代,例如保守取代)。在一些实施方式中,核酸可包含编码重链可变区和轻链可变区的核苷酸序列,所述重链可变区和轻链可变区具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或具有一个或多个取代,例如保守取代)。
[0633]
在某些实施方式中,核酸可包含编码重链的核苷酸序列,所述重链具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或具有一个或多个取代,例如保守取代)。在一些实施方式中,核酸可包含编码轻链的核苷酸序列,所述轻链具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或具有一个或多个取代,例如保守取代)。在一些实施方式中,核酸可包含编码重链和轻链的核苷酸序列,所述轻链具有本文表中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或具有一个或多个取代,例如保守取代)。
[0634]
在某些实施方式中,核酸可包含编码来自重链可变区的至少一个,两个或三个cdr的核苷酸序列,所述核酸具有表2中所示的核苷酸序列,与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或能够在本文所述的严格条件下杂交)。在一些实施方式中,核酸可包含编码来自轻链可变区的至少一个,两个或三个cdr的核苷酸序列,所述核酸具有表2中所示的核苷酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或能够在本文所述的严格条件下杂交)。在某些实施方式中,核酸可包含编码来自重链和轻链可变区的至少一个,两个,三个,四个,五个或六个cdr的核苷酸序列,所述核酸具有表2中所示的核苷酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或能够在本文所述的严格条件下杂交)。
[0635]
在某些实施方式中,核酸包含表2中所示的核苷酸序列或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或能够在本文所述的严格条件下杂交)。在一些实施方式中,核酸包含表2中所示的核苷酸序列的一部分或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同的序列,和/或能够在本文所述的严格条件下杂交)。该部分可编码例如可变区(例如vh或vl);一个、两个或三个或更多个cdr;或一个、两个、三个、四个或更多个框架区。
[0636]
本文所述的核酸包括脱氧核糖核苷酸或核糖核苷酸或其类似物。多核苷酸可以是单链或双链,并且如果是单链,可以是编码链或非编码(反义)链。多核苷酸可包括修饰的核苷酸,如甲基化的核苷酸和核苷酸类似物。核苷酸序列可间插有非核苷酸组分。多核苷酸聚合后可被进一步修饰,如通过与标记性组分偶联。核酸可为重组多核苷酸、或基因组、cdna、半合成或合成来源的多核苷酸,即非天然存在或以非天然排列方式与另一多核苷酸相联。
[0637]
在一方面中,本技术的特征包括包含本文所述核酸的宿主细胞和载体。核酸可存在于同一宿主细胞或非同一宿主细胞中的单个载体中或独立的多个载体中,详见下文。
[0638]
载体
[0639]
本文进一步提供了包含编码本文描述的抗cd138抗体分子的核苷酸序列的载体。
[0640]
在一个实施方式中,载体包含编码本文所述(例如,如表1、2或6中所述)的抗体分子的核苷酸序列。在另一个实施方式中,载体包含本文(例如,表2中)所述的核苷酸序列。载
体包括但不限于病毒、质粒、粘粒、λ噬菌体或酵母人工染色体(yac)。
[0641]
可采用许多种载体系统。例如,一类载体利用dna元件,这些元件衍生自动物病毒例如牛乳头瘤病毒、多瘤病毒、腺病毒、痘苗病毒、杆状病毒、逆转录病毒(劳斯氏肉瘤病毒、mmtv或momlv)或sv40病毒。另一类载体利用衍生自rna病毒的rna元件,所述rna病毒为例如塞姆利基森林病毒、东部马脑炎病毒和黄病毒。
[0642]
此外,通过引入能够选择已转染宿主细胞的一种或多种标志物,可选择已将dna稳定整合入其染色体中的细胞。该标志物可向营养缺陷型宿主提供例如营养缺陷型、杀生物剂(如抗生素)抗性或对重金属如铜等的抗性。选择性标志物基因可直接连接于待表达的dna序列,或者通过共同转化引入同一细胞内。mrna的优化合成也可能需要其它元件。这些元件可以包括剪接信号,以及转录启动子、增强子和终止信号。
[0643]
一旦制得用于表达的含构建体的表达载体或dna序列,可将表达载体转染或导入合适的宿主细胞。可用各种技术实现之,例如原生质体融合、磷酸钙沉淀、电穿孔、逆转录病毒转导、病毒转染、基因枪、基于脂质的转染或其他常规技术。在原生质体融合的情形下,可在培养基中使细胞生长,并筛选适当的活性。
[0644]
培养所得转染细胞以及回收所产生的抗体分子的方法和条件是本领域技术人员已知的,且可基于本文的描述,根据所用的特定表达载体和哺乳动物宿主细胞进行改变或优化。
[0645]
细胞
[0646]
本公开内容还提供了包含编码如本文所述的抗cd138抗体分子的核酸的细胞(例如宿主细胞)。例如,宿主细胞可包含具有表2中所述的核苷酸序列,与之基本同源的序列(例如,与其具有至少约85%,90%,95%,99%或更高同一性的序列,和/或能够在本文所述的严格条件下杂交的序列)或所述核酸之一的部分的核酸分子。另外,宿主细胞可包含编码表2中的氨基酸序列的核酸分子,与其基本上同源的序列(例如,与其至少约80%,85%,90%,95%,99%或更多相同的序列),或所述序列之一的一部分。
[0647]
在一些实施方式中,宿主细胞经遗传工程改造以包含编码本文所述的抗体分子的核酸。
[0648]
在某些实施方式中,采用表达盒对宿主细胞进行遗传工程化改造。术语“表达盒”是指能够影响与此类序列相容的宿主中基因表达的核苷酸序列。此类表达盒可包括启动子、含或不含内含子的开放阅读框、以及终止信号。还可以采用实现表达所必需或有帮助的其他因子,例如诱导型启动子。
[0649]
本公开还提供了包含本文所述载体的宿主细胞。
[0650]
细胞可为但不限于:真核细胞、细菌细胞、昆虫细胞或人细胞。合适的真核细胞包括但不限于:vero细胞、hela细胞、cos细胞、cho细胞、hek293细胞、bhk细胞和mdckii细胞。合适的昆虫细胞包括但不限于:sf9细胞。在一个实施方式中,细胞(例如宿主细胞)是分离的细胞。
[0651]
在一个实施方式中,人源化抗体分子在细胞中的表达水平至少比相关非人源化抗体分子高1、2、3、4、5、6、7、8、9或10倍。在一个实施方式中,细胞是cho细胞。在一个实施方式中,人源化抗体分子以约35mg/l或更高,例如,约40mg/l、50mg/l、60mg/l、70mg/l、80mg/l、90mg/l、100mg/l、110mg/l、120mg/l、130mg/l、140mg/l、150mg/l、160mg/l、170mg/l、180mg/
l、190mg/l、200mg/l或更高的水平表达。
[0652]
抗体分子的用途
[0653]
本文所述的人源化抗体分子以及本文所述的药物组合物具有体外、离体和体内治疗、预防和/或诊断用途。
[0654]
在一个实施方式中,抗体分子在表达cd138的细胞上引起(例如,诱导或增加)效应物功能。例如,可以将抗体分子给予对象(例如人对象)以对与其结合的患病细胞(例如癌细胞或癌前细胞)产生抗体依赖性细胞毒性作用。在一个实施方式中,抗体分子在表达cd138的细胞上引起补体依赖性细胞毒性活性。在一个实施方式中,抗体分子减少(例如,抑制,阻断或中和)表达cd138的细胞的一种或多种生物活性。在一个实施方式中,抗体分子抑制蛋白酶对膜结合的cd138的作用,例如,以减少cd138的脱落。例如,可将这些抗体分子体外或离体给予培养中的细胞,或例如体内给予对象例如人类对象,以减少(例如抑制,阻断或中和)细胞的一种或多种生物活性。
[0655]
因此,一方面,本公开内容提供了在对象中治疗、预防或诊断病症,例如本文所述病症(例如,多发性骨髓瘤)的方法,所述方法包括向所述对象给予所述的人源化抗cd138抗体分子,从而可以治疗、预防或诊断该疾病。例如,本公开内容提供了一种方法,该方法包括使本文所述的人源化抗体分子与培养物中的细胞例如体外或离体接触,或例如向对象体内给予本文所述的抗体分子,以治疗、预防或诊断疾病,例如与cd138相关的疾病(例如,多发性骨髓瘤)。
[0656]
本文所用术语“对象”旨在包括人和非人动物。在一些实施方式中,对象是人类对象,例如患有本文所述病症(例如,多发性骨髓瘤)或处于患有本文所述病症(例如,多发性骨髓瘤)的风险的人类患者。术语“非人动物”包括哺乳动物和非哺乳动物,例如非人灵长类动物。在一些实施方式中,对象是人。本文所述的方法和组合物适合于治疗人类患者本文所述的病症(例如,多发性骨髓瘤)。具有本文所述病症的患者包括,例如,患有本文所述病症但(至少暂时)无症状的那些患者,已经表现出本文所述病症的症状的患者,以及患有与本文所述的病症相关或相关联的病症的患者。
[0657]
治疗或预防疾病的方法
[0658]
本文所述的人源化抗体分子可用于治疗或预防与cd138或其症状相关联的疾病。
[0659]
可与cd138相关联的示例性疾病或病症包括但不限于癌症(例如血液癌(例如,骨髓瘤,例如多发性骨髓瘤)或实体瘤,和癌前病症(例如,冒烟型骨髓瘤或意义未明的单克隆丙种球蛋白血症(mgus))。在一个实施方式中,所述疾病与cd138的异常表达相关联。在一个实施方式中,所述抗体分子用于治疗患有本文所述疾病或有发展成本文所述疾病的风险的对象。在一个实施方式中,抗体分子用于减少疾病的进展,例如,减少癌前病症向癌症的进展。
[0660]
在一个实施方式中,例如,通过本文所述方法所确定,与参考抗体分子(例如,相关非人源化抗体分子)相比,人源化抗体分子在治疗本文所述疾病方面具有更高的疗效。在一个实施方式中,例如在预定时间段内,人源化抗体分子导致肿瘤负荷降低至少10%、20%、30%、40%、50%、60%、70%、80%或90%。在一个实施方式中,人源化抗体分子导致至少大10%、20%、30%、40%、50%、60%、70%、80%或90%或至少1、2、3、4或5倍的总存活,例如,从诊断日期或治疗开始的时间长度。在一个实施方式中,疾病是癌症,例如,多发性骨髓瘤。
在一个实施方式中,通过成像确定肿瘤负荷。在一个实施方式中,在组织,例如骨骼组织中确定肿瘤负荷。
[0661]
本文所述抗体分子的给药频率通常应保持患者系统中抗体分子的治疗有效水平,直到患者康复为止。例如,可以以达到足以使至少约1、2、5、10、20、30或40个抗体分子结合每个cd138分子的血清浓度的频率给予抗体分子。在一个实施方式中,每1、2、3、4、5、6或7天,每1、2、3、4、5或6周,或者每1、2、3、4、5或6个月给予抗体分子。
[0662]
给予各种抗体分子的方法是本领域已知的,并描述于下文。所使用的抗体分子的合适剂量将取决于对象的年龄和体重以及所使用的特定药物。
[0663]
在一个实施方式中,将抗体分子静脉内给予对象(例如人对象)。在一个实施方式中,抗体分子以以下剂量给予对象:0.1mg/kg-50mg/kg,例如,0.2mg/kg-25mg/kg、0.5mg/kg-10mg/kg、0.5mg/kg-5mg/kg、0.5mg/kg-3mg/kg、0.5mg/kg-2.5mg/kg、0.5mg/kg-2mg/kg、0.5mg/kg-1.5mg/kg、0.5mg/kg-1mg/kg、1mg/kg-1.5mg/kg、1mg/kg-2mg/kg、1mg/kg-2.5mg/kg、1mg/kg-3mg/kg、1mg/kg-2.5mg/kg,或1mg/kg-5mg/kg。在一个实施方式中,抗体分子以以下固定剂量给予对象:10mg-1000mg,例如,10mg-500mg、10mg-250mg、10mg-150mg、10mg-100mg、10mg-50mg、250mg-500mg、150mg-500mg、100mg-500mg、50mg-500mg、25mg-250mg、50mg-150mg、50mg-100mg、100mg-150mg、100mg-200mg,或150mg-250mg。在一个实施方式中,抗体分子每周一次,每周两次,每两周一次,每三周一次,每四周一次,每八周一次,每月一次,每两个月一次或每三个月一次给予。在一个实施方式中,每周一次,每周两次,每两周一次或每四周一次以0.5mg/kg-3mg/kg或50mg-150mg给予抗体分子。
[0664]
可单独使用抗体分子或将其与第二药剂偶联,所述第二药剂为例如菌类药剂(bacterial agent)、毒素或蛋白质(例如第二抗cd138抗体分子)。该方法包括:给予需要该治疗的对象单独的抗体分子,或者与第二试剂偶联的抗体分子。可用多种治疗剂(例如毒素或其混合物)递送抗体分子。
[0665]
癌症
[0666]
本文所述的人源化抗cd138抗体分子可用于治疗或预防癌症或癌前病症。
[0667]
cd138表达在许多癌症中失调,例如前列腺癌,乳腺癌,胰腺癌,卵巢癌,结肠癌,肺癌和骨髓瘤(kiviniemi等.apmis.2004;112(2):89-97;lendorf等.j histochem cytochem.2011;59(6):615-629;juuti等.oncology.2005;68(2-3):97-106;kusumoto等.oncol rep.2010;23(4):917-25;hashimoto等.bmc cancer.2008;8:185;joensuu等.cancer res.2002;62(18):5210-5217;seidel等.blood.2000;95(2):388-392)。cd138可调节肿瘤发生的几个关键过程,例如癌细胞增殖,凋亡和血管生成(teng等.matrix biol.2012;31(1):3-16)。实体癌和血液癌中cd138的分子和临床特征描述于例如akl等.oncotarget.2015;6(30):28693-28715。
[0668]
cd138可通过调节肿瘤细胞存活和增殖的介导物(例如癌基因或生长因子)来影响肿瘤发生。例如,sdc1-/-小鼠被保护免于wnt-1诱导的乳腺肿瘤发生(alexander等.nat genet.2000;25(3):329-32)。肝细胞生长因子(hgf)与骨髓瘤细胞上的cd138结合(derksen等.blood.2002;99(4):1405-1410)。hgf与cd138增强的met信号转导的相互作用,涉及许多癌症的生长、存活和扩散(birchmeier等.nat rev mol cell biol.2003;4(12):915-925;derksen等.blood.2002;99(4):1405-1410)。cd138表达在乳腺癌组织的反应性基质中升高
(stanley等.am j clin pathol.1999;112(3):377-383)。表达cd138的mef在共培养中增强了乳腺癌细胞系的生长并促进了体内乳腺癌的发展(maeda等.cancer res.2004;64(2):612-621)。
[0669]
cd138可调节肿瘤细胞凋亡。cd138在骨髓瘤细胞中的敲减诱导生长停滞和凋亡(khotskaya等.j biol chem.2009;284(38):26085-26095)。重组cd138胞外域在mcf-7乳腺癌细胞和培养的人前列腺癌细胞中诱导凋亡(sun等.cancer res.2008;68(8):2912-2919;hu等.neoplasia.2010;12(10):826-836)。
[0670]
cd138可结合促血管生成因子(例如fgf-2和vegf),并将这些因子呈递给内皮细胞上的它们各自的受体以启动内皮侵袭和萌发(teng等.matrix biol.2012;31(1):3-16)。在几种癌中,例如乳腺癌,胃癌和甲状腺癌中,观察到基质成纤维细胞中cd138表达的增加(stanley等.am j clin pathol.1999;112(3):377-383;wiksten等.int j cancer.2001;95(1):1-6;barbareschi等.cancer.2003;98(3):474-483)。在人类乳腺癌细胞和cd138转染的成纤维细胞植入小鼠的异种移植模型中,基质cd138表达与微血管密度显著升高和较大的血管面积相关联(maeda等.oncogene.2006;25(9):1408-1412)。
[0671]
可以通过本文所述的抗体分子治疗或预防的示例性癌症包括但不限于:急性淋巴细胞白血病(all),急性髓细胞性白血病(aml),肾上腺皮质癌,卡波济肉瘤,aids相关淋巴瘤,原发性中枢神经系统(cns)淋巴瘤,肛门癌,阑尾癌,星形细胞瘤,非典型类畸形/类人瘤,基底细胞癌,胆管癌,膀胱癌,骨癌(例如尤因肉瘤或骨肉瘤和恶性纤维组织细胞瘤),脑瘤(例如星形细胞瘤,脑干神经胶质瘤,中枢神经系统非典型类畸形/横纹肌样瘤,中枢神经系统胚胎肿瘤,中枢神经系统生殖细胞肿瘤,颅咽管瘤或室管膜瘤),乳腺癌,支气管肿瘤,伯基特淋巴瘤,类癌(例如,胃肠道类癌),心(心脏)肿瘤,胚胎肿瘤,生殖细胞肿瘤,淋巴瘤,宫颈癌,胆管癌,脊索瘤,慢性淋巴细胞性白血病(cll),慢性粒细胞性白血病(cml),慢性骨髓增生性肿瘤,结肠癌,结肠直肠癌,颅咽管瘤,皮肤t细胞淋巴瘤,原位导管癌(dcis),子宫内膜癌,室管膜瘤,食管癌,鼻腔神经胶质瘤,尤因肉瘤,颅外生殖细胞肿瘤,性腺外生殖细胞肿瘤,眼癌(例如眼内黑素瘤或视网膜母细胞瘤),输卵管癌,骨纤维组织细胞瘤,骨肉瘤,胆囊癌,胃(胃部)癌,胃肠道类癌,胃肠道间质瘤(gist),生殖细胞肿瘤(例如中枢神经系统肿瘤,颅外肿瘤,性腺外肿瘤,卵巢癌或睾丸癌),妊娠滋养细胞疾病,神经胶质瘤,毛细胞白血病,头颈癌,肝细胞(肝)癌,霍奇金淋巴瘤,下咽癌,眼内黑色素瘤,胰岛细胞瘤,胰腺神经内分泌肿瘤,卡波济肉瘤,肾癌(例如肾细胞癌或wilms肿瘤),朗格汉斯细胞组织细胞增生症(lch),喉癌,白血病(例如,急性淋巴细胞白血病(all),急性髓细胞性白血病(aml),慢性淋巴细胞性白血病(cll),慢性骨髓性白血病(cml)或毛细胞白血病),唇和口腔癌,肝癌,肺癌(例如非小细胞肺癌(nsclc)或小细胞肺癌),淋巴瘤(例如与艾滋病有关的伯基特淋巴瘤,皮肤t细胞淋巴瘤,霍奇金淋巴瘤,非霍奇金淋巴瘤或原发中枢神经系统(cns)淋巴瘤),沃尔登斯特龙巨球蛋白血症,男性乳腺癌,骨恶性纤维组织细胞瘤和骨肉瘤,黑色素瘤(例如眼内(眼)黑色素瘤),默克尔细胞癌,间皮瘤,转移性鳞状上皮癌,中线癌,口腔癌,多发性内分泌肿瘤,多发性骨髓瘤/浆细胞瘤,真菌病,蕈样肉芽肿,骨髓增生异常综合征,骨髓增生异常/骨髓增生性肿瘤,慢性髓磷脂增生性肿瘤,鼻腔和鼻旁窦癌,鼻咽癌,神经母细胞瘤,口腔癌,唇和口腔癌,口咽癌,骨肉瘤和骨恶性纤维组织细胞瘤,卵巢癌(例如上皮性卵巢癌或生殖细胞卵巢肿瘤),胰腺癌,胰腺神经内分泌肿瘤(胰岛细胞瘤),乳
头状瘤病,副神经节瘤,鼻旁窦和鼻腔癌,甲状旁腺癌,阴茎癌,咽喉癌,嗜铬细胞瘤,垂体瘤,胸膜肺母细胞瘤,腹膜癌,前列腺癌,直肠癌,视网膜,横纹肌肉瘤,唾液腺癌,肉瘤(例如,尤因肉瘤,卡波西肉瘤,骨肉瘤,横纹肌肉瘤,软组织肉瘤或子宫肉瘤),塞氏(s
é
zary)综合征,皮肤癌(例如黑素瘤,默克尔细胞癌或非黑素瘤皮肤癌),小肠癌,鳞状细胞癌,睾丸癌,喉癌,胸腺瘤和胸腺癌,甲状腺类癌,肾盂和输尿管的移行细胞癌,尿道癌,子宫内膜子宫癌,阴道癌,外阴癌或其转移性病变。
[0672]
在一个实施方式中,癌症是血液学癌症,例如骨髓瘤,淋巴瘤或白血病。在一个实施方式中,癌症是骨髓瘤。在一个实施方式中,癌症是多发性骨髓瘤。
[0673]
在另一个实施方式中,癌症是实体瘤。在一个实施方式中,所述癌症是宫颈癌(例如宫颈鳞状细胞癌或宫颈内腺癌),子宫癌(例如子宫内膜样癌),脑癌(例如胶质母细胞瘤),肺癌(例如,肺鳞状细胞癌)或乳腺癌(例如,乳腺浸润癌)。
[0674]
在一个实施方式中,所述癌症选自膀胱癌,乳腺癌,宫颈癌,结肠直肠癌,子宫内膜癌,胆囊癌,胃癌,神经胶质瘤,头颈癌,喉癌,肝癌,肺癌,间皮瘤,鼻咽癌,口腔癌,卵巢癌,胰腺癌,前列腺癌或甲状腺癌。
[0675]
在一个实施方式中,所述癌症是膀胱癌。cd138在膀胱癌中表达(kim和park.hum pathol.2014;45:1830-1838)。在一个实施方式中,膀胱癌是尿路上皮癌,鳞状细胞癌或腺癌。在一个实施方式中,膀胱癌是非侵袭性,非肌肉侵袭性或肌肉侵袭性。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用以治疗膀胱癌。在一个实施方式中,抗cd138抗体分子与手术(例如,膀胱肿瘤的经尿道切除术(turbt)或膀胱切除术),膀胱内治疗(例如,膀胱内免疫治疗(例如,卡介苗(bcg)治疗)或膀胱内化疗(例如丝裂霉素,缬沙星,多西紫杉醇,噻替帕或吉西他滨)),化疗(例如膀胱内化疗或全身性化疗(例如顺铂,氟尿嘧啶(5-fu),丝裂霉素,吉西他滨,甲氨蝶呤,长春碱,阿霉素,卡铂,紫杉醇,多西他赛,异环磷酰胺或培美曲塞),放疗或免疫疗法(例如膀胱内bcg,免疫检查点抑制剂(例如pd-l1抑制剂(例如阿特朱单抗,度伐利尤单抗,或阿维鲁单抗)或pd-1抑制剂(例如纳武单抗或派姆单抗)联合使用。
[0676]
在一个实施方式中,癌症是乳腺癌。cd138在乳腺癌中表达(akl等.oncotarget.2015;6(30):28693-28715;barbareschi等.cancer.2003;98:474-483;lim等.singapore med j.2014;55:468-472;nguyen等.am j clin pathol.2013;140:468-474;lendorf等.j histochem c少tochem.2011;59:615-629;gotte等.breast cancer res.2007;9(1):r8;tsanou等.j exp clin cancer res.2004;23(4):641-650)。在一个实施方式中,乳腺癌是导管癌(例如,原位导管癌(dcis)或侵袭性导管癌(idc)(例如,肾小管癌,髓样癌,粘液癌,乳头状癌或筛状癌),小叶癌(例如,小叶原位癌(lcis)或浸润性小叶癌(ilc))或炎性乳腺癌。在一个实施方式中,乳腺癌是er阳性,pr阳性,her2阳性或三阴性(er-,pr-和her2-)。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用以治疗膀胱癌。在一个实施方式中,抗cd138抗体分子与手术(例如,保乳手术或乳房切除术),放疗,化疗(例如,蒽环类(例如,阿霉素,脂质体阿霉素,表柔比星),紫杉烷(例如,紫杉醇,结合白蛋白的紫杉醇(例如白蛋白结合型紫杉醇(nab-paclitaxel))或多西他赛),5-氟尿嘧啶(5-fu),环磷酰胺,铂试剂(例如顺铂或卡铂),长春瑞滨,卡培他滨,吉西他滨,米托蒽醌,伊沙匹隆或艾日布林),激素疗法(例如他莫昔芬,托瑞米芬,氟维司群,芳香
酶抑制剂(例如来曲唑,阿那曲唑或依西美坦),卵巢消融术(例如卵巢切除术,促黄体生成激素的释放激素(lhrh)类似物或化疗药物),靶向治疗(例如曲妥珠单抗,帕妥珠单抗,阿多-曲妥珠单抗氨丹宁,拉帕替尼,那拉替尼,cdk4/6抑制剂(例如帕博西利布或利比昔布),mtor抑制剂(例如依维莫司)或其组合联合使用。
[0677]
在一个实施方式中,所述癌症是宫颈癌。cd138在宫颈癌中表达(akl等.oncotarget.2015;6(30):28693-28715)。在一个实施方式中,宫颈癌是微侵袭性宫颈癌或侵袭性宫颈癌。在一个实施方式中,宫颈癌是鳞状细胞癌或腺癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用以治疗宫颈癌。在一个实施方式中,抗cd138抗体分子与手术(例如,冷冻手术,激光手术,锥切术,单纯子宫切除术,根治性子宫切除术,气管切除术或骨盆切除术),化疗(例如顺铂,卡铂,紫杉醇,拓扑替康,吉西他滨,多西他赛,异环磷酰胺,5-氟尿嘧啶(5-fu),伊立替康或丝裂霉素),靶向疗法(例如血管生成抑制剂(例如贝伐单抗))或其组合联合使用。
[0678]
在一个实施方式中,所述癌症是子宫内膜癌。cd138在子宫内膜癌中表达(hasengaowa等.ann oncol.2005;16:1109-1115)。在一个实施方式中,子宫内膜癌是子宫内膜样癌,浆液性癌,透明细胞癌,粘液性癌,混合或未分化癌,鳞状细胞癌,过渡性细胞癌或子宫内膜间质肉瘤。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用,以治疗子宫内膜癌。在一个实施方式中,抗cd138抗体分子与手术,放疗,激素疗法(例如孕激素(例如,醋酸甲羟孕酮)或醋酸孕甾酮),他莫昔芬,促黄体激素释放激素(lhrh)激动剂(例如,戈舍瑞林或亮丙瑞林),芳香酶抑制剂(例如,来曲唑,阿那曲唑或依西美坦),化疗(例如,紫杉醇,卡铂,阿霉素,脂质体阿霉素或顺铂)或其组合联合使用。
[0679]
在一个实施方式中,所述癌症是胆囊癌。cd138在胆囊癌中过表达(roh等.eur surg res.2008;41(2):245-250)。在一个实施方式中,胆囊癌是腺癌或乳头状腺癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用以治疗胆囊癌。在一个实施方式中,抗cd138抗体分子与手术,放疗,化疗(例如,吉西他滨,顺铂,5-氟尿嘧啶(5-fu),卡培他滨或奥沙利铂),或姑息疗法(例如,胆道支架,胆道导管,胆道旁路,醇类注射,止痛药)或其组合联合使用。
[0680]
在一个实施方式中,所述癌症是胃癌。强基质cd138表达与胃癌有关(wiksten等.int j cancer.2001;95(1):1-6)。在一个实施方式中,胃癌是腺癌(aca)。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用以治疗胃癌。在一个实施方式中,抗cd138抗体分子与手术,化疗(例如5-fu(氟尿嘧啶),卡培他滨,卡铂,顺铂,多西他赛,表柔比星,伊立替康,奥沙利铂或紫杉醇)或其组合联合使用。
[0681]
在一个实施方式中,癌症是脑癌(例如,神经胶质瘤)。cd138在神经胶质瘤中表达(xu等.mol biol rep.2012;39(9):8979-8985)。在一个实施方式中,神经胶质瘤是星形细胞瘤,脑膜突细胞瘤或少突胶质细胞瘤。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用,以治疗神经胶质瘤。在一个实施方式中,抗cd138抗体分子与手术,放疗,化疗(例如,卡铂,卡莫司汀(bcnu),顺铂,环磷酰胺,依托泊苷,伊立替康,洛莫司汀(ccnu),甲氨蝶呤,丙卡巴肼,替莫唑胺或长春新碱),靶向疗法(例如贝伐单抗或依维莫司),皮质类固醇(例如地塞米松),抗癫痫药或激素,或其组合联合使用。
[0682]
在一个实施方式中,所述癌症是喉癌。cd138表达在喉癌中(klatka等
.otolaryngol pol.2004;58:933-940)。在一个实施方式中,喉癌是鳞状细胞癌或腺癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗喉癌。在一个实施方式中,抗cd138抗体分子与手术,放疗,化疗(例如,顺铂,卡铂,5-氟尿嘧啶(5-fu),多西他赛,紫杉醇,博来霉素,甲氨蝶呤或异环磷酰胺),靶向疗法(例如egfr抑制剂(例如西妥昔单抗))或其组合联合使用。在一个实施方式中,癌症是肝癌。在一个实施方式中,肝癌是肝细胞癌(hcc),胆管癌,血管肉瘤或继发性肝癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗肝癌。在一个实施方式中,抗cd138抗体分子与手术,肿瘤消融,肿瘤栓塞,放疗,靶向疗法(例如索拉非尼或雷戈非尼),化疗(例如阿霉素,5-氟尿嘧啶(5-fu)或顺铂)或其组合联合使用。
[0683]
在一个实施方式中,所述癌症是肺癌。cd138在肺癌中表达(anttonen等.lung cancer.2001;32:297-305)。在一个实施方式中,肺癌是非小细胞肺癌(nsclc)(例如,腺癌,鳞状细胞癌,大细胞癌或大细胞神经内分泌肿瘤)或小细胞肺癌(sclc)。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗肺癌。在一个实施方式中,抗cd138抗体分子与手术,射频消融(rfa),放疗,化疗(顺铂,卡铂,紫杉醇,结合白蛋白的紫杉醇(白蛋白结合型紫杉醇),多西他赛,吉西他滨,长春瑞滨,伊立替康,依托泊苷,长春碱或培美曲塞),靶向治疗(血管生成抑制剂(例如贝伐单抗或雷莫西单抗),egfr抑制剂(例如埃洛替尼,阿法替尼,吉非替尼,奥西替尼或奈妥珠单抗),alk抑制剂(例如克唑替尼,色瑞替尼,艾乐替尼或布格替尼),braf抑制剂(例如达拉非尼或曲美替尼),免疫疗法(例如pd-1抑制剂(例如纳武单抗或帕博利珠单抗)或pd-l1抑制剂(例如阿特珠单抗)或其组合联合使用,例如,以治疗非小细胞肺癌。在一个实施方式中,抗cd138抗体分子与手术,放疗,化疗(顺铂,依托泊苷,卡铂,或伊立替康)或组合联合使用,例如,以治疗小细胞肺癌。
[0684]
在一个实施方式中,所述癌症是间皮瘤。cd138在间皮瘤中表达(kumar-singh等.j pathol.1998;186:300-305)。在一个实施方式中,间皮瘤是上皮样间皮瘤,肉瘤样间皮瘤或双相性间皮瘤。在一个实施方式中,间皮瘤是胸膜间皮瘤,腹膜间皮瘤或心包间皮瘤。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用,以治疗间皮瘤。在一个实施方式中,抗cd138抗体分子与手术,放疗,化疗(例如,培美曲塞,顺铂,卡铂,吉西他滨,甲氨蝶呤,长春瑞滨,丝裂霉素或阿霉素),或其组合联合使用。
[0685]
在一个实施方式中,所述癌症是鼻咽癌。cd138在鼻咽癌中表达(anttonen等.lung cancer.2001;32:297-305)。在一个实施方式中,鼻咽癌是角化鳞状细胞癌,非角化分化癌或未分化癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗鼻咽癌。在一个实施方式中,抗cd138抗体分子与手术,放疗,化疗(例如卡铂,阿霉素,表柔比星,紫杉醇,多西他赛,吉西他滨,博来霉素或甲氨蝶呤),靶向疗法(例如,西妥昔单抗)或其组合联合使用。
[0686]
在一个实施方式中,所述癌症是鼻咽癌。cd138在口腔癌中表达(al-otaibi等.j oral pathol med.2013;42:186-193)。在一个实施方式中,口腔癌是鳞状细胞癌,疣状癌或轻度唾液腺癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用,以治疗口腔癌。在一个实施方式中,抗cd138抗体分子与手术,放疗,化疗(例如,顺铂,卡铂,5-氟尿嘧啶(5-fu),紫杉醇,多西他赛,甲氨蝶呤,异环磷酰胺或博来霉素),靶向疗法(例如西妥昔单抗)或其组合联合使用。
[0687]
在一个实施方式中,该癌症是卵巢癌。cd138在卵巢癌中表达(kusumoto等.oncol rep.2010;23:917-925;davies等.clin cancer res.2004;10:5178-5186)。在一个实施方式中,卵巢癌是上皮癌,生殖细胞癌,间质癌或小细胞癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用,以治疗卵巢癌。在一个实施方式中,抗cd138抗体分子与手术,化疗(例如,顺铂,卡铂,紫杉醇,白蛋白结合的紫杉醇(白蛋白结合型紫杉醇),多西紫杉醇,阿替雷明,卡培他滨,环磷酰胺,依托泊苷,吉西他滨,异环磷酰胺,伊立替康,脂质体阿霉素,美法仑,培美曲塞,托泊替康或长春瑞滨),激素治疗(例如促黄体生成激素释放激素(lhrh)激动剂(例如戈舍瑞林或亮丙瑞林),他莫昔芬,或芳香化酶抑制剂(例如,来曲唑,阿那曲唑或依西美坦),靶向疗法(例如,血管生成抑制剂(例如,贝伐单抗),parp抑制剂(例如,奥拉帕尼,卢卡帕尼或尼拉帕利布),放疗或其组合联合使用。
[0688]
在一个实施方式中,所述癌症是胰腺癌。cd138在胰腺癌中表达(juuti等.oncology.2005;68:97-106)。在一个实施方式中,胰腺癌是外分泌肿瘤或内分泌肿瘤。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗胰腺癌。在一个实施方式中,抗cd138抗体分子与手术,消融,栓塞,放疗或化疗(西西他滨,5-氟尿嘧啶(5-fu),伊立替康,奥沙利铂,白蛋白结合的紫杉醇,卡培他滨,顺铂,紫杉醇,多西紫杉醇或伊立替康脂质体联合使用。
[0689]
在一个实施方式中,所述癌症是前列腺癌。cd138在前列腺癌中表达(ledezma等.asian j androl.2011;13:476-480;shariat等.bju int.2008;101:232-237;kiviniemi等.apmis.2004;112:89-97;zellweger等.prostate.2003;55:20-29)。在一个实施方式中,前列腺癌是腺癌,移行细胞(或尿路上皮)癌,鳞状细胞癌或小细胞前列腺癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗前列腺癌。在一个实施方式中,抗cd138抗体分子与手术,放疗,冷冻疗法,激素疗法(例如,睾丸切除术,lhrh激动剂(例如,亮丙瑞林,戈舍瑞林,曲普瑞林或组蛋白),lhrh拮抗剂(例如地加瑞克),cyp17抑制剂(例如阿比特龙),抗雄激素(例如氟他米特,比卡鲁胺,尼鲁米特或恩杂鲁胺),雌激素或酮康唑),化疗(例如多西他赛,卡巴他赛,米托蒽醌或雌莫司汀),疫苗治疗(例如sipuleucel-t)或骨定向治疗(例如双膦酸盐(例如唑来膦酸),地诺单抗,皮质类固醇(例如泼尼松或地塞米松),外部放射线疗法,放射性药物(例如,锶-89,钐-153或镭-223)或其组合联合使用。
[0690]
在一个实施方式中,所述癌症是头颈癌。cd138在头颈癌中表达(anttonen等.br j cancer.1999;79:558-564;inki等.br j cancer.1994;70:319-323)。在一个实施方式中,头颈癌是鳞状细胞癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗头颈癌。在一个实施方式中,抗cd138抗体分子与手术,放疗,化疗(例如甲氨蝶呤,博来霉素或多西他赛),靶向疗法(例如西妥昔单抗),免疫疗法(例如pd-1抑制剂(例如,纳武单抗或派姆单抗)或其组合联合使用。
[0691]
在一个实施方式中,所述癌症是甲状腺癌。cd138在甲状腺癌中表达(oh和park.j korean med sci.2006;21:397-405)。在一个实施方式中,甲状腺癌是乳头状癌,滤泡状癌,h
ü
rthle细胞癌,甲状腺髓样癌或间变性癌。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗甲状腺癌。在一个实施方式中,抗cd138抗体分子与手术,放射性碘治疗,甲状腺激素疗法,放疗,化疗,靶向疗法(例如激酶抑制剂(例如索拉
非尼或乐伐替尼))或其组合联合使用。
[0692]
在一个实施方式中,癌症是慢性淋巴细胞性白血病(cll)。cd138在慢性淋巴细胞性白血病癌症中表达(jilani等.int j lab hematol.2009;31:97-105)。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法结合使用以治疗甲状腺癌。在一个实施方式中,抗cd138抗体分子与化疗(例如嘌呤类似物(例如氟达拉滨,喷司他丁或克拉屈滨),烷基化剂(例如苯丁酸氮芥,环磷酰胺或苯达莫司汀),皮质类固醇(例如强的松,甲基强的松龙或地塞米松),阿霉素,甲氨蝶呤,奥沙利铂,长春新碱,依托泊苷和阿糖胞苷),抗cd20抗体(利妥昔单抗,奥贝努妥珠单抗或奥法木单抗),抗cd52抗体(如阿仑单抗),靶向治疗(例如依鲁替尼,依达拉西布或威尼托克斯),干细胞移植(sct)或其组合联合使用。
[0693]
在一个实施方式中,癌症是淋巴瘤(例如,弥漫性大b细胞淋巴瘤(dlbcl))。cd138在dlbcl中表达(oh和park.j korean med sci.2006;21:397-405;bodoor等.asian pac j cancer prev.2012;13:3037-3046)。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用,以治疗dlbcl。在一个实施方式中,抗cd138抗体分子与化疗(例如,烷化剂(例如,环磷酰胺,苯丁酸氮芥,苯达莫司汀或异环磷酰胺),皮质类固醇(例如,泼尼松或地塞米松),铂类药物(顺铂,卡铂或奥沙利铂),嘌呤类似物(例如氟达拉滨,喷司他丁或克拉屈滨),抗代谢物(例如阿糖胞苷,吉西他滨,甲氨蝶呤或普拉拉司特),长春新碱,阿霉素,米托蒽醌,依托泊苷,依托泊苷,依托泊苷,免疫疗法(例如抗cd20抗体(利妥昔单抗,奥比妥珠单抗或奥法木单抗),抗cd52抗体(例如阿仑单抗),抗cd30抗体(例如贝伦妥单抗-维多汀),干扰素,免疫调节药物(例如,沙利度胺或来那度胺),靶向疗法(例如蛋白酶体抑制剂(例如硼替佐米),组蛋白脱乙酰基酶(hdac)抑制剂(例如罗米地辛或贝利司他)或激酶抑制剂(例如依鲁替尼或依达拉西布)),放射治疗,干细胞移植(sct)或其组合联合使用。
[0694]
在一个实施方式中,癌症是霍奇金淋巴瘤。cd138在霍奇金淋巴瘤中表达(gharbaran等.j hematol oncol.2013;6:62;vassilakopoulos等.anticancer res.2005;25:4743-4746)。本文所述的抗cd138抗体分子可单独使用或与第二治疗剂,手术或疗法联合使用,以治疗霍奇金淋巴瘤。在一个实施方式中,抗cd138抗体分子与化疗(例如,阿霉素,博来霉素,长春碱,达卡巴嗪,依托泊苷,环磷酰胺,长春新碱,普卡巴嗪,泼尼松,甲氧乙胺,长春新碱或长春碱),免疫疗法(例如抗cd30抗体(例如贝伦妥单抗-维多汀)),干细胞移植或其组合联合使用。
[0695]
在一个实施方式中,抗体分子用于治疗或预防癌前病症。癌前病症,也称为恶化前病症,潜在癌前病症或潜在恶性症前病症,是指与癌症风险增加相关的细胞形态紊乱的状态。如果不及时治疗,癌前状况可能导致癌症。在一个实施方式中,恶前病变是形态学上不典型的组织,其在显微镜检查下表现为异常,并且比其明显正常的癌中更可能发生癌症。在一个实施方式中,癌前状况是冒烟型骨髓瘤或无症状的骨髓瘤。在一个实施方式中,癌前病症是意义未明的单克隆丙种球蛋白血症(mgus)。癌前病症的其它示例包括但不限于,光化性角化病,巴雷特食管,萎缩性胃炎,原位导管癌,先天性角化不全,吞咽障碍,吞咽困难,扁平苔藓,口腔粘膜下纤维化,日光性弹力组织变性,宫颈非典型增生,黏膜白斑病和黏膜红斑病。
[0696]
多发性骨髓瘤
[0697]
本文所述的人源化抗体分子可用于治疗或预防多发性骨髓瘤。
[0698]
多发性骨髓瘤(mm),也称为浆细胞骨髓瘤,是浆细胞的癌症,其通常负责产生抗体(raab等.lancet.2009;374(9686):324-39)。多发性骨髓瘤通常被认为是骨髓中单克隆浆细胞(pc)不受控制增殖的恶性疾病。这种血液系统恶性肿瘤的临床特征包括:例如,单克隆免疫球蛋白的大量产生、溶骨性骨病、贫血、免疫抑制和终末器官损伤,主要发生在肾脏。在过去几十年中,mm患者的治疗取得了令人鼓舞的进展。尽管取得了这些进展,但在大多数患者中,多发性骨髓瘤仍然是一种不可治愈的疾病,因为复发率或治疗耐药性很高。mm是(全球)第二大血液系统癌症,约占美国所有新诊断癌症的2%,约占血液系统恶性肿瘤的13%,保守估计2018年新增病例超过30000例,导致约13000人死亡。迫切需要开发用于治疗、预防和诊断多发性骨髓瘤和具有相似疾病机制的其它浆细胞疾病的新方法。在不希望受到理论约束的情况下,人们相信,在一个具体实施方式中,通过使用安全有效的药物对疾病治疗进行早期干预的前景也是一种新兴且有吸引力的策略。新的靶向疗法,例如使用本文所述的抗cd138抗体分子的疗法,至少在这方面可能是有益的。
[0699]
多发性骨髓瘤的体征或症状包括,例如骨痛,贫血(例如正常血红细胞和/或正常变色性贫血),肾衰竭(例如急性或慢性肾衰竭),感染(例如肺炎或肾盂肾炎),神经系统症状(例如,无力,混乱,疲劳,头痛,视力改变,视网膜病变,神经根疼痛,肠或膀胱失去控制,腕管综合症或截瘫)。
[0700]
多发性骨髓瘤的风险因素包括,例如冒烟型骨髓瘤(也称为无症状性骨髓瘤),意义未明的单克隆丙种球蛋白病(mgus),肥胖症或家族易感性。在一个实施方式中,本文所述的抗cd138抗体分子可用于减少(例如,预防)冒烟型骨髓瘤或mgus发展为多发性骨髓瘤。
[0701]
有症状的骨髓瘤,无症状的骨髓瘤和mgus的诊断标准描述于,例如kyle和rajkumar leukemia.2009;23(1):3-9。
[0702]
有症状的骨髓瘤的诊断标准(必须满足所有三个标准)包括,例如,骨髓活检物或(任何数量)其它组织(浆细胞瘤)的活检物中>10%的克隆浆细胞,血清或尿液中的单克隆蛋白(骨髓瘤蛋白)(真正的非分泌性骨髓瘤除外),以及,感觉到与浆细胞疾病(相关器官或组织损伤,通常简称为“crab”)相关联的终末器官破坏的证据:高钙血症(校正后的钙>2.75mmol/1,>11mg/dl),肾功能不全(可归因于骨髓瘤),贫血(血红蛋白<10g/dl),骨病变(溶解性病变或伴有压缩性骨折的骨质疏松症)。无症状/冒烟型骨髓瘤的诊断标准包括,例如,骨髓活检时血清m蛋白>30g/l(3g/dl)和/或克隆浆细胞>10%,且无骨髓瘤相关器官或组织损伤。意义未明的单克隆丙种球蛋白血症(mgus)的诊断标准包括,例如,骨髓活检物中血清副蛋白<30g/l(3g/dl)和克隆浆细胞<10%,且无骨髓瘤相关器官或组织损伤或相关的b细胞淋巴组织增生性疾病。
[0703]
相关状况包括,例如孤立性浆细胞瘤,浆细胞发育不良(例如al淀粉样变性)和周围神经病,器官肿大,内分泌病,单克隆浆细胞疾病和皮肤变化。
[0704]
用于骨髓瘤的国际分期系统(iss)描述于,例如,greipp等.j clin oncol.2005;23(15):3412-20。例如,iss包括以下:i期:β2免疫球蛋白(β2m)<3.5mg/l,白蛋白≥3.5g/dl;ii期:β2m<3.5mg/l且白蛋白<3.5g/dl;或β2m 3.5-5.5mg/l,无论血清白蛋白如何;iii期:β2m≥5.5mg/l。
[0705]
iss可以与durie-salmon分期系统一起使用。durie-salmon分期系统描述于,例如,durie和salmon cancer.1975;36(3):842-54。例如,durie-salmon分期系统包括以下内
容:第一阶段(所有hb>10g/dl,钙正常,骨骼检查:正常或单个浆细胞瘤或骨质疏松症,如果igg,则血清副蛋白水平<5g/dl,如果iga,则<3g/dl,尿轻链排泄<4g/24h);第二阶段(不满足第一阶段或第三阶段的标准);第三阶段(hb<8.5g/dl,高钙>12mg/dl,骨骼检查:三个或更多个溶骨性病变,如果igg,则血清副蛋白>7g/dl,如果iga,则>5g/dl,尿液轻链排泄>12g/24h中的一项或多项)。根据血清肌酐,durie-salmon分期系统的第一、第二和第三阶段可分为a或b:a:血清肌酐<2mg/dl(<177μtmol/l);b:血清肌酐>2mg/dl(>177μtmol/l)。
[0706]
可与本文所述的抗cd138抗体分子联合使用的多发性骨髓瘤的其它治疗方法包括,例如,蛋白酶抑制剂(例如硼替佐米卡非佐米或伊沙佐米免疫调节剂(例如沙利度胺来那度胺或波马利度胺化疗(例如美法仑,长春新碱环磷酰胺,依托泊苷,阿霉素脂质体阿霉素或苯达莫司汀皮质类固醇(例如泼尼松或地塞米松),组蛋白脱乙酰基酶(hdac)抑制剂(例如帕比司他抗cd38抗体(例如达雷木单抗抗slamf7抗体(例如艾洛珠单抗干扰素或骨髓移植(例如自体干细胞移植(asct)或同种异体干细胞移植),双膦酸盐(例如帕米膦酸和唑来膦酸放疗,手术,静脉注射免疫球蛋白(ivig),用于低血细胞计数的治疗(例如促红细胞生成素或达贝泊汀血浆置换术或其组合。
[0707]
可以与本文所述的抗cd138抗体分子联合使用的示例性联合疗法包括但不限于:美法仑和泼尼松(mp),有或不有沙利度胺或硼替佐米;和长春新碱,阿霉素和地塞米松(vad);沙利度胺(或来那度胺)和地塞米松;硼替佐米,阿霉素和地塞米松;硼替佐米,地塞米松和沙利度胺(或来那度胺);脂质体阿霉素,长春新碱和地塞米松;卡非佐米,来那度胺和地塞米松;地塞米松,环磷酰胺,依托泊苷和顺铂(dcep);地塞米松,沙利度胺,顺铂,阿霉素,环磷酰胺和依托泊苷(dt-pace),有或没有硼替佐米;帕比司他,硼替佐米和地塞米松;来那度胺和地塞米松,依洛珠单抗,来那度胺和地塞米松。
[0708]
联合治疗
[0709]
本文所述的人源化抗体分子可以与其它疗法联合使用。例如,联合治疗可包括将抗体分子与一种或多种其他治疗剂(例如一种或多种本文所述的其他治疗剂)共同配制和/或共同给药。在其他实施方式中,联合给予抗体分子和其他治疗性处理模式(例如本文所述的其他治疗性处理模式)。此类联合治疗可有利地利用较低剂量的所给治疗剂,由此避免了与各种单独治疗相关的可能毒性或并发症。
[0710]
如本文所用,“联合”给予是指在对象罹患病症之前或期间,将两种(或更多种)不同处理/治疗递送给该对象。在一个实施方式中,两种或更多种处理是预防性递送的,例如在对象罹患病症前或被诊断患有该病症前递送。在另一个实施方式中,在对象已发展或诊断出患有所述疾病之后进行两种或更多种处理。在一些实施方式中,在第二处理开始递送
时,第一处理的递送仍在持续,由此存在重叠。有时称此为“同时”或“共同递送”。在其他实施方式中,在第一处理的递送终止后,再开始递送其他处理。在这两种情况之任一的实施方式中,处理因联合给予而更有效。例如,与若只给予第二处理而不给予第一处理所能观察到的相比,第二处理更有效(例如采用更少的第二处理观察到同样的效果,或者第二处理更大程度地减轻或减少症状),或者第一处理亦然。在一些实施方式中,与递送一种处理而不递送另一种所能观察到的相比,递送更大程度地减轻或减少或降低症状或病症相关的其他参数。两种或更多种处理的效果可部分加合、完全加合或大于加合。在一些实施方式中,两种或更多种处理的效果可能是协同的。递送可使递送第一处理的效果在递送第二处理时仍可被检测到。
[0711]
在某些实施方式中,另外的试剂是第二抗体分子,例如,与第一抗体分子不同的第二抗体分子。可以组合使用的示例性抗体分子包括但不限于表1、2或6中列出的抗体分子的任何组合。
[0712]
在一个实施方式中,抗体分子与第二疗法联合给予以治疗或预防骨髓瘤,例如多发性骨髓瘤。
[0713]
在一个实施方式中,抗体分子与蛋白酶抑制剂组合给予。示例性的蛋白酶抑制剂包括例如硼替佐米卡非佐米和依克佐米(ixazomib)
[0714]
在一个实施方式中,抗体分子与免疫调节剂组合给予。示例性的免疫调节剂包括,例如,沙利度胺来那度胺和泊马利度胺
[0715]
在一个实施方式中,抗体分子与化疗剂组合给予。示例性的化疗剂包括例如美法仑,长春新碱环磷酰胺,依托泊苷,阿霉素脂质体阿霉素和苯达莫司汀
[0716]
在一个实施方式中,抗体分子与皮质类固醇(例如泼尼松和地塞米松)组合给予。
[0717]
在一个实施方式中,抗体分子与组蛋白脱乙酰基酶(hdac)抑制剂,例如帕比司他组合给予。
[0718]
在一个实施方式中,抗体分子与抗cd38抗体例如达雷木单抗组合给予。
[0719]
在一个实施方式中,抗体分子与抗slamf7抗体,例如依洛珠单抗联合给予。
[0720]
在一个实施方式中,抗体分子与干扰素联合给予。
[0721]
在一个实施方式中,抗体分子与骨髓移植(例如,自体干细胞移植(asct)或同种异体干细胞移植)联合给予。
[0722]
在一个实施方式中,抗体分子与双膦酸盐,例如帕米膦酸盐或唑来膦酸组合给予。
[0723]
在一个实施方式中,抗体分子与放疗组合给予。
[0724]
在一个实施方式中,抗体分子与手术组合给予。
[0725]
在一个实施方式中,抗体分子与静脉内免疫球蛋白(ivig)组合给予。
[0726]
在一个实施方式中,抗体分子与用于低血细胞计数的治疗例如促红细胞生成素或达贝泊汀组合给予。
[0727]
在一个实施方式中,抗体分子与血浆置换术组合给予。
[0728]
在一个实施方式中,抗体分子与美法仑和泼尼松(mp)联合给予,有或没有沙利度胺或硼替佐米。
[0729]
在一个实施方式中,抗体分子与长春新碱,阿霉素和地塞米松(vad)联合给予。
[0730]
在一个实施方式中,抗体分子与沙利度胺(或来那度胺)和地塞米松组合给予。
[0731]
在一个实施方式中,抗体分子与硼替佐米,阿霉素和地塞米松联合给予。
[0732]
在一个实施方式中,抗体分子与硼替佐米,地塞米松和沙利度胺(或来那度胺)组合给予。
[0733]
在一个实施方式中,抗体分子与脂质体阿霉素,长春新碱和地塞米松组合给予;
[0734]
在一个实施方式中,抗体分子与卡非佐米,来那度胺和地塞米松联合给予。
[0735]
在一个实施方式中,抗体分子与地塞米松,环磷酰胺,依托泊苷和顺铂(dcep)组合给予。
[0736]
在一个实施方式中,抗体分子与地塞米松,沙利度胺,顺铂,阿霉素,环磷酰胺和依托泊苷(dt-pace)联合给予,有或没有硼替佐米。
[0737]
在一个实施方式中,抗体分子与帕比司他,硼替佐米和地塞米松联合给予。
[0738]
在一个实施方式中,抗体分子与依沙米布,来那度胺和地塞米松联合给予。
[0739]
在一个实施方式中,抗体分子与依洛珠单抗,来那度胺和地塞米松联合给予。
[0740]
在一个实施方式中,抗体分子与靶向cd138途径的第二试剂联合给予。靶向cd138途径的示例性试剂包括,例如,例如靶向cd138胞外域的试剂(例如,辛思他汀(synstatin),bt-062-dm4(英达妥昔单抗拉夫坦辛(indatuximab ravtansine)),bb4,其偶联至
131
i,oc-46f2,或glvglifav(seq id no:448)),靶向脱落的cd138的试剂(例如,nsc 405020,bb-94,pi-88,pg545,m402,sst00001或正五聚蛋白-3),以及靶向cd138遗传表达的试剂(例如(全反式维甲酸,尼美舒利,唑来膦酸或伊马替尼)。靶向cd138途径的其它试剂描述于,例如,akl等.oncotarget.2015;6(30):28693-28715,其内容通过引用其全文的方式纳入本文。
[0741]
在一个实施方式中,将抗体分子与来那度胺和/或地塞米松联合给予,例如以治疗多发性骨髓瘤(例如复发的多发性骨髓瘤)。
[0742]
在一个实施方式中,抗体分子与fgfr2拮抗剂(例如,抗fgfr2抗体,例如,fpa144)组合给予以治疗实体瘤(例如,晚期实体瘤)。
[0743]
在一个实施方式中,抗体分子与αvβ3抑制剂(例如,针对整合素αvβ3的adc,例如,贝伦妥单抗-维多汀)联合给予,以治疗霍奇金淋巴瘤(例如,复发性或难治性霍奇金淋巴瘤)。
[0744]
在一个实施方式中,抗体分子与肝素或乙酰肝素酶抑制剂(例如,容帕斯塔(roneparstat)(sst0001))联合给予,例如以治疗多发性骨髓瘤(例如,晚期多发性骨髓瘤)。
[0745]
在一个实施方式中,抗体分子与vegfr抑制剂(例如贝伐单抗或西地尼布)联合给药,例如以治疗癌症(例如晚期癌症)。
[0746]
在一个实施方式中,抗体分子与wnt信号转导途径抑制剂(例如伊帕福利赛(ipafricept)(omp-54f28))组合给予,例如以治疗实体瘤。
[0747]
在一个实施方式中,抗体分子与fak抑制剂(例如蒂法替尼(defactinib)(vs-6063)或gsk2256098)组合给予,例如以治疗实体瘤,例如肺癌(例如非小细胞肺癌,例如具有kras突变的癌症)。
[0748]
在一个实施方式中,抗体分子与糖胺聚糖或乙酰肝素酶抑制剂(例如,耐帕兰尼(necuparanib)(m402))联合给予,任选地,进一步与化学治疗剂(例如,白蛋白结合型紫杉醇或吉西他滨)联合给予,例如以治疗胰腺癌(例如转移性胰腺癌)。
[0749]
在一个实施方式中,将抗体分子与甘露糖寡糖或fgf,乙酰肝素酶和/或vegf抑制剂(例如,木帕佛司他(muparfostat)(pi-88))联合给予,例如以治疗癌症(例如,黑素瘤)。
[0750]
在一个实施方式中,抗体分子与化学修饰的硫酸肝素/乙酰肝素酶抑制剂(例如pg545)组合给予,例如以治疗实体瘤(例如晚期实体瘤)。
[0751]
在一个实施方式中,抗体分子与氨基酸或基质金属蛋白酶抑制剂(例如,胸膜内巴马司他(bb-94))组合给予,例如以治疗恶性胸腔积液。
[0752]
在一个实施方式中,抗体分子与嵌合抗cd138抗原受体修饰的t细胞组合给予,例如以治疗多发性骨髓瘤(例如复发和/或难治性多发性骨髓瘤)。
[0753]
在一个实施方式中,抗体分子与蛋白酶体抑制剂组合给予。在一个实施方式中,蛋白酶体抑制剂包括硼替佐米。在一个实施方式中,蛋白酶体抑制剂包括下式的化合物:
[0754]
或其药学上可接受的盐、水合物、溶剂合物、前药、立体异构体或互变异构体。
[0755]
硼替佐米(也称为ldp 341、mln341或ps-341)是一种抗癌药物,也是第一种用于人类的治疗性蛋白酶体抑制剂。蛋白酶体是一种高阶酶复合物,可降解错误折叠、受损或潜在有毒的蛋白质,并构成一种代谢和稳态机制,细胞通过该机制调节此类蛋白质的浓度和周转。在一些癌症中,这种稳态是不平衡的,导致通常用于杀死癌细胞或控制细胞生长的蛋白质(例如免疫蛋白酶体)的不当降解。硼替佐米调节这一过程,促进癌细胞的促凋亡或免疫杀伤。它部分是通过促进未折叠蛋白反应(upr)来实现的。在一个实施方式中,硼替佐米具有[(1r)-3-甲基-1-[(2s)-1-氧代-3-苯基-2-[(吡嗪羰基)氨基]丙基]氨基]丁基]硼酸的化学结构。
[0756]
硼替佐米在美国和欧洲被批准用于治疗复发性多发性骨髓瘤和套细胞淋巴瘤。临床研究表明,硼替佐米作为初始治疗、维持治疗或二线治疗先前治疗的多发性骨髓瘤有部分益处。该药物通常与地塞米松(vd)联合使用,或作为三种药物组合的一部分使用,例如velcade-revlimid(来那度胺)-地塞米松(vrd)。
[0757]
可与本文所述抗体分子或组合物联合使用以治疗或预防其他病症的示例性治疗/
疗法也描述于本文“治疗或预防病症的方法”部分中。
[0758]
诊断方法
[0759]
在一方面,本公开提供了用于在体外(例如,在生物样品,例如活检物或血液样品中)或体内(例如,在对象体内成像)检测cd138存在的诊断方法。该方法包括:(i)使样品与本文所述的人源化抗cd138抗体分子接触,或向对象给予所述抗体分子;(任选地)(ii)使参照样品,例如对照样品(例如对照生物样品,例如活检物或血样)或对照对象与本文所述的抗体分子接触;和(iii)检测抗体分子与样品或对象或对照样品或对象中cd138之间复合物的形成,其中相对于对照样品或对象,样品或对象中复合物形成的变化(例如统计学上显著的变化)指示样品中cd138的存在。抗体分子可以用可检测物质直接或间接标记,以便于检测结合或未结合的抗体分子。合适的可检测物质包括如上所述并在下面更详细地描述的各种酶、辅基、荧光材料、发光材料、和放射性材料。
[0760]
术语“样品”是指用于检测多肽(例如cd138)或编码该多肽的核酸的样品,包括但不限于细胞,细胞裂解液,蛋白质或细胞膜提取物,体液例如血液,或组织样品(例如活检物)。
[0761]
可以通过测量或观察与cd138结合的抗体分子或未结合的抗体分子来检测抗体分子与cd138之间的复合物形成。任何合适的检测方法均可使用,常规检测方法包括酶联免疫测试(elisa)、放射免疫测试(ria)或组织免疫组化法。除了标记抗体分子外,cd138的存在可以通过竞争性免疫测定法,利用标记有可检测物质和未标记抗体分子的标准品,通过竞争免疫分析法测定。在该测试中,合并生物样品、有标记标准物质和抗体分子,并测定与无标记结合分子结合的有标记标准物质的量。样品中cd138的量与结合至抗体分子的标记的标准品的量成反比。
[0762]
本文所述的抗cd138抗体分子可用于诊断可由本文所述的抗cd138抗体分子治疗或预防的疾病。本文所述的检测或诊断方法可与本文所述的其他方法联合以治疗或预防本文所述的病症。
[0763]
本公开内容还包括如下编号段落中的任意内容:
[0764]
1.一种抗cd138抗体分子,其包含以下一种或两种:
[0765]
(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:
[0766]
(i)hcdr1,其所含氨基酸序列与本文公开的抗cd138单克隆抗体(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中任一个,或表1、2或6所列)的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;
[0767]
(ii)hcdr2,其所含氨基酸序列与所述抗cd138抗体的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0768]
(iii)hcdr3,其所含氨基酸序列与所述抗cd138抗体的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0769]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:
[0770]
(i)lcdr1,其所含氨基酸序列与所述抗cd138抗体的lcdr1的氨基酸序列相比具有
不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;
[0771]
(ii)lcdr2,其所含氨基酸序列与所述抗cd138抗体的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;或
[0772]
(iii)lcdr3,其所含氨基酸序列与所述抗cd138抗体的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0773]
2.如段落1所述的抗体分子,其中vh包含:
[0774]
(i)hcdr1,其所含氨基酸序列与所述抗cd138抗体的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;
[0775]
(ii)hcdr2,其所含氨基酸序列与所述抗cd138抗体的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和
[0776]
(iii)hcdr3,其所含氨基酸序列与所述抗cd138抗体的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0777]
3.如段落1或2所述的抗体分子,其中vh包含:(i)hcdr1,其包含所述抗cd138抗体的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述抗cd138抗体的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述抗cd138抗体的hcdr3的氨基酸序列。
[0778]
4.如段落1-3中任一段所述的抗体分子,其中vl包括:
[0779]
(i)lcdr1,其所含氨基酸序列与所述抗cd138抗体的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;
[0780]
(ii)lcdr2,其所含氨基酸序列与所述抗cd138抗体的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和
[0781]
(iii)lcdr3,其所含氨基酸序列与所述抗cd138抗体的lcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0782]
5.如段落1-4中任一段所述的抗体分子,其中vl包括:(i)lcdr1,其包含所述抗cd138抗体的lcdr1的氨基酸序列;(ii)lcdr2,其包含所述抗cd138抗体的lcdr2的氨基酸序列;和(iii)lcdr3,其包含所述抗cd138抗体的lcdr3的氨基酸序列。
[0783]
6.如段落1-5中任一段所述的抗体分子,其包含:
[0784]
(a)vh,其包含:
[0785]
(i)hcdr1,其所含氨基酸序列与所述抗cd138抗体的hcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;
[0786]
(ii)hcdr2,其所含氨基酸序列与所述抗cd138抗体的hcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和
[0787]
(iii)hcdr3,其所含氨基酸序列与所述抗cd138抗体的hcdr3的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性,和
[0788]
(b)vl,其包含:
[0789]
(i)lcdr1,其所含氨基酸序列与所述抗cd138抗体的lcdr1的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;
[0790]
(ii)lcdr2,其所含氨基酸序列与所述抗cd138抗体的lcdr2的氨基酸序列相比具有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性;和
[0791]
(iii)lcdr3,其所含氨基酸序列与所述抗cd138抗体的lcdr3的氨基酸序列相比具
有不多于1、2或3个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0792]
7.如段落1-6中任一段所述的抗体分子,其包含:
[0793]
(a)vh,其包含:(i)hcdr1,其包含所述抗cd138抗体的hcdr1的氨基酸序列;(ii)hcdr2,其包含所述抗cd138抗体的hcdr2的氨基酸序列;和(iii)hcdr3,其包含所述抗cd138抗体的hcdr3的氨基酸序列,和
[0794]
(b)vl,其包含:(i)lcdr1,其包含所述抗cd138抗体的lcdr1的氨基酸序列;(ii)lcdr2,其包含所述抗cd138抗体的lcdr2的氨基酸序列;和(iii)lcdr3,其包含所述抗cd138抗体的lcdr3的氨基酸序列。
[0795]
8.如段落1-7中任一段所述的抗体分子,其中,vh所含的氨基酸序列与抗cd138抗体的vh的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0796]
9.如段落1-8中任一段所述的抗体分子,其中,vh包含抗cd138抗体的vh的氨基酸序列。
[0797]
10.如段落1-9中任一段所述的抗体分子,其中,vl所含的氨基酸序列与抗cd138抗体的vl的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0798]
11.如段落1-10中任一段所述的抗体分子,其中,vl包含抗cd138抗体的vl的氨基酸序列。
[0799]
12.如段落1-11中任一段所述的抗体分子,其中:
[0800]
(a)vh所含的氨基酸序列与所述抗cd138抗体的vh的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性;和
[0801]
(b)vl所含的氨基酸序列与所述抗cd138抗体的vh的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0802]
13.如段落1-12中任一段所述的抗体分子,其中,vh包含抗cd138抗体的vh的氨基酸序列,并且vl包含抗cd138抗体的vl的氨基酸序列。
[0803]
14.如段落1-13中任一段所述的抗体分子,其包含fc区。
[0804]
15.如段落1-14中任一段所述的抗体分子,包含重链(hc),其所含的氨基酸序列与抗cd138抗体的hc的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0805]
16.如段落15所述的抗体分子,其中,hc包含抗cd138抗体的hc的氨基酸序列。
[0806]
17.如段落1-16中任一段所述的抗体分子,包含轻链(lc),其所含的氨基酸序列与抗cd138抗体的lc的氨基酸序列相比具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或至少85、90、95、99或100%的同源性。
[0807]
18.如段落17所述的抗体分子,其中,lc包含抗cd138抗体的lc的氨基酸序列。
[0808]
19.如段落1-18中任一段所述的抗体分子,其包含:
[0809]
(a)重链(hc),所述hc所含的氨基酸序列与所述抗cd138抗体的hc的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、
90、95、99或100%的同源性;和
[0810]
(b)轻链(lc),所述lc所含的氨基酸序列与所述抗cd138抗体的lc的氨基酸序列具有不多于1、2、3、4、5、6、7、8、9、10、11、12、13、14或15个氨基酸残基的差异或具有至少85、90、95、99或100%的同源性。
[0811]
20.如段落19所述的抗体分子,其中,hc包含抗cd138抗体的hc的氨基酸序列,而lc包含抗cd138抗体的lc的氨基酸序列。
[0812]
21.一种抗cd138抗体分子,其包含:
[0813]
(i)(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其包含g-y-n/s/t-f-a/s/t-s-y(seq id no:438)的氨基酸序列;(ii)hcdr2,其包含h-p-s-d-s-t(seq id no:351)的氨基酸序列;或(iii)hcdr3,其包含f-v-y(seq id no:508)的氨基酸序列;和
[0814]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其包含k/r-a/s-s-k/q-s-l-l-y-k-d-g-k-t-y-l-n(seq id no:522)的氨基酸序列;(ii)lcdr2,其包含v-l/v-s-s/t-l/r-a/q-s(seq id no:523)的氨基酸序列;或(iii)lcdr3,其包含q-q-l-v-e/q-y-p-y-t(seq id no:524)的氨基酸序列;或
[0815]
(ii)(a)重链可变区(vh),其中vh包含三个重链互补决定区(hcdr1、hcdr2和hcdr3),其中vh包含以下一个、两个或全部:(i)hcdr1,其包含s-y-y-i/m-h(seq id no:525)的氨基酸序列;(ii)hcdr2,其包含t-i-h-p-s-d-s-t-a/t-n-y-a/n-q-k-f-k/q-g(seq id no:526)的氨基酸序列;或(iii)hcdr3,其包含f-v-y(seq id no:508)的氨基酸序列;和
[0816]
(b)轻链可变区(vl),其中vl包含三个轻链互补决定区(lcdr1、lcdr2和lcdr3),其中vl包含以下一个、两个或全部:(i)lcdr1,其包含k/r-a/s-s-k/q-s-l-l-y-k-d-g-k-t-y-l-n(seq id no:522)的氨基酸序列;(ii)lcdr2,其包含v-l/v-s-s/t-l/r-a/q-s(seq id no:523)的氨基酸序列;或(iii)lcdr3,其包含q-q-l-v-e/q-y-p-y-t(seq id no:524)的氨基酸序列。
[0817]
22.如段落1-21中任一段所述的抗体分子,其包含两个vh和两个vl。
[0818]
23.如段落1-22中任一段所述的抗体分子,其是合成抗体分子或分离的抗体分子。
[0819]
24.如段落1-23中任一段所述的抗体分子,其是单价抗体分子,多价(例如,二价,三价或四价)抗体分子,单特异性分子或多特异性(例如,双特异性,三特异性或四特异性)抗体分子。
[0820]
25.如段落1-24中任一段所述的抗体分子,其是人源化抗体分子。
[0821]
26.如段落1-25中任一段所述的抗体分子,其包含衍生自人框架种系序列的一个或多个框架区。
[0822]
27.如段落1-26中任一段所述的抗体分子,其为igg抗体。
[0823]
28.如段落1-27中任一段所述的抗体分子,其包含选自igg1,igg2,igg3或igg4的igg的重链恒定区。
[0824]
29.如段落1-28中任一段所述的抗体分子,其包含κ或λ轻链的轻链恒定区。
[0825]
30.如段落1-29中任一段所述的抗体分子,其包含fc区,该fc区包含一个或多个突变以增加对新生受体fcrn的结合亲和性和/或该抗体分子的半衰期。
[0826]
31.如段落1-30中任一段所述的抗体分子,其包含fc区,其包含本文所述的一个或多个突变,例如,以增加半衰期,adcc,cdc或adcp中的一项或多项。
[0827]
32.一种抗体分子,其与本文所述的抗cd138单克隆抗体(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中任一个)竞争结合至cd138。
[0828]
33.一种抗体分子,其结合、或基本上结合至与本文所述的抗cd138单克隆抗体(例如,抗体3820、3821、3826、4221、4226、4320、4321、4322、4326、4421、4520、4521、4526、3522、3621、3822、3825或4422中任一个)的表位完全或部分重叠的表位。
[0829]
34.一种抗体-分子药物偶联物(adc),其包含如段落1-33中任一段所述的抗体分子,任选地包含细胞毒性剂,还任选地包含接头。
[0830]
35.一种组合物,其包含如段落1-33中任一段所述的抗体分子或如段落34所述的adc,任选地,其中所述组合物是药物组合物。
[0831]
36.如段落35所述的组合物,其还包含药学上可接受的运载体。
[0832]
37.一种核酸分子,其编码如段落1-33中任一段所述的抗体分子的重链可变区(vh),轻链可变区(vl)或两者。
[0833]
38.一种载体,其包含如段落37所述的核酸分子。
[0834]
39.一种细胞,其包含如段落37所述的核酸分子或如段落38所述的载体,任选地,其中所述细胞是分离的细胞。
[0835]
40.一种试剂盒,其包含如段落1-33中任一段所述的抗体分子,如段落34所述的adc或如段落35或36所述的组合物,以及所述抗体分子或组合物的使用说明。
[0836]
41.一种容器,其包含如段落1-33中任一段所述的抗体分子,如段落34所述的adc或如段落35或36所述的组合物。
[0837]
42.一种产生抗cd138抗体分子的方法,该方法包括在允许产生抗体分子的条件下培养如段落33所述的细胞,从而产生抗体分子。
[0838]
43.如段落36所述的方法,其还包括分离或纯化抗体分子。
[0839]
44.如段落1-33中任一段所述的抗体分子,如段落34所述的adc或如段落35或36所述的组合物,其用于治疗对象的癌症的方法。
[0840]
45.如段落44所述应用的抗体分子、adc或组合物,其中所述癌症是血液学癌症。
[0841]
46.如段落44或45所述应用的抗体分子,adc或组合物,其中所述癌症是多发性骨髓瘤。
[0842]
47.如段落44所述应用的抗体分子,adc或组合物,其中所述癌症是实体瘤,例如本文所述的实体瘤。
[0843]
48.如段落44-47中任一段所述的抗体分子,adc或组合物,其中所述抗体分子,adc或组合物经静脉内给予对象。
[0844]
49.如段落44-48中任一段所述应用的抗体分子、adc或组合物,其中,所述抗体分子、adc或组合物以以下剂量给予对象:0.1mg/kg-50mg/kg、0.2mg/kg-25mg/kg、0.5mg/kg-10mg/kg、0.5mg/kg-5mg/kg、0.5mg/kg-3mg/kg、0.5mg/kg-2.5mg/kg、0.5mg/kg-2mg/kg、0.5mg/kg-1.5mg/kg、0.5mg/kg-1mg/kg、1mg/kg-1.5mg/kg、1mg/kg-2mg/kg、1mg/kg-2.5mg/kg、1mg/kg-3mg/kg、1mg/kg-2.5mg/kg,或1mg/kg-5mg/kg。
[0845]
50.如段落44-49中任一段应用的抗体分子、adc或组合物,其中,所述抗体分子、adc或组合物以以下固定剂量给予对象:10mg-1000mg、10mg-500mg、10mg-250mg、10mg-150mg、10mg-100mg、10mg-50mg、250mg-500mg、150mg-500mg、100mg-500mg、50mg-500mg、25mg-250mg、50mg-150mg、50mg-100mg、100mg-150mg、100mg-200mg,或150mg-250mg。
[0846]
51.如段落44-50中任一段所述应用的抗体分子、adc或组合物,其中所述抗体分子、adc或组合物每周一次,每周两次,每两周一次,每三周一次或每四周一次给予。
[0847]
52.如段落44-51中任一段所述应用的抗体分子、adc或组合物,其还包括确定来自对象的样品中cd138的水平。
[0848]
53.如段落44-52中任一段所述应用的抗体分子、adc或组合物,其还包括向所述对象给予针对癌症的第二种疗法。
[0849]
54.如段落1-33中任一段所述的抗体分子,如段落34所述的adc或如段落35或36所述的组合物,其用于治疗癌前病症或预防癌症的方法。
[0850]
55.如段落54所述应用的抗体分子、adc或组合物,其中,所述癌前病症是冒烟型骨髓瘤或意义未明的单克隆丙种球蛋白病(mgus)。
[0851]
56.如段落54所述应用的抗体分子、adc或组合物,其中所述癌症是多发性骨髓瘤。
[0852]
57.一种引起adcc活性的方法,该方法包括使细胞或对象接触如段落1-33中任一段所述的抗体分子,如段落34的adc或如段落35或36的组合物,从而引起adcc活性。
[0853]
58.一种治疗癌症的方法,该方法包括向有此需要的对象给予有效量的如段落1-33中任一段所述的抗体分子,如段落34所述的adc或如段落35或36所述的组合物,由此治疗癌症。
[0854]
59.一种治疗癌前病症或预防癌症的方法,该方法包括向有此需要的对象给予有效量的如段落1-33中任一段所述的抗体分子,如段落34所述的adc或如段落35或36所述的组合物,由此治疗癌前病症或预防癌症。
[0855]
60.一种检测抗cd138分子的方法,该方法包括使细胞或对象接触如段落1-33中任一段所述的抗体分子,从而检测cd138分子。
[0856]
61.如段落60所述的方法,其中,所述抗体分子与可检测标记物偶联。
[0857]
62.如段落60或61所述的方法,其中,所述cd138分子是体外、离体或体内检测的。
[0858]
63.如段落44-56中任一项所述用途的抗体分子、adc或组合物,或如段落58或59所述的方法,其中所述抗体分子联合第二治疗剂或治疗方法使用或给予。
[0859]
64.如段落63所述用途的抗体分子、adc或组合物,或如段落63所述的方法,其中所述第二治疗剂或治疗方法包括蛋白酶体抑制剂。
[0860]
65.如段落64所述用途的抗体分子、adc或组合物,或如段落64所述的方法,其中蛋白酶体抑制剂包括硼替佐米。
[0861]
实施例
[0862]
实施例1:人源化抗cd138抗体变体
[0863]
在该实例中,将鼠嵌合抗cd138抗体2810的可变区人源化,以用于潜在的治疗用途、减轻免疫原性、改善生物物理、物理化学和药学性质,以及在用于抗体生产的哺乳动物细胞系中更高的重组表达。虽然免疫原性是一个多方面和复杂的现象,但一般来说,出于人源化的目的,构建体的设计目的是使功能性人类种系的变化最少,以便最接近于人类源性
抗体。如本文和pct公开号wo 2019/070726或美国专利申请公开号us 2019/0100588所述(其各自均通过引用全部并入本文),以保持mab 2810的抗体特性为目的,对mab 2810进行人源化。这种抗体特性涉及但不限于靶点结合、效应物功能、细胞毒性和表位结合。简言之,通过鉴定小鼠可变重(vh)和可变轻(vl)序列附近的人类种系来进行人源化。一旦确定,使用结构导向设计将来自mab 2810vh和vl的互补决定区(cdr)分别移植到人类vh和vl种系模板上。基于对结构模型的目视检查,选择性地引入了附加的突变(包括小鼠mab中亲本残基的回复突变)。纳入合适的其他方法。
[0864]
与这些人源化抗体变体的可变区相对应的dna序列,以及基于这些蛋白质设计的dna序列,在密码子优化后进行化学合成,以适合在人类和啮齿类动物细胞系中表达。使用标准分子克隆方法将可变区克隆到哺乳动物表达载体pcdna 3.4(赛默飞世尔科技公司(thermo fisher scientific))中,以构建重组载体。这些载体包括必要的遗传、翻译和蛋白质信号转导元件,适用于在哺乳动物细胞(如hek293或中国仓鼠卵巢)中瞬时或稳定转染这些载体后合成和分泌功能性单克隆抗体。在本实施例中,通过分别编码重链(hc)和轻链(lc)的单独载体的瞬时共转染产生人源化的mab 2810变体,以在expicho(中国仓鼠卵巢细胞)中产生作为分泌蛋白的全长人igg1κ抗体。dna转染通常使用基于脂质的转染试剂(例如expifectamine cho转染试剂盒,赛默飞世尔科技公司)和制造商通常建议的标准方案进行。细胞培养在摇瓶中完成,时间为7-10天。通过离心法从废培养基中提取分泌抗体,然后通过膜过滤进一步澄清和灭菌。随后根据已建立的重组抗体纯化方案,使用快速蛋白液相色谱(fplc)上的蛋白a亲和捕获从细胞培养基中纯化单克隆抗体。
[0865]
人源化抗cd138抗体是在设计用于修饰抗体fc糖基化的条件下产生的,尤其是在n297位的相应n-聚糖中核心岩藻糖的减少,并用于增强fc介导的adcc活性,例如,如本文所述。igg fc核心岩藻糖的缺失或大量减少极大地增加了与fcγriii的结合,fcγriii是存在于髓细胞和nk细胞上的fc受体,从而提高了治疗性抗体对fc介导的效应物功能(如nk细胞介导的adcc)的疗效。为此目的对细胞系进行糖工程化的几种方法包括,例如,遗传方法(例如,敲除或沉默α1,6岩藻糖基转移酶8,这是糖基化途径中负责添加岩藻糖的关键细胞酶)或代谢方法(例如,转染细菌酶gdp-6-脱氧-d-塔格糖还原酶(rmd)以阻断岩藻糖的从头生产)。另一种减少igg fc区岩藻糖基化的方法是使用诱饵底物2-脱氧-2-氟-1-岩藻糖(2ff)。已证明向培养基中添加2ff可使igg fc聚糖中岩藻糖的掺入量降低至20%以下。在本实施例中,在瞬时转染抗体lc和hc载体后1小时,以0.15mm在培养基中同时添加2ff。
[0866]
与cd138 多发性骨髓瘤细胞系上表达的膜cd138的抗体结合
[0867]
在一项实验中,评估了单克隆抗体2810的人源化变体与细胞表面上cd138结合的能力。简而言之,瞬时转染后,在hek 293细胞中产生抗体2810的人源化变体。然后将抗体连续稀释三倍。使用cd138 人淋巴母细胞性骨髓瘤细胞系u266评价与膜cd138结合的抗体,并通过流式细胞术定量。抗体-细胞结合以几何平均荧光强度(mfi)报告。使用非线性回归分析和4参数曲线拟合绘制结合数据。如图1所示,抗体2810的人源化变体与cd138 多发性骨髓瘤细胞呈剂量依赖性结合。人源化变体观察到的结合与亲本2810抗体观察到的结合相当。
[0868]
adcc生物测定
[0869]
在另一个实验中,评估了抗cd138抗体2810的人源化变体的adcc活性。简而言之,
人源化变体抗体是通过瞬时转染hek 293细胞产生的,这些细胞经过代谢改变,以减少fc岩藻糖基化。然后在基于萤光素酶的adcc报告试验中,使用稳定转染人fcγriiia受体的工程jurkat细胞作为效应细胞,评价抗体对cd138 人淋巴母细胞性骨髓瘤u266细胞的抗体依赖性细胞毒性(adcc)活性。u266细胞与单克隆抗体孵育,单克隆抗体从3μg/ml的起始浓度连续稀释3倍,并以10∶1的效应物与靶细胞比率添加到效应细胞和cd138
u266多发性骨髓瘤靶细胞中。在37℃下培养16小时后,萤光素酶活性被评估为adcc活性的量度,并报告为相对发光单位(rlu)。使用非线性回归分析和4参数曲线拟合绘制adcc数据。如图2所示,人源化抗cd138抗体变体诱导大量adcc活性,与抗体2810所显示的活性相当。
[0870]
实施例2:人源化抗cd138变体的进一步表征
[0871]
在本实施例中,进一步检测了抗cd138抗体2810的人源化变体的子集在一组多发性骨髓瘤细胞系中与adcc的结合和诱导。
[0872]
首先,评价人源化抗cd138抗体变体3821、4321、4320、4521、4326和3820与以下三种不同的cd138 多发性骨髓瘤相关细胞系的结合:mm1.s、lp-1和rpmi 8226。如实施例15所述,通过流式细胞术测量抗体结合。如图3a-3c所示,人源化抗cd138抗体变体与三个多发性骨髓瘤细胞系中的每一个都表现出剂量依赖性结合。
[0873]
其次,使用基于萤光素酶的adcc报告分析,如实施例15所述,评估人源化抗cd138抗体变体3821、4321、4320、4521、4326和3820对u266、mm1.s、lp-1和rpmi 8226cd138
多发性骨髓瘤细胞系的adcc活性。cd138 靶细胞与抗cd138抗体一起孵育,这些抗体从10μg/ml的浓度开始连续稀释3倍,然后以一定的效应物与靶细胞的细胞比率(e∶t为10∶1)添加到fcγriiia效应细胞中。在37℃下培养16小时后,细胞萤光素酶水平被定量为adcc活性的量度,并报告为相对发光单位(rlu)。如图4a-4d所示,人源化抗cd138抗体变体在四种多发性骨髓瘤细胞系中均诱导adcc活性。
[0874]
实施例3:抗cd138抗体的体内疗效研究
[0875]
在本实施例中,使用小鼠异种移植多发性骨髓瘤模型评估单克隆抗cd138抗体2810的体内疗效。简而言之,mab 2810的体内疗效是在cb17scid小鼠中的mm1.s扩散模型中确定的。4-6周龄小鼠在第0天静脉注射5.00e 06的mm1.s细胞,并在使两组之间的肿瘤体积标准化后在第14天分期给药(每组n=8只动物)。以4.0mg/kg剂量水平腹腔注射单克隆抗体2810(q3dx2;隔3天)四次,并通过每周一次的生物发光评估肿瘤体积。图5a-5b显示了在所示特定时间点通过ivis成像确定的肿瘤平均bli
±
sem(图5a),比较了载剂组和mab2810组中个体小鼠的肿瘤生长情况(图5b)。还测试了抗cd138抗体治疗对减少骨骼组织中骨髓瘤肿瘤负荷的作用。两组在安乐死后第42天对脊柱和后肢的离体成像肿瘤的肿瘤体积进行定量(分别为图5c和5d)。
[0876]
实施例4.人源化抗cd138抗体的体内疗效研究
[0877]
在本实施例中,使用类似实施例3所述的小鼠异种移植多发性骨髓瘤模型,使用萤光素酶表达的人多发性骨髓瘤细胞系mm1.s(luc)的生物发光成像(bli),评估人源化单克隆抗cd138抗体mab 4320和2810的体内疗效。生物发光成像(bli)允许无创测定局部肿瘤负荷。全身注射d-荧光素后,肿瘤发出的光的数量被校准,以与活的肿瘤负荷相关。5-6周龄小鼠在第0天静脉注射5.0e 06台盼排除mm1.s(luc)细胞,并且在bli设定为2.39e 07p/s(组平均值范围为2.35-2.43e 07p/s)的组间肿瘤体积标准化后在第14天分期给药。分配小鼠
(每组n=8只)以确保所有组的平均全身肿瘤负荷在研究人群整体平均全身肿瘤负荷的10%以内。在本研究中,在第14、21、28、35和42天采集体内bli图像。
[0878]
每周腹腔注射抗cd138抗体两次(q3dx2;隔3天),持续五周。研究组包括载剂(pbs),同样通过腹腔注射(0.2ml)每周给药两次。mab 2810的单剂量水平为4.0mg/kg,而人源化mab 4320的剂量为4、8或16mg/kg。bli使用ivis luminas5(帕金埃尔默公司(perkinelmer),马塞诸塞州)进行。在1-2%异氟醚气体麻醉下,每次对动物进行成像,一次五只。给每只小鼠ip注射150mg/kg(15mg/ml)d-荧光素,并在注射10分钟后在俯卧位和仰卧位成像。使用了大尺寸的ccd芯片,并调整了曝光时间(5秒到2分钟),以获得每张图像至少几百个计数,并避免ccd芯片饱和。
[0879]
使用living image4.3.1(帕金埃尔默公司(perkinelmer),马塞诸塞州)软件对图像进行分析。将每只动物个体的全身固定量感兴趣区域放置在俯卧和仰卧图像上,并根据动物识别进行标记。将俯卧位和仰卧位图像相加,以估计全身肿瘤负荷。
[0880]
图6a-6b总结了在特定时间点和所示剂量水平下,通过ivis成像定量播散性多发性骨髓瘤的平均bli
±
标准误差。根据统计分析(p<0.001,双向anova),与仅接受载剂的对照组动物相比,观察用抗体mab 4320治疗的疗效。即使在最高剂量水平为16mg/kg的情况下,使用mab4320治疗也没有表现出剂量依赖性,这表明在本研究中,在4mg/kg的剂量下有足够的暴露。在该分析中,与小鼠-人嵌合抗cd138抗体mab 2810相比,使用人源化抗cd138抗体mab 4320治疗明显降低肿瘤负荷并提高疗效。在载剂,人源化抗cd138抗体mab 4320和小鼠嵌合抗cd138 mab 2810治疗组中,个体小鼠全身肿瘤负荷的比较示于图6b。图6c总结了载剂组动物与用抗cd138抗体mab 2810和4320治疗的动物的存活百分比。存活率或存活百分比界定为存活到与疾病相关的发病率相关的预定安乐死标准(定义为体重减轻超过20%,中枢神经系统功能严重受损或运动严重受损或翻正反射丧失)的小鼠。与载剂对照组相比,基于使用人源化抗cd138 mab 4320治疗动物,建立了治疗疗效的相关方面,如延长寿命、总体存活率和评估时间(定义为达到1.00e 09p/s bli单位肿瘤负荷的时间)。
[0881]
实施例5.人源化抗cd138抗体的生物物理和药代动力学性质评价
[0882]
用于确定抗体热稳定性的差示扫描量热法荧光测定
[0883]
热稳定性代表抗体的一个重要属性,并根据以差示热熔解曲线为特征的相对稳定性曲线,被用作人类药物稳定性的预测替代物。有几种基于热熔解的产品稳定性评估方法。其中包括圆二色性(cd)、差示扫描量热法(dsc)和差示扫描荧光法(dsf)等。在本实施例中,通过dsf评价选定的人源化抗cd138抗体的热稳定性。dsf用于监测蛋白质在不断增加的热应力下的构象稳定性。染料sypro在疏水环境中发出荧光,例如在热触发蛋白质去折叠或变性过程中暴露的疏水核心残基。简而言之,橙色染料(西格玛化学公司(sigma chemical))在ph值为7.4的磷酸盐缓冲盐水(pbs)中以1∶500的比例稀释,不添加任何洗涤剂。同样,将抗体在pbs中稀释至0.5mg/ml的目标浓度。将15μl稀释抗体和荧光染料以1∶1(v/v)的比例添加到96孔微量滴定板中,并通过重复移液彻底混合。使用具有荧光检测功能的实时定量pcr(qpcr)热循环仪进行热扫描。扫描在25℃下开始。井温从25℃上升到95℃,每分钟上升1℃。自然状态和第一次展开事件之间的中点(tm)被报告为转变温度或熔体温度(tm)。然后使用荧光信号随时间的一阶导数(d荧光/d时间),根据数据转换计算tm(图7)。这些分析通常会导致两种热转变,分别报告为tm1和t
m 2,并分别对应于fab和igg fc结
构域的局部变性(表4)。
[0884]
表4.通过dsf测量的示例性抗cd138单克隆抗体的热稳定性
[0885]
抗体id批号tm1(℃)tm2(℃)2810901461.9
‑‑
3821876369.177.74320901368.977.74321876669.376.9
[0886]
转基因tg276小鼠中的抗体药代动力学
[0887]
除了在人源化mab 2810的过程中观察到的抗cd138抗体的相对热稳定性的变化外,治疗性抗体的生物物理性质的改善也可导致体内性质的改善,例如药代动力学(pk)。在本实施例中,在使用人类fcrn转基因小鼠品系(tg276)的小鼠中评价了8种人源化抗cd138抗体的相对血清滴度曲线。这种转基因小鼠模型被描述为基于人类fcrn的转基因表达预测抗体pk曲线的合理替代物,该受体通过受体介导的再循环关键性地促进抗体半衰期延长。它至少可以作为一种有价值的体内工具,用于评估在这种模型中相对测量的各种抗体的相对pk特性。
[0888]
在本实施例中,人源化cd138抗体在hek 293(expi 293,赛默飞世尔科技公司(thermo fisher scientific))中产生,包括诱饵底物2-脱氧-2-氟-1-岩藻糖(2ff),以大幅降低核心岩藻糖基化,如实施例1所述。抗rsv单克隆抗体莫维珠单抗(mvz)和亲本抗cd138抗体mab 2810用于比较目的。mvz在hek 293中单独生产,不包含2ff,产生正常岩藻糖基化的fc聚糖。抗体通过尾静脉注射进行静脉给予。实验设计包括50μg剂量水平(约2.5mg/kg),3只小鼠/组。使用标准方案处理血清样品,然后间隔约1小时和65小时采集血液。随后使用人igg定量elisa试剂盒(bethyl labs)通过elisa对人igg的血清水平进行定量,该试剂盒包括亲和纯化的山羊抗人igg-fc涂层抗体(用于捕获)和用于人igg fc检测的hrp偶联山羊二抗人igg抗体。使用人类参考血清进行定量,并作为分析对照。65小时时的血清抗体水平针对第一个1小时的时间点进行标准化,并根据od值报告为剩余抗体的百分比(图8)。基于该分析,在试验条件下,检测到的人源化抗cd138 mab 4320的浓度约为亲本抗体mab 2810的2倍。
[0889]
中国仓鼠卵巢细胞系中抗体产生滴度
[0890]
除了不同的热稳定性和pk谱,抗cd138抗体mab 2810(非人源化)和mab 4320(人源化)在cho细胞中产生时表现出不同的产生滴度。表5列出了两种抗体产量的比较评估。产量代表在相同的转染条件和培养规模下,通过蛋白a亲和层析从细胞培养基中纯化后的抗体量。也注意到基于培养基中抗体的蛋白质-a生物传感器(生物层干涉法)定量的差异预纯化滴度,同样表明不同的表达水平(抗体滴度)。
[0891]
表5.抗cd138抗体的表达水平
[0892]
抗体id批号表达(mg/l)43209013106.42810901430.2
[0893]
实施例6:抗cd138抗体的比较cd138结合和效应物功能的研究
[0894]
结合至cd138 多发性骨髓瘤细胞系u266上表达的膜cd138的抗体
[0895]
将人源化抗cd138抗体4320与本文用作参考的特征良好的抗cd138单克隆抗体bb4进行比较。在一个实验中,评估了人源化抗cd138 mab 4320和bb4与cd138 人淋巴母细胞性骨髓瘤细胞系u266表面上cd138结合的相对能力,并使用实施例1所述的方法通过流式细胞术进行定量。抗体-细胞结合以几何平均荧光强度(mfi)报告。使用非线性回归分析和4参数曲线拟合绘制结合数据。如图9a所示,两种抗cd138抗体均显示出与cd138 多发性骨髓瘤细胞的剂量依赖性结合,基于相似的ec
50
值,具有相当的结合亲和力。根据最大mfi值,mab 4320与膜相关cd138的总细胞表面结合比抗体bb4高约25%,如在本试验中同时测量。
[0896]
adcc生物测定
[0897]
虽然基于流式细胞术的细胞表面染色,mab4320和bb4似乎具有相似的cd138结合谱,但与mab 2810相比,基于bb4各自的生物活性和特性,预测两种抗体的表位接合是不同的。在本实验中,评价了mab 4320和bb4的相对抗体依赖性细胞毒性(adcc)活性。简而言之,在基于萤光素酶的adcc报告试验中,使用稳定转染人fcγriiia受体的工程jurkat细胞作为效应细胞,评价两种抗体对cd138 人淋巴母细胞性骨髓瘤u266细胞的adcc活性,如实施例1所述。图9b总结了这种比较,数据标准化为相对于负抗体对照的adcc活性的倍数诱导。人源化抗cd138抗体mab 4320诱导大量adcc活性;相比之下,抗cd138抗体bb4仅在测试的最高抗体浓度下表现出适度的adcc活性。这些数据表明这两种抗cd138抗体的明显差异化的fc效应物介导的活性,但也指向这些抗体的差异化表位和副表位-靶接合模式,预期这可能会影响这种活性。
[0898]
与cd138胞外结构域和衍生肽的结合
[0899]
在本实验中,通过抗原捕获elisa评价mab 4320和bb4与可溶性人cd138的胞外结构域的结合,该结构域具有氨基酸18-251、seq id no.1或选择性人cd138衍生肽(表3)的序列。简而言之,在2-8℃下,maxisorp
tm
板首先用浓度为0.5μg/m1的抗体4320或bb4包被过夜(12-15小时)。从50nm浓度开始,以5倍系列抗原稀释液测试固定化单克隆抗体与生物素化重组cd138胞外结构域或肽2a、肽6a的结合。使用hrp偶联的抗生物素二抗(1∶10000稀释度)进行检测。如图10所示,基于结合ec50值,抗体4320和参考抗体bb4都能够以明显的亚纳摩尔亲和力结合到cd138胞外结构域;与bb4相比,显示mab 4320的结合亲和力高出约6倍。还注意到与cd138衍生肽的差异结合。mab 4320与肽2a结合,其亲和力显著高于评价的较高浓度下检测到的对于肽6a的亲和力。相比之下,bb4与肽2a结合的亲和力低于mab4320所测量的亲和力;在任何肽浓度下均未观察到bb4参考抗体与肽6a的结合。这些数据证实了两种抗体的一组不同表位,并进一步表明,这些表位差异影响了adcc生物测定所测得的各自fc效应物功能。这些数据还表明,mab 4320表位至少与cd138内的两个肽区对应,包括膜近端区域。
[0900]
实施例7:多发性骨髓瘤的小鼠异种移植模型中抗cd138疗效的评价
[0901]
本实施例描述了在c.b-17scid小鼠中的播散性多发性骨髓瘤人类异种移植模型中,对剂量递增的示例性人源化抗cd138抗体分子mab4320进行的体内评价。基于先前的研究和历史数据,将亲代抗cd138单克隆抗体2810(鼠-人嵌合体和人源化mab 4320的前身)以单剂量水平纳入本次评估,以进行比较,并用作阳性对照。这项研究的结果表明,与载剂对照相比,以人cd138为靶点的mab 4320是一种减少疾病发生的有效治疗方法,并基于多个终点,包括减少中位肿瘤负荷(播散性和组织定位),肿瘤生长延迟和总体生存率,通过根据预
定标准导致安乐死的疾病相关发病率来衡量。对临床和尸检结果的分析表明,mab 4320和对照组出现了相同的显性骨髓瘤诱发发病率,但疾病进展速率存在显著差异。这一观察结果与mab 4320的耐受性一致。在生物效价方面普遍缺乏剂量反应,结合测定的mab 4320血清滴度(pk分析),进一步表明在研究的最低剂量水平下有足够的暴露。这些数据还表明,人源化mab 4320的生物活性相比其衍生来源的亲本小鼠抗体(mab 2810)有所提高。
[0902]
方法
[0903]
mab 4320的产生
[0904]
本文描述了抗cd138抗体mab 4320的发现和人源化。简言之,通过鉴定小鼠可变重(vh)和可变轻(vl)序列附近的人类种系来进行人源化。一旦确定,使用结构导向设计将来自亲本小鼠衍生的mab2810的互补决定区(cdr)分别移植到人类vh和vl种系模板上。基于对结构模型的目视检查,选择性地引入了附加的突变(包括小鼠mab中亲本残基的回复突变)。所得的结构(包括mab 4320)被设计为相比功能性人类种系的变化数量最少,以最接近人类源性抗体。亲本mab2810的人源化以保留(或改善)mab 2810的抗体特性为目的,这些特性涉及但不限于靶结合、效应物功能、细胞毒性和表位接合。
[0905]
mab 4320是通过分别编码重链(hc)和轻链(lc)的两种哺乳动物表达载体的瞬时共转染产生的,用于在中国仓鼠卵巢细胞(expicho,赛默飞世尔科技公司(thermo fisher scientific))中产生全长人igg1κ抗体。dna转染使用基于脂质的转染试剂(例如expifectamine cho转染试剂盒,赛默飞世尔科技公司)和制造商建议的标准方案进行。mab 4320是在细胞培养条件下产生的,旨在减少天冬酰胺297处相应n-聚糖中的核心岩藻糖,并最终用于进一步增强fc介导的adcc活性。通过使用诱饵底物2-脱氧-2-氟-1-岩藻糖(2ff),在瞬时转染后4小时,以0.15mm同时添加到培养基中,在代谢上实现了大幅降低的核心岩藻糖基化。在不补充进料的情况下,在600ml细胞培养规模的摇瓶中进行细胞培养,时间为7-10天。随后使用快速蛋白液相色谱(fplc)上的蛋白a亲和捕获从细胞培养基中纯化分泌的单克隆抗体。亲本抗cd138mab 2810是使用相同的细胞培养策略和纯化流程并行产生的。两种抗体均在ph值为7.4的磷酸盐缓冲盐水中配制。通过流式细胞术评价所有抗体与淋巴母细胞瘤和多发性骨髓瘤相关细胞系(包括mm1.s、rpmi8226、lp-1和u266)的结合。在基于萤光素酶的adcc报告试验中,使用稳定转染人类fcγriiia受体的工程化jurkat细胞(普洛麦格集团(promega corporation)),评价抗体对cd138
人类淋巴母细胞性骨髓瘤u266细胞的adcc活性。所有抗体在被认为可在小鼠体内使用之前,还进行了内毒素和外来剂测试。
[0906]
mm.1s luc异种多发性骨髓瘤模型
[0907]
使用涉及通过c.b-17scid小鼠体内静脉注射植入骨髓瘤细胞系mm.1s播散的小鼠异种移植多发性骨髓瘤模型,评估人源化抗cd138 mab 4320和亲本小鼠/人嵌合抗体mab 2810的体内疗效。实验设计的概要如图11所示。基于保留与抗体作用机制相关的先天免疫方面,即抗体靶向cd138阳性mm细胞的nk细胞介导的细胞毒性选择c.b-17小鼠。注意到小鼠nk细胞与人类fc交叉结合的能力,尽管亲和力较低。表达萤光素酶的人多发性骨髓瘤细胞系mm1.s(luc)的全生物发光成像(bli)用于非侵入性定量特定部位的疾病负荷、疾病进展和治疗效益。全身注射d-荧光素后,肿瘤发出的光的数量被校准,以与活的肿瘤负荷相关。
[0908]
5-6周龄小鼠在第0天静脉注射5.0x106活(台盼排除)mm1.s(luc)细胞,并且在bli设定为2.39x107光子/秒(组平均值范围为2.35-2.43x107p/s)的组间肿瘤体积标准化后在
第14天分期给药。分配小鼠(每组n=8只)以确保所有组的平均全身肿瘤负荷在研究人群整体平均全身肿瘤负荷的10%以内。
[0909]
每周腹腔给予抗cd138抗体两次(2qw),持续五周。治疗天数(相对于mm1.s(luc)细胞输注的天数)为第14、17、21、24、28、31、35、38、42和45天(适用于仍在研究中的动物)。研究组包括载剂(pbs),同样通过腹腔注射(0.2ml/20g)每周给药两次。mab 2810的单剂量水平为4.0mg/kg,而人源化mab 4320的剂量为4、8和16mg/kg。bli使用ivis lumina s5(帕金埃尔默公司(perkinelmer),马塞诸塞州)进行。每周给动物成像一次,共4张图像(在第14天、第21天、第28天和第35天分期)。在1-2%异氟醚气体麻醉下,每次对动物进行成像,一次5只小鼠。给每只小鼠ip注射150mg/kg(15mg/ml)d-荧光素,并在注射10分钟后在俯卧位和仰卧位成像。使用了大尺寸的ccd芯片,并调整了曝光时间(5秒到2分钟),以获得每张图像至少几百个计数,并避免ccd芯片饱和。
[0910]
使用living image 4.3.1(帕金埃尔默公司(perkinelmer),马塞诸塞州)软件对图像进行分析。将每只动物的全身固定体积感兴趣区域放置在俯卧和仰卧图像上,并根据动物识别标记。将俯卧位和仰卧位图像相加,以估计全身肿瘤负荷(bli)。
[0911]
其他测量包括体重(每周3次)、每日临床观察和安乐死后尸检(根据预定标准或第59天研究结束)。安乐死标准与疾病进展相关,包括体重减轻20%以上或疾病相关的发病率,如后肢瘫痪、感觉异常或其他严重中枢神经系统或肌肉骨骼损伤的迹象。
[0912]
主要和次要疗效终点使用体内全身bli生成,包括定义为t/c百分比的肿瘤负荷(其中t=治疗组,c=载剂对照),在每个成像日测量,并在第35天报告,以及在bli信号为1.0x109p/s的情况下,作为肿瘤负荷时间测量的肿瘤生长延迟。
[0913]
其他疗效终点包括生存率(中位寿命)也根据发病率标准化至载剂对照(增加寿命%),并根据治疗的第一天而不是植入的那天进行计算。
[0914]
抗体药代动力学(pk)
[0915]
从第一次给药第15天之前的第14天、第一次给药第20天之后的24小时、第三次给药第27天之前、第五次给药之前和第34天、第七次给药之前(如适用)开始,每周对每组4只小鼠进行非终末血样采集。选择每周取样的动物在每组动物1-4和5-8之间交替,以符合每只动物两周的出血时间表。通过眼眶后穿刺收集100微升全血并处理成血清,通过elisa测定人类抗体滴度。根据制造商的建议,使用bethyl labs的人igg定量elisa试剂盒(目录号e80-104)在小鼠血清中测量人igg1抗体滴度,并根据需要进行修改。根据需要,将血清从1:50-1:1350稀释,以符合分析线性和定量(loq)的预设限值。抗体浓度使用试剂盒中提供的两种经验证的人类ig标准品以及纯化的mab 4320进行外推,以进行比较。两种定量方法都可以计算出可比的抗体血清学滴度。
[0916]
结果
[0917]
疗效
[0918]
根据先前从体内研究收集的模型数据,肿瘤生长符合历史标准(td范围:1.5-2.2天)。该实验在技术上被认为是令人满意的,并且数据适合于评估。疗效数据总结如图12所示(全身bli的平均值
±
sem)。图13显示了相应的个体动物数据(以包含最小-最大值的框图和须图表示)。代表性图像(对应于第35天最接近bli中值的小鼠)如图14所示。
[0919]
基于这些数据,与载剂对照组相比,向动物给予mab 4320显示出明显的治疗效益,
4320治疗有效地降低了疾病负荷,这可以通过延长评估时间(肿瘤生长延迟)、延长中位生存期以及相关骨骼组织中播散性肿瘤的明显减少来证明。在评价的三个剂量水平(4-16mg/kg)下,未观察到关于mab 4320疗效的明确剂量反应。这些发现结果,结合观察到的与血清抗体水平(pk)有关的线性剂量反应,表明mab 4320在评价的最低剂量水平(4mg/kg)下的充分暴露,以实现生物反应。较低的剂量水平也可能足以应对这种反应。
[0930]
根据对载剂对照组中疾病相关发病的类似观察,给予mab 4320似乎耐受性良好,没有明显的治疗相关发病或毒性。这种特定模型在人类免疫反应(例如,人类对比小鼠fcγ受体)的完全复制方面的局限性可能会影响mab 4320基于免疫的作用机制的最大功效,从而导致细胞介导的细胞毒性(adcc),使得这种比较不切实际。
[0931]
综上所述,本研究的阳性疗效数据既验证了以cd138为靶点的抗体策略,也验证了基于免疫的恶性浆细胞杀伤机制的有效性。这些结果进一步支持mab 4320作为治疗多发性骨髓瘤和其他与cd138有关的适应症的药物。
[0932]
实施例8:在多发性骨髓瘤的小鼠异种模型中评估作为单一药物或与硼替佐米组合的抗cd138疗效
[0933]
本实施例总结了示例性的人源化抗cd138抗体分子mab 4320在mm1.s多发性骨髓瘤异种移植模型中的体内疗效评估,既可作为单药治疗,也可与蛋白酶体抑制剂(硼替佐米)联合使用。在这里,在接受mab 4320单药治疗的动物中,疾病(播散性肿瘤负担)得到了有效的减少,导致选择动物完全消退(22%),表明与未经治疗的动物相比肿瘤生长延迟和明显的生存益处(>50%)。mab 4320与硼替佐米的联合使用产生了附加的和示范性的疗效,这一点在几乎所有接受治疗的动物都得到了完全缓解,从而导致无瘤生存(tfs)和基于肿瘤成像的最小残留疾病(mrd)的明显表现所证明。此外,mab 4320与硼替佐米联合使用可使患者在74天内100%存活,这与基于主要疗效数据的mrd观察结果一致。即使在这种攻击性模型中,mab 4320单独或与硼替佐米联合治疗中断三周后,仍能观察到这种持续有效性。mab 4320耐受性良好,无论是作为单一疗法还是与硼替佐米联合使用,均未观察到与治疗相关的死亡。相比之下,单独使用硼替佐米会导致与治疗相关的毒性,需要减少初始剂量。纳入mab 4320有效地挽救了较低剂量硼替佐米的疗效和毒性,从而扩大了这种联合治疗的治疗窗口。
[0934]
方法
[0935]
mab 4320的产生
[0936]
简而言之,人源化基于亲本小鼠源性mab 2810。所得的人源化抗体(mab 4320)设计为相对于功能性人类种系的变化数量最少以最接近人类衍生抗体,以降低免疫原性,同时保留或改善亲本mab 2810的抗体特性。mab 4320通过瞬时载体转染中国仓鼠卵巢细胞产生(expicho,赛默飞世尔科技公司(thermo fisher scientific))。在不补充进料的情况下,在600ml细胞培养规模的摇瓶中进行细胞培养,时间为7天。mab 4320是在细胞培养条件下产生的,旨在最少化天冬酰胺297处相应n-聚糖中的核心岩藻糖,并最终用于进一步增强fc介导的adcc活性,如之前所述。随后使用快速蛋白液相色谱(fplc)上的蛋白a亲和捕获从细胞培养基中纯化分泌的单克隆抗体。在基于萤光素酶的adcc报告试验中,使用稳定转染人类fcγriiia受体的工程化jurkat细胞(普洛麦格集团(promega corporation)),功能上评价纯化的mab 4320对cd138
人类淋巴母细胞性骨髓瘤u266细胞的adcc活性。mab 4320在
被认为可在小鼠体内使用之前,还进行了内毒素和外来剂测试。
[0937]
mm.1s萤光素酶异种多发性骨髓瘤模型
[0938]
使用涉及通过c.b-17scid小鼠体内静脉注射植入骨髓瘤细胞系mm.1s播散的小鼠异种移植多发性骨髓瘤模型,评估人源化抗cd138 mab4320和硼替佐米(作为单药或联合用药)的体内疗效,通常如之前所述,但有一些修改。5-7周龄雌性c.b-17scid小鼠(c.b-17/icrhsd-prkdc
scid
)在第0天静脉注射5.0x106活(台盼排除)mm1.s(luc)细胞,并且在bli设定为2.90x106光子/秒(组平均值范围为2.81-3.07x106p/s)的基线肿瘤负荷标准化后在第14天分期给药治疗。分配小鼠(每组n=9只)以确保所有组的平均全身肿瘤负荷在研究人群整体平均全身肿瘤负荷的10%以内。在肿瘤植入后第14天开始治疗。载剂(pbs)每天灌胃一次(0.2m1/20g);每周两次腹腔注射mab 4320(4mg/kg)和硼替佐米(1mg/kg),持续52天。硼替佐米单药治疗组和与mab 4320联合使用的动物最初以2mg/kg的硼替佐米剂量水平进行治疗,但由于观察到的毒性(体重变化),包括仅硼替佐米治疗组中一只研究动物在一剂给药后死亡,该剂量在第18天降低至1mg/kg。所有组在第53天停止治疗;存活的动物再进行3周的监测直至第73天(研究的中止阶段)。
[0939]
用生物发光法监测全身肿瘤负荷。表达萤光素酶的mm1.s(luc)人类mm肿瘤细胞系的生物发光成像(bli)也可以无创测定局部肿瘤负荷。bli使用ivis lumina s5(帕金埃尔默公司(perkinelmer),马塞诸塞州)进行。在1-2%异氟醚气体麻醉下,每次对动物进行5次成像。给每只小鼠ip注射150mg/kg(15mg/ml)在注射用盐水中配制的d-荧光素(普洛麦格公司(promega),批号0000307215),并在注射10分钟后在俯卧位和仰卧位成像。使用了大尺寸的ccd芯片,并调整了曝光时间(5秒到2分钟),以获得每张图像至少几百个计数,并避免ccd芯片饱和。在分期时每周给动物成像一次,在第14天、21天、29天、36天、43天、53天和73天(研究结束)对所有剩余的研究动物成像一次。使用living image 4.7.1(帕金埃尔默公司(perkinelmer),马塞诸塞州)软件对图像进行分析。将每只动物的全身固定体积感兴趣区域(roi)放置在俯卧和仰卧图像上,并根据动物识别标记。计算并导出所有roi的总通量(光子/秒),以便于组间分析。将俯卧位和仰卧位roi相加,以估计全身肿瘤负荷。还将对象roi放置在每只小鼠上,并将特定区域的roi放置在每只动物的脊柱和后肢上。这些roi然后独立于全身roi进行定量,以便仅计算来自后肢或脊柱的信号。
[0940]
主要和次要疗效终点使用体内全身bli生成,包括本文所述的肿瘤负荷评估。终点包括在每个成像日测量并在第36天报告的全身bli比率t/c(其中t=治疗组和c=载剂对照),以及肿瘤生长延迟(测量为达到预定为1.0x109p/s的bli信号的肿瘤负荷的时间)。其他疗效终点包括肿瘤消退、无瘤生存率(tfs),标准化至载剂对照的中位寿命(增加寿命%);后一个终点是根据治疗的第一天计算的,而不是植入的那天。根据研究中剩余的动物计算总存活率。
[0941]
其他测量包括体重(每周3次)、每日临床观察和安乐死后尸检。预定的安乐死标准与疾病进展相关,包括体重减轻20%以上或疾病相关的发病率,如后肢瘫痪、感觉异常或其他严重中枢神经系统或肌肉骨骼损伤的迹象。
[0942]
结果
[0943]
mab 4320/cd138结合测定和mm1.s细胞培养分析
[0944]
作为验证性分析,在植入cb.17scid小鼠之前,通过流式细胞术评价该异种移植模
型中使用的人类mm1.s(1uc)细胞系的cd138靶表达水平和mab 4320结合。如本文所述,异种移植研究包括开始治疗前的两周分期阶段和六周给药阶段,然后是仍在研究中的动物的三周中止阶段。mab 4320在2.5μg/ml的浓度下表现出强健且可饱和的结合,超过96%的活细胞对mab 4320呈阳性染色,且相应的mfi值指示cd138的高表达水平(例如,相对于cd38或本文所述的阴性对照)。
[0945]
疗效
[0946]
在治疗的第一天,实验中所有组的平均估计肿瘤负荷为2.90x106p/s,实验中所有组均匹配良好(组平均值范围为2.81-2.98x106p/s)。开始治疗时,所有动物的体重至少为14.3克。第一次治疗时的平均组体重也很匹配(组平均值范围为18.3-19.2g)。本研究的bli背景信号以7.20x105p/s测量。选择1.00x109p/s的肿瘤负荷,通过肿瘤生长延迟来评估疗效。图18和图19总结了基于bli成像的疗效数据。生存数据(kaplan-meier曲线)如图20所示。
[0947]
对照组
[0948]
对照组的中值寿命为30天。在载剂对照组(vc)中没有出现自发缓解。vc组的肿瘤生长符合历史标准(肿瘤倍增时间范围:1.5-2.2天)。该实验在技术上被认为是令人满意的,并且数据适合于评估。在vc组,评估肿瘤大小的中位时间为28.2天,肿瘤体积倍增的中位时间为2.1天。vc组的所有动物在第51天停止研究。
[0949]
mab 4320单药治疗
[0950]
在给药剂量水平下,mab 4320单药治疗可使动物寿命延长100.0%以上,肿瘤生长延迟13.9天,在给药阶段结束时,完全或部分缓解的发生率为22%。然而,根据获得的bli图像,在选定的小鼠中,肿瘤负荷明显减轻。在研究期间(第73天),有5/9只动物(56%)仍在研究中。尽管在第53天三周前停止治疗,但仍观察到明显的存活益处。未观察到mab 4320单一疗法的治疗相关死亡。这些数据证实,在接受mab 4320单一疗法的动物中,疾病有效减少,在一些动物中观察到部分缓解。
[0951]
硼替佐米单药治疗
[0952]
与载剂对照组相比,按所选剂量水平给予硼替佐米在降低肿瘤负荷和疾病进展动力学方面具有疗效。硼替佐米治疗的小鼠肿瘤生长延迟10.6天,寿命延长40%。没有一只动物表现出部分或完全缓解,也没有一只动物存活到研究第73天结束。如上所述,一只动物在初始给药阶段早期被处死。
[0953]
mab 4320和硼替佐米联合治疗
[0954]
与mab 4320或硼替佐米作为单一药物相比,mab 4320和硼替佐米联合治疗肿瘤植入小鼠的疗效最明显。mab 4320与硼替佐米联合使用可导致完全缓解,并显示最小残留疾病(mrd)。从所有终点来看,这一证明性疗效是明显的,包括肿瘤生长延迟(大于44.8天,是研究终止时计算的最大值)、寿命延长超过100%以及100%的生存效益(所有动物在整个研究期间仍在研究中)。根据这一疗效曲线,这一生存益处可能会在第73天终止研究后出现。这一组合还产生了100%的完全疾病缓解发生率,以及在研究终止时超过55%的无肿瘤生存率的保守计算。tfs可能大大高于保守计算,技术上是基于在肿瘤植入前测量的野生型(未处理)cb.17只小鼠中非常低的bli信号计算的,并用于设定非常低的无病基线。这一数字更可能接近100%(见图18和图19d),与计算的100%cr一致。即使在肿瘤植入后第53天停止治疗,通过联合使用mab 4320和硼替佐米获得的治疗效果也非常有效地维持。未观察到
mab 4320联合硼替佐米的治疗相关死亡。
[0955]
耐受性
[0956]
用mab 4320治疗似乎耐受性很好。没有与任何感染、采样或创伤或其他明显与疾病无关的症状相关的死亡报告。在治疗的第一周,体重的减轻是最小的,平均体重变化也是最小的(通常<5%)(图21)。与治疗相关的最大体重减轻发生在载剂对照组(vc),表明疾病进展是体重减轻的主要原因。尽管由于疾病进展,预期体重会下降,但使用4mg/kg mab 4320治疗的动物平均实际上体重呈上升趋势。在任何mab 4320治疗组中均未报告动物死亡。由于抗体治疗组的大多数临床症状和尸检结果与对照组相匹配,疾病进展的因果关系,而不是治疗,应被最合理地视为发病的主要原因。本研究中未观察到任何迹象表明给予mab 4320会对小鼠产生不利影响。
[0957]
相比之下,在最初接受2mg/kg剂量水平的硼替佐米的两组(3和7)中观察到治疗相关的毒性。这些组中的几只硼替佐米治疗的动物在给药的第一周出现了更大的体重减轻(相对于载剂对照);与这种毒性有关,硼替佐米单一治疗组(第3组)因在体重迅速下降(-24%)后在第23天早期处死而导致11%的相关死亡。从第18天开始,所有接受该治疗的动物的硼替佐米剂量水平从2mg/kg降至1mg/kg是值得的。值得注意的是,这些动物在减少该剂量后体重变化方面部分恢复,但主要是在第7组中,其中接受1mg/kg硼替佐米的小鼠也接受了4mg/kg剂量水平的mab 4320。
[0958]
总结
[0959]
该实施例证明了mab 4320在小鼠多发性骨髓瘤异种移植模型中的体内疗效,mab 4320是一种靶向人cd138(syndecan-1)的人源化单克隆抗体。在此,对mab 4320作为单一药物或与硼替佐米联合使用的疗效进行了评价,硼替佐米是一种蛋白酶体抑制剂,目前被批准用于治疗骨髓瘤,并构成临床实践中的护理标准(通常与地塞米松和免疫调节药物如来那度胺或波马度胺联合使用)。4mg/kg剂量的mab 4320单一疗法有效地降低了疾病负荷,这可以通过延长评估时间(肿瘤生长延迟)、大于100%的延长中位生存期以及相关骨骼组织中播散性肿瘤的明显减少来证明。在评价至第53天(给药的最后一天)和选择的剂量水平下,mab 4320治疗还导致一个亚组的小鼠的疾病缓解。先前研究中对mab 4320pk/pd相关性的评价表明,在该剂量水平(4mg/kg)下,mab 4320的暴露足以实现生物反应。在不希望受到理论约束的情况下,相信在一个实施方式中,甚至更低的剂量水平也足以实现这种反应。
[0960]
根据对载剂对照组中疾病相关发病的类似观察,给予mab 4320耐受性良好,没有明显的治疗相关发病或毒性。
[0961]
还对mab 4320与硼替佐米联合治疗进行了评价。选择次优剂量水平(1mg/kg)是因为观察到的毒性,如以所选较高的2mg/kg剂量进行初始治疗后,一只动物的体重显著下降和死亡率。在这里,用mab 4320和硼替佐米联合治疗荷瘤小鼠,在第73天的研究结束前,所有动物的疾病完全缓解和100%存活率都显示出明显的疗效。即使在研究终止前三周的第53天停止治疗后,这种证明性疗效仍然持续。明显缺乏任何明显的肿瘤负荷表明,在接受两种联合治疗的动物中,残余疾病最小。此外,与两种单一疗法相比,mab 4320和硼替佐米联合使用的疗效有所提高,表明治疗(疗效)具有协同效应,而不是单纯的叠加效应。在较低的非限制性剂量下增加硼替佐米的活性也表明了挽救硼替佐米因为这种限制性毒性的治疗
益处,可用于改善骨髓瘤细胞的细胞毒性杀伤。
[0962]
综上所述,本研究的阳性功效数据既验证了以cd138为靶点的抗体策略,也验证了基于免疫的恶性浆细胞杀伤机制的有效性。这些结果进一步支持mab 4320作为治疗多发性骨髓瘤和其他与cd138有关的适应症的药物。也指出在治疗其他浆细胞紊乱和/或自身免疫性疾病时,作为单一治疗剂或与(免疫)蛋白酶体抑制剂联合使用mab 4320的附加用途。
[0963]
通过引用纳入
[0964]
本文提到的所有出版物、专利和登记号在此通过引用全文纳入本文,如同每个单独的出版物或专利被明确单独指明通过引用纳入。
[0965]
等同形式
[0966]
尽管讨论了本发明的具体实施方式,但以上说明书仅为说明性而非限制性的。本领域的技术人员阅读了本说明书和所附权利要求后将清楚了解本发明的许多变化。本发明的全部范围应该通过参考所附权利要求书连同其等同物的全部范围,以及说明书连同此类变化来确定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。