1.(相关申请)
2.本技术主张2019年11月25日向日本专利局申请的日本技术编号第2019-211990号的权益。出于所有目的,该日本技术以其申请文件(说明书、权利要求书、附图、说明书摘要)的全部在本说明书中公开的方式作为参照而引入本说明书。
3.本发明属于再生医疗的技术领域。本发明涉及在该技术领域中利用低分子化合物从体细胞制备褐色脂肪细胞的方法、以及通过所述制备方法制备的低分子化合物诱导性褐色脂肪细胞(cibas:chemical compound-induced brown adipocytes)。另外,本发明还涉及能够用于制备该褐色脂肪细胞的方法的诱导用培养基组合物。
背景技术:
4.近年来,正在积极地研究在不进行基因导入的情况下利用低分子化合物将成纤维细胞这样的体细胞直接转变为其它细胞的方法(直接重编程:direct reprogramming)。例如,在专利文献1中,将alk5抑制剂、alk6抑制剂等若干低分子化合物进行组合,在其存在下对体细胞、特别是人成纤维细胞进行培养,并从其直接诱导为褐色脂肪细胞等。如专利文献1的发明那样,如果能够利用容易获得的低分子化合物从普通的成纤维细胞直接诱导成褐色脂肪细胞等细胞,将会是非常有益的。例如,由于能够从自体的成纤维细胞简便地制备自体的其它细胞,因此提高了在再生医疗上的应用。另外,可以容易地制备作为用于新药开发的实验材料的细胞。
5.非专利文献1也与专利文献1同样,在若干低分子化合物的组合的存在下培养人皮肤成纤维细胞,由所述成纤维细胞直接诱导为褐色脂肪细胞。具体而言,在非专利文献1的发明中,在sb431542(alk5抑制剂)、ldn193189(alk2/3抑制剂)、dorsomorphin(alk2/3/6抑制剂)、毛喉素(camp诱导剂)、以及罗格列酮(pparγ激动剂)这样的低分子化合物的存在下培养人皮肤成纤维细胞,从所述成纤维细胞直接诱导为褐色脂肪细胞。专利文献1中也公开了所述低分子化合物的组合。
6.从上述这样的体细胞向褐色脂肪细胞等的分化诱导必须通过在包含其它的化合物、营养素等的培养基中进行培养而进行。作为该培养基,可以列举例如:作为通常的培养基的mem(最低必需培养基)、dmem(dulbecco’s modified eagle medium、dulbecco改良eagle培养基)、dmem/f12、或者对它们进行了改良而得到的培养基,它们是市售的。另外,通常考虑到待诱导的细胞而将适当的成分(血清、蛋白质、氨基酸、糖类、维生素类、脂肪酸类、抗生素等)适宜添加至这些培养基中进行细胞的分化诱导。其中,由于胎牛血清(fbs)这样的血清中包含激素、生长因子、粘附因子等细胞增殖所必需的成分,因此经常添加血清进行分化诱导。专利文献1、非专利文献1的发明也利用添加有fbs的培养基进行了分化诱导。
7.现有技术文献
8.专利文献
9.专利文献1:国际公开第2018/062269号
10.非专利文献
11.非专利文献1:takeda y.,harada y.,yoshikawa t.,and dai p.,sci.rep.,7,4304(2017)
技术实现要素:
12.发明要解决的课题
13.本发明的主要课题在于提供能够在不进行基因导入的情况下利用低分子化合物进行从体细胞向褐色脂肪细胞的直接转变或诱导的新的制造方法。另外,本发明还在于提供用于在低分子化合物的存在下培养体细胞并通过直接转变制备褐色脂肪细胞的新的组合物。
14.解决课题的方法
15.本发明人等进行了深入研究,结果发现,在无血清状态下利用一定的低分子化合物的组合可以解决上述课题,从而完成了本发明。
16.作为本发明,例如,可以举出下述发明。
17.[1]一种褐色脂肪细胞的制备方法,其是通过直接分化诱导而从体细胞制备褐色脂肪细胞的方法,该方法包括:
[0018]
在选择性pparγ激动剂及camp诱导剂的存在下,在无血清的分化诱导用培养基中对体细胞进行培养的工序。
[0019]
[2]根据上述[1]所述的褐色脂肪细胞的制备方法,其中,上述工序为进一步在bmp7的存在下对体细胞进行培养的工序。
[0020]
[3]根据上述[1]或[2]所述的褐色脂肪细胞的制备方法,其中,上述工序为进一步在alk2/3抑制剂及alk6抑制剂不存在的条件下对体细胞进行培养的工序。
[0021]
[4]根据上述[1]~[3]中任一项所述的褐色脂肪细胞的制备方法,其中,上述工序为进一步在alk5抑制剂不存在的条件下对体细胞进行培养的工序。
[0022]
[5]根据上述[1]~[4]中任一项所述的褐色脂肪细胞的制备方法,其中,选择性pparγ激动剂为罗格列酮,或者camp诱导剂为毛喉素。
[0023]
[6]根据上述[1]~[5]中任一项所述的褐色脂肪细胞的制备方法,其中,上述体细胞为成纤维细胞。
[0024]
[7]一种褐色脂肪细胞,其是由上述[1]~[6]中任一项所述的制备方法制备的。
[0025]
[8]一种分化诱导用组合物,其是用于通过直接分化诱导从体细胞制备褐色脂肪细胞的组合物,所述分化诱导用组合物包含选择性pparγ激动剂及camp诱导剂、且无血清。
[0026]
[9]根据上述[8]所述的分化诱导用组合物,其进一步包含bmp7。
[0027]
[10]根据上述[8]或[9]所述的分化诱导用组合物,其中,选择性pparγ激动剂为罗格列酮,或者camp诱导剂为毛喉素。
[0028]
[11]根据上述[8]~[10]中任一项所述的分化诱导用组合物,其中,上述体细胞为成纤维细胞。
[0029]
[12]一种筛选作用于褐色脂肪细胞的药剂的方法,其使用通过上述[1]~[6]中任一项所述的制备方法制备的褐色脂肪细胞、或上述[7]所述的褐色脂肪细胞。
[0030]
[13]一种评价因受试物质所引起的细胞的褐色化倾向的增强程度的方法,该方法
包括:
[0031]
对于通过权利要求[1]~[6]中任一项所述的制备方法制备的褐色脂肪细胞或其制备过程中的细胞、或权利要求[7]所述的褐色脂肪细胞添加受试物质,并评价该受试物质所引起的该细胞的褐色化倾向的增强程度。
[0032]
发明的效果
[0033]
根据本发明,可以在不进行基因导入的情况下,以无血清状态有效地进行从体细胞向褐色脂肪细胞的直接转变或直接分化诱导。由本发明得到的褐色脂肪细胞作为再生医疗、人褐色脂肪细胞模型等是有用的。
附图说明
[0034]
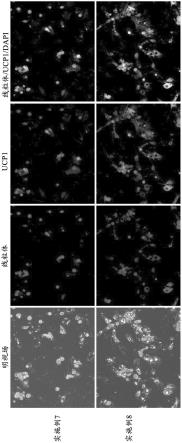
图1是培养细胞的照片、以及将该细胞的线粒体(红)、ucp1蛋白质(绿)及细胞核(蓝)进行免疫染色而得到的照片。由于图1是单色的,因此,虽然没有显示出红、绿及蓝的各种颜色,但在图1的原始照片中显示出各种颜色。上方4个图示出了实施例1的化合物的组合的结果,下方4个图示出了实施例2的化合物的组合的结果。
[0035]
图2示出了脂肪样细胞及ucp1阳性细胞的比例。左侧2个柱示出了实施例1的化合物的组合的结果,右侧2个柱示出了实施例2的化合物的组合的结果。在各实施例的结果中,左侧柱示出了脂肪样细胞的比例,右侧柱示出了ucp1阳性细胞的比例。纵轴示出了这些细胞相对于细胞核染色(dapi)阳性细胞的比例(%)。
[0036]
图3的a图示出了ucp1基因的表达量,b图示出了fabp4基因的表达量,c图示出了ucp1/fabp4之比,d图为对ucp1蛋白质进行定量的电泳照片。符号1表示比较例3(对照),符号2表示实施例1,符号3表示实施例2。纵轴表示该mrna量相对于内标基因(tbp)的mrna量的相对值。
[0037]
图4的左图示出了ucp1基因的表达量,右图为对ucp1蛋白质进行定量的电泳照片。符号1表示比较例3(对照),符号2表示实施例3,符号3表示实施例2。纵轴表示该mrna量相对于内标基因(tbp)的mrna量的相对值。
[0038]
图5示出了ucp1基因的表达量。符号1表示比较例3(对照),符号2表示实施例3,符号3表示比较例2,符号4表示比较例1,符号5表示实施例4。纵轴表示该mrna量相对于内标基因(tbp)的mrna量的相对值。
[0039]
图6的a图示出了ucp1基因的表达量,b图示出了fabp4基因的表达量。在不同的人样本来源的皮肤成纤维细胞的结果中,各左侧柱表示无化合物(比较例3)时的结果,各右侧柱表示实施例3的化合物的组合的结果。纵轴表示该mrna量相对于内标基因(tbp)的mrna量的相对值。
[0040]
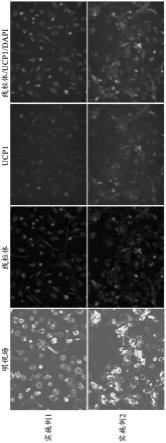
图7是培养细胞的照片、对该细胞的线粒体(红)及ucp1蛋白质(绿)进行免疫染色而得到的照片、以及细胞核(蓝)的染色与它们合并的照片。由于图7是单色的,因此未显示出绿色、红色及蓝色,但在图7的原始照片中,显示出绿色、红色及蓝色。
[0041]
图8示出了脂肪样细胞及ucp1阳性细胞的比例。在各人成纤维细胞的结果中,各左侧柱表示脂肪样细胞的比例,各右侧柱表示ucp1阳性细胞的比例。
[0042]
图9示出了ucp1基因表达的激活。c表示对照细胞(未添加化合物、比较例3)的表达量。h2o 6h表示在利用实施例3的化合物的组合进行诱导之后,进一步在无血清褐色脂肪保
持培养基(sfbamam)中进行培养,对于得到的细胞添加对照的h2o(水)并培养6小时后的结果。iso 6h表示添加作为β肾上腺素受体激动剂的异丙肾上腺素(isoproterenol)来代替先前的h2o并培养6小时后的结果。纵轴表示该mrna量相对于内标基因(tbp)的mrna量的相对值。
[0043]
图10的a图示出了氧消耗速度的变化。灰色圆形表示对照细胞(未添加化合物、比较例3)的结果,黑色菱形表示由实施例3的化合物的组合所引起的成纤维细胞来源的褐色脂肪细胞的结果。图中,虚线部表示添加了寡霉素、fccp或抗霉素a/鱼藤酮。横轴表示时间(分钟)。b图表示与横轴的各参数相应的氧消耗速度。在各参数的结果中,各左侧柱表示无化合物(比较例3)时的结果,各右侧柱表示实施例3的化合物的组合的结果。纵轴表示氧消耗速度ocr(皮摩尔/分/104细胞)。
[0044]
图11示出了基因的表达量。在各图中,纵轴表示该mrna量相对于内标基因(tbp)的mrna量的相对值。横轴数值表示时间(周)。
具体实施方式
[0045]
以下,对本发明详细地进行说明。
[0046]
1褐色脂肪细胞的制备方法
[0047]
本发明的褐色脂肪细胞的制备方法(以下称为“本发明的制备方法”)是通过直接分化诱导从体细胞制备褐色脂肪细胞的方法,该方法包括:在选择性pparγ激动剂及camp诱导剂的存在下,在无血清的分化诱导用培养基中对体细胞进行培养的工序。
[0048]
这里,“无血清”是指实质上不包含无调整或未纯化的血清,在本发明中,即使在分化诱导用培养基中混入了经纯化的血液来源的成分、动物组织来源的成分,只要实质上不包含无调整或未纯化的血清,也可称为无血清的分化诱导用培养基。
[0049]
通过本发明的方法制备的“褐色脂肪细胞”(cibas)与具有大量的线粒体和大量的脂肪滴并表达ucp1(uncoupling protein-1:解偶联蛋白)基因的所谓的褐色脂肪细胞同等。因此,可以简称为褐色脂肪细胞,也可以称为褐色脂肪样细胞。另外,也可以称为所谓的人米色细胞、亮细胞的模型。
[0050]
本发明的制备方法中的上述工序进一步优选为在bmp7存在下对体细胞进行培养的工序。
[0051]
上述选择性pparγ激动剂及camp诱导剂分别可以使用1种,也可以组合使用2种以上。
[0052]
1.1关于体细胞
[0053]
生物的细胞可以分类为体细胞和生殖细胞。本发明的制备方法可以使用任意的体细胞作为其起始材料。体细胞没有特别限定,可以是从生物体采集的原代细胞或确立细胞株中的任意细胞。在本发明的制备方法中,可以使用处于分化的各种阶段的体细胞,例如,终末分化的体细胞(例如,成纤维细胞、脐静脉内皮细胞(huvec)、肝细胞(hepatocytes)、胆管细胞(biliary cells)、胰腺α细胞(pancreaticαcells)、胰腺腺泡细胞(acinar cells)、胰腺导管细胞(ductal cells)、小肠隐窝细胞(intestinal crypt cells)等)、处于向终末分化的过程中的体细胞(例如,间充质干细胞、神经干细胞、内胚层祖细胞等)、或已经初始化而获得了多能性的ips细胞这样的体细胞及从ips细胞分化的或正在分化过程中的体细
胞。作为能够用于本发明的制备方法的体细胞,可以列举任意的体细胞,例如,造血系统的细胞(各种淋巴细胞、巨噬细胞、树突细胞、骨髓细胞等)、器官来源的细胞(肝细胞、脾细胞、胰腺细胞、肾细胞、肺细胞等)、肌肉组织系统的细胞(骨骼肌细胞、平滑肌细胞、成肌细胞、心肌细胞等)、成纤维细胞、神经细胞、成骨细胞、软骨细胞、内皮细胞、间质细胞、脂肪细胞(白色脂肪细胞等)、胚胎干细胞(es细胞)等。另外,这些细胞的前体细胞、癌细胞也可以适用本发明的制备方法。优选可以使用成纤维细胞。
[0054]
作为本发明中可使用的成纤维细胞,没有特别限定,可以列举例如:皮肤成纤维细胞(dermal fibroblasts)、主动脉外膜成纤维细胞(adventitial fibroblasts)、心脏成纤维细胞(cardiac fibroblasts)、肺成纤维细胞(pulmonary fibroblasts)、子宫成纤维细胞(uterine fibroblasts)、绒毛膜间充质成纤维细胞(villous mesenchymal fibroblasts)等在各种组织、器官中构成结缔组织的主要细胞成分、且是进行胶原纤维生产的细胞。
[0055]
作为上述的体细胞的供给源,可以示例出人、除人以外的哺乳动物、以及除哺乳动物以外的动物(鸟类、爬行类、两栖类、鱼类等),但并不限定于此。作为体细胞的供给源,优选为人、以及除人以外的哺乳动物,特别优选为人。在以对人施用为目标而通过本发明的制备方法制备褐色脂肪细胞的情况下,优选可以使用从与受体的组织相容性抗原的类型一致或类似的供体采集到的体细胞。可以将从受体本身采集到的体细胞供于褐色脂肪细胞的制备。
[0056]
1.2关于选择性pparγ激动剂
[0057]
pparγ(peroxisome proliferator-activated receptorγ:过氧化物酶体增殖物激活受体γ)是属于核受体超级家族的蛋白质之一,是通过与视黄醇x受体(rxr)形成异二聚体并与靶基因的启动子区域结合而控制了基因表达的转录因子。ppar中存在α、δ(β)、γ这3种亚型,在本发明中使用选择性地与其中的γ作用的激动剂。
[0058]“选择性pparγ激动剂的存在下”是指在能够选择性地对pparγ发挥激动剂作用的培养条件下,其方式没有特别限定,通常可以利用选择性地对pparγ发挥激动剂作用的化合物。
[0059]
在本发明中,作为选择性pparγ激动剂,可以举出例如以下的化合物或其盐,但没有特别限定。优选可以举出噻唑烷类的选择性pparγ激动剂剂,具体可以列举:罗格列酮、吡格列酮、曲格列酮。
[0060]
罗格列酮(cas no.:122320-73-4)
[0061]
[化学式1]
[0062][0063]
马来酸罗格列酮(cas no.:155141-29-0)
[0064]
环格列酮(cas no.:74772-77-3)
[0065]
依格列宗(cas no.:213411-83-7)
[0066]
gw1929盐酸盐(cas no.:1217466-21-1)
[0067]
ntzdpa(cas no.:118414-59-8)
[0068]
盐酸吡格列酮(cas no.:112529-15-4)
[0069]
s26948(cas no.:353280-43-0)
[0070]
曲格列酮(cas no.:97322-87-7)
[0071]
巴格列酮(cas no.:199113-98-9)
[0072]
利格列酮(cas no.:185428-18-6)
[0073]
选择性pparγ激动剂的浓度根据该激动剂的种类、所使用的体细胞等而不同,没有特别限定,可以适当确定,例如,可以在0.1μmol/l~20μmol/l、优选在0.5μmol/l~5μmol/l的范围内使用。
[0074]
1.3关于camp诱导剂
[0075]
camp(环磷酸腺苷)是作为第二信使参与各种细胞内信号转导的物质。camp在细胞内通过利用腺苷酸环化酶(adenylate cyclase)将三磷酸腺苷(atp)环化而生成。
[0076]“camp诱导剂的存在下”是指在能够诱导camp的培养条件下,其方式没有特别限定,例如,可以利用能够使细胞内camp浓度增加的任意方式。除了能够直接作用于作为与camp的生成相关的酶的腺苷酸环化酶而进行诱导的物质、能够促进腺苷酸环化酶的表达的物质以外,还可以使用抑制作为分解camp的酶的磷酸二酯酶的物质等作为使细胞内camp浓度增加的方式。也可以使用在细胞内具有与camp相同作用的作为camp的结构类似物的二丁酰基camp(dibutyryl camp)、8溴camp(8-bromo-camp)等。
[0077]
在本发明中,例如,可以举出毛喉素(毛喉素:cas no.:66575-29-9)、以及毛喉素衍生物(例如,日本特开2002-348243号公报)、以下的化合物等作为camp诱导剂(腺苷酸环化酶激活剂),但没有特别限定。可以优选使用毛喉素。
[0078]
毛喉素(cas no.:66428-89-5)
[0079]
[化学式2]
[0080][0081]
异丙肾上腺素(cas no.:7683-59-2)
[0082]
nkh477(cas no.:138605-00-2)
[0083]
pacap1-27(cas no.:127317-03-7)
[0084]
pacap1-38(cas no.:137061-48-4)
[0085]
camp诱导剂的浓度根据该诱导剂的种类、所使用的体细胞等而不同,没有特别限定,可以适当确定,例如,可以在0.1μmol/l~100μmol/l、优选在0.5μmol/l~30μmol/l的范围内使用。
[0086]
1.4关于bmp7
[0087]
bmp(bone morphogenetic protein:骨形成蛋白)7是bmp家族之一。人bmp7由117个残基的氨基酸组成,以同源二聚体的形式与细胞表面的受体结合,激活bmp信号通路。从bmp2至bmp7的6种被分类为tgfb超级家族,分别由不同的基因编码。在本发明中,可以是人来源的bmp7,也可以是动物来源的bmp7,还可以是它们的重组体。其中,优选使用人来源的bmp7。
[0088]
bmp7的浓度根据该bmp7的种类、所使用的体细胞等而不同,没有特别限定,可以适当确定,例如,可以在0.1ng/ml~200ng/ml、优选在1ng/ml~50ng/ml的范围内使用。
[0089]
1.5优选的培养条件
[0090]
在本发明中,虽然没有特别限定,但本发明的制备方法中的上述工序中,更优选在alk2/3抑制剂(抑制alk2及3这两者的药剂)及alk6抑制剂不存在的条件下对体细胞进行培养、在alk5抑制剂不存在的条件下对体细胞进行培养、或者在alk2/3抑制剂、alk6抑制剂及alk5抑制剂不存在的条件下对体细胞进行培养。
[0091]
在alk2/3抑制剂、alk6抑制剂或alk5抑制剂不存在的条件下是指实质上不存在这些抑制剂,不仅包括这些抑制剂完全不存在的情况,也可包括以不起到其效果的量存在的情况。
[0092]
alk2是alk家族成员的受体丝氨酸/苏氨酸激酶,位于smad蛋白、特别是与smad1/5/8相关的信号传导通路的上游。通过alk2-smad1通路的激活,由内皮糖蛋白降低前立腺癌细胞的运动性。alk2基因是与进行性骨化性纤维发育不良(fop)相关的主要基因,该进行性骨化性纤维发育不良是以在肌肉组织中的进行性异位骨化为特征的稀有的常染色体显性遗传先天性疾病。
[0093]
alk3是跨膜丝氨酸-苏氨酸激酶家族的成员。alk3基因在pten(phosphatase and tensin homologue deleted on chromosome 10)突变阴性cowden病(多发性错构瘤综合征)中作为次要易感基因而发挥作用。alk3运输在fop的病变形成中发挥重要作用,而且也与人t细胞分化相关。
[0094]
作为具体的alk2/3抑制剂,可以列举例如:ldn193189(cas no.:1062368-24-4)、dorsomorphin(cas no.:866405-64-3)、k02288(cas no.:1431985-92-0)、ldn212854(cas no.:1432597-26-6)、ldn193189盐酸盐(cas no.:1062368-62-0)、ml347(cas no.:1062368-49-3)、ldn214117(cas no.:1627503-67-6)。
[0095]
alk6也称为bmpr1b,是骨形成蛋白(bmp)受体成员中的跨膜丝氨酸/苏氨酸激酶成员,与作为激活素受体的acvr1和acvr2非常类似。alk6主要参与软骨内的骨形成和胚胎形成。
[0096]
作为具体的alk6抑制剂,可以列举例如:dorsomorphin(cas no.:866405-64-3)、k02288(cas no.:1431985-92-0)。
[0097]
alk5是也被称为tgfβr1(转化生长因子β受体1)的tgfβ受体亚家族成员。alk5是在与tgfβ结合时与ii型tgfβ受体形成异二聚体复合物的丝氨酸/苏氨酸激酶,将tgfβ信号从细胞表面传导至细胞质。
[0098]
作为具体的alk5抑制剂,可以列举例如:sb431542(cas no.:301836-41-9)、a83-01(cas no.:909910-43-6)、repsox(cas no.:446859-33-2)、d4476(cas no.:301836-43-1)、ly364947(cas no.:396129-53-6)、sb525334(cas no.:356559-20-1)、sd208(cas no.:
627536-09-8)。
[0099]
1.6体细胞的培养
[0100]
对于本发明的制备方法中的体细胞的培养而言,选择与待使用的体细胞的种类相应的培养基、温度、其它条件,在上述的选择性pparγ激动剂及camp诱导剂的存在下,使用无血清的分化诱导用培养基利用通常方法进行。
[0101]
本发明的制备方法中,通过在包含上述的选择性pparγ激动剂及camp诱导剂的无血清分化诱导用培养基中对体细胞进行培养,可以通过一步培养从体细胞制备褐色脂肪细胞。
[0102]
另外,也可以通过选择容易培养的细胞作为待使用的体细胞,将预先使细胞数增加而达到基本汇合的状态的体细胞转变为褐色脂肪细胞。因此,扩大规模的褐色脂肪细胞的制备也是容易的。
[0103]
在实施本发明方面作为基础的分化诱导用培养基或用于对体细胞传代培养的培养基可以从公知的培养基或市售的培养基中选择。例如,可以在作为通常的基本培养基的mem(eagle最低必需培养基)、gmem(glasgow’s最低必需培养基)、dmem(dulbecco改良eagle培养基)、ham’s f-12、dmem/f12、rpmi1640、imdm(iscov’s改良dulbecco培养基)或将它们改良而得到的培养基中添加适当的成分(血清、蛋白质、氨基酸、糖类、维生素类、脂肪酸类、抗生素等)而使用。
[0104]
作为培养条件,可以适当选择通常的细胞培养的条件。可示例出37℃、5%co2的条件等。在培养中优选以适当的间隔(优选为1天~5天1次、更优选为2天~3天1次)更换培养基。在将成纤维细胞作为材料实施本发明的制备方法的情况下,在37℃、5%co2的条件下于3天~7天左右开始出现褐色脂肪细胞,并且褐色脂肪细胞持续增加至21天~28天左右。
[0105]
体细胞的培养可以使用培养板、培养皿、细胞培养用烧瓶、细胞培养用袋等细胞培养容器。需要说明的是,作为细胞培养用袋,优选具有透气性。在需要大量细胞的情况下,可以使用大型培养槽。培养可以在开放体系或封闭体系中的任意一种中实施,在以得到的褐色脂肪细胞对人施用等作为目标的情况下,优选在封闭体系中进行培养。
[0106]
需要说明的是,地塞米松(糖皮质激素受体激动剂)、胰岛素、3-异丁基-1-甲基黄嘌呤(磷酸二酯酶抑制剂)、三碘甲状腺原氨酸(甲状腺激素受体激动剂,也称为t3)、l-抗坏血酸2-磷酸酯(抗坏血酸衍生物、l-ascorbic acid-2-phophate)等已知是对于向脂肪细胞的分化的诱导有效的物质。作为对于向褐色脂肪细胞的分化的诱导有效的物质,例如,也可以使用市售的产品作为分化诱导剂。在本发明的制备方法中,优选在从上述的物质中选择的1种以上、优选为3种以上、更优选为4种以上、进一步优选为5种物质的存在下对体细胞进行培养。优选可以使用地塞米松、胰岛素、以及3-异丁基-1-甲基黄嘌呤、t3、l-抗坏血酸2-磷酸酯。
[0107]
在使用地塞米松的情况下,地塞米松的浓度没有特别限定,优选可以在0.01μmol/l~30μmol/l、优选在0.1μmol/l~10μmol/l的范围内使用。
[0108]
在使用胰岛素的情况下,胰岛素的浓度没有特别限定,优选可以在1ng/ml~100μg/ml、优选在100ng/ml~20μg/ml的范围内使用。
[0109]
在使用3-异丁基-1-甲基黄嘌呤的情况下,3-异丁基-1-甲基黄嘌呤的浓度没有特别限定,优选可以在1μmol/l~1mmol/l、优选在10μmol/l~0.5mmol/l的范围内使用。
[0110]
在使用t3的情况下,t3的浓度没有特别限定,优选可以在1nmol/l~10umol/l、优选在0.01μmol/l~1μmol/l的范围内使用。
[0111]
在使用l-抗坏血酸2-磷酸酯的情况下,l-抗坏血酸2-磷酸酯的浓度没有特别限定,优选可以在1μg/ml~1mg/ml、优选在10μg/ml~250μg/ml的范围内使用。
[0112]
2褐色脂肪细胞
[0113]
通过上述的本发明的制备方法,可以得到含有褐色脂肪细胞的细胞集团。通过本发明的制备方法制备的褐色脂肪细胞也在本发明的范围内。用本发明的制备方法制备的褐色脂肪细胞除了终末分化的细胞以外,还可以是注定要分化成褐色脂肪细胞的前体细胞。
[0114]
通过本发明的制备方法制备的褐色脂肪细胞是利用低分子化合物从体细胞直接分化诱导的所谓的低分子化合物诱导性褐色脂肪细胞(cibas),与通过基因导入而分化诱导的褐色脂肪细胞相区别。另外,通过本发明的制备方法制备的褐色脂肪细胞可以是米色细胞样或亮细胞样。
[0115]
通过本发明的制备方法制备的褐色脂肪细胞例如可以利用细胞的形态的变化、褐色脂肪细胞的特征性质、特异性标记物进行检测、确认及分离。
[0116]
脂肪细胞将脂肪积蓄在细胞内。因此,可以通过使用了油红o的细胞内脂肪的染色来检测脂肪细胞。
[0117]
作为褐色脂肪细胞的特异性标记物,可以列举:ucp1、evol3(elongation of very long chain fatty acid protein 3)、pgc1a(ppar gamma coactivator1-alpha)、prdm16(prd1-bf1-riz1 homologous domain containing 16)、cited1(cbp/p300 interacting transactivator with glu/asp rich carboxy-terminal domain 1)等,但并不限定于此。ucp1是解偶联蛋白(uncoupling protein)的一种。
[0118]
特异性标记物的检测可以利用检疫的方法(基于抗体的检测),关于蛋白质分子,也可以通过其mrna量的定量来实施检测。识别褐色脂肪细胞的特异性标记物的抗体在对通过本发明的制备方法得到的褐色脂肪细胞进行分离及纯化方面是有用的。
[0119]
通过本发明的制备方法制备的褐色脂肪细胞例如可以用于外科治疗后的组织修复等。使用通过本发明的制备方法制备的褐色脂肪细胞,可以制造用于组织修复等的医药用组合物。另外,期待褐色脂肪细胞向生物体的移植、施用具有改善生物体的代谢、防止肥胖等效果。
[0120]
在将褐色脂肪细胞制成医药用组合物的情况下,可以通过通常方法将褐色脂肪细胞与医药上可接受的载体进行混合等而制成适合向个体给药的形式的制剂。作为载体,例如,可以举出加入生理盐水、葡萄糖、其它辅助剂(例如,d-山梨糖醇、d-甘露糖醇、氯化钠等)而等张的注射用蒸馏水。还可以进一步配合缓冲剂(例如,磷酸盐缓冲液、乙酸钠缓冲液)、无痛剂(例如,苯扎氯铵、盐酸普鲁卡因等)、稳定剂(例如,人血清白蛋白、聚乙二醇等)、防腐剂、抗氧化剂等。
[0121]
褐色脂肪细胞也可以制成进一步与对发挥褐色脂肪细胞的功能、提高移植性有效的其它细胞或成分组合而成的组合物。
[0122]
另外,通过本发明的制备方法制备的褐色脂肪细胞也可以用于作用于褐色脂肪细胞的医药候选化合物或食品成分的筛选、医药候选化合物的安全性评价。因此,使用通过本发明的制备方法制备的褐色脂肪细胞,可以筛选增强褐色脂肪细胞的糖/脂质代谢及产热
功能的药剂。用于该筛选的医药候选化合物例如包括所谓的生活习惯病治疗药、代谢疾病治疗药、其它的药库药物等现有药。食品成分例如包括维生素类、糖类、氨基酸、矿物质等广泛的食品的营养素、功能性食品的成分、中药、草药、其它食品中的低分子化合物及蛋白质、脂质等。
[0123]
上述筛选例如可以通过以下方式实施:向通过本发明的制备方法制备的褐色脂肪细胞或其制备过程中的细胞添加受试物质,对由该受试物质所引起的该细胞的褐色化倾向的增强程度进行评价。在所述评价中,例如,可以利用例如实时pcr对作为与褐色脂肪细胞特异性的标记物的ucp1基因及在全部脂肪细胞中表达的fabp4基因的表达量进行定量,使其比值作为褐色化倾向的指标。由此分析的增强褐色化倾向的医药候选化合物、食品成分可以成为能够在人体内增加褐色脂肪细胞(米色细胞)的有力的候选化合物。
[0124]
根据本发明的制备方法,由于可以通过一次性操作获得大量的褐色脂肪细胞,因此能够不受细胞的批次差异的影响而得到具有重现性的研究结果。
[0125]
2组合物
[0126]
本发明的诱导用组合物(以下称为“本发明组合物”)是用于通过直接分化诱导从体细胞制备褐色脂肪细胞的组合物,其特征在于包含选择性pparγ激动剂及camp诱导剂且无血清。
[0127]
在本发明中,优选进一步包含bmp7的本发明组合物。
[0128]
上述选择性pparγ激动剂及camp诱导剂分别可以使用1种,也可以组合使用2种以上。
[0129]
上述的选择性pparγ激动剂、camp诱导剂及无血清的含义、具体例、优选例等与上述含义相同。
[0130]
本发明组合物可以作为用于从体细胞制备褐色脂肪细胞的组合物而使用。另外,本发明组合物也可以作为用于从体细胞制备褐色脂肪细胞的培养基而使用。
[0131]
作为用于从体细胞制备褐色脂肪细胞的培养基,可以示例出在将细胞的培养所需要的成分混合而制成的基础培养基(无血清)中含有选择性pparγ激动剂及camp诱导剂作为有效成分而得到的培养基。上述的有效成分只要以对褐色脂肪细胞的制备有效的浓度含有即可,浓度可以由本领域技术人员适当确定。基础培养基可以从公知的培养基或市售的培养基中选择。例如,可以使用作为通常的基本培养基的mem(eagle最低必需培养基)、gmem(glasgow’s最低必需培养基)、dmem(dulbecco改良eagle培养基)、ham’s f-12、dmem/f12、rpmi1640、imdm(iscov’s改良dulbecco培养基)作为基础培养基。
[0132]
培养基中可以进一步添加本说明书中记载的公知的培养基成分、例如血清、蛋白质(白蛋白、转铁蛋白、成长因子等)、氨基酸、糖类、维生素类、脂肪酸类、抗生素等。
[0133]
培养基中可以进一步添加本说明书中记载的地塞米松、胰岛素、以及3-异丁基-1-甲基黄嘌呤、t3、l-抗坏血酸2-磷酸酯等对于向脂肪细胞的分化的诱导有效的物质。
[0134]
实施例
[0135]
以下,通过实施例、比较例及试验例对本发明具体地进行说明,但本发明并不限定于实施例等的范围。
[0136]
[实施例]褐色脂肪细胞的制备
[0137]
(1)细胞培养
[0138]
作为材料的人成纤维细胞从ds pharma biomedical公司购入。是38岁的人皮肤来源的成纤维细胞。
[0139]
将上述人成纤维细胞接种于用明胶(cat#:190-15805,fujifilm wako pure chemical公司制)涂布后的35mm培养皿,每个培养皿接种5
×
104个,在添加有10%胎牛血清(fetal bovine serum;fbs)、100u/ml青霉素、100μg/ml链霉素的dmem培养基(cat#:11965092;gibco公司制)中于37℃、5%co2条件下培养至达到80~90%汇合。
[0140]
(2)从人成纤维细胞向褐色脂肪细胞的直接转变(直接分化诱导)
[0141]
向褐色脂肪细胞的直接转变所使用的无血清培养基(无血清褐色脂肪诱导培养基)是以达到该最终浓度的方式,以表3所示的化合物的组合将表2的各成分添加于dmem培养基(cat#:11965092;gibco公司制)而制备的。以下,将其称为无血清褐色脂肪诱导培养基“sfbam”。
[0142]
[表1]
[0143][0144]
[表2]
[0145][0146]
[表3]
[0147][0148]
表3中,“ ”表示培养基中存在该化合物,“-”表示培养基中不存在该化合物。
[0149]
然后,在人成纤维细胞达到80~90%汇合之后,将培养皿的培养基更换为上述sfbam,在sfbam中将人成纤维细胞培养3周。培养基每3天进行更换。需要说明的是,例如,在图9的特定的实验中,将表4所示的各成分添加于dmem培养基(cat#:11965092;gibco公司制)而制备的无血清褐色脂肪保持培养基(以下称为“sfbamam”)中进一步培养1周,使化学诱导的褐色脂肪细胞样细胞(cibas)成熟。
[0150]
[表4]
[0151][0152]
(3)免疫染色
[0153]
免疫细胞如已经报道的那样进行(dai p,et al.j clin biochem nutr.2015;56(3):166-70)。首先,用4%多聚甲醛(nacalai tesque公司)固定了细胞。用磷酸盐缓冲生理盐水(pbs)清洗3次后,用含有0.1%triton x-100的pbs将细胞孵育10分钟。接下来,利用含有3%脱脂牛奶的pbs将细胞在室温下封闭1小时。用封闭溶液将ucp-1抗体(ab10983,abcam,cambridge,uk)稀释至1/500。将细胞和抗体在4℃下孵育过夜。用pbs清洗3次后,将细胞和alexa fluor 488donkey anti-rabbit igg(a-21206,thermo fisher scientific)在室温下孵育1小时。用dapi溶液(同仁化学研究所)对细胞核进行染色。图像全部使用荧光显微镜(axio vert.a1,carl zeiss,oberkochen,germany)获得。线粒体使用mitotracker(注册商标)red cmxros(thermo fisher scientific)进行了染色。
[0154]
(4)rna分离及qrt-pcr
[0155]
为了对基因表达进行定量,使用fastgene(注册商标)rna basic kit(nippon genetics公司制)从用各化合物进行处理后的成纤维细胞中提取出总rna。作为对照,使用sfbam对成纤维细胞进行并行培养,从用化合物诱导的褐色脂肪细胞及对照细胞中提取出总rna。利用revertraace(注册商标)pcr rt master mix with gdna remover(东洋纺株式会社制)进行逆转录之后,使用power sybr green pcr master mix(thermo fisher scientific)进行了实时pcr分析。反应在以下的条件下对每1个水平实施了3个反应。在95℃下10分钟后,在95℃下15秒钟及60℃下60秒钟进行40个循环。结果全部以tbp mrna的量进行了标准化。qrt-pcr中使用的引物示于下述表5。
[0156]
[表5]
[0157]
[0158]
(5)结果
[0159]
将实验结果示于附图。需要说明的是,在全部的附图中,数据表示平均值
±
sd(n=3),“***”、“**”及“*”表示通过student’s t检验分别在p<0.001、p<0.01及p<0.05具有显著差异,“n.s.”表示不具有显著差异。
[0160]
如图1所示,观察到了在无血清培养基sfbam中,通过包含罗格列酮(选择性pparγ激动剂)及毛喉素(camp诱导剂)的化合物的组合,从人成纤维细胞向褐色脂肪细胞进行了充分的直接分化诱导(直接转变)。另外,如图1及图2所示,在无血清培养基中,在从实施例1的化合物的组合中排除ldn193189(alk2/3抑制剂)及dorsomorphin(alk2/3/6抑制剂)并加入了bmp7的实施例2的化合物的组合中,与实施例1的化合物的组合的情况相比,向ucp1阳性细胞、即褐色脂肪细胞的转变效率提高。
[0161]
如图3所示,在无血清培养基中,虽然作为脂肪细胞特异性基因的fabp4的表达比对照(比较例3、无化合物)增加,但在实施例1与实施例2的情况之间没有确认到显著性差异(图3b)。但是,对于作为褐色脂肪细胞特异性基因的ucp1的表达量及比例而言,实施例2的化合物的组合的情况比实施例1的化合物的组合的情况大幅增大(图3a)。另外,与实施例1相比,实施例2的情况下ucp1的表达量相对于fabp4的表达量之比大幅增加(图3c)。此外,与ucp1 mrna的表达量的增加相对应,与实施例1相比,实施例2的情况下观察到了ucp1蛋白质的增加(图3d)。
[0162]
如图4所示,在无血清培养基中,通过从实施例2的化合物的组合中排除了sb431542(alk5抑制剂)的实施例3的化合物(毛喉素、罗格列酮及bmp7)的组合,作为褐色脂肪细胞特异性基因的ucp1的表达进一步增大。与此相对应,实施例3的情况下ucp1蛋白质的量也增加。
[0163]
将从实施例3的化合物(毛喉素、罗格列酮及bmp7)的组合中排除了任意一种化合物的结果示于图5。如图5所示,在无血清培养基中,在从实施例3的化合物的组合中排除了罗格列酮(选择性pparγ激动剂)的情况(符号3、比较例2)下,基本上未观察到向褐色脂肪细胞的直接转变。另一方面,在从实施例3的化合物的组合中排除毛喉素(camp诱导剂)(符号4、比较例1)、或排除bmp7(符号5、实施例4)时,尽管少,但也观察到了向褐色脂肪细胞的直接转变,但在排除了毛喉素的情况下难以进行直接转变。
[0164]
因此可以认为,在无血清培养基中从人成纤维细胞向褐色脂肪细胞的直接转变中,罗格列酮(选择性pparγ激动剂)的转变效率高,其次毛喉素(camp诱导剂)的转变效率高。
[0165]
对于化合物的各种组合,根据图1~图5所示的结果评价了无血清培养基中向脂肪细胞样细胞的直接转变效率。将其结果示于下述表6。需要说明的是,图1是用相位差显微镜观察免疫染色的结果而得到的结果,并且结合其细胞的状态综合地判断效率。 的标记的数量越多,转变效率越高。例如, 表示在转变成脂肪细胞的细胞中,其的大部分转变为ucp1阳性的褐色脂肪细胞。-的标记表示未转变为褐色脂肪细胞。
[0166]
[表6]
[0167]
组合效率实施例1 实施例2
实施例3 实施例4 或 比较例1 比较例2-比较例3-
[0168]
[试验例1]从不同的人成纤维细胞向褐色脂肪细胞的直接转变
[0169]
与上述实施例(1)(2)同样,在加入了实施例3的化合物(罗格列酮、毛喉素及bmp7)的无血清诱导培养基sfbam中,对3人的不同的人皮肤成纤维细胞培养了3周。然后,利用qrt-pcr对与脂肪细胞及褐色脂肪组织特异性的多个标记基因进行了定量。
[0170]
供于实验的人皮肤成纤维细胞由ds pharma biomedical公司购入。该细胞信息如下述表7所述。
[0171]
[表7]
[0172] 批次#传代数bmi年龄性别部位hdf22dfm06250932922男性胸部hdf38dfm090214323.138男性腹部hdf54ddfm052010b321.354女性腹部
[0173]
将其结果示于图6。与未添加化合物(比较例3)的对照相比,在无血清培养基中,在全部的成纤维细胞中显著诱导了ucp1 mrna(图6a)。在无血清培养基中,在用该化合物诱导的褐色脂肪细胞中,作为成脂分化标记物的fabp4的表达在全部成纤维细胞中增加(图6b)。
[0174]
另外,进行免疫细胞化学分析,对线粒体的增加和ucp1蛋白质的表达、以及向褐色脂肪细胞的转变效率进行了分析(图7及图8)。其结果表明,脂肪细胞的大部分判明为ucp1阳性,具有褐色脂肪细胞的特征。此外,ucp1染色与线粒体信号的上升充分重叠。
[0175]
[试验例2]本发明中分化诱导的褐色脂肪细胞的产热能力的评价
[0176]
经由ucp1的产热在褐色脂肪细胞中受到交感神经系统及β肾上腺素受体信号通路的调节。为了对本发明中分化诱导的褐色脂肪细胞的产热能力进行评价,与上述实施例(1)(2)同样地利用实施例3的化合物的组合(罗格列酮、毛喉素及bmp7)将人成纤维细胞在无血清培养基sfbam中进行3周的直接转变,接着使直接转变的细胞成熟,因此,对于在无血清培养基sfbamam中进一步培养了1周的细胞,在用异丙肾上腺素(β肾上腺素受体激动剂)进行了6小时处理后的情况和用其溶剂h2o进行了相同时间处理后的情况下,对ucp1 mrna进行了定量。将其结果示于图9。
[0177]
如图9所示,与添加了h2o的对照相比,用异丙肾上腺素处理后的ucp1mrna显著增大至3.1倍。
[0178]
因此,在无血清培养基中,用实施例3的化合物的组合进行了分化诱导的褐色脂肪细胞、即利用本发明从成纤维细胞分化诱导的褐色脂肪细胞显示出能够对产热基因诱导的β肾上腺素受体信号通路进行应答。
[0179]
[试验例3]本发明中分化诱导的褐色脂肪细胞的氧消耗速度的测定
[0180]
为了测定线粒体的氧消耗速度(oxygen consumption rate:ocr),与上述实施例(1)(2)同样,利用实施例3的化合物的组合(罗格列酮、毛喉素及bmp7)在96孔板上的无血清培养基sfbam中将人成纤维细胞进行了3周的直接转变。作为对照,在无血清培养基sfbam中
对人成纤维细胞进行了并行培养。在37℃的非co2培养箱内孵育1小时后,使用xf96 extracellular flux analyzer(seahorse bioscience inc.,billerica,ma)按照操作说明书对包含用化合物诱导的褐色脂肪细胞的各孔的氧消耗速度进行了分析。在分析中,经由注入装置以最终浓度分别到达2μm、0.3μm及0.5μm的方式将作为线粒体的电子传输系统抑制剂的寡霉素(
オリゴマシン
)、fccp(羰基氰化物4-(三氟甲氧基)苯腙)、以及抗霉素a/鱼藤酮添加于各孔。
[0181]
将其结果示于图10。如图10a所示,ocr值随着在分析中添加线粒体抑制剂而代表性地发生变化,利用实施例3的化合物的组合从人成纤维细胞进行直接转变而得到的褐色脂肪细胞比对照显示出更高的ocr。如图10b所示,与线粒体的各活性相当的ocr值也分别比对照增大。
[0182]
因此可知,在无血清培养基中,用实施例3的化合物的组合分化诱导而得到的褐色脂肪细胞、即利用本发明从成纤维细胞进行分化诱导而得到的褐色脂肪细胞的线粒体中的氧化代谢增强。
[0183]
[试验例4]向褐色脂肪细胞的诱导期间的研究
[0184]
与上述实施例(1)(2)同样,在加入了实施例3的化合物(罗格列酮、毛喉素及bmp7)的无血清诱导培养基sfbam中对人皮肤成纤维细胞进行培养。然后,利用qrt-pcr对与脂肪细胞及褐色脂肪组织特异性的下述表8所示的多个标记基因的表达量进行了定量。将其结果示于图11。在图中,“c”表示不包含实施例3的化合物而同样地培养5周的情况,“ro”表示在实施例3的化合物中仅包含罗格列酮并同样地培养5周的情况。需要说明的是,图11a所示的基因对于褐色脂肪细胞是特异性的,图11b所示的基因对于全部脂肪细胞是特异性的。
[0185]
[表8]
[0186][0187]
如图11所示,任意基因均在培养第1周之前开始表达,并且表达量持续增加至第3周或第4周。另外,根据该结果可以认为,利用本发明从成纤维细胞分化诱导的褐色脂肪细
胞在第1周之前开始出现,并且持续增加至第3周或第4周。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。