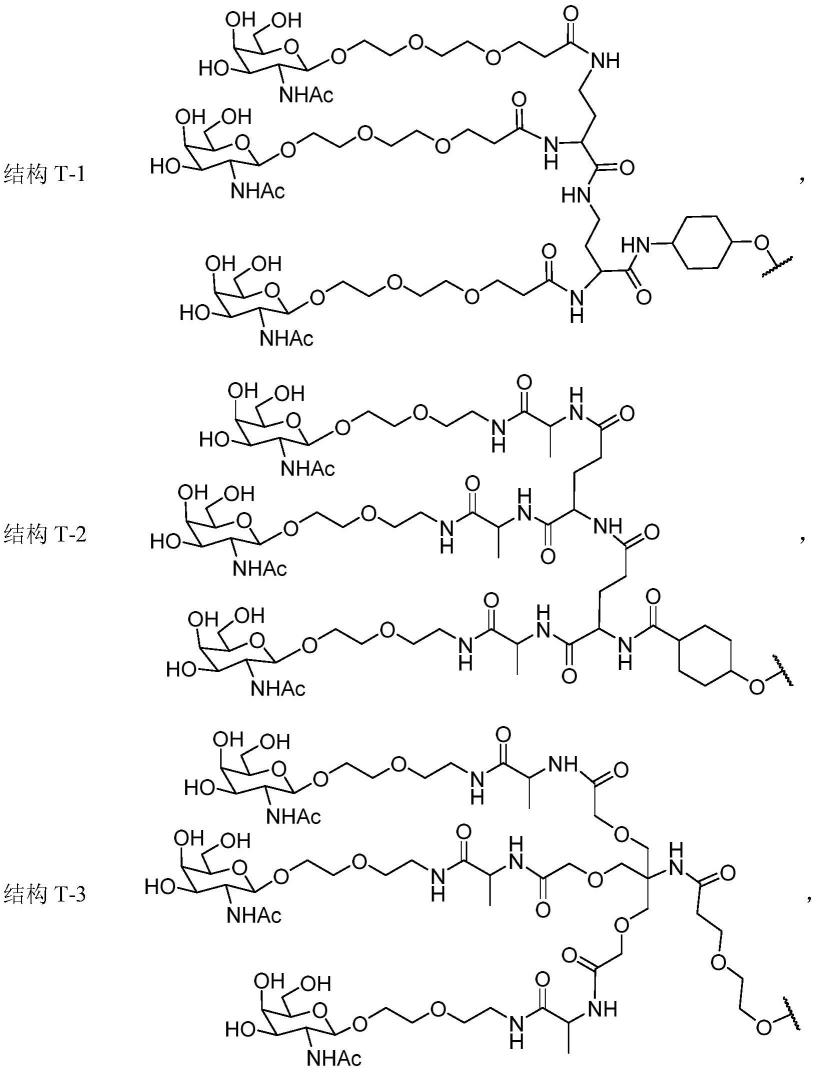
抗冠状病毒的全人广谱中和抗体76e1及其应用
技术领域
1.本发明涉及医药领域,具体地涉及一株抗冠状病毒的全人广谱中和抗体76e1及其应用。
背景技术:
2.sars-cov-2的爆发再次引起了人们对冠状病毒的重视和研究。普通冠状病毒如 229e-cov,oc43-cov,nl63-cov等仅导致轻微的呼吸系统疾病。而sars-cov-2, sars-cov及mers-cov具有较强的传染性和致病性,严重威胁人类健康和经济社会稳定。截至到2020年8月31日,全球共确诊2531.5万例,死亡84.6万例(新型冠状病毒肺炎实时追踪2020/08/31)。因此,开发有效的预防和治疗手段刻不容缓。
3.单克隆抗体临床干预在预防和治疗病毒感染方面非常有效,临床上已成功用于预防呼吸道合胞病毒的感染。大量临床前及早期临床数据表明单克隆抗体能有效预防和治疗多种病毒引起的感染。因此,开发预防及治疗性中和抗体,对抗击当下新型冠状病毒疫情或未来新发、突发冠状病毒感染疫情具有重要价值。
4.冠状病毒表面刺突蛋白是诱导中和抗体的重要抗原,中和抗体通过阻断s蛋白与受体的结合或抑制病毒与宿主细胞膜的融合发挥中和作用。s蛋白由s1和s2两个功能域组成。其中s1负责结合宿主细胞上的特定受体以促进病毒感染,在不同冠状病毒之间序列高度可变。s2介导病毒与细胞膜的融合,相对于s1较保守。目前,国内外有多家实验室从新冠病毒康复患者中陆续分离到靶向sars-cov-2刺突蛋白的全人单克隆抗体,这些抗体大多靶向s蛋白的受体结合区域(rbd),通过阻断rbd与宿主受体血管紧张素转化酶2(ace2)的相互作用,从而抑制病毒感染宿主细胞。由于不同冠状病毒rbd的差异性,这些抗体只能中和sars-cov-2,对其他冠状病毒不具有广谱中和活性或仅对 sars-cov有较弱交叉中和,无法应对未来新发或突发的新型冠状病毒。近期,多篇文献报道sars-cov-2在世界各地已经发生突变,某些突变尤其是rbd上的突变导致早期分离的中和抗体无效。靶向rbd的中和抗体耐药位点的出现限制了其使用范围。因此,寻找冠状病毒广谱性中和抗体以及新表位的抗体显得尤为重要。目前,靶向新型冠状病毒保守区域s2的抗体未有报道,并缺少系统性的研究。
5.因此,本领域仍然需要开发能够预防及控制新型冠状病毒感染的更有效的全人单克隆抗体。
技术实现要素:
6.本发明目的是提供了一种能够预防及控制冠状病毒感染的全人广谱中和抗体。
7.本发明的第一方面,提供了一种抗体的重链可变区,所述的重链可变区包括以下三个互补决定区cdr:
8.seq id no.:3所示的cdr1,
9.seq id no.:4所示的cdr2,和
10.seq id no.:5所示的cdr3。
11.在另一优选例中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个(如1-3个,较佳地1-2个,更佳地1个)氨基酸并能够保留冠状病毒s蛋白(较佳地s2蛋白)结合亲和力的衍生序列。
12.在另一优选例中,所述重链可变区还包括人源的fr区或鼠源的fr区。
13.在另一优选例中,所述重链可变区具有seq id no.:1所示的氨基酸序列。
14.本发明的第二方面,提供了一种抗体的重链,所述的重链具有如本发明第一方面所述的重链可变区。
15.在另一优选例中,所述的抗体的重链还包括重链恒定区。
16.在另一优选例中,所述的重链恒定区为人源、鼠源或兔源的。
17.本发明的第三方面,提供了一种抗体的轻链可变区,所述的轻链可变区包括以下三个互补决定区cdr:
18.seq id no.:6所示的cdr1’,
19.氨基酸序列为evn的cdr2’,和
20.seq id no.:8所示的cdr3’。
21.在另一优选例中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个(如1-3个,较佳地1-2个,更佳地1个)氨基酸并能够保留冠状病毒s蛋白(较佳地s2蛋白)结合亲和力的衍生序列。
22.在另一优选例中,所述轻链可变区还包括人源的fr区或鼠源的fr区。
23.在另一优选例中,所述轻链可变区具有seq id no.:2所示的氨基酸序列。
24.本发明的第四方面,提供了一种抗体的轻链,所述的轻链具有如本发明第三方面所述的轻链可变区。
25.在另一优选例中,所述的抗体的轻链还包括轻链恒定区。
26.在另一优选例中,所述的轻链恒定区为人源、鼠源或兔源的。
27.本发明的第五方面,提供了一种抗体,所述抗体具有:
28.(1)如本发明第一方面所述的重链可变区;和/或
29.(2)如本发明第三方面所述的轻链可变区;
30.或者,所述抗体具有:如本发明第二方面所述的重链;和/或如本发明第四方面所述的轻链。
31.在另一优选例中,所述的抗体为特异性抗冠状病毒的抗体,较佳地为特异性抗s蛋白(较佳地s2蛋白)的抗体。
32.在另一优选例中,所述抗体选自:动物源抗体、嵌合抗体、人源化抗体、或其组合。
33.在另一优选例中,所述的抗体为双链抗体、或单链抗体。
34.在另一优选例中,所述的抗体为单克隆抗体、或多克隆抗体。
35.在另一优选例中,所述的抗体是部分或全人源化的单克隆抗体。
36.在另一优选例中,所述的抗体为药物偶联物形式。
37.在另一优选例中,所述抗体的重链可变区序列如seq id no.:1所示;并且所述的抗体的轻链可变区序列如seq id no.:2所示。
38.本发明的第六方面,提供了一种重组蛋白,所述的重组蛋白具有:
39.(i)如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或本发明第五方面所述的抗体;以及
40.(ii)任选的协助表达和/或纯化的标签序列。
41.在另一优选例中,所述的标签序列包括6his标签、gggs序列、flag标签。
42.在另一优选例中,所述的重组蛋白(或多肽)包括融合蛋白。
43.在另一优选例中,所述的重组蛋白为单体、二聚体、或多聚体。
44.在另一优选例中,所述的重组蛋白特异性结合冠状病毒s蛋白,较佳地结合s2蛋白,最佳地结合s蛋白809-833位肽。
45.本发明的第七方面,提供了一种car构建物,所述的car构建物的抗原结合区域的scfv段为特异性结合于冠状病毒s蛋白(较佳地s2蛋白)的结合区,并且所述scfv具有如本发明第一方面所述的重链可变区和如本发明第三方面所述的轻链可变区。
46.本发明的第八方面,提供了一种重组的免疫细胞,所述的免疫细胞表达外源的如本发明第七方面所述的car构建物。
47.在另一优选例中,所述的免疫细胞选自下组:nk细胞、t细胞。
48.在另一优选例中,所述的免疫细胞来自人或非人哺乳动物(如鼠)。
49.本发明的第九方面,提供了一种抗体药物偶联物,所述的抗体药物偶联物含有:
50.(a)抗体部分,所述抗体部分选自下组:如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体、或其组合;和
51.(b)与所述抗体部分偶联的偶联部分,所述偶联部分选自下组:可检测标记物、药物、毒素、细胞因子、放射性核素、酶、或其组合。
52.在另一优选例中,所述偶联物选自:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶、放射性核素、生物毒素、细胞因子(如il-2等)、抗体、抗体fc片段、抗体scfv片段、金纳米颗粒/纳米棒、病毒颗粒、脂质体、纳米磁粒、前药激活酶(例如,dt-心肌黄酶(dtd) 或联苯基水解酶-样蛋白质(bphl))、化疗剂(例如,顺铂)或任何形式的纳米颗粒等。
53.在另一优选例中,所述的抗体部分与所述的偶联部分通过化学键或接头进行偶联。
54.本发明的第十方面,提供了一种活性成分的用途,所述活性成分选自下组:如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或本发明第五方面所述的抗体、如本发明第六方面所述的重组蛋白、或其组合,所述活性成分用于制备药剂、试剂、检测板或试剂盒。
55.在另一优选例中,所述试剂、检测板或试剂盒用于检测冠状病毒。
56.在另一优选例中,所述药剂用于治疗或预防冠状病毒感染。
57.在另一优选例中,所述的试剂包括芯片、包被抗体的免疫微粒。
58.本发明的第十一方面,提供了一种药物组合物,所述的药物组合物含有:
59.(i)活性成分,所述活性成分选自下组:如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所
述的轻链、或本发明第五方面所述的抗体、如本发明第六方面所述的重组蛋白、如本发明第八方面所述的免疫细胞、如本发明第九方面所述的抗体药物偶联物、或其组合;以及
60.(ii)药学上可接受的载体。
61.在另一优选例中,所述的药物组合物为液态制剂。
62.在另一优选例中,所述的药物组合物为注射剂。
63.在另一优选例中,所述的药物组合物用于预防和/或治疗冠状病毒感染。
64.本发明的第十二方面,提供了一种多核苷酸,所述的多核苷酸编码选自下组的多肽:
65.(1)如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或本发明第五方面所述的抗体;或
66.(2)如本发明第六方面所述的重组蛋白;
67.(3)如本发明第七方面所述的car构建物。
68.在另一优选例中,所述的多核苷酸具有seq id no.:8和/或seq id no.:9所示的序列。
69.本发明的第十三方面,提供了一种载体,所述的载体含有如本发明第十二方面所述的多核苷酸。
70.在另一优选例中,所述的载体包括:细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒、或其他载体。
71.本发明的第十四方面,提供了一种遗传工程化的宿主细胞,所述的宿主细胞含有如本发明第十三方面所述的载体或基因组中整合有如本发明第十二方面所述的多核苷酸。
72.本发明的第十五方面,提供了一种检测样品中冠状病毒的方法,所述方法包括步骤:
73.(1)将样品与本发明的第五方面所述的抗体接触;
74.(2)检测是否形成抗原-抗体复合物,其中形成复合物就表示样品中存在冠状病毒。
75.在另一优选例中,所述检测为非治疗非诊断目的。
76.本发明还提供了一种检测样品中冠状病毒s蛋白的方法,所述方法包括步骤:
77.(1)将样品与本发明的第五方面所述的抗体接触;
78.(2)检测是否形成抗原-抗体复合物,其中形成复合物就表示样品中存在冠状病毒s 蛋白。
79.在另一优选例中,所述冠状病毒s蛋白为冠状病毒s2蛋白。
80.在另一优选例中,所述检测为非治疗非诊断目的。
81.本发明的第十六方面,提供了一种检测板,所述的检测板包括:基片(支撑板)和测试条,所述的测试条含有如本发明第五方面所述的抗体或如本发明第九方面所述的免疫偶联物。
82.本发明的第十七方面,提供了一种试剂盒,所述试剂盒中包括:
83.(1)第一容器,所述第一容器中含有如本发明第五方面所述的抗体;和/或
84.(2)第二容器,所述第二容器中含有抗如本发明第五方面所述的抗体的二抗;
85.或者,所述试剂盒含有如本发明第十六方面所述的检测板。
86.本发明的第十八方面,提供了一种重组多肽的制备方法,所述方法包括:
87.(a)在适合表达的条件下,培养如本发明第十四方面所述的宿主细胞;
88.(b)从培养物中分离出重组多肽,所述的重组多肽是如本发明第五方面所述的抗体或如本发明第六方面所述的重组蛋白。
89.本发明的第十九方面,提供了一种治疗冠状病毒感染的方法,所述方法包括:给需要的对象施用如本发明第五方面所述的抗体、所述抗体的抗体-药物偶联物、或表达所述抗体的car-t细胞、或其组合。
90.本发明的第二十方面,提供了一种疫苗组合物,所述组合物包括:
91.(i)包含有如seq id no.:10所示的sars-cov-2s2蛋白809-833位氨基酸序列或其部分序列的多肽;和
92.(ii)疫苗上可接受的载体。
93.在另一优选例中,所述多肽与如seq id no.:10所示氨基酸序列的同一性≥85%,较佳地≥90%,更佳地≥95%。
94.在另一优选例中,所述多肽与如seq id no.:10所示氨基酸序列的同一性≥85%、≥86%、≥87%、≥88%、≥89%、≥90%、≥91%、≥92%、≥93%、≥94%、≥95%、≥96%、≥97%、≥98%或≥99%。
95.在另一优选例中,所述载体是药学上可接受的载体。
96.在另一优选例中,所述药学上可接受的载体含有液体,较佳地为水、盐水或缓冲液。
97.在另一优选例中,所述载体还含有辅助性的物质,较佳地为填充剂、润滑剂、助流剂、润湿剂或乳化剂、ph缓冲物质等。
98.在另一优选例中,所述载体中还含有细胞转染试剂。
99.在另一优选例中,所述疫苗组合物为二联疫苗或多联疫苗。
100.在另一优选例中,所述疫苗组合物为预防新型冠状病毒感染的疫苗。
101.在另一优选例中,所述疫苗组合物还可以含有源自一种或多种选自下组的病原体的疫苗组分:sars-cov、mers-cov、hcov-229e、hcov-oc43、hcov-nl63、hcov-hku1 或其组合。
102.在另一优选例中,所述的疫苗组分包括灭活株、减毒株、或蛋白、多肽、核酸等。
103.在另一优选例中,所述的疫苗组合物还含有佐剂。
104.在另一优选例中,所述佐剂包括:颗粒型和非颗粒型佐剂。
105.在另一优选例中,所述颗粒型佐剂选自下组:铝盐、油包水乳剂、水包油乳剂、纳米颗粒、微小颗粒、脂质体、免疫刺激复合物,或其组合;
106.另一优选例中,所述非颗粒型佐剂选自下组:胞壁酰二肽及其衍生物、皂苷、脂质 a、细胞因子、衍生多糖、细菌毒素,微生物及其产物如分枝杆菌(结核杆菌、卡介苗)、短小杆菌、百日咳杆菌、蜂胶、或其组合。
107.在另一优选例中,所述的疫苗组合物为注射剂型。
108.在另一优选例中,所述的疫苗组合物为重组亚单位疫苗、载体疫苗、合成肽疫苗、核酸疫苗或其组合。
109.本发明的第二十一方面,提供了一种抑制剂,所述抑制剂靶向sars-cov-2s2蛋白 809-833线性表位,用于抑制新冠病毒感染。
110.在另一优选例中,所述的抑制剂为(a)包含如seq id no.:10所示的sars-cov-2s2 蛋白809-833位氨基酸序列或其部分序列的多肽。
111.在另一优选例中,所述多肽与如seq id no.:10所示氨基酸序列的同一性≥85%,较佳地≥90%,更佳地≥95%。
112.在另一优选例中,所述多肽与如seq id no.:10所示氨基酸序列的同一性≥85%、≥86%、≥87%、≥88%、≥89%、≥90%、≥91%、≥92%、≥93%、≥94%、≥95%、≥96%、≥97%、≥98%或≥99%。
113.在另一优选例中,所述的抑制剂为(b)靶向sars-cov-2s2蛋白809-833线性表位的小分子化合物。
114.在另一优选例中,所述的抑制剂为(a)和(b)的组合。
115.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
116.图1显示了76e1抗体对冠状病毒sars-cov-2的全长s蛋白,s1蛋白和s2蛋白的结合活性。其中,76e1抗体可以结合sars-cov-2的全长s蛋白和s2蛋白,不能结合s1蛋白。
117.图2显示了76e1抗体可以广谱性结合不同冠状病毒的s蛋白。其中,图2a-c显示了76e1/76f6/28-12与7株感染人类的冠状病毒s蛋白的结合情况;图2d显示了7株体外纯化的冠状病毒s蛋白与76e1的亲和力分析结果;图2e-g显示了76e1与细胞表面的s蛋白的结合活性的流式细胞分析结果。
118.图3显示了76e1抗体可以广谱性中和不同冠状病毒假病毒。
119.图4显示了76e1抗体可以中和sars-cov-2真病毒。
120.图5显示了76e1抗体识别s2 809-833的线性表位。
121.图6显示了76e1抗体抑制病毒与细胞膜融合的结晶紫染色结果。
122.图7显示了76e1抗体抑制s2’酶切位点的酶切的蛋白质印迹结果。
123.图8显示了76e1抗体保护ace2人源化小鼠感染sars-cov-2真病毒,减轻其体重下降。
124.图9显示了76e1抗体降低ace2人源化小鼠感染sars-cov-2真病毒后肺部病毒载量
具体实施方式
125.本发明人通过广泛而深入的研究,意外地获得一株针对冠状病毒s2蛋白的全人单克隆抗体76e1。该抗体能够可以广谱性的结合冠状病毒s2蛋白,并对冠状病毒具有很高的结合中和活性,具有识别广谱性和广谱中和性,能够抑制或阻止冠状病毒侵染易感细胞。体内外实验证实76e1抗体能有效地预防及控制冠状病毒的感染。在此基础上,完成了本发明。
126.本发明从一个新冠病毒感染康复患者志愿者pbmc中,通过单细胞rt-pcr技术筛选到一株抗冠状病毒全人广谱性中和抗体76e1。elisa结合实验和细胞水平中和实验证实
76e1抗体对冠状病毒s2蛋白具有广谱结合活性和广谱中和活性。且76e1抗体属于全人源抗体,不含有鼠源成分,意味着其有更低的免疫原性和更高的安全性,这预示该抗体潜在的抗冠状病毒感染的临床应用价值,为临床上提供新型抗冠状病毒感染的候选药物。本发明的抗体结合冠状病毒s蛋白,特别是s蛋白融合肽809-833位,76e1抗体表位的发掘也为冠状病毒疫苗的设计提供一些新的思路和参考。
127.术语
128.为了更容易理解本发明,以下具体定义了某些技术和科学术语。除非在本文中另有明确定义,本文使用的所有其它技术和科学术语都具有本发明所属领域的一般技术人员通常理解的含义。在描述本发明之前,应当理解本发明不限于所述的具体方法和实验条件,因为这类方法和条件可以变动。还应当理解本文所用的术语其目的仅在于描述具体实施方案,并且不意图是限制性的,本发明的范围将仅由所附的权利要求书限制。
129.除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。如本文所用,在提到具体列举的数值中使用时,术语“约”意指该值可以从列举的值变动不多于1%。例如,如本文所用,表述“约100”包括99 和101和之间的全部值(例如,99.1、99.2、99.3、99.4等)。
130.本发明所用氨基酸三字母代码和单字母代码如j.biol.chem,243,p3558(1968)中所述。
131.如本文所用,术语“治疗”指给予患者内用或外用治疗剂,包含本发明的针对冠状病毒s蛋白(较佳地s2蛋白)的单克隆抗体及其组合物,所述患者具有一种或多种疾病症状,而已知所述治疗剂对这些症状具有治疗作用。通常,以有效缓解一种或多种疾病症状的治疗剂的量(治疗有效量)给予患者。
132.如本文所用,术语“任选”或“任选地”意味着随后所描述的事件或情况可以发生但不是必须发生。例如,“任选包含1-3个抗体重链可变区”是指特定序列的抗体重链可变区可以有但不是必须有,可以是1个、2个或3个。
133.本发明所述的“序列同一性”表示当具有适当的替换、插入或缺失等突变的情况下最佳比对和比较时,两个核酸或两个氨基酸序列之间的同一性程度。本发明中所述的序列和其具有同一性的序列之间的序列同一性可以至少为85%、90%或95%,优选至少为95%。非限制性实施例包括85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%, 97%,98%,99%,100%。
134.冠状病毒(coronavirus,cov)
135.冠状病毒在系统分类上属套式病毒目(nidovirales)冠状病毒科(coronaviridae)冠状病毒属(coronavirus)。冠状病毒属的病毒是具囊膜(envelope)、基因组为线性单股正链的rna病毒,是自然界广泛存在的一大类病毒。冠状病毒直径约80~120nm,基因组5
′
端具有甲基化的帽状结构,3
′
端具有poly(a)尾,基因组全长约27-32kb,是目前已知rna病毒中基因组最大的病毒。其仅感染脊椎动物,如人、鼠、猪、猫、犬、狼、鸡、牛、禽类。
136.2019新型冠状病毒(sars-cov-2,引发新型冠状病毒肺炎covid-19)是目前已知的第7种可以感染人的冠状病毒,其余6种分别是hcov-229e、hcov-oc43、hcov-nl63、 hcov-hku1、sars-cov(引发重症急性呼吸综合征)和mers-cov(引发中东呼吸综合征)。
137.为进一步获得疗效更好的、全新的冠状病毒抗体药物及寻找新的抗体识别表位,本发明利用单细胞rt-pcr技术从人的外周血pbmc中分离到一株广谱性中和抗体76e1。新的抗体的发现一方面为广谱中和抗体治疗应用提供了新的选择,另一方面新的表位的发现为广谱疫苗的开发提供了新的思路。
138.抗体
139.如本文所用,术语“抗体”或“免疫球蛋白”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。
140.如本文所用,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(fr)。天然重链和轻链的可变区中各自包含四个 fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nih publ.no.91-3242,卷i,647-669页(1991))。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。
141.脊椎动物抗体(免疫球蛋白)的“轻链”可根据其恒定区的氨基酸序列归为明显不同的两类(称为κ和λ)中的一类。根据其重链恒定区的氨基酸序列,免疫球蛋白可以分为不同的种类。主要有5类免疫球蛋白:iga,igd,ige,igg和igm,其中一些还可进一步分成亚类 (同种型),如igg1,igg2,igg3,igg4,iga和iga2。对应于不同类免疫球蛋白的重链恒定区分别称为α、δ、ε、γ、和μ。不同类免疫球蛋白的亚单位结构和三维构型是本领域人员所熟知的。
142.如本文所用,术语“单克隆抗体(单抗)”指从一类基本均一的群体获得的抗体,即该群体中包含的单个抗体是相同的,除少数可能存在的天然发生的突变外。单克隆抗体高特异性地针对单个抗原位点。而且,与常规多克隆抗体制剂(通常是具有针对不同决定簇的不同抗体)不同,各单克隆抗体是针对抗原上的单个决定簇。除了它们的特异性外,单克隆抗体的好处还在于它们是通过杂交瘤培养来合成的,不会被其它免疫球蛋白污染。修饰语“单克隆”表示了抗体的特性,是从基本均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来生产抗体。
143.本发明还包括具有所述的抗冠状病毒s蛋白(较佳地s2蛋白)单克隆抗体的相应氨基酸序列的单克隆抗体、具有所述的抗冠状病毒s蛋白(较佳地s2蛋白)单克隆抗体可变区链的单克隆抗体,以及具有这些链的其他蛋白质或蛋白质偶联物及融合表达产物。具体地,本发明包括具有含超变区(互补决定区,cdr)的轻链和重链的任何蛋白质或蛋白质偶联物及融合表达产物(即免疫偶联物及融合表达产物),只要该超变区与本发明的轻链和重链的
region, cdr)”可互换使用。
155.术语“cdr”是指抗体的可变结构域内主要促成抗原结合的6个高变区之一。所述6 个cdr的最常用的定义之一由kabat e.a等人,(1991)sequences of proteins ofimmunological interest.nih publication91-3242)提供。
156.在本发明的一个优选的实施方式中,所述抗体的重链可变区包括以下三个互补决定区cdr:
157.cdr1:gfsfkdyg(seq id no.:3),
158.cdr2:isgdtrgt(seq id no.:4),和
159.cdr3:aalvivaagddfdl(seq id no.:5)。
160.在另一优选例中,所述重链可变区的氨基酸序列如seq id no.:1所示,其中下划线标注的依次为重链可变区cdr1,cdr2,cdr3的氨基酸序列。
161.evqlvesgggvvqpggslrlsceasgfsfkdygmhwirqtpgkglewisrisgdtrgtsyvdsvkgrfivsrdnsrnslflqmnslrsedtalyycaalvivaagddfdlwgqgtvvtvss(seq id no.:1)
162.在另一优选例中,所述重链可变区的核酸编码序列如seq id no.:8所示,其中下划线标注的依次为重链可变区cdr1,cdr2,cdr3的核酸编码序列。
163.gaggtgcagctggtggagtctgggggaggcgtggtgcagccgggggggtc cctgaggctctcctgtgaagcctctggattcagctttaaagactatggcatgca ctggatccgtcagactccagggaagggtctggagtggatctctcgtattagtggagacactagaggcacatcctatgtagactctgtgaagggccgattcatcgtctc cagagacaacagcagaaactccttgtttttacaaatgaacagtctgagaagtga agacaccgccttgtattactgtgcagcattagttattgtagctgccggcgatgattttgatctctggggccaagggacagtggtcaccgtttcttca(seq id no.:8)
164.在本发明的一个优选的实施方式中,所述抗体的重链包括上述重链可变区和重链恒定区,所述重链恒定区可以为鼠源或人源。
165.如本文所用,术语“轻链可变区”与“v
l”可互换使用。
166.在本发明的一个优选的实施方式中,根据本发明的抗体的轻链可变区,具有选自下组的互补决定区cdr:
167.cdr1’:ssdigsynf(seq id no.:6),
168.cdr2’:evn,和
169.cdr3’:csyggrnnli(seq id no.:7)。
170.在另一优选例中,所述轻链可变区的氨基酸序列如seq id no.:2所示,其中双下划线标注的依次为轻链可变区cdr1’,cdr2’,cdr3’的氨基酸序列。
171.qsaltqplsvsgspgqsvtisctgsssdigsynfvswyrqypgkapkvmiyevn krpsgvpvrfsgsksgntasltvsglqhedeadyyccsyggrnnlifgggtkltvl (seq id no.:2)
172.在另一优选例中,所述轻链可变区的核酸编码序列如seq id no.:9所示,其中双下划线标注的依次为轻链可变区cdr1’,cdr2’,cdr3’的核酸编码序列。
173.cagtctgccctgactcagcctctctcagtgtccgggtctcctggacagtcc gtcaccatctcctgcactggatccagcagtgacattgggagttataattttgtct cctggtatcgacaatatccaggcaaagcccccaaagtcatgatctatgaggtcaataagcggccctcgggggtccctgttcgcttctctggctccaagtctggcaaca cggcctccctgaccgtctctgggctccaacatgaggatgaggctgactattact gctgctcatatggaggccgcaaca
atttgattttcggcggagggaccaagctga ccgtccta(seq id no.:9)
174.在本发明的一个优选的实施方式中,所述抗体的轻链包括上述轻链可变区和轻链恒定区,所述轻链恒定区可以为鼠源或人源。
175.本发明抗体的功能是由此抗体轻链和重链可变区基因特异性基因序列决定,可以广谱性的结合冠状病毒的s2蛋白,能够阻止冠状病毒侵染易感细胞。利用此抗体可变区基因或互补决定区(cdr)基因,可在利用原核和真核细胞的任何表达系统中改造和生产不同形式的基因工程抗体。
176.在本发明中,术语“本发明抗体”、“本发明蛋白”、或“本发明多肽”可互换使用,都指特异性结合冠状病毒s蛋白(较佳地s2蛋白)的抗体,例如具有重链可变区(如 seq id no.:8所示的核苷酸序列编码的氨基酸序列)和/或轻链可变区(如seq id no.: 9所示的核苷酸序列编码的氨基酸序列)的蛋白或多肽。它们可含有或不含起始甲硫氨酸。
177.在另一优选例中,所述的抗体为抗冠状病毒s蛋白(较佳地s2蛋白)的鼠或人鼠嵌合单克隆抗体,它的重链恒定区和/或轻链恒定区可以是人源化的重链恒定区或轻链恒定区。更优选地,所述的人源化的重链恒定区或轻链恒定区为人igg1、igg2 等的重链恒定区或轻链恒定区。
178.一般,抗体的抗原结合特性可由位于重链和轻链可变区的3个特定的区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了 fr或cdr区域。
179.本发明抗体的重链和/或轻链的可变区特别令人感兴趣,因为它们中至少部分涉及结合抗原。因此,本发明包括那些具有带cdr的单克隆抗体轻链和重链可变区的分子,只要其cdr与此处鉴定的cdr具有90%以上(较佳地95%以上,最佳地98%以上)的同源性。
180.本发明不仅包括完整的单克隆抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。例如在本发明抗体的基础上进行的fc片段的改造,为了延长抗体半衰期,在ch2区域引入三个突变点m252y/s254t/t256e。
181.如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明抗体相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或与 6his标签形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
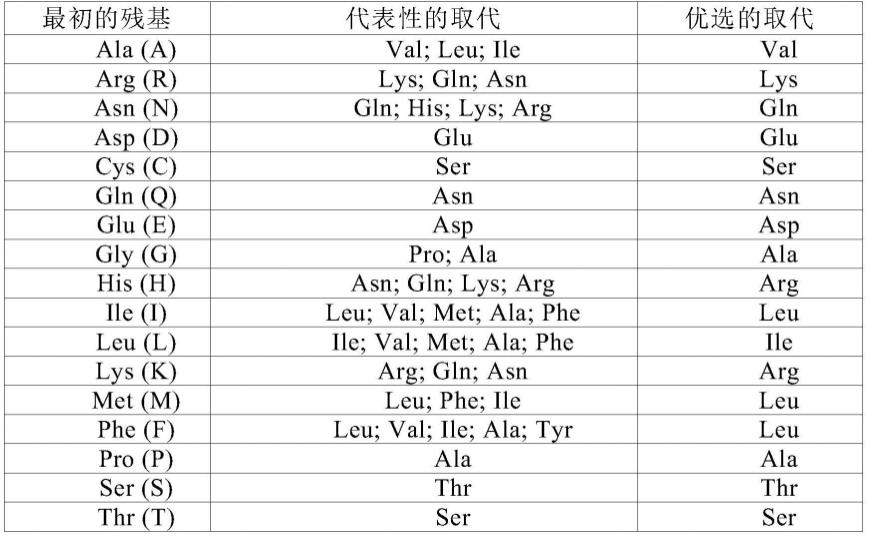
182.本发明抗体指具有冠状病毒s蛋白(较佳地s2蛋白)结合活性的、包括上述 cdr区的多肽。该术语还包括具有与本发明抗体相同功能的、包含上述cdr区的多肽的变异形式。这些变异形式包括(但并不限于):一个或多个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在 c末端和/或n末端添加一个或数
个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括本发明抗体的活性片段和活性衍生物。
183.该多肽的变异形式包括:同源序列、保守性变异体、等位变异体、天然突变体、诱导突变体、在高或低的严紧度条件下能与本发明抗体的编码dna杂交的dna所编码的蛋白、以及利用抗本发明抗体的抗血清获得的多肽或蛋白。
184.本发明还提供了其他多肽,如包含人抗体或其片段的融合蛋白。除了几乎全长的多肽外,本发明还包括了本发明抗体的片段。通常,该片段具有本发明抗体的至少约50个连续氨基酸,较佳地至少约60个连续氨基酸,更佳地至少约80个连续氨基酸,最佳地至少约100个连续氨基酸。
185.在本发明中,“本发明抗体的保守性变异体”指与本发明抗体的氨基酸序列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。
186.表a
[0187][0188][0189]
本发明还提供了编码上述抗体或其片段或其融合蛋白的多核苷酸分子。本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码成熟多肽的编码区序列可以与seq id no.:8或9所示的编码区序列相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码具有与本发明的多肽相同的氨基酸序列,但与seq id no.:8或9所示的编码区序列有差别的核酸序列。
[0190]
编码本发明的成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。
[0191]
术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
[0192]
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少 70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2
×
ssc,0.1%sds,60℃;或(2)杂交时加有变性剂,如 50%(v/v)甲酰胺,0.1%小牛血清/0.1%ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与seq id no.:1和/或seq id no.:2所示的成熟多肽有相同的生物学功能和活性。
[0193]
本发明的抗体的核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。一种可行的方法是用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。此外,还可将重链的编码序列和表达标签(如6his)融合在一起,形成融合蛋白。
[0194]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。本发明所涉及的生物分子(核酸、蛋白等)包括以分离的形式存在的生物分子。
[0195]
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0196]
本发明还涉及包含上述的适当dna序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0197]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母;果蝇s2或sf9的昆虫细胞;cho、cos7、293 细胞的动物细胞等。
[0198]
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔,脂质体包装等。
[0199]
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
[0200]
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用
蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0201]
本发明的抗体可以单独使用,也可与可检测标记物(为诊断目的)、治疗剂、pk(蛋白激酶)修饰部分或任何以上这些物质的组合结合或偶联。
[0202]
用于诊断目的的可检测标记物包括但不限于:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶。
[0203]
可偶联的治疗剂包括但不限于:胰岛素、il-2、干扰素、降钙素、ghrh肽、肠肽类似物、白蛋白、抗体片段、细胞因子、和激素。
[0204]
此外还可与本发明抗体结合或偶联的治疗剂包括但不限于:1.放射性核素;2. 生物毒;3.细胞因子如il-2等;4.金纳米颗粒/纳米棒;5.病毒颗粒;6.脂质体; 7.纳米磁粒;8.前药激活酶;10.化疗剂(例如,顺铂)或任何形式的纳米颗粒等。
[0205]
本发明还提供了一种组合物。在优选例中,所述的组合物是药物组合物,它含有上述的抗体或其活性片段或其融合蛋白,以及药学上可接受的载体。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为 5-8,较佳地ph约为6-8,尽管ph值可随被配制物质的性质以及待治疗的病症而有所变化。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):口服、呼吸道、瘤内、腹膜内、静脉内、或局部给药。
[0206]
本发明的药物组合物可直接用于结合冠状病毒s蛋白(较佳地s2蛋白)分子,因而可用于延长药物的半衰期,此外,还可同时使用其他治疗剂。
[0207]
本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的本发明上述的单克隆抗体(或其偶联物)以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1 微克/千克体重-约10毫克/千克体重。此外,本发明的多肽还可与其他治疗剂一起使用。
[0208]
使用药物组合物时,是将安全有效量的免疫偶联物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约8毫克/千克体重,较佳地该剂量是约10微克/千克体重-约1毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0209]
检测用途和试剂盒
[0210]
本发明的抗体可用于检测应用,例如用于检测样本,从而提供诊断信息。
[0211]
本发明中,所采用的样本(样品)包括细胞、组织样本和活检标本。本发明使用的术语“活检”应包括本领域技术人员已知的所有种类的活检。因此本发明中使用的活检可以包括例如通过内窥镜方法或器官的穿刺或针刺活检制备的组织样本。
[0212]
本发明中使用的样本包括固定的或保存的细胞或组织样本。
[0213]
本发明还提供了一种指含有本发明的抗体(或其片段)的试剂盒,在本发明的一个优选例中,所述的试剂盒还包括容器、使用说明书、缓冲剂等。在优选例中,本发明的抗体可
以固定于检测板。
[0214]
sars-cov-2s2蛋白809-833线性表位
[0215]
本发明提供的单克隆抗体优选地结合sars-cov-2s2蛋白809-833线性表位,具体序列如下所示:
[0216]
pskpskrsfiedllfnkvtladagf(seq id no.:10)。
[0217]
其中,815(r)、819(e)、823(f)为本发明的抗体76e1作用的最关键表位, 820(d)和822(l)为次关键表位。
[0218]
基于该表位,本发明还提供了一种疫苗组合物,所述疫苗组合物包括:
[0219]
(i)包含有如seq id no.:10所示的sars-cov-2s2蛋白809-833位氨基酸序列或其部分序列的多肽;和
[0220]
(ii)疫苗上可接受的载体。
[0221]
此外,本发明还提供了一种种抑制剂,所述抑制剂靶向sars-cov-2s2蛋白809-833 线性表位,用于抑制新冠病毒感染。
[0222]
在另一优选例中,所述的抑制剂为(a)包含如seq id no.:10所示的sars-cov-2s2 蛋白809-833位氨基酸序列或其部分序列的多肽。
[0223]
在另一优选例中,所述的抑制剂为(b)靶向sars-cov-2s2蛋白809-833线性表位的小分子化合物。
[0224]
在另一优选例中,所述的抑制剂为(a)和(b)的组合。
[0225]
本发明的主要优点
[0226]
(1)本发明全人单克隆抗体能够特异性识别并结合冠状病毒的s蛋白,对冠状病毒具有很高的中和活性,并且可以结合中和229e-cov,oc43-cov,nl63-cov,hku1-cov, sars-cov-2,sars-cov及mers-cov 7株感染人类的冠状病毒s蛋白,有效抑制或阻止冠状病毒侵染易感细胞。
[0227]
(2)本发明全人单克隆抗体对多种冠状病毒具有广谱结合活性和广谱中和活性,能有效中和多种冠状病毒。
[0228]
(3)本发明是全人单克隆抗体76e1,不含鼠源部分,对人体来说具有更低的免疫原性和更高的安全性,可以避免人抗鼠等其它物种来源的抗体介导免疫排斥反应。
[0229]
(4)本发明全人单克隆抗体76e1结合冠状病毒s蛋白,特别是s2蛋白上的融合肽,即809-833氨基酸,是一段线性表位,76e1抗体表位的发掘也为冠状病毒疫苗的设计提供一些新的思路和参考。
[0230]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0231]
本发明实施例或测试例中未注明具体条件的实验,通常按常规条件进行,或按照原料/商品制造商建议的条件;未注明具体来源的试剂,为市场购买的常规试剂。
[0232]
以下说明本发明能够中和冠状病毒s蛋白的中和性全人单克隆抗体制备以及抗体特性分析过程。
[0233]
实施例1单细胞rt-pcr法获得抗体基因以及抗体表达
[0234]
1.1外周血单核细胞(pbmc)的获得
[0235]
从健康的志愿者体内抽取外周血,采用常规ficoll-paque(厂家为-h (cedarlane)公司)密度梯度离心,得到107以上个外周血单核细胞(pbmc)。
[0236]
ficoll分离方法:
[0237]
(1)收集血液,于50ml离心管(预含4%柠檬酸钠1ml),收集全血20ml,颠倒混匀8-10次。(即使柠檬酸钠终浓度为0.4%);
[0238]
(2)加等体积rpmi1640(含柠檬酸钠),混匀;
[0239]
(3)用15ml透明离心管,铺3ml淋巴细胞分离液,在其上小心加6ml血样。形成分离界面(或4ml分离液加8ml血样);
[0240]
(4)室温离心800g,20min(2000rpm,20min);
[0241]
(5)小心吸取界面层细胞,转移至新管;
[0242]
(6)加rpmi1640(含柠檬酸钠),稀释减小液体密度。离心,800g/2000rpm,10min。去上清;
[0243]
(7)rpmi1640洗细胞2-3次,备用
[0244]
1.2刺突蛋白s特异性记忆b细胞的获得
[0245]
使用fitc-cd19/apc-igg/bv421-s蛋白为标志物,bd horizon
tm fixable viabilitystain 780-apc-cy7去掉死细胞,cd4/cd14/cd8-percp5.5去除巨噬细胞和t细胞等,经流式细胞仪获得特异性b细胞至96孔rt-pcr板,每孔一个细胞,获得s蛋白特异性记忆b细胞。
[0246]
(1)sars-cov-2 s蛋白由哺乳动物细胞cho表达系统表达。s蛋白序列参考 ncov-sh01(genbank:mt121215.1),在上海捷瑞公司进行全基因合成;
[0247]
(2)sars-cov-2 s蛋白进行生物素(biotin)标记,用来检测生物素标记的s蛋白;
[0248]
(3)分选细胞的标记:pbmc细胞分组,实验组 对照组,按细胞数加入标志物,避光染色,进行标记,用pbs重悬后,使用40μm bd falcon滤膜过滤;
[0249]
(4)特异性b细胞的分选:使用bd facs influx筛选,根据前向角和侧向角从 pbmc中筛选到淋巴细胞,然后通过不同对照组的调节补偿,获得s蛋白的特异性记忆b 细胞,将其分选到96孔板中进行rt-pcr(反转录pcr),每孔一个细胞,板置于干冰上。
[0250]
1.3抗体基因获得及载体构建
[0251]
将获得的单个记忆b细胞通过rt-pcr获得cdna,然后通过nested-pcr获得抗体基因可变区,跑琼脂糖核酸凝胶,将重轻链可以配对的胶块回收并测序。检索获得抗体基因序列。接下来将抗体基因分别连接到相应的igh,igκ和igλ表达载体上。全人抗体表达载体igh,igκ和igλ(分别表达抗体heavy链、kappa链、lambda链),由patrick wilson实验室馈赠。
[0252]
1.4抗体表达和纯化
[0253]
瞬时转染cho细胞,进行全人抗体表达。转染前一天(第
–
1天),分种 expicho-s
tm
细胞,最终密度为3
×
106–4×
106个活细胞/ml,使细胞过夜生长。次日(第0天),测定活细胞密度和存活率百分比。细胞密度应达到约7
×
106–
10
×
106个活细胞/ml。存活率应为95
–
99%,方可继续转染。将细胞稀释至最终密度为6
×
106个活细胞/ml。使用预冷的试剂(4℃)配制
expi fectamine
tm cho/质粒dna复合物。室温孵育expi fectamine
tm cho/质粒dna复合物1
–
5分钟,然后将溶液慢慢转移至cho细胞培养瓶中,在添加过程中轻轻晃动培养瓶。将细胞置于轨道摇床上 (37℃培养箱含8%co2的湿化空气条件下)培养。培养7-11天,待细胞死亡一半时即可收上清,开始纯化抗体。
[0254]
使用protein g agarose 4ff填料(购自ge)纯化抗体。首先将收集的cho细胞悬液4000rpm,4℃离心30min,将收集的上清再用0.45um filter过滤,待纯化。取重力型离心柱,加入protein g agarose 4ff填料,使用3倍柱体积的20%乙醇稳定填料,之后用5倍柱体积的结合缓冲液平衡柱子,然后上样品,再用10倍柱体积的结合缓冲液平衡柱子,最后用3倍柱体积的洗脱缓冲液洗脱柱子,向洗脱下来的抗体溶液中加入中和buffer使洗脱下来的样品ph达7.5左右。将抗体溶液在5l 1*pbs中透析3 次,即可将抗体浓缩保存至-80℃。
[0255]
1.5实验结果:
[0256]
单细胞rt-pcr和nested-pcr法获得匹配抗体重轻链可变区基因,分子量为 400bp左右。琼脂糖割胶回收并进行测序。将测序结果在http://www.ncbi.nlm.nih.gov/igblast及http://www.imgt.org/进行比对,获得抗体胚系基因信息和抗体重轻链基因高可变区信息,并进行表达载体构建及后续表达纯化。最后,通过该技术,成功获得一株广谱性中和冠状病毒的全人单克隆抗体,命名为76e1。
[0257]
全人抗体76e1重链可变区基因序列如下,其中使用下划线标注的为重链基因可变区中的高变区序列,依次为重链基因cdr1,cdr2和cdr3序列。
[0258]
gaggtgcagctggtggagtctgggggaggcgtggtgcagccgggggggtccc tgaggctctcctgtgaagcctctggattcagctttaaagactatggcatgcactgg atccgtcagactccagggaagggtctggagtggatctctcgtattagtggagacactagaggcacatcctatgtagactctgtgaagggccgattcatcgtctccagagaca acagcagaaactccttgtttttacaaatgaacagtctgagaagtgaagacaccgcc ttgtattactgtgcagcattagttattgtagctgccggcgatgattttgatctctgg ggccaagggacagtggtcaccgtttcttca(seq id no.:8)
[0259]
全人抗体76e1重链可变区氨基酸序列如下,其中使用下划线标注的依次为重链氨基酸cdr1,cdr2,cdr3序列。
[0260]
evqlvesgggvvqpggslrlsceasgfsfkdygmhwirqtpgkglewisrisgdtrgtsyvdsvkgrfivsrdnsrnslflqmnslrsedtalyycaalvivaagddfdlwgq gtvvtvss(seq id no.:1)
[0261]
全人抗体76e1轻链可变区基因序列如下,其中下划线标注的为轻链基因可变区中的高变区序列,依次为cdr1’,cdr2’和cdr3’序列。
[0262]
cagtctgccctgactcagcctctctcagtgtccgggtctcctggacagtccgt caccatctcctgcactggatccagcagtgacattgggagttataattttgtctcctg gtatcgacaatatccaggcaaagcccccaaagtcatgatctatgaggtcaataagc ggccctcgggggtccctgttcgcttctctggctccaagtctggcaacacggcctccc tgaccgtctctgggctccaacatgaggatgaggctgactattactgctgctcatatggaggccgcaacaatttgattttcggcggagggaccaagctgaccgtccta(seq id no.:9)
[0263]
全人抗体76e1轻链可变区氨基酸序列如下,其中使用下划线标注的依次为轻链氨基酸cdr1’,cdr2’和cdr3’序列。
[0264]
qsaltqplsvsgspgqsvtisctgsssdigsynfvswyrqypgkapkvmiyevnk rpsgvpvrfsgsksgntasltvsglqhedeadyyccsyggrnnlifgggtkltvl(seq id no.:2)
[0265]
实施例2抗体特性分析
[0266]
2.1elisa检测抗体结合抗原的活性
[0267]
使用elisa检测表达的抗体是否识别不同冠状病毒s蛋白。不同冠状病毒的s蛋白购买自北京义桥神州有限公司。28-12为阴性对照抗体,为本实验室生产。包被s蛋白 elisa板,0.5μg/ml,每孔100μl,4℃过夜。次日pbst洗板3次。2%bsa封闭,每孔200μl,37℃,2h。再次pbst洗板3次。76e1及对照抗体3倍梯度稀释,起始测试浓度为10μg/ml。上样,每孔100μl,37℃,2h。pbst洗板3次。goatanti-human igg(fc specific)-peroxidase antibody(sigma),1:8000稀释,每孔100μl, 37℃,1h。pbst洗板3次。加底物tmb 100μl/孔显色,若颜色较浅可37℃避光反应15min。加入2m h2so4终止反应,每孔50μl。测定od
450
,并进行数据处理。
[0268]
2.2生物膜层干涉技术(bli)亲和力检测
[0269]
本实验在生化细胞研究所的分子平台使用octet red 96仪器完成。首先将 ahc sensor放到有pbs的96孔黑板中浸泡至少10min,加样76e1,浓度为20ug/ml;抗原设置浓度梯度,2倍梯度稀释:200nm-100nm-50nm-25nm-12.5nm-6.25 nm;将抗体抗原及再生buffer及pbs buffer加到另一块黑板中,置于仪器上;设定程序,开始运行,程序为:baseline 120s
→
loading ab
→
300s-baseline
→
240s-association
ꢀ→
900s-disassociation
→
900s-regenaration
→
5s-baseline
→
5s-regenaration
→
5s-baseline
→ꢀ
5s-regenaration
→
5s-baseline
→
5s;软件分析数据,计算抗原抗体亲和力kd值。
[0270]
2.3假病毒中和实验
[0271]
将全长sars-2-cov s蛋白质粒和pnl4-3的质粒共转染hek293t细胞于10cm 培养皿中,6小时换液,48小时后收集上清液,使用完全培养基稀释。将抗体梯度稀释,并与等体积的病毒混合,37℃下培养1h。将抗体和病毒混合物转移到稳定表达的人ace2的hek293t细胞中。37℃下培养48小时。去掉上清,向细胞中加入裂解缓冲液,充分裂解。检测荧光素酶活性(promega)。通过比较实验组的荧光素酶值与仅病毒对照组的荧光素酶值来计算中和效率。计算公式如下:
[0272]
抑制活性百分比(%)=(病毒对照平均值-测试孔读值)/(病毒对照平均值
‑ꢀ
细胞对照平均值)
×
100;
[0273]
ic
50
值通过prism软件计算。
[0274]
2.4合胞体形成实验
[0275]
编码sars-cov,mers-cov和sars-cov-2s蛋白的质粒分别转染hela细胞。同时,另一组hela细胞分别转染编码hace2及hdpp4的质粒。转染48h后,将表达 s蛋白的hela细胞与不同浓度的抗体混合,37℃孵育1小时。将表达ace2的hela 细胞与以上表达sars-cov或者sars-cov-2s蛋白细胞抗体混合物按照1:1混合, 37℃培养12小时。同理,表达hdpp4的hela细胞与以上表达mers-cov s蛋白细胞抗体混合物按照1:1混合,37℃培养12小时。4%pfa固定细胞15min。结晶紫染色2小时。使用olympus ix73共焦显微镜收集和分析图像。
[0276]
2.5酶切抑制实验
[0277]
准备新鲜纯化的sars-cov,mers-cov和sars-cov-2s蛋白,分别与76e1 及对照抗体28-12按照1:5室温孵育1h;按质量比trypsin:ha=1:100加入 tpck-trypsin,室温(22℃)下进行酶切;加入trypsin时刻记作0min,分别于 10min,20min,40min时刻取出混合物
样品后立即加入蛋白loading buffer,100℃煮样10min;通过蛋白质印迹(western blot),使用6xhis抗体检测his显影情况判断ha蛋白酶切情况。
[0278]
2.6真病毒中和实验
[0279]
(1)接种细胞:取处于对数生长期的vero-e6细胞,接种到96孔板中,每孔 100μl,每孔细胞4
×
104个。
[0280]
(2)中和实验:
[0281]
供试品稀释:96孔板第1列(b-g行)加入10μg/ml预稀释样品60μl,加入病毒稀释液60μl后抗体终浓度为5μg/ml,其余孔加入依次3倍稀释的样品60μl。第1 行为细胞对照(cell control,cc)加入无血清培养基120μl,第8行为病毒对照(viruscontrol,vc)加入无血清培养基60μl。
[0282]
病毒稀释:病毒储存液滴度为2.5
×
105tcid50/ml,取病毒储存液200μl,加入 25ml无血清培养基,充分混匀,将病毒稀释至100tcid50/50μl。
[0283]
滴加病毒:垂直悬滴病毒(细胞对照除外)至96孔板内,加样体积60μl/孔,最终病毒-抗体混合液120μl。
[0284]
中和:将加好样的细胞培养板在震荡器上混匀,置于37℃培养箱,中和1小时。中和结束后,吸去接种有细胞的培养板上清液,随后将病毒-血清混合液吸取100μl/ 孔加入其中,放入37℃co2培养箱中培养1小时,进行感染。病毒感染结束后,吸去培养板上清液,空斑形成实验样品加入含有1%的甲基纤维素的维持培养基(dmem 培养基含有2%fbs),放入37℃co2培养箱中培72-96小时。用倒置显微镜于4 天时观察并记录结果,弃去上清,空斑形成实验样品经甲醛固定后,结晶紫染色空斑计数分析。对于测试100%抑制率,用倒置显微镜于2天时观察cpe并记录结果。
[0285]
2.7动物保护实验
[0286]
76e1在小鼠上的预防实验:
[0287]
10周龄的hace转基因雌鼠提前放置到复旦医学院生物安全三级级实验室动物实验房,并分为3个组,4-6只/组,day0天3组小鼠分别接种50mg/kg,150mg/kg 的76e1抗体及pbs作为对照。24h后,用0.5%戊巴比妥钠麻醉小鼠,对小鼠经鼻腔攻击3.7x10^4个病毒颗粒的sars-cov-2。连续称体重3天,并于day3天对小鼠进行安乐死,解剖收集肺组织进行病毒rna测定和组织病理学检查。
[0288]
用trizol试剂(invitrogen)从肺组织中提取病毒rna,并使用反转录试剂盒(中国天根)将rna反转录成cdna。采用super real pre mix plus sybr green试剂盒和上述sars-cov-2 n基因特异性引物进行实时定量pcr,以此测定肺组织中病毒 rna含量。
[0289]
将小鼠肺置于4%多聚甲醛溶液中固定。用苏木精-伊红(h&e)对组织石蜡切片进行染色。通过olympus显微镜观察切片。
[0290]
2.8实验结果
[0291]
(1)76e1抗体只能结合sars-2-cov的s2区域
[0292]
为了研究76e1抗体结合sars-2-cov s蛋白的表位位置,我们用elisa的方法验证 76e1抗体分别对s全长,s1,s2蛋白的结合活性。如图1所示,76e1抗体可以结合s全长蛋白以及s2蛋白,但是并不能结合s1。76e1抗体与以往报道的大部分靶向受体结合区域的新冠抗体不同,主要靶向s2,这暗示其作用机制也会不同于靶向rbd的抗体。
[0293]
(2)76e1抗体能广谱性的结合不同冠状病毒的s蛋白
[0294]
s2区域位于s蛋白的茎秆部,其序列在不同冠状病毒中高度保守。为了研究76e1 抗体结合不同冠状病毒s蛋白的能力,用elisa的方法验证76e1抗体对体外纯化的可溶性的不同冠状病毒s蛋白的结合活性。76f6是一株靶向rbd的抗体,用来作为阴性对照抗体。本发明人实验室拥有的一株抗流感的全人抗体28-12作为阴性同型对照抗体。如图2a-c所示,76e1抗体可以广谱性的结合229e-cov,oc43-cov, nl63-cov,hku1-cov,sars-cov-2,sars-cov及mers-cov 7株感染人类的冠状病毒s蛋白。而rbd抗体76f6只能结合sars-cov-2,阴性对照抗体28-12均不结合各种冠状病毒s蛋白。
[0295]
同时,通过生物膜层干涉技术分析以上7株体外纯化的冠状病毒s蛋白与76e1 的亲和力。76e1与7株冠状病毒s蛋白均表现出较高的亲和活性,亲和力达到nm 级别及以上(图2,d)。为进一步研究76e1与细胞表面的s蛋白的结合活性,将不同 s蛋白转染cho细胞,并通过流式细胞术检测76e1与细胞膜表面的s蛋白的结合活性。结果表明,76e1均可以结合7种细胞表面表达的s蛋白,而76f6只能结合 sars-cov-2s蛋白(图2,e)。然而,76e1并不能结合三聚体s蛋白的融合前形式,意味着其识别的是s蛋白构象变化过程中的某一种形式(图2,f,g)。
[0296]
(3)76e1抗体可以广谱性中和不同冠状病毒假病毒
[0297]
为了进一步确认76e1的功能,包装了sars-cov,mers-cov以及sars-cov-2 的假病毒,在稳转人ace2的293t细胞上进行sars-cov及sars-cov-2假病毒中和实验,在huh7细胞上进行mers-cov假病毒中和实验。实验表明,76e1以不同能力中和不同毒株的假病毒,其对sars-cov-2的中和活性最好,ic
50
为76ng/ml(图 3,a)。sars-cov,mars-cov次之(图3,b,c)。
[0298]
(4)76e1抗体可以中和sars-cov-2真病毒
[0299]
为了进一步确认76e1对sars-cov-2真病毒中和活性,在bsl-3实验室进行 sars-cov-2真病毒中和活性检测。结果表明,76e1可以有效抑制sars-cov-2真病毒,ic
50
为12.25nm(图4)。
[0300]
(5)76e1抗体识别s2 809-833的线性表位
[0301]
首先,通过elisa实验发现76e1依然对变性后的s蛋白保持较高的结合活性,暗示76e1主要识别s蛋白的线性表位。通过对7株冠状病毒s蛋白的序列比对,发现s2上有6处位置序列高度保守。由于76e1可以广谱性的结合这7株病毒的s蛋白,因此76e1的表位极有可能位于这6段多肽上。elisa实验表明,76e1只能结合 809-833多肽(图5,a-c),因此76e1的主要表位位于该段多肽上。该段多肽是融合肽,在介导病毒包膜与宿主胞膜膜融合过程中发挥重要作用。
[0302]
(6)76e1抗体通过抑制病毒与细胞膜融合来抑制病毒感染
[0303]
由于76e1结合s蛋白融合肽,猜测76e1通过抑制病毒与细胞膜融合来抑制病毒感染。通过分别转染hela细胞s质粒及ace2质粒,将hela-s细胞与hela-ace2 细胞混合融合来模拟病毒包膜与宿主包膜融合过程。结果表明,对于sars-cov-2及 sars-cov,76e1可以有效抑制膜融合,而对照抗体28-12不能抑制膜融合(图6)。 mers-cov介导的膜融合相对于sars-cov-2及sars-cov较少,但76e1依然可以有效抑制膜融合,而对照抗体28-12不能(图6)。以上实验证实76e1通过抑制病毒与细胞膜融合来抑制病毒感染。
[0304]
(7)76e1通过抑制s2’酶切位点的酶切来抑制膜融合
[0305]
s蛋白经过s1/s2及s2’的酶切,从而暴露融合肽,促进病毒与细胞膜融合。由于76e1的识别表位靠近s2’酶切位点,因此猜测76e1能抑制s2’的酶切。western blot 实验表明,76e1能抑制s蛋白的s2’的酶切,而对照抗体不能(图7)。
[0306]
(8)76e1抗体保护ace2人源化小鼠感染sars-cov-2真病毒,减轻其体重下降(图8)。76e1抗体降低ace2人源化小鼠感染sars-cov-2真病毒后肺部病毒载量(图9)
[0307]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。