1.本发明属于细胞生物学技术领域,具体涉及一种山羊胰腺腺泡细胞的分离培养及鉴定方法。
背景技术:
2.反刍动物小肠内过瘤胃营养物质的消化受到胰腺外分泌功能的限制,尤其以胰腺淀粉酶分泌不足导致40%的过瘤胃淀粉消化不完全,表现出胰腺外分泌功能不足。开展胰腺腺泡细胞分离培养工作对于进一步从细胞分泌、配体结合、底物摄取、蛋白质合成或第二代信使等角度解析反刍动物胰腺外分泌不足机制,并建立可能的营养调控策略具有重要意义。
3.在细胞水平上对胰腺外分泌功能的探索始于20世纪70年代。并已逐步建立了各类动物的胰腺腺泡细胞分离方法,包括人、猪、牛和鼠等。然而,目前尚未见山羊胰腺腺泡细胞的原代细胞分离和培养方法相关报道。且在已有的培养方法中,消化各动物胰腺腺泡细胞所使用的消化酶和消化时间各有不同,鉴定工作也鲜有报道。
技术实现要素:
4.本发明旨在克服现有技术的不足,提供一种山羊胰腺腺泡细胞的分离培养及鉴定方法。
5.为了达到上述目的,本发明提供的技术方案为:
6.所述山羊胰腺腺泡细胞的分离培养及鉴定方法包括如下步骤:
7.(1)将1-3mm3山羊胰腺组织清洗后离心,弃上清,然后向离心后的沉淀中添加消化液进行山羊胰腺组织消化处理;所述沉淀与消化液的质量体积比为1g/10ml;所述消化液由dmem/f12培养基中添加胶原酶ⅳ和egta配制而成,所述胶原酶ⅳ在dmem/f12培养基中的浓度为1mg/ml,所述egta在dmem/f12培养基中的浓度为0.001mol/ml;
8.(2)终止消化后,离心并弃上清,用原代培养基混匀离心后的沉淀,得山羊胰腺腺泡悬液;所述沉淀与原代培养基的质量体积比为1g/5ml;所述原代培养基由dmem/f12培养基中添加fbs、青链霉素混合液、庆大霉素、两性霉素、胰岛素和egf配制而成,所述fbs、青链霉素混合液、庆大霉素、两性霉素、胰岛素和egf在dmem/f12培养基中的浓度或体积百分比浓度分别为:10%、10%青链霉素混合液、2.5μg/ml、2.5μg/ml、10μg/ml和10ng/ml;
9.(3)依次采用差时消化、差时贴壁及细胞刮取的方式对山羊胰腺腺泡细胞悬液中的山羊胰腺腺泡细胞进行纯化处理;
10.(4)将纯化处理后所得的山羊胰腺腺泡细胞接种至传代培养基中进行传代培养;所述传代培养基由dmem/f12培养基中添加fbs、青链霉素混合液、庆大霉素、两性霉素、胰岛素和egf配制而成,所述fbs、青链霉素混合液、庆大霉素、两性霉素、胰岛素和egf在dmem/f12培养基中的浓度或体积百分比浓度分别为:10%、2%青链霉素混合液、2.5μg/ml、2.5μg/ml、10μg/ml和10ng/ml;
11.(5)对传代培养后的山羊胰腺腺泡细胞进行鉴定。
12.优选地,步骤(1)中所述的消化处理是于37℃、80rpm/min条件下摇床消化时间为20min。
13.优选地,步骤(1)中所述的离心条件是1000rpm/min离心5min;步骤(2)中所述的离心条件是600g/min离心5min。
14.优选地,步骤(2)中所述的终止消化是用含有fbs的dmem/f12培养基中培养基终止,所述dmem/f12培养基中的体积百分比浓度为10%。
15.优选地,步骤(5)中所述的鉴定是利用cpa1抗体鉴定山羊胰腺腺泡细胞。
16.更优选地,所述的鉴定是利用cpa1抗体作为一抗识别山羊腺泡细胞中的cpa1,再用带荧光的二抗与一抗结合来显示cpa1蛋白。
17.下面对本发明作进一步说明:
18.胶原酶是在细胞解离工作中被广泛应用的消化酶,本发明主要评估胶原酶ⅳ不同浓度和消化时间对山羊胰腺腺泡细胞的解离效果,优化山羊胰腺腺泡细胞原代培养方法,以期快速分离出足量且活性良好的胰腺腺泡细胞并稳定培养。该培养方法的建立,可为反刍动物胰腺外分泌功能的进一步研究奠定基础。
19.胰腺在各物种之间,以及各物种不同年龄阶段的生长发育、功能机理都有着极大地差异。因此现今依旧没有一个在各物种上能够稳定分离胰腺腺泡细胞原代培养的方法。当前在已经原代培养成功的胰腺腺泡上进行的研究也还存在着诸多疑问。例如,不同物种胰腺腺泡细胞上的胆囊收缩素(cck)受体类型及分布存在差异,甚至于不具有cck受体,且随着生长发育也有一定变化。反刍动物随生长发育胰腺腺泡细胞上cck受体图谱未见报道;腺泡细胞的自噬机制很大程度上影响着胰腺外分泌功能,然而,自噬的转录调控机制并未研究透彻;胰腺内分泌对胰腺外分泌影响的全部意义也尚不清楚;腺泡细胞内消化酶原提前激活的调控机制尚未得到统一解答;原代培养胰腺腺泡不能稳定传代等一系列疑问;原代培养的胰腺腺泡细胞进行细胞鉴定也鲜有报道。山羊胰腺腺泡细胞分离培养方法的建立有助于对胰腺外分泌功能及其他生理机制在细胞水平上的研究。
20.在细胞分离的过程中能否得到数量足够且形态完整活性良好的腺泡细胞,取决于消化酶的类型的使用。胶原酶和胰蛋白酶在一般消化解离细胞的工作中较为常见。与胰蛋白酶相比,由于胶原酶具有温和的剪切力,胶原酶ⅳ包含至少7中蛋白酶成分,能够更好地将组织块解离成单个细胞。我们还在消化液中运用了egta(一种ca2 螯合剂,能够破坏细胞间的连接而不影响细胞的完整性),这进一步使得我们分离得到的细胞为单个细胞。
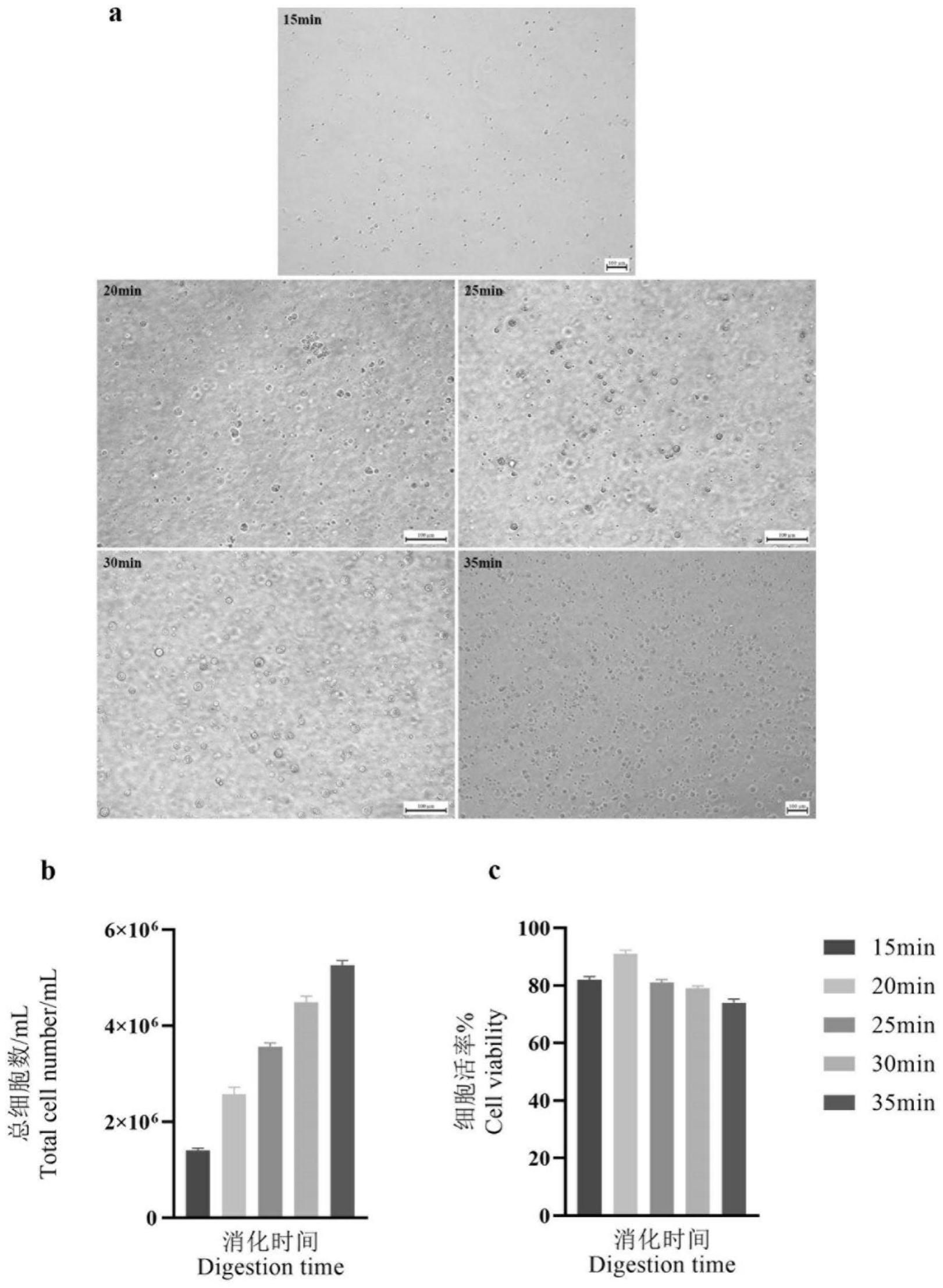
21.自1972年胰腺腺泡细胞运用胶原酶被首次分离成功后,由此在报道的腺泡细胞解离工作中胶原酶被更为广泛的使用。但山羊的胰腺组织在消化解离的过程中可能与其他物种对消化液的要求有差异,因此在我们的工作中胶原酶的工作浓度及消化时间需要验证,确定最佳的消化时间及工作浓度,以期得到良好的山羊胰腺腺泡细胞。jayaveni等人运用1mg/ml胶原酶iii将剪碎的牛胰腺组织消化15min进行牛胰腺腺泡细胞的分离培养,但其工作并未介绍其消化液工作浓度和消化时间消化得到的细胞数和细胞活率。在我们的工作中,我们运用1mg/ml胶原酶ⅳ作为消化液工作浓度,设置五个消化时间节点寻求最佳消化时间。由结果可以看出得到的总细胞数随着时间的延长逐渐增多。总细胞数的细胞活率在15min时低于20min,造成这样的原因我们猜测,由于在消化前我们对胰腺组织进行机械剪
切,造成组织块表面较多的损伤细胞。而20min进一步消化出更多的未损伤细胞,所以20min细胞活率高于15min。而随着时间的延长细胞活率逐渐降低,这就应该是消化过度造成的。因此我们选取总细胞数相对适宜,细胞活率较高的20min进行后一步的试验,因为较高的细胞活率可避免接种后的污染风险。另外我们在后期的试验中希望在较短的培养时间能得到足量的第一代贴壁细胞,因此我们尤其注重得到的细胞具有较高活力,使解离得到的细胞具有较高的贴壁效率。
22.在验证适宜消化时间的过程中我们发现,有细胞碎片的存在,因此我们尝试将消化液工作浓度降低,将1mg/ml胶原酶ⅳ降低到0.5mg/ml,在消化20min的情况下,结果显示细胞碎片确实少了许多,但单个细胞数量及细胞活率并不理想。在其他胰腺腺泡细胞的原代培养工作中,研究人员们同样也运用了1mg/ml胶原酶,但胶原酶的类型不同。由于胰腺自身的自噬、分泌消化酶等特异性,存在胰腺组织坏死及细胞损伤的情况,因此我们并未尝试用低浓度的消化酶去延长消化时间,以得到更多的单个细胞。另外,胰腺腺泡细胞的自我损伤也是细胞分离难度较高,细胞生长不稳定的主要原因,因此消化酶浓度和消化时间的把控极为重要。
23.在各种细胞培养的工作中,0.25%胰蛋白酶常作为原代细胞解离的消化液来使用,但在胰腺组织上的运用较为少见,guo等人运用胰蛋白酶冷消化法解离犊牛胰腺腺泡细胞,但其消化的时间相对较长。在与1mg/ml胶原酶ⅳ对比的试验中我们发现,0.25%胰蛋白酶在同等条件下消化效率并不如胶原酶ⅳ,虽说在显微镜下观察后我们发现0.25%胰蛋白酶消化得到的细胞碎片相对较少。但细胞碎片的问题经过我们多次摸索发现,在600g/min,离心五分钟,重复两次可以有效清除细胞碎片的存在。
24.胰腺腺泡细胞虽然在胰腺组织中占比极高,但是在原代培养的过程中不免会分离出胰腺中的其他细胞,因此在培养过程中我们对分离的腺泡细胞进行了细胞纯化工作。分离的原代细胞主要依靠流式细胞术、差时消化、差速贴壁及刮取等技术手段进行细胞纯化。但由于物种的原因,山羊胰腺腺泡细胞进行基因编辑存在极高的难度,另外就是抗体的缺乏,导致在我们的工作中难以运用流式细胞术来纯化分离得到的山羊胰腺腺泡细胞。因此我们运用了差时消化、差时贴壁、刮取等手段相结合来对腺泡细胞进行纯化工作。这些手段相结合在保证成本的前提下,能够得到较为纯的细胞。虽说这三种技术主要依靠细胞形态来判断纯化得到的细胞,但我们在之后进行了细胞的鉴定工作。由此也可验证我们纯化细胞工作的可行性。
25.鉴于胰腺腺泡细胞分泌消化酶的特殊性,在之前各物种培养原代腺泡细胞时都讨论了细胞存活时限。早先原代培养的胰腺腺泡细胞存活时间比较短,随着消化酶、消化时间和培养基等影响因素的不断优化,目前胰腺腺泡细胞的培养时间大概在两周左右。但体外培养细胞所需的条件肯定是存在缺陷的,因此原代细胞应该总是处于一个应激的状态。近来也有报道,胰腺腺泡细胞极易化生为胰腺导管细胞,如果长时间培养可能会导致这样的情况发生。因此在我们的工作中,我们更期望得到与原组织更为接近的细胞。所以在细胞量足够的情况下我们更希望得到第一及第二代细胞。为保证细胞的活性我们在培养基中添加了egf,同为防止腺泡细胞自身分泌消化酶的影响我们在培养基中添加了10%的特级胎牛血清(fbs)。在这些条件的影响下,保证了我们的腺泡细胞在第一代及第二代有了良好的完整性及活性。另外我们还尝试继续传代和冻存,结果显示我们培养的细胞能够传5代以上。
冻存复苏后也有较好的活性。
26.在胰腺腺泡细胞分离成功后,由于考虑到腺泡细胞自身分泌胰蛋白酶,可能造成腺泡细胞不容易贴壁,因此我们担心分离培养的细胞是否是我们预期得到的腺泡细胞。尽管胰腺腺泡细胞的分离培养已有过一些报道,但鉴定工作并不多见。鉴于原代培养的山羊胰腺腺泡细胞分离培养及鉴定工作鲜有报道,另外也为验证纯化工作的可行性,为此我们展开了山羊胰腺腺泡细胞的鉴定工作。一开始我们效仿jayaveni等人运用α-淀粉酶抗体来进行鉴定工作,但经过多次试验及调整并未显示阳性,我们分析可能是物种的原因造成的。因此决定选用其他抗体进行鉴定。羧肽酶a1(cpa1)是一种在胰腺腺泡细胞中产生的锌金属蛋白酶,在饮食蛋白c端支链和芳香族氨基酸的裂解过程中发挥作用,最早于1929年从牛胰腺提取物中鉴定出该酶。在医学上cpa1被确定为胰腺腺泡细胞癌的标志物,但在运用胰腺组织做免疫组化时,正常胰腺组织中的腺泡细胞也能被cpa1抗体染色呈阳性,且相较于胰蛋白酶等其他标志物具有更高的灵敏度。由此启发了我们运用cpa1抗体来进行山羊胰腺腺泡细胞的鉴定工作,这也是cpa1抗体首次运用于原代培养的胰腺腺泡细胞鉴定工作中。
27.总之,本发明利用胶原酶ⅳ分离山羊胰腺腺泡细胞,开展了胶原酶ⅳ的最佳工作浓度与消化时间、与0.25%胰蛋白酶消化效率对比、腺泡细胞纯化以及鉴定研究。结果表明:1)采用1mg/ml胶原酶ⅳ对湘东黑山羊胰腺组织消化20min时,腺泡细胞分离效果最佳。应用此条件消化得到2.275
×
106/ml总细胞数及91%的细胞活率。2)采用差时消化、差速贴壁及刮取等技术手段纯化原代细胞,得到活性良好、且形态均一成簇生长呈“鹅卵石”状的山羊胰腺腺泡细胞。3)纯化后腺泡细胞能够稳定传5代以上,且形态不发生改变。4)通过免疫荧光技术运用兔抗羧肽酶a1(cpa1)作为一抗对第1代和第5代山羊胰腺腺泡细胞进行鉴定,结果显示阳性。
附图说明
28.图1:应用1mg/ml胶原酶ⅳ不同消化时间对山羊胰腺腺泡细胞消化效率的影响;a:消化状态(100
×
);b:总细胞数;c:细胞活率;
29.图2:不同浓度胶原酶ⅳ对山羊胰腺腺泡细胞消化效率的影响;a:消化状态(100
×
);b:总细胞数;c:细胞活率;
30.图3:1mg/ml胶原酶ⅳ与0.25%胰蛋白酶对山羊胰腺腺泡细胞消化效率的影响。a:消化状态(100
×
);b:总细胞数;c:细胞活率;
31.图4:纯化前后不同时间节点的山羊胰腺腺泡细胞(100
×
)。a:纯化前各时间点山羊胰腺腺泡细胞;b:纯化后各时间点山羊胰腺腺泡细胞;c:纯化后第5代山羊胰腺腺泡细胞;
32.图5:应用cpa1抗体鉴定山羊胰腺腺泡细胞。a:空白对照(100
×
);b:第1代细胞(200
×
);c:第5代细胞(100
×
)。
具体实施方式
33.1材料与方法
34.1.1主要仪器及试剂
35.超净工作台;倒置荧光显微镜;co2培养箱(thermo fisher);全自动细胞计数仪
(thermo fisher);摇床;共聚焦显微镜(蔡司);共聚焦培养皿(biosharp);dmem/f12培养基、胎牛血清(fbs)、dpbs、pbs、0.25%胰蛋白酶消化液(gibco);胶原酶ⅳ、重组人胰岛素、表皮生长因子(egf)(biofroxx);青链霉素混合液、庆大霉素、两性霉素b(solarbio);兔抗羧肽酶a1(cpa1)(一抗)(proteintech);fitc标记山羊抗兔igg(二抗)(翊圣生物);通用固定液(servicebio);tritonx-100(sigma);抗荧光淬灭剂(含染核试剂(dapi))(碧云天)。
36.清洗液配制:向pbs(500ml)加入100
×
青链霉素混合液,使青链霉素混合液稀释成10
×
,文中称10
×
pbs清洗液,将配制号的清洗液分装成实验室外用和内用两部分,外用用于屠宰取样时清洗胰腺组织,内用用于消化解离时对胰腺组织反复清洗。试验前配制,用前先预冷;转移液配制:向用dmem/f12培养基(50ml)加入100
×
青链霉素混合液,使青链霉素混合液稀释成10
×
,文中称10
×
转移液。取样完成后将胰腺组织置于转移液中运送至细胞培养室,转移液起保护作用。试验前配制,使用时全程置于冰上;培养基配制:用dmem/f12培养基(500ml)配制,在试验过程中需用青链霉素混合液浓度不同的两种培养基,原代培养需将青链霉素混合液稀释成10
×
,传代培养稀释成2
×
。此外还包含10%胎牛血清,10μg/ml胰岛素,10ng/ml egf,2.5μg/ml庆大霉素,2.5μg/ml两性霉素b。试验前配制;消化液配制:运用dmem/f12培养基将胶原酶ⅳ配置成1mg/ml及0.5mg/ml两个浓度的消化液,且都添加0.001mol/ml的egta。试验前配制,使用前37℃预热;抗体稀释:根据说明书用2%的bsa稀释。
37.1.2试验动物
38.选取处于发育期健康状况良好的湘东黑山羊进行屠宰,屠宰前禁食4小时以上。放血完毕后及时解剖暴露胰腺,在用预冷的10
×
清洗液不断冲洗的同时,迅速采取胰腺组织。适当剔除血管及筋膜,反复用10
×
清洗液清洗4~5遍后放入预先配制10
×
转移液中冰浴及时带回实验室。
39.1.3试验方法
40.1.3.1消化酶的消化效率
41.在正式进行山羊胰腺腺泡细胞分离培养前,先探索消化酶相对适宜的消化时间、消化酶浓度及消化酶种类,以寻求更高的消化效率。运用1mg/ml胶原酶ⅳ作为山羊胰腺腺泡细胞消化解离的消化液,寻找在山羊胰腺组织上相对适宜的消化时间,设置15min、20min、25min、30min和35min连续五个消化时间梯度;在得到相对适宜的消化时间后,进行1mg/ml与0.5mg/ml两个浓度胶原酶ⅳ消化液消化解离20min后的比较;在验证过胶原酶的工作浓度及消化时间后,用0.25%胰蛋白酶作为消化液来对比1mg/ml的胶原酶ⅳ。消化解离结束后进行总细胞计数及细胞活率检测。具体操作步骤如下:
42.预先用dmem/f12配制50ml浓度为1mg/ml的胶原酶ⅳ,配制10ml浓度为0.5mg/ml胶原酶ⅳ及准备10ml 0.25%胰蛋白酶。为得到更多的单细胞及及减少细胞碎片,三种消化液中egta的浓度为0.001mol/ml;将取回的胰腺组织带回无菌细胞培养室,将胰腺组织从转移液中出。由于胰腺组织样品量有限,将采集的胰腺组织切分成1g重量小块;将切分称重完的胰腺组织块置于超净工作台上。在10cm培养皿中加适量10
×
清洗液,将组织块浸泡于其中,仔细剔除胰腺组织上多余的筋膜及脂肪组织。之后用清洗液重复清洗2~3遍,洗完后将每份胰腺组织剪切成1~3mm3的小块,转移到15ml离心管中再用清洗液清洗3~5遍。1000rpm/min离心两分钟,去除多余液体;取5份清洗完的并剪碎的组织块各添加10ml 1mg/ml胶原酶
ⅳ
消化液,用锡箔纸包裹避光置于37℃、80rpm/min的恒温摇床上消化。设置15min、20min、25min、30min和35min消化时间梯度;每个消化时间节点结束后取出已消化结束、的组织迅速加入5ml含10%fbs的dmem/f12终止消化,反复吹打之后1000rpm/min离心5min弃上清;再添加5ml含fbs的dmem/f12混匀沉淀,用70um的细胞筛过滤收集细胞悬液,取每个离心管收集到的少量悬液在显微镜下观察消化状态,每个离心管取3个平行样用全自动细胞计数仪进行活率检测和细胞计数;再取2份清洗完且剪碎的组织块置于15ml无菌无酶离心管中,分别加入10ml浓度为0.5mg/ml胶原酶ⅳ和10ml 0.25%胰蛋白酶。用锡箔纸包裹避光置于37℃、80rpm/min的恒温摇床上消化20min。之后重复上述后两个步骤。
43.1.3.2原代山羊胰腺腺泡细胞分离
44.将采集的胰腺组织块通过转移液运回细胞培养实验室。在无菌超净工作台上将胰腺组织取出,置于盛有清洗液的10cm无菌培养皿中仔细剔除胰腺组织上多余的筋膜及脂肪组织;再用pbs清洗3~5遍后将胰腺组织剪切成1~3mm3的小块,使其能够被移液枪吸取。将剪好的胰腺组织块转移到15ml无菌无酶离心管中,用含10
×
青链霉素的pbs反复冲洗5~6遍,最后1000rpm/min离心5min弃上清;添加上述试验验证出的胶原酶ⅳ10ml,用锡箔纸裹上离心管避光置于37℃、80rpm/min的恒温摇床上消化20min;消化结束后迅速加入5ml含10%胎牛血清(fbs)的dmem/f12终止消化,之后1000rpm/min离心5min弃上清;添加5ml含10%fbs、10
×
青链霉素混合液、2.5μg/ml庆大霉素、2.5μg/ml两性霉素、10μg/ml胰岛素、10ng/ml egf的dmem/f12混匀沉淀,用70μm的细胞筛过滤收集细胞悬液;600g/min、5min离心,去上清,重悬接种到培养皿,调整接种密度为3
×
105个细胞/cm2,置于37℃、5%co2饱和湿度的细胞培养箱中培养。1天后观察贴壁及污染情况,若无问题则更换培养基继续培养。此后1天换1次液,整个过程中尽量避免剧烈晃动。
45.1.3.3胰腺腺泡细胞的纯化及传代培养
46.在原代胰腺腺泡细胞传第一代时进行细胞纯化工作。采取差时消化、差时贴壁及细胞刮取等方法来对胰腺腺泡细胞进行纯化。
47.差时消化:利用细胞之间对消化酶的敏感性存在差异以及胰腺腺泡细胞的自身特性。去除培养基后,静置2min,用加2ml dpbs轻轻冲洗,会有一定量的细胞脱落;迅速收集脱落的细胞到15ml无菌无酶离心管中,加2ml含10%胎fbs的dmem/f12,轻轻吹打后1000rpm/min离心5min弃上清,用1ml培养基重悬细胞后接种;向第一步培养皿清洗过的细胞中加入1.5ml 0.25%胰蛋白酶消化液,摇晃铺平后静置2min,不用放进培养箱。加3ml含10%胎fbs的dmem/f12终止消化,轻轻冲洗,将脱落的细胞收集到无菌离心管中轻轻吹打几下,1000rpm/min离心5min弃上清,用1ml培养基重悬细胞后接种;向未脱落的细胞中加1.5ml 0.25%胰蛋白酶消化液,置于37℃、5%co2饱和湿度的细胞培养箱中3min;当细胞完全消化脱落时加3ml含10%胎fbs的dmem/f12终止消化。1000rpm/min离心5min弃上清,用1ml培养基重悬细胞后接种。
48.差速贴壁:根据各细胞间贴壁的时间存在差异来纯化得到胰腺腺泡细胞。结合上述差时消化接种的细胞,在接种后不同时间段观察贴壁情况;若在各时间点观察到有一定数量的贴壁细胞,则将悬液转移到新的培养皿继续贴壁,原培养皿加新的培养基继续培养。
49.细胞刮取:经过差时消化及差速贴壁处理后,会有形态比较均一的细胞成片生长。将形态均一、成簇生长的细胞用细胞刮子刮落,转移到新的培养皿继续培养。或者将除形态
均一、成簇生长以外的细胞刮去,冲洗过后继续培养。
50.经过以上处理得到形态均一纯度较高的的胰腺腺泡细胞后进行传代培养,传代培养用含10%fbs、2
×
青链霉素混合液、2.5μg/ml庆大霉素,2.5μg/ml两性霉素、10μg/ml胰岛素,10ng/ml egf的dmem/f12培养基进行传代培养。同时进行胰腺腺泡细胞鉴定工作。
51.1.3.4胰腺腺泡细胞的鉴定
52.利用免疫荧光法对所培养的胰腺腺泡细进行鉴定。将纯化后的胰腺腺泡细胞接种到共聚焦小皿置于37℃、5%co2饱和湿度细胞培养箱中培养;当细胞贴壁生长至70%以上时弃培养基,用1-2ml pbs浸洗3次,每次3min;添加1-2ml常温的4%多聚甲醛后将培养皿置于4℃固定细胞30min,固定结束后吸出多聚甲醛,缓慢加入pbs浸洗3次,每次5min;配制0.2%tritonx-100(pbs配制)加1ml至培养皿,室温下通透20min。吸出0.2%tritonx-100,再用pbs浸洗3次,每次5min;加入1ml 2%fbs,室温下封闭1小时。封闭结束后吸出封闭液,切勿再次浸洗,向培养皿加入足量的一抗(cpa1稀释比例根据说明书,用2%bsa稀释),置于4℃过夜;次日取出培养皿,每孔加入1-2ml pbs,浸洗3次,每次5min,吸出pbs,加入足量的荧光二抗(fitc标记山羊抗兔igg稀释比例根据说明书,用2%bsa稀释),室温下孵育1小时;加入2ml pbs,浸洗3次,每次5min,吸出pbs,加入抗荧光淬灭剂(含染核试剂(dapi)),共聚焦显微镜下观察拍照。
53.1.4数据统计
54.细胞计数及活率检测数据经excel 2016进行初步整理后,采用spss 25.0软件的独立样本t检验进行统计学分析。试验结果以平均值和均值标准误表示。
55.2结果(见图1至图3)
56.2.1消化酶消化效率对比
57.15min、20min、25min、30min和35min连续五个消化时间节点消化结果如图1显示,由图1a展示出各时间节点显微镜下观察得到的消化状态,发现细胞团的数量并不多,存在更多数量的单个细胞。随消化时间的增长,解离得到的细胞密度逐渐增加,但组织碎片也随之增多。图1b显示随消化时间的逐步延长,消化的到的总细胞数从1.407
×
106/ml逐步增长到5.262
×
106/ml细胞。图1c显示细胞活率在消化20min时达到91%,消化20min后细胞活率逐渐降低,消化时间为35min时细胞活率低至74%,为五个时间节点最低值。
58.图1显示了1mg/ml与0.5mg/ml两个浓度胶原酶ⅳ消化胰腺组织20min后的比较结果。显微镜下观察消化状态由图1a展示,结果显示0.5mg/ml的胶原酶ⅳ存在着比单个细胞数量还多的细胞碎片,且单个细胞数量也明显没有1mg/ml的胶原酶ⅳ个数充足。图1b显示0.5mg/ml的胶原酶ⅳ消化得到的总细胞数为8.032
×
105/ml,远低于工作浓度为1mg/ml的胶原酶ⅳ消化得到的2.275
×
106/ml总细胞数量。同时由图1c发现0.5mg/ml胶原酶ⅳ消化的细胞活率也低于1mg/ml胶原酶ⅳ消化的91%细胞活率,仅为83%。
59.图2a展示的图片显示胰蛋白酶虽有较少的细胞碎片,但消化得到的总细胞数及细胞活率均低于胶原酶。如图2b显示0.25%胰蛋白酶解离胰腺组织20min得到1.072
×
106/ml的总细胞数,低于1mg/ml的胶原酶ⅳ消化得到的总细胞数。且图2c显示胰蛋白酶得到的细胞活率仅为80%,低于胶原酶ⅳ91%的活率。
60.2.2山羊胰腺腺泡细胞的纯化及传代培养(图4)
61.在前述优化的消化酶工作浓度和消化时间基础上,我们进一步开展山羊胰腺腺泡
细胞的纯化和传代培养。在1mg/l的胶原酶ⅳ消化20min后,用70μm的细胞筛过滤收集细胞悬液,600g/min多次离心后调整细胞悬液为3
×
105个细胞/cm2进行接种。接种后在显微镜下观察,如图4a显示细胞形态不均一,以成团成簇生长的细胞为主,杂细胞较多。因此我们开展了细胞纯化工作。
62.当原代细胞贴壁达90%以上后,我们通过差时消化、差速贴壁及细胞刮取等手段将原代细胞纯化后在进行传代培养。如图4b显示在我们纯化后,各时间节点的细胞形态明显更加均一,主要为成簇生长呈“鹅卵石”状的细胞。传代培养至第5代依然保持形态(图4c)
63.2.3山羊胰腺腺泡细胞鉴定(图5)
64.我们通过免疫荧光技术利用抗原抗体反应对山羊胰腺腺泡细胞进行鉴定工作。羧肽酶a1(cpa1)是胰腺腺泡细胞特异性表达的蛋白,因此我们选取cpa1作为目标蛋白。运用cpa1抗体作为一抗识别腺泡细胞中的cpa1,再用带荧光的二抗与一抗结合来显示cpa1蛋白。当目标蛋白、一抗和二抗结合在一起,在激光共聚焦显微镜下激发荧光才能显色呈阳性。若未显色则说明目标蛋白与抗体没有发生反应。据此,首先我们设置了不加一抗仅用二抗孵育的对照组(图5a),结果没有激发绿色荧光,仅显示经染核试剂(dapi)显色的蓝色细胞核部分,结果未显示阳性。当我们运用cpa1抗体对第1代细胞进行孵育,再与二抗结合时,细胞中的cpa1与cpa1抗体成功反应,激发绿色荧光,结果显示阳性(图5b)。之后我们又对第5代细胞进性鉴定,同样显示出阳性(图5c)。由此我们成功鉴定出我们分离并纯化培养的细胞为山羊胰腺腺泡细胞。
65.2结论
66.本发明运用胶原酶ⅳ对湘东黑山羊胰腺组织进行解离培养山羊胰腺腺泡细胞。消化酶相对适宜的消化时间和工作浓度为1mg/ml消化20min,消化得到2.275
×
106/ml总细胞数及91%的细胞活率(即短时间内获得更多状态良好的细胞)。且在相同条件下消化效率优于0.5mg/ml胶原酶ⅳ和0.25%胰蛋白酶。采用差时消化、差速贴壁和刮取等技术手段纯化原代细胞,得到活性良好且形态均一呈“鹅卵石”状的山羊胰腺腺泡细胞。纯化后腺泡细胞能够稳定传5代以上,且形态不发生改变。通过兔抗羧肽酶a1(cpa1)作为一抗对第1代及第5代山羊胰腺腺泡细胞进行鉴定,结果显示阳性。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。