1.本发明涉及生物技术领域,尤其涉及转录调控蛋白突变株及应用。
背景技术:
2.合成生物学是一门新型的交叉学科,以工程化的理念,对生物系统进行重设 计、改造和优化的过程。基因线路的设计和合成是合成生物学非常重要和核心的 一部分内容,在基因线路的设计和合成过程中基因元件就像是每一块积木,选择 不同的基因元件以特定的方式组合,导入活细胞后可以行驶特定的生物功能。因 此,丰富基因元件的组成以及探索每一个元件对基因线路的影响对合成生物学的 发展非常重要。
3.启动子是基因线路设计中使用到的非常重要的一种基因元件,而转录因子则 像“开关”决定着启动子下游基因的表达。常用的用于原核生物基因表达的启动 子大都是诱导型,例如t7启动子需要iptg诱导,pbad启动子需要阿拉伯糖诱 导。诱导型启动子的优点是可以让蛋白更好的在体内表达,但是同时增加了蛋白 表达的成本;并且,目前还具有更多的蛋白表达和基因线路设计的需求亟待满足; 此外,转录调控强度对基因线路表达的影响目前也仍不清楚。
4.为了解决上述问题,在现有技术的基础上提供了转录调控蛋白突变株及应 用。
技术实现要素:
5.本发明的目的是提供转录调控蛋白突变株及应用,本发明首先构建了转录调 控蛋白突变株arac的截短蛋白c154,并证明了c154可以在没有阿拉伯糖诱导 的情况下启动pbad启动子下游基因的表达,但是调控强度非常弱,不适合用于 基因元件的构建;在c154的基础上,我们通过蛋白质定向演化的手段以及本发 明构建的筛选体系筛选获得了一系列不同调控强度的可以直接启动pbad下游基 因表达的调控蛋白。
6.并且,本发明利用这一系列的强度的转录调控蛋白突变株构建正反馈的基因 线路,但是得到的表达模式(双稳态或单稳态)却是不同的,证明了本发明获得 的调控蛋白可以作为基因元件应用于合成生物学中更复杂的基因线路的构建,且 可以用于研究转录调控强度对基因线路表达效果的影响。
7.此外,本发明进一步将c154-muts中部分突变位点引入arac蛋白中获得arac-muts,该系列蛋白相比于野生型arac-muts具有更高的调控效率,在相同 的阿拉伯糖诱导下可以更强的启动pbad下游基因的表达,同时在没有阿拉伯糖 诱导下的本底表达水平低,该系列转录因子可以用于更有效的蛋白表达,同时节 约了蛋白表达的成本,证明了本发明具有重要的意义。
8.本发明的上述技术目的是通过以下技术方案得以实现的:
9.转录调控蛋白突变株,所述转录调控蛋白突变株包括c154-muts调控蛋白和arac-muts调控蛋白,所述c154-muts调控蛋白不需要阿拉伯糖诱导能够直接启 动pbad启动子下游基因表达;且所述c154-muts调控蛋白和arac-muts调控蛋 白的制备方法如下:
10.s1、以arac调控蛋白ⅰ为模板通过分子克隆获得n端153个氨基酸缺失的片段,并将所述片段进行表达,获得c154蛋白;
11.s2、验证所述c154蛋白可以在没有阿拉伯糖诱导的情况下启动pbad启动子下游基因的表达;
12.s3、以c154蛋白为起始模板进行蛋白定向演化,通过构建的筛选体系筛选出pbad启动子的转录调控蛋白突变株,即为c154-muts调控蛋白;
13.s4、所述c154-muts调控蛋白经测序后确定突变位点,通过融合pcr的方法将突变位点引入arac蛋白ⅱ中从而获得arac-muts调控蛋白。
14.进一步地:步骤s3所述的筛选体系由1个表达质粒和1个报告质粒组成,所述表达质粒为phy-01质粒,所述报告质粒为reporterplasmid质粒;所述phy-01质粒和reporterplasmid质粒的构建方法分别如下:
15.1)phy-01质粒的构建:以pbad-myc-hisa质粒为模板、以c154-f-ncoi和arac-r-bamhi为引物扩增出c154基因片段利用ncoi和bamhi酶切位点插入到pacyc-duet质粒中,从而得到phy-01质粒;
16.2)reporterplasmid质粒的构建:首先设计引物pbad-expectarac-f和pbad-expectarac-r;通过pcr将所述pbad-myc-hisa质粒中的arac基因片段敲除;再通过bglⅱ和ecorⅰ酶切位点插入gfpuv片段,即得到reporterplasmid质粒。
17.本发明还提供了转录调控蛋白突变株的应用,将所述转录调控蛋白突变株应用于正反馈基因路线构建,所述正反馈基因线路构建包括pfl质粒和non-pfl质粒的构建;所述pfl质粒和non-pfl质粒的构建方法分别如下:
[0018]ⅰ.pfl质粒的构建:以所述reporterplasmid为基础,首先在所述reporterplasmid质粒的gfpuv基因后面插入终止子;然后以所述phy-01为模板扩增出pbad-c154/muts片段,并插入到两个终止子之间;所述pbad-c154/muts片段包含pbad启动子序列和c154序列或pbad启动子序列和c154-muts序列;
[0019]ⅱ.non-pfl质粒的构建:以所述reporterplasmid为基础,首先在所述reporterplasmid质粒的gfpuv基因后面插入终止子;然后以所述phy-01为模板扩增出plac-c154/muts片段;所述plac-c154/muts片段包含plac启动子序列和c154序列或者plac启动子序列和c154-muts序列。
[0020]
通过上述技术方案,本发明中使用的定向演化技术是合成生物学中的一种方法,通过设计合理的筛选体系可以获得具有预期功能的蛋白。
[0021]
通过定向演化的方法在arac调控蛋白基础上获得了一系列不同转录调控强度的转录因子。其中,一部分(c154-muts)不需要阿拉伯糖可以直接启动pbad下游基因的表达,该部分转录因子可以用于研究转录因子调控强度这一单一因素对基因线路表达的影响,排除了诱导物与转录因子之间作用的干扰,本发明利用该系列调控蛋白突变株(c154-muts)和pbad启动子构建的正反馈基因线路可以呈现不同的表达模式,说明了转录因子调控强度对该基因线路设计的重要性。
[0022]
另一部分突变转录因子(arac-muts)相比于野生型的arac具有更高的调控效率,相同浓度的阿拉伯糖可以产生更高的pbad下游基因的表达,且保持了pbad启动子的严谨型调控,即没有诱导物时下游基因的本地表达很低,该系列转录因子(arac-muts)的使用
可以节约蛋白表达的成本。
[0023]
本发明的筛选体系由一个表达质粒(phy-01)和一个报告质粒(reporterplasmid)组成。
[0024]
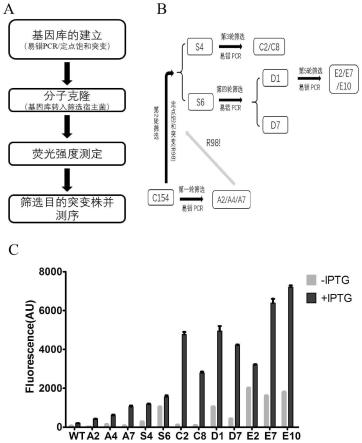
表达质粒是t7启动子控制突变文库的表达,报告质粒是pbad启动子控制报 告基因gfpuv的表达,突变蛋白如果可以启动pbad启动子下游gfpuv的表达筛 选宿主菌则会发出荧光,通过荧光定量检测即可筛选出具有不同调控强度的转录 调控蛋白突变株突变株(c154-muts)。本发明中突变文库是以c154为模板通过 易错pcr或定点饱和突变的方法获得,总共进行了五轮筛选,获得一系列不同调 控强度的不需要阿拉伯糖直接启动pbad下游基因表达的转录调控蛋白突变株 (c154-muts)。
[0025]
总之,本发明所获得的转录调控蛋白突变株进一步丰富了合成生物学的元件 组成,可以用于研究基因线路中转录调控强度这一因素的重要性,另外,ara-muts的使用相比于野生型arac降低了蛋白表达的成本,提高了蛋白表达的效率。
[0026]
正反馈基因线路是构建复杂基因线路中常用到的一种基因线路模块,也在生 物体内的调控中占有非常重要的作用。已有研究表明正反馈基因线路之所以在基 因调控中应用广泛主要是因为该基因线路的双稳态性质。双稳态在理解细胞基本 功能中起到关键作用,例如细胞周期、细胞分化以及凋亡等,正反馈是双稳态系 统形成的必要条件之一,但是正反馈并不是只有双稳态这一种输出方式,尤其是 越简单的正反馈线路越容易受到很多因素的影响不能保证双稳态的输出。
[0027]
本发明利用获得的转录调控蛋白突变株突变株(c154-muts)可以用于构建 具有不同表达模式的正反馈路基因路线,并对比研究了不同调控强度对该基因线 路输出的影响,结果显示不同强度转录因子可以产生不同的输出模式,证明了转 录因子的重要性,也说明了本发明的意义之一。
[0028]
综上所述,本发明具有以下有益效果:
[0029]
1.本发明首先构建了转录调控蛋白突变株arac的截短蛋白c154,并证明了 c154可以在没有阿拉伯糖诱导的情况下启动pbad启动子下游基因的表达,但是 调控强度非常弱,不适合用于基因元件的构建;在c154的基础上,我们通过蛋 白质定向演化的手段以及本发明构建的筛选体系筛选获得了一系列不同调控强 度的可以直接启动pbad下游基因表达的调控蛋白。
[0030]
2.本发明利用这一系列的强度的转录调控蛋白突变株构建正反馈的基因线 路,但是得到的表达模式(双稳态或单稳态)却是不同的,证明了本发明获得的 调控蛋白可以作为基因元件应用于合成生物学中更复杂的基因线路的构建,且可 以用于研究转录调控强度对基因线路表达效果的影响。
[0031]
3.本发明进一步将c154-muts中部分突变位点引入arac蛋白中获得arac-muts,该系列蛋白相比于野生型arac-muts具有更高的调控效率,在相同 的阿拉伯糖诱导下可以更强的启动pbad下游基因的表达,同时在没有阿拉伯糖 诱导下的本底表达水平低,该系列转录因子可以用于更有效的蛋白表达,同时节 约了蛋白表达的成本,证明了本发明具有重要的意义。
附图说明
[0032]
图1是本发明中构建的质粒图谱(phy-01,reporter plasmid,non-pfl, pfl);
[0033]
图2是本发明中定向演化宿主菌的构建及验证;
[0034]
图3是本发明中定向演化筛选及结果;
[0035]
图4是正反馈基因线路的设计和表达;
[0036]
图5是正反馈基因线路表达模式鉴定;
[0037]
图6是arac-muts调控pbad下游基因表达。
具体实施方式
[0038]
下面结合附图和实施方式对本发明作进一步的详细说明:
[0039]
试剂和菌株:本发明中的所有试剂均是市场购买的试剂级以上的试剂。其中, 木糖,葡萄糖,酵母基本氮源,胶回收试剂盒,t4连接酶及所有的限制性内切 酶均来源于上海生工生物工程公司。大肠杆菌jm109(de3)菌株作为分子克隆时 使用的宿主菌(promega公司),luria-bertani(lb)培养基用作培养e.coli。
[0040]
实施例1:转录调控蛋白突变株,所述转录调控蛋白突变株包括c154-muts 调控蛋白,所述c154-muts调控蛋白不需要阿拉伯糖诱导能够直接启动pbad启 动子下游基因表达;且所述c154-muts调控蛋白的制备方法如下:
[0041]
s1、以arac调控蛋白ⅰ为模板通过分子克隆获得n端153个氨基酸缺失的 片段,并将所述片段进行表达,获得c154蛋白;
[0042]
s2、验证所述c154蛋白可以在没有阿拉伯糖诱导的情况下启动pbad启动子 下游基因的表达,调控强度非常弱;
[0043]
s3、以c154蛋白为起始模板进行蛋白定向演化,通过构建的筛选体系筛选 出具有不同表达强度的pbad启动子的转录调控蛋白突变株,即为c154-muts调 控蛋白。
[0044]
所述筛选体系所使用的宿主菌株为菌株hyb-3;筛选宿主菌株hyb-3的构建 方法如下:
[0045]
以jm109(de3)为出发菌株,进行arac的敲除,具体步骤和方法如下:
[0046]
1)首先制备jm109(de3)感受态细胞(本发明所有感受态细胞制备方法一 致,整个操作尽量在冰上完成):
[0047]
①
按照1:100比例将过夜培养的大肠杆菌接种到500ml新鲜的lb培养基种, 37℃,转速250rpm培养至od600=0.5-0.7;
[0048]
②
培养好的大肠杆菌分装至50ml离心管,并在冰上静置20min后在低温冷 冻离心机中离心15min,转速4000g;
[0049]
③
弃去离心好的上清,用500ml预冷的10%甘油溶液重悬离心后的沉淀,在 低温冷冻离心机中离心15min,转速4000g;
[0050]
④
离心结束后再次弃上清,用250ml预冷的10%甘油溶液重悬离心后的沉淀, 在低温冷冻离心机中离心15min,转速4000g;
[0051]
⑤
离心结束后再次弃上清,用20ml预冷的10%甘油溶液重悬所有的沉淀并 汇于一管;在低温冷冻离心机中离心15min,转速4000g;
[0052]
⑥
离心结束后再次弃上清,用1.5ml预冷的10%甘油溶液重悬沉淀,并分装 50ul/
离心管,-80℃保存。
[0053]
2)将pkd46质粒通过电转的方式转入jm109(de3)(本发明电转方法一致):
[0054]
①
从-80℃冰箱取出冻存的感受态细胞置于冰上,待融化后加入2ul待转质 粒,轻轻混匀并在冰上放置1min;
[0055]
②
用移液枪将感受态细胞和质粒混合物转移至预冷干净的电击杯中,使用电 穿孔仪器进行电击转化;
[0056]
③
电击完成后,迅速取出电击杯,加入1ml液体lb培养基并重悬菌体,然 后置于摇床培养1h(30℃,250rpm)
[0057]
④
培养好的大肠杆菌培养液稀释至合适倍数,涂布于含有氨苄抗生素的培养 皿中倒置过夜30℃培养。
[0058]
⑤
第二天在平板上挑取单克隆即为含有pkd46的jm109(ed3)。
[0059]
3)利用转入pkd46质粒的jm109(de3)制备感受态细胞
[0060]
4)准备待转化的pcr片段,该片段以pkd13为模板,正向和反向引物包含 敲除基因上下游各50bp加上pkd13中frt位点的上下游各20bp,pcr产物使用 胶回收并用dpni进行酶切去除模板,
[0061]
5)将4)获得的pcr产物通过电转的方式转入3)制备的含有pkd46的jm109 (de3)感受态细胞中,通过氨苄霉素和卡那霉素筛选,选择可以在卡那霉素培 养基上生长但是无氨苄抗性的菌株,说明pkd46丢失,成功转入pcr片段的菌株, 再通过菌落pcr以及进一步的测序确认片段dna上的抗性基因成功置换需敲除的arac基因,此时获得菌株hyb-1;
[0062]
6)消除hyb-1的卡那霉素抗性:
[0063]
①
制备hyb-1的感受态细胞;
[0064]
②
然后转入pcp20质粒,转化后涂布于只有氨苄抗性的固体培养基上,30℃ 倒置过夜培养;
[0065]
③
第二天,选取一些培养基上的克隆接种于没有抗性的lb液体培养基中, 37℃,250rpm过夜培养;
[0066]
④
第二天,吸取同一试管的菌液分别划线在含有氨苄青霉素、卡那霉素以及 没有抗生素的固体培养基中,37℃倒置培养过夜;
[0067]
⑤
挑去只能在无抗性的培养基上生长的菌落(无氨苄抗性说明pcp20丢失, 无卡那霉素抗性说明细菌重组的卡那霉素抗性丢失)获得hyb-2菌株;
[0068]
⑥
基因敲除的验证:测序。
[0069]
7)再通过电转的方式将reporter plasmid转入hyb-2菌株,即获得定向演 化筛选时用的宿主菌株hyb-3。
[0070]
实施例2:转录调控蛋白突变株,所述转录调控蛋白突变株还包括arac-muts调控蛋白,且所述arac-muts调控蛋白的制备方法如下:
[0071]
c154-muts调控蛋白经测序后确定突变位点,通过融合pcr的方法将突变位 点引入arac蛋白ⅱ中从而获得arac-muts调控蛋白。
[0072]
本发明通过易错pcr或定点饱和突变pcr的方法建立突变库,再将突变株 通过电转的方式转入筛选用的宿主菌,具体步骤和方法如下:
[0073]
1)制备hyb-3的感受态细胞;
c154/muts(包含plac启动子序列和c154或者c154-muts 序列)
[0091]
3)将plac-c154/muts片段通过ecori和hindiii酶切位点插入1)构建的 质粒a中,从而获得non-pfl质粒。
[0092]
3、将pfl和non-pfl分别转入hyb-2即可获得正反馈表达系统和对照非正 反馈表达系统。
[0093]
4、两种基因线路表达系统性质鉴定
[0094]
1)将含有pfl和non-pfl质粒的菌株过夜培养
[0095]
2)第二天,吸取50ul菌液加入到5ml新鲜培养基的试管,37℃继续培 养;
[0096]
3)每隔1h取10ul菌液,使用leica dmi600显微镜下观察并拍照,另 外最后7h取100ul菌液,使用pbs洗一次,然后用100ulpbs重悬起来用于荧光 值测定,如图5所示;
[0097]
4)最后使用imagej软件对结果进行统计分析,如图6所示。
[0098]
实施例4:arac-muts的获得和调控能力鉴定
[0099]
本发明使用融合pcr的方法将c154-muts(d1/e2/e7/e10)与arac蛋白的n 端153个氨基酸融合在一起从而获得对应的arac-muts,具体步骤和方法如下:
[0100]
1)以c154-f-ncoi和fusion-a为引物,含有c154-muts(d1/e2/e7/e10) 的质粒为模板扩增出片段a;
[0101]
2)以fusion-b和arac-r-bamhi为引物,pbad-myc-hisa为模板扩增出片 段b;
[0102]
3)以片段a和片段b等比例混合为模板,c154-f-ncoi和arac-r-bamhi为 引物进行扩增获得片段arac-muts;
[0103]
4)通过ncoi和bamhi酶切位点将arac-muts片段插入pacyc-duet质粒中 获得可表达arac-muts系列蛋白的质粒;
[0104]
5)将该系列质粒分别转入筛选宿主菌hyb-3中;
[0105]
6)将6)获得的菌株过夜培养,第二天1:100接种到新鲜培养基中37℃, 250rpm培养3h后,加入iptg或/和阿拉伯糖诱导;继续培养3h后收细菌进行 荧光的定量测量;对照组既不加iptg也不加阿拉伯糖;
[0106]
7)获得的结果通过软件处理作图,通过荧光蛋白的表达情况分析arac-mut的调控能力。
[0107]
表1本专利中涉及的菌株
[0108][0109]
表2本专利中筛选获得c154-muts的突变信息
[0110][0111]
表3:本专利使用的引物序列信息
[0112]
[0113][0114]
arac蛋白序列为seq id no:1;
[0115]
c154蛋白序列为seq id no:2;
[0116]
non-pfl质粒序列为seq id no:3;
[0117]
pfl质粒序列为seq id no:4;
[0118]
phy-01质粒序列为seq id no:5;
[0119]
reporter plasmid质粒序列为seq id no:6。
[0120]
本具体实施例仅仅是对本发明的解释,其并不是对本发明的限制,本领域技 术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修 改,但只要在本发明的权利要求范围内都受到专利法的保护。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
