1.本发明属于生物技术领域,具体涉及一种兼具抗氧化和降血压作用的活性肽及其应用。
背景技术:
2.自由基是机体新陈代谢中产生的具有高度氧化活性的中间产物。它们的共同特点是都含有不成对的电子,这些电子会使活性氧自由基(ros)产生不稳定性。当机体处于正常的生理状态时,适量自由基能够参与细胞内信号级联,抵御病原体的入侵。然而,过量的自由基不仅会产生毒害作用,还会导致细胞氧化应激,增加人类患糖尿病、心血管疾病、癌症的风险。通过口服抗氧化剂来清除机体内过剩的自由基是目前广泛使用的一种方法。抗氧化剂可以通过氢原子转移、电子转移或螯合金属离子来灭活自由基,从而防止或终止自由基链反应以达到抗氧化的目的。目前的研究表明,bht、bha等人工合成的抗氧化剂存在一定程度的食品安全问题,可对人体器官造成损害。因此,安全性高、容易获得且具有良好抗氧化活性的食源性抗氧化剂已成为当前的研究热点。有研究者利用花粉提取抗氧化肽,经分离纯化后得到具有良好的抗氧化活性的肽;也有人从鲣鱼骨胶原蛋白中鉴定出的抗氧化肽。
3.高血压是一种常见的慢性疾病,以血管舒张不足为特征,是引起脑血管和心血管疾病的主要因素。高血压目前已成为影响全球死亡率的主要因素,有超过20%的成年人患有高血压。人体的血压是由肾素-血管紧张素系统(ras)调节的,血管紧张素转换酶(ace)是其中的关键因素。ace能够将血管紧张素i转化为血管紧张素ii,引起血管收缩,导致血压升高。因此,抑制ace活性是降低血压的有效途径,ace抑制剂也成为当下应用最广泛的降血压药物。此外,调节血压还可以通过内皮型一氧化氮合酶产生一氧化氮,维持正常血压水平。然而,过量的活性氧(ros)可导致氧化应激、一氧化氮生物利用度降低、血管内皮损伤,最终导致高血压。目前已有研究表明,化学合成的降血压药物有许多副作用,它们不仅降低了患者的耐受性,而且增加了医疗成本。由于食源性肽副作用少且容易获得,还具有不俗于化学合成药物的降血压活性,因此它们成为降血压药物的理想替代品或补充物。
4.近年来,许多研究者从不同食物来源的蛋白质中提取具有抗氧化或降血压活性的多肽,并且发现一些抗氧化活性强的肽段同时也具有良好的降血压活性。如从小麦胚芽蛋白的kelppsdadw和sggsyadelvstak,从斜生栅藻提取出的wygpdrpkfl,从副渔获物提取出来的ngvaa以及从郫县豆瓣酱中提取出来的rglsk和tpcppq。
技术实现要素:
5.为解决相关问题,本发明的首要目的在于提供一种兼具抗氧化和降血压作用的活性肽。
6.本发明的另一目的在于提供上述兼具抗氧化和降血压作用的活性肽的制备方法。
7.本发明的再一目的在于提供上述兼具抗氧化和降血压作用的活性肽的应用。
8.为了实现上述发明目的,本发明采用以下技术方案:
9.一种兼具抗氧化和降血压作用的活性肽,其氨基酸序列为ghvaa(gly-his-val-ala-ala)
10.所述的活性肽的制备方法,包括如下步骤:
11.步骤1:对陈酿5年广东糯米酒进行超滤,得到广东糯米酒《3kda组分;
12.步骤2:利用制备型rt-hplc系统和c18自组装柱对广东糯米酒《3kda组分进行多级逐级分离纯化后,利用hplc-ms/ms进一步鉴定分析,即得到所述活性肽。
13.进一步地,步骤2中所述的分离纯化中,流动相为:去离子水和0.1%三氟乙酸组成的溶剂a,甲醇和0.1%三氟乙酸组成的溶剂b;第一次分离纯化时,样品以10ml/min的流速洗脱85min,洗脱条件为:6-15%溶剂b洗脱20min,15-25%溶剂b洗脱20min,25-50%溶剂b洗脱20min,50-90%溶剂b洗脱5min,90%溶剂b10min,90-6%溶剂b10min;进一步分离纯化时,样品以10ml/min的流速洗脱65min,洗脱条件为:溶剂b 6-25%洗脱40min,溶剂b 25-50%洗脱10min,50
–
95%的溶剂b保持10分钟,95
–
6%的溶剂b保持5min。
14.所述的活性肽在制备抗氧化剂、ace抑制剂、降血压功能性食品配料和/或降血压药物中的应用。
15.进一步地,在所述的应用中,所述的抗氧化剂、ace抑制剂、降血压功能性食品配料和/或降血压药物是以所述的活性肽作为活性成分,可添加食品上或药物学上可接受的载体或辅料。
16.一种抗氧化剂,包含所述的活性肽作为活性成分。
17.进一步地,所述的抗氧化剂中还包含药物学上可接受的载体或辅料。
18.一种ace抑制剂,包含所述的活性肽作为活性成分。
19.进一步地,所述的ace抑制剂中还包含药物学上可接受的载体或辅料。
20.一种降血压功能性食品配料,包含所述的活性肽作为活性成分。
21.进一步地,所述的降血压功能性食品配料中还包含食品上可接受的载体或辅料。
22.一种降血压药物,包含所述的活性肽作为活性成分。
23.进一步地,所述的降血压药物中还包含药物学上可接受的载体或辅料。
24.本发明相对于现有技术具有如下的优点及效果:
25.本发明前期在分析不同时间段广东糯米酒中肽含量变化的基础上,从广东糯米酒中分离出具有抗氧化和降血压活性的多肽,并对多肽的组成和氨基酸序列进行了鉴定,同时对其细胞抗氧化活性和分子机制进行了研究。结果表明,陈酿5年广东糯米酒超滤液的小肽含量最高(3.62mg/ml)。经超滤和两次反相高效液相色谱分离得到具有良好抗氧化和降血压活性的f2-2组分,其对dpph和abts的ec50值分别为2.39mg/ml和3.75mg/ml,ace抑制率的ic50值为2.91mg/ml。通过lc-ms/ms鉴定并筛选出1个具有潜在抗氧化和降血压活性的肽段ghvaa(453.2336da)。
26.本发明对ghvaa进行化学合成与活性评价,均表现出良好的抗氧化和降血压活性。通过分子对接探究肽的抗氧化机制,我们发现ghvaa均能与两种受体蛋白进行有效对接,且它们与keap1蛋白的结合效果比cd38蛋白更加明显。上述实验结果表明,ghvaa可成为兼具抗氧化和降血压功能性食品配料或药物的理想原料来源。
附图说明
27.图1为不同时间段广东糯米酒中多肽含量的测定结果图;
28.图2为《3kda组分和》3kda组分广东糯米酒的抗氧化和降血压活性研究结果图;其中,a为dpph和abts自由基清除率,b为ace抑制率;
29.图3为《3kda组分广东糯米酒rp-hplc色谱图;
30.图4为f1和f2的抗氧化和降血压活性研究结果图;其中,a为dpph和abts自由基清除率,b为ace抑制率;
31.图5为f2组分rp-hplc分离色谱图;
32.图6为f2-a、f2-b和f2-c的抗氧化和降血压活性研究结果图;其中,a为dpph和abts自由基清除率,b为ace抑制率;
33.图7为f2、f2-b的抗氧化ec50值和降血压活性ic50值研究结果图;其中,a为abts和dpph的ec50值,b为ace抑制率的ic50值;
34.图8为f2-2的总离子流和二级质谱图;其中,a为f2-2的总离子流图,b为ghvaa的二级质谱图;
35.图9为活性肽的降血压活性研究结果图;
36.图10为活性肽的细胞毒性研究结果图;
37.图11为活性肽的抗氧化活性研究结果图;
38.图12为活性肽对细胞氧化损伤的保护作用研究结果图;
39.图13为cd38与活性肽的分子对接结果图;其中,a为ghvaa与cd38的理论结合模式,b为ghvaa与cd38相互作用效果和作用位点;
40.图14为keap1与活性肽的分子对接结果图;其中,a为ghvaa与keap1的理论结合模式,b为ghvaa与keap1相互作用效果和作用位点。
具体实施方式
41.下面结合实施例和附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
42.实施例1:广东糯米酒中活性肽的分离和测定
43.1.实验材料
44.广东糯米酒由广东河源绿纯食品有限公司提供,1,1-二苯基-2-苦味酸(dpph),3-乙基苯并噻唑啉-6-磺酸(abts),血管紧张素转换酶(ace,来自兔肺)购自sigma(美国密苏里州圣路易斯)。人肝癌细胞(hepg2)atcc细胞库;dmem(dulbecco's modified eagle medium)培养基、胎牛血清(fetal bovine serum,fbs)和0.25%胰酶购自美国gibco公司;dcfh-da活性氧ros荧光探针、磷酸盐缓冲液(phosphate buffer saline,pbs)、二甲基亚砜(dimethyl sulfoxide,dmso)、羟乙基哌嗪乙磺酸(hepes)购自美国sigma-aldrich公司;其他化学品和试剂均为分析纯。
45.2.广东糯米酒中多肽的测定
46.采用3kda超滤膜处理不同年份的广东糯米酒,测定3kda以下广东糯米酒超滤液中的多肽含量。总氮含量采用凯氏定氮法测定,换算系数为6.25,游离氨基酸含量采用茚三酮法测定。肽含量的计算公式如下所示:
47.肽含量(mg/ml)=总氮含量
–
游离氨基酸含量。
48.3.广东糯米酒的超滤及活性评价
49.采用3kda膜对陈酿5年广东糯米酒进行超滤,得到广东糯米酒《3kda组分和广东糯米酒>3kda组分。随后浓缩冻干广东糯米酒、广东糯米酒《3kda组分和广东糯米酒>3kda组分,测定三个组分的抗氧化活性和降血压活性,确定最强活性组分以备后续进一步分离纯化。
50.4.广东糯米酒活性肽的分离纯化
51.采用制备型rp-hplc系统(quik-sep high quality&expert,china)和c18自组装柱(10μm,10mm
×
250mm)对陈酿5年广东糯米酒中活性更强的超滤组分进行分离纯化。流动相为:溶剂a(去离子水,0.1%三氟乙酸),溶剂b(甲醇,0.1%三氟乙酸)。样品以10ml/min的流速洗脱85min,洗脱条件为:6-15%溶剂b洗脱20min,15-25%溶剂b洗脱20min,25-50%溶剂b洗脱20min,50-90%溶剂b洗脱5min,90%溶剂b10min,90-6%溶剂b10min。色谱过程在214nm处监测。收集各吸收峰并浓缩、冻干,测定其抗氧化和降血压活性。
52.活性最强的吸收峰进一步通过制备型rp-hplc系统和另一根c18柱(5μm,4.6mm
×
200mm)分离。流动相为:溶剂a(去离子水,0.1%三氟乙酸);和溶剂b(甲醇,0.1%三氟乙酸)。样品以10ml/min的流速洗脱65min,洗脱条件为:溶剂b 6-25%洗脱40min,溶剂b 25-50%洗脱10min,50
–
95%的溶剂b保持10分钟,95
–
6%的溶剂b保持5min。色谱过程在214nm处监测。收集各吸收峰并浓缩、冻干,测定其抗氧化和降血压活性。
53.5.活性肽的鉴定
54.首先,在easy-nlc1200(thermofisher)色谱系统上对待测样品进行脱盐和分离。分析柱为c18反相色谱柱(acclaim pepmap rslc,75μm
×
25cm c18-2μm)。实验采用的流动相为:溶剂a(去离子水,0.1%甲酸);溶剂b(80%乙腈,0.1%甲酸),溶剂b浓度在60min内由5%提高到38%。
55.然后,利用dda(data acquisition-dependent)质谱技术在q-exactive质谱仪(美国thermofisher公司)上获得串联质谱数据。离子喷涂电压为1.9kv,界面加热温度为275℃。质谱测量的扫描参数如下:靶值,3
×
106;扫描范围,100~1500m/z;分辨率,70000;最大注入时间,100ms。对于ms2扫描,仅选择电荷态为1-3的光谱进行高能碰撞解离,归一化碰撞能量为28ev。
56.最后,利用peaks studio 8.5(bioinformatics solutions inc.waterloo,canada)软件对质谱法收集的原始图形文件进行处理和分析。数据库为uniprot下载的uniprot-oryza sativa物种蛋白数据库。
57.6.抗氧化活性测定
58.6.1.dpph自由基清除活性测定
59.将100μl样品溶液与100μl 0.2mmol/l dpph溶液混合于96孔板中(dpph用体积分数为95%的乙醇溶解)。将混合溶液在25℃下避光培养30min,使用酶标仪(enspire 2300,perkinelmer,ma,usa)在517nm处测量其吸光值,并记录为a1。空白组为:100μl样品溶液 100μl95%乙醇溶液混合,吸光值记录为a2;对照组为100μl dpph溶液 100μl 95%乙醇溶液混合,吸光值记录为a0。最后,通过如下公式计算样品的dpph自由基清除活性:
60.dpph自由基清除活性(%)=[1
–
(a1
–
a2)/a0]
×
100。
[0061]
6.2.abts自由基清除活性测定
[0062]
将7mmol/l的abts与2.45mmol/l的过硫酸钾充分混合,在室温下避光反应12-16h,然后在734nm下用蒸馏水稀释至吸光度为0.70
±
0.02的工作溶液。100μl样品溶液等体积的工作溶液混合于96孔板中。将混合溶液在室温下避光放置10min,使用酶标仪(enspire 2300,perkinelmer,ma,usa)在734nm处测量其吸光值,并记录为a1。空白组为:100μl样品溶液 100μl去离子水混合,吸光值记录为a2;对照组为100μl工作溶液 100μl去离子水混合,吸光值记录为a0。最后,通过如下公式计算样品的abts自由基清除活性:
[0063]
abts自由基清除活性(%)=[1
–
(a1
–
a2)/a0]
×
100
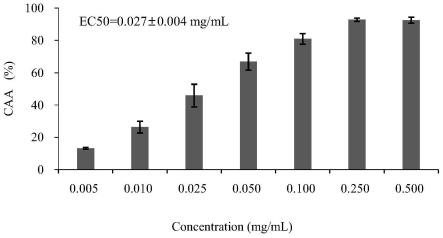
[0064]
7.降血压活性测定
[0065]
取40μl样品溶液,与50μl 1.0mmol/l fappg混合,空白组使用40μl 80mmol/l hepes缓冲液与50μl fappg混合。两组同时加入10μl0.1 u/ml ace。加入ace后,立即在340nm波长处测量两组的吸光值,空白组记录为a1,实验组记录为b1。经37℃避光培养后取出,在340nm处再次测量两组的吸光度值,分别记录为a2、b2。所得数据按如下公式计算:
[0066]
ace抑制率(%)=[(a1
–
a2)
–
(b1
–
b2)]/(a1
–
a2)
×
100。
[0067]
8.结果
[0068]
本发明重点分析了不同年份广东糯米酒中<3kd组分肽的含量变化(图1),随着发酵时间和贮藏时间的延长,<3kd组分肽的含量显著增加。其中贮存时间最长的陈酿5年广东糯米酒的肽含量最高,达到3.62mg/ml,这可能是黄酒在贮存过程中蛋白质被酶催化或进一步降解,导致小肽含量增加。
[0069]
为了确定广东糯米酒中不同分子量范围物质的抗氧化和降血压活性,我们采用3kda超滤膜将陈酿5年的糯米酒分离成两种不同分子量的组分,并与陈酿5年的糯米酒进行了活性对比分析。抗氧化活性测定结果如图2中a所示。在相同浓度下,各组分都能有效清除abts和dpph自由基,而《3kda组分的清除自由基的能力最强,分别达到25.83%和31.36%,这表明糯米酒中低分子量肽组分具有更好的抗氧化活性。
[0070]
降血压活性研究结果见图2中b。与抗氧化活性相似,《3kda组分的ace抑制率最强(20.54%),是>3kda组分的2.16倍。这可能与《3kda组分中含有能够与血管紧张素转换酶活性部分结合的活性肽有关。肽的生物活性与其分子量有关,分子量较低的组分更有可能表现出其生物活性,因为它们有利于与靶分子结合。因此,将《3kda组分大量收集并用反相高效液相色谱进一步分离纯化,以得到具有更强抗氧化和降血压活性的成分。
[0071]
rp-hplc对《3kda组分进行分离,共得到两个分离组分,分别命名为f1(6~15min)和f2(15~25min)(图3)。f1和f2组分的抗氧化活性和降血压活性测定结果如图4中a与b所示。值得注意的是,f2组分在抗氧化和降血压活性方面均显著优于f1组分。在抗氧化活性方面,相同浓度下f2组分的abts自由基清除率(24.28%)和dpph自由基清除率(35.20%)分别是f1的2.44倍和1.61倍。经rp-hplc分离后,f2的ace抑制率明显提高,达到30.89%,分别比《3kda组分和f1提高了10.35%和18.79%。在反相高效液相色谱中,疏水性强的组分通常在后面被洗脱出来,f2显著的抗氧化和降血压活性可能与其富含疏水性氨基酸组分有关。
[0072]
f2组分进一步分离纯化得到三个组分,分别命名为f2-1(12~14.5min)、f2-2(38~46min)和f2-3(46~50min)(图5)。三个组分的抗氧化和降血压活性结果如图6中a和b所示,f2-2表现出最强的抗氧化和降血压活性,其abts和dpph自由基清除率分别为34.91%和
38.62%,ace抑制率为43.78%,均高于相同浓度下f2-1和f2-3的活性。
[0073]
经过两次rp-hplc分离纯化先后得到的活性物组分f2和f2-2的抗氧化活性ec50值和降血压活性的ic50值分别如图7中a和b所示。在抗氧化活性方面,f2-2的dpph和abts ec50值分别为2.39mg/ml和3.75mg/ml,均明显低于f2。在降血压活性方面,f2-2的ace抑制率ic50值为2.91mg/ml,比f2组分降低了将近30%。以上结果表明,反相高效液相色谱法能够将广东糯米酒的生物活性肽有效地分离,获得具有更强抗氧化和降血压活性的多肽。
[0074]
f2-2组分经hplc-ms/ms进一步分析鉴定,总离子流图见图8。从f2-2组分中鉴定出124个广东糯米酒活性肽,并从中发现1个活性肽单体ghvaa(453.2336da),进一步验证其降血压活性、细胞抗氧化活性及对氧化损伤的保护作用。
[0075]
实施例2:活性肽的合成和活性测定
[0076]
1.活性肽的合成
[0077]
活性肽ghvaa由南京synpeptide有限公司合成。采用高效液相色谱法测定合成肽的纯度为98%,lc/esi-ms法测定合成肽的分子质量。通过降血压活性实验、细胞抗氧化活性实验与分子对接验证其降血压活性和抗氧化活性。
[0078]
2.降血压活性测定
[0079]
取40μl样品溶液,与50μl 1.0mmol/l fappg混合,空白组使用40μl 80mmol/l hepes缓冲液与50μl fappg混合。两组同时加入10μl0.1 u/ml ace。加入ace后,立即在340nm波长处测量两组的吸光值,空白组记录为a1,实验组记录为b1。经37℃避光培养后取出,在340nm处再次测量两组的吸光度值,分别记录为a2、b2。所得数据按如下公式计算:
[0080]
ace抑制率(%)=[(a1
–
a2)
–
(b1
–
b2)]/(a1
–
a2)
×
100。
[0081]
3.细胞抗氧化活性测定
[0082]
3.1.细胞毒性实验
[0083]
把hepg2细胞置于完全培养基(dmem中加入10%胎牛血清、1%非必需氨基酸和1%青霉素-链霉素溶液)中培养。培养液储存在37℃,5%二氧化碳的环境中。细胞毒性通过mtt法测定,在白色96孔板中接种每孔100μl的细胞悬液,得到接种密度为每孔1
×
104个细胞,并在37℃下孵育24h。为避免周围环境变化,将pbs加入到板的最外层孔中。细胞培养24h后进行换液,正常组加入100μl完全培养基,实验组加入不同浓度(0.025、0.05、0.1、0.25、0.5、1、2mg/ml)样品的培养基继续培养24h。细胞培养24h后进行换液,在孔分别加入100μl0.5mg/ml mtt溶液,避光培养4h,弃去mtt溶液后用pbs清洗并加入100μl dmso,充分震荡10min用酶标仪于490nm下测od值。细胞存活率按如下公式计算:
[0084]
存活率(%)=实验组od值/正常组od值
×
100
[0085]
3.2.细胞抗氧化活性测定
[0086]
在黑色96孔板中每孔接种100μl细胞悬液,得到接种密度为每孔6
×
104个细胞。接种后将细胞分为空白组、对照组、实验组,正常培养24h。为避免周围环境变化,将pbs加入到板的最外层孔中。细胞培养24h后进行换液,不同组别分别补充相应培养基。空白组和对照组中加入50μl的50μm dcfa-da工作溶液和50μl无菌水;样品组加入50μl的50μm dcfa-da工作溶液和50μl不同浓度(0.005、0.01、0.025、0.05、0.1、0.25、0.5mg/ml)的抗氧化肽。37℃下孵育1h,弃去培养基,用100μl pbs洗涤后弃去pbs,在空白组加入培养基,对照组和样品组加入100μl 60μm aaph工作溶液。放入酶标仪中测定在528nm中测定其荧光值,激发波长
为485nm,1h内每5min测定一次。数据分为三种类型:对照孔(pc)、空白孔(nc)和实验孔(tc),auc代表荧光强度-时间曲线下的积分面积,用dcfh-da和含aaph的hbss处理的细胞作为阳性对照(pc)。用dcfh-da和不含aaph的hbss处理的细胞作为阴性对照(nc)。按如下公式计算caa值,并绘制曲线,计算样品对应的半数有效浓度(ec50):
[0087]
caa(%)=[1
–
(auc(treatment)
–
auc(nc)/auc(pc)
–
auc(nc))]
×
100。
[0088]
3.3aaph诱导细胞损伤保护实验
[0089]
在96孔板中每孔接种100μl密度为1
×
104个细胞的悬液。接种后将细胞分为空白组(nc)、损伤组(pc)、实验组,正常培养24h。24h后进行换液,空白组与损伤组加入100μl完全培养基,实验组加入100μl不同浓度(0.001~0.1mg/ml)的抗氧化肽,继续培养24h。24h后进行换液,空白组加入100μl完全培养基,损伤组与实验组加入100μl5mm的aaph溶液,继续培养24h。24h后进行换液,三组都加入100μl0.5mg/ml mtt溶液,避光培养4h,弃去mtt溶液后加入100μl dmso,充分震荡10min用酶标仪于490nm下测od值。细胞存活率按如下公式计算:
[0090]
存活率(%)=实验组od值/正常组od值
×
100。
[0091]
4.分子对接
[0092]
用marvinsketch软件对合成肽进行结构绘制,并进行能量最小化结构优化,输出为mol2格式文件,用于后续对接。从pdb数据库(rcsb pdb:homepage)中下载受体分子keapl蛋白(4l7b)和cd38(3dzk)的晶体结构,并用pymol软件去除受体中含有的配体和水分子,而cd38由两条完全对称的肽链组成,分子对接只需分析其中一条,因此需删除a链,保留b链,最后保存为pdb格式文件。用autodocktools1.5.6软件对受体分子与合成肽进行加氢和计算电荷等处理并输出为pdbqt格式文件后使用vina进行对接。设置盒子中心位置(cd38:18.794,8.07,-28.844;keap1:-2.47,6.17,1.8)、盒子大小(cd38:100
×
100
×
100;keap1:120
×
100
×
100),开始对接。根据vina对接结合能选择最低值的结果用pymol与discovery studio 4.5软件进行可视化分析处理。
[0093]
5.统计分析
[0094]
统计分析使用spss 20.0统计分析软件完成。所有实验重复三次,结果以平均值
±
标准差表示。经单因素方差分析,p《0.05时表明差异有显著性。
[0095]
6.结果:
[0096]
6.1.活性肽的降血压活性
[0097]
如图9所示,ace抑制率随着活性肽ghvaa浓度的增加而增加,且ic50值为0.63mg/ml。这表明本发明活性肽能有效地与调节人体血压的重要因子ace相结合,抑制其参与血压调节,从而达到降血压的目的。
[0098]
6.2.活性肽的细胞抗氧化活性及对氧化损伤的保护作用
[0099]
(1)细胞毒性实验
[0100]
基于mtt法评估ghvaa在0.025~2mg/ml下的细胞毒性,结果如图10所示。ghvaa在0.025~2mg/ml时的细胞活性均在90%以上,无细胞毒性,且在0.5mg/ml时的细胞长势更好。因此我们选择活性肽单体的最大浓度为0.5mg/ml对hepg2细胞进行后续细胞抗氧化活性测定。
[0101]
(2)细胞抗氧化活性测定
[0102]
通过测定不同浓度下活性肽的细胞抗氧化活性并计算其ec50值可以有效判断活性肽对细胞的抗氧化作用。如图11所示,ghvaa在0.005~0.5mg/ml浓度范围内均显示良好的细胞抗氧化作用,ec50值为0.027mg/ml,低于目前已报道的桑树活性肽rdy(ec50:0.24mg/ml)和甘蓝型油菜蛋白质活性肽kdhch(ec50:0.11mg/ml),这可能是ghvaa能更有效穿过细胞膜,通过阻止或终止细胞内自由基链式反应来保护细胞免受损伤,达到清除体内自由基的作用。
[0103]
(3)对细胞氧化损伤的保护作用
[0104]
ghvaa对aaph诱导hepg2细胞氧化损伤的保护作用如图12所示,与空白组(nc)相比,添加了aaph的损伤组(pc)的hepg2细胞存活率为66.17%,这表明氧化剂aaph能够破坏细胞结构,导致细胞凋亡。与pc组相比,加入了不同浓度的活性肽均能显著降低aaph导致的细胞氧化损伤破坏,且在0.001~0.1mg/ml的范围内具有剂量依赖性。在0.1mg/ml时,ghvaa分别能够使细胞存活率从66.17%显著提高至96.81%。这些结果表明从广东糯米酒分离得到的活性肽ghvaa对aaph诱导的细胞损伤具有优秀的保护作用。
[0105]
实施例3:计算机模拟活性肽的分子机制
[0106]
1.ghvaa对cd38的抑制模式分析
[0107]
烟酰胺腺嘌呤二核苷酸(nad )是sirt1-7介导的信号通路中关键的辅酶因子,参与机体多种代谢途径与细胞氧化还原反应。包括协助和承载代谢途径中氢原子的转移,参加三羧酸循环中部分氧化反应与线粒体中脂肪酸和氨基酸的氧化过程等。更重要的是,nad 能够与其他酶共同参与调控细胞凋亡、细胞衰老、dna修复等进程,达到抗氧化和抗衰老的目的。cd38是一种降解机体内nad 的酶,目前已报导的部分抗氧化肽能与cd38结合来抑制其酶活性,提高nad 在体内的含量,进而发挥抗氧化、延缓衰老的效果。
[0108]
cd38与nad 结合的关键活性位点有trp125、ser126、arg127、glu146、trp189、thr221和glu226。ghvaa与cd38的理论结合模式如图13中a所示,活性肽与cd38的结合位点都处于同一个疏水空腔,且与cd38降解nad 的位置相近,其相互作用效果和作用位点如图13中b所示,ghvaa与cd38的关键位点thr221形成氢键,与glu226形成氢键和静电作用,与arg127形成疏水相互作用,与trp125形成pi-sigma键,与glu146形成静电作用,与trp189形成pi-sigma键和静电作用,此外还与关键位点附近的氨基酸残基leu145、asp155、ser193形成疏水相互作用、静电作用和氢键。如表1所示,ghvaa-cd38复合体能形成5个氢键,对接结合能为-7.5kcal/mol,说明ghvaa能与nad 竞争性结合cd38中的关键位点,抑制cd38的酶活性,还能与关键位点周边的氨基酸残基结合,形成空间位阻,从而阻止nad 进入cd38疏水空腔,使得nad 能够抑制机体内的氧化反应。
[0109]
2.ghvaa对keap1的抑制模式分析
[0110]
keap1-nrf2信号通路是机体在受到细胞氧化应激反应时进行自我防御与自我保护的重要通路。当细胞产生氧化应激时,机体内的nrf2蛋白被激活,从而达到清除体内过量自由基的目的。而keap1蛋白能够与nrf2结合并降解,抑制机体的抗氧化反应。若活性肽能与keap1结合,进而可抑制nrf2不被降解,并在机体内的含量维持在较高的水平,进而增强机体的自由基清除能力。
[0111]
活性肽ghvaa与keap1的理论结合模式如图14中a所示,活性肽能够占据keap1的疏水空腔,与nrf2的结合位置相似。nrf2在keap1蛋白kelch区的关键结合位点为tyr334、
ser334、arg380、asn382、arg415、arg483、gln530、ser555,如果肽能够与上述位点形成相互作用力,则可能达到干扰nrf2与keap1蛋白结合的目的。ghvaa与keap1的相互作用如图14中b所示,ghvaa与6个关键位点ser363、ser555形成氢键、与tyr334形成pi-pi键,此外,还与其他位点gly364、asn414、ile416、ala556、ser602形成氢键,与gly509、gly603形成碳氢键,与tyr572、tyr525形成疏水性相互作用。如表1所示,活性肽ghvaa能与keap1的7个氨基酸残基以氢键结合,对接结合能为-8.2kcal/mol,说明它能与nrf2竞争性结合keap1的疏水性空腔位置并形成空间位阻,抑制keap1的活性,使得nrf2能够激活机体内与其相关的抗氧化应激反应。
[0112]
在蛋白质-配体复合物的结构中,除了常见的氢键与疏水相互作用能稳定复合物结构之外,由两个相反电荷官能基之间组成的盐桥也能对复合物的稳定性起重要作用。而pi-sigma键能使肽在与受体蛋白的结合位点上更加稳定,实现肽和受体蛋白之间的电荷转移。因此,我们认为这些肽能够对上述两种受体蛋白亲密结合,发挥高效的抗氧化作用。
[0113]
表1ghvaa与cd38、keap1的分子对接结果
[0114][0115]
以上结果表明,ghvaa均能与cd38、keap1蛋白中发挥催化活性的关键氨基酸位点以及周边的氨基酸残基以不同非共价键紧密结合,且它与keap1的结合能比cd38更高。因此我们可以推断ghvaa可能是通过调节与keap1-nrf2通路来发挥抗氧化作用,且keap1蛋白的结合效果比cd38蛋白更加明显。而两次分子对接的结果并无相关性,这可能与不同受体蛋白的抗氧化机制不同有关。
[0116]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受所述的实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。