猫细小病毒vp2蛋白及所得自主组装病毒样颗粒
技术领域
1.本发明属于vlp疫苗领域,尤其涉及一种猫细小病毒vp2蛋白及所得自主组装病毒样颗粒。
背景技术:
2.猫细小病毒(feline parvovirus,fpv)又称猫泛白减少症病毒,猫瘟热病毒,猫传染性肠炎病毒。主要发生于12月龄以下小猫,尤其36月龄幼猫易感,是目前肉食兽细小病毒属感染范围最广,致病性最强的一种病毒。由于fpv给我国宠物猫行业以及野生动物保护造成极大的危害,抓紧研制新型疫苗才是重中之重。
3.fpv是一种单股无囊膜dna病毒,直径20nm24nm,呈二十面体对称。vp2蛋白是细小病毒外壳的主要成分,vp2蛋白是免疫原性蛋白,可诱导机体产生中和抗体。病毒样颗粒(viruslike particles,vlp)也称核心样颗粒,是由病毒结构蛋白组装而成的介于于15nm~400nm的空心颗粒。vlp不含病毒基因组,不能自主复制,在形态上与真正病毒粒子相似,可通过和病毒感染一样的途径呈递给免疫细胞,有效诱导机体产生免疫保护反应。
4.目前,研究报道的用于表达病毒样颗粒的主要是昆虫细胞表达系统,生产成本较高且原核表达系统蛋白表达量一般,应用效果也不佳。因此,如何提供更为有效的重组表达fpv vp2,并自组装成病毒样颗粒,提供有效的猫细小病毒的vlp疫苗,将有效解决宠物猫及猫科动物所面临的保护问题。
技术实现要素:
5.本发明提供了一种猫细小病毒vp2蛋白及所得自主组装病毒样颗粒,基于该猫细小病毒vp2蛋白制备得到的vlp疫苗可有效保护宠物猫及猫科动物免受猫瘟病毒侵害。
6.为了达到上述目的,本发明提供了一种猫细小病毒vp2基因,所述猫细小病毒vp2基因具有seq id no.1所示的核苷酸序列。
7.本发明还提供了一种表达载体,将上述技术方案所述的猫细小病毒vp2基因插入到载体中,得到表达载体。
8.作为优选,所述载体包括pet28a载体。
9.本发明还提供了一种根据上述技术方案所述的猫细小病毒vp2蛋白的制备方法,包括以下步骤:
10.以fvp基因序列为基础,对其进行密码子优化,合成大小为1752bp的基因片段,通过对所述基因片段进行pcr扩增,同源重组后,得到重组vp2基因;
11.将所得重组vp2基因与经相同酶切后的pet28a载体用连接酶连接,并转化到大肠杆菌dh5α感受态细胞,经氨苄西林抗性筛选阳性克隆,提取pcr鉴定阳性菌液质粒,经酶切鉴定得到阳性重组质粒pet28a-fipv vp2;
12.将阳性重组质粒pet28a-fipv vp2转化到e.coli bl21感受态细胞,诱导表达及纯化后,得到可溶性猫细小病毒vp2蛋白。
13.本发明还提供了一种猫细小病毒vp2蛋白,通过上述技术方案所述方法制备得到,所得猫细小病毒vp2蛋白具有seq id no.2所示的氨基酸序列。
14.本发明还提供了一种猫细小病毒vp2蛋白体外组装病毒样颗粒,采用上述技术方案所述猫细小病毒vp2蛋白制备得到。
15.本发明还提供了一种根据上述技术方案所述的体外组装病毒样颗粒,其直径为20-30nm。
16.本发明还提供了一种根据上述技术方案所述的猫细小病毒vp2蛋白体外组装病毒样颗粒的制备方法,将所述猫细小病毒vp2蛋白置于组装液中进行体外组装,所述组装液组分包括50mm tris和250mm nacl,所述组装液的ph值为8.0。
17.与现有技术相比,本发明的优点和积极效果在于:
18.本发明根据大肠杆菌的密码子的偏爱性,人工修饰合成了猫细小病毒vp2基因的dna序列,应用序列表达的vp2蛋白具有良好的免疫活性,可有效保护宠物猫及猫科动物免受猫瘟病毒侵害。
附图说明
19.图1为本发明实施例提供的pet28a-fpv vp2质粒图谱;
20.图2为vp2蛋白的表达验证;其中a.vp2-his的sds-page.;b.vp2-myc的sds-page.;c.vp2-myc的wb.;
21.图3为vlp的透射电镜图;
22.图4为elisa测定抗体效价的elisa显色情况;其中,从左到右依次为阴-1、血清-1、血清-2、阴-2、血清-3、血清-4;
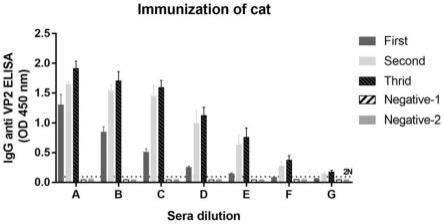
23.图5为vp2和三次免疫的猫血清的elisa;其中,a-1:500、b-1:1500、c-1:4500、d-1:13500、e-1:40500、f-1:121500、g-1:364500。
具体实施方式
24.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
25.菌株、质粒、试验动物与试剂
26.6周龄babl/c雄性小鼠购自北京维通利华实验动物技术有限公司;fpv毒株本实验室保存;pet28a质粒、大肠杆菌dh5α及bl21购自山东赫兹生物科技技术有限公司;sds-page蛋白胶试剂盒购自雅酶生物科技技术有限公司;弗氏佐剂购自sigma公司;g4s dna连接酶及转染试剂均购自takara公司。
27.实施例1重组质粒的构建及原核表达
28.参照fpv基因序列,根据大肠杆菌的密码子偏爱性对序列进行优化,设计大小为1752bp的fpv vp2基因片段,核苷酸序列如seq id no.1所示。将带有his标签、trxa促溶标签、ncoi和xhoi酶切位点、tev酶切位点、g4s连接头以及myc标签的fpv vp2基因片段直接合成到pet28a质粒上,以获得正确的重组质粒pet28a-fpv vp2如图1所示。
29.进而,将收集的重组质粒pet28a-fpv vp2转化到e.coli bl21感受态细胞,挑取单菌落接种20ml含卡那霉素(终浓度100μg/ml)lb培养液,37℃摇床培养2h,按照1:100体积比,将培养物接种氨苄青霉素2l lb培养基,37℃摇床培养至od600=0.6-0.8时加入1mm iptg,20℃摇床诱导表达9h。4℃4500rpm离心沉淀菌体用80ml tris-hcl(ph=7.4)悬浮,冰浴中超声波充分破碎裂解。4℃10000rpm离心20min,收集上清液,进行纯化,得到fpv vp2重组蛋白,氨基酸序列如seq id no.2所示。
30.实施例2 fpv vp2蛋白纯化及表达
31.将实施例1收集的上清蛋白样品加入事先用50mm tris-hcl平衡好的镍柱中,孵育1h,使蛋白充分与镍柱结合,之后让样品缓慢流出,收集流出液,并二次上样。分别用5倍柱体积的50mm和250mm浓度的咪唑洗脱并收集蛋白;将收集的蛋白转移到超滤管中,4℃,3000r/min超滤浓缩,分别取8μl浓缩后蛋白,加入2μl 5
×
蛋白上样缓冲液混匀并变性10min,分别取8μl样品进行sds-page鉴定。
32.经sds-page电泳显示,包涵体、50和250mm咪唑洗脱浓缩液中,均在约70kda处出现目的条带(图2a、b)。并且,250mm洗脱浓缩液后获得较纯的fpv vp2蛋白。此外,western blot结果显示,250mm咪唑洗脱的fpv vp2蛋白能够与鼠源抗猫细小病毒单克隆抗体发生特异性结合(图2c),说明成功获得纯化的fpv vp2蛋白。经测定,fpv vp2蛋白在50mm咪唑溶液中的洗脱浓度为0.8mg/ml,在250mm咪唑溶液中的洗脱浓度为1.5mg/ml,说明目的蛋白表达量较高。
33.实施例3猫细小病毒样颗粒的制备
34.将纯化后的蛋白装入透析袋中,以去除咪唑洗脱液。在4℃中进行透析组装(50mm tris、250mm nacl、ph=8.0),vlp的直径为20-30nm,为最接近天然的猫细小病毒粒子。为了进一步确定vlp的形成状态,进行了透射电镜(tem)检测,即,将上述纯化获得的vlp,经2%磷钨酸负染,通过透射电镜观察vlp的形态,其直径约为25nm,大小均匀,呈现为空心形态,结果如图3所示,目的蛋白fpv vp2能自发组装成直径约为25nm的粒子,且界限清晰,颗粒均一度较高,与fpv的天然病毒样颗粒形态相似。因此,在组装条件为50mm tris,250mm nacl,ph=8.0时可形成质量较好的vlp,形成率较高。
35.实施例4 vp2蛋白免疫情况及elisa检测抗体效价
36.取6只6周龄的babl/c雄性小鼠,分为免疫组和对照组,每组3只。免疫组肌肉注射fpv vp2蛋白50μg/只,共免疫4次,每次间隔14d(表1)。对照组肌肉注射生理盐水 免疫组同剂量的佐剂。免疫组和对照组在相同的环境下饲养,自由采食。
37.表1免疫情况
[0038][0039]
第4次免疫后7天采血进行抗体效价检测。
[0040]
将fpv vp2目的蛋白以5μg/100μl的浓度进行4℃过夜包被酶标板,按照血清稀释
比例,依次设立a组(1:300)、b组(1:900)、c组(1:2700)、d组(1:8100)、e组(1:24300)、f组(1:72900)、g组(1:218700),同时设立血清的阴性对照阴-1、阴-2。阴-1为不添加血清,仅添加bsa封闭液,阴-2为未免疫疫苗的血清。用酶标仪读取od
450
值,如图4所示,在稀释218700倍后,二免、三免和四免组的抗体滴度仍然大于2倍未免疫组血清的抗体滴度(2n),因此抗体效价可达2.19
×
105。
[0041]
实施例5vp2蛋白动物实验
[0042]
设有免疫组(四只)与未免疫组(三只)试验猫进行预实验,实验方法参照表2。由于免疫4次抗体效价过高,可能对动物造成负担,故本试验仅免疫3次,弗氏佐剂和不完全弗氏佐剂替换为动物负担更小的氢氧化铝佐剂。
[0043]
表2动物实验方法
[0044][0045]
每次免疫前和免疫完成后7天采血进行抗体效价检测。
[0046]
将fpv vp2目的蛋白以5μg/100μl的浓度进行4℃过夜包被酶标板,按照血清稀释比例,依次设立a组(1:500)、b组(1:1500)、c组(1:4500)、d组(1:13500)、e组(1:40500)、f组(1:121500)、g组(1:364500),同时设立血清的阴性对照阴-1、阴-2。阴-1为不添加血清,仅添加bsa封闭液,阴-2为未免疫的猫血清。用酶标仪读取od
450
值,在稀释364500倍后,二免和三免组的抗体滴度仍然大于2倍未免疫组血清的抗体滴度(2n),因此抗体效价可达3.65
×
104(图5)。
[0047]
在免疫程序完成三个月后,免疫组与未免疫组受自然猫瘟病毒侵害,其中免疫组三只中三只健康状况良好,未表现症状,一只伴随猫瘟感染症状,pcr结果为阳性。在再次进行vp2疫苗的接种后(治疗用),症状逐渐减轻,恢复良好;未免疫组三只均感染猫瘟病毒,pcr结果为阳性,并伴随严重症状,其中两只快速死亡,在对第三只进行vp2疫苗的接种后(治疗用),症状逐渐减轻且恢复良好。
[0048]
以上预实验中不排除个体差异及年龄等因素的影响(免疫组年龄较未免疫组大2-3个月),综上预实验结果良好。
[0049]
实施例4 vp2蛋白的细胞保护性试验
[0050]
复苏crfk细胞于25ml培养瓶中,用培养基(emem 10%fbs 1%丙酮酸钠 1%双抗)培养。待长到80%时,1ml胰酶消化3min,1000rpm/min离心10min,用培养基重悬稀释至50000个细胞/ml,取96孔细胞培养板,每孔加入100μl细胞悬液,静置培养贴壁。
[0051]
将病毒的细胞培养液依次按100~10
11
倍稀释,命名为fpv1~fpv12。取上述96孔细胞培养板,前3行依次各加入上述病毒稀释液(fpv1~fpv12)100μl。第4行作阴性对照,仅加入100μl细胞培养基,于细胞培养箱静置培养3日,每日观察细胞状态,根据每日产生cpe的孔数,计算tcid
50
,以确定适宜浓度的病毒液。
[0052]
通过测定结果显示107稀释倍数为最高tcid50,选择105倍稀释为最优稀释倍数,进
行血清保护性实验。
[0053]
将已免疫fpv vp2抗原的猫血清置于50℃水浴锅30min,过0.22μm滤膜后,依次按100~10
11
倍稀释,方法同上培养96孔细胞培养板,取105稀释倍数浓度的病毒液以每孔100μl加入前4行,并在第1、2、3、4行依次按稀释梯度加入兔血清每孔100μl。第4行每孔加入100μl细胞培养基;第5行每孔仅加入100μl培养基,第6行仅加入200μl培养基,于细胞培养箱静置培养,每日观察细胞状态。
[0054]
通过观察细胞cpe可确定,在血清107稀释倍数出现明显cpe现象,104稀释倍数未出现明显cpe,可以确定血清产生中高强度和性抗体。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。