1.本发明属于组织工程生物材料技术领域,具体涉及一种肺组织脱细胞外基质微载体的制备方法及其应用。
背景技术:
2.间充质干细胞(mscs)具有高度自我更新能力及多向分化潜能,且具有易分离,低免疫原性和免疫调节的特性,使其成为组织工程领域的理想种子细胞。mscs的临床应用需要数十亿的细胞,而mscs目前的培养主要是采用传统的塑料培养瓶培养方式,这种二维培养方式无法满足规模化生产的需求,且难以模拟细胞在体内生长的微环境,一来会损害mscs的自我更新能力,使得mscs的扩增效率降低,二来会致使mscs细胞老化,发生“自发性”分化,损害其多向分化潜能,从而使mscs在科研和临床的应用中面临着巨大的挑战。
3.目前,利用三维支架系统对各项组织工程材料进行培养已取得了一定的研究进展,并且在mscs的体外培养中展现出了一定的效果。三维培养由于模拟了细胞在体内的生长环境,从而增强了单层培养中观察不到的细胞活性。而去细胞化的细胞外基质是最接近天然组织的支架材料,它具有天然组织中的复杂成分,包括胶原蛋白、粘连蛋白、纤维连接蛋白、弹性蛋白和蛋白聚糖等,而且具有与体内微环境相似的三维结构和柔韧性。同时,经脱细胞处理后原有细胞留下的空间能为后续的细胞培养提供足够的生长空间。此外,细胞分泌的(extracellular matrix,细胞外基质)能在体外重建,并模拟体内的微环境,从而通过调控间充质干细胞在ecm中的细胞行为,从而影响间充质干细胞的自我更新能力和定向分化潜能。然而,三维支架系统在展现出独特优势的同时,也给mscs的生产带来了重大挑战,主要表现在:(1)使用来自人类或动物组织的未定义成分,可能会导致批次间的差异,并造成病原体和免疫原转移的风险,从而阻碍细胞生产的良好生产规范(gmp);(2)大量细胞聚集可能导致mscs分化或衰老;(3)长期连续扩增的不可预测后果。因此,为解决三维支架系统存在的上述问题,微载体培养应运而生。
4.微载体具有微米级的尺寸、较大的比表面积、负载能力强、可增强细胞粘附和浸润等特点,使其能够使用最小的空间,花费较少的费用来扩增大量的细胞,而且微载体还允许营养物质和代谢废物的有效运输,从而提高细胞间的相互作用。目前,微载体已被广泛应用于可注射水凝胶、细胞及分子载体和疫苗生产等领域。此外,基于微载体的细胞培养系统是相对灵活的,不仅可以促进细胞的产量,还可以集成到现有的生物培养系统(如搅拌式生物反应器)中,有利于细胞培养环境的实时监控,保证不同批次细胞的稳定性,实现干细胞大规模生产。然而,现有的微载体大部分存在细胞相容性差的问题,导致其应用受到了一定的制约。因此,有必要开发具有良好生物相容性的微载体。
技术实现要素:
5.为了克服上述现有技术的不足,本发明的首要目的是提供一种肺组织脱细胞外基质微载体的制备方法。
6.本发明的第二个目的是提供采用上述制备方法制备得到的肺组织脱细胞外基质微载体及其应用。
7.本发明的上述第一个目的是通过以下技术方案来实现的:
8.本发明提供了一种肺组织脱细胞外基质微载体的制备方法,具体为:首先利用乙醇使肺组织中的蛋白交联固定,然后使用sds(十二烷基硫酸钠)和trypsin/edta进行脱细胞处理,脱细胞后再用nacl溶液和明胶溶液去除残留试剂,最后使用胃蛋白酶溶液消化制备得到脱细胞外基质微载体。
9.作为本发明的一个优选实施方式,上述的一种肺组织脱细胞外基质微载体的制备方法,包括以下步骤:
10.s1、将肺组织浸泡于75%乙醇中,使组织发生蛋白交联固定;
11.s2.将步骤s1中的肺组织浸泡于sds溶液和trypsin/edta溶液中进行脱细胞处理,得到脱细胞化的肺组织;
12.s3.将步骤s2中脱细胞化的肺组织浸泡于明胶溶液和nacl溶液中,清洗去除残留的试剂;
13.s4.将步骤s3中脱细胞化的肺组织浸泡于胃蛋白酶溶液中进行消化,得到脱细胞外基质微载体。
14.优选地,所述肺组织为猪肺组织,且所述肺组织为新鲜的肺组织。
15.本发明首先对猪肺组织进行交联固定,经脱细胞处理后再使用胃蛋白酶消化,进而得到脱细胞基质微载体,该微载体具有良好生物相容性,用于间充质干细胞的培育,可为细胞提供良好的生存环境,帮助细胞快速增殖及正常功能的表达,在干细胞规模化生产、干细胞旁分泌因子及外泌体生产、体外疾病模型构建、组织工程等方面有重要的应用潜力。
16.进一步地,所述猪肺组织取自肺叶远离支气管、次级支气管的尖端部分。
17.优选地,sds溶液的浓度为1%,sds溶液的浸泡温度为室温,时间不少于24h。
18.优选地,trypsin/edta溶液的浓度为0.25%,trypsin/edta溶液的浸泡温度为37℃,时间不少于24h。
19.优选地,胃蛋白酶溶液的浓度为1mg/ml,胃蛋白酶溶液的浸泡温度为37℃,时间不少于72h。
20.优选地,明胶溶液的浓度为0.3%,明胶溶液的浸泡温度为室温,时间不少于1h;nacl溶液的浓度为1m,nacl溶液的浸泡温度为室温,浸泡次数为2次,每次浸泡不少于0.5h。
21.优选地,75%乙醇浸泡时,抽真空排尽组织中的残留空气。
22.优选地,经明胶溶液和nacl溶液浸泡处理后均需要用生理盐水多次冲洗。
23.优选地,胃蛋白酶溶液浸泡处理前,先将脱细胞化的肺组织置于双抗溶液进行浸泡处理,并用生理盐水清洗多次。
24.本发明的上述第二个目的是通过以下技术方案来实现的:
25.本发明还提供了采用上述的制备方法制备得到的肺组织脱细胞外基质微载体。
26.本发明还提供了采用上述的肺组织脱细胞外基质微载体在细胞培养中的应用。
27.优选地,所述细胞包括但不限于间充质干细胞(mscs)。
28.本发明制备的脱细胞外基质微载体生物相容性好,可用于间充质干细胞的体外大规模扩增培养,可以有效促进干细胞的体外扩增效率,保持干细胞特有的免疫表型,在细胞
治疗等组织工程领域具有广泛的应用前景。
29.进一步地,所述间充质干细胞(mscs)为人脐带间充质干细胞(hucmscs)。
30.优选地,所述细胞培养为细胞体外培养。
31.与现有技术相比,本发明的有益效果是:
32.本发明公开了一种肺组织脱细胞外基质微载体的制备方法,首先对肺组织通过乙醇进行交联固定后,再使用sds和trypsin/edta进行脱细胞处理,最后使用胃蛋白酶进行消化处理后制备得到一种肺组织脱细胞外基质微载体。本发明提供的肺脱细胞外基质微载体,材料来源广泛易得,制备方式简单,反应无毒无害,且所制备的肺组织脱细胞外基质不仅保留了大量的i型胶原、iv型胶原,层粘连蛋白、纤连蛋白和弹性蛋白,而且具有与体内微环境相似的结构,可以大幅度提高培养材料的生物相容性和细胞相容性,有利于细胞的增殖、以及干性维持,有望用于间充质干细胞的体外大规模生产,在组织工程领域具有很高的应用前景及实用价值。
附图说明
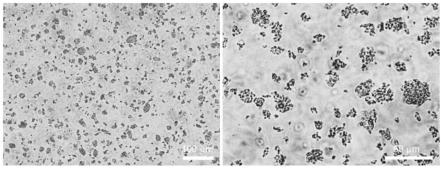
33.图1为脱细胞外基质微载体的光镜图;
34.图2为脱细胞外基质微载体的扫描电镜图;
35.图3为脱细胞外基质微载体培养细胞14天后的活细胞染色图(a为纯细胞,b为细胞:微载体=1:1,c为细胞:微载体=1:10,d为细胞:微载体=1:100);
36.图4为脱细胞外基质微载体培养细胞14天后的扫描电镜图(a为纯细胞,b为细胞:微载体=1:1,c为细胞:微载体=1:10,d为细胞:微载体=1:100);
37.图5为脱细胞外基质微载体培养细胞14天后的组织切片h&e染色图(a为纯细胞,b为细胞:微载体=1:1,c为细胞:微载体=1:10);
38.图6为脱细胞外基质微载体培养细胞7和14天后的dna定量结果。
具体实施方式
39.下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
40.下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试验材料,如无特殊说明,均为可通过常规的商业途径购买得到。
41.下述实施例中,sds溶液、trypsin/edta溶液和胃蛋白酶溶液采用过滤除菌,其他溶液全部高温高压灭菌。
42.实施例1猪肺组织脱细胞外基质微载体的制备
43.具体的制备方法包括以下步骤:
44.(1)取猪肺肺叶远离支气管、次级支气管的尖端部分,切成2
×
2cm大小的小薄片,用生理盐水反复清洗,直至没有血水为止;
45.(2)将切碎的肺组织置于75%乙醇中浸泡,并于真空干燥罐中抽真空处理,让肺组织中的空气排掉,然后盖上保鲜膜,置于4℃浸泡2天;
46.(3)将肺组织取出置于培养皿中,剪碎成小于5mm的碎片,用生理盐水清洗6遍,将
清洗完后的肺组织置于1%sds溶液中,室温搅拌24h(转速为200rpm),然后再浸泡在0.25%trypsin/edta溶液中,37℃消化24h,再用生理盐水清洗3遍,得到脱细胞化的肺组织;
47.(4)将脱细胞化的肺组织浸泡在0.3%明胶溶液中,室温下置于摇床上摇晃1h(转速为100rpm),重复1次,然后用生理盐水冲洗6遍;再将肺组织用1m nacl溶液浸泡2次,每次浸泡0.5h,再用生理盐水清洗5遍;
48.(5)将清洗完后的脱细胞化的肺组织置于10倍的双抗溶液中浸泡4h(青霉素原液浓度为10000u/ml,链霉素原液浓度为10000ug/ml,加pbs稀释10倍制成10倍浓度的双抗溶液),然后用生理盐水清洗5遍;再将肺组织置于浓度为1mg/ml的胃蛋白酶/乙酸溶液中,在37℃下搅拌(100~200rpm)消化72h。
49.在光镜下观察制备得到的肺脱细胞外基质微载体,如图1所示。该微载体呈现大小不均的颗粒状聚集体,颗粒粒径约5~30μm。
50.同时,对该肺脱细胞外基质微载体进行表面形貌观察,即将制备得的肺脱细胞外基质微载体使用导电胶固定在样品台上,然后使用离子溅射仪喷金处理,并置于热场发射扫描电镜的真空室进行真空处理,当真空度达到10-3
kpa以上时,在加速电压为20kv,电流为10ma下观察样品。结果如图2所示。
51.从图2可以看出,所制得的肺脱细胞外基质微载体形状不规则,粒径分布较广,表面凹凸不平,有利于细胞的附着。
52.实验例1肺脱细胞外基质微载体对细胞的培养效果
53.一、肺脱细胞外基质微载体培养hucmscs细胞14天后的活细胞染色实验
54.(1)mscs细胞用培养基的配制:往dmem/f12培养基中添加10%的南美胎牛血清(fbs),1%双抗,1
×
its,40μg/ml的脯氨酸和50μg/ml的l-抗坏血酸,混匀后使用0.22μm的针头过滤器过滤除菌,4℃保存备用;
55.(2)细胞培养:将微载体用无菌pbs清洗2遍后,与hucmscs细胞(5
×
105)按数量比为细胞:微载体=1:0、1:1、1:10、1:100的比例混合置于15ml离心管中,并以5
×
105个细胞作为对照组,所有组别均以1000rpm离心5min,然后置于37℃,5%co2细胞培养箱中培养2天,待微载体-细胞混合物形成小球后换液,培养14天。
56.(3)染色:称取10mg fda(二乙酸荧光素)粉末放在15ml离心管中,再加入5ml丙酮,无需过滤,配成2mg/ml的母液,4℃避光保存,染色时用无菌pbs稀释1000倍(fda工作液)。将微载体与细胞形成的小球取出放在培养皿中,pbs润洗三次后加入1ml的2μg/ml的fda工作液,在培养箱中避光孵育5min左右;孵育结束后,移走fda溶液,pbs润洗三遍,保持样品湿润,采用480nm的激发波长在倒置荧光显微镜下观察细胞的分布形态与活力。结果如图3所示。
57.图3的结果表明,细胞:微载体=1:0、1:1和1:10这三组微载体-细胞混合物形成了球状复合物(pellet),其中细胞:微载体=1:1组与对照组无明显差别,能看到大量的活细胞,细胞都聚集在一起,呈球形,而细胞:微载体=1:1组由于存在大量的微载体,细胞与细胞外基质蛋白相互作用而获得更大的突起并能够扩散。细胞:微载体=1:100组则由于微载体数量太多,细胞无法聚集,没有形成小球,但细胞仍粘附在微载体上生长;可见,微载体能够促进细胞的粘附增殖,并且有利于细胞与外环境之间的相互作用。
58.二、肺脱细胞外基质微载体培养hucmscs细胞14天后的扫描电镜观察
59.按照上述实验方法对细胞球聚集体(pellet)进行染色后,用pbs清洗2遍,4%多聚甲醛固定0.5h,然后快速用去离子水清洗2遍,置于-80℃冷冻过夜后冻干,对冻干样品进行喷金后置于扫描电镜下观察。结果如图4所示。
60.图4结果表明,对照组细胞聚集在一起,没有空隙,可能导致中间的细胞缺氧而生长状态不好;而1:1和1:10组可观察到细胞与微载体形成的小球保留了大量孔洞,有利于营养物质和代谢废物的交换,并且细胞分泌了大量的细胞外基质蛋白;相比之下1:100组观察到大多都是聚集的微载体。
61.三、肺脱细胞外基质微载体培养hucmscs细胞14天后的组织切片h&e染色试验
62.按照上述方法对细胞进行第14天培养后,使用pbs清洗微载体与细胞球状聚集体(pellet),然后用4%多聚甲醛固定24h,并对pellet进行石蜡包埋,切成5μm厚的切片后再脱蜡使用苏木精和伊红染液染色,中性树脂封片干燥后,置于显微镜下观察,结果如图5所示。
63.从图5可以看出,单纯细胞形成的pellet较小,细胞呈圆形分布,细胞被其分泌的细胞外基质包裹;而1:1和1:10组形成的pellet体积更大一点,细胞有伸长的趋势,扩散能力更强,而且同样观察到细胞在周围分泌大量的细胞外基质网络。
64.四、脱细胞外基质微载体培养细胞7和14天后的dna定量试验
65.采用hoechst 33258法进行dna定量:按照上述方法培养hucmscs细胞的第7和14天,分别收集样品,用pbs清洗,-20℃冷冻干燥;然后每个样品加1ml 1mg/ml的木瓜蛋白酶,60℃水浴消化过夜。将hoechst 33258染色液用去离子水配成1mg/ml的母液,4℃避光保存,使用时稀释到0.1μg/ml的工作液。然后往每100μl的待测液中加入2ml染色液避光染色5min,之后使用荧光分光光度计检测352/461nm处的荧光,设定激发波长为350nm,扫描范围为400-550nm,bandpass=5nm,step size=1nm,并以鱼精dna用作标样。
66.从图6可以看出,在第7或14天,1:1组与1:10组的dna含量都要高于1:0组,说明微载体有利于细胞增殖;并且1:1组的dna含量高于1:10组,这可能是1:1组中微载体与细胞形成的微环境更有利于营养物质和气体交换,因此细胞生长得更旺盛。
67.综上所述可见,本发明对新鲜的猪肺组织通过乙醇固定后,使用sds和trypsin/edta溶液进行脱细胞处理,最后使用胃蛋白酶进行消化处理后制备得到一种肺组织脱细胞外基质微载体。所制得的微载体粒径约为5~30μm,且猪肺组织脱细胞后清除了细胞抗原和遗传物质,保留大量的细胞外基质蛋白和活性因子,有利于干细胞的粘附、增殖及正常功能表达。本发明制备的微载体可用于间充质干细胞的体外大规模扩增培养,可以有效促进干细胞的体外扩增效率,保持干细胞特有的免疫表型,在细胞治疗领域具有广泛的应用前景。
68.以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。