精子中mir-199a-3p在制备抑郁症检测产品、抗抑郁症药物中的应用
技术领域
2.本技术涉及生物医学技术领域,特别涉及一种精子中mir-199a-3p在制备抑郁症检测产品、抗抑郁症药物中的应用。
技术背景
4.抑郁症又称抑郁障碍,是世界上最常见也是最具有致残性的精神疾病之一,以显著而持久的心境低落为主要临床特征,是心境障碍的主要类型。目前,全世界的抑郁症患者多达1.2-2.0亿,尽管经过了几十年的研究,抑郁症的病因依然成谜。目前对于抑郁症病因的看法是遗传与环境共同作用的结果。
5.现有研究已证明环境会影响遗传,比如,在大饥荒下出生和成长起来的子女更易患上肥胖症,父亲饮酒可能会导致胎儿出现乙醇综合征症状等。然而,与已知的环境因素相比,我们对抑郁症遗传风险的认识仍存在巨大差距。真正的“抑郁基因”才是导致抑郁症的始作俑者,“抑郁基因”能够用来在啮齿动物身上建立疾病模型或作为潜在的治疗目标,而目前“抑郁基因”尚未通过基因分析等手段鉴定出来。
6.表观遗传(epigenetics)是指在基因的dna序列没有发生改变的情况下,基因功能发生了可遗传的变化,并最终导致了表型的变化。表观遗传特征,如dna甲基化、组蛋白修饰和非编码rna可以通过种系传递到下一代,从而诱导与亲本环境相关的表型。但是,胚系表观遗传的功能、机制和范围仍不清楚,尤其是在父子传递方面,因为人们一直认为精子只是将父系dna传递给卵母细胞。
7.家系研究表明,抑郁症一级亲属患病率约为15%,父亲为抑郁患者时会显著增加子代患抑郁症的风险。因此,近年来精子rna越来越被认为是dna之外父系遗传信息的另一个来源。精子中存在的一系列不同的rna可在受精时进入卵母细胞,包括micrornas (mirnas)、trna衍生的小rna(tsrnas)和长rna(mrnas和长非编码rna)。遗传性mirnas被发现参与胚胎发育、kit基因的变异和亲代表型传递给后代,而tsrnas和长rnas分别参与饮食诱导的代谢紊乱和创伤症状的代际遗传。尽管有这些开创性的研究,精子rna重塑后代发育以重现父系获得的表型的确切机制仍然成谜。特别是,尽管父亲的创伤经历和压力可能通过精子rna对后代产生不利影响,但抑郁症的病理症状是否能通过精子rna介导的代际遗传传递给下一代,目前仍不清楚。所以精子mirna在抑郁症遗传中具体起到怎样的作用,以及是否能够利用精子mirna检测、治疗抑郁症、阻断抑郁症的代际遗传成为了亟待解决的问题。
技术实现要素:
9.有鉴于此,本技术提供了一种精子中mir-199a-3p在制备抑郁症检测产品、抗抑郁症药物中的应用,以解决
背景技术:
中存在的问题。
10.本技术提供一种精子中mir-199a-3p在制备抑郁症检测产品中的应用。
11.进一步地,所述mir-199a-3p的核苷酸序列为acaguagucugcacauugguua。
12.进一步地,所述抑郁症检测产品包括芯片或试剂盒;所述芯片包括固相载体以及固定在所述固相载体上的寡核苷酸探针,所述寡核苷酸探针包括特异性对应于所述 mir-199a-3p的部分或全部序列;所述试剂盒包括检测所述mir-199a-3p表达水平的试剂,所述试剂包括针对所述mir-199a-3p的引物和/或探针。
13.进一步地,所述检测产品以精子中mir-199a-3p的含量为检测指标,当mir-199a-3p 的含量高于同物种正常水平时,提示风险。
14.进一步地,所述高于同类物质正常水平为高于2倍及以上。
15.本技术还提供一种精子中mir-199a-3p在制备抗抑郁药物中的应用。
16.进一步地,所述抗抑郁药物包括所述mir-199a-3p的抑制剂。
17.进一步地,所述mir-199a-3p的核苷酸序列为acaguagucugcacauugguua。
18.进一步地,所述抑制剂包括mir-199a-3p的反向互补序列或者抑制mir-199a-3p复制或表达的抑制物。
19.进一步地,所述mir-199a-3p的抑制剂与其他抑制所述mir-199a-3p表达或减弱所述 mir-199a-3p功能的试剂在制备抗抑郁药物中联合应用。
20.本技术通过大量研究证明,由父亲压力引起的抑郁样表型可以通过精子中 mir-199a-3p的因果作用被后代遗传,即父亲的抑郁会导致精子srna异常、胚胎srna异常,进而抑制dna甲基化,导致胚胎发育异常,使子代抑郁易感,这揭示了抑郁症的新遗传方式,对全面阐释抑郁症发生的分子机理具有重要意义,也为研究精神类疾病的遗传规律提供新的视角。
21.而本技术创新的将精子中mir-199a-3p应用于抑郁症检测产品和抗抑郁药物中,基于精子中特定的mir-199a-3p对抑郁症进行检测和治疗,该抑郁症检测产品能够有效提高抑郁症检测的精确度,检测效率高,该抗抑郁药物不仅能够提高抑郁症的治疗效果,还能够有效抑制抑郁症的代际遗传,易于大规模推广和使用。
附图说明
23.图1是本技术一实施例中对照组小鼠和cms诱导的试验组小鼠的f0代、f1代多种测试结果对比图;
24.图2是本技术一实施例中对照组小鼠和cms诱导的试验组小鼠的f0代、f1代行为表现对比图;
25.图3是本技术一实施例中小鼠培养方法策略示意图;
26.图4是本技术一实施例中对照组小鼠和crs诱导的试验组小鼠的f0代、f1代行为表现对比图;
27.图5是本技术一实施例中cms诱导的试验组小鼠的f0代、f1代pvn、海马和mpfc 神经元对比图;
28.图6是本技术一实施例中对照组小鼠和cms诱导的试验组小鼠的f0代、f1代神经元激活和突触传递相关对比图;
29.图7是本技术一实施例中cms诱导的试验组小鼠的f2代行为表现对比图;
30.图8是本技术一实施例中小鼠受精卵注射精子rna后体外受精后代的行为表现对
比图;
31.图9是本技术一实施例中小鼠受精卵注射精子srna后体外受精后代的神经元激活对比图;
32.图10是本技术一实施例中小鼠精子srna与抑郁症父系传播关系的试验图;
33.图11是本技术一实施例中小鼠受精卵注射irna后体外受精后代的行为表现对比图;
34.图12是本技术一实施例中小鼠受精卵注射合成mirnas后的ivf后代基因改变示意图;
35.图13是本技术一实施例中mirna的不平衡与抑郁样模型f0代雄性小鼠、f1代小鼠的行为表现、神经元激活关系对比图;
36.图14是本技术一实施例中受精卵注射精子rna加mirna反义链后体外受精后代的行为表现和神经元活动对比图;
37.图15是本技术一实施例中调整受精卵中mirna的不平衡与抑郁症样模型的f0代雄性小鼠、f1代小鼠的关系图;
38.图16是本技术一实施例中mirnas对抑郁症相关基因直接调控的验证图;
39.图17是本技术一实施例中定量rt-pcr检测精子中pirnas和tsrnas的特异性和有效性验证图;
40.图18是本技术一实施例中western印迹法测定glua1、glua2、glun2a、glun2b、 camkii和β-actin的结果图;
41.图19是本技术一实施例中抑郁症模型小鼠的精子mirna在胚胎发育早期引起的转录级联变化图;
42.图20是本技术一实施例中小鼠强迫游泳试验漂浮时间对比图;
43.图21是本技术一实施例中小鼠蔗糖偏好试验蔗糖摄入量对比图;
44.图22是本技术一实施例中小鼠血清皮质酮含量对比图;
45.图23是本技术一实施例中小鼠抑郁症相关基因mrna表达水平对比图。
具体实施方式
47.下面结合附图对本技术的具体实施方式进行描述。
48.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的试剂、材料和操作步骤均为相应领域内广泛使用的试剂、材料和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
49.在本技术中,mirna(microrna)是一类内生的、长度约为20-24个核苷酸的小 rna,其在细胞内具有多种重要的调节作用。实施例1
50.本实施例提供一种精子中mir-199a-3p在制备抑郁症检测产品中的应用。
51.具体地,所述mir-199a-3p的核苷酸序列为acaguagucugcacauugguua。
52.所述检测产品以精子中mir-199a-3p的含量为检测指标,当mir-199a-3p的含量高于同物种正常水平时,提示风险。优选地,所述高于同类物质正常水平为高于2倍及以上。
53.本实施例中的mir-199a-3p可以为其初始mir-199a-3p、前体mir-199a-3p、成熟 mir-199a-3p中的至少一种,初始mir-199a-3p和前体mir-199a-3p均能够在人细胞内被剪切并表达成成熟mir-199a-3p。
54.本实施例中的mir-199a-3p还可以包括其变体,即组成型核酸分子的功能等同物,变体能够显示与该mir-199a-3p核酸分子相同的功能,可以通过核苷酸残基的缺失、置换或插入而发生突变。
55.此外,在不影响mir-199a-3p功能的前提下,还可以在mir-199a-3p的一端或两端增加保护性碱基,或是对mir-199a-3p进行碱基修饰,以保证mir-199a-3p的稳定性。
56.所述抑郁症检测产品包括芯片或试剂盒;所述芯片包括固相载体以及固定在所述固相载体上的寡核苷酸探针,所述寡核苷酸探针包括特异性对应于所述mir-199a-3p的部分或全部序列;所述试剂盒包括检测所述mir-199a-3p表达水平的试剂,所述试剂包括针对所述 mir-199a-3p的引物和/或探针。
57.本实施例创新的将精子中mir-199a-3p应用于抑郁症检测产品中,基于精子中特定的mir-199a-3p对抑郁症进行检测,能够有效提高抑郁症检测的精确度。实施例2
58.在实施例1的基础上,本实施例提供一种抑郁症检测产品。
59.该抑郁症检测产品包括如实施例1所述的mir-199a-3p。
60.该抑郁症检测产品可以为芯片或试剂盒;所述芯片包括固相载体以及固定在所述固相载体上的寡核苷酸探针,所述寡核苷酸探针包括特异性对应于所述mir-199a-3p的部分或全部序列;所述试剂盒包括检测所述mir-199a-3p表达水平的试剂,所述试剂包括针对所述 mir-199a-3p的引物和/或探针。
61.上述寡核苷酸探针还可以包括现有能够诊断抑郁症或抑郁倾向的mir-199a-3p寡核苷酸探针。在实际应用中,可以将上述的一种、两种或多种mir-199a-3p的检测探针放置在同一芯片上进行检测。
62.上述试剂还可以包括现有能够诊断抑郁症或抑郁倾向的mir-199a-3p引物和/或探针。在实际应用中,可以将上述的一种、两种或多种mir-199a-3p的检测引物和/或探针放置于同一试剂盒中进行检测。
63.本实施例提供的抑郁症检测产品,从抑郁症的遗传机理出发,开拓了新的抑郁症检测角度,检测效率高,准确性高。实施例3
64.本实施例提供一种精子中mir-199a-3p在制备抗抑郁药物中的应用。所述抗抑郁药物包括所述mir-199a-3p的抑制剂。
65.所述mir-199a-3p的核苷酸序列为acaguagucugcacauugguua。
66.优选地,所述抑制剂包括mir-199a-3p的反向互补序列(即能够与mir-199a-3p配对形成双链结构)或者抑制mir-199a-3p复制或表达的抑制物。
67.在实际应用中,所述mir-199a-3p的抑制剂与其他抑制所述mir-199a-3p表达或减弱所述mir-199a-3p功能的试剂在制备抗抑郁药物中联合应用。
68.本技术创新的将精子中mir-199a-3p应用于抗抑郁药物中,通过mir-199a-3p抑制剂抑制精子中特定mir-199a-3p的含量减弱抑郁症的遗传,对抑郁症进行治疗,能够有效提
高抗抑郁药物的治疗效果。实施例4
69.在实施例3的基础上,本实施例提供一种抗抑郁药物。该抗抑郁药物包括如实施例3 所述的mir-199a-3p的抑制剂。
70.本实施例的抗抑郁药物还可以包含药学上可以接受的载体,该载体包括但不限于稀释剂、缓冲剂、乳剂、包囊剂、赋形剂、填充剂、粘合剂、喷雾剂、透皮吸收剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、着色剂、矫味剂、佐剂、干燥剂、吸附载体等。
71.本实施例的抗抑郁药物的剂型可以为片剂、胶囊剂、粉剂、颗粒剂、丸剂、栓剂、软膏剂、溶液剂、混悬剂、洗剂、凝胶剂、糊剂等。
72.本实施例的抗抑郁药物对抑郁症及抑郁症相关疾病具有良好的治疗效果。抑郁症相关疾病可以是抑郁症形成过程中产生的疾病或抑郁症引起的并发症、后遗症等与抑郁症具有一定相关性的疾病。
73.本实施例的抗抑郁药物还可以与其他具有抗抑郁效果的治疗药物或治疗手段联合使用对抑郁症患者进行治疗,以提高治疗效果。
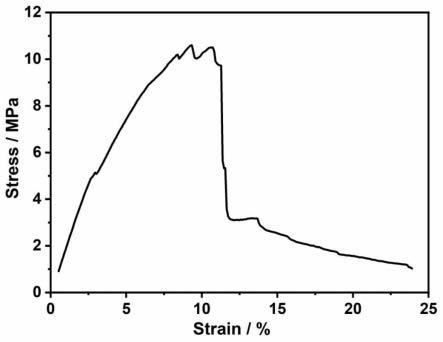
74.上述治疗药物包括选择性5-羟色胺再摄取抑制剂(ssri,比如氟西汀、帕罗西汀、舍曲林、氟伏沙明、西酞普兰和艾司西酞普兰)、5-羟色胺和去甲肾上腺素再摄取抑制剂 (snri,比如文拉法辛和度洛西汀)、去甲肾上腺素和特异性5-羟色胺能抗抑郁药(nassa,比如米氮平)等;上述治疗手段包括心理治疗、物理治疗等,本技术对此不做限制。
75.本实施例提供的抗抑郁药物,从抑郁症的遗传机理出发,开拓了新的抑郁症治疗角度,疗效好,适于大规模推广与应用。实施例5
76.本实施例设置对照组和试验组,对照组和试验组均选择相同数量的8周龄c57bl/6j 小鼠。
77.首先,对试验组的小鼠建立慢性轻度应激(cms)诱导的抑郁小鼠模型,具体地,令试验组小鼠接受5周的慢性轻度应激试验,即让小鼠受到湿笼、剥夺食物、束缚、频闪照明时间(150次/min)、光-暗周期倒置、笼子倾斜(45
°
)和噪音(90-105db)的压力,所有压力在不同时间点进行施加,并且为避免习惯化,还需给压力增加不可预测的因素。对照组的小鼠在没有压力的情况下保持正常的饲养条件,对照组小鼠和试验组小鼠每周均称重两次。
78.如图1b所示,试验组的cms诱导的f0雄性小鼠(f0-dep)与对照组非应激的f0 雄性小鼠(f0-ctl)相比,体重显著减少。
79.如图1c和图1d所示,试验组的cms诱导的f0雄性小鼠(f0-dep)与对照组非应激的f0雄性小鼠(f0-ctl)相比,试验组f0雄性小鼠表现出明显的抑郁行为,比如强迫游泳试验(fst)中其静止时间更长,蔗糖偏好试验(spt)中其蔗糖摄入量更低。
80.为证明小鼠的上述改变不是运动活动引起的,将试验组和对照组小鼠f0代和f1代放置于一个开阔的场地(50
×
50
×
40cm3)中进行试验,该场地上方放置一个60瓦灯泡,无干扰噪音或任何其他干扰,室内光线昏暗。在将鼠标放在竞技场中心后,用摄像机记录下运动5分钟。采用topscan软件分析小鼠的运动距离和身体运动速度,结果如图2所示。
81.图2a为试验组的cms诱导的f0雄性小鼠(f0-dep)和对照组非应激的f0雄性小鼠(f0-ctl)在开阔场地中的运动活性对比图(每组n=15只小鼠);图2b为试验组的cms 诱导
的f1雄性小鼠(f1-dep)和对照组非应激的f1雄性小鼠(f1-ctl)在开阔场地中的运动活性对比图(每组n=16只小鼠);图2c和图2d为在暴露于持续1周、2周或3周的cvs 刺激后,f1-dep与f1-ctl的fst(每组17-20只小鼠)和spt(每组16-18只小鼠)的行为表现对比图;图2e和图2f为在基线条件下或暴露于cvs后,分别对f1代雄性小鼠和雌性小鼠进行fst和spt的行为表现评估的评估结果对比图(每组n=15-25只小鼠),数据显示为平均值
±
标准误差(sems)。从图2的试验结果来看,该试验结果与图1c和图1d的试验结果相似,这说明试验组小鼠fst试验中静止时间变长和spt试验中蔗糖摄入量变低并不是由于运动、活动等的改变而导致的。
82.此外,血浆皮质酮是下丘脑-垂体-肾上腺轴(hpa)轴的关键激素,血浆皮质酮水平显著升高,也是应激强度的一个特征性标志物(21,25),为测量小鼠的皮质酮水平,在早上7点至9点之间,使用动物刺针获取对照组和试验组小鼠血样,血液样本收集到edta涂层的试管中,在4℃的环境下以2000g速度离心20分钟后分离血浆,使用酶联免疫吸附试验 (elisa)试剂盒(纽约恩佐生命科学公司)测量10μl血浆中的皮质酮,每个样品测量三个重复,结果如图1e所示,试验组cms诱导的f0雄性小鼠血浆皮质酮水平显著升高。
83.抑郁是由不适应的应激引起的不同脑区和离散的神经回路中的分子、细胞和突触神经传递的改变引起的。下丘脑脑室旁核(pvn)是hpa轴的重要组成部分,如图1f所示,试验组的cms诱导的f0雄性小鼠(f0-dep)中促肾上腺皮质激素释放激素(crh)的mrna 表达显著升高,这与血浆皮质酮水平的升高一致。这些结果共同表明cms诱导的f0雄性小鼠hpa轴激活过度。
84.海马体、内侧前额叶皮质(mpfc)和外侧缰核(lhb)参与抑郁症的病理生理学,共同构成进化上保守的核心神经回路,对环境条件和内部状态的灵活和适应性行为反应至关重要。特别是抑郁症患者的海马体和内侧前额叶皮质中经常出现谷氨酸能神经递质功能障碍和神经营养因子丢失。对试验组的cms诱导的f0雄性小鼠的海马体和内侧前额叶皮质的基因表达特征进行分析,发现谷氨酸信号基因异常表达(glua1和glua2下调,glun2a和/ 或glun2b上调),而谷氨酸信号基因的表达降低,相比之下,βcamkii的表达在外侧缰核中显著上调。
85.对试验组的cms诱导的f0雄性小鼠(f0-dep)和对照组非应激的f0雄性小鼠 (f0-ctl)进行免疫印迹分析,结果如图1g所示,证明了介导突触传递和可塑性的谷氨酸受体亚单位和信号蛋白在试验组的cms诱导的f0雄性小鼠的海马体和内侧前额叶皮质中的异常表达。
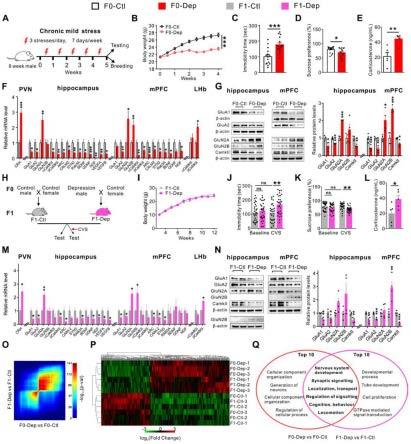
86.为了研究抑郁症的遗传规律,将试验组的cms诱导的f0雄性小鼠(f0-dep)和对照组非应激的f0雄性小鼠(f0-ctl)分别与健康雌性小鼠交配,具体交配及培养方法如图3 所示。
87.对试验组及对照组f1代小鼠进行抑郁样症状筛查,结果如图1i所示,试验组f1代小鼠(f1-dep)生长正常,体重增长也无异于对照组f1代小鼠(f1-ctl)。如图1j、图1k 所示,在基线条件下,试验组f1代小鼠也表现出与对照组f1代小鼠相似的静止时间和蔗糖摄入量;然而,在暴露于持续2周的轻微慢性可变压力(cvs)后,试验组f1代小鼠再现了父系抑郁样表型,包括明显更长的漂浮时间和更少的蔗糖消耗,而对照组f1代小鼠未表现抑郁样行为。如图2b所示,开放场试验同样证实了试验组f1代小鼠的这些行为表型与运动活动无关。
88.此外,如图1l所示,试验组f1代小鼠血浆皮质酮水平显著升高。
89.为了验证环境刺激与后代抑郁样症状发生的相关性,我们从1周到3周逐渐加强了 cvs刺激。如图2c、图2d所示,虽然1周的cvs不足以诱导试验组f1代小鼠的不动性增加和蔗糖消耗减少,但2周或3周的cvs在试验组f1代小鼠中产生了明显的抑郁样行为。此外,对f1代雄性小鼠和雌性小鼠分别进行行为测试评估,图2e和图2f的结果显示,在暴露于cvs后,两种性别都表现出相似的抑郁样表型倾向。
90.如图4a、图4b所示,在另一个由慢性束缚应激(crs)建立的抑郁样模型中,也观察到了应激脆弱性的代际传递。如图4c-图4e所示,与cms模型相似,crs诱导的f0 雄性小鼠(f0 dep)所生的f1后代(f1 dep)在基线条件下表现出正常的行为表现,但在轻微cvs暴露时,比对照组f1代小鼠(f1 ctl)更易受抑郁样行为的影响。这些结果表明, crs诱导的雄性小鼠,其后代抗压能力较低。
91.为了解释在f1-dep中观察到的抑郁样行为,我们在与抑郁症相关的几个关键脑区进行了分子分析。如图1m和图5所示,当暴露于cvs时,f1-dep具有与f0-dep相似的基因表达特征,其特征是pvn中crh mrna的过度表达;海马和mpfc中谷氨酸受体、突触蛋白和神经营养因子的mrna失调;lhb中glua1/2、rab3a、bdnf和βcamkii mrna上调。
92.为验证上述结果对其进行免疫印迹分析,结果如图1n所示,证实谷氨酸信号和突触蛋白在f1-dep的海马体和mpfc中的异常表达。此外,我们还对f0-dep和f1-dep的海马体转录组进行了全基因组测序,并与未应激的f0-ctl和f1-ctl进行了比较。通过秩-秩超几何重叠(rrho)分析,以无阈值的方式识别全基因组重叠的模式和强度,如图1o所示,结果表明f0 dep与f0 ctl以及f1 dep与f1-ctl之间上调和下调的海马基因存在显著重叠。如图1p所示,分层聚类也显示出在f0-dep和f1-dep中相似的海马基因谱,而f0-ctl和f1-ctl 的基因谱属于不同的聚类组。基因的生物过程可能会被改变,然后进行基因聚类分析。
93.如图1q以及图3所示,f0-dep vs f0-ctl和f1-dep vs f1-ctl共有6个go簇,这些重叠的go功能类别与“神经系统发育”、“突触信号”、“定位、运输”、“信号调节”、“认知、行为”和“运动”直接相关。这些数据有力地表明,f0-dep所生的f1后代可能由于分子和信号的不适应变化而受损,因此更容易受到应激诱导的抑郁样症状的影响。
94.为了解剖海马、mpfc和lhb的功能变化,我们通过c-fos免疫细胞化学、神经元激活的敏感标记技术和全细胞膜片钳记录来评估神经元的激活和突触传递。如图6a、图6d 和图7a所示,随着crhmrna和血浆皮质酮的增加,f0-dep的pvn中的crhergic神经元与f0-ctl的pvn相比明显被激活。因此,与f1-ctl相比,f1-dep的pvn中的crhergic 神经元明显被激活,表明f1-dep的hpa轴活性显著增加。同样,如图5b、图5c所示,在 f1-dep的lhb中也观察到神经元激活的明显增加。然而,从图6b、图6c、图6e、图6f、图7b和图7c来看,与f0-ctl相比,f0-dep的海马和mpfc中的神经元激活明显沉默。因此,与f1-ctl相比,f1-dep的海马和mpfc中的神经元激活明显减少。这些结果显示抑郁症与海马体和mpfc神经元激活减少有关,而lhb和pvn的过度活跃在抑郁症中起着因果关系。
95.此外,如图6g、图6h所示,与f0-ctl相比,f0-dep的海马体和mpfc锥体神经元的自发兴奋性突触后电流(sepscs)的频率和振幅均显著降低,f1-dep的海马和mpfc锥体神经元的自发兴奋性突触后电流(sepscs)的频率和振幅也有类似程度的下降与f1 ctl 中的比较。这些结果表明,尽管f1-dep是正常饲养的,并且没有受到像f0-dep那样的应激暴露,但
f1-dep的神经回路中的突触传递和神经元活动模式与f0-dep相似。
96.随后,我们针对抑郁样性状是否会遗传给f2代的问题进行如下试验。如图3和图 8a所示,将f1-dep和f1-ctl的雄性与正常雌性杂交,检查f2代后代(f2-dep与f2-ctl) 各项指标。如图8b、图8c所示,与f2-ctl相比,f2-dep对cvs刺激不敏感,表明抑郁易感性的遗传是代际遗传,而不是跨代遗传。实施例6
97.越来越多的证据表明,在环境暴露中获得的父系特征可以通过精子遗传给后代,然而精子中连接父系环境和后代结局的活性成分仍有待阐明。精子rna以前被认为是精子发生过程中可忽略的残余物,最近发现在受精过程中会传递到受精卵。
98.为了评估精子rna是否与后代抑郁样表型增加相关,我们从实施例5的f0-dep和 f0-ctl小鼠的精子中纯化总rna,并将其注射到正常受精卵中(rna注射量标准化为大约 10个精子),然后将胚胎移植到代孕体中母亲产生后代(rna-dep vs rna-ctl);用焦碳酸二乙酯(depc)水代替精子进行rna分离,注入正常受精卵,所得后代作为对照组。如图9所示,与对照组相比,rna-ctl在行为上没有差异,这表明将来自f0-ctl的精子rna 注射到受精卵中不会影响后代的表型。值得注意的是,与rna-ctl相比,rna-dep在基线条件下没有表现出明显的抑郁样行为,rna-dep对cvs产生了显著的抑郁样行为。总的来说,将精子rna注射到受精卵中会产生与那些因压力诱导的f0-dep而出生的后代一样的抑郁样行为改变。
99.为了缩小精子rna中的活性成分,从f0-dep和f0-ctl的精子中特别富集小rna (srna,《200nt)部分,并微量注射到野生型受精卵中产生ivf后代(srna-dep vs srna-ctl; srna注射标准化为大约10个精子),将等量的合成乱序rna(scrrna,随机序列,长度为0-50nt)代替精子进行rna分离,注入受精卵中产生模拟对照后代。如图10a-c所示,虽然srna-dep、srna-ctl和模拟对照在基线条件下表现出相同的行为表现,并且srna-ctl 和模拟对照在暴露于cvs后表现出相似的行为表现,但srna-dep更易受cvs诱发的抑郁样行为的影响,包括在fst试验中较长的静止时间和spt试验中蔗糖摄入量较低。如图10d-f 和图11a所示,与srna-ctl相比,srna-dep显示hpa轴异常激活,包括血浆皮质酮水平升高、刺激crh表达以及pvn中crheric神经元的激活增强。同样,如图12所示,与srna-ctl 相比,srna-dep的lhb中与抑郁相关的基因和神经元的激活显著增加。
100.此外,如图10g-图10k和图11b-图11c所示,与srna-ctl相比,在srna-dep的海马体和mpfc中观察到抑郁相关基因/蛋白质的异常表达和神经元活化降低。如图10l、图 10m所示,在srna-dep的海马和mpfc锥体神经元中,sepscs的频率和振幅都降低。
101.如图13a-图13c所示,我们从f0-dep和f0-ctl的精子中特别富集了长rna (lrna,》200nt)部分,并将其微注射到野生型受精卵中以产生ivf后代(lrna-depvs-lrna-ctl)。与lrna-ctl相比,lrna-dep在基线条件下和cvs暴露后均未表现出明显的抑郁样行为。这些结果表明,精子核糖核酸(srnas)而不是lrnas参与了精子rna对后代抑郁样症状的诱导作用。
102.精子携带大量的srnas,包括mirnas、piwi相互作用rna(pirnas)和tsrnas。为了确定哪些特定的精子srnas亚型会导致后代的异常,我们通过rna深度测序检测了来自f0-dep和f0-ctl的精子的srna图谱。如图14a所示,长度分布分析显示,来自f0-dep 和f0-ctl的精子中的srna成分相似。使用严格的阈值(平均读数》500,倍数变化》2和 p《0.05)对差异表达的srnas进行分析,如图15a、图2和图4所示,发现f0-dep精子中有19个mirnas、24个pirnas
和0个tsrnas与f0 ctl精子中的显著不同。而如图15a,更大比例的mirnas在f0 dep精子中表达增加,而大多数pirnas呈下降趋势。定量rt-pcr 分析证实了rna深度测序的准确性。如图15b所示,总共有16个和1个mirnas在f0-dep 精子中被证实显著上调和下调;1个和5个pirnas在f0-dep精子中分别显著上调和下调; 0个tsrnas在f0-dep精子中显著改变。如图14所示,当对f1-ctl和f1-dep的精子中的 19个mirna进行评估时(在没有cvs刺激的基线条件下),未发现f1-dep精子中的mirna 有显著变化。这些结果与我们观察到的抑郁样性状不能从f1代传递到f2代是一致的。综上所述,上述结果表明,srnas确实对父亲的应激经历非常敏感,并且在暴露于压力后在精子中有差异表达。实施例7
103.由于mirnas在胚胎发育中有着广泛的调节作用,遗传的mirnas被假设为重塑后代向抑郁样表型的发展。因此,模拟f0-dep中16个最高表达精子mirnas的合成mirnas 子集或等量的乱序rna被注入正常受精卵(以相当于自然条件的水平注入mirnas),并评估ivf后代的抑郁样表型(mirna dep vs scrna ctl)如图12a-图12c所示,尽管在基线条件下,后代没有表现出行为改变,mirna-dep对cvs的抑郁样行为有更高的易感性。血浆中皮质醇水平也高于对照组。此外,如图12e-图12g所示,mirna-dep抑制相关脑区的神经元激活也被重塑为异常状态。如图12h、图12i所示,mirna-dep具有与f0-dep相似的神经电生理表型。如图12j所示,一部分再现抑郁信号的标记基因也在mirna-dep中异常表达,包括在pvn中crh的过度表达以及海马和mpfc中一些谷氨酸受体、突触可塑性基因和神经营养因子的下调。因此,mirna介导的表观遗传机制可能至少部分地促进了应激性抑郁脆弱性的代际传递。
104.为了研究抑郁遗传是否通过一组特定的mirnas介导,正常卵母细胞首先由来自 f0-dep或f0-ctl的精子受精,然后在受精卵期注射一组mirna反义链来阻断16个精子 mirna的增加,以中和遗传精子mirnas的影响,产生ivf后代(f1-dep 抗或f1-ctl 抗);对照组用f0-dep或f0-ctl的精子受精,然后注射加扰rna产生ivf后代(f1-dep scrrna 或f1-ctl scrrna)。如图15a、图15b所示,在基线条件下,这四组之间的行为表现没有差异。如图15d、图15e所示,暴露于cvs后,与f1-ctl scrrna相比,f1-dep scrrna 表现出相当多的抑郁样行为,而f1-dep anti表现出相对正常的行为表现,几乎与 f1-ctl scrrna中的表现相当。作为对照,与f1ctl scrrna相比,f1-ctl anti没有表现出抑郁样行为,这表明mirna反义链单独注射到受精卵中对后代表型没有明显影响。
105.同样,如图15f所示,f1-ctl anti和f1-ctl scrrna的血浆皮质酮水平相似,而 f1-dep anti中f1dep scrrna的高血浆皮质酮水平显著降低。而且,如图15g-图15j所示, f1-dep与f1ctl scrrna相比,ctl anti表现出正常的神经元激活和突触传递,与 f1-ctl scrrna相比,f1-dep scrrna的pvn、海马和mpfc的神经元激活和突触传递的畸变明显减弱,恢复到接近正常状态。再次验证mirna反义链能够抵消遗传性mirnas引发的抑郁样表型的脆弱性,将受精卵共注射mirna反义链和来自f0 dep的精子rna(rnadep anti)与来自f0 dep或f0 ctl的精子rna以及乱序rna(rna dep scrrna或rnactl scrrna)的后代进行比较,如图14a-图14l所示,这三组的后代在基线条件下有相似的行为反应。与rna-ctl scrrna相比,rna-dep scrrna表现出抑郁样行为的风险增加, rna-dep anti对cvs刺激下的抑郁样行为不敏感。因此,在rna-dep scrrna中,血浆皮质酮水平升高、异常神经元激活和突触传递恢复到正常状态。
106.我们进一步研究了精子srnas参与抑郁症遗传的机制。由于早期胚胎期代表了一个对成人表型非常重要的可塑性窗口,我们将来自f0-dep或f0-ctl的精子srnas注入受精卵,并评估胚胎发育到e3.5囊胚期时mirna的变化(srna-dep-e3.5 vs srna-ctl-e3.5)。在 f0-dep精子中16个高表达的mirna中,13个在srna-dep-e3.5胚胎中表现出1.5-4倍的增加。此外,当我们将16个mirnas的合成模拟物或等量的scrrna注入正常受精卵,并评估e3.5囊胚期的mirna变化(mirna-dep-e3.5 vs scrrna-ctl-e3.5),发现15个 mirna-dep-e3.5胚胎的mirna增加了2-6倍。为了研究mirnas增加对胚胎发育的潜在影响,我们通过单细胞转录组rna测序评估了srna-dep-e3.5和srna-ctl-e3.5中基因谱的变化。如图19a所示,共有264个(107个上调和157个下调)胚胎基因被鉴定为在 srna-dep-e3.5中差异表达(折叠变化》2和p《0.05)。对这些差异表达基因的go分析发现go簇的丰富,其功能紊乱常常导致神经精神异常,如突触信号、神经元分化和神经元发育,参见图19bhe tu 9。我们评估了这些差异表达的基因是否受到17个mirna集(16个上调mirna加下调mir-184)的潜在调控。在264个基因集中,总共有78个基因(1个上调,77个下调)有直接靶向的趋势,这一数字明显高于随机模拟获得的数量,参见图19c。通过文献挖掘,78个基因集中有许多基因与神经功能和病理生理(如突触可塑性、树突棘形成和神经生长)的调节有关。其中,app、tspan7、wnk3、ly6a、grin3a和app为代表,并对其进行了表征。转染人工mirna模拟物的胚胎干(es)细胞显示出这6种蛋白质的减少,荧光素酶报告分析证实了相应的mirnas直接与6个基因的3'非翻译区域(3'-utrs) 结合。从理论上讲,这些最初倾向于在胚胎早期进行微调和精确控制的神经元基因可能会被遗传的精子mirna不适当地破坏和重新编程。
107.与此假设相一致,在f1-dep与f1-ctl和srna-dep与srna-ctl的胚胎发育过程中观察到这些基因的异常表达。具体而言,虽然在f1-ctl胚胎中,app、tspan7、wnk3、ly6a 和grin3a的表达水平从4细胞期到桑椹胚期急剧增加,但在f1 dep胚胎中,这些基因的表达明显延迟。相反,当βcamkii在f1-ctl胚胎中的表达维持在基础水平时,其在f1-dep胚胎中的表达被显著诱导,参见图19d。一致地,srna-dep与srna-ctl的早期胚胎中的基因改变与f1-dep和f1-ctl的基因图谱相同,参见图19e。结果表明,精子srnas可能在胚胎发育早期的核心神经元回路中留下干扰印记。
108.实施例5-7的试验可以证明,mirnas对压力体验非常敏感,精子中mirnas的失调是抑郁症风险代际遗传的必要条件;反义链中和精子中异常的mirnas在很大程度上挽救了 f0-dep所生f1后代的获得性抑郁样表型;精子rrna衍生的小rna(rsrnas)都会因饮食而敏感地改变,并可能有助于代际遗传。实施例8
109.采用上述实施例的方法构建抑郁症小鼠,实验组1:30只抑郁症f0小鼠,实验组2: 25只抑郁症f1代小鼠:对比组:20只正常小鼠。其中,f1代小鼠的获得过程为:抑郁小鼠父本与正常小鼠母本所生的小鼠中,选择表现出抑郁症行为学的小鼠作为f1代小鼠。将实验组和对比组做以下处理:
110.a.提取总rna:收获细胞或组织,加入trizol试剂(invitrogen),按试剂说明书提取总rna,计算od260/od280以鉴定总rna浓度和纯度,理想的数值为od260/od280= 2.0。
111.b.逆转录反应:
112.反应体系为20μl,在0.2ml薄壁管中加入如下试剂:reverse transcription(5
×
buffer) 4μl、dntp mixture(10mm)1μl、rnase inhibitor 0.5μl、茎环引物1μl、u6 reverse primer 1μl、 rna 2μl、reverse transcriptase 1μl、rnase free h2o 9.5μl,加入上述试剂的薄壁管离心混匀后置于pcr仪,按如下程序进行反转录:16℃:15min,42℃:60min,85℃:5min,4℃: 5min
113.c.pcr:
114.qrt-pcr反应体系为20μl,在96孔pcr板中加入如下试剂:taq 0.3μl、cdna 1μl、 mgcl2 1.2μl、dntp mixture 1.6μl、10
×
pcr buffer 2μl、sybr green or taqman probe 1μl、forwardprimer 0.2μl、reverse primer 0.2μl、ddh2o 12.5μl,pcr反应条件为:预变性:95℃,15min;变性:95℃,15sec;退火、延伸:60℃,60sec。
115.d.数据处理方法为δδct法。ct设为反应达到域值时的循环数,计算mir-199a-3p 表达量,即将所提取的mirna中的mir-199a-3p相对于标准内参的表达量可以用方程2-δct 表示,其中δct=ct样品-ct内参。内参是u6 snrna分子,是一种100nt大小的管家基因。
116.在本实施例中,以基因u6为内参,经内参矫正后,正常小鼠中的mir-199a-3p相对于内参基因u6的含量为0.01,f0和f1所示的抑郁症小鼠中的mir-199a-3p含量为0.02。
117.经本实施例中的试验验证以及在其他试验中的大量试验研究显示,当小鼠精子中的 mir-199a-3p数量为正常小鼠中的2倍及以上时,其患抑郁症的几率在80%左右及以上。实施例9
118.为了进一步探究精子内mir-199a-3p是否直接介导抑郁症代际遗传现象的发生,合成了mir-199a-3p的反向互补序列(antisense),然后将该antisense加入到提取的抑郁症精子rna中,之后将该混合rna显微注射到正常受精卵内,注射方法:将浓度为2ng/μl的 mir-199a-3p注射至小鼠受精卵中,注射量为1pl(皮升)。最后将注射后的胚胎移植至正常代孕雌鼠子宫内繁殖子代。实验共分为3组:nc 正常精子mir-199a-3p(total-c nc)、 nc 抑郁症精子mir-199a-3p(total-d nc)和antisense 抑郁症精子mir-199a-3p (total-d anti),其中nc为等浓度等长无义单链rna序列。
119.分别在静息状态下和急性刺激后检测,发现三组rna注射子代小鼠强迫游泳静止时间、蔗糖消耗及蔗糖偏好等行为学指标无明显变化(急性刺激后total-d anti组相对于 total-d nc组显著升高)。之后,给予三组rna注射子代小鼠两周慢性刺激后再次检测行为学指标,发现相较于total-c nc注射组子代小鼠,total-d nc注射组子代小鼠强迫游泳静止时间显著增加,蔗糖消耗量显著减少,显示出了明显的抑郁样症状,这也与已有结果相符;更关键的是,total-d anti注射组子代小鼠在经过慢性刺激后相对于total-d nc注射组子代小鼠小鼠强迫游泳静止时间显著减少,蔗糖消耗量显著增加,且几乎回复至对照组 (total-c nc)水平。该实验说明加入mir-199a-3p antisense降低抑郁症精子rna中异常上调的mirna水平可显著回复抑郁症精子rna介导的代际遗传现象。实施例10
120.本实施例设置对照组和试验组,对照组和试验组均选择相同数量的8周龄c57bl/6j 小鼠。
121.对试验组的小鼠显微注射mir-199a-3p,注射方法:将浓度为2ng/μl的mir-103-3p 注射至小鼠受精卵中,注射量为1pl(皮升)。试验组小鼠与对照组小鼠其他饲养条件相同,分别对试验组小鼠和对照组小鼠进行强迫游泳试验、蔗糖偏好试验、血清皮质酮检测以及
抑郁症相关基因mrna表达水平检测。
122.强迫游泳试验具体为:将小鼠单独放置在一个垂直的有机玻璃圆筒(25厘米高,18 厘米直径),在25
±
1℃的温度下装有15厘米的水,并录像6分钟。通过视频分析(topview 动物行为分析系统;cleversys inc,reston,va)测量试验最后5分钟内的总漂浮时间(静止时间)。
123.结果如图20所示,可以看出,显微注射mir-199a-3p的试验组小鼠相对与对照组小鼠其漂浮时间更长,这说明注射了mir-199a-3p的试验组小鼠求生欲更低,具有抑郁症倾向。
124.蔗糖偏好试验具体为:单独安置每只小鼠,使其可以自由选择饮用1%蔗糖溶液或白开水(水和蔗糖瓶的左右位置在小鼠之间保持平衡)。习惯化3天后,记录24小时的水和蔗糖消耗量(12小时后更换水和蔗糖瓶位置,以控制位置偏好)。通过计算蔗糖摄入量占液体总摄入量的百分比确定小鼠的蔗糖偏好。
125.结果如图21所示,可以看出,显微注射mir-199a-3p的试验组小鼠相对于对照组小鼠其蔗糖消耗占比更少,这说明试验组小鼠出现快感缺失的现象,具有抑郁症倾向。
126.血清皮质酮检测具体为:在早上7:00-9:00之间,使用动物刺针,获取小鼠下颌下血样,血液样本收集到edta涂层的试管中,在4℃下以2000g速度离心20分钟后分离血浆,使用酶联免疫吸附试验(elisa)试剂盒(纽约恩佐生命科学公司)测量10μl血浆中的皮质酮,每个样品重复测量三次。
127.结果如图22所示,显微注射mir-199a-3p的试验组小鼠相对于对照组小鼠血清中皮质酮含量显著升高。
128.抑郁症相关基因mrna表达水平检测具体为:使用trizol试剂(加利福尼亚州卡尔斯巴德invitrogen)从组织和精子中分离出总rna。在mrna定量rt-pcr分析中,用amv 逆转录酶(中国大连takara)和oligo-dt引物(takara)将1μg总rna反转录成cdna。应用生物系统7300序列检测系统,用sybr-green-pcr试剂盒进行定量rt-pcr。基因表达分析采用
△△
ct法,相关基因表达标准化为β-actinmrna水平。每个样品重复测量三次。
129.结果如图23所示,显微注射mir-199a-3p的试验组小鼠相对于对照组小鼠pvn、海马、mpfc缰核等脑区的抑郁症相关基因表达水平较高。
130.由此可见,mir-199a-3p能够诱导小鼠抑郁,而抑制小鼠体内的mir-199a-3p自然也能够抑制小鼠的抑郁发展。实施例11
131.本实施例设置对照组和试验组,对照组和试验组每组均选择50只8周龄c57bl/6j 小鼠。
132.试验组的小鼠接受5周的慢性轻度应激试验,即让小鼠受到湿笼、剥夺食物、束缚、频闪照明时间(150次/min)、光-暗周期倒置、笼子倾斜(45
°
)和噪音(90-105db)的压力,所有压力在不同时间点进行施加,并且为避免习惯化,还需给压力增加不可预测的因素,建立慢性轻度应激(cms)诱导的抑郁小鼠模型。
133.对照组的小鼠在没有压力的情况下保持正常的饲养条件。
134.首先分别对试验组和对照组小鼠进行fst试验以及stp试验,得到实际患抑郁小鼠数量(行为学检测结果),再采用本技术提供的抑郁症检测产品(试剂盒)对各组小鼠进行抑
郁症情况检测,得到检测患抑郁小鼠数量(试剂盒检测结果),该试剂盒包括dntp/amv 逆转录酶、能够检测到本技术中mir-199a-3p的探针、缓冲液、mgcl2、depc水和taq酶;探针是由applied biosystems公司定制合成的taqman microrna探针;检测结果如表1所示。
135.表1各组小鼠抑郁检测结果示意表
136.由此可见,本技术提供的检测试剂盒对抑郁的检测结果与行为学检测结果匹配度达到了百分之七十以上,检测准确率高,开拓了抑郁症检测的新思路。
137.在本实施例中,根据目标序列进行设计探针为现有技术,故不再详述,此外,试剂盒的检测方法也是现有技术(与实施例8中的步骤类似),这里不再赘述。实施例12
138.本实施例设置对照组1-2和试验组1,对照组1-2和试验组1每组均选择50只8周龄c57bl/6j小鼠。
139.将对照组和试验组的小鼠接受5周的慢性轻度应激试验,即让小鼠受到湿笼、剥夺食物、束缚、频闪照明时间(150次/min)、光-暗周期倒置、笼子倾斜(45
°
)和噪音(90-105db) 的压力,所有压力在不同时间点进行施加,并且为避免习惯化,还需给压力增加不可预测的因素,建立慢性轻度应激(cms)诱导的抑郁小鼠模型。
140.各组小鼠以同样的饲养环境和饲养条件继续饲养四周,其中,对照组1-2及试验组1 小鼠的给药情况如表2所示:
141.表2各组小鼠给药情况示意表
142.上述表中,试验组1中所述的本技术提供的抗抑郁药物为mir-199a-3p的反向互补序列(antisense)。mg/kg中的mg指前述抗抑郁药物的质量,kg指小鼠的质量。
143.在给药饲养期间,对照组小鼠和试验组小鼠每周称重两次,结果显示,对照组1-2 的小鼠与试验组1的小鼠相比,体重显著减少。
144.在给药饲养期间,每周分别对对照组小鼠和试验组小鼠进行fst试验和spt试验,试验结果表明,对照组1的小鼠的fst静止时间在不断变长,蔗糖摄入量不断降低,对照组 2的小鼠在给药后,fst静止时间略微缩短,蔗糖摄入量略微降低,试验组1的小鼠在给药后,fst静止时间显著缩短,蔗糖摄入量显著升高。
145.在给药饲养期间,每周分别测量2次对照组小鼠和试验组小鼠的血浆皮质酮水平,试验结果表明,对照组1的小鼠的血浆皮质酮水平在不断升高,对照组2的小鼠在给药后,血浆皮质酮水平仅仅略微升高,试验组1的小鼠在给药后,血浆皮质酮水平有所降低。
146.所以本技术提供的抗抑郁药能够有效治疗抑郁症,相对于现有的抗抑郁药物,治
疗效果更为显著,且经济成本低,易于大规模推广和应用。
147.总而言之,上述试验揭示了由父亲压力引起的抑郁样表型可以通过精子中mirna特别是mir-199a-3p的因果作用被后代遗传。为了解抑郁症的表观遗传机制为开发新的抗抑郁药物提供了一个重要的维度。而本技术提供的精子中mir-199a-3p可以应用于抑郁症检测产品和抗抑郁药物中,有效提高抑郁症检测的精确度以及抗抑郁药物的治疗效果。
148.在本文中,“相等”、“相同”等并非严格的数学和/或几何学意义上的限制,还包含本领域技术人员可以理解的且制造或使用等允许的误差。
149.除非另有说明,本文中的数值范围不仅包括其两个端点内的整个范围,也包括含于其中的若干子范围。
150.上面结合附图对本技术优选的具体实施方式和实施例作了详细说明,但是本技术并不限于上述实施方式和实施例,在本领域技术人员所具备的知识范围内,还可以在不脱离本技术构思的前提下做出各种变化。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。