1.本发明涉及用基于铂的试剂和抗组织因子(抗tf)抗体-药物偶联物的组合治疗癌症(如膀胱癌和宫颈癌)的方法。
2.以ascii文本文件提交的序列表
3.下述以ascii文本文件提交的内容通过引用其全部内容纳入本文:计算机可读形式(crf)序列表(文件名:761682002840seqlist.txt,记录日期:2020年10月22日,大小:6kb)。
背景技术:
4.组织因子(tf),也称为促凝血酶原激酶、因子iii或cd142,是存在于内皮下组织、血小板和白细胞中的蛋白质,是从酶原凝血酶原开始形成凝血酶所必需的。凝血酶的形成最终导致血液凝结。tf使细胞能够启动凝血级联反应,并且其作为凝血因子viia(fviia)(一种丝氨酸蛋白酶)的高亲和力受体。所得的复合物提供催化事件,该催化事件负责通过特定的有限蛋白水解作用来启动凝血蛋白酶级联反应。与这些蛋白酶级联反应的作为无功能的前体进行循环的其他辅助因子不同,tf是一种高效的引发剂,当在细胞表面表达时,它是完全功能性的。
5.tf是丝氨酸蛋白酶因子viia(fviia)的细胞表面受体。fviia结合至tf开始细胞内的信号转导过程,所述信号转导功能在血管生成中起作用。血管生成是生长和发育以及伤口愈合中的正常过程,但它也是肿瘤从休眠状态转变为恶性状态的基本步骤。当癌细胞获得产生参与血管生成的蛋白质(即血管生成生长因子)的能力时,这些蛋白质被肿瘤释放到附近组织中,从而刺激新血管从现有的健康血管向着肿瘤萌发并进入肿瘤中。一旦新血管进入肿瘤,肿瘤就能迅速扩大其大小并侵入局部组织和器官。通过新血管,癌细胞可以进一步逃逸到循环系统中并在其他器官中停留而形成新的肿瘤,也称为转移瘤。
6.在包括宫颈癌在内的多种类型的癌症中观察到tf的表达,并且与更具侵略性的疾病相关。此外,人tf也以可溶的可变剪接形式ashtf存在。已经发现ashtf促进肿瘤生长(hobbs等,2007,thrombosis res.120(2):s13-s21)。
7.基于铂的试剂是烷基化剂,其共价结合至dna和交联dna链,导致抑制dna合成和功能并且抑制转录。数十年来,单药卡铂是复发性或转移性疾病的一线选择。在单药卡铂用于复发性或转移性子宫颈鳞状癌的2期试验中,总缓解率为15%(6/41),并且主要毒性作用包括恶心和呕吐(48%),贫血(47%),白细胞减少(38%)和血小板减少(22%)(weiss等.,1990,gynecol.oncol.39,332-336)。在顺铂加或不加紫杉醇的3期试验中评估了加用紫杉醇的情况,该试验证明ivb期、复发或持续性宫颈鳞状细胞癌患者的pfs明显改善;此外,组合方案的缓解率也大大提高。接受顺铂的对象的19%出现了客观缓解(objective response)(or)(6%完全客观缓解加13%部分客观缓解),而接受卡铂 紫杉醇的对象中36%出现了客观缓解(15%完全客观缓解加21%部分客观缓解)(p=.002)。顺铂对比卡铂
紫杉醇的中位pfs分别为2.8和4.8个月(p《.001)。数据截止时,中位生存期没有差异(8.8个月对比9.7个月)(moore等,2004)。虽然用顺铂观察到了功效提高,但该试剂的毒性概况比卡铂更差。已在多个试验(包括3期试验jcog050)中评估了这两种试剂的可互换性。该试验证明了顺铂和紫杉醇的组合相较于卡铂 紫杉醇相似的功效(中位oa分别为18.3个月对比17.5个月;hr 0.994(90%ci,0.79-1.25;p=.032),并被认为是ivb期、复发性或持续性宫颈癌患者的标准护理选择(kitagawa等,2015,j.clin.oncol.33,2129-2135)。
8.膀胱癌是一种危及生命的进展性疾病,其通常始于膀胱上皮衬里(即膀胱上皮)。浸润性膀胱癌可能扩散到淋巴结,骨盆的其他器官(导致肾脏和肠功能问题)或体内的其他器官,如肝和肺。膀胱癌的标准疗法是手术、放疗、化疗和生物疗法。膀胱癌是美国第五大最常见的癌症诊断。由于患者具有高复发和进展风险,从患者的一生中来看,膀胱癌是治疗最昂贵的癌症。尽管膀胱癌的发病率和流行率高,但是膀胱癌研究的资金却严重不足,导致膀胱癌治疗进展甚微。
9.宫颈癌在世界范围内构成了严重的医学问题,估计每年有超过500,000例新病例和250,000例死亡。参见tewari等,2014,n engl j med.,370:734-743。在欧盟,每年产生约34,000例宫颈癌新病例和13,000例死亡。参见hillemanns等,2016,oncol.res.treat.39:501-506。宫颈癌的主要类型是鳞状细胞癌和腺癌。16型和18型人乳头瘤病毒(hpv)的长期感染导致大多数的宫颈癌病例。宫颈癌一线疗法的标准是基于铂的疗法加上基于紫杉烷的疗法。贝伐单抗(bevacizumab)是一种抗vegf抗体,其经美国食品药品监督管理局(u.s.food and drug administration)批准与化疗组合用于治疗宫颈癌,并在临床试验中改善了总生存期。晚期宫颈癌的一线(1l)治疗包含贝伐单抗组合紫杉醇加上铂(例如,顺铂或卡铂)或紫杉醇加上拓扑替康(topotecan)。尽管客观缓解率(orr)为48%,中位总生存期(os)约为18个月,但不幸的是,几乎所有患者在接受该1l治疗后都复发了。参见tewari等,2014,n engl j med.,370:734-743。2018年,派姆单抗(pembrolizumab)(抗程序性死亡1抗体)在美国获得快速批准,用于程序性死亡配体1(pd-l1)阳性(组合阳性评分≥1%)的复发或转移宫颈癌(r/mcc)患者的2l 治疗。在这种情况下,派姆单抗的客观缓解率(orr)为14%,其中42%的患者先前接受过贝伐单抗治疗。参见默沙东公司(corp.msd.)(派姆单抗)注射用,静脉内使用。新泽西州怀特豪斯:默克公司(merck&co.,inc.);06/2018。入组研究的大多数患者具有鳞状组织学(92%)(同上),因此,对派姆单抗在具有非鳞状组织学的患者中的功效知之甚少。大多数二线(及以上)患有复发性或转移性宫颈癌的患者不能从派姆单抗治疗中获益。这些数据凸显了对更有效疗法的迫切需求,所述疗法能在更广泛的先前接受过伴或不伴贝伐单抗的双重化疗的r/mcc患者群中提供临床益处,且不受生物标志物表达的限制。对于二线(2l)治疗,患者通常采用单药方式治疗,包括但不限于:培美曲塞、拓扑替康、多西他赛、白蛋白结合型紫杉醇、长春瑞滨、以及在某些情况下使用的贝伐单抗。对单药治疗的荟萃分析(meta-analysis)显示,只有10.9%的中度缓解率(即552名患者中有60名缓解者),中位总生存期(os)约为7个月。参见例如,burotto等,2015,oncologist 20:725-726;candelaria等,2009,int.j.gynecol.cancer.19:1632-1637;coronel等,2009,med.oncol.26:210-214;fiorica等,2009,gynecol.oncol.115:285-289;garcia等,2007,am.j.clin.oncol.30-428-431;goncalves等,2008,gynecol.oncol.108:42-46;homesley等,2008,int.j.clin.oncol.13:
62-65;mclachlan等,2017,clin.oncol.(r.coll.radiol.)29:153-160;miller等,2008,gynecol.oncol.110:65-70;monk等,2009,j.clin.oncol.27:1069-1074;muggia等,2004,gynecol.oncol.92:639-643;rose等,2006,gynecol.oncol.102:210-213;santin等,2011,gynecol.oncol.122:495-500;schilder等,2005,gynecol.oncol.96:103-107;和torfs等,2012,eur.j.cancer.48:1332-1340.iv期宫颈癌的五年相对生存率仅为15%,这表明高度需要针对宫颈癌的改进疗法。
10.对于癌症治疗,特别是对于膀胱癌和宫颈癌治疗,仍然需要具有可接受的安全性概况和高功效的组合疗法。本发明满足了该需求,提供了用基于铂的试剂和抗组织因子(抗tf)抗体-药物偶联物的组合治疗癌症(如膀胱癌和宫颈癌)的方法。
11.本文引用的所有参考文献,包括专利申请、专利出版物和科技文献,均通过引用整体并入本文,就好像每个单独的参考文献均已明确地和单独地指出通过引用并入。
技术实现要素:
12.本文提供了一种治疗对象中癌症的方法,所述方法包括给予所述对象基于铂的试剂和结合至组织因子(tf)的抗体-药物偶联物,其中抗体-药物偶联物包含与单甲基奥瑞他汀或其功能性类似物或其功能性衍生物偶联的抗tf抗体或其抗原结合片段,其中抗体-药物偶联物以约0.5mg/kg至约2.1mg/kg范围内的剂量给予,其中所述抗体-药物偶联物连续三周约每1周给予一次,随后约1周休止期,其中不进行任何所述抗体-药物偶联物的给药,从而每周期时间为约28天,其中包括所述休止期。在一些实施方式中,抗体-药物偶联物以约0.65mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以0.65mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约0.7mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以0.7mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约0.8mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以0.8mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约0.9mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以0.9mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约1.0mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以1.0mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约1.1mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以1.1mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约1.2mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以1.2mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约1.3mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以1.3mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约1.4mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以1.4mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以约1.5mg/kg的剂量给予。在一些实施方式中,抗体-药物偶联物以1.5mg/kg的剂量给予。在本文的任何实施方式的一些中,所述抗体-药物偶联物连续3周每1周给予一次,随后1周的休止期,其中不进行任何所述抗体-药物偶联物的给药,从而每周期时间是28天,其中包括所述休止期。在本文的任何实施方式的一些中,抗体-药物偶联物在抗体-药物偶联物在约4周周期的约第1、8和15天给予。在本文的任何实施方式的一些中,抗体-药物偶联物在抗体-药物偶联物在4周周期的第1、8和15天给予。在本文的任何实施方式的一些中,所述基于铂的试剂以介于约auc=4和约auc=6之间的剂量给予。在本文的任何实施方式的一些中,其中所述基于铂的试剂
以约auc=5的剂量给予。在本文的任何实施方式的一些中,其中所述基于铂的试剂以auc=5的剂量给予。在本文的任何实施方式的一些中,基于铂的试剂约每1周给予一次、约每2周给予一次、约每3周给予一次或约每4周给予一次。在本文的任何实施方式的一些中,基于铂的试剂约每3周给予一次。在本文的任何实施方式的一些中,基于铂的试剂每3周给予一次。在本文的任何实施方式的一些中,基于铂的试剂在约21天周期的约第1天给予。在本文的任何实施方式的一些中,基于铂的试剂在约21天周期的第1天给予。在本文的任何实施方式的一些中,癌症是膀胱癌。在本文的任何实施方式的一些中,癌症是宫颈癌。在本文的任何实施方式的一些中,对象不是治愈性疗法的候选人。在本文的任何实施方式的一些中,治愈性疗法包括放疗和/或内脏切除手术。在本文的任何实施方式的一些中,对象未接受过针对宫颈癌的在先全身疗法。在本文的任何实施方式的一些中,宫颈癌是腺癌、腺鳞癌、鳞状细胞癌或非鳞状细胞癌。在本文的任何实施方式的一些中,宫颈癌是腺癌。在本文的任何实施方式的一些中,宫颈癌是腺鳞癌。在本文的任何实施方式的一些中,宫颈癌是鳞状细胞癌。在本文的任何实施方式的一些中,宫颈癌是非鳞状细胞癌。在本文的任何实施方式的一些中,宫颈癌是晚期宫颈癌。在本文的任何实施方式的一些中,晚期宫颈癌是3期或4期宫颈癌。在本文的任何实施方式的一些中,晚期宫颈癌是转移性宫颈癌。在本文的任何实施方式的一些中,宫颈癌是复发性宫颈癌。在本文的任何实施方式的一些中,单甲基奥瑞他汀是单甲基奥瑞他汀e(mmae)。在本文的任何实施方式的一些中,抗体-药物偶联物的抗tf抗体或其抗原结合片段是单克隆抗体或其单克隆抗原结合片段。在本文的任何实施方式的一些中,抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包括:
13.(i)cdr-h1,包含seq id no:1的氨基酸序列;
14.(ii)cdr-h2,包含seq id no:2的氨基酸序列;和
15.(iii)cdr-h3,包含seq id no:3的氨基酸序列;和
16.其中所述轻链可变区包括:
17.(i)cdr-l1,包含seq id no:4的氨基酸序列;
18.(ii)cdr-l2,包含seq id no:5的氨基酸序列;和
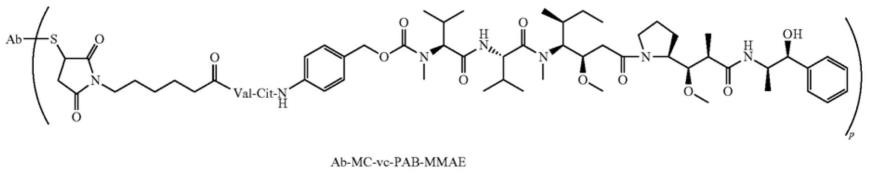
19.(iii)cdr-l3,包含seq id no:6的氨基酸序列,其中抗tf抗体或其抗原结合片段的cdr由imgt编号方案定义。在本文的任何实施方式的一些中,抗体-药物偶联物的抗tf抗体或其抗原结合片段包含重链可变区和轻链可变区,其中所述重链可变区包含与seq id no:7的氨基酸序列有至少85%同一性的氨基酸序列,所述轻链可变区包含与seq id no:8的氨基酸序列有至少85%同一性的氨基酸序列。在本文的任何实施方式的一些中,抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含seq id no:7的氨基酸序列,所述轻链可变区包含seq id no:8的氨基酸序列。在本文的任何实施方式的一些中,抗体-药物偶联物的抗tf抗体为替索土单抗或其生物类似物。在本文的任何实施方式的一些中,抗体-药物偶联物的抗tf抗体是替索土单抗(tisotumab)。在本文的任何实施方式的一些中,抗体-药物偶联物还包括抗tf抗体或其抗原结合片段与单甲基奥瑞他汀之间的接头。在本文的任何实施方式的一些中,接头是可裂解肽接头。在本文的任何实施方式的一些中,可裂解肽接头具有式:-mc-vc-pab-,其中:
20.a)mc是:
[0021][0022]
b)vc是二肽缬氨酸-瓜氨酸,并且
[0023]
c)pab是:
[0024][0025]
在本文的任何实施方式的一些中,接头被附接至抗tf抗体的巯基残基,其通过所述抗tf抗体或其抗原结合片段的部分还原或充分还原而获得。在本文的任何实施方式的一些中,接头被附接至mmae,其中抗体-药物偶联物具有如下结构:
[0026][0027]
其中,p表示1至8的数字,s代表所述抗tf抗体的巯基残基,并且ab指代所述抗tf抗体或其抗原结合片段。在本文的任何实施方式的一些中,抗体-药物偶联物群体中p的平均值为约4。在本文的任何实施方式的一些中,抗体-药物偶联物是替索土单抗维多汀(tisotumab vedotin)或其生物类似物。在本文的任何实施方式的一些中,抗体-药物偶联物是替索土单抗维多汀。在本文的任何实施方式的一些中,抗体-药物偶联物的给药途径是静脉内。在本文的任何实施方式的一些中,基于铂的试剂选自下组:卡铂、顺铂、奥沙利铂和奈达铂。在本文的任何实施方式的一些中,基于铂的试剂是卡铂。在本文的任何实施方式的一些中,基于铂的试剂是顺铂。在本文的任何实施方式的一些中,基于铂的试剂的给药途径是静脉内。在本文的任何实施方式的一些中,基于铂的试剂和抗体-药物偶联物依次给予。在本文的任何实施方式的一些中,基于铂的试剂和抗体-药物偶联物同时给予。在本文的任何实施方式的一些中,至少约0.1%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%的宫颈癌细胞表达tf。在本文的任何实施方式的一些中,对象中的一种或多种治疗效果在给予抗体-药物偶联物和基于铂的试剂后相对于基线得到改善。在本文的任何实施方式的一些中,一种或多种治疗效果选自下组:源自所述宫颈癌的肿瘤的大小、客观缓解率、缓解持续时间、达到缓解时间、无进展生存期和总生存期。在本文的任何实施方式的一些中,源自宫颈癌的肿瘤的大小相对于给予抗体-药物偶联物和基于铂的试剂之前的源自宫颈癌的肿瘤的大小减小至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约
70%或至少约80%。在本文的任何实施方式的一些中,客观缓解率为至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。在本文的任何实施方式的一些中,在给予抗体-药物偶联物和基于铂的试剂后,对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。在本文的任何实施方式的一些中,在给予抗体-药物偶联物和基于铂的试剂后,对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。在本文的任何实施方式的一些中,在给予抗体-药物偶联物和基于铂的试剂后,抗体-药物偶联物和基于铂的试剂所致的缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。在本文的任何实施方式的一些中,对象具有一个或多个不良事件,并且进一步接受其他治疗剂以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。在本文的任何实施方式的一些中,对象处于发展出一个或多个不良事件的风险,并且进一步接受其他治疗剂以预防一个或多个不良事件或降低一个或多个不良事件的严重程度。在本文的任何实施方式的一些中,一个或多个不良事件是出血、恶心、脱发、结膜炎、角膜炎、结膜溃疡、粘膜炎、便秘、食欲下降、腹泻、呕吐、中性粒细胞减少、发热性中性粒细胞减少、血小板计数减少或出血增加。在本文的任何实施方式的一些中,一个或多个不良事件是3级或更高级的不良事件。在本文的任何实施方式的一些中,一个或多个不良事件是严重的不良事件。在本文的任何实施方式的一些中,一个或多个不良事件是结膜炎、结膜溃疡和/或角膜炎,并且其他药剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂和/或类固醇滴眼剂。在本文的任何实施方式的一些中,对象是人。在本文的任何实施方式的一些中,抗体-药物偶联物在包含所述抗体-药物偶联物和药学上可接受的运载体的药物组合物中。在本文的任何实施方式的一些中,基于铂的试剂在包含基于铂的试剂和药学上可接受的运载体的药物组合物中。
[0028]
本文还提供了试剂盒,其包括:
[0029]
(a)剂量范围为约auc=4至约auc=6的基于铂的试剂;
[0030]
(b)剂量范围为约5mg至约200mg的结合至组织因子(tf)的抗体-药物偶联物,其中抗体-药物偶联物包含偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段;和
[0031]
(c)说明书,以根据本文的任何实施方式的一些使用基于铂的试剂和抗体药物偶联物。在一些实施方式中,基于铂的试剂是卡铂。在本文的任何实施方式的一些中,抗体-药物偶联物是替索土单抗维多汀或其生物类似物。在本文的任何实施方式的一些中,抗体-药物偶联物是替索土单抗维多汀。
附图说明
[0032]
图1a-e是显示宫颈癌异种移植小鼠模型中替索土单抗维多汀和顺铂的组合抗肿
瘤活性的一系列图表。a)用4mg/kg igg1对照(空心黑色圆形)、4mg/kg igg1-mmae对照(实心黑色圆形)、4mg/kg顺铂(空心黑色方形)、2mg/kg替索土单抗维多汀(实心黑色方形)或2mg/kg替索土单抗维多汀组合4mg/kg顺铂(空心黑色三角)治疗后,小鼠中的平均肿瘤大小。倒黑色箭头指示给予替索土单抗维多汀剂量的日期。倒黑色实心三角形指示给予顺铂剂量的日期。通过卡尺测量来评估肿瘤负荷。误差线指示平均值的标准误差。*表明替索土单抗维多汀 顺铂治疗相对于单药治疗p《0.05。b)用4mg/kg igg1对照(空心黑色圆形)、4mg/kg igg1-mmae对照(实心黑色圆形)、4mg/kg顺铂(空心黑色方形)、4mg/kg替索土单抗维多汀(实心黑色方形)或4mg/kg替索土单抗维多汀组合4mg/kg顺铂(空心黑色三角)治疗后,小鼠中的平均肿瘤大小。倒黑色箭头指示给予替索土单抗维多汀剂量的日期。倒黑色三角形指示给予顺铂剂量的日期。通过卡尺测量来评估肿瘤负荷。误差线指示平均值的标准误差。*表明替索土单抗维多汀 顺铂治疗相对于单药治疗p《0.05。c)用4mg/kg igg1对照(组01)、4mg/kg igg1-mmae对照(组02)、4mg/kg替索土单抗维多汀(组03)、2mg/kg替索土单抗维多汀(组04)、1mg/kg替索土单抗维多汀(组05)、0.5mg/kg替索土单抗维多汀(组06)、4mg/kg顺铂(组07)、4mg/kg替索土单抗维多汀组合4mg/kg顺铂(组08)、2mg/kg替索土单抗维多汀组合4mg/kg顺铂(组09)、1mg/kg替索土单抗维多汀组合4mg/kg顺铂(组10)或0.5mg/kg替索土单抗维多汀组合4mg/kg顺铂(组11)治疗后第38天,小鼠中的平均肿瘤大小。d)用4mg/kg igg1-mmae对照(组02)、仅4mg/kg替索土单抗维多汀(组03)、4mg/kg替索土单抗维多汀组合4mg/kg顺铂(组08)或仅4mg/kg顺铂(组07)治疗的小鼠中的无肿瘤生存百分比,其中肿瘤大小截止为1000mm3。e)用4mg/kg igg1-mmae对照(组02)、仅2mg/kg替索土单抗维多汀(组04)、2mg/kg替索土单抗维多汀组合4mg/kg顺铂(组09)或仅4mg/kg顺铂(组07)治疗的小鼠中的无肿瘤生存百分比,其中肿瘤大小截止为1000mm3。
[0033]
图2a-d是显示膀胱癌小鼠模型中替索土单抗维多汀和顺铂的组合抗肿瘤活性的图表。a)用igg1-mmae对照(实心黑色圆形)、顺铂(空心黑色方形)、替索土单抗维多汀(实心黑色方形)或替索土单抗维多汀组合顺铂(空心黑色三角形)治疗后,小鼠中的平均肿瘤大小。倒黑色箭头指示给予替索土单抗维多汀剂量的日期。倒黑色实心三角形指示给予顺铂剂量的日期。通过卡尺测量来评估肿瘤负荷。误差线指示平均值的标准误差。b)igg1-mmae对照、替索土单抗维多汀、顺铂或替索土单抗维多汀组合顺铂治疗后第25天,小鼠中的平均肿瘤大小。c)用替索土单抗维多汀或替索土单抗维多汀组合顺铂治疗后第32天,小鼠中的平均肿瘤大小。d)用igg1-mmae对照、仅替索土单抗维多汀、仅顺铂、替索土单抗维多汀组合顺铂治疗的小鼠中的无肿瘤生存百分比,其中肿瘤大小截止为500mm3。
[0034]
图3a-c是显示宫颈癌小鼠模型中替索土单抗维多汀和顺铂的组合抗肿瘤活性的图表。a)用2mg/kg igg1对照(空心圆形)、2mg/kg igg1-mmae对照(实心圆形)、2mg/kg替索土单抗维多汀(实心方形)、40mg/kg卡铂(空心方形)、80mg/kg卡铂(空心菱形)、2mg/kg替索土单抗维多汀组合40mg/kg卡铂(空心三角形)或2mg/kg替索土单抗维多汀组合80mg/kg卡铂(实心三角形)治疗后,小鼠中的平均肿瘤大小。箭头指示治疗的日期。通过卡尺测量来评估肿瘤负荷。误差线指示平均值的标准误差。b)用2mg/kg igg1对照(空心圆形)、2mg/kg igg1-mmae对照(实心圆形)、2mg/kg替索土单抗维多汀(实心方形)、40mg/kg卡铂(空心方形)、80mg/kg卡铂(空心菱形)、2mg/kg替索土单抗维多汀组合40mg/kg卡铂(空心三角形)或2mg/kg替索土单抗维多汀组合80mg/kg卡铂(实心三角形)治疗后20天时,小鼠中的平均肿
瘤大小。c)用2mg/kg igg1对照(空心圆形)、2mg/kg igg1-mmae对照(实心圆形)、2mg/kg替索土单抗维多汀(实心方形)、40mg/kg卡铂(空心方形)、80mg/kg卡铂(空心菱形)、2mg/kg替索土单抗维多汀组合40mg/kg卡铂(空心三角形)或2mg/kg替索土单抗维多汀组合80mg/kg卡铂(实心三角形)治疗的小鼠中的无进展生存百分比,其中肿瘤大小截止为750mm3。
[0035]
图4a-b是显示宫颈癌异种移植小鼠模型中替索土单抗维多汀和顺铂的组合抗肿瘤活性的图表。a)用2mg/kg igg1对照(浅灰色圆形)、2mg/kg igg1-mmae对照(灰色方形)、2mg/kg替索土单抗维多汀(浅灰色三角形)、40mg/kg卡铂(深灰色三角形)或2mg/kg替索土单抗维多汀组合40mg/kg卡铂(黑色圆形)治疗后,小鼠中的平均肿瘤体积。箭头指示治疗的日期。通过卡尺测量来评估肿瘤负荷。误差线指示平均值的标准误差。b)用2mg/kg igg1对照、2mg/kg igg1-mmae对照、2mg/kg替索土单抗维多汀、40mg/kg卡铂或2mg/kg替索土单抗维多汀组合40mg/kg卡铂治疗的小鼠中的无进展生存百分比,其中肿瘤大小截止为1,000m3。
[0036]
发明详述
[0037]
i.定义
[0038]
为了可以更好地理解本发明,首先定义某些术语。如本技术所用,除本文另有描述外,以下每个术语应具有如下含义。在整个申请中描述了额外定义。
[0039]
本文所用术语“和/或”应被视作具体公开了两种特征或组分的每一种,伴随或不伴随另一种。因此,在例如本文的短语“a和/或b”中使用的术语“和/或”旨在包括“a和b”、“a或b”、“a”(单独)、和“b”(单独)。类似地,在例如“a、b和/或c”的短语中使用的术语“和/或”旨在涵盖以下方面中的每一种:a、b、和c;a、b、或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);和c(单独)。
[0040]
应理解,本文描述的本发明的方面和实施方式包括“包含”,“组成”和“基本上由......组成”方面和实施方式。
[0041]
除非另有定义,本文使用的所有科技术语与本公开所属领域普通技术人员所理解的通常含义相同。例如,《生物医药和分子生物学简明词典》(concise dictionary of biomedicine and molecular biology),juo,pei-show,第2版,2002,crc出版社(crc press);《细胞和分子生物学词典》(the dictionary of cell and molecular biology),第3版,1999,学术出版社(academic press);和《牛津生物化学和分子生物学辞典》(oxford dictionary of biochemistry and molecular biology),修订,2000,牛津大学出版社(oxford university press),向技术人员提供了本公开使用的很多术语的常用词典。
[0042]
单位、前缀和符号以它们的国际单位制(si)接受的形式表示。数值范围包括限定该范围的数值。本文提供的标题不是本公开各种方面的限制,可以参考说明书整体理解本公开的各种方面或实施方式。因此,下面紧接着定义的术语完全参考说明书全文定义。
[0043]
术语“组织因子”、“tf”、“cd142”、“组织因子抗原”、“tf抗原”和“cd142抗原”在本文中可互换使用,并且除非另有说明,否则包括细胞天然表达或在用组织因子基因转染的细胞上表达的人组织因子的任何变体、同种型和物种同源物。在一些实施方式中,组织因子包含genbank登录号np_001984中存在的氨基酸序列。
[0044]
术语"免疫球蛋白"表示这样的一类结构相关的糖蛋白,其由两对多肽链组成:一对轻(l)低分子量链和一对重(h)链,所有四条链通过二硫键相互连接。免疫球蛋白的结构
已经被充分表征。参见例如《基础免疫学》(fundamental immunology)第7章(paul,w.,编,第2版,瑞文出版社(raven press),纽约(1989))。简言之,各重链通常包含重链可变区(本文中缩写为vh或vh)和重链恒定区(ch或ch)。重链恒定区通常包含三个结构域ch1、ch2和ch3。重链在所谓的“铰链区”中通常通过二硫键相互连接。各轻链通常包含轻链可变区(本文中缩写为v
l
或vl)和轻链恒定区(c
l
或cl)。轻链恒定区通常包含一个结构域c
l
。cl可以是κ(kappa)或λ(lambda)同种型。术语“恒定结构域”和“恒定区”在本文中可互换使用。除非另外说明,恒定区中氨基酸残基的编号按照eu索引,如kabat等.,《热门免疫学蛋白质序列》(sequences of proteins of immunological interest),第5版,美国国立卫生研究院公共卫生局,马里兰州贝塞斯达(1991)中所述。免疫球蛋白可以源自任何常规已知的同种型,包括但不限于iga、分泌型iga、igg和igm。igg亚类也是本领域技术人员众所周知的,包括但不限于人igg1、igg2、igg3和igg4。“同种型”是指由重链恒定区基因编码的抗体类别或亚类(如igm或igg1)。
[0045]
术语“可变区”或“可变结构域”指涉及抗体与抗原结合的抗体重链或轻链结构域。天然抗体的重链和轻链的可变区(分别为vh和v
l
)可进一步细分为超变区(regions of hypervariability)(或高变区(hypervariable regions),其在序列中和/或结构定义的环形式中可以是高变的),也称为互补决定区(cdr),其间插更保守的区域,称为框架区(fr)。与“高变区”或“hvr”同义的术语“互补决定区”和“cdr”为本领域已知,指抗体可变区内氨基酸的非连续序列,其赋予抗原特异性和/或结合亲和力。通常,各重链可变区存在三个cdr(cdr-h1、cdr-h2、cdr-h3),并且各轻链可变区存在三个cdr(cdr-l1、cdr-l2、cdr-l3)。“框架区”和“fr”为本领域已知,指代重链和轻链可变区的非cdr部分。通常,各全长重链可变区存在四个fr(fr-h1、fr-h2、fr-h3和fr-h4),并且各全长轻链可变区存在四个fr(fr-l1、fr-l2、fr-l3和fr-l4)。各vh和v
l
内,三个cdr和四个fr通常从氨基端到羧基端按照以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4(还参见chothia和lesk j.mot.biol.,195,901-917(1987))。
[0046]
在本发明的上下文中,术语“抗体”(ab)是指免疫球蛋白分子、免疫球蛋白分子的片段或其任一种的衍生物,其具有在典型的生理条件下与抗原特异性结合的能力,其半衰期的时间很长,例如至少约30分钟、至少约45分钟、至少约1小时(h)、至少约2小时、至少约4小时、至少约8小时、至少约12小时(h)、约24小时或更多、约48小时或更多、约3、4、5、6、7或更多天等、或任何其他相关的功能性定义的时间段(如足以诱发、促进、增强和/或调节与抗体结合至抗原相关联的生理反应的时间和/或足以使抗体招募效应物活性的时间)。免疫球蛋白分子的重链和轻链的可变区包含与抗原相互作用的结合结构域。抗体(ab)的恒定区可以介导免疫球蛋白结合至宿主组织或因子,包括免疫系统的各种细胞(如效应细胞)和补体系统的成分(如c1q),这是补体激活的经典途径中的第一成分。抗体可以是双特异性抗体、双抗体、多特异性抗体或相似分子。
[0047]
本文所用术语“单克隆抗体”指用单个一级氨基酸序列重组产生的抗体分子的制品。单克隆抗体组合物针对特定表位显示单一的结合特异性和亲和性。因此,术语“人单克隆抗体”指表现出单一结合特异性的抗体,其具有衍生自人种系免疫球蛋白序列的可变区和恒定区。人单克隆抗体可以通过杂交瘤产生,所述杂交瘤包括b细胞,所述b细胞获得自具有包含人重链转基因和轻链转基因的基因组的转基因或转染色体非人动物(如转基因小
鼠),与永生化细胞融合。
[0048]“分离的抗体”是指基本上不含具有不同抗原特异性的其他抗体的抗体(例如与tf特异性结合的分离的抗体基本上不含与tf以外的抗原特异性结合的抗体)。但是,与tf特异性结合的分离抗体可以具有与其他抗原(例如来自不同物种的tf分子)的交叉反应性。另外,分离的抗体可以基本不含其他细胞物质和/或化学物质。在一个实施方式中,分离的抗体包括附接至另一试剂(例如,小分子药物)的抗体偶联物。在一些实施方式中,分离的抗tf抗体包括抗tf抗体和小分子药物(例如,mmae或mmaf)的偶联物。
[0049]“人抗体”(humab)是指可变区中fr和cdr均源自人种系免疫球蛋白序列的抗体。此外,如果抗体包含恒定区,则该恒定区也源自人种系免疫球蛋白序列。本公开的人抗体可包括并非由人种系免疫球蛋白序列编码的氨基酸残基(例如由体外随机或位点特异性诱变或体内体细胞突变引入的突变)。然而,本文所用术语“人抗体”不旨在包括这样的抗体,其中源自另一种哺乳动物物种(如小鼠)的种系的cdr序列已被嫁接到人框架序列上。术语“人抗体”和“完全人抗体”是同义使用的。
[0050]
本文所用术语“人源化抗体”指遗传工程改造的非人抗体,其包含人抗体恒定结构域和经修饰以包含与人可变结构域具有高水平序列同源性的非人可变结构域。这可以通过将6个非人抗体互补决定区(cdr)(它们一起形成抗原结合位点)移植到同源人受体框架区(fr)上来实现(参见wo92/22653和ep0629240)。为了完全重建亲本抗体的结合亲和力和特异性,可能需要将来自亲本抗体(即非人抗体)的框架残基替换为人框架区(回复突变)。结构同源性建模可以帮助鉴定框架区中对于抗体的结合特性重要的氨基酸残基。因此,人源化抗体可以包含非人cdr序列,主要是人框架区,任选地包含向非人氨基酸序列的一个或多个氨基酸回复突变,以及完全人恒定区。任选地,可以应用其他氨基酸修饰(不一定是回复突变)以获得具有优选特性(如亲和力和生化特性)的人源化抗体。
[0051]
本文所用术语“嵌合抗体”指这样的抗体,其中可变区衍生自非人类物种(例如,衍生自啮齿动物)并且恒定区衍生自不同物种,如人类。嵌合抗体可以通过抗体工程改造产生。“抗体工程改造”是针对不同种类的抗体修饰的通用术语,并且是本领域技术人员所熟知的方法。具体地,通过使用如sambrook等,1989,《分子克隆:实验室手册》(molecular cloning:alaboratory manual),纽约:冷泉港实验室出版社,第15章中所述的标准dna技术可以生成嵌合抗体。因此,嵌合抗体可以是遗传或酶工程改造的重组抗体。产生嵌合抗体在本领域技术人员的知识范畴内,并且因此,可以通过除本文所述之外的其他方法产生根据本发明的嵌合抗体。开发了用于治疗应用的嵌合单克隆抗体以降低抗体免疫原性。它们通常包含对感兴趣的抗原具有特异性的非人(例如,鼠)可变区,和人恒定抗体重链和轻链结构域。在嵌合抗体的上下文中使用的术语“可变区”或“可变结构域”指包含免疫球蛋白重链和轻链二者的cdr和框架区的区域。
[0052]“抗抗原抗体”指结合至抗原的抗体。例如,抗tf抗体是结合至抗原tf的抗体。
[0053]
抗体的“抗原结合部分”或“抗原结合片段”是指抗体的一个或多个片段,其保特异性留结合至被该完整抗体结合的抗原的能力。抗体片段(如抗原结合片段)的示例包括但不限于fv、fab、fab'、fab'-sh、f(ab')2;双抗体;线性抗体;单链抗体分子(如scfv);和由抗体片段形成的多特异性抗体。木瓜蛋白酶消化抗体会产生两个相同的抗原结合片段,称为“fab”片段,每个片段都有一个抗原结合位点以及一个残留的“fc”片段,其名称反映了其易
于结晶的能力。胃蛋白酶处理产生f(ab’)2片段,其具有两个抗原结合位点,并且仍然能够交联抗原。
[0054]
相对于参比肽序列的“序列同一性百分数(%)”定义为:比对序列并引入缺口(如果需要)以实现最大序列同一性百分比之后,候选序列中与参比多肽序列中氨基酸残基相同的氨基酸残基的百分比,并且不考虑将任何保守性取代作为部分序列同一性。以测定氨基酸序列同一性百分率为目的比对可以本领域技术范围内的不同方式实现,例如,使用公共渠道可获得的计算机软件如blast、blast-2、align或megalign(dnastar)软件。本领域技术人员能够确定用于比对序列的合适参数,包括使比较的序列实现全长最大对齐所需的任何算法。例如,给定氨基酸序列a与、和或针对给定氨基酸序列b的序列同一性%(也可以替代地表述为与、和或针对给定氨基酸序列b具有或包含特定序列同一性%的给定氨基酸序列a)如下所示计算:
[0055]
分数x/y的100倍
[0056]
其中x是在该程序的a和b的比对中记为被序列等同匹配的氨基酸残基的数量,并且其中y是b中氨基酸残基的总数。应当理解的是,当氨基酸序列a的长度不等于氨基酸序列b的长度的情况下,a与b的序列同一性%将不等于b与a的序列同一性%。
[0057]
在抗体与预定抗原结合的上下文中,本文所用术语“结合”、“接合”或“特异性结合”通常是在通过例如生物层干扰量度法(bli)技术于octet htx仪器中使用抗体作为配体并使用抗原作为分析物确定时这样的结合,所述结合的亲和力对应于约10-6
m或更小,例如,10-7
m或更小,如约10-8
m或更小,如约10-9
m或更小,约10-10
m或更小,或约10-11
m或更小的kd,并且其中抗体结合预定抗原的亲和力对应这样的kd,所述kd比抗体与除了预定抗原或密切相关的抗原外的非特异性抗原(例如,bsa、酪蛋白)结合的kd低至少十倍,如低至少100倍,例如低至少1,000倍,如低至少10,000倍、例如低至少100,000倍。结合的kd较低的量取决于抗体的kd,因此,当抗体的kd非常低时,与抗原结合的kd低于与非特异性抗原结合的kd的量可以是至少10,000倍(也就是抗体具有高度特异性)。
[0058]
本文所用术语“k
d”(m)是指特定抗体-抗原相互作用的解离平衡常数。如本文所用,亲和力与kd成反比,也就是较高的亲和力旨在表示较低的kd,而较低的亲和力旨在表示较高的kd。
[0059]
术语“adc”是指抗体-药物偶联物,其在本发明的上下文中指与本技术中所述的药物部分(例如,mmae或mmaf)偶联的抗tf抗体。
[0060]
缩写“vc”和“val-cit”是指二肽缬氨酸-瓜氨酸。
[0061]
缩写“pab”是指自毁型间隔物(self-immolative spacer):
[0062][0063]
缩写“mc”是指延伸体(stretcher)马来酰亚胺基己酰基:
[0064]
[0065]
术语“ab-mc-vc-pab-mmae”是指通过mc-vc-pab接头与药物mmae偶联的抗体。
[0066]“基于铂的试剂”指这样的分子或包含分子的组合物,其含有包含化学元素铂并且可用作化疗药物的配位化合物。基于铂的试剂通常通过抑制dna合成起作用,并且有些具有烷基化活性。基于铂的试剂包括当前正用作化疗方案部分的那些药物,当前正在开发的药物和可能在将来开发的药物。
[0067]“癌症”指一大组各种各样的疾病,其特征是体内异常细胞的不受控制的生长。“癌症”或“癌组织”可包括肿瘤。不受控制的细胞分裂和生长导致恶性肿瘤的形成,其侵入相邻组织,并且还可以通过淋巴系统或血流转移到身体的远端。转移后,远端肿瘤可以说是“源自”转移前肿瘤。例如,“肿瘤源自”宫颈癌是指作为转移的宫颈癌的结果的肿瘤。
[0068]
对象的“治疗”或“疗法”是指对对象实施的任何类型的干预或过程,或向对象给予活性剂,其目的是逆转、减轻、改善、抑制、减慢或预防与疾病相关的症状、并发症、病症或生化指标的发作、进展、发展、严重程度或复发。在一些实施方式中,所述疾病是癌。
[0069]“对象”包括任何人或非人动物。术语“非人动物”包括但不限于脊椎动物,例如非人灵长类动物、绵羊、狗、以及啮齿动物如小鼠、大鼠和豚鼠。在一些实施方式中,对象是人。术语“对象”和“患者”和“个体”在本文中可互换使用。
[0070]“有效量”或“治疗有效量”或“治疗有效剂量”的药物或治疗剂是任何量的药物,当单独使用或与另一治疗剂组合使用时保护对象免于疾病的发作或促进疾病消退,其由疾病症状的严重程度的降低、无疾病症状时期的频率和持续时间的增加、或者由于疾病的折磨而造成的障碍或残疾的预防来证明。可以使用本领域技术人员已知的多种方法来评价治疗剂促进疾病消退的能力,例如在临床试验期间的人对象中,在预测人中的功效的动物模型系统中,或者通过在体外试验中测定该药剂的活性。
[0071]
例如,对于肿瘤的治疗,相对于未治疗的对象(例如,一个或多个未治疗的对象),治疗有效量的抗癌剂在经治疗的对象(例如,一个或多个经治疗的对象)中抑制至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%或至少约80%、至少约90%、至少约95%、至少约96%、至少约98%、至少约99%的细胞生长或肿瘤生长。在一些实施方式中,相对于未治疗的对象(例如,一个或多个未治疗的对象),治疗有效量的抗癌剂在经治疗的对象(例如,一个或多个经治疗的对象)中抑制100%的细胞生长或肿瘤生长。
[0072]
在本公开的其他实施方式中,可以观察到肿瘤消退并且持续至少约20天、至少约30天、至少约40天、至少约50天或至少约60天的时间。尽管对治疗有效性进行了这些最终测量,但免疫治疗药物的评价也必须考虑“免疫相关缓解模式”。
[0073]
治疗有效量的药物(例如,抗tf抗体-药物偶联物或基于铂的试剂)包括“预防有效量”,其是当单独或与抗癌剂组合给予处于发展出癌症的风险(如患有恶变前病症的对象)或经受癌症复发折磨的对象时,抑制癌症发展或复发的药物的任何量。在一些实施方式中,预防有效量完全防止癌症的发展或复发。“抑制”癌症的发展或复发是指降低癌症发展或复发的可能性,或者完全防止癌症的发展或复发。
[0074]
如本文所用,“亚治疗剂量”是这样的治疗化合物(例如,抗tf抗体-药物偶联物或基于铂的试剂)剂量,其低于单独给药以治疗过度增生性疾病(例如,癌症)时治疗化合物的常规或典型剂量。
[0075]
"免疫相关缓解模式"指在经免疫治疗剂治疗的癌症患者中常常观察到的临床缓解模式,其通过诱导癌症特异性免疫反应或通过修饰天然免疫过程来产生抗肿瘤作用。该缓解模式的特征是最初增加肿瘤负荷或出现新病灶后的有益的治疗作用,在评估传统化学治疗剂时,其将被分类为疾病进展并将与药物失败同义。因此,正确评估免疫治疗剂可能需要长期监测这些治疗剂对靶疾病的作用。
[0076]
举例来说,“抗癌剂”促进对象中的癌症消退。在一些实施方式中,治疗有效量的药物促进癌症消退至消除癌症的点。“促进癌症消退”是指单独或与抗癌剂组合给予有效量的药物可导致肿瘤生长或大小的减少、肿瘤坏死、至少一种疾病症状的严重程度降低、无疾病症状时期的频率和持续时间增加、或预防由于疾病的折磨而造成的障碍或残疾。此外,关于治疗的术语“有效”和“有效性”包括药理有效性和生理安全性。药理有效性是指药物促进患者中的癌症消退的能力。生理安全性是指由给药引起的细胞、器官和/或生物体水平上的毒性或其他不良生理反应(不良反应)。
[0077]“持续缓解”是指在停止治疗后在减少肿瘤生长方面的持续作用。例如,与给药阶段开始时的大小相比,肿瘤大小可以保持相同或较小。在一些实施方式中,持续缓解的持续时间与治疗持续时间至少相同,或者比治疗持续时间长至少1.5、2.0、2.5或3倍。
[0078]
如本文所用,“完全缓解”或“cr”是指所有目标病灶消失;“部分缓解”或“pr”是指以基线sld为参比,目标病灶的最长直径之和(sld)至少减小30%;“稳定的疾病”或“sd”是指以自治疗开始以来最小的sld为参比,目标病灶既未充分缩小以符合pr标准,又未充分增加以符合pd标准。
[0079]
如本文所用,“无进展生存期”或“pfs”是指在治疗期间和之后的时间长度,在此期间所治疗的疾病(如癌症)不会恶化。无进展生存期可以包括患者经历完全缓解或部分缓解的时间,以及患者经历稳定的疾病的时间。
[0080]
如本文所用,“总缓解率”或“orr”是指完全缓解(cr)率和部分缓解(pr)率之和。
[0081]
如本文所用,“总生存率”或“os”是指一组个体中在特定时间段后可能存活的个体百分比。
[0082]
本文所指术语“基于体重的剂量”是指基于对象的体重来计算向对象给予的剂量。例如,当体重为60kg的对象需要2.0mg/kg的基于铂的试剂或抗tf抗体-药物偶联物时,可以计算并使用适当量的基于铂的药剂或抗tf抗体-药物偶联物(即120mg)给予所述对象。
[0083]
关于本公开的方法和剂量使用的术语“平剂量”是指不考虑对象的体重或体表面积(bsa)而给予对象的剂量。因此,平剂量不是以mg/kg剂量的形式给出,而是以药剂(如抗tf抗体-药物偶联物和/或基于铂的药剂)的绝对量的形式给出。例如,体重为60kg的对象和体重为100kg的对象将接受相同剂量的抗体或抗体-药物偶联物(例如,240mg抗tf抗体-药物偶联物或例如,750mg基于铂的药剂)。
[0084]
短语“药学上可接受的”表示物质或组合物必须在化学和/或毒理学上与包含在制剂中的其他成分和/或与用其治疗的哺乳动物相容。
[0085]
本文所用短语“药学上可接受的盐”是指本发明化合物的药学上可接受的有机或无机盐。示例性的盐包括但不限于:硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸性磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸性柠檬酸盐、酒石酸盐、油酸盐、单宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆
酸盐、富马酸盐、葡萄糖酸盐、葡糖醛酸盐、蔗糖盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐、扑酸盐(即4.4
’‑
亚甲基-双(2-羟基-3-萘甲酸盐)、碱金属(如钠和钾)盐、碱土金属(如镁)盐和铵盐。药学上可接受的盐可涉及包括另一种分子,例如乙酸根离子、琥珀酸根离子或其他抗衡离子。该抗衡离子可以是任何能稳定亲本化合物上电荷的有机或无机部分。此外,药学上可接受的盐可以在其结构中具有超过一个的带电原子。药学上可接受的盐含多个带电原子的情况下可具有多个抗衡离子。因此,药学上可接受的盐可具有一个或多个带电原子和/或一个或多个抗衡离子。
[0086]“给药”或“给予”是指使用本领域技术人员已知的各种方法和递送系统中的任一种将治疗剂物理引入对象。抗tf抗体-药物偶联物和/或基于铂的试剂的示例性给药途径包括静脉内、肌肉内、皮下、腹膜内、脊髓或其他胃肠外给药途径,例如通过注射或输注(如静脉内输注)。本文所用短语“胃肠外给药”是指除肠道和局部给药外的给药形式,通常通过注射,包括但不限于静脉内、肌肉内、动脉内、鞘内、淋巴管内、病灶内、囊内、眼内、心脏内、皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下(subcapsular)、蛛网膜下、脊柱内、硬膜外和胸骨内注射和输注、以及体内电穿孔。可以通过非胃肠外途径或口服给予治疗剂。其他非胃肠外途径包括局部、表皮或粘膜给药途径,例如鼻内、阴道、直肠、舌下或局部给药。也可以例如一次、多次和/或在一个或多个延长的时期内进行给药。
[0087]
本文中可互换使用的术语“基线”或“基线值”可以指在给予治疗(例如,本文所述抗tf抗体-药物偶联物和/或本文所述基于铂的试剂)之前或在开始给予治疗时的症状的测量或表征。可以将基线值与参比值进行比较,以确定本文考虑的疾病(例如本文考虑的tf相关疾病(膀胱癌或宫颈癌))的症状的减轻或改善。本文中可互换使用的术语“参比”或“参比值”可以指在给予治疗(例如本文所述的抗体-药物偶联物和/或本文所述的基于铂的试剂)后的症状的测量或表征。参比值可以在给药方案或治疗周期期间或在给药方案或治疗周期完成时测量一次或多次。“参比值”可以是绝对值;相对值;具有上限和/或下限的值;一系列值;平均值;中值;均值;或与基线值相比的值。
[0088]
类似地,“基线值”可以是绝对值;相对值;具有上限和/或下限的值;一系列值;平均值;中值;均值;或与参比值相比的值。参比值和/或基线值可以从一个个体、两个不同个体或一组个体(如两个、三个、四个、五个或更多个体的组)获得。
[0089]
本文所用术语“单一疗法”是指抗tf抗体-药物偶联物或基于铂的试剂是在治疗周期内给予对象的唯一抗癌剂。然而,也可以给予对象其他治疗剂。例如,可以在单一疗法期间给予患有癌症的对象抗炎剂或其他药剂,以治疗与癌症相关的症状而非潜在的癌症本身,包括例如炎症、疼痛、体重减轻和全身不适。
[0090]
本文所用的“不良事件”(ae)是与药物治疗的使用相关联的任何不利且通常是意外或不希望的迹象(包括异常的实验室发现)、症状或疾病。一种药物治疗可以具有一种或多种相关联的ae,而每种ae可以具有相同或不同水平的严重程度。提及能够“改变不良事件”的方法是指降低与使用不同治疗方案相关的一种或多种ae的发生率和/或严重程度的治疗方案。
[0091]
本文所用的“严重不良事件”或“sae”是满足下述标准之一的不良事件:
[0092]
致命或威胁生命(在严重不良事件的定义中使用的“威胁生命”是指事件发生时患者处于死亡风险中的事件;它不是指如果其更加严重的话假设可能会导致死亡的事件。
[0093]
导致持续或显著的残疾/失能
[0094]
构成先天性异常/出生缺陷
[0095]
是医学上很严重的,即定义为危害患者或可能需要医学或外科手术干预以防止上述转归之一的事件。在确定ae是否是“医学上很严重的”时必须进行医学和科学判断
[0096]
需要住院治疗或延长现有住院治疗,但以下情况除外:1)对潜在疾病的常规治疗或监测,不与任何病症恶化相关联;2)对已有病症的选择性或预先计划的治疗,所述病症与进行研究的适应症无关并且自签署知情同意书以来没有恶化,和3)在患者的总体状况没有任何恶化的情况下社会原因和暂停护理。
[0097]
替代方案(例如“或”)的使用应理解为是指替代方案之一、两者或它们的任意组合。如本文所用,不定冠词“一”或“一个”应理解为是指任何引用或列举的组分中的“一个或多个”。
[0098]
术语“约”或“基本上包含”是指在本领域普通技术人员确定的特定数值或组成的可接受误差范围内的数值或组成,这将取决于该数值或组成的测量或确定方式,即测量体系的极限。例如,“约”或“基本上包含”可按本领域实践表示在1个标准偏差之内或大于1个标准偏差。或者,“约”或“基本上包含”可表示最高为20%的范围。此外,特别是就生物系统或过程而言,这些术语可表示最高为一个数量级或最高为一个数值的5倍。当在本技术和权利要求书中提供特定的值或组成时,除非另有说明,否则应假定“约”或“基本上包含”的含义在该特定的数值或组成的可接受误差范围内。
[0099]
本文所用术语“约每周一次”、“约每两周一次”或任何其他类似的给药间隔术语是指近似数。“约每周一次”可包括每7天
±
1天,即每6天至每8天。“约每两周一次”可包括每14天
±
2天,即每12天至每16天。“约每三周一次”可包括每21天
±
3天,即每18天至每24天。例如,类似的近似适用于约每四周一次、约每五周一次、约每六周一次、以及约每十二周一次。在一些实施方式中,约每六周一次或约每十二周一次的给药间隔意味着可以在第一周的任何一天给予第一剂,然后可以分别在第六周或第十二周的任何一天给予下一剂。在其他实施方式中,约每六周一次或约每十二周一次的给药间隔意味着在第一周的特定日期(例如,星期一)给予第一剂,然后分别在第六周或第十二周的同一天(即星期一)给予下一剂。
[0100]
如本文所述,任何浓度范围、百分数范围、比例范围或整数范围应理解为包括所述范围内的任何整数值,适当时也包括其分数值(如整数的十分之一和百分之一),除非另有说明。
[0101]
在以下小节中进一步详细描述本公开的各个方面。
[0102]
ii.组合疗法
[0103]
本发明提供了结合至tf的抗tf抗体-药物偶联物用于癌症的治疗,其中所述抗体-药物偶联物与基于铂的试剂组合给药或将与其组合给药,其中抗体-药物偶联物包含偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段。在另一方面中,本发明提供了基于铂的试剂用于癌症的治疗,其中所述基于铂的试剂与结合至tf的抗体-药物偶联物组合给药或将与其组合给药,其中抗体-药物偶联物包含偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段。在一些实施方式中,癌症是膀胱癌。在一些实施方式中,癌症是宫颈癌。在一些实施方式中,宫颈癌是晚期宫颈癌(例如,3期宫颈癌或4期宫颈癌或转移性宫颈癌)。在一些实施方式中,晚期宫
颈癌是转移性癌症。在一些实施方式中,对象患有复发的、复发性的和/或转移性的宫颈癌。
[0104]
a.抗-tf抗体
[0105]
通常,本公开的抗tf抗体结合tf(例如,人tf)并对恶性细胞(如膀胱癌细胞或宫颈癌细胞)发挥细胞抑制和细胞毒性作用。本公开的抗tf抗体优选地是单克隆的,并且可以是多特异性的,人、人源化或嵌合抗体,单链抗体,fab片段,f(ab’)片段、由fab表达文库产生的片段和上述任何一种的tf结合片段。在一些实施方式中,本公开的抗tf抗体特异性地结合tf。本公开的免疫球蛋白分子可以是任何类型(例如,igg、ige、igm、igd、iga和igy),类(如igg1、igg2、igg3、igg4、iga1和iga2)或亚类的免疫球蛋白分子。
[0106]
在本公开的某些实施方式中,抗tf抗体是本文所述的抗原结合片段(例如,人抗原结合片段),包括但不限于:fab、fab’和f(ab’)2、fd、单链fv(scfv)、单链抗体、二硫键连接的fv(sdfv)和包含v
l
或vh结构域的片段。包括单链抗体在内的抗原结合片段可以单独包含一个或多个可变区,或者也可以与以下的全部或部分组合:铰链区、ch1、ch2、ch3和cl结构域。本公开还包括抗原结合片段,其包含一个或多个可变区与铰链区、ch1、ch2、ch3和cl结构域的任意组合。在一些实施方式中,抗tf抗体或其抗原结合片段是人、鼠(例如,小鼠和大鼠)、驴、绵羊、兔、山羊、豚鼠、骆驼科动物、马或鸡。
[0107]
本公开的抗tf抗体可以是单特异性、双特异性、三特异性或更大的多特异性。多特异性抗体可以对tf的不同表位具有特异性,或者对tf和异源蛋白都具有特异性。参见例如pct公开wo 93/17715;wo 92/08802;wo 91/00360;wo 92/05793;tutt等,1991,j.immunol.147:60 69;美国专利第4,474,893号;美国专利第4,714,681号;美国专利第4,925,648号;美国专利第5,573,920号;美国专利第5,601,819号;kostelny等,1992,j.immunol.148:1547 1553。
[0108]
本公开的抗tf抗体可以根据它们所包含的特定cdr来描述或指定。给定cdr或fr的精确氨基酸序列边界可以使用许多已知方案中的任何一种编号来容易地确定,包括kabat等,(1991),《热门免疫学蛋白质序列》(sequences of proteins of immunological interest),第5版,美国国立卫生研究院公共卫生局,马里兰州贝塞斯达(“kabat”编号方案);al-lazikani等,(1997)jmb 273,927-948(“chothia”编号方案);maccallum等,j.mol.biol.262:732-745(1996),《抗体-抗原相互作用:接触分析和结合位点拓扑图》(antibody-antigen interactions:contact analysis and binding site topography),j.mol.biol.262,732-745.(“contact”编号方案);lefranc mp等,《免疫球蛋白和t细胞受体可变结构域和ig超家族v样结构域的唯一imgt编号》(imgt unique numbering for immunoglobulin and t cell receptor variable domains and ig superfamily v-like domains),dev comp immunol,2003jan;27(1):55-77(“imgt”编号方案);honegger a和pl
ü
ckthun a,《免疫球蛋白可变结构域的另一个编号方案:自动建模和分析工具》(yet another numbering scheme for immunoglobulin variable domains:an automatic modeling and analysis tool),j mol biol,2001jun 8;309(3):657-70,(“aho”编号方案);以及martin等,《建模抗体高变环:组合算法》(modeling antibody hypervariable loops:a combined algorithm),pnas,1989,86(23):9268-9272,(“abm”编号方案)描述的方案。给定cdr的边界可以变化,取决于用于鉴定的方案。在一些实施方式中,给定抗体或其区域(例如,其可变区)的“cdr”或“互补决定区”或单独指定的cdr(例如,cdr-h1、cdr-h2、
cdr-h3)应理解为涵盖由任何上述方案定义的(或特定的)cdr。例如,当描述特定的cdr(如cdr-h3)包括给定的vh或v
l
区氨基酸序列中的相应cdr的氨基酸序列时,应理解该cdr具有可变区内的相应cdr(如cdr-h3)的序列,如任何上述方案所定义。可以指定用于鉴定一个或多个特定cdr的方案,例如由kabat、chothia、abm或imgt方法定义的cdr。
[0109]
本文提供的cdr序列中氨基酸残基的编号是根据lefranc,m.p.等,dev.comp.immunol.,2003,27,55-77中所述的imgt编号方案。本文所提供的抗tf抗体-药物偶联物的抗tf抗体的cdr序列根据lefranc,m.p.等,dev.comp.immunol.,2003,27,55-77中所述的imgt方法。
[0110]
在某些实施方式中,本公开的抗体包含抗体011的一个或多个cdr。参见wo 2011/157741和wo 2010/066803。本公开涵盖了包含重链或轻链可变结构域的抗体或其衍生物,所述可变结构域包含:(a)一组三个cdr,其中所述cdr组来自单克隆抗体011,和(b)一组四个框架区,其中所述框架区组不同于单克隆抗体011中的框架区组,并且其中所述抗体或其衍生物结合至tf。在一些实施方式中,所述抗体或其衍生物特异性地结合至tf。在某些实施方式中,抗tf抗体是011。抗体011也称为替索土单抗。
[0111]
在一个方面,本文还提供了与替索土单抗竞争结合tf的抗tf抗体。本文还提供了与替索土单抗结合至同一表位的抗tf抗体。
[0112]
在一个方面,本文提供包含替索土单抗的1、2、3、4、5或6个cdr序列的抗tf抗体。
[0113]
一方面,本文提供包括重链可变区和轻链可变区的抗tf抗体,其中所述重链可变区包括:(i)包含seq id no:1的氨基酸序列的cdr-h1,(ii)包含seq id no:2的氨基酸序列的cdr-h2,以及(iii)包含seq id no:3的氨基酸序列的cdr-h3;和/或其中所述轻链可变区包括:(i)包含seq id no:4的氨基酸序列的cdr-l1,(ii)包含seq id no:5的氨基酸序列的cdr-l2,以及(iii)包含seq id no:6的氨基酸序列的cdr-l3;其中,所述抗tf抗体的cdr由imgt编号方案定义。
[0114]
本文所述的抗tf抗体可以包含任何合适的框架可变结构域序列,只要抗体保留结合至tf(例如,人tf)的能力。如本文所用,重链框架区记作“hc-fr1-fr4”,轻链框架区记作“lc-fr1-fr4”。在一些实施方式中,抗tf抗体包含seq id no:9、10、11和12的重链可变结构域框架序列(分别为hc-fr1、hc-fr2、hc-fr3和hc-fr4)。在一些实施方式中,抗tf抗体包含seq id no:13、14、15和16的轻链可变结构域框架序列(分别为lc-fr1、lc-fr2、lc-fr3和lc-fr4)。
[0115]
在本文所述抗tf抗体的一些实施方式中,重链可变结构域包含氨基酸序列:
[0116]
evqllesggglvqpggslrlscaasgftfsnyamswvrqapgkglewvssisgsgdytyytdsvkgrftisrdnskntlylqmnslraedtavyycarspwgyyldswgqgtlvtvss(seq id no:7),轻链可变结构域包含氨基酸序列:diqmtqsppslsasagdrvtitcrasqgissrlawyqqkpekapksliyaasslqsgvpsrfsgsgsgtdftltisslqpedfatyycqqynsypytfgqgtkleik(seq id no:8)。
[0117]
在本文所述的抗tf抗体的一些实施方式中,重链cdr序列包含以下:
[0118]
a)cdr-h1(gftfsnya(seq id no:1));
[0119]
b)cdr-h2(isgsgdyt(seq id no:2));和
[0120]
c)cdr-h3(arspwgyylds(seq id no:3))。
[0121]
在本文所述的抗tf抗体的一些实施方式中,重链fr序列包含以下:
[0122]
a)hc-fr1(evqllesggglvqpggslrlscaas(seq idno:9));
[0123]
b)hc-fr2(mswvrqapgkglewvss(seq id no:10));
[0124]
c)hc-fr3
[0125]
(yytdsvkgrftisrdnskntlylqmnslraedtavyyc(seq id no:11));和
[0126]
d)hc-fr4(wgqgtlvtvss(seq id no:12))。
[0127]
在本文所述的抗tf抗体的一些实施方式中,轻链cdr序列包含以下:
[0128]
a)cdr-l1(qgissr(seq id no:4));
[0129]
b)cdr-l2(aas(seq id no:5));和
[0130]
c)cdr-l3(qqynsypyt(seq id no:6))。
[0131]
在本文所述的抗tf抗体的一些实施方式中,轻链fr序列包含以下:
[0132]
a)lc-fr1(diqmtqsppslsasagdrvtitcras(seq id no:13));
[0133]
b)lc-fr2(lawyqqkpekapksliy(seq id no:14));
[0134]
c)lc-fr3(slqsgvpsrfsgsgsgtdftltisslqpedfatyyc(seq id no:15));和
[0135]
d)lc-fr4(fgqgtkleik(seq id no:16))。
[0136]
在一些实施方式中,本文提供与结合至tf(例如,人tf)的抗tf抗体,其中所述抗体包含重链可变区和轻链可变区,其中所述抗体包含:
[0137]
(a)重链可变结构域,其包括:
[0138]
(1)包含seq id no:9的氨基酸序列的hc-fr1;
[0139]
(2)包含seq id no:1的氨基酸序列的cdr-h1;
[0140]
(3)包含seq id no:10的氨基酸序列的hc-fr2;
[0141]
(4)包含seq id no:2的氨基酸序列的cdr-h2;
[0142]
(5)包含seq id no:11的氨基酸序列的hc-fr3;
[0143]
(6)包含seq id no:3的氨基酸序列的cdr-h3;以及
[0144]
(7)包含seq id no:12的氨基酸序列的hc-fr4;
[0145]
和/或
[0146]
(b)轻链可变结构域,其包括:
[0147]
(1)包含seq id no:13的氨基酸序列的lc-fr1;
[0148]
(2)包含seq id no:4的氨基酸序列的cdr-l1;
[0149]
(3)包含seq id no:14的氨基酸序列的lc-fr2;
[0150]
(4)包含seq id no:5的氨基酸序列的cdr-l2;
[0151]
(5)包含seq id no:15的氨基酸序列的lc-fr3;
[0152]
(6)包含seq id no:6的氨基酸序列的cdr-l3;和
[0153]
(7)包含seq id no:16的氨基酸序列的lc-fr4。
[0154]
一方面,本文提供抗tf抗体,其包括包含seq id no:7的氨基酸序列的重链可变结构域或包括包含seq id no:8的氨基酸序列的轻链可变结构域。一方面,本文提供抗tf抗体,其包括包含seq id no:7的氨基酸序列的重链可变结构域和包括包含seq id no:8的氨基酸序列的轻链可变结构域。一方面,本文提供抗tf抗体,其包括包含seq id no:7的氨基酸序列的重链可变结构域的cdr和包括包含seq id no:8的氨基酸序列的轻链可变结构域的cdr。
[0155]
在一些实施方式中,本文提供抗tf抗体,其包括包含与seq id no:7的氨基酸序列有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性的氨基酸序列的重链可变结构域。在某些实施方式中,包含与氨基酸序列seq id no:7具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列的重链可变结构域相对于参比序列含有取代(例如,保守取代)、插入或缺失并且保留结合至tf(例如,人tf)的能力。在某些实施方式中,seq id no:7中总计有1至10个氨基酸被取代、插入和/或缺失。在某些实施方式中,取代、插入或缺失(例如,1、2、3、4或5个氨基酸)发生在cdr之外的区域(即fr中)。在一些实施方式中,抗tf抗体包括含有序列的翻译后修饰的seq id no:7的重链可变结构域序列。在特定实施方式中,重链可变结构域包括选自下组的一个、两个或三个cdr:(a)包含seq id no:1的氨基酸序列的cdr-h1,(b)包含seq id no:2的氨基酸序列的cdr-h2,以及(c)包含seq id no:3的氨基酸序列的cdr-h3。
[0156]
在一些实施方式中,本文提供抗tf抗体,其包括包含与seq id no:8的氨基酸序列有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性的氨基酸序列的轻链可变结构域。在某些实施方式中,包含与seq id no:8的氨基酸序列具有至少85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的氨基酸序列的轻链可变结构域相对于参比序列含有取代(例如,保守取代)、插入或缺失并且保留结合至tf(例如,人tf)的能力。在某些实施方式中,seq id no:8中总计有1至10个氨基酸被取代、插入和/或缺失。在某些实施方式中,取代、插入或缺失(例如,1、2、3、4或5个氨基酸)发生在cdr之外的区域(即fr中)。在一些实施方式中,抗tf抗体包括含有序列的翻译后修饰的seq id no:8的轻链可变结构域序列。在特定实施方式中,轻链可变结构域包括选自下组的一个、两个或三个cdr:(a)包含seq id no:4的氨基酸序列的cdr-l1,(b)包含seq id no:5的氨基酸序列的cdr-l2,以及(c)包含seq id no:6的氨基酸序列的cdr-l3。
[0157]
在一些实施方式中,抗tf抗体包括以上提供的任何实施方式中的重链可变结构域和以上提供的任何实施方式中的轻链可变结构域。在一个实施方式中,抗体包括seq id no:7的重链可变结构域序列和seq id no:8的轻链可变结构域序列,其中包括这些序列的翻译后修饰。
[0158]
在一些实施方式中,抗tf抗体-药物偶联物的抗tf抗体包括:i)包含氨基酸序列seq id no:1的重链cdr1,包含氨基酸序列seq id no:2的重链cdr2,包含氨基酸序列seq id no:3的重链cdr3;和ii)包含氨基酸序列seq id no:4的轻链cdr1,包含氨基酸序列seq id no:5的轻链cdr2,和包含氨基酸序列seq id no:6的轻链cdr3,其中所述抗tf抗体的cdr由imgt编号方案定义。
[0159]
在一些实施方式中,抗tf抗体-药物偶联物的抗tf抗体包括:i)与包含氨基酸序列seq id no:7的重链可变区具有至少85%序列同一性的氨基酸序列,和ii)与包含氨基酸序列seq id no:8的轻链可变区具有至少85%序列同一性的氨基酸序列。
[0160]
在一些实施方式中,抗tf抗体-药物偶联物的抗tf抗体是单克隆抗体。
[0161]
在一些实施方式中,抗tf抗体-药物偶联物的抗tf抗体是替索土单抗,其也称为抗体011,如wo 2011/157741和wo 2010/066803中所述。
[0162]
本发明的抗tf抗体还可以就其对tf(例如,人tf)的结合亲和力来描述或指定。优选的结合亲和力包括解离常数或kd小于5x10-2
m、10-2
m、5x10-3
m、10-3
m、5x10-4
m、10-4
m、5x10-5
m、10-5
m、5x10-6
m、10-6
m、5x10-7
m、10-7
m、5x10-8
m、10-8
m、5x10-9
m、10-9
m、5x10-10
m、10-10
m、5x10-11
m、10-11
m、5x10-12
m、10-12
m、5x10-13
m、10-13
m、5x10-14
m、10-14
m、5x10-15
m或10-15
m的结合亲和力。
[0163]
有五类免疫球蛋白:iga、igd、ige、igg和igm,分别具有记作α、δ、ε、γ和μ的重链。γ和α类进一步分为亚类,例如人类表达以下亚类:igg1、igg2、igg3、igg4、iga1和iga2。igg1抗体可以以称为同种异型的多种多态变体存在(在jefferis和lefranc 2009mabsvol 1issue 4 1-7中综述),其中任何一种都适合用于本文的一些实施方式中。人群中常见的同种异型变体是由字母a、f、n、z或其组合指示的变体。在本文的任何实施方式中,抗体可以包括重链fc区,其包含人igg fc区。在另一些实施方式中,人igg fc区包含人igg1。
[0164]
抗体还包括经修饰的衍生物,即,通过任何类型的分子与抗体的共价附接而被修饰,以使得共价附接不会阻止抗体与tf结合或对hd细胞发挥细胞抑制或细胞毒性作用。例如但不限于,抗体衍生物包括已经修饰的抗体,例如通过糖基化、乙酰化、peg化、磷酸化、酰胺化、由已知的保护/阻断基团衍生化、蛋白水解裂解、与细胞配体或其他蛋白质连接等。通过已知技术可进行多种化学修饰中的任一种,包括但不限于:特异性化学裂解、乙酰化、甲酰化、衣霉素的代谢合成等。此外,衍生物可包含一种或多种非经典氨基酸。
[0165]
b.抗体-药物偶联物结构
[0166]
在一些方面,本文所述的抗tf抗体-药物偶联物包括本文所述的抗tf抗体或其抗原结合片段与细胞抑制或细胞毒性药物之间的接头。在一些实施方式中,接头是不可裂解接头。在一些实施方式中,接头是可裂解接头。
[0167]
在一些实施方式中,接头是包含马来酰亚胺基己酰基(mc)、二肽缬氨酸-瓜氨酸(vc)和对氨基苄基氨基甲酸酯(pab)的可裂解肽接头。在一些实施方式中,可裂解肽接头具有式:mc-vc-pab-,其中:
[0168]
a)mc为:
[0169][0170]
b)vc是二肽缬氨酸-瓜氨酸,并且
[0171]
c)pab为:
[0172][0173]
在一些实施方式中,接头是包含马来酰亚胺基己酰基(mc)的可裂解肽接头。在一些实施方式中,可裂解肽接头具有式:mc-,其中:
[0174]
a)mc为:
[0175][0176]
在一些实施方式中,接头附接至抗tf抗体或其抗原结合片段的巯基残基,其通过所述抗tf抗体或其抗原结合片段的部分还原或充分还原而得。在一些实施方式中,接头附接至抗tf抗体或其抗原结合片段的巯基残基,其通过所述抗tf抗体或其抗原结合片段的部分还原而得。在一些实施方式中,接头附接至抗tf抗体或其抗原结合片段的巯基残基,其通过所述抗tf抗体或其抗原结合片段的充分还原而得。
[0177]
在一些方面,本文所述的抗tf抗体-药物偶联物包括本文所述的抗tf抗体或其抗原结合片段与细胞抑制或细胞毒性药物之间的本文所述的接头。已经证明奥瑞他汀干扰微管动力学、gtp水解以及核和细胞分裂(参见woyke等,(2001)antimicrob.agents and chemother.45(12):3580-3584)并具有抗癌(参见美国专利第5663149号)和抗真菌活性(参见pettit等,(1998)antimicrob.agents and chemother.42:2961-2965)。例如,奥瑞他汀e能够与对乙酰基苯甲酸或苯甲酰基戊酸反应分别生成aeb和aevb。其他典型的奥瑞他汀衍生物包括afp、mmaf(单甲基奥瑞他汀f)和mmae(单甲基奥瑞他汀e)。合适的奥瑞他汀及奥瑞他汀类似物、衍生物和前药、以及用于奥瑞他汀与抗体偶联的合适的接头描述于例如美国专利第5,635,483号、美国专利第5,780,588号和美国专利第6,214,345号以及国际专利申请公开wo02088172、wo2004010957、wo2005081711、wo2005084390、wo2006132670、wo03026577、wo200700860、wo207011968和wo205082023。在本文所述抗tf抗体-药物偶联物的一些实施方式中,细胞抑制或细胞毒性药物是奥瑞他汀或其功能性类似物(例如,其功能性肽)或其功能性衍生物。在一些实施方式中,奥瑞他汀是单甲基奥瑞他汀或其功能性类似物(例如,其功能性肽)或其功能性衍生物。
[0178]
在一些实施方式中,奥瑞他汀是单甲基奥瑞他汀e(mmae):
[0179][0180]
其中波浪线表示接头的附接位点。
[0181]
在一些实施方式中,奥瑞他汀是单甲基奥瑞他汀f(mmaf):
[0182]
[0183]
其中波浪线表示接头的附接位点。
[0184]
在一个实施方式中,可裂解肽接头具有式:mc-vc-pab-,并且附接至mmae。所得的接头-奥瑞他汀mc-vc-pab-mmae也记作vcmmae。该vcmmae药物接头部分和偶联方法公开于wo2004010957、us7659241、us7829531和us7851437。当vcmmae附接至本文所述的抗tf抗体或其抗原结合片段时,所得结构为:
[0185][0186]
其中,p表示1至8的数字,例如,1、2、3、4、5、6、7或8,例如p可以是3-5,s表示抗tf抗体的巯基残基,而ab表示本文所述的抗tf抗体或其抗原结合片段。在一个实施方式中,抗体-药物偶联物群体中p的平均值约为4。在一些实施方式中,p通过疏水相互作用色谱(hic)测得,例如基于增强的疏水性来拆分载有药物的物质,其中疏水性最弱的非偶联形式先洗脱,疏水性最强的8种药物形式最后洗脱,峰面积百分比代表载有特定药物的抗体-药物偶联物物质的相对分布。参见ouyang,j.,2013,《抗体-药物偶联物,分子生物学方法(方法与方案)》(antibody-drug conjugates,methods in molecular biology(methods and protocols))。在一些实施方式中,p通过反相高效液相色谱(rp-hplc)测得,例如首先进行还原反应以将adc的重链和轻链完全解离,然后在rp柱上分离轻链和重链及其相应的载有药物的形式,其中百分比峰来自轻链和重链峰的积分,与每个峰所分配的药物负载相结合,用于计算药物与抗体之比的加权平均数。参见ouyang,j.,2013,《抗体-药物偶联物,分子生物学方法(方法与方案)》(antibody-drug conjugates,methods in molecular biology(methods and protocols))。
[0187]
在一个实施方式中,可裂解肽接头具有式:mc-vc-pab-,并且附接至mmaf。所得的接头-奥瑞他汀mc-vc-pab-mmaf也记作vcmmaf。在另一实施方式中,不可裂解的接头mc附接至mmaf。所得的接头-奥瑞他汀mc-mmaf也记作mcmmaf。vcmmaf和mcmmaf药物接头部分和偶联方法公开于wo2005081711和us7498298。当vcmmaf或mcmmaf附接至本文所述的抗tf抗体或其抗原结合片段时,所得结构为:
[0188][0189]
其中,p表示1至8的数字,例如,1、2、3、4、5、6、7或8,例如p可以是3-5,s表示抗tf抗体的巯基残基,而ab或mab表示本文所述的抗tf抗体或其抗原结合片段。在一个实施方式中,抗体-药物偶联物群体中p的平均值约为4。在一些实施方式中,p通过疏水相互作用色谱(hic)测得,例如基于增强的疏水性来拆分载有药物的物质,其中疏水性最弱的非偶联形式先洗脱,疏水性最强的8种药物形式最后洗脱,峰面积百分比代表载有特定药物的抗体-药物偶联物物质的相对分布。参见ouyang,j.,2013,《抗体-药物偶联物,分子生物学方法(方法与方案)》(antibody-drug conjugates,methods in molecular biology(methods and protocols))。在一些实施方式中,p通过反相高效液相色谱(rp-hplc)测得,例如首先进行还原反应以将adc的重链和轻链完全解离,然后在rp柱上分离轻链和重链及其相应的载有药物的形式,其中百分比峰来自轻链和重链峰的积分,与每个峰所分配的药物负载相结合,用于计算药物与抗体之比的加权平均数。参见ouyang,j.,2013,《抗体-药物偶联物,分子生物学方法(方法与方案)》(antibody-drug conjugates,methods in molecular biology(methods and protocols))。
[0190]
在一个实施方式中,抗体-药物偶联物是替索土单抗维多汀或其生物类似物。在一个实施方式中,抗体-药物偶联物是替索土单抗维多汀。
[0191]
c.基于铂的试剂
[0192]
通常,本公开的基于铂的试剂指这样的分子或包含分子的组合物,其含有包含化学元素铂并且可用作化疗药物的配位化合物。在一些实施方式中,基于铂的试剂共价结合至dna并交联链,抑制dna合成和/或抑制转录。基于铂的试剂包括当前正用作化疗方案部分的那些药物,当前正在开发的药物和可能在将来开发的药物。基于铂的试剂包括但不限于卡铂、顺铂、奥沙利铂、奈达铂、四硝酸三铂、菲蒽铂、吡铂和赛特铂。在一些实施方式中,基于铂的试剂是卡铂、顺铂、奥沙利铂或奈达铂。在一些实施方式中,基于铂的试剂是卡铂。在一些实施方式中,基于铂的试剂是顺铂。在一些实施方式中,基于铂的试剂是奥沙利铂。在一些实施方式中,基于铂的试剂是奈达铂。在一些实施方式中,基于铂的试剂是四硝酸三铂。在一些实施方式中,基于铂的试剂是菲蒽铂。在一些实施方式中,基于铂的试剂是吡铂。在一些实施方式中,基于铂的试剂是赛特铂。
[0193]
d.核酸、宿主细胞和生产方法
[0194]
在一些方面,本文还提供编码本文所述的抗tf抗体或其抗原结合片段的核酸。本文还提供包含编码本文所述的抗tf抗体或其抗原结合片段的核酸的载体。本文还提供表达编码本文所述的抗tf抗体或其抗原结合片段的核酸的宿主细胞。本文还提供包含载体的宿主细胞,该载体包含编码本文所述的抗tf抗体或其抗原结合片段的核酸。产生抗tf抗体、接头和抗tf抗体-药物偶联物的方法述于美国专利第9,168,314号中。
[0195]
本文所述的抗tf抗体可以使用众所周知的表达载体系统和宿主细胞通过众所周知的重组技术制备。在一个实施方式中,抗体在cho细胞中使用gs表达载体系统制备,如de la cruz edmunds等,2006,molecular biotechnology 34;179-190、ep216846、美国专利第5,981,216号、wo87/04462、ep323997、美国专利第5,591,639号、美国专利第5,658,759号、ep338841、美国专利第5,879,936号和美国专利第5,891,693号中所述。
[0196]
使用本领域众所周知的技术从细胞培养基中分离并纯化抗tf抗体后,如美国专利第9,168,314号所述通过接头与奥瑞他汀偶联。
[0197]
本文所述的单克隆抗tf抗体例如可以通过首先由kohler等,nature,256,495(1975)中描述的杂交瘤方法来制造,或者可以通过重组dna方法来制造。单克隆抗体也可以采用例如clackson等,nature 352:624-628(1991)和marks等,j.mol.biol.222(3):581-597(1991)中描述的技术从噬菌体抗体文库中分离。单克隆抗体可以从任何合适的来源获得。因此,例如单克隆抗体可以从用感兴趣的抗原免疫的小鼠获得的鼠脾脏b细胞制备的杂交瘤获得,所述感兴趣的抗原例如以在表面上表达抗原的细胞或编码感兴趣的抗原的核酸的形式。单克隆抗体也可以从来源于经免疫的人或非人哺乳动物(如大鼠、狗、灵长类等)的表达抗体的细胞的杂交瘤获得。
[0198]
在一个实施方式中,本发明的抗体(例如,抗tf抗体)是人抗体。可以使用携带一部分人免疫系统而非小鼠系统的转基因或转染色体小鼠来产生针对tf的人单克隆抗体。这样的转基因和转染色体小鼠包括本文中分别称为humab小鼠和km小鼠的小鼠,它们在本文中合称为“转基因小鼠”。
[0199]
humab小鼠包含人免疫球蛋白基因小基因座,其编码未重排的人重链(μ和γ)和κ轻链免疫球蛋白序列,以及使内源性μ和κ链基因座失活的靶向突变(lonberg,n.等,nature,368,856-859(1994))。因此,小鼠表现出小鼠igm或κ表达降低,并且对免疫产生反应,引入的人重链和轻链转基因经历类别转换和体细胞突变,以产生高亲和力的人igg,κ单克隆抗体(lonberg,n.等,(1994),同上;综述于lonberg,n.实验药理学手册(handbook of experimental pharmacology)113,49-101(1994),lonberg,n.和huszar.d.,intern.rev.immunol,vol.13 65-93(1995)以及harding,f.和lonberg,n.ann,n.y.acad.sci 764:536-546(1995))。humab小鼠的制备详细描述于taylor,l.等,核酸研究(nucleic acids research.)20:6287-6295(1992),chen,j.等,国际免疫学(international immunology.)5:647-656(1993),tuaillon等,j.immunol,152:2912-2920(1994),taylor,l.等,international immunology,6:579-591(1994),fishwild,d.等,nature biotechnology,14:845-851(1996)。也参见美国专利第5,545,806号、美国专利第5,569,825号、美国专利第5,625,126号、美国专利第5,633,425号、美国专利第5,789,650号、美国专利第5,877,397号、美国专利第5,661,016号、美国专利第5,814,318号、美国专利第5,874,299号、美国专利第5,770,429号、美国专利第5,545,807、wo 98/24884、wo 94/
25585、wo93/1227、wo 92/22645/wo 92/03918和wo 01/09187。
[0200]
hco7小鼠在其内源性轻链(κ)基因中具有jkd破坏(如chen等,embo j.12:821-830(1993)中所述),在其内源性重链基因中具有cmd破坏(如wo 01/14424的实施例1中所述),具有kco5人κ轻链转基因(如fishwild等,nature biotechnology,14:845-851(1996)中所述)和hco7人重链转基因(如美国专利第5,770,429号中所述)。
[0201]
hco12小鼠在其内源性轻链(κ)基因中具有jkd破坏(如chen等,embo j.12:821-830(1993)中所述),在其内源性重链基因中具有cmd破坏(如wo 01/14424的实施例1中所述),具有kco5人κ轻链转基因(如fishwild等,nature biotechnology,14:845-851(1996)中所述)和hco12人重链转基因(如wo 01/14424的实施例2中所述)。
[0202]
hco17转基因小鼠品系(也参见us 2010/0077497)是通过共注射phc2的80kb插入片段(taylor等,(1994)int.immunol.,6:579-591)、pvx6的kb插入片段以及yigh24染色体的-460kb酵母人工染色体片段而产生的。该品系记作(hco17)25950。接着,将(hco17)25950系与包含cmd突变(述于pct公开wo 01109187的实施例1中)、jkd突变(chen等,(1993)embo j.12:811-820)和(kc05)9272转基因(fishwild等,(1996)nature biotechnology,14:845-851)的小鼠一起繁殖。所得小鼠在背景纯合子中表达人免疫球蛋白重链和κ轻链转基因,以破坏内源性小鼠重链和κ轻链基因座。
[0203]
hco20转基因小鼠品系是共注射小基因座30重链转基因phc2、含有种系可变区(vh)的yac yigh10以及小基因座构建体pvx6的结果(如wo09097006中所述)。接着,将(hco20)系与包含cmd突变(述于pct公开wo 01/09187的实施例1中)、jkd突变(chen等,(1993)embo j.12:811-820)和(kco5)9272转基因(fishwild等,(1996)nature biotechnology,14:845-851)的小鼠一起繁殖。所得小鼠在背景纯合子中表达人10免疫球蛋白重链和κ轻链转基因,以破坏内源性小鼠重链和κ轻链基因座。
[0204]
为了产生具有balb/c品系的有益效果的humab小鼠,将humab小鼠与通过kc05品系和野生型balb/c小鼠的回交而产生的kco05[mik](balb)小鼠杂交(如fishwild等,(1996)nature biotechnology,14:845-851),以产生小鼠,如wo09097006中所述。使用该杂交balb/c杂合体来创建hco12、hco17和hco20品系。
[0205]
在km小鼠品系中,如chen等,embo j.12:811-820(1993)中所述,内源性小鼠κ轻链基因已被纯合破坏,并且如wo 01/09187的实施例1中所述,内源性小鼠重链基因已被纯合破坏。该小鼠品系携带人κ轻链转基因kco5,如fishwild等,nature biotechnology,14:845-851(1996)中所述。该小鼠品系还携带由染色体14片段hcf(sc20)组成的人重链转染色体,如wo 02/43478中所述。
[0206]
来自这些转基因小鼠的脾细胞可用于产生杂交瘤,所述杂交瘤可根据众所周知的技术分泌人单克隆抗体。也可以通过产生对于感兴趣的免疫球蛋白重链和轻链序列而言是转基因的另一种非人哺乳动物或植物,并由此产生可回收形式的抗体,从而以转基因方式产生本发明的人单克隆抗体或多克隆抗体或源自其他物种的本发明的抗体。与哺乳动物中的转基因生产相关,抗体可以在山羊、牛或其他哺乳动物的乳中产生并从中回收。参见例如美国专利第5,827,690号、美国专利第5,756,687号、美国专利第5,750,172号和美国专利第5,741,957号。
[0207]
此外,本发明的人抗体或来自其他物种的本发明的抗体可以使用本领域众所周知
的技术,通过展示型技术来产生,包括但不限于噬菌体展示、逆转录病毒展示、核糖体展示和其他技术,并且可以对所得分子进行另外的成熟、例如亲和力成熟,因为这样的技术是本领域众所周知的(参见例如hoogenboom等,j.mol,biol.227(2):381-388(1992)(噬菌体展示)、vaughan等,nature biotech,14:309(1996)(噬菌体展示)、hanes和plucthau,pnas usa 94:4937-4942(1997)(核糖体展示)、parmley和smith,gene,73:305-318(1988)(噬菌体展示)、scott,tibs.17:241-245(1992)、cwirla等,pnas usa,87:6378-6382(1990)、russel等,nucl.acids research,21:1081-4085(1993)、hogenboom等,immunol,reviews,130:43-68(1992)、chiswell和mccafferty,tibtech,10:80-84(1992)、以及美国专利第5,733,743号)。如果利用展示技术来产生非人的抗体,则此类抗体可以被人源化。
[0208]
iii.治疗方法
[0209]
本发明提供用本文所述的抗tf抗体-药物偶联物和本文所述的基于铂的试剂治疗对象中癌症的方法。一方面,抗体-药物偶联物是替索土单抗维多汀或其生物类似物。一方面,抗体-药物偶联物是替索土单抗维多汀。在一个方面中,基于铂的试剂是卡铂。在一个方面中,基于铂的试剂是顺铂。在特定实施方式中,对象是人。
[0210]
在另一方面中,本发明提供了与tf结合的抗体-药物偶联物,用于癌症的治疗,其中所述抗体-药物偶联物与基于铂的试剂组合给药或将与其组合给药,其中所述抗体-药物偶联物包含与单甲基奥瑞他汀或其功能性类似物或其功能性衍生物偶联的抗tf抗体或其抗原结合片段。
[0211]
在另一方面中,本发明提供了基于铂的试剂用于癌症的治疗,其中所述基于铂的试剂与结合至tf的抗体-药物偶联物组合给药或将与其组合给药,其中抗体-药物偶联物包含偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段。
[0212]
a.膀胱癌
[0213]
膀胱癌是美国第五大最常见的癌症诊断。美国癌症协会(acs)估计,2009年有70980名膀胱癌新患者,每年有14330人死于膀胱癌。acs还估计,男性的膀胱癌发病率为1/27,女性为1/85,90%的膀胱癌患者年龄超过55岁。浸润性膀胱癌可能扩散到淋巴结,骨盆的其他器官(导致肾脏和肠功能问题)或体内的其他器官,如肝和肺。膀胱癌的标准疗法是手术、放疗、化疗和生物疗法。
[0214]
在一些方面中,本发明提供用本文所述的抗tf抗体-药物偶联物和本文所述的基于铂的试剂治疗对象中膀胱癌的方法。一方面,抗体-药物偶联物是替索土单抗维多汀或其生物类似物。一方面,抗体-药物偶联物是替索土单抗维多汀。一方面,基于铂的试剂是卡铂。一方面,基于铂的试剂是顺铂。在特定实施方式中,对象是人。
[0215]
在一些实施方式中,来自对象的至少约0.1%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%的膀胱癌细胞表达tf。在一些实施方式中,来自对象的至少0.1%、至少1%、至少2%、至少3%、至少4%、至少5%、至少6%、至少7%、至少8%、至少9%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%或至少80%的膀胱癌细胞表达tf。在一些实施方
式中,使用免疫组化(ihc)确定表达tf的细胞的百分比。在一些实施方式中,使用流式细胞术确定表达tf的细胞的百分比。在一些实施方式中,使用酶联免疫吸附试验(elisa)确定表达tf的细胞的百分比。
[0216]
b.宫颈癌
[0217]
尽管在筛查、诊断、预防和治疗方面取得了进步,宫颈癌仍然是女性与癌症相关的死亡的主要原因之一。它占新诊断癌症病例总数的约4%,占癌症死亡总数的4%。参见zhu等,2016,drug des.devel.ther.10:1885-1895。宫颈癌是全球第七大最常见的女性癌症,也是欧盟第十六大最常见的癌症。根据最初发病时的阶段,25-61%的妇女的宫颈癌会复发。参见tempfer等,2016,oncol.res.treat.39:525-533。在大多数情况下,复发的疾病在初次治疗后的2年内被诊断出,并可能在各个部位被观察到。化学治疗是这些患者的标准治疗方法。参见zhu等,2016,drug des.devel.ther.10:1885-1895。目前,中位总生存期已超过一年,但是,iv期宫颈癌的五年相对生存率仅为15%,这表明对改进的宫颈癌治疗方法的高度需求。
[0218]
在一些方面中,本文提供的是用本文所述的抗tf抗体-药物偶联物和本文所述的基于铂的试剂治疗对象中宫颈癌的方法。一方面,抗体-药物偶联物是替索土单抗维多汀或其生物类似物。一方面中,抗体-药物偶联物是替索土单抗维多汀。在一个方面中,基于铂的试剂是卡铂。在一个方面中,基于铂的试剂是顺铂。在一些实施方式中,对象先前未接受过针对宫颈癌的在先全身疗法。在一些实施方式中,化疗不被认为是针对宫颈癌的在先全身疗法。在一些实施方式中,放疗不被认为是针对宫颈癌的在先全身疗法。在一些实施方式中,化疗组合放疗不被认为是针对宫颈癌的在先全身疗法。在一些实施方式中,对象先前已经用化疗和/或放疗治疗。在一些实施方式中,对象不是治愈性疗法的候选人。在一些实施方式中,治愈性疗法是放射治疗和/或内脏切除疗法。在一些实施方式中,治愈性疗法是放射治疗。在一些实施方式中,治愈性疗法是内脏切除疗法。在特定实施方式中,对象是人。
[0219]
在本文提供的方法或用途或用于用途的产品的一些实施方式中,宫颈癌是腺癌、腺鳞癌、鳞状细胞癌、非鳞状细胞癌、小细胞癌、神经内分泌肿瘤、玻璃状细胞癌或前庭腺癌。在一些实施方式中,宫颈癌是腺癌、腺鳞癌或鳞状细胞癌或非鳞状细胞癌。在一些实施方式中,宫颈癌是腺癌。在一些实施方式中,宫颈癌是腺鳞癌。在一些实施方式中,宫颈癌是鳞状细胞癌。在一些实施方式中,宫颈癌是非鳞状细胞癌。
[0220]
在一些实施方式中,来自对象的至少约0.1%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%的宫颈癌细胞表达tf。在一些实施方式中,来自对象的至少0.1%、至少1%、至少2%、至少3%、至少4%、至少5%、至少6%、至少7%、至少8%、至少9%、至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%或至少80%的宫颈癌细胞表达tf。在一些实施方式中,使用免疫组化(ihc)确定表达tf的细胞的百分比。在一些实施方式中,使用流式细胞术确定表达tf的细胞的百分比。在一些实施方式中,使用酶联免疫吸附试验(elisa)确定表达tf的细胞的百分比。
[0221]
在本文提供的方法或用途或用于用途的产品的一些实施方式中,宫颈癌是0、1、2、
3或4期宫颈癌。在一些实施方式中,宫颈癌是0、1a、1b、2a、2b、3a、3b、4a或4b期宫颈癌。在一些实施方式中,宫颈癌由国际妇产科联合会(figo)分期系统分期。在一些实施方式中,分期基于临床检查。在一些实施方式中,在0期宫颈癌中,癌局限于宫颈的表面层(内壁细胞)。在一些实施方式中,在1期宫颈癌中,癌已生长到深入宫颈,但尚未扩散到宫颈之外。在一些实施方式中,在1a期宫颈癌中,侵袭性癌只能通过显微镜来诊断,并且最深的浸润小于5mm,最大的延伸小于7mm。在一些实施方式中,在1b期宫颈癌中,病灶在临床上是可见的,并且仅限于宫颈。在一些实施方式中,在2期宫颈癌中,宫颈癌已浸润到子宫,但未浸润到骨盆壁或阴道下部三分之一。在一些实施方式中,在2a期宫颈癌中,没有子宫旁的浸润。在一些实施方式中,在2b期宫颈癌中,有子宫旁的浸润。在一些实施方式中,在3期宫颈癌中,肿瘤延伸到骨盆壁和/或累及阴道下部三分之一和/或引起肾积水或肾功能不全。在一些实施方式中,在3a期宫颈癌中,肿瘤累及阴道下部三分之一,没有延伸到骨盆壁。在一些实施方式中,在3b期宫颈癌中,延伸到骨盆壁和/或引起肾积水或肾功能不全。在一些实施方式中,在4期宫颈癌中,癌已经超出了真正的骨盆或累及了膀胱或直肠的粘膜。在一些实施方式中,在4a期宫颈癌中,肿瘤已扩散到邻近器官。在一些实施方式中,在4b期宫颈癌中,肿瘤已扩散到远端器官。在一些实施方式中,所述宫颈癌是晚期宫颈癌。在一些实施方式中,晚期宫颈癌是3或4级宫颈癌。在一些实施方式中,晚期宫颈癌是转移性宫颈癌。在一些实施方式中,宫颈癌是转移性和复发性宫颈癌。在一些实施方式中,宫颈癌是转移性宫颈癌。在一些实施方式中,宫颈癌是复发性宫颈癌。
[0222]
在本文所提供的方法或用途或用于用途的产品的一些实施方式中,对象尚未接受过针对宫颈癌的在先全身疗法。在一些实施方式中,化疗不被认为是针对宫颈癌的在先全身疗法。在一些实施方式中,放疗不被认为是针对宫颈癌的在先全身疗法。在一些实施方式中,化疗组合放疗不被认为是针对宫颈癌的在先全身疗法。在一些实施方式中,对象先前已经用化疗和/或放疗治疗。在一些实施方式中,对象对用化疗和放疗的治疗没有缓解。在一些实施方式中,对象接受过宫颈癌的化疗治疗并对化疗没有缓解。在一些实施方式中,对象接受过宫颈癌的放射治疗,但对放射没有缓解。在一些实施方式中,对象在用化疗和放疗治疗后复发。在一些实施方式中,对象接受过宫颈癌的化疗治疗并在用化疗治疗后复发。在一些实施方式中,对象接受过宫颈癌的放射治疗,但在放射治疗后复发。在一些实施方式中,对象在用化疗和/或放疗治疗后经历疾病进展。在一些实施方式中,对象接受过宫颈癌的化疗治疗并在用化疗治疗后经历疾病进展。在一些实施方式中,对象接受过宫颈癌的放射治疗并在放射治疗后经历了疾病进展。在一些实施方式中,对象先前已经用一种或多种治疗剂治疗宫颈癌。在一些实施方式中,对象先前已经用一种或多种治疗剂治疗,但是对治疗没有缓解。在一些实施方式中,对象先前已经用一种或多种治疗剂治疗,治疗后复发。在一些实施方式中,对象先前已经用一种或多种治疗剂治疗,治疗期间经历疾病进展。在一些实施方式中,一种或多种治疗剂选自下组:化学治疗剂、培美曲塞、白蛋白结合型紫杉醇、长春瑞滨、贝伐单抗、顺铂、卡铂、紫杉醇、拓扑替康、贝伐单抗和紫杉醇的组合、贝伐单抗和顺铂的组合、贝伐单抗和卡铂的组合、紫杉醇和拓扑替康的组合、贝伐单抗和拓扑替康的组合、贝伐单抗和顺铂和紫杉醇的组合、贝伐单抗和卡铂和紫杉醇的组合、以及贝伐单抗和紫杉醇和拓扑替康的组合。在一些实施方式中,一种或多种治疗剂是化学治疗剂。在一些实施方式中,一种或多种治疗剂是贝伐单抗。在一些实施方式中,一种或多种治疗剂是顺铂,在一些
实施方式中,一种或多种治疗剂是卡铂。在一些实施方式中,一种或多种治疗剂是紫杉醇。在一些实施方式中,一种或多种治疗剂是拓扑替康。在一些实施方式中,一种或多种治疗剂是贝伐单抗和紫杉醇的组合。在一些实施方式中,一种或多种治疗剂是贝伐单抗和顺铂的组合。在一些实施方式中,一种或多种治疗剂是贝伐单抗和卡铂的组合。在一些实施方式中,一种或多种治疗剂是紫杉醇和拓扑替康的组合。在一些实施方式中,一种或多种治疗剂是贝伐单抗和拓扑替康的组合。在一些实施方式中,一种或多种治疗剂是贝伐单抗、顺铂和紫杉醇的组合。在一些实施方式中,一种或多种治疗剂是贝伐单抗、卡铂和紫杉醇的组合。在一些实施方式中,一种或多种治疗剂是贝伐单抗、紫杉醇和拓扑替康的组合。在一些实施方式中,对象不是治愈性疗法的候选人。在一些实施方式中,治愈性疗法是放射治疗和/或内脏切除疗法。在一些实施方式中,治愈性疗法是放射治疗。在一些实施方式中,治愈性疗法是内脏切除疗法。在特定实施方式中,对象是人。
[0223]
c.给药途径
[0224]
本文所述的基于铂的试剂和/或本文所述的抗tf抗体-药物偶联物或其抗原结合片段可以通过任何合适的途径和方式给药。给予本发明的基于铂的试剂和/或抗体-药物偶联物的合适途径是本领域众所周知的,并且可以由本领域普通技术人员选择。在一个实施方式中,基于铂的试剂和/或抗tf抗体药物偶联物肠胃外给予。胃肠外给药是指除肠道和局部给药外的给药形式,通常通过注射,包括但不限于表皮、静脉内、肌肉内、动脉内、鞘内、囊内、眼内、心脏内、皮内、腹膜内、肌腱内、经气管、皮下、表皮下、关节内、囊下(subcapsular)、蛛网膜下、脊柱内、颅内、胸腔内、硬膜外和胸骨内注射和输注。在一些实施方式中,本文所述的抗tf抗体-药物偶联物或其抗原结合片段的给药途径是静脉内注射或输注。在一些实施方式中,本文所述的抗tf抗体-药物偶联物或其抗原结合片段的给药途径是静脉内输注。在一些实施方式中,本文所述基于铂的试剂的给药途径是静脉内注射或输注。在一些实施方式中,本文所述基于铂的试剂的给药途径是静脉内输注。
[0225]
d.给药频率和剂量
[0226]
在一个方面中,本发明提供用特定剂量的本文所述的抗tf抗体-药物偶联物或其抗原结合片段和本文所述的基于铂的试剂来治疗患有本文所述癌症的对象的方法,其中以特定频率向所述对象给予本文所述的抗体-药物偶联物或其抗原结合片段和本文所述的基于铂的试剂。
[0227]
在本文提供的方法或用途或用于用途的产品的一个实施方式中,以约0.5mg/kg至约2.1mg/kg对象体重范围内的剂量向所述对象给予本文所述的抗tf抗体-药物偶联物或其抗原结合片段。在某些实施方式中,剂量为约0.5mg/kg、约0.6mg/kg、约0.65mg/kg、约0.7mg/kg、约0.8mg/kg、约0.9mg/kg、约1.0mg/kg、约1.1mg/kg、约1.2mg/kg、约1.3mg/kg、约1.4mg/kg、约1.5mg/kg、约1.6mg/kg、约1.7mg/kg、约1.8mg/kg、约1.9mg/kg、约2.0mg/kg或约2.1mg/kg。在某些实施方式中,剂量为0.5mg/kg、0.6mg/kg、0.65mg/kg、0.7mg/kg、0.8mg/kg、0.9mg/kg、1.0mg/kg、1.1mg/kg、1.2mg/kg、1.3mg/kg、1.4mg/kg、1.5mg/kg、1.6mg/kg、1.7mg/kg、1.8mg/kg、1.9mg/kg、2.0mg/kg或2.1mg/kg。在一个实施方式中,剂量为约0.65mg/kg。在一个实施方式中,剂量为0.65mg/kg。在一个实施方式中,剂量为约0.65mg/kg,并且抗tf抗体-药物偶联物是替索土单抗维多汀。在一个实施方式中,剂量为0.65mg/kg,并且抗tf抗体-药物偶联物是替索土单抗维多汀。在一个实施方式中,剂量为约0.9mg/
kg。在一个实施方式中,剂量为0.9mg/kg。在一个实施方式中,剂量为约0.9mg/kg,并且抗tf抗体-药物偶联物是替索土单抗维多汀。在一个实施方式中,剂量为0.9mg/kg,并且抗tf抗体-药物偶联物是替索土单抗维多汀。在一个实施方式中,剂量为约1.2mg/kg。在一个实施方式中,剂量为1.2mg/kg。在一个实施方式中,剂量为约1.2mg/kg,并且抗tf抗体-药物偶联物是替索土单抗维多汀。在一个实施方式中,剂量为1.2mg/kg,并且抗tf抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,对于体重超过100kg的对象,所给予的抗tf抗体-药物偶联物的剂量是如果对象体重为100kg则应当给予的量。在一些实施方式中,对于体重超过100kg的对象,所给予的抗tf抗体-药物偶联物的剂量为65mg、90mg或120mg。
[0228]
在本文提供的方法或用途或用途产品的一些实施方式中,约每1周一次向对象给予如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是约1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间约为28天(包括休止期)。在本文提供的方法或用途或用途产品的一个实施方式中,每1周一次向对象给予如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为28天(包括休止期)。因此,提供了一种给药方案,其中向待治疗的对象以单周剂量给药持续连续三周,随后是休止周。此治疗方案在本文中也可称为“剂量密集方案”,并且与“4周(28天)周期”和“3q4w”相同。在一个实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在约4周周期的约第1、8和15天给予对象。在一个实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在4周周期的第1、8和15天给予对象。本发明包含实施方式,其中对象以3q4w治疗周期保持至少2、3、4、5、6、7、8、9、10、11、12或更多周期。在另一实施方式中,对象以3q4w治疗周期保持2至48个周期,例如2至36个周期,例如2至24个周期,例如2至15个周期,例如2至12个周期,例如2个周期、3个周期、4个周期、5个周期、6个周期、7个周期、8个周期、9个周期、10个周期,11个周期或12个周期,其中每个周期为28天,如上所述。在一些实施方式中,对象以3q4w治疗周期保持12个周期或更多,例如16个周期或更多,例如24个周期或更多,例如36个周期或更多。在一些实施方式中,给予3q4w治疗周期不超过3、不超过4、不超过5或不超过6个四周治疗周期。适合任何特定对象或对象群体的治疗周期的数量可由本领域的技术人员,通常是医生来确定。
[0229]
在一些实施方式中,约每周一次向对象给予约1.2mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是约1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间约为28天(包括休止期)。在一些实施方式中,约每周一次向对象给予约1.2mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为28天(包括休止期)。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在约4周周期的约第1、8和15天以约1.2mg/kg的剂量给予对象。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在4周周期的第1、8和15天以约1.2mg/kg的剂量给予对象。在一些实施方式中,约每周一次向对象给予1.2mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是约1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为约28天(包括休止期)。在一些实施方式中,每周一次向对象给
予1.2mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为28天(包括休止期)。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在约4周周期的约第1、8和15天以1.2mg/kg的剂量给予对象。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在4周周期的第1、8和15天以1.2mg/kg的剂量给予对象。在一些实施方式中,约每周一次向对象给予约0.9mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是约1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间约为28天(包括休止期)。在一些实施方式中,每周一次向对象给予约0.9mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为28天(包括休止期)。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在约4周周期的约第1、8和15天以约0.9mg/kg的剂量给予对象。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在4周周期的第1、8和15天以约0.9mg/kg的剂量给予对象。在一些实施方式中,约每周一次向对象给予0.9mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是约1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为约28天(包括休止期)。在一些实施方式中,每周一次向对象给予0.9mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为28天(包括休止期)。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在约4周周期的约第1、8和15天以0.9mg/kg的剂量给予对象。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在4周周期的第1、8和15天以0.9mg/kg的剂量给予对象。在一些实施方式中,约每周一次向对象给予约0.65mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是约1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间约为28天(包括休止期)。在一些实施方式中,每周一次向对象给予约0.65mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为28天(包括休止期)。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在约4周周期的约第1、8和15天以约0.65mg/kg的剂量给予对象。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在4周周期的第1、8和15天以约0.65mg/kg的剂量给予对象。在一些实施方式中,约每周一次向对象给予0.65mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是约1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为约28天(包括休止期)。在一些实施方式中,每周一次向对象给予0.65mg/kg剂量的如本文所述的抗-tf抗体药物偶联物或其抗原结合片段,持续连续3周,随后是1周的休止期,其中不给予抗-tf抗体药物偶联物或其抗原结合片段,使得每个周期时间为28天(包括休止期)。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在约4周周期的约第1、8和15天以0.65mg/kg的剂量给予对象。在一些实施方式中,如本文所述的抗tf抗体-药物偶联物或其抗原结合片段在4周周
期的第1、8和15天以0.65mg/kg的剂量给予对象。在一些实施方式中,剂量为约0.9mg/kg,并且在约4周周期的约第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为约0.9mg/kg,并且在4周周期的第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为0.9mg/kg,并且在约4周周期的约第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为0.9mg/kg,并且在4周周期的第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为0.9mg/kg,并且在约4周周期的约第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀,并且如果发生一个或多个不良事件则剂量降至0.65mg/kg。在一些实施方式中,剂量为0.9mg/kg,并且在4周周期的第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀,并且如果发生一个或多个不良事件则剂量降至0.65mg/kg。在一些实施方式中,剂量为约0.65mg/kg,并且在约4周周期的约第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为约0.65mg/kg,并且在4周周期的第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为0.65mg/kg,并且在约4周周期的约第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为0.65mg/kg,并且在4周周期的第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为约1.2mg/kg,并且在约4周周期的约第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为约1.2mg/kg,并且在4周周期的第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为1.2mg/kg,并且在约4周周期的约第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,剂量为1.2mg/kg,并且在4周周期的第1、8和15天给予,并且抗体-药物偶联物是替索土单抗维多汀。在一些实施方式中,对于体重超过100kg的对象,所给予的抗tf抗体-药物偶联物的剂量是如果对象体重为100kg则应当给予的量。在一些实施方式中,对于体重超过100kg的对象,所给予的抗tf抗体-药物偶联物的剂量为65mg、90mg或120mg。
[0230]
在本文所提供的方法或用途或用于用途的产品的一实施方式中,本文所述基于铂的试剂如卡铂以基于下述卡尔弗特公式(calvert formula)的剂量给予对象:
[0231]
基于铂的试剂的剂量(mg)=(目标auc)x(gfr 25),
[0232]
其中auc表示“浓度相对时间曲线下面积”(auc以mg/ml
·
分钟表示),而gfr表示“肾小球滤过率”(gfr以ml/分钟表示)。在一些实施方式中,gfr通过计算肌酸清除率估算。在一些实施方式中,血清肌酸(creatine)通过idms方法测量。在一些实施方式中,本文所述基于铂的试剂(例如卡铂)以介于约auc=4和约auc=6之间的剂量给予。在一些实施方式中,本文所述的基于铂的试剂(例如卡铂)的剂量约为auc=4、auc=4.5、auc=5、auc=5.5或auc=6中的任一个。在一些实施方式中,本文所述的基于铂的试剂(诸如卡铂)的剂量为约auc=5。在一些实施方式中,本文所述的基于铂的试剂(诸如卡铂)的剂量为auc=5。在一些实施方式中,剂量为约auc=4,并且约每1周给予一次。在一些实施方式中,剂量为约auc=4,并且约每2周给予一次。在一些实施方式中,剂量为约auc=4,并且约每3周给予一次。在一些实施方式中,剂量为约auc=4,并且约每4周给予一次。在一些实施方式中,剂量为约auc=4.5,并且约每1周给予一次。在一些实施方式中,剂量为约auc=4.5,并且约每2周给予一次。在一些实施方式中,剂量为约auc=4.5,并且约每3周给予一次。在一些实施方式
中,剂量为约auc=4.5,并且约每4周给予一次。在一些实施方式中,剂量为约auc=5,并且约每1周给予一次。在一些实施方式中,剂量为约auc=5,并且约每2周给予一次。在一些实施方式中,剂量为约auc=5,并且约每3周给予一次。在一些实施方式中,剂量为约auc=5,并且约每4周给予一次。在一些实施方式中,剂量为约auc=5.5,并且约每1周给予一次。在一些实施方式中,剂量为约auc=5.5,并且约每2周给予一次。在一些实施方式中,剂量为约auc=5.5,并且约每3周给予一次。在一些实施方式中,剂量为约auc=5.5,并且约每4周给予一次。在一些实施方式中,剂量为约auc=6,并且约每1周给予一次。在一些实施方式中,剂量为约auc=6,并且约每2周给予一次。在一些实施方式中,剂量为约auc=6,并且约每3周给予一次。在一些实施方式中,剂量为约auc=6,并且约每4周给予一次。在一些实施方式中,本文所述的基于铂的试剂(例如卡铂)的剂量为auc=4、auc=4.5、auc=5、auc=5.5或auc=6中的任一个。在一些实施方式中,本文所述的基于铂的试剂(诸如卡铂)的剂量为auc=5。在一些实施方式中,本文所述的基于铂的试剂(诸如卡铂)的剂量为auc=5。在一些实施方式中,剂量为auc=4,并且约每1周给予一次。在一些实施方式中,剂量为auc=4,并且约每2周给予一次。在一些实施方式中,剂量为auc=4,并且约每3周给予一次。在一些实施方式中,剂量为auc=4,并且约每4周给予一次。在一些实施方式中,剂量为auc=4.5,并且约每1周给予一次。在一些实施方式中,剂量为auc=4.5,并且约每2周给予一次。在一些实施方式中,剂量为auc=4.5,并且约每3周给予一次。在一些实施方式中,剂量为auc=4.5,并且约每4周给予一次。在一些实施方式中,剂量为auc=5,并且约每1周给予一次。在一些实施方式中,剂量为auc=5,并且约每2周给予一次。在一些实施方式中,剂量为auc=5,并且约每3周给予一次。在一些实施方式中,剂量为auc=5,并且约每4周给予一次。在一些实施方式中,剂量为auc=5.5,并且约每1周给予一次。在一些实施方式中,剂量为auc=5.5,并且约每2周给予一次。在一些实施方式中,剂量为auc=5.5,并且约每3周给予一次。在一些实施方式中,剂量为auc=5.5,并且约每4周给予一次。在一些实施方式中,剂量为auc=6,并且约每1周给予一次。在一些实施方式中,剂量为auc=6,并且约每2周给予一次。在一些实施方式中,剂量为auc=6,并且约每3周给予一次。在一些实施方式中,剂量为auc=6,并且约每4周给予一次。在一些实施方式中,剂量为auc=5,并且约每3周(如
±
3天)给药一次。在一些实施方式中,剂量为auc=5,并且每3周给药一次。在一些实施方式中,剂量为auc=5,并且每3周给药一次,基于铂的试剂是卡铂。在一些实施方式中,剂量为auc=5,在约21天周期(如
±
3天)的约第1天给药。在一些实施方式中,剂量为auc=5,在21天周期的第1天给药。在一些实施方式中,剂量为auc=5,在21天周期的第1天给药,基于铂的试剂是卡铂。
[0233]
在本文所提供的方法或用途或用于用途的产品的一个实施方式中,本文所述基于铂的试剂以范围为约50mg至约900mg的平剂量给予对象,如以约50mg的平剂量或约60mg的平剂量或约70mg的平剂量或约80mg的平剂量或约90mg的平剂量或约100mg的平剂量或约120mg的平剂量或约140mg的平剂量或约160mg的平剂量或约180mg的平剂量或约200mg的平剂量或约220mg的平剂量或约240mg的平剂量或约260mg的平剂量或约280mg的平剂量或约300mg的平剂量或约320mg的平剂量或约340mg的平剂量或约360mg的平剂量或约380mg的平剂量或约400mg的平剂量或约420mg的平剂量或约440mg的平剂量或约460mg的平剂量或约480mg的平剂量或约500mg的平剂量或约520mg的平剂量或约540mg的平剂量或约560mg的平剂量或约580mg的平剂量或约600mg的平剂量或约620mg的平剂量或约640mg的平剂量或约
660mg的平剂量或约680mg的平剂量或约700mg的平剂量或约720mg的平剂量或约740mg的平剂量或约750mg的平剂量或约760mg的平剂量或约780mg的平剂量或约800mg的平剂量或约820mg的平剂量或约840mg的平剂量或约860mg的平剂量或约880mg的平剂量或约900mg的平剂量。在本文所提供的方法或用途或用于用途的产品的一个实施方式中,本文所述基于铂的试剂以范围为50mg-900mg的平剂量给予对象,如以50mg的平剂量或60mg的平剂量或70mg的平剂量或80mg的平剂量或90mg的平剂量或100mg的平剂量或120mg的平剂量或140mg的平剂量或160mg的平剂量或180mg的平剂量或200mg的平剂量或220mg的平剂量或240mg的平剂量或260mg的平剂量或280mg的平剂量或300mg的平剂量或320mg的平剂量或340mg的平剂量或360mg的平剂量或380mg的平剂量或400mg的平剂量或420mg的平剂量或440mg的平剂量或460mg的平剂量或480mg的平剂量或500mg的平剂量或520mg的平剂量或540mg的平剂量或560mg的平剂量或580mg的平剂量或600mg的平剂量或620mg的平剂量或640mg的平剂量或660mg的平剂量或680mg的平剂量或700mg的平剂量或720mg的平剂量或740mg的平剂量或750mg的平剂量或760mg的平剂量或780mg的平剂量或800mg的平剂量或820mg的平剂量或840mg的平剂量或860mg的平剂量或880mg的平剂量或900mg的平剂量。在一些实施方式中,平剂量为750mg。在一些实施方式中,平剂量是750mg,并且基于铂的试剂是卡铂。在一些实施方式中,平剂量为约600mg,并且约每1周给予一次。在一些实施方式中,平剂量为约600mg,并且约每2周给予一次。在一些实施方式中,平剂量为约600mg,并且约每3周给予一次。在一些实施方式中,平剂量为约600mg,并且约每4周给予一次。在一些实施方式中,平剂量为约750mg,并且约每1周给予一次。在一些实施方式中,平剂量为约750mg,并且约每2周给予一次。在一些实施方式中,平剂量为约750mg,并且约每3周给予一次。在一些实施方式中,平剂量为约750mg,并且约每4周给予一次。在一些实施方式中,平剂量为600mg,并且约每1周给予一次。在一些实施方式中,平剂量为600mg,并且约每2周给予一次。在一些实施方式中,平剂量为600mg,并且约每3周给予一次。在一些实施方式中,平剂量为600mg,并且约每4周给予一次。在一些实施方式中,平剂量为750mg,并且约每1周给予一次。在一些实施方式中,平剂量为750mg,并且约每2周给予一次。在一些实施方式中,平剂量为750mg,并且约每3周给予一次。在一些实施方式中,平剂量为750mg,并且约每4周给予一次。在一些实施方式中,平剂量为750mg,并且约每3周(例如,
±
3天)给予一次。在一些实施方式中,平剂量为750mg,并且每3周给予一次。在一些实施方式中,平剂量为750mg,并且每3周给药一次,基于铂的试剂是卡铂。在一些实施方式中,平剂量为750mg,在约21天周期(例如,
±
3天)的约第1天给药。在一些实施方式中,平剂量为750mg,在21天周期的第1天给药。在一些实施方式中,平剂量为750mg,在21天周期的第1天给药,基于铂的试剂是卡铂。
[0234]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为0.65mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为0.65mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为0.65mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何
抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是0.65mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是0.65mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是0.65mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0235]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为0.7mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,大约每3周(例如,
±
3天)给药一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为0.7mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为0.7mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是0.7mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是0.7mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是0.7mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0236]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为0.8mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为0.8mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为0.8mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是0.8mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是0.8mg/kg并
且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是0.8mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0237]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为0.9mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为0.9mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为0.9mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是0.9mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是0.9mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是0.9mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0238]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.0mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.0mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为1.0mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.0mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.0mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是1.0mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0239]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.1mg/kg,约每1
周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.1mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为1.1mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.1mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.1mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是1.1mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0240]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.2mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.2mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为1.2mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.2mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.2mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是1.2mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0241]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.3mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.3mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于
铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为1.3mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.3mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.3mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是1.3mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0242]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.4mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.4mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为1.4mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.4mg/kg并且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.4mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是1.4mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0243]
在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.5mg/kg,约每1周给药一次,持续连续3周,然后是约1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间约为28天(包括休止期),基于铂类的试剂的剂量为auc=5,约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量为1.5mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),基于铂类的试剂的剂量为auc=5,每3周给药一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量为1.5mg/kg,每1周给药一次,持续连续3周,然后是1周的休止期,其中不给予任何抗tf抗体-药物偶联物或其抗原结合片段,从而每个周期时间为28天(包括休止期),抗体-药物偶联物是替索土单抗维多汀,基于铂类的试剂的剂量为auc=5,每3周给药一次,基于铂类的试剂是卡铂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.5mg/kg并
且约4周周期的约第1、8和15天给予,基于铂的试剂的剂量为auc=5且约每3周(例如,
±
3天)给予一次。在一些实施方式中,本文所述的抗tf抗体-药物偶联物的剂量是1.5mg/kg并且在4周周期的第1、8和15天给予,基于铂的试剂的剂量为auc=5且每3周给予一次。在一些实施方式中,抗tf抗体-药物偶联物的剂量是1.5mg/kg并且在4周周期的第1、8和15天给予,抗体-药物偶联物为替索土单抗维多汀,且基于铂的试剂的剂量为auc=5且每3周给予一次,基于铂的试剂为卡铂。
[0244]
在一些实施方式中,共同给予本文所述的抗tf抗体-药物偶联物或其抗原结合片段和本文所述的基于铂的试剂。在一些实施方式中,共同给药是同时的或依次的。在一些实施方式中,本文所述的抗tf抗体-药物偶联物与本文所述的基于铂的试剂同时给予。在一些实施方式中,同时意指抗tf抗体-药物偶联物和基于铂的试剂以小于1小时的间隔,如小于约30分钟的间隔、小于约15分钟的间隔、小于约10分钟的间隔或小于约5分钟的间隔给予对象。在一些实施方式中,本文所述的抗tf抗体-药物偶联物与本文所述的基于铂的试剂依次给予。在一些实施方式中,依次给予意指抗tf抗体-药物偶联物和基于铂的试剂以至少1小时的间隔、至少2小时的间隔、至少3小时的间隔、至少4小时的间隔、至少5小时的间隔、至少6小时的间隔、至少7小时的间隔、至少8小时的间隔、至少9小时的间隔、至少10小时的间隔、至少11小时的间隔、至少12小时的间隔、至少13小时的间隔、至少14小时的间隔、至少15小时的间隔、至少16小时的间隔、至少17小时的间隔、至少18小时的间隔、至少19小时的间隔、至少20小时的间隔、至少21小时的间隔、至少22小时的间隔、至少23小时的间隔、至少24小时的间隔、至少2天的间隔、至少3天的间隔、至少4天的间隔、至少5天的间隔、至少5天的间隔、至少7天的间隔、至少2周的间隔、至少3周的间隔或至少4周的间隔给药。
[0245]
在一些实施方式中,本文所述的治疗方法或用途或用于用途的产品还包括给予一种或多种其他治疗剂。在一些实施方式中,一种或多种其他治疗剂与本文所述的抗tf抗体-药物偶联物或其抗原结合片段(例如替索土单抗维多汀)和如本文所述基于铂的试剂(例如卡铂)同时给予。在一些实施方式中,一种或多种其他治疗剂与本文所述的抗tf抗体-药物偶联物(例如替索土单抗维多汀)或其抗原结合片段和如本文所述基于铂的试剂(例如卡铂)依次给予。
[0246]
e.治疗转归
[0247]
一方面,用本文所述抗tf抗体-药物偶联物(例如例如替索土单抗维多汀)或其抗原结合片段,和本文所述基于铂的试剂(例如例如卡铂)治疗癌症的方法导致对象中一种或多种治疗效果在给予抗体-药物偶联物和/或基于铂的试剂后相对于基线得到改善。在一些实施方式中,一种或多种治疗效果是源自癌症(例如膀胱癌或宫颈癌)的肿瘤的大小、客观缓解率、缓解持续时间、达到缓解时间、无进展生存期、总生存期或其任意组合。在一个实施方式中,一种或多种治疗效果是源自癌症的肿瘤的大小。在一个实施方式中,一种或多种治疗效果是减小肿瘤大小。在一个实施方式中,一种或多种治疗效果是稳定的疾病。在一个实施方式中,一种或多种治疗效果是部分缓解。在一个实施方式中,一种或多种治疗效果是完全缓解。在一个实施方式中,一种或多种治疗效果是客观缓解率。在一个实施方式中,一种或多种治疗效果是缓解持续时间。在一个实施方式中,一种或多种治疗效果是达到缓解时间。在一个实施方式中,一种或多种治疗效果是无进展生存期。在一个实施方式中,一种或多种治疗效果是总生存期。在一个实施方式中,一种或多种治疗效果是癌症消退。
[0248]
在本文提供的方法或用途或用于用途的产品的一个实施方式中,对于用本文所述的抗tf抗体-药物偶联物(例如,替索土单抗维多汀)或其抗原结合片段和本文所述的基于铂的试剂(例如,卡铂)进行治疗的缓解可包括以下标准(recist标准1.1):
[0249][0250][0251]
在本文提供的方法或用途或用于用途的产品的一个实施方式中,通过测定客观缓解率来评估用本文所述的抗tf抗体-药物偶联物(例如,替索土单抗维多汀)或其抗原结合片段和本文所述的基于铂的试剂(例如,卡铂)进行治疗的有效性。在一些实施方式中,客观缓解率是肿瘤大小在最短时间内减少了预定数量的患者的比例。在一些实施方式中,客观缓解率基于recist 1.1版。在一个实施方式中,客观缓解率为至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。在一个实施方式中,客观缓解率为至少约20%-80%。在一个实施方式中,客观缓解率为至少约30%-80%。在一个实施方式中,客观缓解率为至少约40%-80%。在一个实施方式中,客观缓解率为至少约50%-80%。在一个实施方式中,客观缓解率为至少约60%-80%。在一个实施方式中,客观缓解率为至少约70%-80%。在一个实施方式中,客观缓解率为至少约80%。在一个实施方式中,客观缓解率为至少约85%。在一个实施方式中,客观缓解率为至少约90%。在一个实施方式中,客观缓解率为至少约95%。在一个实施方式中,客观缓解率为至少约98%。在一个实施方式中,客观缓解率为至少约99%。在一个实施方式中,客观缓解率为至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%或至少80%。在一个实施方式中,客观缓解率为至少20%-80%。
在一个实施方式中,客观缓解率为至少30%-80%。在一个实施方式中,客观缓解率为至少40%-80%。在一个实施方式中,客观缓解率为至少50%-80%。在一个实施方式中,客观缓解率为至少60%-80%。在一个实施方式中,客观缓解率为至少70%-80%。在一些实施方式中,客观缓解率为至少80%。在一些实施方式中,客观缓解率为至少85%。在一些实施方式中,客观缓解率为至少90%。在一些实施方式中,客观缓解率为至少95%。在一些实施方式中,客观缓解率为至少98%。在一些实施方式中,客观缓解率为至少99%。在一些实施方式中,客观缓解率为100%。
[0252]
在本文提供的方法或用途或用于用途的产品的一个实施方式中,通过测定源自癌症(例如,膀胱癌或宫颈癌)的肿瘤的大小来评估用本文所述的抗tf抗体-药物偶联物或其抗原结合片段(例如,替索土单抗维多汀)和本文所述的基于铂的试剂(例如,卡铂)进行治疗的缓解。在一个实施方式中,相对于给予抗tf抗体-药物偶联物和/或基于铂的试剂之前源自癌症的肿瘤的大小,源自癌症的肿瘤的大小减小至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约10%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约20%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约30%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约40%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约50%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约60%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约70%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约85%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约90%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约95%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约98%。在一个实施方式中,源自癌症的肿瘤的大小减小至少约99%。在一个实施方式中,相对于给予抗tf抗体-药物偶联物和/或基于铂的试剂之前源自癌症的肿瘤的大小,源自癌症的肿瘤的大小减小至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%或至少80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少10%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少20%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少30%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少40%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少50%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少60%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少70%-80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少80%。在一个实施方式中,源自癌症的肿瘤的大小减小至少85%。在一个实施方式中,源自癌症的肿瘤的大小减小至少90%。在一个实施方式中,源自癌症的肿瘤的大小减小至少95%。在一个实施方式中,源自癌症的肿瘤的大小减小至少98%。在一个实施方式中,源自癌症的肿瘤的大小减小至少99%。在一个实施方式中,源自癌症的肿瘤的大小减小100%。在一个实施方式中,源自癌症的肿瘤的大小通过核磁共振成像(mri)来测定。在一个实施方式中,源自癌症的肿瘤的大小通过计算机断层扫描(ct)来测定。在一些实施方式中,源自宫颈癌的肿瘤的大小通过骨盆检查来测定。参见choi等,2008,j.gynecol.oncol.19(3):205。在一些实施方式中,源自膀胱癌的肿瘤的大小通过膀胱镜检查或细胞学来测定。
参见us 2017/0181988。在一些实施方式中,相对于给予本文所述抗tf抗体药物偶联物和基于铂的试剂之前的肿瘤的大小,源自癌症的肿瘤的大小减小。在一些实施方式中,相对于给予抗tf抗体药物偶联物之前的肿瘤的大小,源自癌症的肿瘤的大小减小。在一些实施方式中,相对于给予基于铂的试剂之前的肿瘤的大小,源自癌症的肿瘤的大小减小。
[0253]
在本文提供的方法或用途或用于用途的产品的一个实施方式中,用本文所述的抗体-药物偶联物或其抗原结合片段(例如,替索土单抗维多汀)和本文所述的基于铂的试剂(例如,卡铂)进行治疗的缓解促进源自癌症(例如,膀胱癌或宫颈癌)的肿瘤消退。在一个实施方式中,相对于给予抗tf抗体-药物偶联物和/基于铂的试剂之前源自癌症的肿瘤的大小,源自癌症的肿瘤消退至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。在一个实施方式中,源自癌症的肿瘤消退至少约10%至约80%。在一个实施方式中,源自癌症的肿瘤消退至少约20%至约80%。在一个实施方式中,源自癌症的肿瘤消退至少约30%至约80%。在一个实施方式中,源自癌症的肿瘤消退至少约40%至约80%。在一个实施方式中,源自癌症的肿瘤消退至少约50%至约80%。在一个实施方式中,源自癌症的肿瘤消退至少约60%至约80%。在一个实施方式中,源自癌症的肿瘤消退至少约70%至约80%。在一个实施方式中,源自癌症的肿瘤消退至少约80%。在一个实施方式中,源自癌症的肿瘤消退至少约85%。在一个实施方式中,源自癌症的肿瘤消退至少约90%。在一个实施方式中,源自癌症的肿瘤消退至少约95%。在一个实施方式中,源自癌症的肿瘤消退至少约98%。在一个实施方式中,源自癌症的肿瘤消退至少约99%。在一个实施方式中,相对于给予抗tf抗体-药物偶联物和/或基于铂的试剂之前源自癌症的肿瘤的大小,源自癌症的肿瘤消退至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%或至少80%。在一个实施方式中,源自癌症的肿瘤消退至少10%-80%。在一个实施方式中,源自癌症的肿瘤消退至少20%-80%。在一个实施方式中,源自癌症的肿瘤消退至少30%-80%。在一个实施方式中,源自癌症的肿瘤消退至少40%-80%。在一个实施方式中,源自癌症的肿瘤消退至少50%-80%。在一个实施方式中,源自癌症的肿瘤消退至少60%-80%。在一个实施方式中,源自癌症的肿瘤消退至少70%-80%。在一个实施方式中,源自癌症的肿瘤消退至少80%。在一个实施方式中,源自癌症的肿瘤消退至少85%。在一个实施方式中,源自癌症的肿瘤消退至少90%。在一个实施方式中,源自癌症的肿瘤消退至少95%。在一个实施方式中,源自癌症的肿瘤消退至少98%。在一个实施方式中,源自癌症的肿瘤消退至少99%。在一个实施方式中,源自癌症的肿瘤消退100%。在一个实施方式中,肿瘤的消退通过用核磁共振成像(mri)测定肿瘤的大小来确定。在一个实施方式中,肿瘤的消退通过用计算机断层扫描(ct)测定肿瘤的大小来确定。在一个实施方式中,肿瘤的消退通过用骨盆检查测定肿瘤的大小来确定。参见choi等,2008,j.gynecol.oncol.19(3):205。在一些实施方式中,源自膀胱癌的肿瘤的大小通过膀胱镜检查或细胞学来测定。参见us 2017/0181988。在一些实施方式中,相对于给予抗tf抗体药物偶联物和基于铂的试剂之前的肿瘤的大小,源自癌症的肿瘤消退。在一些实施方式中,相对于给予抗tf抗体药物偶联物之前的肿瘤的大小,源自癌症的肿瘤消退。在一些实施方式中,相对于给予基于铂的试剂之前的肿瘤的大小,源自癌症的肿瘤消退。
[0254]
在本文所述的方法或用途或用于用途的产品的一个实施方式中,通过测定给予抗
tf抗体-药物偶联物和/或基于铂的试剂后无进展生存期的时间来评估用本文所述的抗tf抗体-药物偶联物或其抗原结合片段(例如,替索土单抗维多汀)和本文所述的基于铂的试剂(例如,卡铂)进行治疗的缓解。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约6个月的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约1年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约2年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约3年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约4年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约5年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少18个月、至少2年、至少3年、至少4年或至少5年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少6个月的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少1年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少2年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少3年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少4年的无进展生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少5年的无进展生存期。在一些实施方式中,通过测定给予抗tf抗体-药物偶联物和基于铂的试剂后无进展生存期的时间来评估治疗的缓解。在一些实施方式中,通过测定给予抗tf抗体-药物偶联物后无进展生存期的时间来评估治疗的缓解。在一些实施方式中,通过测定给予基于铂的试剂后无进展生存期的时间来评估治疗的缓解。
[0255]
在本文所述的方法或用途或用于用途的产品的一个实施方式中,通过测定给予抗tf抗体-药物偶联物和/或基于铂的试剂后总生存期的时间来评估用本文所述的抗tf抗体-药物偶联物或其抗原结合片段(例如,替索土单抗维多汀)和本文所述的基于铂的试剂(例如,卡铂)进行治疗的缓解。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约6个月的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约1年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约2年的总生存期。在一些实施方式中,在给予抗tf
抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约3年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约4年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少约5年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少18个月、至少2年、至少3年、至少4年或至少5年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少6个月的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少1年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少2年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少3年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少4年的总生存期。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对象展现出至少5年的总生存期。在一些实施方式中,通过测定给予抗tf抗体-药物偶联物和基于铂的试剂后总生存期的时间来评估治疗的缓解。在一些实施方式中,通过测定给予抗tf抗体-药物偶联物后总生存期的时间来评估治疗的缓解。在一些实施方式中,通过测定给予基于铂的试剂后总生存期的时间来评估治疗的缓解。
[0256]
在本文所述的方法或用途或用于用途的产品的一个实施方式中,通过测定给予抗tf抗体-药物偶联物和/或基于铂的试剂后对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间来评估用本文所述的抗tf抗体-药物偶联物或其抗原结合片段(例如,替索土单抗维多汀)和本文所述的基于铂的试剂(例如,卡铂)进行治疗的缓解。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少约6个月。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少约1年。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少约2年。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少约3年。在一些实施方式中,在给予抗体-药物偶联物后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少约4年。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少约5年。在一些实施方式中,在给予抗tf抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少1个月、至少2个月、至少3个月、至少4个月、至少5个月、至少6个月、至少7个月、至少8个月、至少9个月、至少10个月、至少11个月、至少12个月、至少18个月、至少2年、至少3年、至少4年或至少5年。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持
续时间为至少6个月。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少1年。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少2年。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少3年。在一些实施方式中,在给予抗体-药物偶联物后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少4年。在一些实施方式中,在给予抗体-药物偶联物和/或基于铂的试剂后,对抗tf抗体-药物偶联物和基于铂的试剂的缓解持续时间为至少5年。在一些实施方式中,给予抗tf抗体-药物偶联物和基于铂的试剂后评估治疗的缓解。在一些实施方式中,在给予抗tf抗体药物偶联物后测量缓解持续时间。在一些实施方式中,给予基于铂的试剂后评估缓解持续时间。
[0257]
f.不良事件
[0258]
一方面,用本文所述的抗tf抗体-药物偶联物或其抗原结合片段(例如,替索土单抗维多汀)和本文所述的基于铂的试剂(例如,卡铂)治疗癌症(例如,膀胱癌或宫颈癌)的方法导致对象发展出一个或多个不良事件。在一些实施方式中,向对象给予其他治疗剂以消除或降低不良事件的严重程度。在一些实施方式中,对象发展出的一个或多个不良事件是出血增多、出血、肝功能异常(例如,肝酶升高)、黏膜炎、中性粒细胞减少、发热性中性粒细胞减少、周围神经病变、血小板计数减少、呕吐、神经病变、结膜炎、角膜炎、结膜溃疡、睑球粘连、输注相关反应或整体健康恶化或其任意组合。在一些实施方式中,对象发展出的一个或多个不良事件是贫血、腹痛、出血、低钾血症、低钠血症、鼻出血、疲劳、恶心、脱发、结膜炎、角膜炎、结膜溃疡、便秘、食欲下降、腹泻、呕吐、中性粒细胞减少症、血小板计数减少、周围神经病变或全身健康状况恶化或其任意组合。在一些实施方式中,一个或多个不良事件是1级或更高级的不良事件。
[0259]
在一些实施方式中,一个或多个不良事件是2级或更高级的不良事件。在一些实施方式中,一个或多个不良事件是3级或更高级的不良事件。在一些实施方式中,一个或多个不良事件是1级不良事件。在一些实施方式中,一个或多个不良事件是2级不良事件。在一些实施方式中,一个或多个不良事件是3级不良事件。在一些实施方式中,一个或多个不良事件是4级不良事件。在一些实施方式中,一个或多个不良事件是严重的不良事件。在一些实施方式中,一个或多个不良事件是结膜炎、结膜溃疡和/或角膜炎,并且其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂、抗生素、类固醇滴眼剂或其任意组合。在一些实施方式中,一个或多个不良事件是结膜炎、结膜溃疡和角膜炎,并且其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂、抗生素、类固醇滴眼剂或其任意组合。在一些实施方式中,一个或多个不良事件是结膜炎和角膜炎,并且其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂、抗生素、类固醇滴眼剂或其任意组合。在一些实施方式中,一个或多个不良事件是结膜炎,并且其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂、抗生素、类固醇滴眼剂或其任意组合。在一些实施方式中,一个或多个不良事件是角膜炎,并且其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩药、抗生素、类固醇滴眼剂或其任意组合。在本文的任何实施方式的一些中,给予对象用其他治疗剂的治疗,以消除或降低不良事件(例如,结膜炎、结膜溃疡和/或角膜炎)的严重程度。在一些实施方式中,治疗是眼部冷却垫(例如,
thera pearl眼罩之类)。在一些实施方式中,一个或多个不良事件是与反复输注相关的反应,并且其他治疗剂是抗组胺药、对乙酰氨基酚和/或皮质类固醇。在一些实施方式中,一个或多个不良事件是中性粒细胞减少症,并且其他治疗剂是生长因子支持物(g-csf)。在一些实施方式中,一个或多个不良事件是甲状腺功能亢进症,并且其他试剂是非选择性β-阻断剂(例如,普萘洛尔)或硫代酰胺(thionamide)。在一些实施方式中,一个或多个不良事件是甲状腺功能减退症,并且其他试剂是甲状腺替代激素(例如,左旋甲状腺素或碘塞罗宁(liothyroinine))。
[0260]
在一个方面,用本文所述的抗tf抗体-药物偶联物或其抗原结合片段(例如,替索土单抗维多汀)和本文所述的基于铂的试剂(例如,卡铂)治疗的对象处于发展出一个或多个不良事件的风险中。在一些实施方式中,向对象给予其他治疗剂以防止不良事件的发展或降低不良事件的严重程度。在一些实施方式中,对象处于发展出一个或多个不良事件的风险中是出血增多、出血、肝功能异常(例如,肝酶升高)、黏膜炎、中性粒细胞减少、发热性中性粒细胞减少、周围神经病变、血小板计数减少、呕吐、神经病变、结膜炎、角膜炎、结膜溃疡、睑球粘连、输注相关反应或整体健康恶化或其任意组合。在一些实施方式中,对象处于发展出一个或多个不良事件的风险中是贫血、腹痛、出血、低钾血症、低钠血症、鼻出血、疲劳、恶心、脱发、结膜炎、角膜炎、结膜溃疡、便秘、食欲下降、腹泻、呕吐、中性粒细胞减少症、血小板计数减少、周围神经病变或全身健康状况恶化或其任意组合。在一些实施方式中,一个或多个不良事件是1级或更高级的不良事件。在一些实施方式中,一个或多个不良事件是2级或更高级的不良事件。在一些实施方式中,一个或多个不良事件是3级或更高级的不良事件。在一些实施方式中,一个或多个不良事件是1级不良事件。在一些实施方式中,一个或多个不良事件是2级不良事件。在一些实施方式中,一个或多个不良事件是3级不良事件。在一些实施方式中,一个或多个不良事件是4级不良事件。在一些实施方式中,一个或多个不良事件是严重的不良事件。在一些实施方式中,一个或多个不良事件是结膜炎、结膜溃疡和/或角膜炎,并且其他试剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂、抗生素、类固醇滴眼剂或其任意组合。在一些实施方式中,一个或多个不良事件是结膜炎和角膜炎,并且其他试剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂、抗生素、类固醇滴眼剂或其任意组合。在一些实施方式中,一个或多个不良事件是结膜炎,并且其他试剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂、抗生素、类固醇滴眼剂或其任意组合。在一些实施方式中,一个或多个不良事件是角膜炎,并且其他试剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂、抗生素、类固醇滴眼剂或其任意组合。在本文的任何实施方式的一些中,用其他治疗剂给予对象治疗以防止不良事件的发展或降低不良事件(例如,结膜炎、结膜溃疡和/或角膜炎)的严重程度。在一些实施方式中,治疗是眼部冷却垫(例如,thera pearl眼罩之类)。在一些实施方式中,一个或多个不良事件是与反复输注相关的反应,并且其他药剂是抗组胺药、对乙酰氨基酚和/或皮质类固醇。在一些实施方式中,一个或多个不良事件是中性粒细胞减少症,并且其他药剂是生长因子支持物(g-csf)。在一些实施方式中,一个或多个不良事件是甲状腺功能亢进症,并且其他试剂是非选择性β-阻断剂(例如,普萘洛尔)或硫代酰胺(thionamide)。在一些实施方式中,一个或多个不良事件是甲状腺功能减退症,并且其他试剂是甲状腺替代激素(例如,左旋甲状腺素或碘塞罗宁(liothyroinine))。
[0261]
iv.组合物
[0262]
在一些方面中,本文还提供包含任何本文所述的抗tf抗体-药物偶联物或其抗原结合片段(例如,替索土单抗维多汀)和/或本文所述的基于铂的试剂(例如,卡铂)的组合物(例如,药物组合物和治疗制剂)。
[0263]
通过将具有所需纯度程度的活性成分与任选的药学上可接受的运载体、赋形剂或稳定剂混合来制备治疗制剂以进行储存(雷明顿:《药学科学与实践》(the science and practice of pharmacy),第20版,lww出版社(lippincott williams&wiklins),gennaro编,宾夕法尼亚州费城,2000)。
[0264]
可接受的运载体、赋形剂或稳定剂在使用的剂量和浓度下对接受者无毒,包括缓冲剂、抗氧化剂(包括抗坏血酸、甲硫氨酸、维生素e、焦亚硫酸钠);防腐剂、等渗剂、稳定剂、金属络合物(例如,锌蛋白络合物);螯合剂,如edta和/或非离子表面活性剂。
[0265]
缓冲剂可用于将ph控制在达到最佳治疗有效性的范围内,尤其是在稳定性取决于ph的情况下。缓冲剂可以以约50mm至约250mm范围内的浓度存在。用于本发明的合适的缓冲剂包括有机和无机酸及其盐。例如柠檬酸盐、磷酸盐、琥珀酸盐、酒石酸盐、富马酸盐、葡萄糖酸盐、草酸盐、乳酸盐、乙酸盐。此外,缓冲剂可以由组氨酸和三甲胺盐如tris组成。
[0266]
可以添加防腐剂以防止微生物生长,并且防腐剂通常以约0.2%-1.0%(w/v)范围内的量存在。用于本发明的合适的防腐剂包括十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎卤铵(例如,苯扎氯铵、苯扎溴铵、苯扎碘铵)、苄索氯铵;硫柳汞、苯酚、丁醇或苯甲醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇、3-戊醇和间甲酚。
[0267]
可以存在张力剂,有时称为“稳定剂”,以调节或维持组合物中液体的张力。当与带电的大型生物分子(如蛋白质和抗体)一起使用时,它们通常被称为“稳定剂”,因为它们可以与氨基酸侧链的带电基团相互作用,从而减少分子间和分子内相互作用的可能性。将其他成分的相对量考虑在内,张力剂可以以约0.1重量%至约25重量%或约1重量%至约5重量%的任何量存在。在一些实施方式中,张力剂包括多元糖醇、三元或更高级的糖醇,例如甘油、赤藓糖醇、阿拉伯糖醇、木糖醇、山梨糖醇和甘露糖醇。
[0268]
其他赋形剂包括可用作以下一种或多种的试剂:(1)填充剂、(2)溶解度增强剂、(3)稳定剂和(4)防止变性或粘附在容器壁上的试剂。这样的赋形剂包括:多元糖醇(上面列举);氨基酸,例如丙氨酸、甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸、赖氨酸、鸟氨酸、亮氨酸,2-苯丙氨酸、谷氨酸、苏氨酸等;有机糖或糖醇,例如蔗糖、乳糖、乳糖醇、海藻糖、水苏糖、甘露糖、山梨糖、木糖、核糖、核糖醇、肌醇糖(myoinisitose)、肌-肌醇、半乳糖、半乳糖醇、甘油、环糖醇(例如,肌醇)、聚乙二醇;含硫的还原剂,例如脲、谷胱甘肽、硫辛酸、硫代乙醇酸钠、硫代甘油、α-单硫代甘油和硫代硫酸钠;低分子量蛋白质,例如人血清白蛋白、牛血清白蛋白、明胶或其他免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;单糖(例如木糖、甘露糖、果糖、葡萄糖;二糖(例如,乳糖、麦芽糖、蔗糖);三糖(例如,棉子糖);以及多糖(例如葡聚糖或右旋糖酐)。
[0269]
可以存在非离子表面活性剂或去污剂(也称为“湿润剂”),以帮助溶解治疗剂并保护治疗蛋白免于搅动引起的聚集,这也使制剂暴露于剪切表面应力而不会引起活性治疗性蛋白质或抗体的变性。非离子表面活性剂以约0.05mg/ml至约1.0mg/ml或约0.07mg/ml至约0.2mg/ml的范围存在。在一些实施方式中,非离子表面活性剂以约0.001%至约0.1%w/v或
约0.01%至约0.1%w/v或约0.01%至约0.025%w/v的范围存在。
[0270]
合适的非离子表面活性剂包括聚山梨酸酯(20、40、60、65、80等)、泊洛沙姆(184、188等)、多元醇、聚氧乙烯脱水山梨糖醇单醚(等)、聚桂醇400、聚乙二醇硬脂酸酯40(polyoxyl 40stearate)、聚氧乙烯氢化蓖麻油10、50和60、单硬脂酸甘油酯、蔗糖脂肪酸酯、甲基纤维素和羧甲基纤维素。可以使用的阴离子去污剂包括月桂基硫酸钠、琥珀酸二辛酯磺酸钠和磺酸二辛酯钠。阳离子去污剂包括苯扎氯铵和苄索氯铵。
[0271]
wo2015/075201中描述了用于本文提供的治疗方法的、包含本文所述的抗tf抗体-药物偶联物的制剂。在一些实施方式中,本文所述的抗tf抗体-药物偶联物是包含抗tf抗体-药物偶联物、组氨酸、蔗糖和d-甘露糖醇的制剂,其中所述制剂的ph为约6.0。在一些实施方式中,本文所述的抗tf抗体-药物偶联物是包含浓度约为10mg/ml的抗tf抗体-药物偶联物、浓度约为30mm的组氨酸、浓度约为88mm的蔗糖、浓度约为165mm的d-甘露糖醇的制剂,其中所述制剂的ph为约6.0。在一些实施方式中,本文所述的抗tf抗体-药物偶联物是包含浓度为10mg/ml的抗tf抗体-药物偶联物、浓度为30mm的组氨酸、浓度为88mm的蔗糖、浓度为165mm的d-甘露糖醇的制剂,其中所述制剂的ph为6.0。在一些实施方式中,制剂包含浓度约为10mg/ml的替索土单抗维多汀、浓度约为30mm的组氨酸、浓度约为88mm的蔗糖、浓度约为165mm的d-甘露糖醇,其中所述制剂的ph为6.0。
[0272]
在本文提供的一些实施方式中,本文所述的包含抗tf抗体-药物偶联物的制剂不包含表面活性剂(即不含表面活性剂)。
[0273]
用于体内给药的制剂必须是无菌的。可以通过用无菌滤膜过滤来使制剂无菌。本文的治疗剂组合物一般将被置于具有无菌进入端口的容器中,例如,具有可用皮下注射针头刺穿的塞子的静脉内溶液包或瓶中。
[0274]
给药途径是根据已知和公认的方法,例如通过长时间以适当方式单次或多次推注或输注,如通过皮下、静脉内、腹膜内、肌肉内、动脉内、病灶内或关节内途径进行注射或输注,局部给药,吸入或通过持续释放或延长释放的方式。
[0275]
根据所治疗的特定适应症的需要,本文的制剂也可以含有超过一种活性化合物,优选相互间不会产生不良影响的具有补充活性的化合物。或者或此外,组合物可以包含细胞毒性剂、细胞因子或生长抑制剂。这些分子适合以目标效果有效量存在于组合中。
[0276]
本发明提供包含本文所述的抗tf抗体-药物偶联物或其抗原结合片段的群体的组合物,用于本文所述的治疗宫颈癌的方法。在一些方面,本文提供包含抗体-药物偶联物群体的组合物,其中所述抗体-药物偶联物包含附接至mmae的接头,其中所述抗体-药物偶联物具有如下结构:
[0277][0278]
其中,p表示1至8的数字,例如,1、2、3、4、5、6、7或8,s表示抗tf抗体或其抗原结合片段的巯基残基,并且ab表示本文所述抗tf抗体(例如替索土单抗)或其抗原结合片段。在
一些实施方式中,p表示3至5的数字。在一些实施方式中,组合物中的p的平均值约为4。在一些实施方式中,群体是抗体-药物偶联物的混合群体,其中对于各抗体-药物偶联物,p在1至8之间变化。在一些实施方式中,群体是抗体-药物偶联物的均一群体,其中各抗体-药物偶联物的p具有相同数值。
[0279]
在一些实施方式中,将包含本文所述的抗tf抗体-药物偶联物(如替索土单抗维多汀)或其抗原结合片段的组合物和包含本文所述的基于铂的试剂(如替索土单抗维多汀)的组合物共给予。在一些实施方式中,共同给药是同时的或依次的。在一些实施方式中,本文所述的抗tf抗体-药物偶联物与基于铂的试剂同时给予。在一些实施方式中,同时意指抗tf抗体-药物偶联物和基于铂的试剂以小于约1小时的间隔,如小于约30分钟的间隔、小于约15分钟的间隔、小于约10分钟的间隔或小于约5分钟的间隔给予对象。在一些实施方式中,同时意指抗tf抗体-药物偶联物和基于铂的试剂以小于1小时的间隔,如小于30分钟的间隔、小于15分钟的间隔、小于10分钟的间隔或小于5分钟的间隔给予对象。在一些实施方式中,抗tf抗体-药物偶联物与基于铂的试剂依次给予。在一些实施方式中,依次给予意指抗tf抗体-药物偶联物和基于铂的试剂以至少1小时的间隔、至少2小时的间隔、至少3小时的间隔、至少4小时的间隔、至少5小时的间隔、至少6小时的间隔、至少7小时的间隔、至少8小时的间隔、至少9小时的间隔、至少10小时的间隔、至少11小时的间隔、至少12小时的间隔、至少13小时的间隔、至少14小时的间隔、至少15小时的间隔、至少16小时的间隔、至少17小时的间隔、至少18小时的间隔、至少19小时的间隔、至少20小时的间隔、至少21小时的间隔、至少22小时的间隔、至少23小时的间隔、至少24小时的间隔、至少2天的间隔、至少3天的间隔、至少4天的间隔、至少5天的间隔、至少5天的间隔、至少7天的间隔、至少2周的间隔、至少3周的间隔或至少4周的间隔给予。在一些实施方式中,包含本文所述的抗tf抗体-药物偶联物和/或本文所述的基于铂的试剂的组合物与一种或多种治疗剂共同给予,以消除或减轻一个或多个不良事件的严重程度。在一些实施方式中,包含本文所述的抗tf抗体-药物偶联物和/或本文所述的基于铂的试剂的组合物与一种或多种治疗剂共给予,以防止不良事件的发展或降低不良事件的严重程度。
[0280]
在一些实施方式中,将包含本文所述的抗tf抗体-药物偶联物(例如,替索土单抗维多汀)和/或本文所述的基于铂的试剂(例如,卡铂)的组合物与一种或多种其他治疗剂共给予。在一些实施方式中,共同给药是同时的或依次的。在一些实施方式中,本文所述抗tf抗体-药物偶联物和/或本文所述基于铂的试剂与一种或多种其他治疗剂同时给予。在一些实施方式中,同时意指抗tf抗体-药物偶联物和/或基于铂的试剂与一种或多种其他治疗剂以小于约1小时的间隔,如小于约30分钟的间隔、小于约15分钟的间隔、小于约10分钟的间隔或小于约5分钟的间隔给予对象。在一些实施方式中,抗tf抗体-药物偶联物和/或基于铂的试剂与一种或多种其他治疗剂依次给予。在一些实施方式中,同时意指抗tf抗体-药物偶联物和/或基于铂的试剂与一种或多种其他治疗剂以小于1小时的间隔,如小于30分钟的间隔、小于15分钟的间隔、小于10分钟的间隔或小于5分钟的间隔给予对象。在一些实施方式中,抗tf抗体-药物偶联物和/或基于铂的试剂与一种或多种其他治疗剂依次给予。在一些实施方式中,依次给予意指抗tf抗体-药物偶联物和/或基于铂的试剂与一种或多种其他治疗剂以至少1小时的间隔、至少2小时的间隔、至少3小时的间隔、至少4小时的间隔、至少5小时的间隔、至少6小时的间隔、至少7小时的间隔、至少8小时的间隔、至少9小时的间隔、至少
10小时的间隔、至少11小时的间隔、至少12小时的间隔、至少13小时的间隔、至少14小时的间隔、至少15小时的间隔、至少16小时的间隔、至少17小时的间隔、至少18小时的间隔、至少19小时的间隔、至少20小时的间隔、至少21小时的间隔、至少22小时的间隔、至少23小时的间隔、至少24小时的间隔、至少2天的间隔、至少3天的间隔、至少4天的间隔、至少5天的间隔、至少5天的间隔、至少7天的间隔、至少2周的间隔、至少3周的间隔或至少4周的间隔给予。
[0281]
在一些实施方式中,包含本文所述的抗tf抗体-药物偶联物(例如,替索土单抗维多汀)和/或本文所述的基于铂的试剂(例如,卡铂)的组合物与一种或多种治疗剂共给予,以消除或减轻一个或多个不良事件的严重程度。在一些实施方式中,共同给药是同时的或依次的。在一些实施方式中,抗tf抗体-药物偶联物和/或基于铂的试剂与一种或多种治疗剂同时给予,以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。在一些实施方式中,同时意指抗tf抗体-药物偶联物和/或基于铂的试剂和一种或多种治疗剂以小于约1小时的间隔、如小于约30分钟的间隔、小于约15分钟的间隔、小于约10分钟的间隔或小于约5分钟的间隔给予对象,以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。在一些实施方式中,同时意指抗tf抗体-药物偶联物和/或基于铂的试剂和一种或多种治疗剂以小于1小时的间隔、如小于30分钟的间隔、小于15分钟的间隔、小于10分钟的间隔或小于5分钟的间隔给予对象,以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。在一些实施方式中,抗tf抗体-药物偶联物和/或基于铂的试剂与一种或多种治疗剂依次给予,以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。在一些实施方式中,依次给予意指抗tf抗体-药物偶联物和/或基于铂的试剂与一种或多种其他治疗剂以至少1小时的间隔、至少2小时的间隔、至少3小时的间隔、至少4小时的间隔、至少5小时的间隔、至少6小时的间隔、至少7小时的间隔、至少8小时的间隔、至少9小时的间隔、至少10小时的间隔、至少11小时的间隔、至少12小时的间隔、至少13小时的间隔、至少14小时的间隔、至少15小时的间隔、至少16小时的间隔、至少17小时的间隔、至少18小时的间隔、至少19小时的间隔、至少20小时的间隔、至少21小时的间隔、至少22小时的间隔、至少23小时的间隔、至少24小时的间隔、至少2天的间隔、至少3天的间隔、至少4天的间隔、至少5天的间隔、至少5天的间隔、至少7天的间隔、至少2周的间隔、至少3周的间隔或至少4周的间隔给予。在一些实施方式中,抗tf抗体-药物偶联物和/或基于铂的试剂在一种或多种治疗剂之前给予,以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。在一些实施方式中,一种或多种治疗剂在抗tf抗体-药物偶联物和/或基于铂的试剂之前给予,以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0282]
v.制品和试剂盒
[0283]
在另一方面,提供制品或试剂盒,其包括本文所述的抗tf抗体-药物偶联物(例如,替索土单抗维多汀)和/或本文所述的基于铂的试剂(例如,卡铂)。该制品或试剂盒可以进一步包括在本发明的方法中使用抗tf抗体-药物偶联物和/或基于铂的试剂的说明书。因此,在某些实施方式中,制品或试剂盒包括在治疗对象中的癌症(例如,膀胱癌或宫颈癌)的方法中使用抗tf抗体-药物偶联物和/或基于铂的试剂的说明书,其中包括给予对象有效量的抗tf抗体-药物偶联物和/或基于铂的试剂。在一些实施方式中,所述癌症是膀胱癌。在一些实施方式中,所述癌症是宫颈癌。在一些实施方式中,所述宫颈癌是晚期宫颈癌。在一些
实施方式中,晚期宫颈癌是转移性宫颈癌。在一些实施方式中,晚期宫颈癌是3或4期宫颈癌。在一些实施方式中,宫颈癌是转移性癌症和复发性癌症。在一些实施方式中,宫颈癌是复发性癌症。在一些实施方式中,对象不是治愈性疗法的候选人。在一些实施方式中,对象尚未接受过针对宫颈癌的在先全身疗法。在一些实施方式中,对象是人。
[0284]
制品或试剂盒可以进一步包括容器。合适的容器包括例如瓶子、小瓶(例如,双室小瓶)、注射器(例如,单室或双室注射器)和试管。在一些实施方式中,容器是小瓶。该容器可以由多种材料形成,例如玻璃或塑料。该容器装有制剂。
[0285]
制剂或试剂盒可以进一步包括位于容器上或与容器相连的标签或包装插页,可以指示配制和/或使用制剂的指导。标签或包装插页可以进一步指示制剂可用于或旨在用于皮下、静脉内(例如,静脉内输注)或其他给药方式来治疗对象中的癌症,诸如本文所述的膀胱癌或宫颈癌(例如,晚期宫颈癌,如3级或4级或转移性宫颈癌)。装有制剂的容器可以是一次性小瓶或多次使用的小瓶,允许重复给予重建的制剂。制品或试剂盒还可以包括包含合适的稀释剂的第二容器。制品或试剂盒还可以包括从商业、治疗和用户角度出发期望的其他材料,包括其他缓冲剂、稀释剂、过滤器、针、注射器和带有使用说明书的包装插页。
[0286]
任选地,本文的制品或试剂盒还包括含有第二药物的容器,其中抗tf抗体-药物偶联物是第一药物,并且该制品或试剂盒还包括用于以有效量使用第二药物治疗对象的位于标签或包装插页上的说明书。在一些实施方式中,第二药物是如本文所述的基于铂的试剂。在一些实施方式中,标签或包装插页指示将第一和第二药物依次或同时给予,如本文所述。
[0287]
任选地,本文的制品或试剂盒还包括含有第三药物的容器,其中第三药物用于消除一个或多个不良事件或降低一个或多个不良事件的严重程度,其中抗tf抗体-药物偶联物是第一药物,基于铂的试剂是第二药物,并且该制品或试剂盒还包括位于标签或包装插页上用于以有效量使用第三药物治疗对象的说明书。在一些实施方式中,标签或包装插页指示第一、第二和第三药物待依次或同时给予,如本文所述,例如其中标签或包装插页指示首先给予抗tf抗体-药物偶联物,然后给予基于铂的试剂,然后给予第三药物。
[0288]
在一些实施方式中,抗tf抗体-药物偶联物和/或基于铂的试剂以冻干粉末形式存在于容器中。在一些实施方式中,冻干粉末置于气密性密闭容器、例如小瓶、安瓿或小药袋中,标明活性剂的量。通过注射给予药物时,例如可任选地提供一安瓿的无菌注射用水或盐水作为试剂盒的一部分,以便在给药前与药物成分混合。如果需要,这样的试剂盒还可以包括各种常规药物试剂盒组分中的一种或多种,例如具有一种或多种药学上可接受的运载体的容器、其他容器等,这对于本领域技术人员来说是显而易见。试剂盒中也可以包括印刷的说明书,作为插页或标签,标明要给予的组分的量、给药指导、和/或混合组分的指南。
[0289]
vii.示例性实施方式
[0290]
本文中提供的实施方式包括:
[0291]
a.治疗方法
[0292]
1a.一种治疗对象中癌症的方法,所述方法包括给予所述对象基于铂的试剂和结合至组织因子(tf)的抗体-药物偶联物,其中所述抗体-药物偶联物包含与单甲基奥瑞他汀或其功能性类似物或其功能性衍生物偶联的抗tf抗体或其抗原结合片段,其中所述抗体-药物偶联物以约0.5mg/kg至约2.1mg/kg范围内的剂量给予,其中所述抗体-药物偶联物连续三周约每1周给予一次,随后约1周休止期,其中不进行任何所述抗体-药物偶联物的给
药,从而每周期时间为约28天,其中包括所述休止期。
[0293]
2a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约0.65mg/kg的剂量给予。
[0294]
3a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以0.65mg/kg的剂量给予。
[0295]
4a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约0.7mg/kg的剂量给予。
[0296]
5a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以0.7mg/kg的剂量给予。
[0297]
6a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约0.8mg/kg的剂量给予。
[0298]
7a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以0.8mg/kg的剂量给予。
[0299]
8a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约0.9mg/kg的剂量给予。
[0300]
9a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以0.9mg/kg的剂量给予。
[0301]
10a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约1.0mg/kg的剂量给予。
[0302]
11a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以1.0mg/kg的剂量给予。
[0303]
12a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约1.1mg/kg的剂量给予。
[0304]
13a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以1.1mg/kg的剂量给予。
[0305]
14a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约1.2mg/kg的剂量给予。
[0306]
15a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以1.2mg/kg的剂量给予。
[0307]
16a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约1.3mg/kg的剂量给予。
[0308]
17a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以1.3mg/kg的剂量给予。
[0309]
18a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约1.4mg/kg的剂量给予。
[0310]
19a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以1.4mg/kg的剂量给予。
[0311]
20a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以约1.5mg/kg的剂量给予。
[0312]
21a.如实施方式1a所述的方法,其中所述抗体-药物偶联物以1.5mg/kg的剂量给予。
[0313]
22a.如实施方式1a-21a中任一项所述的方法,其中所述抗体-药物偶联物连续3周每1周给予一次,随后1周的休止期,其中不进行任何抗体-药物偶联物的给药,因此每周期时间是28天,其中包括所述休止期。
[0314]
23a.如实施方式1a-21a中任一项所述的方法,其中所述抗体-药物偶联物在约4周周期的约第1、8和15天给予。
[0315]
24a.如实施方式1a-21a中任一项所述的方法,其中所述抗体-药物偶联物在4周周期的第1、8和15天给予。
[0316]
25a.如实施方式1a-24a中任一项所述的方法,其中所述基于铂的试剂以介于约auc=4和约auc=6之间的剂量给予。
[0317]
26a.如实施方式25a所述的方法,其中所述基于铂的试剂以约auc=5的剂量给予。
[0318]
27a.如实施方式25a所述的方法,其中所述基于铂的试剂以auc=5的剂量给予。
[0319]
28a.如实施方式1a-27a中任一项所述的方法,其中所述基于铂的试剂约每1周给予一次、约每2周给予一次、约每3周给予一次或约每4周给予一次。
[0320]
29a.如实施方式28a所述的方法,其中所述基于铂的试剂约每3周给予一次。
[0321]
30a.如实施方式28a所述的方法,其中所述基于铂的试剂每3周给予一次。
[0322]
31a.如实施方式1a-27a中任一项所述的方法,其中所述基于铂的试剂在约21天周期的约第1天给予。
[0323]
32a.如实施方式1a-27a中任一项所述的方法,其中所述基于铂的试剂在21天周期的第1天给予。
[0324]
33a.如实施方式1a-32a中任一项所述的方法,其中所述癌症是膀胱癌。
[0325]
34a.如实施方式1a-32a中任一项所述的方法,其中所述癌症是宫颈癌。
[0326]
35a.如实施方式34a所述的方法,其中所述对象不是治愈性疗法的候选者。
[0327]
36a.如实施方式35a所述的方法,其中治愈性疗法包括放疗和/或内脏切除手术。
[0328]
37a.如实施方式34a-36a中任一项所述的方法,其中所述对象尚未接受过针对所述宫颈癌的在先全身疗法。
[0329]
38a.如实施方式34a-37a中任一项所述的方法,其中所述宫颈癌是腺癌、腺鳞癌、鳞状细胞癌或非鳞状细胞癌。
[0330]
39a.如实施方式38a所述的方法,其中所述宫颈癌是腺癌。
[0331]
40a.如实施方式38a所述的方法,其中所述宫颈癌是腺鳞癌。
[0332]
41a.如实施方式38a所述的方法,其中所述宫颈癌是鳞状细胞癌。
[0333]
42a.如实施方式38a所述的方法,其中所述宫颈癌是非鳞状细胞癌。
[0334]
43a.如实施方式34a-42a中任一项所述的方法,其中所述宫颈癌是晚期宫颈癌。
[0335]
44a.如实施方式43a所述的方法,其中所述晚期宫颈癌是3期或4期宫颈癌。
[0336]
45a.如实施方式43a或44a所述的方法,其中所述晚期宫颈癌是转移性宫颈癌。
[0337]
46a.如实施方式34a-45a中任一项所述的方法,其中宫颈癌是复发性宫颈癌。
[0338]
47a.如实施方式1a-46a中任一项所述的方法,其中单甲基奥瑞他汀是单甲基奥瑞他汀e(mmae)。
[0339]
48a.如实施方式1a-47a中任一项所述的方法,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段是单克隆抗体或其单克隆抗原结合片段。
[0340]
49a.如实施方式1a-48a中任一项所述的方法,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包括:
[0341]
(i)cdr-h1,包含seq id no:1的氨基酸序列;
[0342]
(ii)cdr-h2,包含seq id no:2的氨基酸序列;和
[0343]
(iii)cdr-h3,包含seq id no:3的氨基酸序列;和
[0344]
其中所述轻链可变区包括:
[0345]
(i)cdr-l1,包含seq id no:4的氨基酸序列;
[0346]
(ii)cdr-l2,包含seq id no:5的氨基酸序列;和
[0347]
(iii)cdr-l3,包含seq id no:6的氨基酸序列,其中抗tf抗体或其抗原结合片段的cdr由imgt编号方案定义。
[0348]
50a.如实施方式1a-49a中任一项所述的方法,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含与seq id no:7的氨基酸序列有至少约85%同一性的氨基酸序列,所述轻链可变区包含与seq id no:8的氨基酸序列有至少约85%同一性的氨基酸序列。
[0349]
51a.如实施方式1a-50a中任一项所述的方法,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含seq id no:7的氨基酸序列,所述轻链可变区包含seq id no:8的氨基酸序列。
[0350]
52a.如实施方式1a-51a中任一项所述的方法,其中所述抗体-药物偶联物的抗tf抗体是替索土单抗或其生物类似物。
[0351]
53a.如实施方式1a-52a中任一项所述的方法,其中抗体-药物偶联物还包括抗tf抗体或其抗原结合片段与单甲基奥瑞他汀之间的接头。
[0352]
54a.如实施方式53a所述的方法,其中接头是可裂解肽接头。
[0353]
55a.如实施方式54a所述的方法,其中可裂解肽接头具有式:-mc-vc-pab-,其中:
[0354]
a)mc是:
[0355][0356]
b)vc是二肽缬氨酸-瓜氨酸,并且
[0357]
c)pab是:
[0358][0359]
56a.如实施方式53a-55a中任一项所述的方法,其中接头附接至抗tf抗体的巯基残基,其通过所述抗tf抗体或其抗原结合片段的部分还原或充分还原而得。
[0360]
57a.如实施方式56a所述的方法,其中接头附接至mmae,其中抗体-药物偶联物具有如下结构:
[0361][0362]
其中,p表示1至8的数字,s代表所述抗tf抗体的巯基残基,并且ab指代所述抗tf抗体或其抗原结合片段。
[0363]
58a.如实施方式57a所述的方法,其中抗体-药物偶联物群体中p的平均值约为4。
[0364]
59a.如实施方式1a-58a中任一项所述的方法,其中所述抗体-药物偶联物是替索土单抗维多汀或其生物类似物。
[0365]
60a.如实施方式1a-59a中任一项所述的方法,其中抗体-药物偶联物的给药途径是静脉内。
[0366]
61a.如实施方式1a-60a中任一项所述的方法,其中所述基于铂的试剂选自下组:卡铂、顺铂、奥沙利铂和奈达铂。
[0367]
62a.如实施方式1a-60a中任一项所述的方法,其中所述基于铂的试剂是卡铂。
[0368]
63a.如实施方式1a-60a中任一项所述的方法,其中所述基于铂的试剂是顺铂。
[0369]
64a.如实施方式1a-63a中任一项所述的方法,其中所述基于铂的试剂的给药途径是静脉内。
[0370]
65a.如实施方式1a-64a中任一项所述的方法,其中所述基于铂的试剂和所述抗体-药物偶联物依次给予。
[0371]
66a.如实施方式1a-64a中任一项所述的方法,其中所述基于铂的试剂和所述抗体-药物偶联物同时给予。
[0372]
67a.如实施方式1a-66a中任一项所述的方法,其中至少约0.1%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%的宫颈癌细胞表达tf。
[0373]
68a.如实施方式1a-67a中任一项所述的方法,其中所述对象中的一种或多种治疗效果在给予所述抗体-药物偶联物和所述基于铂的试剂后相对于基线得到改善。
[0374]
69a.如实施方式68a所述的方法,其中一种或多种治疗效果选自下组:源自所述宫颈癌的肿瘤的大小、客观缓解率、缓解持续时间、达到缓解时间、无进展生存期和总生存期。
[0375]
70a.如实施方式1a-69a中任一项所述的方法,其中相对于给予所述抗体-药物偶联物和所述基于铂的试剂之前源自所述宫颈癌的肿瘤的大小,源自所述宫颈癌的肿瘤的大小减小至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0376]
71a.如实施方式1a-70a中任一项所述的方法,其中客观缓解率为至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0377]
72a.如实施方式1a-71a中任一项所述的方法,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。
[0378]
73a.如实施方式1a-72a中任一项所述的方法,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。
[0379]
74a.如实施方式1a-73a中任一项所述的方法,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述抗体-药物偶联物所致的缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。
[0380]
75a.如实施方式1a-74a中任一项所述的方法,其中对象具有一个或多个不良事件,并且进一步接受其他治疗剂以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0381]
76a.如实施方式1a-75a中任一项所述的方法,其中对象处于发展出一个或多个不良事件的风险,并且进一步接受其他治疗剂以预防一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0382]
77a.如实施方式75a或76a中所述的方法,其中所述一个或多个不良事件是出血、恶心、脱发、结膜炎、角膜炎、结膜溃疡、粘膜炎、便秘、食欲下降、腹泻、呕吐、中性粒细胞减少、发热性中性粒细胞减少、血小板计数减少或出血增加。
[0383]
78a.如实施方式75a-77a中任一项所述的方法,其中,所述一个或多个不良事件是3级或更高级的不良事件。
[0384]
79a.如实施方式75a-77a中任一项所述的方法,其中,所述一个或多个不良事件是严重不良事件。
[0385]
80a.如实施方式75a-79a中任一项所述的方法,其中所述一个或多个不良事件是结膜炎、结膜溃疡和/或角膜炎,并且所述其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂和/或类固醇滴眼剂。
[0386]
81a.如实施方式1a-80a中任一项所述的方法,其中对象是人。
[0387]
82a.如实施方式1a-81a中任一项所述的方法,其中抗体-药物偶联物在包含所述抗体-药物偶联物和药学上可接受的运载体的药物组合物中。
[0388]
83a.如实施方式1a-82a中任一项所述的方法,其中所述基于铂的试剂在包含所述基于铂的试剂和药学上可接受的运载体的药物组合物中。
[0389]
84a.一种试剂盒,其包括:
[0390]
(a)剂量范围为约auc=4至约auc=6的基于铂的试剂;
[0391]
(b)剂量范围为约5mg至约200mg的结合至组织因子(tf)的抗体-药物偶联物,其中
抗体-药物偶联物包含偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段;和
[0392]
(c)根据实施方式1a-83a中任一项所述的方法使用所述基于铂的试剂和所述抗体药物偶联物的说明书。
[0393]
85a.如实施方式84a所述的试剂盒,其中所述基于铂的试剂是卡铂。
[0394]
86a.如实施方式84a或85a所述的试剂盒,其中所述抗体-药物偶联物是替索土单抗维多汀或其生物类似物。
[0395]
b.抗体-药物偶联物用途
[0396]
1b.一种结合tf的抗体-药物偶联物,用于治疗对象的癌症,其中抗体-药物偶联物用于与基于铂的试剂组合给药或待与其组合给药,其中该抗体-药物偶联物包括偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段,其中抗体-药物偶联物以约0.5mg/kg至约2.1mg/kg范围内的剂量给予,其中所述抗体-药物偶联物连续三周约每1周给予一次,随后约1周休止期,其中不进行任何所述抗体-药物偶联物的给药,从而每周期时间为约28天,其中包括所述休止期。
[0397]
2b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约0.65mg/kg的剂量给予。
[0398]
3b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以0.65mg/kg的剂量给予。
[0399]
4b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约0.7mg/kg的剂量给予。
[0400]
5b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以0.7mg/kg的剂量给予。
[0401]
6b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约0.8mg/kg的剂量给予。
[0402]
7b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以0.8mg/kg的剂量给予。
[0403]
8b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约0.9mg/kg的剂量给予。
[0404]
9b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以0.9mg/kg的剂量给予。
[0405]
10b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约1.0mg/kg的剂量给予。
[0406]
11b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以1.0mg/kg的剂量给予。
[0407]
12b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约1.1mg/kg的剂量给予。
[0408]
13b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以1.1mg/kg的剂量给予。
[0409]
14b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以
约1.2mg/kg的剂量给予。
[0410]
15b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以1.2mg/kg的剂量给予。
[0411]
16b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约1.3mg/kg的剂量给予。
[0412]
17b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以1.3mg/kg的剂量给予。
[0413]
18b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约1.4mg/kg的剂量给予。
[0414]
19b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以1.4mg/kg的剂量给予。
[0415]
20b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以约1.5mg/kg的剂量给予。
[0416]
21b.如实施方式1b所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物以1.5mg/kg的剂量给予。
[0417]
22b.用于如实施方式1b-21b中任一项所述的用途的抗体-药物偶联物,其中所述抗体-药物偶联物连续3周每1周给予一次,随后1周的休止期,其中不进行任何抗体-药物偶联物的给药,因此每周期时间是28天,其中包括所述休止期。
[0418]
23b.用于如实施方式1b-21b中任一项所述用途的抗体-药物偶联物,其中所述抗体-药物偶联物在约4周周期的约第1、8和15天给予。
[0419]
24b.用于如实施方式1b-21b中任一项所述用途的抗体-药物偶联物,其中所述抗体-药物偶联物在4周周期的第1、8和15天给予。
[0420]
25b.如实施方式1b-24b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂以介于约auc=4和约auc=6之间的剂量给予。
[0421]
26b.如实施方式25b所述用途的抗体-药物偶联物,其中所述基于铂的试剂以约auc=5的剂量给予。
[0422]
27b.如实施方式25b所述用途的抗体-药物偶联物,其中所述基于铂的试剂以auc=5的剂量给予。
[0423]
28b.如实施方式1b-27b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂约每1周给予一次、约每2周给予一次、约每3周给予一次或约每4周给予一次。
[0424]
29b.如实施方式28b所述用途的抗体-药物偶联物,其中所述基于铂的试剂约每3周给予一次。
[0425]
30b.如实施方式28b所述用途的抗体-药物偶联物,其中所述基于铂的试剂每3周给予一次。
[0426]
31b.用于如实施方式1b-27b中任一项所述的用途的抗体-药物偶联物,其中所述基于铂的试剂在约21天周期的约第1天给予。
[0427]
32b.用于如实施方式1b-27b中任一项所述的用途的抗体-药物偶联物,其中所述基于铂的试剂在21天周期的第1天给予。
[0428]
33b.用于如实施方式1b-32b中任一项所述用途的抗体-药物偶联物,其中所述癌
症是膀胱癌。
[0429]
34b.用于如实施方式1b-32b中任一项所述用途的抗体-药物偶联物,其中所述癌症是宫颈癌。
[0430]
35b.用于如实施方式34b所述用途的抗体-药物偶联物,其中所述对象不是治愈性疗法的候选者。
[0431]
36b.如实施方式35b所述用途的抗体-药物偶联物,其中治愈性疗法包括放疗和/或内脏切除手术。
[0432]
37b.用于如实施方式34b-36b中任一项所述用途的抗体-药物偶联物,其中所述对象尚未接受过针对所述宫颈癌的在先全身疗法。
[0433]
38b.用于如实施方式34b-37b中任一项所述用途的抗体-药物偶联物,其中所述宫颈癌是腺癌、腺鳞癌、鳞状细胞癌或非鳞状细胞癌。
[0434]
39b.用于如实施方式38b所述用途的抗体-药物偶联物,其中所述宫颈癌是腺癌。
[0435]
40b.用于如实施方式38b所述用途的抗体-药物偶联物,其中所述宫颈癌是腺鳞癌。
[0436]
41b.用于如实施方式38b所述用途的抗体-药物偶联物,其中所述宫颈癌是鳞状细胞癌。
[0437]
42b.用于如实施方式38b所述用途的抗体-药物偶联物,其中所述宫颈癌是非鳞状细胞癌。
[0438]
43b.用于如实施方式34b-42b中任一项所述的用途的抗体-药物偶联物,其中所述宫颈癌是晚期宫颈癌。
[0439]
44b.用于如实施方式43b所述的用途的抗体-药物偶联物,其中所述晚期宫颈癌是3期或4期宫颈癌。
[0440]
45b.用于如实施方式43b或44b所述用途的抗体-药物偶联物,其中所述晚期宫颈癌症是转移性宫颈癌。
[0441]
46b.用于如实施方式34b-45b中任一项所述的用途的抗体-药物偶联物,其中宫颈癌是复发性宫颈癌。
[0442]
47b.用于如实施方式1b-46b中任一项所述用途的抗体-药物偶联物,其中单甲基奥瑞他汀是单甲基奥瑞他汀e(mmae)。
[0443]
48b.用于如实施方式1b-47b中任一项所述的用途的抗体-药物偶联物,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段是单克隆抗体或其单克隆抗原结合片段。
[0444]
49b.用于如实施方1b-48b中任一项所述的用途的抗体-药物偶联物,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包括:
[0445]
(i)cdr-h1,包含seq id no:1的氨基酸序列;
[0446]
(ii)cdr-h2,包含seq id no:2的氨基酸序列;和
[0447]
(iii)cdr-h3,包含seq id no:3的氨基酸序列;和
[0448]
其中所述轻链可变区包括:
[0449]
(i)cdr-l1,包含seq id no:4的氨基酸序列;
[0450]
(ii)cdr-l2,包含seq id no:5的氨基酸序列;和
[0451]
(iii)cdr-l3,包含seq id no:6的氨基酸序列,其中抗tf抗体或其抗原结合片段的cdr由imgt编号方案定义。
[0452]
50b.用于如实施方式1b-49b中任一项所述的用途的抗体-药物偶联物,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含与seq id no:7的氨基酸序列有至少约85%同一性的氨基酸序列,所述轻链可变区包含与seq id no:8的氨基酸序列有至少约85%同一性的氨基酸序列。
[0453]
51b.用于如实施方式1b-50b中任一项所述用途的抗体-药物偶联物,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含seq id no:7的氨基酸序列,所述轻链可变区包含seq id no:8的氨基酸序列。
[0454]
52b.用于如实施方式1b-51b中任一项所述用途的抗体-药物偶联物,其中所述抗体-药物偶联物的抗tf抗体是替索土单抗或其生物类似物。
[0455]
53b.用于如实施方式1b-52b中任一项所述用途的抗体-药物偶联物,其中抗体-药物偶联物还包括抗tf抗体或其抗原结合片段与单甲基奥瑞他汀之间的接头。
[0456]
54b.用于如实施方式53b所述用途的抗体-药物偶联物,其中接头是可裂解肽接头。
[0457]
55b.用于如实施方式54b所述用途的抗体-药物偶联物,其中可裂解肽接头具有式:-mc-vc-pab-,其中:
[0458]
a)mc是:
[0459][0460]
b)vc是二肽缬氨酸-瓜氨酸,并且
[0461]
c)pab是:
[0462][0463]
56b.用于如实施方式53b-55b中任一项所述用途的抗体-药物偶联物,其中接头附接至抗tf抗体的巯基残基,其通过所述抗tf抗体或其抗原结合片段的部分还原或充分还原而得。
[0464]
57b.用于如实施方式56b所述用途的抗体-药物偶联物,其中接头附接至mmae,其中抗体-药物偶联物具有如下结构:
[0465]
[0466]
其中,p表示1至8的数字,s代表所述抗tf抗体的巯基残基,并且ab指代所述抗tf抗体或其抗原结合片段。
[0467]
58b.用于如实施方式57b所述用途的抗体-药物偶联物,其中抗体-药物偶联物群体中p的平均值约为4。
[0468]
59b.用于如实施方式1b-58b中任一项所述用途的抗体-药物偶联物,其中所述抗体-药物偶联物是替索土单抗维多汀或其生物类似物。
[0469]
60b.用于如实施方式1b-59b中任一项所述用途的抗体-药物偶联物,其中抗体-药物偶联物的给药途径是静脉内。
[0470]
61b.用于如实施方式1b-60b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂选自下组:卡铂、顺铂、奥沙利铂和奈达铂。
[0471]
62b.用于如实施方式1b-60b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂是卡铂。
[0472]
63b.用于如实施方式1b-60b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂是顺铂。
[0473]
64b.用于如实施方式1b-63b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂的给药途径是静脉内。
[0474]
65b.用于如实施方式1b-64b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂和所述抗体-药物偶联物依次给予。
[0475]
66b.用于如实施方式1b-64b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂和所述抗体-药物偶联物同时给予。
[0476]
67b.用于实施方式1b-66b中任一项所述用途的抗体-药物偶联物,其中至少约0.1%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%的宫颈癌细胞表达tf。
[0477]
68b.用于如实施方式1b-67b中任一项所述用途的抗体-药物偶联物,其中所述对象中的一种或多种治疗效果在给予所述抗体-药物偶联物和所述基于铂的试剂后相对于基线得到改善。
[0478]
69b.用于如实施方式68b所述的用途的抗体-药物偶联物,其中一种或多种治疗效果选自下组:源自所述宫颈癌的肿瘤的大小、客观缓解率、缓解持续时间、达到缓解时间、无进展生存期和总生存期。
[0479]
70b.用于如实施方式1b-69b中任一项所述用途的抗体-药物偶联物,其中相对于给予所述抗体-药物偶联物和所述基于铂的试剂之前源自宫颈癌的肿瘤的大小,源自所述宫颈癌的肿瘤的大小减小至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0480]
71b.用于如实施方式1b-70b中任一项所述用途的抗体-药物偶联物,其中客观缓解率为至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0481]
72b.如实施方式1b-71b中任一项所述用途的抗体-药物偶联物,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。
[0482]
73b.用于如实施方式1b-72b中任一项所述用途的抗体-药物偶联物,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。
[0483]
74b.用于如实施方式1b-73b中任一项所述用途的抗体-药物偶联物,其中给予抗体-药物偶联物和基于铂的试剂后,该抗体-药物偶联物所致的缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。
[0484]
75b.如实施方式1b-74b中任一项所述的用途的抗体-药物偶联物,其中对象具有一个或多个不良事件,并且进一步接受其他治疗剂以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0485]
76b.用于如实施方式1b-75b中任一项所述用途的抗体-药物偶联物,其中对象处于发展出一个或多个不良事件的风险,并且进一步接受其他治疗剂以预防一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0486]
77b.如实施方式75b或76b所述用途的抗体-药物偶联物,其中所述一个或多个不良事件是出血、恶心、脱发、结膜炎、角膜炎、结膜溃疡、粘膜炎、便秘、食欲下降、腹泻、呕吐、中性粒细胞减少、发热性中性粒细胞减少、血小板计数减少或出血增加。
[0487]
78b.如实施方式75b-77b中任一项所述的用途的抗体-药物偶联物,其中所述一个或多个不良事件是3级或更高级的不良事件。
[0488]
79b.如实施方式75b-77b中任一项所述的用途的抗体-药物偶联物,其中所述一个或多个不良事件是严重不良事件。
[0489]
80b.用于如实施方式75b-79b中任一项所述用途的抗体-药物偶联物,其中所述一个或多个不良事件是结膜炎、结膜溃疡和/或角膜炎,并且所述其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂和/或类固醇滴眼剂。
[0490]
81b.用于如实施方式1b-80b中任一项所述用途的抗体-药物偶联物,其中所述对象是人。
[0491]
82b.用于如实施方式1b-81b中任一项所述用途的抗体-药物偶联物,其中抗体-药物偶联物在包含所述抗体-药物偶联物和药学上可接受的运载体的药物组合物中。
[0492]
83b.用于如实施方式1b-82b中任一项所述用途的抗体-药物偶联物,其中所述基于铂的试剂在包含所述基于铂的试剂和药学上可接受的运载体的药物组合物中。
[0493]
c.抗体-药物偶联物的用途
[0494]
1c.一种结合tf的抗体-药物偶联物的用途,用于制备治疗对象的癌症的药物,其
中所述药物用于与基于铂的试剂组合使用,其中该抗体-药物偶联物包括偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段,其中抗体-药物偶联物以约0.5mg/kg至约2.1mg/kg范围内的剂量给予,其中所述抗体-药物偶联物连续三周约每1周给予一次,随后约1周休止期,其中不进行任何所述抗体-药物偶联物的给药,从而每周期时间为约28天,其中包括所述休止期。
[0495]
2c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约0.65mg/kg的剂量给予。
[0496]
3c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以0.65mg/kg的剂量给予。
[0497]
4c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约0.7mg/kg的剂量给予。
[0498]
5c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以0.7mg/kg的剂量给予。
[0499]
6c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约0.8mg/kg的剂量给予。
[0500]
7c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以0.8mg/kg的剂量给予。
[0501]
8c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约0.9mg/kg的剂量给予。
[0502]
9c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以0.9mg/kg的剂量给予。
[0503]
10c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约1.0mg/kg的剂量给予。
[0504]
11c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以1.0mg/kg的剂量给予。
[0505]
12c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约1.1mg/kg的剂量给予。
[0506]
13c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以1.1mg/kg的剂量给予。
[0507]
14c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约1.2mg/kg的剂量给予。
[0508]
15c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以1.2mg/kg的剂量给予。
[0509]
16c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约1.3mg/kg的剂量给予。
[0510]
17c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以1.3mg/kg的剂量给予。
[0511]
18c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约1.4mg/kg的剂量给予。
[0512]
19c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以1.4mg/kg的剂量给予。
[0513]
20c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以约1.5mg/kg的剂量给予。
[0514]
21c.如实施方式1c所述的用途,其中所述抗体-药物偶联物以1.5mg/kg的剂量给予。
[0515]
22c.如实施方式1c-21c中任一项所述的用途,其中所述抗体-药物偶联物连续3周每1周给予一次,随后1周的休止期,其中不进行任何抗体-药物偶联物的给药,因此每周期时间是28天,其中包括所述休止期。
[0516]
23c.如实施方式1c-21c中任一项所述的用途,其中所述抗体-药物偶联物在约4周周期的约第1、8和15天给予。
[0517]
24c.如实施方式1c-21c中任一项所述的用途,其中所述抗体-药物偶联物在4周周期的第1、8和15天给予。
[0518]
25c.如实施方式1c-24c中任一项所述的用途,其中所述基于铂的试剂以介于约auc=4和约auc=6之间的剂量给予。
[0519]
26c.如实施方式25c所述的用途,其中所述基于铂的试剂以约auc=5的剂量给予。
[0520]
27c.如实施方式25c所述的用途,其中所述基于铂的试剂以auc=5的剂量给予。
[0521]
28c.在实施方式1c-27c中任一项所述的用途,其中所述基于铂的试剂约每1周给予一次、约每2周给予一次、约每3周给予一次或约每4周给予一次。
[0522]
29c.如实施方式28c所述的用途,其中所述基于铂的试剂约每3周给予一次。
[0523]
30c.如实施方式28c所述的用途,其中所述基于铂的试剂每3周给予一次。
[0524]
31c.如实施方式1c-27c中任一项所述的用途,其中所述基于铂的试剂在约21天周期的约第1天给予。
[0525]
32c.如实施方式1c-27c中任一项所述的用途,其中所述基于铂的试剂在21天周期的第1天给予。
[0526]
33c.如实施方式1c-32c中任一项所述的用途,其中所述癌症是膀胱癌。
[0527]
34c.如实施方式1c-32c中任一项所述的用途,其中所述癌症是宫颈癌。
[0528]
35c.如实施方式34c所述的用途,其中所述对象不是治愈性疗法的候选者。
[0529]
36c.如实施方式35c所述的用途,其中治愈性疗法包括放疗和/或内脏切除手术。
[0530]
37c.如实施方式34c-36c中任一项所述的用途,其中所述对象尚未接受过针对所述宫颈癌的在先全身疗法。
[0531]
38c.如实施方式34c-37c中任一项所述的用途,其中所述宫颈癌是腺癌、腺鳞癌、鳞状细胞癌或非鳞状细胞癌。
[0532]
39c.如实施方式38c所述的用途,其中所述宫颈癌是腺癌。
[0533]
40c.如实施方式38c所述的用途,其中所述宫颈癌是腺鳞癌。
[0534]
41c.如实施方式38c所述的用途,其中所述宫颈癌是鳞状细胞癌。
[0535]
42c.如实施方式38c所述的用途,其中所述宫颈癌是非鳞状细胞癌。
[0536]
43c.如实施方式34c-42c中任一项所述的用途,其中所述宫颈癌是晚期宫颈癌。
[0537]
44c.如实施方式43c所述的用途,其中所述晚期宫颈癌是3期或4期宫颈癌。
[0538]
45c.如实施方式43c或44c所述的用途,其中所述晚期宫颈癌是转移性宫颈癌。
[0539]
46c.如实施方式34c-45c中任一项所述的用途,其中宫颈癌是复发性宫颈癌。
[0540]
47c.如实施方式1c-46c中任一项所述的用途,其中单甲基奥瑞他汀是单甲基奥瑞他汀e(mmae)。
[0541]
48c.如实施方式1c-47c中任一项所述的用途,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段是单克隆抗体或其单克隆抗原结合片段。
[0542]
49c.如实施方式1c-48c中任一项所述的用途,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包括:
[0543]
(i)cdr-h1,包含seq id no:1的氨基酸序列;
[0544]
(ii)cdr-h2,包含seq id no:2的氨基酸序列;和
[0545]
(iii)cdr-h3,包含seq id no:3的氨基酸序列;和
[0546]
其中所述轻链可变区包括:
[0547]
(i)cdr-l1,包含seq id no:4的氨基酸序列;
[0548]
(ii)cdr-l2,包含seq id no:5的氨基酸序列;和
[0549]
(iii)cdr-l3,包含seq id no:6的氨基酸序列,其中抗tf抗体或其抗原结合片段的cdr由imgt编号方案定义。
[0550]
50c.如实施方式1c-49c中任一项所述的用途,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含与seq id no:7的氨基酸序列有至少约85%同一性的氨基酸序列,所述轻链可变区包含与seq id no:8的氨基酸序列有至少约85%同一性的氨基酸序列。
[0551]
51c.如实施方式1c-50c中任一项所述的用途,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含seq id no:7的氨基酸序列,所述轻链可变区包含seq id no:8的氨基酸序列。
[0552]
52c.如实施方式1c-51c中任一项所述的用途,其中所述抗体-药物偶联物的抗tf抗体是替索土单抗或其生物类似物。
[0553]
53c.如实施方式1c-52c中任一项所述的用途,其中抗体-药物偶联物还包括抗tf抗体或其抗原结合片段与单甲基奥瑞他汀之间的接头。
[0554]
54c.如实施方式53c所述的用途,其中接头是可裂解肽接头。
[0555]
55c.如实施方式54c所述的用途,其中可裂解肽接头具有式:-mc-vc-pab-,其中:
[0556]
a)mc是:
[0557][0558]
b)vc是二肽缬氨酸-瓜氨酸,并且
[0559]
c)pab是:
[0560][0561]
56c.如实施方式53c-55c中任一项所述的用途,其中接头附接至抗tf抗体的巯基残基,其通过所述抗tf抗体或其抗原结合片段的部分还原或充分还原而得。
[0562]
57c.如实施方式56c所述的用途,其中接头附接至mmae,其中抗体-药物偶联物具有如下结构:
[0563][0564]
其中,p表示1至8的数字,s代表所述抗tf抗体的巯基残基,并且ab指代所述抗tf抗体或其抗原结合片段。
[0565]
58c.如实施方式57c所述的用途,其中抗体-药物偶联物群体中p的平均值约为4。
[0566]
58c.如实施方式1c-58c中任一项所述的用途,其中所述抗体-药物偶联物是替索土单抗维多汀或其生物类似物。
[0567]
60c.如实施方式1c-59c中任一项所述的用途,其中抗体-药物偶联物的给药途径是静脉内。
[0568]
61c.如实施方式1c-60c中任一项所述的用途,其中所述基于铂的试剂选自下组:卡铂、顺铂、奥沙利铂和奈达铂。
[0569]
62c.如实施方式1c-60c中任一项所述的用途,其中所述基于铂的试剂是卡铂。
[0570]
63c.如实施方式1c-60c中任一项所述的用途,其中所述基于铂的试剂是顺铂。
[0571]
64c.如实施方式1c-63c中任一项所述的用途,其中所述基于铂的试剂的给药途径是静脉内。
[0572]
65c.如实施方式1c-64c中任一项所述的用途,其中所述基于铂的试剂和所述抗体-药物偶联物依次给予。
[0573]
66c.如实施方式1c-64c中任一项所述的用途,其中所述基于铂的试剂和所述抗体-药物偶联物同时给予。
[0574]
67c.如实施方式1c-66c中任一项所述的用途,其中至少约0.1%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%的宫颈癌细胞表达tf。
[0575]
68c.如实施方式1c-67c中任一项所述的用途,其中所述对象中的一种或多种治疗效果在给予所述抗体-药物偶联物和所述基于铂的试剂后相对于基线得到改善。
[0576]
69c.如实施方式68c所述的用途,其中一种或多种治疗效果选自下组:源自所述宫颈癌的肿瘤的大小、客观缓解率、缓解持续时间、达到缓解时间、无进展生存期和总生存期。
[0577]
70c.如实施方式1c-69c中任一项所述的用途,其中相对于给予所述抗体-药物偶联物和所述基于铂的试剂之前源自宫颈癌的肿瘤的大小,源自宫颈癌的肿瘤的大小减小至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0578]
71c.如实施方式1c-70c中任一项所述的用途,其中客观缓解率为至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0579]
72c.如实施方式1c-71c中任一项所述的用途,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。
[0580]
73c.如实施方式1c-72c中任一项所述的用途,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。
[0581]
74c.如实施方式1c-73c中任一项所述的用途,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述抗体-药物偶联物所致的缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。
[0582]
75c.如实施方式1c-74c中任一项所述的用途,其中对象具有一个或多个不良事件,并且进一步接受其他治疗剂以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0583]
76c.如实施方式1c-75c中任一项所述的用途,其中对象处于发展出一个或多个不良事件的风险,并且进一步接受其他治疗剂以预防一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0584]
77c.在实施方式75c或76c所述的用途中,其中所述一个或多个不良事件是出血、恶心、脱发、结膜炎、角膜炎、结膜溃疡、粘膜炎、便秘、食欲下降、腹泻、呕吐、中性粒细胞减少、发热性中性粒细胞减少、血小板计数减少或出血增加。
[0585]
78c.如实施方式75c-77c中任一项所述的用途,其中,所述一个或多个不良事件是3级或更高级的不良事件。
[0586]
79c.如实施方式75c-77c中任一项所述的用途,其中,所述一个或多个不良事件是严重不良事件。
[0587]
80c.如实施方式75c-79c中任一项所述的用途,其中所述一个或多个不良事件是结膜炎、结膜溃疡和/或角膜炎,并且所述其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂和/或类固醇滴眼剂。
[0588]
81c.如实施方式1c-80c中任一项所述的用途,其中对象是人。
[0589]
82c.如实施方式1c-81c中任一项所述的用途,其中所述抗体-药物偶联物在包含所述抗体-药物偶联物和药学上可接受的运载体的药物组合物中。
[0590]
83c.如实施方式1c-82c中任一项所述的用途,其中所述基于铂的试剂在药物组合物中,所述药物组合物包含所述基于铂的试剂和药学上可接受的运载体。
[0591]
d.基于铂的试剂用途
[0592]
1d.一种用于治疗对象的癌症的基于铂的试剂,其中基于铂的试剂用于与结合tf的抗体-药物偶联物组合给药或待与其组合给药,其中该抗体-药物偶联物包括偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段,其中抗体-药物偶联物以约0.5mg/kg至约2.1mg/kg范围内的剂量给予,其中所述抗体-药物偶联物连续三周约每1周给予一次,随后约1周休止期,其中不进行任何所述抗体-药物偶联物的给药,从而每周期时间为约28天,其中包括所述休止期。
[0593]
2d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约0.65mg/kg的剂量给予。
[0594]
3d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以0.65mg/kg的剂量给予。
[0595]
4d.如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约0.7mg/kg的剂量给予。
[0596]
5d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以0.7mg/kg的剂量给予。
[0597]
6d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约0.8mg/kg的剂量给予。
[0598]
7d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以0.8mg/kg的剂量给予。
[0599]
8d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约0.9mg/kg的剂量给予。
[0600]
9d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以0.9mg/kg的剂量给予。
[0601]
10d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约1.0mg/kg的剂量给予。
[0602]
11d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以1.0mg/kg的剂量给予。
[0603]
12d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约1.1mg/kg的剂量给予。
[0604]
13d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以1.1mg/kg的剂量给予。
[0605]
14d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约1.2mg/kg的剂量给予。
[0606]
15d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以1.2mg/kg的剂量给予。
[0607]
16d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约1.3mg/kg的剂量给予。
[0608]
17d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以1.3mg/kg的剂量给予。
[0609]
18d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约1.4mg/kg的剂量给予。
[0610]
19d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以1.4mg/kg的剂量给予。
[0611]
20d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以约1.5mg/kg的剂量给予。
[0612]
21d.用于如实施方式1d所述用途的基于铂的试剂,其中所述抗体-药物偶联物以1.5mg/kg的剂量给予。
[0613]
22d.用于如实施方式1d-21d中任一项所述用途的基于铂的试剂,其中所述抗体-药物偶联物连续3周每1周给予一次,随后1周的休止期,其中不进行任何抗体-药物偶联物的给药,因此每周期时间是28天,其中包括所述休止期。
[0614]
23d.用于如实施方式1c-21c中任一项所述用途的基于铂的试剂,其中所述抗体-药物偶联物在约4周周期的约第1、8和15天给予。
[0615]
24d.用于如实施方式1c-21c中任一项所述用途的基于铂的试剂,其中所述抗体-药物偶联物在4周周期的第1、8和15天给予。
[0616]
25d.用于如实施方式1d-24d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂以介于约auc=4和约auc=6之间的剂量给予。
[0617]
26d.用于如实施方式25d所述用途的基于铂的试剂,其中所述基于铂的试剂以约auc=5的剂量给予。
[0618]
27d.用于如实施方式25d所述用途的基于铂的试剂,其中所述基于铂的试剂以auc=5的剂量给予。
[0619]
28d.用于如实施方式1d-27d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂约每1周给予一次、约每2周给予一次、约每3周给予一次或约每4周给予一次。
[0620]
29d.用于如实施方式28d所述用途的基于铂的试剂,其中所述基于铂的试剂约每3周给予一次。
[0621]
30d.用于如实施方式28d所述用途的基于铂的试剂,其中所述基于铂的试剂每3周给予一次。
[0622]
31d.用于如实施方式1d-27d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂在约21天周期的约第1天给予。
[0623]
32d.用于如实施方式1d-27d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂在21天周期的第1天给予。
[0624]
33d.用于如实施方式1d-32d中任一项所述用途的基于铂的试剂,其中所述癌症是膀胱癌。
[0625]
34d.用于如实施方式1d-32d中任一项所述用途的基于铂的试剂,其中所述癌症是宫颈癌。
[0626]
35d.用于如实施方式34d所述用途的基于铂的试剂,其中所述对象不是治愈性疗法的候选人。
[0627]
36d.用于如实施方式35d所述用途的基于铂的试剂,其中治愈性疗法包括放疗和/或内脏切除手术。
[0628]
37d.用于如实施方式34d-36d中任一项所述用途的基于铂的试剂,其中所述对象尚未接受过针对所述宫颈癌的在先全身疗法。
[0629]
38d.用于如实施方式34d-37d中任一项所述用途的基于铂的试剂,其中所述宫颈癌是腺癌、腺鳞癌、鳞状细胞癌或非鳞状细胞癌。
[0630]
39d.用于如实施方式38d所述用途的基于铂的试剂,其中所述宫颈癌是腺癌。
[0631]
40d.用于如实施方式38d所述用途的基于铂的试剂,其中所述宫颈癌是腺鳞癌。
[0632]
41d.用于如实施方式38d所述用途的基于铂的试剂,其中所述宫颈癌是鳞状细胞癌。
[0633]
42d.用于如实施方式38d所述用途的基于铂的试剂,其中所述宫颈癌是非鳞状细胞癌。
[0634]
43d.用于如实施方式34d-42d中任一项所述用途的基于铂的试剂,其中所述宫颈癌是晚期宫颈癌。
[0635]
44d.用于如实施方式43d所述用途的基于铂的试剂,其中所述晚期宫颈癌是3期或4期宫颈癌。
[0636]
45d.用于如实施方式43d或44d所述用途的基于铂的试剂,其中所述晚期宫颈癌症是转移性宫颈癌。
[0637]
46d.用于如实施方式34d-45d中任一项所述用途的基于铂的试剂,其中所述宫颈癌是复发性宫颈癌。
[0638]
47d.用于如实施方式1d-46d中任一项所述用途的基于铂的试剂,其中所述单甲基奥瑞他汀是单甲基奥瑞他汀e(mmae)。
[0639]
48d.用于如实施方式1d-47d中任一项所述用途的基于铂的试剂,其中所述抗体-药物偶联物的抗tf抗体或其抗原结合片段是单克隆抗体或其单克隆抗原结合片段。
[0640]
49d.用于如实施方式1d-48d中任一项所述的用途的基于铂的试剂,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包括:
[0641]
(i)cdr-h1,包含seq id no:1的氨基酸序列;
[0642]
(ii)cdr-h2,包含seq id no:2的氨基酸序列;和
[0643]
(iii)cdr-h3,包含seq id no:3的氨基酸序列;和
[0644]
其中所述轻链可变区包括:
[0645]
(i)cdr-l1,包含seq id no:4的氨基酸序列;
[0646]
(ii)cdr-l2,包含seq id no:5的氨基酸序列;和
[0647]
(iii)cdr-l3,包含seq id no:6的氨基酸序列,其中抗tf抗体或其抗原结合片段的cdr由imgt编号方案定义。
[0648]
50d.用于如实施方式1d-49d中任一项所述用途的基于铂的试剂,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区
药物偶联物是替索土单抗维多汀或其生物类似物。
[0665]
60d.用于如实施方式1d-59d中任一项所述用途的基于铂的试剂,其中所述抗体-药物偶联物的给药途径是静脉内。
[0666]
61d.用于如实施方式1d-60d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂选自下组:卡铂、顺铂、奥沙利铂和奈达铂。
[0667]
62d.用于如实施方式1d-60d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂是卡铂。
[0668]
63d.用于如实施方式1d-60d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂是顺铂。
[0669]
64d.用于如实施方式1d-64d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂的给药途径是静脉内。
[0670]
65d.用于如实施方式1d-65d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂和所述抗体-药物偶联物依次给予。
[0671]
66d.如实施方式1d-64d中任一项所述的方法,其中所述基于铂的试剂和所述抗体-药物偶联物同时给予。
[0672]
67d.用于实施方式1d-66d中任一项所述用途的基于铂的试剂,其中至少约0.1%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%的宫颈癌细胞表达tf。
[0673]
68d.用于如实施方式1d-67d,中任一项所述的用途的基于铂的试剂,其中所述对象中的一种或多种治疗效果在给予所述抗体-药物偶联物和所述基于铂的试剂后相对于基线得到改善。
[0674]
69d.如实施方式68d所述用途的基于铂的试剂,其中所述一种或多种治疗效果选自下组:源自所述宫颈癌的肿瘤的大小、客观缓解率、缓解持续时间、达到缓解时间、无进展生存期和总生存期。
[0675]
70d.如实施方式1d-69d中任一项所述用途的基于铂的试剂,其中相对于给予所述抗体-药物偶联物和所述基于铂的试剂之前源自宫颈癌的肿瘤的大小,源自所述宫颈癌的肿瘤的大小减小至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0676]
71d.如实施方式1d-70d中任一项所述的用途的基于铂的试剂,其中客观缓解率为至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0677]
72d.如实施方式1d-71d中任一项所述用途的基于铂的试剂,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。
[0678]
73d.如实施方式1d-72d中任一项所述用途的基于铂的试剂,其中在给予所述抗
体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。
[0679]
74d.用于如实施方式1d-73d中任一项所述的用途的基于铂的试剂,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述抗体-药物偶联物所致的缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。
[0680]
75d.用于如实施方式1d-74d中任一项所述用途的基于铂的试剂,其中对象具有一个或多个不良事件,并且进一步接受其他治疗剂以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0681]
76d.如实施方式1d-75d,中任一项所述用途的基于铂的试剂,其中所述对象处于发展出一个或多个不良事件的风险中,并且进一步接受其他治疗剂以预防或降低所述一个或多个不良事件的严重程度。
[0682]
77d.如实施方式75d或76d所述用途的基于铂的试剂,其中所述一个或多个不良事件是出血、恶心、脱发、结膜炎、角膜炎、结膜溃疡、粘膜炎、便秘、食欲下降、腹泻、呕吐、中性粒细胞减少、发热性中性粒细胞减少、血小板计数减少或出血增加。
[0683]
78d.如实施方式75d-77d中任一项所述的用途的基于铂的试剂,其中所述一个或多个不良事件是3级或更高级的不良事件。
[0684]
79d.用于如实施方式75d-77d中任一项所述的用途的基于铂的试剂,其中所述一个或多个不良事件是严重不良事件。
[0685]
80d.用于如实施方式75d-79d中任一项所述用途的基于铂的试剂,其中所述一个或多个不良事件是结膜炎、结膜溃疡和/或角膜炎,并且所述其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂和/或类固醇滴眼剂。
[0686]
81d.用于如实施方式1d-80d中任一项所述用途的基于铂的试剂,其中所述对象是人。
[0687]
82d.用于如实施方式1d-81d中任一项所述用途的基于铂的试剂,其中所述抗体-药物偶联物在包含所述抗体-药物偶联物和药学上可接受的运载体的药物组合物中。
[0688]
83d.用于如实施方式1d-82d中任一项所述用途的基于铂的试剂,其中所述基于铂的试剂在包含所述基于铂的试剂和药学上可接受的运载体的药物组合物中。
[0689]
e.基于铂的试剂的用途
[0690]
1e.基于铂的试剂用于制备用于制备治疗对象的癌症的药物的用途,其中所述药物用于与结合tf的抗体药物偶联物组合使用,其中该抗体-药物偶联物包括偶联至单甲基奥瑞他汀或其功能性类似物或其功能性衍生物的抗tf抗体或其抗原结合片段,其中抗体-药物偶联物以约0.5mg/kg至约2.1mg/kg范围内的剂量给予,其中所述抗体-药物偶联物连续三周约每1周给予一次,随后约1周休止期,其中不进行任何所述抗体-药物偶联物的给药,从而每周期时间为约28天,其中包括所述休止期。
[0691]
2e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约0.65mg/kg的剂量
给予。
[0692]
3e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以0.65mg/kg的剂量给予。
[0693]
4e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约0.7mg/kg的剂量给予。
[0694]
5e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以0.7mg/kg的剂量给予。
[0695]
6e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约0.8mg/kg的剂量给予。
[0696]
7e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以0.8mg/kg的剂量给予。
[0697]
8e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约0.9mg/kg的剂量给予。
[0698]
9e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以0.9mg/kg的剂量给予。
[0699]
10e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约1.0mg/kg的剂量给予。
[0700]
11e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以1.0mg/kg的剂量给予。
[0701]
12e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约1.1mg/kg的剂量给予。
[0702]
13e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以1.1mg/kg的剂量给予。
[0703]
14e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约1.2mg/kg的剂量给予。
[0704]
15e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以1.2mg/kg的剂量给予。
[0705]
16e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约1.3mg/kg的剂量给予。
[0706]
17e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以1.3mg/kg的剂量给予。
[0707]
18e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约1.4mg/kg的剂量给予。
[0708]
19e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以1.4mg/kg的剂量给予。
[0709]
20e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以约1.5mg/kg的剂量给予。
[0710]
21e.如实施方式1e所述的用途,其中所述抗体-药物偶联物以1.5mg/kg的剂量给予。
[0711]
22e.如实施方式1e-21e中任一项所述的用途,其中所述抗体-药物偶联物连续3周每1周给予一次,随后1周的休止期,其中不进行任何抗体-药物偶联物的给药,因此每周期时间是28天,其中包括所述休止期。
[0712]
23e.如实施方式1e-21e中任一项所述的用途,其中所述抗体-药物偶联物在约4周周期的约第1、8和15天给予。
[0713]
24e.如实施方式1e-21e中任一项所述的用途,其中所述抗体-药物偶联物在4周周期的第1、8和15天给予。
[0714]
25e.如实施方式1e-24e中任一项所述的用途,其中所述基于铂的试剂以介于约auc=4和约auc=6之间的剂量给予。
[0715]
26e.如实施方式25e所述的用途,其中所述基于铂的试剂以约auc=5的剂量给予。
[0716]
27e.如实施方式25e所述的用途,其中所述基于铂的试剂以auc=5的剂量给予。
[0717]
28e.在实施方式1e-27e中任一项所述的用途,其中所述基于铂的试剂约每1周给予一次、约每2周给予一次、约每3周给予一次或约每4周给予一次。
[0718]
29e.如实施方式28e所述的用途,其中所述基于铂的试剂约每3周给予一次。
[0719]
30e.如实施方式28e所述的用途,其中所述基于铂的试剂每3周给予一次。
[0720]
31e.如实施方式1e-27e中任一项所述的用途,其中所述基于铂的试剂在约21天周期的约第1天给予。
[0721]
32e.如实施方式1e-27e中任一项所述的用途,其中所述基于铂的试剂在21天周期的第1天给予。
[0722]
33e.如实施方式1e-32e中任一项所述的用途,其中所述癌症是膀胱癌。
[0723]
34e.如实施方式1e-32e中任一项所述的用途,其中所述癌症是宫颈癌。
[0724]
35e.如实施方式34e所述的用途,其中所述对象不是治愈性疗法的候选者。
[0725]
36e.如实施方式35e所述的用途,其中治愈性疗法包括放疗和/或内脏切除手术。
[0726]
37e.如实施方式34e-36e中任一项所述的用途,其中所述对象尚未接受过针对所述宫颈癌的在先全身疗法。
[0727]
38e.如实施方式34e-37e中任一项所述的用途,其中所述宫颈癌是腺癌、腺鳞癌、鳞状细胞癌或非鳞状细胞癌。
[0728]
39e.如实施方式38e所述的方法,其中所述宫颈癌是腺癌。
[0729]
40e.如实施方式38e所述的用途,其中所述宫颈癌是腺鳞癌。
[0730]
41e.如实施方式38e所述的用途,其中所述宫颈癌是鳞状细胞癌。
[0731]
42e.如实施方式38e所述的用途,其中所述宫颈癌是非鳞状细胞癌。
[0732]
43e.如实施方式34e-42e中任一项所述的用途,其中所述宫颈癌是晚期宫颈癌。
[0733]
44e.如实施方式43e所述的用途,其中所述晚期宫颈癌是3期或4期宫颈癌。
[0734]
45e.如实施方式43e或44e所述的用途,其中所述晚期宫颈癌是转移性宫颈癌。
[0735]
46e.如实施方式34e-45e中任一项所述的用途,其中宫颈癌是复发性宫颈癌。
[0736]
47e.如实施方式1e-46e中任一项所述的用途,其中单甲基奥瑞他汀是单甲基奥瑞他汀e(mmae)。
[0737]
48e.如实施方式1e-47e中任一项所述的用途,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段是单克隆抗体或其单克隆抗原结合片段。
[0738]
49e.如实施方式1e-48e中任一项所述的用途,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包括:
[0739]
(i)cdr-h1,包含seq id no:1的氨基酸序列;
[0740]
(ii)cdr-h2,包含seq id no:2的氨基酸序列;和
[0741]
(iii)cdr-h3,包含seq id no:3的氨基酸序列;和
[0742]
其中所述轻链可变区包括:
[0743]
(i)cdr-l1,包含seq id no:4的氨基酸序列;
[0744]
(ii)cdr-l2,包含seq id no:5的氨基酸序列;和
[0745]
(iii)cdr-l3,包含seq id no:6的氨基酸序列,其中抗tf抗体或其抗原结合片段的cdr由imgt编号方案定义。
[0746]
50e.如实施方式1e-49e中任一项所述的用途,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含与seq id no:7的氨基酸序列有至少约85%同一性的氨基酸序列,所述轻链可变区包含与seq id no:8的氨基酸序列有至少约85%同一性的氨基酸序列。
[0747]
51e.如实施方式1e-50e中任一项所述的用途,其中抗体-药物偶联物的抗tf抗体或其抗原结合片段包括重链可变区和轻链可变区,其中所述重链可变区包含seq id no:7的氨基酸序列,所述轻链可变区包含seq id no:8的氨基酸序列。
[0748]
52e.如实施方式1e-51e中任一项所述的用途,其中所述抗体-药物偶联物的抗tf抗体是替索土单抗或其生物类似物。
[0749]
53e.如实施方式1e-52e中任一项所述的用途,其中抗体-药物偶联物还包括抗tf抗体或其抗原结合片段与单甲基奥瑞他汀之间的接头。
[0750]
54e.如实施方式53e所述的用途,其中接头是可裂解肽接头。
[0751]
55e.如实施方式54e所述的用途,其中可裂解肽接头具有式:-mc-vc-pab-,其中:
[0752]
a)mc是:
[0753][0754]
b)vc是二肽缬氨酸-瓜氨酸,并且
[0755]
c)pab是:
[0756][0757]
56e.如实施方式53e-55e中任一项所述的用途,其中接头附接至抗tf抗体的巯基残基,其通过所述抗tf抗体或其抗原结合片段的部分还原或充分还原而得。
[0758]
57e.如实施方式56e所述的用途,其中接头附接至mmae,其中抗体-药物偶联物具有如下结构:
[0759][0760]
其中,p表示1至8的数字,s代表所述抗tf抗体的巯基残基,并且ab指代所述抗tf抗体或其抗原结合片段。
[0761]
58e.如实施方式57e所述的用途,其中抗体-药物偶联物群体中p的平均值约为4。
[0762]
59e.如实施方式1e-58e中任一项所述的用途,其中所述抗体-药物偶联物是替索土单抗维多汀或其生物类似物。
[0763]
60e.如实施方式1e-59e中任一项所述的用途,其中抗体-药物偶联物的给药途径是静脉内。
[0764]
61e.如实施方式1e-60e中任一项所述的用途,其中所述基于铂的试剂选自下组:卡铂、顺铂、奥沙利铂和奈达铂。
[0765]
62e.如实施方式1e-60e中任一项所述的用途,其中所述基于铂的试剂是卡铂。
[0766]
63e.如实施方式1e-60e中任一项所述的用途,其中所述基于铂的试剂是顺铂。
[0767]
64e.如实施方式1e-63e中任一项所述的用途,其中所述基于铂的试剂的给药途径是静脉内。
[0768]
65e.如实施方式1e-64e中任一项所述的用途,其中所述基于铂的试剂和所述抗体-药物偶联物依次给予。
[0769]
66e.如实施方式1e-64e中任一项所述的用途,其中所述基于铂的试剂和所述抗体-药物偶联物同时给予。
[0770]
67e.如实施方式1e-66e中任一项所述的用途,其中至少约0.1%、至少约1%、至少约2%、至少约3%、至少约4%、至少约5%、至少约6%、至少约7%、至少约8%、至少约9%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%的宫颈癌细胞表达tf。
[0771]
68e.如实施方式1e-67e中任一项所述的用途,其中所述对象中的一种或多种治疗效果在给予所述抗体-药物偶联物和所述基于铂的试剂后相对于基线得到改善。
[0772]
69e.如实施方式68e所述的用途,其中一种或多种治疗效果选自下组:源自所述宫颈癌的肿瘤的大小、客观缓解率、缓解持续时间、达到缓解时间、无进展生存期和总生存期。
[0773]
70e.如实施方式1e-69e中任一项所述的用途,其中相对于给予所述抗体-药物偶联物和所述基于铂的试剂之前源自宫颈癌的肿瘤的大小,源自宫颈癌的肿瘤的大小减小至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0774]
71e.如实施方式1e-70e中任一项所述的用途,其中客观缓解率为至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约60%、至少约70%或至少约80%。
[0775]
72e.如实施方式1e-71e中任一项所述的用途,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个
月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的无进展生存期。
[0776]
73e.如实施方式1e-72e中任一项所述的用途,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述对象展现出至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年的总生存期。
[0777]
74e.如实施方式1e-73e中任一项所述的用途,其中在给予所述抗体-药物偶联物和基于铂的试剂后,所述抗体-药物偶联物所致的缓解持续时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约18个月、至少约2年、至少约3年、至少约4年或至少约5年。
[0778]
75e.如实施方式1e-74e中任一项所述的用途,其中对象具有一个或多个不良事件,并且进一步接受其他治疗剂以消除一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0779]
76e.如实施方式1e-75e中任一项所述的用途,其中对象处于发展出一个或多个不良事件的风险,并且进一步接受其他治疗剂以预防一个或多个不良事件或降低一个或多个不良事件的严重程度。
[0780]
77e.在实施方式75e或76e所述的用途中,其中所述一个或多个不良事件是出血、恶心、脱发、结膜炎、角膜炎、结膜溃疡、粘膜炎、便秘、食欲下降、腹泻、呕吐、中性粒细胞减少、发热性中性粒细胞减少、血小板计数减少或出血增加。
[0781]
78e.如实施方式75e-77e中任一项所述的用途,其中,所述一个或多个不良事件是3级或更高级的不良事件。
[0782]
79e.如实施方式75e-77e中任一项所述的用途,其中,所述一个或多个不良事件是严重不良事件。
[0783]
80e.如实施方式75e-79e中任一项所述的用途,其中所述一个或多个不良事件是结膜炎、结膜溃疡和/或角膜炎,并且所述其他治疗剂是无防腐剂的润滑滴眼剂、眼部血管收缩剂和/或类固醇滴眼剂。
[0784]
81e.如实施方式1e-80e中任一项所述的用途,其中对象是人。
[0785]
82e.如实施方式1e-81e中任一项所述的用途,其中所述抗体-药物偶联物在包含所述抗体-药物偶联物和药学上可接受的运载体的药物组合物中。
[0786]
83e.如实施方式1e-82e中任一项所述的用途,其中所述基于铂的试剂在药物组合物中,所述药物组合物包含所述基于铂的试剂和药学上可接受的运载体。
[0787]
通过参考以下实施例将更全面地理解本发明。然而,它们不应解释为对本发明范围的限制。应理解,本文所述的实施例和实施方式仅用于说明目的,本领域技术人员应了解据此作出的各种修饰或改变,且它们包括在本技术的主旨和权益以及所附权利要求书的范围内。
实施例
[0788]
实施例1:宫颈癌小鼠模型中替索土单抗维多汀与基于铂的试剂组合的抗肿瘤活性
[0789]
替索土单抗维多汀是包括与组织因子(tf)结合的抗体、蛋白酶可裂解接头、微管破坏剂mmae的抗体-药物偶联物。tf是在包括宫颈癌在内的多种肿瘤中异常表达的蛋白质,并且与不良预后相关。参见y等clin chim acta.364(1-2):12-21,2006和cocco e等bmc cancer.11:263,2011。替索土单抗维多汀选择性靶向tf,以将经临床验证的毒性净负荷递送至肿瘤细胞。参见breij ec等cancer res.2014;74(4):1214-1226和chu aj.int j inflam.2011;2011。doi:10.4061/2011/367284。
[0790]
顺铂(一种基于铂的试剂)与紫杉醇(一种微管抑制剂)组合使用,作为治疗ivb期、复发性或持续性宫颈癌的标准护理选择。参见kitagawa r等,j clin oncol.,33:2129-2135,2015。本文评估了替索土单抗维多汀与基于铂的试剂(如顺铂)的组合用于治疗宫颈癌。
[0791]
材料和方法
[0792]
在balb/c裸鼠(冠科生物技术有限公司(crown bioscience inc.))的患者衍生的异种移植(pdx)小鼠模型中评估替索土单抗维多汀组合顺铂的体内抗肿瘤功效。异种移植物源自癌症患者的肿瘤样品。初次植入裸鼠后,建立和鉴定pdx模型。肿瘤异种移植物传代大约3-5次,直到建立稳定的生长模式。肿瘤碎片获自裸鼠中系列传代的异种移植物。将肿瘤切成2-3mm直径的碎片并置于磷酸盐缓冲液(pbs)中直到皮下植入。该实验使用宫颈癌pdx模型(宫颈异种移植模型cv1248[r4p5];冠科生物技术有限公司)。通过每周至少两次卡尺测量确定肿瘤大小,并将肿瘤体积计算为0.5x长度x宽度2。当肿瘤达到200mm3的体积时,将小鼠随机分组成11个组(各治疗组7-8只小鼠)。用下述方案通过静脉内注射治疗小鼠:1)仅替索土单抗维多汀,剂量水平为0.5mg/kg、1mg/kg、2mg/kg或4mg/kg,在治疗的第0天和第7天提供;2)仅顺铂,剂量为4mg/kg,在治疗的第0天、第7天和第14天提供;3)替索土单抗维多汀组合顺铂,替索土单抗维多汀剂量水平为0.5mg/kg、1mg/kg、2mg/kg或4mg/kg并在治疗的第0天和第7天提供,顺铂剂量为4mg/kg并在治疗的第0天、第7天和第14天提供;4)igg1同种型对照,剂量为4mg/kg,在治疗的第0天和第7天提供;或5)igg1-mmae对照,剂量为4mg/kg,在治疗的第0天和第7天提供。观测小鼠疾病的临床症状。小鼠饲养在独立通风笼盒(ivc)中,每笼4或5只小鼠,并通过耳标识别。
[0793]
为了确定对照组和治疗组中的肿瘤体积之间是否存在统计学上显著的差异,在所有组都完整的最后一天(即第38天)使用曼-惠特尼(mann-whitney)分析将治疗组中的肿瘤体积与对照组(例如,治疗组对比igg1-mmae对照)中的肿瘤体积进行比较。对于生存分析(肿瘤体积截止为1,000mm3)。在kaplan-meier图上进行进行对数秩(mantel-cox)分析,并且截止设为肿瘤体积》1,000mm3。
[0794]
结果
[0795]
在宫颈癌小鼠模型中,单独用替索土单抗维多汀进行治疗高效地抑制肿瘤生长(图1a-c)并延长生存期(图1d和1e),剂量为2mg/kg和4mg/kg。单独用顺铂进行治疗也抑制肿瘤生长(图1a-c)并延长生存期(图1d和1e)。相较于单用替索土单抗维多汀或单用顺铂,用2mg/kg或4mg/kg替索土单抗维多汀与顺铂组合治疗增强抗肿瘤活性(图1a-e)。
[0796]
表a.统计学分析。
[0797][0798][0799]
实施例2:膀胱癌小鼠模型中替索土单抗维多汀与基于铂的试剂组合的抗肿瘤活性
[0800]
本文评估了替索土单抗维多汀与基于铂的试剂(如顺铂)的组合用于治疗膀胱癌。
[0801]
材料和方法
[0802]
在雌性crl:nmri-foxn1
nu
(envigo rms sar,法国)裸鼠(查尔斯河探索研究服务公司(charles river discovery research services))的pdx小鼠模型中评估替索土单抗维多汀组合顺铂的体内抗肿瘤功效。异种移植物源自癌症患者的肿瘤样品。初次植入裸鼠后,建立和鉴定pdx模型。肿瘤异种移植物传代大约3-5次,直到建立稳定的生长模式。肿瘤碎片获自裸鼠中系列传代的异种移植物。将肿瘤切成3-4mm直径的碎片并置于磷酸盐缓冲液(pbs)中直到皮下植入。该实验使用膀胱癌pdx模型(膀胱癌异种移植模型bxf1036;查尔斯河探索研究服务公司)。通过每周至少两次卡尺测量确定肿瘤大小,并将肿瘤体积计算为0.52x长度x宽度2。当肿瘤达到50-250mm3的体积时,将小鼠随机分组成5个组(各治疗组10只小鼠)。用下述方案治疗小鼠:1)仅替索土单抗维多汀,剂量水平为0.5mg/kg,在治疗的第1天提供;2)仅顺铂,剂量为2mg/kg,在治疗的第1天和第8天提供;3)替索土单抗维多汀组合顺铂,替索土单抗维多汀剂量水平为0.5mg/kg并在治疗的第1天提供,顺铂剂量为2mg/kg并在治疗的第1天和第8天提供;4)igg1同种型对照,剂量为0.5mg/kg,在治疗的第1天提供;或5)igg1-mmae对照,剂量为0.5mg/kg,在治疗的第1天提供。igg1同种型对照,igg1-mmae对照和替索土单抗维多汀各自在pbs中并静脉注射。顺铂在0.9%nacl中,皮下注射。观测小鼠疾病的临床症状。小鼠饲养在独立通风笼盒(ivc)中,每笼最多5只小鼠,并通过耳标鉴定。
[0803]
为了确定对照组和治疗组中的肿瘤体积之间是否存在统计学上显著的差异,在所
有组都完整的最后一天(即第25天)使用曼-惠特尼分析将治疗组中的肿瘤体积与对照组(例如,igg1-mmae对照、单独替索土单抗维多汀或单独顺铂)中的肿瘤体积进行比较。在第32天进行了替索土单抗维多汀组合顺铂治疗组与单独替索土单抗治疗组或单独顺铂治疗组之间差异的统计分析。
[0804]
在kaplan-meier图上绘制肿瘤进展,并且截止设为肿瘤体积》500mm3。使用对数秩分析在kaplan-meier图上比较经替索土单抗维多汀组合顺铂治疗的小鼠与经igg1-mmae对照、单独替索土单抗维多汀或单独顺铂治疗的小鼠的kaplan-meier曲线。
[0805]
结果
[0806]
在膀胱癌的pdx模型中,单独用替索土单抗维多汀进行治疗高效地抑制肿瘤生长(图2a-c)并延长生存期(图2d)。单独用顺铂治疗(图2a-c)也抑制肿瘤生长并延长生存期(图2d)。相较于单独替索土单抗维多汀或单独顺铂,用替索土单抗维多汀与顺铂组合治疗在膀胱癌的pdx模型中增强抗肿瘤活性(图2a-d)。统计学分析的结果示于表b。
[0807]
表b.统计学分析。
[0808][0809]
实施例3:宫颈癌小鼠模型中替索土单抗维多汀与基于铂的试剂组合的抗肿瘤活性
[0810]
本文评估了替索土单抗维多汀与基于铂的试剂(如卡铂)的组合用于治疗宫颈癌。
[0811]
材料和方法
[0812]
在雌性balb/c裸鼠(冠科生物技术[太仓]有限公司(crown bioscience[taicang]inc.))的患者衍生的异种移植(pdx)小鼠模型中评估替索土单抗维多汀组合顺铂的体内抗肿瘤功效。异种移植物源自癌症患者的肿瘤样品。肿瘤碎片获自裸鼠中系列传代的异种移植物。将肿瘤切成2-4mm直径的碎片并置于磷酸盐缓冲液(pbs)中直到皮下植入。该实验使用宫颈癌pdx模型(宫颈异种移植模型cv1248[p3];冠科生物技术有限公司)。通过每周至少两次卡尺测量确定肿瘤大小,并将肿瘤体积计算为0.5x长度x宽度2。当肿瘤达到150mm3的平均体积时,将小鼠随机分组成7个组(各治疗组10只小鼠)。将随机分组日指定为第0天。用下述方案通过静脉内注射治疗小鼠:1)仅替索土单抗维多汀,剂量水平为2mg/
kg,在第0天、第7天和第14天提供;2)仅卡铂(赛莱克化学品公司(selleck chemicals),目录号s121511),剂量为40mg/kg或80mg/kg,在第0天、第7天和第14天提供;3)替索土单抗维多汀组合卡铂,替索土单抗维多汀剂量水平为2mg/kg并在第0天、第7天和第14天提供,卡铂剂量为40mg/kg或80mg/kg并在第0天、第7天和第14天提供;4)igg1同种型对照,剂量为2mg/kg,在第0天、第7天和第14天提供;或5)igg1-mmae对照,剂量为2mg/kg,在第0天、第7天和第14天提供。观测小鼠疾病的临床症状。小鼠饲养在独立通风笼盒(ivc)中,每笼最多5只小鼠,并通过耳标鉴定。为了确定对照组和治疗组中的肿瘤体积之间是否存在统计学上显著的差异,在所有组都完整的最后一天(即第20天)使用mann-whitney分析将治疗组中的肿瘤体积与对照组(例如,治疗组相对igg1-mmae对照)和组合治疗组中的肿瘤体积进行比较。对于无进展生存期分析(肿瘤大小截止750mm3),在kaplan-meier图上进行对数秩分析。
[0813]
在宫颈癌的小鼠pdx模型中,单独用2mg/kg替索土单抗维多汀进行治疗有效地抑制肿瘤生长(图3a和3b)。用单独卡铂以40或80mg/kg治疗不抑制肿瘤生长(图3a和3b)。相较于单独卡铂,用2mg/kg替索土单抗维多汀组合40mg/kg卡铂高效地增强了抗肿瘤活性(图3a和3b)。相较于单独的卡铂或替索土单抗维多汀,2mg/kg替索土单抗维多汀和80mg/kg卡铂组合高效地增强了抗肿瘤活性。相较于单药,所有组合延长了无进展生存期(肿瘤大小截止750mm3)(图3c)。统计学分析的结果示于表c。
[0814]
表c.统计学分析
[0815][0816]
实施例4:宫颈癌小鼠异种移植模型中替索土单抗维多汀与卡铂组合的抗肿瘤活性
[0817]
本文评估了替索土单抗维多汀与基于铂的试剂卡铂的组合用于治疗宫颈癌。
[0818]
材料和方法
[0819]
在nmri nu/nu小鼠的患者衍生的异种移植(pdx)宫颈癌小鼠模型(模型cexf663)中评估替索土单抗维多汀组合卡铂的体内抗肿瘤功效。异种移植物源自癌症患者的肿瘤样品。初次植入裸鼠后,建立和鉴定pdx模型。肿瘤异种移植物传代大约3-5次,直到建立稳定的生长模式。肿瘤碎片获自裸鼠中系列传代的异种移植物。将肿瘤切成3-4mm直径的碎片并置于pbs中直到皮下植入。通过每周两次卡尺测量确定肿瘤大小,并将肿瘤体积计算为0.5x长度x宽度2。当肿瘤达到约50-250mm3的体积时,将小鼠随机分组成7个组(各治疗组10只小鼠)。给予小鼠下述治疗,所有均每周提供,持续4周(qwx4):1)单独使用替索土单抗维多汀,2mg/kg(静脉内);2)单独使用卡铂,40mg/kg(腹膜内);3)2mg/kg替索土单抗维多汀(静脉内)组合40mg/kg卡铂(腹膜内);4)igg1同种型对照,2mg/kg(静脉内);或5)igg1-mmae对照,
2mg/kg(静脉内)。
[0820]
绘制各治疗组的平均肿瘤体积(图4a)。为了确定对照组和治疗组中的肿瘤体积之间是否存在统计学上显著的差异,在所有组都完整的最后一天使用曼-惠特尼分析将治疗组中的肿瘤体积进行比较(表d)。替索土单抗维多汀和卡铂的组合治疗比用单药治疗组的两个模型中显著更强力,如在接受组合治疗的小鼠中肿瘤大小显著减小所示。无进展生存分析(使用750mm3的肿瘤体积截止)证明了与单药治疗相比组合组的无进展生存延长(曼-惠特尼分析;图4b;表d)。
[0821]
表d.统计学分析
[0822][0823][0824]
实施例5:一线复发性或ivb期宫颈癌中替索土单抗维多汀单独或与基于铂的试剂组合的ii期试验
[0825]
i/ii期试验证明了给予复发的、复发性和/或转移性宫颈癌患者的2.0mg/kg替索土单抗维多汀的稳健功效和可控的安全性概况(nct02001623)。该初步数据显示出针对存在高度未满足需要的群体的积极益处风险概况。需要在更大队列的宫颈癌患者中进一步研究替索土单抗维多汀作为单一疗法和与治疗剂(例如基于铂的试剂)组合。
[0826]
本文评估了0.9,mg/kg、1.2mg/kg、1.3mg/kg或2.0mg/kg替索土单抗维多汀单独或与卡铂(基于铂的试剂)组合作为一线疗法在复发性或ivb期宫颈癌患者中的功效、安全性和耐受性。
[0827]
方法
[0828]
该ii期、开放标签、多中心试验评估替索土单抗维多汀单独或与卡铂组合在一线复发性或ivb期子宫颈鳞状细胞癌、腺鳞癌或腺癌患者中的功效、安全性和耐受性,所述患者不适合使用手术和/或放疗的治愈性治疗并且未曾接受过针对其复发性或ivb期疾病的在先全身疗法。患有复发性疾病的通过盆腔廓清术方法进行治愈性疗法的候选人对象不适格参加试验。
[0829]
将对象对称地分配至6个治疗组之一。分配的方式是尽量减少疾病状态(转移性/复发性)和组织学(鳞状/非鳞状)的不平衡。适格对象用:替索土单抗维多汀1.3mg/kg q3w、替索土单抗维多汀2.0mg/kg q3w、替索土单抗维多汀0.9mg/kg 3q4w 卡铂auc 5q3w、替索土单抗维多汀1.2mg/kg 3q4w 卡铂auc 5q3w、替索土单抗维多汀1.3mg/kg q3w 卡铂auc 5q3w或替索土单抗维多汀2.0mg/kg q3w 卡铂auc 5q3w治疗。对于q3w治疗周期,每21天(
±
3天)出现一个治疗周期;对于3q4w治疗周期,每28天(
±
4天)出现一个治疗周期。所有的治疗成分都是静脉注射(iv)。大约有60名年龄≥18岁的对象入组试验。试验的持续时间为大约7年。试验招募对象的纳入标准和排除标准示于表1。
[0830]
表1.纳入和排除标准的列表
[0831]
[0832]
[0833]
[0834]
[0835][0836]
卡铂以用于静脉内输注的溶液提供。其以每分钟auc 5mg/ml的剂量输注1小时来递送。卡铂的计算剂量将基于对象的肾小球滤过率(gfr以ml/分钟)和通过卡尔(calvert)的目标浓度相对时间曲线下面积(auc以mg/ml分钟)。gfr可以通过算得肌酐清除率估计或基于局部机构标准。与基线相比,体重变化≥10%或出现ctcae≥2级的肾毒性(血清肌酐》1.5uln)的对象,需要重新计算后续周期的卡铂剂量。对象应按照机构护理标准接受卡铂的预用药(pre-medication)。在给予卡铂后至少30分钟开始通过静脉输注给予替索土单抗维多汀。将含有40mg替索土单抗维多汀的冻干小瓶保存在2℃至8℃的冰箱中。将替索土单抗维多汀在4ml水中重建,得到包含10mg/ml的替索土单抗维多汀、30mm的组氨酸、88mm的蔗糖和165mm的d-甘露醇的重建溶液。重建抗体-药物偶联物溶液的ph为6.0。根据为对象计算的剂量,将重建的替索土单抗维多汀稀释至0.9%nacl 100ml输注袋中。替索土单抗维多汀小瓶重建完毕后,24小时内完成静脉内输注。使用0.2μm在线过滤器进行静脉内输注。从准备好的输注袋给予全部100ml的体积。未提供死体积。
[0837]
目标和终点描述于表2。治疗对象,直到疾病进展、毒性或撤回同意。在32周内每6周获得一次成像,此后每12周获得一次,从第一次用药之日起计算。试验中的影像学持续直到对象经历放射性疾病进展、开始新的抗癌治疗、撤回同意或对象死亡。肿瘤缓解是在三个时间点进行分析;分别是无效性评估、早期功效评估和主要功效评估。
[0838]
表2.目标和终点
[0839][0840][0841]
对于不耐受方案指定剂量方案的对象,允许替索土单抗维多汀的降低剂量,以使对象能够继续单独用替索土单抗维多汀或与卡铂组合治疗(表3)。卡铂的剂量也可以减小(表4)。
[0842]
表3.替索土单抗维多汀剂量减小方案
[0843]
替索土单抗维多汀的现行的剂量替索土单抗维多汀的减小的剂量2.0mg/kg1.3mg/kg
1.3mg/kg0.9mg/kg*1.2mg/kg0.9mg/kg*0.9mg/kg0.65mg/kg
[0844]
*将允许不超过2个替索土单抗维多汀的剂量减小。如果第二次替索土单抗维多汀剂量减少后再次出现ae,那么对象必须永久地停止试验治疗。
[0845]
表4.卡铂剂量减小方案
[0846]
卡铂的现行剂量卡铂的减小剂量auc 5auc 4*
[0847]
*如果与卡铂相关的(s)ae再出现并且在治疗持续超过12周后并不降至≤1级,那么对象必须停止卡铂。不允许剂量减小到auc 4以下。
[0848]
在先前的试验中,在单独使用替索土单抗维多汀进行治疗期间发现了特别关注的三个不良事件:1)眼部不良事件;2)周围神经病变的不良事件;和3)出血的不良事件。
[0849]
就眼部ae而言:与替索土单抗维多汀治疗相关的1-2级结膜炎的ae常有报告。实施全面的缓解计划和预防措施,大大降低了眼部不良事件的频率和严重程度。在该试验中,为了以防止眼部ae,两个治疗组(即,单独使用替索土单抗维多汀单独或与卡铂组合)中的所有对象必须坚持下述眼部预先药物指南:1)在试验的整个治疗阶段使用无防腐剂的润滑滴眼剂(即,从第一剂替索土单抗维多汀直到安全性随访)。应当根据产品处方信息给予润滑滴眼剂;2)推荐在用替索土单抗维多汀治疗时从第一剂直到安全性随访期间不要佩戴隐形眼镜;3)输注期间使用基于冰箱的眼部冷却垫,例如thera pearl眼罩之类,其将根据眼部冷却垫所提供的说明在即将输注前给予;4)输注前给予局部眼部血管收缩剂(酒石酸溴莫尼定的0.2%滴眼剂之类,在即将开始输注前每眼各滴3滴;否则根据产品处方信息使用)。如果对象由于不良反应而对眼部血管收缩剂不耐受,可以停止继续使用它们的治疗;和5)在各治疗周期最初的3天期间,施用类固醇滴眼剂(地塞米松0.1%滴眼剂或等同物)(即,开始替索土单抗维多汀输注前给予第一滴剂;之后继续治疗72小时)。应当以每只眼睛1滴给予类固醇滴眼剂,一日三次,持续3天,或根据产品处方信息使用。眼部ae的指南示于表5。
[0850]
表5.眼部不良事件的剂量调整和毒性控制指南。
[0851]
[0852]
[0853]
[0854][0855]
就周围神经病(包括周围神经病;周围感觉神经病;周围运动神经病;多发性神经病)的ae而言:周围神经病变是对使用基于铂和紫杉醇的化疗以及基于mmae的adc众所周知的不良反应,并且在大约35%接受替索土单抗维多汀治疗的对象中报道。报道的病例大多为1-2级;然而,周围神经病是永久中止替索土单抗维多汀治疗的首要原因。ae或周围神经病变ae的指南示于表6。
[0856]
就出血的ae而言:由于替索土单抗维多汀的作用方式,出血事件被认为特别令人关注。鼻出血是最常报道的ae,但是几乎所有病例均为1级。此外,没有观察到活化部分促凝血酶原激酶时间(aptt)或凝血酶原时间(pt)的临床相关扰动。剂量调整和毒性控制指南就
位(表6)。
[0857]
不良反应(ae)如流血、出血、肝酶升高,粘膜炎、中性粒细胞减少症和周围神经病变可能与替索土单抗维多汀给药相关联。血小板计数减少、中性粒细胞减少症、呕吐和神经病变可能与卡铂给药相关。提供了剂量修改和毒性控制指南,针对替索土单抗维多汀和卡铂组合治疗相关联的ae,例如出血、肝功能异常、粘膜炎和神经病变(表6)以及血小板减少症、中性粒细胞减少症、呕吐(表7)。
[0858]
表6.针对卡铂组合索土单抗维多汀治疗组相关联的ae(出血、肝功能异常、粘膜炎和神经病变)的剂量修改和毒性控制指南
[0859]
[0860]
[0861][0862]
inr=国际标准化比率
[0863]1除肺部或cns出血外的任何其他出血。
[0864]
表7.针对卡铂组合索土单抗维多汀治疗组相关联的ae(血小板减少症、中性粒细胞减少症、呕吐)的剂量修改和毒性控制指南
[0865]
[0866]
[0867][0868]
dl=剂量水平;gr=级别
[0869]1复发≥3级事件后停止卡铂。联系投资方,以讨论剂量减少或停止替索土单抗维多汀。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
