屈大麻酚的透皮递送
1.相关申请的交叉引用
2.本技术要求2019年10月3日提交的美国临时专利申请号62/910,255的权益,该申请通过引用并入本文。
技术领域
3.本公开文本涉及恶心和呕吐的治疗,所述恶心和呕吐诸如由经受化学疗法的患者通常经历的恶心和呕吐。
背景技术:
4.恶心和呕吐是癌症化学疗法的常见副作用。推荐诸如屈大麻酚和5-ht3受体拮抗剂的药物用于治疗与癌症化学疗法相关的恶心和呕吐。有时,可以使用一种或多种药物来预防恶心和呕吐(参见herrsted j.,等人,2016 updated mascc/esmo consensus recommendations:prevention of nausea and vomiting following high emetic risk chemotherapy.support care cancer.2017年1月;25(1):277-288.电子版2016年7月22日)。
5.屈大麻酚是芝麻油中的δ-9-四氢大麻酚(δ-9-thc)的合成形式。屈大麻酚被批准用于治疗呕吐,并且可用作口服胶囊(marinol)和口服溶液(syndros)。正如屈大麻酚口服胶囊的包装说明书或药物标签中所述,该药物“被指示用于治疗对常规止吐治疗没有充分反应的患者的与癌症化学疗法相关的恶心和呕吐。其还被指示用于治疗与aids患者的与体重下降相关的厌食症”(参见nda marinol的标签,贴标签,标签行动日期2006年6月21日,2017年7月13日访问,以下简称“标签(label)”)。
6.屈大麻酚口服胶囊涉及许多缺点。首个挑战是剂量方案。为了止吐效果,建议以下剂量方案:化学疗法前1至3小时,口服施用第一剂5mg/m2。化学疗法后,每2至4小时施用一次药物,每天总共4至6剂。根据临床反应,如果剂量不是足够有效的,则按2.5mg/m2的增量增加剂量,最高至约15mg/m2。这种剂量方案对于已经出现恶心和呕吐的患者并不方便。第二个挑战是,药理学反应是剂量相关的,并且患者间存在变化性。第三个挑战是,在最大剂量下,令人不安的精神症状的可能性增加。第四个挑战是,在口服施用后,屈大麻酚经受首过肝代谢且具有高脂溶性;因此,施用剂量的10%-20%到达体循环。另一个挑战是,在室温下,活性成分屈大麻酚在胶囊中是不稳定的,并且因此将胶囊包装在密闭容器中,并且推荐的储存是在冰箱中或在8℃-15℃之间(参见标签)。在室温下,屈大麻酚胶囊仅可稳定保存3个月。这是由于合成的δ-9-thc表现出快速氧化以及酸和碱降解。此外,在光照和较高温度下,合成的δ-9-thc也会更快降解。因此,如果屈大麻酚胶囊不是冷藏储存的并且在原始容器中,则胶囊中δ-9-thc的浓度将降低,可能低于治疗上所需的浓度。
7.已经使用来自大麻(marijuana)植物大麻(cannabis sativa l.)的天然衍生的δ-9-thc来进行先前研究。然而,很难从植物来源诸如大麻中提取纯的δ-9-thc。这是由于提取物中掺杂有存在于最终产品中的少量其他活性大麻二酚(诸如大麻酚、δ-8-thc、大麻
二酚和大麻环萜酚)。因此,最终提取物中thc的含量取决于提取过程,该量由于thc的作用于精神的特性以及其他考虑而很重要。可替代地,δ-9-thc的合成形式是在与其天然衍生对应物的提取过程不同的更受控程序下开发的。例如,合成产生的δ-9-thc基本上由未污染的δ-9-thc组成,其中没有掺杂有其他活性大麻二酚的存在。因此,与先前发表的使用天然衍生的δ-9-thc的工作(所述工作证明天然提取的δ-9-thc通过大鼠皮肤的最大通量为0.01μg/cm2/h(美国专利号6503532))相比,δ-9-thc的合成形式能够提供改善的透皮透过性。
8.美国专利号6328992也涉及大麻素透皮递送的制备。然而,该公开描述了组合的不同大麻素,并且没有描述单独使用纯的合成δ-9-thc。此外,
‘
992专利的发明人描述了透过性增强剂的使用,所述透过性增强剂并不是药品级并且不包括在美国食品和药物管理局非活性成分列表(fda iig)中。因此,
‘
992的公开未提供具有任何药物效用的组合物。此外,
‘
992专利描述了使用具有在接受介质中的50%乙醇的大鼠皮肤进行透皮透过性测试。然而,乙醇破坏真皮皮肤结构并可能增加体外通量值,因此提供了对用于药物应用的透皮贴剂无密切关系的结果。例如,乙醇处理的大鼠皮肤的渗透性几乎是人尸体皮肤的十倍。
9.美国专利号8449908提供了在96小时内通过人尸体皮肤的10000ng thc累积量的递送。该量表示60ng/cm2/h的通量。可以使用以下公式计算贴剂面积:
10.体外通量(ng/cm2/h)=(css(ng/ml)*cl(l/kg*h)*bw(kg))/贴剂面积(cm2)
11.贴剂面积(cm2)=(css(ng/ml)*cl(l/kg*h)*bw(kg))/体外通量(ng/cm2/h)
12.=(1.38*0.2*70*1000)/60
13.=322cm214.为了递送δ-9-thc的5mg/天的治疗剂量,透皮制剂将需要覆盖患者皮肤的至少325cm2表面积。对于任何透皮药物递送系统(tdds),这是不切实际的贴剂大小。
15.因此,需要可以克服与口服施用和天然来源的δ-9-thc相关的上述缺点的改善的屈大麻酚药物递送系统。如本文所提供的,包含合成δ-9-thc的屈大麻酚透皮递送可以解决与口服药物递送相关的挑战。
技术实现要素:
16.下文描述和说明的以下方面及其实施方案旨在是示例性和说明性的,并不限制范围。
17.在一个方面,提供了一种药物组合物,其包含呈用于透皮递送的剂型的屈大麻酚。
18.在一个方面,所述药物组合物不包含另外的止吐药。
19.在一个方面,屈大麻酚呈选自由共晶、无定形、包衣、结晶、盐、异构体、固溶体、前药、类似物、衍生物、代谢物、溶液、合成、乙醇溶液和天然衍生的δ-9-四氢大麻酚组成的组的形式。
20.在一个实施方案中,屈大麻酚以重量比(w/w)约0.01%-95%或重量体积比(w/v)约0.01%-95%存在于所述组合物中。
21.在一个实施方案中,屈大麻酚选自由无定形屈大麻酚、结晶屈大麻酚、屈大麻酚共晶、包衣屈大麻酚和重量比或重量体积比在0.01%-95%范围内的屈大麻酚乙醇溶液组成的组。
22.在一个实施方案中,屈大麻酚呈盐形式。
23.在一个实施方案中,组合物配制为透皮液体制剂、透皮半固体制剂和/或透皮聚合物基质制剂。
24.在一个实施方案中,所述组合物中包含单独的或呈组合的有效量的载体或成分。在一个实施方案中,所述载体或成分选自由溶剂、胶凝剂、聚合物、渗透增强剂、软化剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、悬浮剂、分散剂、稳定剂、增塑剂、表面活性剂、抗氧化剂和氧化剂组成的组。
25.在一个实施方案中,所述载体或成分以重量比或重量体积比约0.01%-95%的范围存在于所述组合物中。
26.在一个实施方案中,所述药物组合物配制为透皮贴剂。
27.在一个实施方案中,所述透皮贴剂选自由储库型贴剂、微储库型贴剂、基质贴剂、压敏粘合剂贴剂和缓释透皮膜组成的组。
28.在一个实施方案中,所述药物组合物配制为微针。
29.在一个实施方案中,所述微针配制为透皮贴剂。
30.在一个实施方案中,用于治疗和/或预防和/或控制与癌症化学疗法相关的恶心和/或呕吐的方法包括:选择需要治疗和/或预防和/或控制与癌症化学疗法相关的恶心和/或呕吐的患者;和局部应用或指导局部应用如本文所述的药物组合物,其中以一天至少一次进行所述局部应用。
31.在一个实施方案中,所述组合物是液体制剂和/或半固体制剂,其中以一天二至六次、一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次进行所述局部应用。
32.在一个实施方案中,以两天一次、三天一次、四天一次、五天一次、六天一次、一周一次或十天一次局部应用所述组合物。
33.在一个实施方案中,局部应用提供一定时间段内所述透皮贴剂的活性组分的恒定速率递送。
34.在一个实施方案中,局部应用提供一定时间段内屈大麻酚的稳定吸收速率。
35.在一个实施方案中,局部应用实现一定时间段内屈大麻酚的恒定血清水平。
36.在一个实施方案中,相对于一定时间段内屈大麻酚的口服施用,局部应用实现所述时间段内屈大麻酚的血清水平的减小变化性。
37.在一个实施方案中,局部应用实现一定时间段内在治疗范围内的屈大麻酚血浆浓度。
38.在一个实施方案中,用于治疗和/或预防和/或控制与癌症化学疗法相关的恶心和/或呕吐和/或与aids患者的体重减轻相关的厌食症的方法包括:选择需要治疗和/或预防和/或控制与癌症化学疗法相关的恶心和/或呕吐和/或与aids患者的体重减轻相关的厌食症的患者;局部应用或指导局部应用本文所述的药物组合物,其中应用实现屈大麻酚的局部递送用于治疗和/或预防和/或控制与癌症化学疗法相关的恶心和/或呕吐和/或与aids患者的体重减轻相关的厌食症。
39.在一个实施方案中,以一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次或十天一次局部应用所述药物组合物。
40.在一个实施方案中,以一天二至六次、一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次局部应用所述药物组合物。
41.在一个实施方案中,所述药物组合物是液体制剂或半固体制剂。
42.在一个方面,所述药物组合物是一透皮递送系统。
43.除上文描述的示例性方面和实施方案外,其他方面和实施方案通过参考附图及研究以下详述将变得显而易见。
44.本发明方法和组合物等的另外实施方案将根据以下描述、附图、实例和权利要求而显而易见。如从前面和以下描述中可以了解的,本文所述的每个特征,以及此类特征中的两个或更多个的每种组合都包括在本公开文本的范围内,前提是包括在这种组合中的特征互不矛盾。此外,任何特征或特征组合可以具体地排除在本公开的任何实施方案之外。本公开文本的另外方面和优点在以下描述和权利要求中阐述,尤其是在结合所附实例和附图考虑的情况下。
附图说明
45.图1是示出了当经由口服途径(空心圆)或透皮途径(实心圆)递送时药物随时间(以小时计)变化的血浆浓度的图。
具体实施方式
46.在透皮递送中,将透皮贴剂或透皮组合物局部应用于皮肤表面。在局部应用透皮贴剂或透皮组合物的整个持续时间中,药物持续释放并且递送通过完整皮肤(经由跨细胞、细胞间和跨皮肤附属物途径)以实现全身性作用。因此,一旦施加,透皮组合物或透皮贴剂就可以全天内或甚至在多于一天内将药物递送至全身性循环,这取决于其应用的持续时间,所述持续时间可以长达一周或更久。
47.透皮递送可以降低屈大麻酚的给药频率,屈大麻酚目前以每天4-6次口服施用。通过透皮递送,屈大麻酚的透皮组合物或透皮制剂或透皮贴剂可以局部应用于皮肤,从而在整个局部应用持续时间内递送药物。根据需要,局部应用的持续时间可以是一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次。因此,透皮递送可以通过降低给药频率来克服口服递送的多剂量方案。
48.此外,在透皮药物递送中,在整个局部应用持续时间内缓慢且连续地递送药物,因此不存在与一天内多次剂量施用相关的药物血浆浓度的峰值和谷值。因此,通过透皮递送屈大麻酚,患者可以在延长时间段内具有药物的治疗效果,而没有药物血浆浓度的剧烈变化。
49.在透皮递送中,药物通过皮肤递送至全身性循环中,它避开了首过肝代谢,因此只需较少的药物就可以实现所需的治疗活性,从而产生较少不良作用或副作用。屈大麻酚具有高脂溶性,并且在口服施用后经受肝首过代谢,因此施用剂量的10%-20%到达全身性循环,因此与口服剂量相比,在透皮递送的情况下,小剂量的屈大麻酚可以给出所需的治疗效果并且还可以克服与高剂量相关的令人不安的精神症状。
50.此外,与先前系统相比,使用针对批准药物产品列出成分的fda iig数据库,本文所述的透皮δ-9-thc递送提供了几乎多10倍的通过人尸体皮肤的体外透过性。
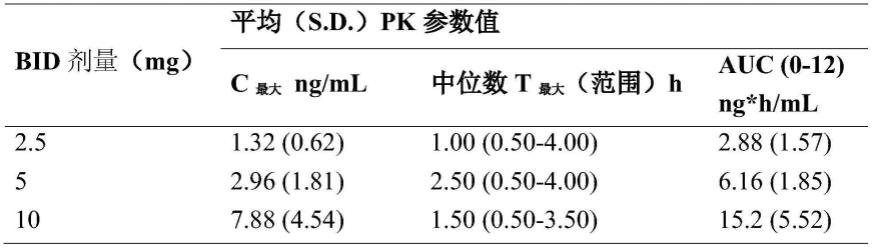
51.例如,根据marinol(屈大麻酚胶囊)的fda标签,在禁食条件下每天两次向健康志愿者(n=34;20-25岁)给予,发现以下药代动力学(pk)参数(参见标签)。
52.表1.参数的汇总
[0053][0054]
另外,根据pk参数,对于通过屈大麻酚胶囊的5mg/天的口服递送的最大血浆浓度是1.32ng/ml,并且对于20mg/天的口服递送,最大血浆浓度是7.88ng/ml。口服递送pk值展示出血浆浓度随时间的峰值和谷值。与口服递送相比之下,透皮药物递送以预定速率递送药物分子并且随时间保持恒定的平均血浆浓度(图1)。
[0055]
平均血浆浓度按以下方式进行计算:
[0056]
对于5mg/天的平均血浆浓度=auc
(0-t)
/t=2.88/12=0.24ng/ml
[0057]
对于20mg/天的平均血浆浓度=15.2/12=1.27ng/ml
[0058]
因此,透皮药物递送系统(tdds)被计算为以0.24-1.27ng/ml的平均血浆浓度递送δ-9-thc。
[0059]
为了预防恶心和呕吐,口服途径常常不是最方便的。患者已经在经历恶心和呕吐并且如果他们在药物施用后不久呕吐,剂量是被吸收还是被呕吐仍然存在不确定性。另一方面,透皮屈大麻酚将通过皮肤递送,这完全消除了这些不确定性。
[0060]
此外,存在与口服屈大麻酚胶囊施用相关的各种另外副作用,诸如中枢神经系统(cns)副作用。副作用是剂量相关的,且因此接受口服剂量的患者需要密切监测,使得可以根据需要调整和减少剂量。
[0061]
可替代地,本文所提供的tdds系统以预定和限定的输入速率提供恒定的药物递送。因此,目前提供的tdds系统由于递送速率恒定而提供恒定的平均血浆浓度,并且未表现出与口服递送δ-9-thc相关的血浆浓度的pk峰值和谷值。因此,与口服递送的对应物相比,目前提供的tdds系统也不太可能引起cns副作用。例如,使用7mg/m2剂量的δ-9-thc未诱导δ-9-thc的副作用。
[0062]
此外,为了避免不良作用,口服剂量必须以每天4至6次提供,而非每天一次服用。另外,口服剂量经受首过代谢,并且口服剂量的仅10%-20%可在血浆中利用,从而导致递送方法效率低下且活性药物大量损失。此外,为了实现来自任何药物分子的治疗效果,药物应具有连续递送以实现稳态血浆浓度或治疗窗中的血浆浓度(在最小与最大治疗有效浓度之间)。因此,本文所提供的针对δ-9-thc的tdds系统解决了基于大麻二酚的药物领域中长期存在且有待满足的需求。
[0063]
此外,透皮递送是容易的、非侵入性的且方便的。施用透皮贴剂或透皮组合物不需要医学监督,因为患者可以自行局部应用透皮贴剂或透皮组合物。
[0064]
关于屈大麻酚,预期在透皮递送的情况下药理学反应的患者间变化性将更小,因
为可以通过控制来自透皮组合物或透皮贴剂的药物递送的速率来控制药物血浆浓度。屈大麻酚的α半衰期为约4小时,通过口服施用,它在体内受到迅速代谢。相比之下,在透皮递送的情况下,可以递送少量的屈大麻酚来实现比口服施用更久的持续时间。与立即释放剂型相比,屈大麻酚的透皮制剂还提供更强的防滥用性。
[0065]
此外,在任何不良作用、副作用或紧急情况的情况下,透皮递送给出通过将透皮贴剂或透皮组合物从皮肤上取下来而随时终止疗法的自由。
[0066]
根据以上所述的预防与癌症化学疗法相关的恶心和呕吐的原因,透皮递送可以提供相比于传统递送系统的患者友好型、简化和方便的治疗方案。透皮递送可以降低屈大麻酚的给药频率。根据需要,给药频率可以是一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次。
[0067]
为了预防与癌症化学疗法相关的恶心和呕吐,为患者开具多种不同的药物,其中一些药物每天多次施用。通过将止吐药配制在透皮贴剂或透皮组合物中为已经由于化学疗法而虚弱和疲惫的患者提供非常简化的剂量方案。根据需要,含有药物的透皮贴剂或透皮组合物的给药频率可以是一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次。这将是对患者依从性的有力补充。
[0068]
屈大麻酚是不稳定的药物。可以通过制备屈大麻酚共晶、包衣屈大麻酚、屈大麻酚晶体、无定形形式和/或惰性物质等来改善屈大麻酚的稳定性。
[0069]
预期想到在一个实施方案中呈包含屈大麻酚的透皮贴剂或递送系统形式的透皮药物递送组合物。透皮递送能够利用通过降低给药频率而简化的治疗方案在预定时间段内以预定速率提供药物血浆浓度。优选地,没有任何限制地,屈大麻酚选自诸如屈大麻酚共晶、屈大麻酚无定形形式、包衣屈大麻酚、屈大麻酚结晶形式的组。
[0070]
如本文所用,“屈大麻酚”是指单独的或呈组合的屈大麻酚的所有形式,例如,屈大麻酚呈以下形式但不限于以下:诸如游离碱或盐或异构体或无定形或结晶或共晶或固溶体或前药或类似物或衍生物或代谢物或包衣形式或δ-9-四氢大麻酚的天然提取物或合成δ-9-四氢大麻酚、屈大麻酚溶液。例如,屈大麻酚的游离形式或其盐或其异构体或其无定形形式或其结晶形式或其共晶或其固溶体或其前药或其类似物或其衍生物或其代谢物或其包衣形式或δ-9-四氢大麻酚的天然提取物或合成δ-9-四氢大麻酚、屈大麻酚乙醇溶液。屈大麻酚可以呈药学上可接受的盐的形式,诸如酸加成盐或碱盐或其溶剂化物,包括其水合物。合适的酸加成盐由形成无毒盐的酸形成。
[0071]
化学名称:(6ar-反式)-6a,7,8,10a-四氢-6,6,9-三甲基-3-戊基-6h-二苯并[b,d]吡喃-1-醇
[0072]
实验式:c
21h30
o2[0073]
分子量:314.47
[0074]
结构:式1
[0075][0076]
屈大麻酚是合成的δ-9-四氢大麻酚。δ-9-四氢大麻酚是存在于大麻中的天然组分。
[0077]
在本公开的实施方案中,没有任何限制地,屈大麻酚的优选形式选自诸如屈大麻酚共晶、屈大麻酚无定形形式、包衣屈大麻酚、屈大麻酚结晶形式的组。可以制备屈大麻酚共晶、包衣屈大麻酚、屈大麻酚结晶形式。
[0078]
药物的无定形形式没有确定的结构。与结晶形式相比,药物的无定形形式具有更高的溶解度。使用不同的技术和方法生产药物的无定形形式。
[0079]
如行业的药物共晶指南的监管分类中所述,“共晶是在同一晶格中由两种或更多种不同分子、通常是药物和共晶形成物(“共形成物(coformer)”)构成的结晶材料”(参见美国卫生和人类服务部食品药品管理局药物评价与研究中心(cder)(u.s.department of health and human services food and drug administration center for drug evaluation and research(cder)),药物共晶监管分类指南行业指南草案(regulatory classification of pharmaceutical co-crystals guidance for industry draft guidance),药品质量/cmc第1修订版,2016年8月,https://www.fda.gov/downloads/drugs/guidances/ucm516813.pdf,2017年7月12日访问)。可获得不同的方法用于制备共晶。每种药物具有不同的化学结构和理化特性,因此难以预测共结晶反应的成功率。在各种实验条件下进行研究以确定用于形成药物共晶的方法(参见nate schultheiss,ann newman.pharmaceutical cocrystals and their physicochemical properties.cryst growth des.2009年6月3日;9(6):2950-2967)。
[0080]
可以用聚合物或其他赋形剂对药物进行包衣。使用不同技术对药物进行包衣。也可以通过胶囊化来增加药物的稳定性。
[0081]
如本文所用,术语“药学上可接受的盐”包括酸加成盐或游离碱的加成盐。术语屈大麻酚的“药学上可接受的盐”在其范围内包括所有可能的异构体及其混合物,以及任何药学上可接受的代谢物、生物前体和/或前药,例如像具有与本公开化合物之一不同结构式的化合物,并且该化合物在给药受试者、例如哺乳动物、特别是人类后,在体内直接或间接地转化为本公开化合物的化合物。
[0082]
在一个实施方案中,屈大麻酚以药学上可接受的盐的形式掺入至透皮系统中,所述药学上可接受的盐的形式作为单一盐、作为盐的组合或者作为碱形式和一种或多种盐形式的组合。屈大麻酚的各种形式的实例包括但不限于诸如游离碱、盐、消旋体、异构体、无定形、结晶、共晶、固溶体、前药、类似物、衍生物、代谢物、溶液和水合物。治疗剂可以呈药学上可接受的盐的形式,诸如酸加成盐或碱盐或其溶剂化物,包括其水合物。合适的酸加成盐由
形成无毒盐的酸形成,并且没有任何限制地,实例是乙酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、硫酸盐、硫酸氢盐、硝酸盐、磷酸盐、磷酸氢盐、磷酸钠、马来酸盐、延胡索酸盐、乳酸盐、酒石酸盐、柠檬酸盐、葡糖酸盐、琥珀酸盐、蔗糖酸盐、苯甲酸盐、甲烷磺酸盐、乙烷磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐。合适的碱盐由形成无毒盐的碱形成,并且没有任何限制地,实例是钠盐、钾盐、铝盐、钙盐、镁盐、锌盐和二乙醇胺盐。
[0083]
如本文所用,术语“受试者”和“患者”可互换使用。如本文所用,术语“患者”是指动物,优选地哺乳动物,诸如非灵长类动物(例如,牛、猪、马、猫、狗、大鼠等)和灵长类动物(例如,猴和人),并且最优选人。在一些实施方案中,受试者是非人动物,诸如家畜(例如,马、猪或牛)或宠物(例如,狗或猫)。在一个具体实施方案中,受试者是人。
[0084]
如本文所用,术语“剂”是指用于在预防、治疗、管理和/或诊断疾病或病症中使用的任何分子、化合物、方法和/或物质。
[0085]
如本文所用,术语“有效量”是指疗法的量,所述量足以使得预防疾病或病症及其一种或多种症状的发展、复发或发作,足以增强或改善另一种疗法的预防效果,降低疾病或病症的严重程度、持续时间,改善疾病或病症的一种或多种症状,防止疾病或病症的进展,引起疾病或病症的消退,和/或增强或改善另一种疗法的治疗效果。
[0086]
如本文所用,短语“药学上可接受的”意指由联邦政府或州政府的监管机构批准的或者在美国药典、欧洲药典或其他通常认可的药典中列出的用于在动物体内且更特别地在人体内使用。
[0087]
如本文所用,术语“治疗剂”是指用于治疗和/或管理疾病或障碍的任何分子、化合物和/或物质。
[0088]
如本文所用,术语“疗法(therapies)”和“疗法(therapy)”可以是指可用于预防、治疗和/或管理疾病或病症或其一种或多种症状的任何方法、组合物和/或剂。在某些实施方案中,术语“疗法(therapy)”和“疗法(therapies)”是指小分子疗法。
[0089]
如本文所用,术语“衍生物”或“衍生的”包括本公开化合物的化学修饰物、或其药学上可接受的盐或其混合物。即“衍生物”可以是本公开化合物的功能等效物,其能够在给定受试者中诱导改善的药理学功能活性。
[0090]
如本文所用,术语“组合物”和“制剂”可互换使用。
[0091]
如本文所用,术语“局部递送”意指通过皮肤将药物递送至全身性循环中。
[0092]
透皮组合物
[0093]
根据某些实施方案,本文所述的透皮组合物用于预防和/或治疗与癌症化学疗法相关的恶心和/或呕吐。
[0094]
根据本文所述的某些实施方案,药物组合物或透皮制剂含有单独的或呈组合的呈选自诸如以下的组的形式的屈大麻酚:共晶、无定形形式、结晶形式、其包衣形式、其溶液和其盐(可以是无水的和/或水合的)。更优选地,透皮制剂可以包含单独的或呈组合的选自以下形式的屈大麻酚:无定形或共晶或结晶或包衣的或其乙醇溶液。
[0095]
本公开文本的一个实施方案可以是透皮药物递送系统,其可以没有任何限制地包括透皮制剂、透皮贴剂、局部制剂、微针、离子电渗疗法或定量透皮喷雾剂。
[0096]
透皮制剂包括液体,没有任何限制地例如像溶液、悬浮液、分散体、乳液。透皮制剂包括半固体,没有任何限制地例如像凝胶、膏剂、乳剂、霜剂、悬浮剂、糊剂、洗剂、香膏。掺入
在透皮贴剂中的液体制剂和/或凝胶制剂是优选的。包含聚合物基质的透皮制剂可以没有任何限制地是粘性基质或非粘性基质。
[0097]
没有任何限制地,透皮贴剂可以包括本领域的所有透皮药物递送系统,优选地但不限于储库型贴剂、基质贴剂、双层基质贴剂、多层基质贴剂、微储库型贴剂、粘性系统、可透皮应用胶带等。
[0098]
在本公开文本的某些实施方案中,透皮贴剂包含储库或基质中含有的屈大麻酚,以及使透皮贴剂粘附至皮肤的粘合剂,以便屈大麻酚从透皮贴剂通过患者皮肤。透皮递送系统可以是闭合的、半闭合的或不闭合的,并且可以是粘性的或非粘性的。
[0099]
在一些实施方案中,透皮贴剂提供了在预定时间段内透皮贴剂的活性组分的恒定速率递送。在一些实施方案中,预定时间段是约24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0100]
在又另外的实施方案中,本文所述的透皮贴剂提供了在预定时间内患者对透皮贴剂的活性组分的稳定吸收速率。在一些实施方案中,预定时间段是24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0101]
在又另外的实施方案中,本文所述的透皮贴剂提供了在预定时间内在患者中透皮贴剂的活性组分的恒定血浆水平。在一些实施方案中,预定时间段是约24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0102]
在又另外的实施方案中,本文所述的透皮贴剂提供了在预定时间内在患者中在治疗范围内的透皮贴剂活性组分血浆浓度。在一些实施方案中,预定时间段是约24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0103]
在又一些实施方案中,本文所述的透皮贴剂实现在预定时间内在患者中活性组分的剂量的减小变化性。在一些实施方案中,预定时间段是约24小时、48小时、72小时、96小时、120小时、144小时、7天、8至13天、两周或15天。
[0104]
本领域中所述的局部制剂没有任何限制地包括例如半固体,诸如膏剂、霜剂、乳液、微乳剂、纳米乳剂、糊剂、香膏、凝胶、洗剂、摩丝;液体,诸如包括溶液、悬浮液、微悬浮液、纳米悬浮液、分散体、纳米分散体等;喷雾剂、气溶胶、乳浆剂等。可以将包含屈大麻酚的局部制剂局部应用至皮肤表面以实现屈大麻酚的透皮递送。
[0105]
本公开的一些实施方案的透皮制剂和/或局部制剂可以包含单独的或呈组合的有效量的载体或成分,没有任何限制地为以下载体或成分,诸如溶剂、胶凝剂、聚合物、可生物降解的聚合物、渗透增强剂、软化剂、皮肤刺激减少剂、缓冲剂、ph稳定剂、增溶剂、悬浮剂、分散剂、稳定剂、增塑剂、增粘剂、表面活性剂、挥发性化学品、抗氧化剂、氧化剂、螯合剂、络合剂、稀释剂、赋形剂、制备贴剂的材料、制备基质贴剂或储库型贴剂的材料。
[0106]
可以将屈大麻酚溶解、悬浮、分散或均匀混合于上述的单一载体、载体混合物和载体组合中。
[0107]
屈大麻酚的所需最佳透皮和/或局部制剂可以没有任何限制地包含单独的或呈其组合的如由实施例1至实施例11所述的以下载体。
[0108]
实施例
[0109]
实施例1
[0110]
透皮制剂和/或局部制剂包含单独的或呈组合的溶剂,包括但不限于醇c1-c20诸
如但不限于(甲醇、乙醇、异丙醇、丁醇、丙醇等)、多元醇、二醇诸如但不限于(丙二醇、聚乙二醇、二丙二醇、己二醇、丁二醇、甘油等)、二醇衍生物、吡咯烷酮诸如但不限于(n甲基2-吡咯烷酮、2-吡咯烷酮等)、亚砜诸如但不限于(二甲基亚砜、癸甲基亚砜等)、二甲基异山梨醇、矿物油、植物油、水、极性溶剂、半极性溶剂、非极性溶剂、可用于制备基质贴剂的挥发性化学品诸如但不限于(乙醇、丙醇、乙酸乙酯、丙酮、甲醇、二氯甲烷、氯仿、甲苯、ipa)、酸(诸如但不限于乙酸、乳酸、乙酰丙酸、脂肪酸)、碱等。在一个实施方案中,所提到的溶剂在重量比或重量体积比0.01%-95%的范围内。
[0111]
实施例2
[0112]
透皮制剂和/或局部制剂包含单独的或呈组合的胶凝剂和/或增稠剂和/或悬浮剂,包括但不限于天然聚合物、多糖及其衍生物诸如但不限于(琼脂、海藻酸和衍生物、肉桂、胶原、明胶、结冷胶、瓜尔胶、果胶、卡拉胶钾或钠、黄蓍胶、黄原胶、柯帕胶、壳聚糖、树脂等)、半合成聚合物及其衍生物诸如(没有任何限制地)纤维素及其衍生物(甲基纤维素、乙基纤维素、羧甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素等)、合成聚合物及其衍生物诸如(没有任何限制地)羧基乙烯基聚合物或卡波姆(卡波普940、卡波普934、卡波普971pnf)、聚乙烯及其共聚物等、粘土诸如但不限于(硅酸盐、膨润土)、二氧化硅、聚乙烯醇、丙烯酸聚合物(丙烯酸树脂)、丙烯酸酯、聚丙烯酸酯共聚物、聚丙烯酰胺、聚乙烯吡咯烷酮均聚物和聚乙烯吡咯烷酮共聚物诸如但不限于(pvp、kollidon 30、泊洛沙姆)、异丁烯、乙酸乙烯酯共聚物、天然橡胶、合成橡胶、压敏粘合剂诸如硅酮聚合物诸如但不限于(bio-psa 4302、bio-psa 4202等)、丙烯酸压敏粘合剂诸如但不限于(duro-tak 87-2156、duro-tak 387-2287等)、聚异丁烯诸如但不限于(聚异丁烯低分子量、聚异丁烯中等分子量、聚异丁烯35000mw等)、丙烯酸共聚物、橡胶基粘合剂、热熔粘合剂、苯乙烯-丁二烯共聚物、膨润土、所有水和/或有机溶剂可溶胀聚合物等。在一个实施方案中,所提及剂在重量比或重量体积比0.1%-70%的范围内。
[0113]
实施例3
[0114]
本公开的透皮制剂和/或局部制剂可以包含单独的或呈组合的本领域技术人员已知的渗透增强剂,没有任何限制地为以下物质,诸如亚砜和类似化学品诸如但不限于(二甲基亚砜、二甲基乙酰胺、二甲基甲酰胺、癸甲基亚砜、二甲基异山梨醇等)、氮酮、吡咯烷酮诸如但不限于(n-甲基-2-吡咯烷酮、2-吡咯烷酮等)、酯、脂肪酸酯诸如但不限于(丙二醇单月桂酸酯、乙酸丁酯、乙酸乙酯、肉豆蔻酸异丙酯、棕榈酸异丙酯、乙酸甲酯、油酸癸酯、单油酸甘油酯、单月桂酸甘油酯、月桂酸月桂酯等)、脂肪酸诸如但不限于(癸酸、辛酸、月桂酸、油酸、肉豆蔻酸、亚油酸、硬脂酸、棕榈酸等)、醇、脂肪醇和二醇诸如但不限于(油醇、nathanol、十二烷醇、丙二醇、甘油等)、醚醇诸如但不限于(二甘醇一乙醚)、尿素、甘油三酯诸如但不限于甘油三乙酸酯、聚氧乙烯脂肪醇醚、聚氧乙烯脂肪酸酯、脂肪醇酯、精油、表面活性剂型增强剂诸如但不限于(brij、十二烷基硫酸钠、吐温、聚山梨醇酯)、萜烯、萜类化合物和书籍“percutaneous penetration enhancers”(eric w.smith,howard i.maibach,2005年11月,crcpress)中提及的所有渗透(penetration)或透过(permeation)增强剂。在一个实施方案中,所提到的剂在重量比或重量体积比0.01%-95%的范围内。
[0115]
实施例4
[0116]
透皮制剂和/或局部制剂包含单独的或呈组合的增塑剂,没有任何限制地包括甘
油及其酯、磷酸酯、二醇衍生物、糖醇、癸二酸酯、柠檬酸酯、酒石酸酯、己二酸酯、邻苯二甲酸酯、甘油三乙酸酯、油酸酯和在书籍“handbook of plasticizers”(george wypych,2004,chem tec publishing)中提及的可用于透皮药物递送系统中的所有增塑剂。在一个实施方案中,所提到的剂在重量比或重量体积比0.01%-95%的范围内。
[0117]
实施例5
[0118]
透皮制剂和/或局部制剂包含单独的或呈组合的软化剂、湿润剂和/或皮肤刺激减少剂,没有任何限制地包括以下物质,如矿脂、羊毛脂、矿物油、聚二甲基硅氧烷、氧化锌、甘油、丙二醇等。在一个实施方案中,所提到的剂在重量比或重量体积比0.01%-95%的范围内。
[0119]
实施例6
[0120]
透皮制剂和/或局部制剂包含单独的或呈组合的增溶剂、表面活性剂、乳化剂、分散剂,没有任何限制地为以下物质:表面活性剂,包括阴离子、阳离子、非离子和两性表面活性剂,诸如商品名span(诸如但不限于span 80、span 20等)的山梨醇酐油酸酯,以及聚山梨醇酯(诸如但不限于聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯80等)、丙二醇单辛酸酯i型、丙二醇单辛酸酯ii型、丙二醇二辛酸酯、中链甘油三酯丙二醇单月桂酸酯ii型、亚油酰聚氧基-6甘油酯、油酰-聚氧基-6-甘油酯、月桂酰-聚氧基-6-甘油酯;聚甘油基-3-二油酸酯二甘醇一乙醚、丙二醇单月桂酸酯i型、聚甘油基-3-二油酸酯、辛酰己酰聚乙二醇-8-甘油酯等、环糊精等。在一个实施方案中,所提到的剂在重量比或重量体积比0.01%95%的范围内。
[0121]
实施例7
[0122]
可以使用不同的技术和成分来增加屈大麻酚在制剂中的稳定性和/或溶解度,没有任何限制地诸如包衣、胶囊化、微胶囊化、纳米胶囊化、冻干、螯合剂、络合剂等。
[0123]
实施例8
[0124]
透皮制剂和/或局部制剂包含单独的或呈组合的辅助ph缓冲剂和ph稳定剂以及本领域技术人员已知的类似化合物以保持制剂的适当ph、优选地在4.0-8.0的范围内,没有任何限制地包含以下物质:诸如磷酸盐缓冲液、醋酸盐缓冲液、柠檬酸盐缓冲液等、酸诸如但不限于(羧酸、无机酸、磺酸、乙烯基羧酸、脂肪酸等)、碱例诸如但不限于(氢氧化钠、氢氧化钾、氢氧化铵、三乙胺、碳酸钠、碳酸氢钠)等。在一个实施方案中,所提到的剂在重量比或重量体积比0.01%-30%的范围内。
[0125]
实施例9
[0126]
透皮制剂和/或局部制剂包含抗氧化剂,诸如但不限于焦亚硫酸钠、柠檬酸、抗坏血酸、bha和bht、氧化剂、稳定剂、脱色剂、防腐剂和类似的化合物或化学品以提供稳定制剂。在一个实施方案中,所提到的剂在重量比或重量体积比0.01%-50%的范围内。
[0127]
实施例10
[0128]
将具有屈大麻酚的透皮制剂和/或局部制剂配制成膏剂和/或霜剂基质、凝胶、洗剂和其他局部制剂。
[0129]
实施例11
[0130]
用于制备呈本领域技术人员已知的例如像但不限于储库型贴剂、基质贴剂、粘合剂中的药物、透皮膜的贴剂形式的本公开透皮递送系统的材料可以包括诸如但不限于单独
的或呈组合的聚合物、共聚物、衍生物、背衬膜、释放膜、释放衬垫等。压敏粘合剂(诸如但不限于有机硅聚合物、基于橡胶的粘合剂、丙烯酸类聚合物、丙烯酸类共聚物、聚异丁烯、丙烯酸-丙烯酸异辛酯共聚物、热熔性粘合剂、聚丁烯等)、背衬膜(诸如但不限于乙烯乙酸乙烯共聚物、乙酸乙烯树脂、聚氨酯、聚氯乙烯、金属箔、聚酯、镀铝膜、聚乙烯等)、释放膜(诸如但不限于微孔聚乙烯膜、微孔聚丙烯膜、控速乙烯乙酸乙烯酯共聚膜等)、释放衬垫(诸如但不限于硅化聚酯膜、氟聚合物涂覆的聚酯膜、聚酯膜、硅化聚对苯二甲酸乙二醇酯膜等)、胶带等。
[0131]
本公开的透皮制剂和/或局部制剂和/或透皮递送系统可以递送至少治疗有效剂量的屈大麻酚。治疗有效的屈大麻酚剂量是指人血浆中用于治疗和/或预防与化学疗法相关的恶心和/或呕吐所需的屈大麻酚治疗浓度。此外,透皮制剂或局部制剂或透皮递送系统中屈大麻酚的精确治疗有效剂量可以由本领域技术人员基于诸如但不限于患者的病症的因素等来确定。透皮制剂或局部制剂或透皮递送系统将可以不同的剂量强度和贴剂大小获得,以基于患者的需求实现最佳治疗效果。
[0132]
在另一实施方案中,本公开的透皮制剂和/或局部制剂和/或透皮递送系统可以递送至少治疗有效剂量的屈大麻酚。治疗有效的屈大麻酚剂量是指人血浆中用于治疗如marinol标签中所述的“与aids患者的体重减轻相关的厌食症”(参见标签)所需的屈大麻酚治疗浓度。此外,透皮制剂或局部制剂或透皮递送系统中屈大麻酚的精确治疗有效剂量可以由本领域技术人员基于诸如但不限于患者的病症等的因素来确定。透皮制剂或局部制剂或透皮递送系统将可以不同的剂量强度和贴剂大小获得,以基于患者的需求实现最佳治疗效果。
[0133]
优选地(但不限于)可以将屈大麻酚的透皮制剂或透皮贴剂以下述剂量方案中的任一种应用于皮肤表面:诸如一天一次、两天一次、三天一次、四天一次、五天一次、六天一次、一周一次、8至约13天一次、两周一次、15天一次。
[0134]
实施例12
[0135]
通过混合如表2中所示的成分来制备用于透皮递送的合成的δ-9-thc制剂(制剂编号001、002、006、007、008和009):
[0136]
表2:透皮的合成δ-9-thc制剂
[0137][0138]
缩略语:tp=二乙二醇单乙基醚p;pg=丙二醇;thc=四氢大麻酚。
[0139]
除thc外,将来自表2的所有组分在搅拌下一起混合18小时。接下来,将在乙醇中的thc添加至赋形剂混合物中以制备最终的透皮制剂。
[0140]
然后对制备的透皮制剂如下进行通量测量测试。在用于研究中之前,将在-80℃下
储存的人尸体皮肤在室温下在磷酸盐缓冲盐水(pbs)中解冻,并且目视检查缺陷。然后使用标准franz扩散池测量透皮通量,所述扩散池由圆柱形供给室和单独的体积为13ml的水夹套圆柱形接受室构成。将人尸体皮肤夹在两个室之间,其中真皮侧面朝接受室。用如上所述制备的thc透皮制剂填充供给室。用接受介质填充接受室,保持在恒温下,并且不断搅拌以在thc扩散通过皮肤并进入接受室时收集thc。确认接受流体始终与皮肤接触很重要。以24h为间隔排空接受室以用于δ-9-thc的测定,并且替换为新鲜的接受溶液。为了保持接受室的漏槽状态,重要的是保持接受室中的δ-9-thc浓度低于其溶解度的10%。实验条件提供于表3中:
[0141][0142]
在96小时(4天)的最少时段内测量thc通过人尸体皮肤的通量,并且通量测量的结果提供于表4中。
[0143]
表4.thc通量结果
[0144][0145]
实施例13
[0146]
通过混合如表5中所示的成分来制备用于透皮递送的另外的合成δ-9-thc制剂(制剂编号010至018):
[0147]
表5:透皮的合成δ-9-thc制剂编号010至018
[0148][0149]
缩略语:thc=四氢大麻酚;pg=丙二醇。
[0150]
通过实施例12中描述的相同程序来制备用于透皮递送的合成δ-9-thc制剂(010-018)。也如实施例12中所述那样进行通量测量。实验条件与实施例12的表3中提供的相同。
[0151]
在96小时(4天)的最少时段内测量thc通过人尸体皮肤的通量,并且通量测量实验的结果提供于表6中。
[0152]
表6.thc通量结果
[0153][0154]
实施例14
[0155]
通过混合如表7中所示的成分来制备用于透皮递送的另外的合成δ-9-thc制剂(制剂编号019至027)。
[0156]
表7:透皮的合成δ-9-thc制剂编号019-027
[0157][0158]
缩略语:thc=四氢大麻酚;pg=丙二醇;nmp=n-甲基吡咯烷酮;gmo=单油酸甘油酯;hpc=羟丙基纤维素。
[0159]
通过实施例12中描述的相同程序来制备用于透皮递送的合成δ-9-thc制剂(019-027)。也如实施例12中所述那样进行通量测量。实验条件与实施例12的表3中提供的相同。
[0160]
在72小时(3天)的最少时段内测量thc通过人尸体皮肤的通量,并且通量测量实验的结果提供于表8中。
[0161]
表8.thc通量结果
[0162][0163]
实施例15
[0164]
通过混合如表9中所示的成分来制备用于透皮递送的另外的合成δ-9-thc制剂(制剂编号028至034):
[0165]
表9:透皮的合成δ-9-thc制剂编号028至034
[0166][0167]
通过实施例12中描述的相同程序来制备用于透皮递送的合成δ-9-thc制剂(制剂编号028至034)。也如实施例12中所述那样进行通量测量。实验条件与实施例12的表3中提供的相同。
[0168]
在120小时(5天)的最少时段内测量穿过人尸体皮肤的thc通量,通量测量试验结果见表10。
[0169]
表10:透皮的合成δ-9-thc制剂
[0170][0171]
实施例16
[0172]
通过混合如表11中所示的成分来制备用于透皮递送贴剂的另外的合成δ-9-thc制剂(制剂编号035至038):
[0173]
表11:透皮的合成δ-9-thc制剂编号035至038
[0174][0175]
为了制备含有合成δ-9-thc的透皮贴剂,除thc外,将来自表11的所有组分在搅拌
下一起混合18小时。接下来,在撒布制剂前30分钟添加thc。使用商业台式撒布机撒布制剂。具体地,将制剂基质均匀地撒布至8x14英寸的释放衬垫片材(诸如3m 9744)上至厚度为0.5mm。然后将片材置于100
°
f下的烘箱中一小时以蒸发掉乙酸乙酯和乙醇粘合剂溶剂。然后用手小心地将具有低透氧性的用于抑制光降解和氧化降解的不透明背衬膜(诸如3m 9730nr膜)应用于片材,以避免形成气泡和空隙。使用圆形模具(直径1.5英寸)切割贴剂(7cm2)以供后续研究。
[0176]
用于以上实施例中的透皮制剂的通量测量的一般程序如下。在使用前,将在-80℃下储存的人尸体皮肤在室温下在pbs中解冻,并且目视检查缺陷。使用标准franz扩散池测量透皮通量,所述扩散池由圆柱形供给室和单独的水夹套圆柱形接受室构成,体积为13ml。将人尸体皮肤夹在两个室之间,其中真皮侧面朝接受室。用于透皮粘合剂贴剂的通量测量的一般方法如下。将释放衬垫从贴剂上剥离,并且将粘合剂表面应用于一块人尸体皮肤(实施例16,仅表11)。将透皮贴剂附着至皮肤,其中贴剂位于与供给室接触的皮肤侧。用接受介质填充接受室,保持在恒温下,并且不断搅拌以在thc从附着的贴剂扩散通过皮肤并进入接受室时收集thc。确认接受流体始终与皮肤接触。以24小时为间隔排空接受室以用于δ-9-thc的测定,并且替换为新鲜的接受溶液。为了保持接受室的漏槽状态,接受室中的δ-9-thc浓度保持低于其溶解度的10%。实验条件与实施例12的表3中提供的相同。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。