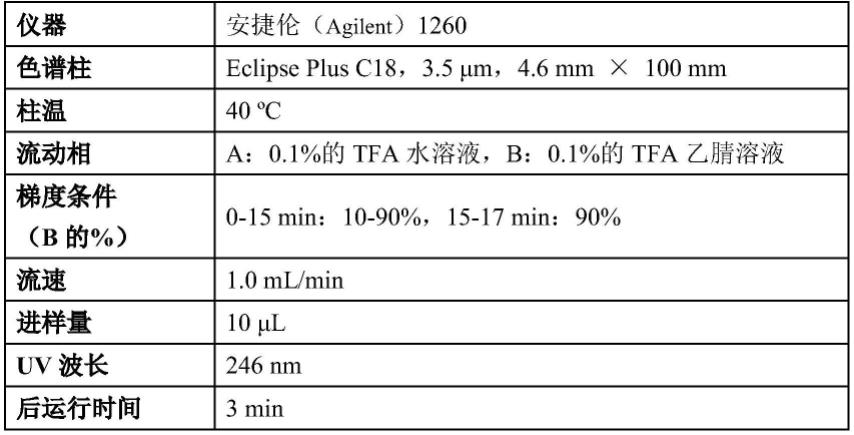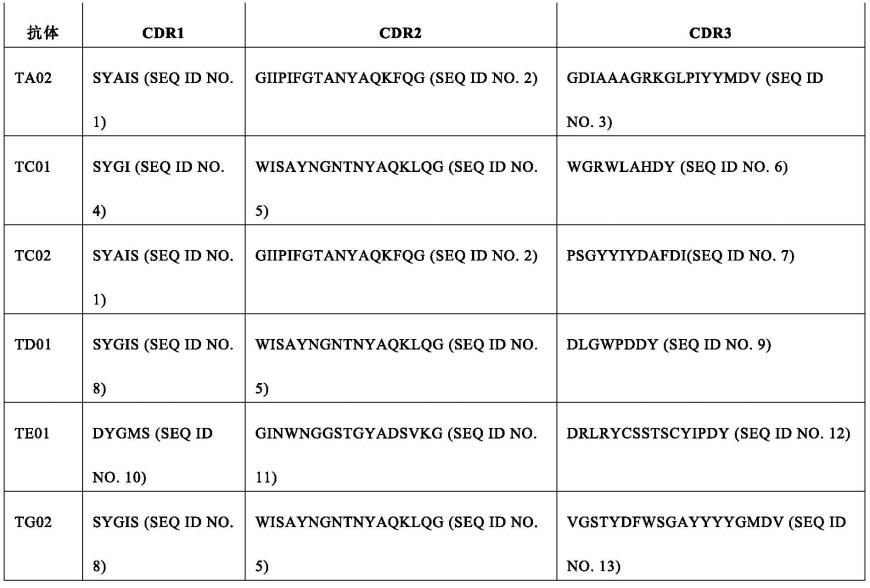
tmem219抗体及其治疗性用途
技术领域
1.本发明涉及特异性结合至igfbp3受体(即tmem219)的抗体或其抗原结合片段,涉及其生产方法、包含所述抗体的药物组合物及其用途。
背景技术:
2.igfbp3/tmem219轴
3.胰岛素样生长因子结合蛋白是一个由七种结合蛋白组成的家族,调节胰岛素样生长因子(igf)的生物利用度。其中igfbp3最为丰富,几乎存在于所有组织中,并且对igf具有较高的亲和力;事实上,大约80-90%的igf结合igfbp3且与酸不稳定亚基(als)形成三元复合物的形式(1)。
4.除了能够调节igf利用度外,igfbp3也被证明具有igf-非依赖性功能(2)。事实上,它能够与细胞表面蛋白、具有整体信号转导能力的细胞表面受体、细胞内和核蛋白(转录因子)相关联,从而影响细胞生长和直接诱导细胞凋亡(2)。在死亡受体中,tmem219,一种单跨膜蛋白,被证明与igfbp-3高结合(3)。igfbp3与tmem219的结合在各种细胞中诱导胱天蛋白酶-8介导的凋亡,包括癌细胞(即前列腺和乳腺)(3),但也包括干细胞(即结肠干细胞)(4)。用不同的策略阻断或增强igfbp3/tmem219轴已被证明分别防止或增加细胞死亡。据我们所知,目前还没有市售可得的针对tmem219或igfbp3的单克隆抗体能够在igfbp3结合至tmem219的靶组织/细胞上阻止igfbp3/tmem219结合,停止igf-i非依赖性和胱天蛋白酶-8介导的有害影响。
5.糖尿病中的igfbp3/tmem219轴
6.1型糖尿病(t1d)和2型糖尿病(t2d)的特征都是β细胞损失,导致胰岛素分泌减少、血糖水平无法控制和高血糖(5,6)。且不论不同的病因机制,无论是t1d中的自身免疫应答或t2d中的胰岛素抗性/炎症都导致β细胞群的逐步减少。事实上,显而易见的是,发生的自身免疫激活似乎并不足以完全解释t1d中的β细胞损失(5)。此外,免疫疗法未能治愈t1d(7)突出了:(i)自身免疫可能不是t1d病理的唯一因素,并且(ii)需要针对不同疾病机理(如β细胞损失)的替代策略,以建立t1d的有效治疗。在长期存在t1d的个体中检测到分散的β细胞(8)证实了新的β细胞必须持续出现以保持β细胞的更新(5,9),或者被破坏的β细胞可能是“不同的”并且容易死亡(10)。这可能表明,表面β细胞受体的上调/下调表达可能在使其为免疫系统可见到方面具有关键作用,更重要的是,其他非免疫学决定因素可能调节β细胞的命运和功能。因此,防止t1d中非免疫性β细胞破坏和t2d中β细胞的进行性损失可能会使β细胞产生和破坏之间的平衡偏向于恢复适当的β细胞群,从而为能够中止或延迟疾病的第一阶段的新治疗方法铺平道路。
7.研究表明,igfbp3受体tmem219在β细胞系和人/鼠胰岛中表达,其连接对β细胞具有毒性。有趣的是,还观察到人igfbp3转基因小鼠发展出高血糖,显示胰岛量减少,且显示对胰岛素-葡萄糖刺激的反应降低(11),而那些被敲除igfbp3的小鼠在糖代谢控制方面没有任何改变(12)。
8.在人中,drogan和他的同事最近发表了一篇文章,认为igfbp3循环水平的升高与t2d的发生有关(13)。此外,diabimmune研究小组最近的一项研究表明,igfbp3水平与处于t1d风险中儿童的自身抗体阳性和血清转换的时机相关,从而表明循环igfbp3在β细胞自身免疫的早期发展中的作用(14)。
9.tmem219,igfbp3受体,已经被描述为一种死亡受体,其激活会触发靶细胞内胱天蛋白酶8介导的凋亡,从而导致其损失(4)。
10.炎性肠病中的igfbp3/tmem219轴
11.肠干细胞(isc)位于小肠和大肠隐窝的底部,控制隐窝的再生和转换。特别地,isc可以沿着隐窝分化,生成杯状细胞、肠上皮细胞、肠内分泌细胞(4)。
12.炎性肠病(ibd)是一种免疫介导的慢性疾病,包括克罗恩病(cd)和溃疡性结肠炎(uc)两种临床实体,影响了欧洲近250万人和美国近100万人(15)。ibd的发病机制仍在研究中,但最近的证据表明isc向潘氏细胞、在回肠cd中和朝向uc杯状细胞的分化受损可能在ibd的发病中起关键作用。特别是,粘膜中的局部信号传导和炎症途径都对外部刺激有响应,并保持isc的数量和功能,从而维持肠道内稳态(16)。事实上,最近yancu等人发表了支持igfbp-3在cd中的作用的结果。事实上,他们证明了,igfbp3的敲除在右旋糖酐硫酸钠(dextran-sodium-sulphate)(dss)结肠炎鼠模型中具有调节炎症的作用(17)。
13.发明人最近发现,胰岛素样生长因子结合蛋白3(igfbp3)受体,称为tmem219受体,在isc上表达,并且它与循环激素igfbp3的相互作用控制着isc在糖尿病肠道疾病和糖尿病性肠病模型中的命运和功能(4)。由于糖尿病性肠病和ibd具有共同的特点,如肠干细胞(isc)稳态改变和粘膜形态改变,这些结果可能为当前未知的ibd发病机制提供重要的认识,并可能导向ibd治疗的新疗法引入。
14.目前对ibd的有效治疗基于抗炎和免疫治疗策略的使用,这些策略会因一些不良反应而加重,其长期疗效仍值得怀疑。外科手术也成功地应用于疾病的晚期状态,尤其是uc中(15)。大部分在cd中复发的疾病也很常见,因此凸显了对不同的治疗方法的需求。因此,鉴定治疗ibd的新的治疗靶标和策略对公共卫生来说具有高度的临床相关性和需求。
15.wo2016193497和wo2016193496(通过引用全文纳入本文)描述了tmem219胞外结构域,外-tmem(ecto-tmem),作为一种有效的治疗剂。然而,受体构建体作为治疗剂不如抗体理想。因此,仍然需要其他治疗剂,模拟外-tmem的作用的抗体或其衍生物。
16.发明概述
17.本文公开了以高亲和力和特异性结合至人外-tmem(tmem的胞外结构域)并且能够减少或消除igfbp3与其同源受体tmem219的结合,而自身在结合时不激活tmem219通路的抗体。这种中和抗体可用于治疗其中igfbp3与tmem219结合导致疾病病理的疾病,包括糖尿病性肠病、炎性肠病(ibd)(例如溃疡性结肠炎和克罗恩病)和1型或2型糖尿病。这种中和抗体提供有利的治疗剂,其具有与基于受体的配体阱(外-tmem219)相似的治疗活性。
18.在第一方面,提供了一种分离的抗体或其抗原结合片段,其结合至人tmem219并抑制或减少igfbp3对所述tmem219受体的结合。
19.优选地,分离的抗体或其抗原结合片段抑制、减少或中和由igfbp3的结合诱导的tmem219受体的激活。
20.igfbp3诱导的tmem219受体的激活可通过本领域的任何已知方法或如下所述进行
测量。特别地,igfbp3诱导的tmem219受体的激活可通过测量如本文所述的凋亡增加或如本领域已知的和若干出版物(4、18、27、28)中所述的迷你肠(minigut)生长减少来测量。
21.优选的分离的抗体或其抗原结合片段,其结合至人tmem219后不激活tmem219通路。
22.在优选的实施方式中,分离的抗体或其抗原结合片段,其可有效地保护糖尿病对象的β细胞和/或防止胰岛被破坏,和/或在体内模型中控制血糖水平。
23.在一个优选的实施方式中,分离的抗体或其抗原结合片段在体内模型中有效地减少急性结肠炎。
24.在一个优选的实施方式中,分离的抗体或其抗原结合片段降低dss-诱导的dai评分和组织学评分的增加,或在体内模型中有效地减少急性结肠炎。
25.本发明还提供一种分离的抗体或其抗原结合片段,其具有选自以下的至少一种活性:
26.a-igfbp3处理的健康对象迷你肠生长增加
27.b-ibd患者迷你肠生长增加;
28.c-糖尿病性肠病血清治疗的健康对象迷你肠生长增加;
29.d-igfbp3处理的健康对象迷你肠中ephb2和/或lgr5表达增加;
30.e-在igfbp3处理的健康对象迷你肠中胱天蛋白酶8表达的降低;
31.f-igfbp3处理的β细胞中β细胞损失的减少;
32.g-igfbp3处理的β细胞中胰岛素表达增加;
33.h-dss-诱导的肠细胞凋亡抑制或减少;
34.i-dss-处理的结肠中pcna的表达恢复;
35.j-igfbp3处理的β细胞中β细胞凋亡减少;
36.k-糖尿病动物模型中胰腺炎评分降低;
37.l-糖尿病动物模型中糖尿病发病率降低;
38.m-保护糖尿病动物模型中β细胞损伤;
39.n-防止糖尿病动物模型中的β细胞损失。
40.优选在a)、b)和c)中增加为至少20%;在d)和e)中增加为至少30%,优选至少50%;在f)中的减少和g)中的增加为至少10%,在k)和1)中的减少为至少50%,优选在1)中减少为至少70%。优选j)的减少为至少30%。
41.本发明提供一种分离的抗体或其抗原结合片段,其包括:
42.a.重链可变结构域(vh),其包括:
43.i.选自下组的氨基酸序列的cdr1序列:seq id no:1、4、8、10、56、59、62、65和68;
44.ii.选自下组的氨基酸序列的cdr2序列:seq id no:2、5、11、57、60、63、66和69;和
45.iii.选自下组的氨基酸序列的cdr3序列:seq id no:3、6、7、9、12、13、58、61、64、67和70;和/或
46.b.轻链可变结构域(vl),其包括:
47.i.选自下组的氨基酸序列的cdr1序列:seq id no:14、17、20、23、26、29、71、77、80、82和85;
48.ii.选自下组的氨基酸序列的cdr2序列:seq id no:15、18、21、24、27、30、72、78、
83和86;和
49.iii.选自下组的氨基酸序列的cdr3序列:seq id no:16、19、22、25、28、31、73、74、75、76、79、81、84、87、166和167。
50.优选地,分离的抗体或其抗原结合片段包括:
[0051]-seq id no:4和seq id no:5和seq id no:6和seq id no:17和seq id no:18和seq id no:19或tc01或tc05的kabat、imgt、chothia、abm、或contact的cdr或
[0052]-seq id no:4和seq id no:5和seq id no:6和seq id no:17和seq id no:18和seq id no:166或tc03的kabat、imgt、chothia、abm或contact的cdr或
[0053]-seq id no:4和seq id no:5和seq id no:6和seq id no:17和seq id no:18和seq id no:167或tc04的kabat、imgt、chothia、abm或contact的cdr或
[0054]-seq id no:68和seq id no:69和seq id no:70和seq id no:85和seq id no:86和seq id no:87或tm1的kabat、imgt、chothia、abm或contact的cdr。
[0055]
优选地,分离的抗体或其抗原结合片段包括:
[0056]
a.重链可变结构域(vh),其包括:
[0057]
i.选自下组的氨基酸序列的cdr1序列:使用abysis工具分析(www.abysis.org)定义的序列;
[0058]
ii.选自下组的氨基酸序列的cdr2序列:使用abysis工具分析(www.abysis.org)定义的序列;和
[0059]
iii.选自下组的氨基酸序列的cdr3序列:使用abysis工具分析(www.abysis.org)定义的序列;和/或
[0060]
b.轻链可变结构域(vl),其包括:
[0061]
i.选自下组的氨基酸序列的cdr1序列:使用abysis工具分析(www.abysis.org)定义的序列;
[0062]
ii.选自下组的氨基酸序列的cdr2序列:使用abysis工具分析(www.abysis.org)定义的序列;和
[0063]
iii.选自下组的氨基酸序列的cdr3序列:使用abysis工具分析(www.abysis.org)定义的序列。
[0064]
优选地,分离的抗体或其抗原结合片段包括如表2-5、8-11以及表3.1-3.4所示的cdr。
[0065]
优选地所述抗体或其抗原结合片段特异性结合至tmem219。
[0066]
优选地,其具有至少一种选自下组的活性:
[0067]
a-igfbp3处理的健康对象迷你肠生长增加
[0068]
b-ibd患者迷你肠生长增加;
[0069]
c-糖尿病性肠病血清治疗的健康对象迷你肠生长增加;
[0070]
d-igfbp3处理的健康对象迷你肠中ephb2和/或lgr5表达增加;
[0071]
e-在igfbp3处理的健康对象迷你肠中胱天蛋白酶8表达的降低;
[0072]
f-igfbp3处理的β细胞中β细胞损失的减少;
[0073]
g-igfbp3处理的β细胞中胰岛素表达增加;
[0074]
h-dss-诱导的肠细胞凋亡抑制或减少;
[0075]
i-dss-处理的结肠中pcna的表达恢复;
[0076]
j-igfbp3处理的β细胞中β细胞凋亡减少。
[0077]
优选地,a)、b)和c)的增加为至少20%;d)和e)的增加为至少50%;f)的减少和g)的增加为至少10%。
[0078]
优选地,分离的抗体或其抗原结合片段包括:
[0079]
a.重链可变结构域(vh),其包括:
[0080]
i.选自下组的氨基酸序列的cdr1序列:seq id no:4、1、8、10、56、59、62、65和68;
[0081]
ii.选自下组的氨基酸序列的cdr2序列:seq id no:5、2、11、57、60、63、66和69;和
[0082]
iii.选自下组的氨基酸序列的cdr3序列:seq id no:6、3、7、9、12、13、58、61、64、67和70;和/或
[0083]
b.轻链可变结构域(vl),其包括:
[0084]
i.选自下组的氨基酸序列的cdr1序列:seq id no:17、14、20、23、26、29、71、77、80、82和85;
[0085]
ii.选自下组的氨基酸序列的cdr2序列:seq id no:18、15、21、24、27、30、72、78、83和86;和
[0086]
iii.选自下组的氨基酸序列的cdr3序列:seq id no:19、16、22、25、28、31、73、74、75、76、79、81、84、87、166和167。
[0087]
优选地,分离的抗体或其抗原结合片段包括:
[0088]-seq id no:4和seq id no:5和seq id no:6和seq id no:17和seq id no:18和seq id no:19或tc01或tc05的kabat、imgt、chothia、abm、或contact的cdr或
[0089]-seq id no:4和seq id no:5和seq id no:6和seq id no:17和seq id no:18和seq id no:166或tc03的kabat、imgt、chothia、abm或contact的cdr或
[0090]-seq id no:4和seq id no:5和seq id no:6和seq id no:17和seq id no:18和seq id no:167或tc04的kabat、imgt、chothia、abm或contact的cdr或
[0091]-seq id no:68和seq id no:69和seq id no:70和seq id no:85和seq id no:86和seq id no:87或tm1的kabat、imgt、chothia、abm或contact的cdr。
[0092]
优选地,分离的抗体或其抗原结合片段包括:
[0093]
a.重链可变结构域(vh),其包括:
[0094]
i.选自下组的氨基酸序列的cdr1序列:使用abysis工具分析(www.abysis.org)定义的序列;
[0095]
ii.选自下组的氨基酸序列的cdr2序列:使用abysis工具分析(www.abysis.org)定义的序列;和
[0096]
iii.选自下组的氨基酸序列的cdr3序列:使用abysis工具分析(www.abysis.org)定义的序列;和/或
[0097]
b.轻链可变结构域(vl),其包括:
[0098]
i.选自下组的氨基酸序列的cdr1序列:使用abysis工具分析(www.abysis.org)定义的序列;
[0099]
ii.选自下组的氨基酸序列的cdr2序列:使用abysis工具分析(www.abysis.org)定义的序列;和
[0100]
iii.选自下组的氨基酸序列的cdr3序列:使用abysis工具分析(www.abysis.org)定义的序列。
[0101]
优选地,分离的抗体或其抗原结合片段包括:
[0102]
a.选自下组的氨基酸序列的重链可变结构域序列:seq id no:32至seq id no:37、或seq id no:88至seq id no:95、或seq id no:168、seq id no:169和seq id no:170;或
[0103]
b.选自下组的氨基酸序列的轻链可变结构域序列:seq id no:38至seq id no:43;或seq id no:96至seq id no:103、或seq id no:171、seq id no:172或seq id no:173;
[0104]
c.(a)的轻链可变结构域和(b)的重链可变结构域。
[0105]
仍优选地,分离的抗体为tc01、tc03、tc04、tc05、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10或其抗原结合片段,优选分离的抗体为tc01、tc05、tc03、tc04或tm1或其抗原结合片段,如表4、7和10-13以及表3.1至3.4所示。优选分离的抗体是tc01。
[0106]
仍优选地,分离的抗体是tc01,其包括seq id no:33和seq id no:39,tc03,其包括seq id no:168和seq id no:171,tc04,其包括seq id no:169和seq id no:172,tc05,其包括seq id no:170和seq id no:173,ta02,其包括seq id no:32和seq id no:38,tc01,其包括seq id no:33和seq id no:39,tc02,其包括seq id no:34和seq id no:40,td01,其包括seq id no:35和seq id no:41,te01,其包括seq id no:36和seq id no:42,tg02,其包括seq id no:37和seq id no:43,te02.1,其包括seq id no:88和seq id no:96,te02.2,其包括seq id no:89和seq id no:97,te02.3,其包括seq id no:90和seq id no:98,te03,其包括seq id no:91和seq id no:99,te04,其包括seq id no:92和seq id no:100,te07,其包括seq id no:93和seq id no:101,te10,其包括seq id no:94和seq id no:102,tm1,其包括seq id no:95和seq id no:103。
[0107]
优选地,本发明的分离的抗体或抗原结合片段以低于或等于10-7
m的亲和力常数,优选低于或等于2x10-8
m的亲和力常数与人tmem219结合。
[0108]
本发明还提供一种分离的抗体或其抗原结合片段,其:
[0109]
(a)特异性结合至igfbp3上的表位,例如表2-19和表3.1-3.4中定义的单克隆抗体tc01、tc03、tc04、tc05、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10识别的表位相同或相似的表位;或
[0110]
(b)与表2-19和表3.1-3.4中定义的单克隆抗体tc01、tc03、tc04、tc05、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10交叉竞争结合;或
[0111]
(c)显示与表2-19和表3.1-3.4中定义的tc01、tc03、tc04、tc05、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任何一个相同或相似的结合亲和力或特异性,或两者都是;或
[0112]
(d)具有本文所述的抗体分子的一种或多种生物学特性,例如,选自,例如,表2-19和表3.1-3.4中定义的tc01、tc03、tc04、tc05、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10的抗体分子;或
[0113]
(e)具有本文所述的抗体分子的一种或多种药代动力学特性,例如,选自,例如,表2-19和表3.1-3.4中定义的tc01、tc03、tc04、tc05、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10的抗体分子。
[0114]
优选地,本发明的分离的抗体或其抗原结合片段是人抗体或人源化抗体。
[0115]
更优选地,本发明的分离的抗体或其抗原结合片段,其为:igg2或igg4抗体,优选igg2κ抗体、igg2λ抗体、igg4κ抗体或igg4λ抗体,优选所述igg2或igg4是人igg2或人igg4。
[0116]
本发明提供一种分离的多核苷酸,其包含编码上述定义的抗体或其抗原结合片段的至少一个序列,优选所述多核苷酸为cdna。
[0117]
本发明提供一种包含上述多核苷酸的载体,优选地,所述载体选自质粒、病毒载体、非附加型哺乳动物载体(non-episomal mammalian vector)、表达载体和重组表达载体。
[0118]
本发明还提供一种包含上述多核苷酸或上述载体的分离的细胞,优选分离的细胞为杂交瘤或中国仓鼠卵巢(cho)细胞或人胚胎肾细胞(hek293)。
[0119]
本发明进一步提供所述抗体或其抗原结合片段或上述分离的多核苷酸或载体或分离的细胞以用作药物,优选用于治疗:糖尿病、肠道(intestinal)疾病和/或肠(bowel)病、吸收不良综合征、恶病质或糖尿病性肠病,优选糖尿病是i型或ii型糖尿病,优选肠道和/或肠病是炎性肠病、乳糜泻、溃疡性结肠炎、克罗恩病或肠梗阻。
[0120]
本发明还提供一种药物组合物,其包含上述分离的抗体或其抗原结合片段或分离的多核苷酸或载体或分离的细胞以及药学上可接受的运载体,优选用于治疗:糖尿病、肠道和/或肠病、吸收不良综合征、恶病质或糖尿病性肠病,优选肠道疾病和/或肠病是炎性肠病、乳糜泻、溃疡性结肠炎、克罗恩病或肠梗阻。
[0121]
本发明提供一种抑制igfbp3与tmem219受体结合的方法,包括将tmem219与上述定义的抗体或组合物接触。
[0122]
本发明提供一种治疗以下状况的方法:糖尿病,优选1型或2型糖尿病、肠道和/或肠病、吸收不良综合征、恶病质或糖尿病性肠病,优选所述肠道疾病和/或肠病为炎性肠病、ibd、乳糜泻、克罗恩病或肠梗阻,所述方法包括向有需要的对象给予药物组合物,所述药物组合物包含上述分离的抗体或其抗原结合片段或分离的多核苷酸或载体或分离的细胞以及药学上可接受的运载体,或向有需要的对象给予上述分离的抗体或其抗原结合片段或分离的多核苷酸或载体或分离的细胞。
[0123]
本发明还提供一种制备抗体或其抗原结合片段的方法,包括获得上述的细胞并产生抗体或其抗原结合片段。
[0124]
在一些实施方式中,所述组合包括igfbp3的抑制剂(例如,如本文所述的抗-tmem抗体分子)。因此,本文公开了用于检测igfbp3的组合物和方法,以及使用本文公开的抗-tmem抗体分子及其组合治疗包括糖尿病在内的各种疾病以及肠道疾病和/或肠病的方法。
[0125]
因此,在一个方面,本发明的特征在于抗体分子(例如,分离的或重组的抗体分子),其具有以下一个或多个特性:
[0126]-以高亲和力结合至tmem219(例如人tmem219),例如具有至少约4x106m-1
,优选107m-1
,通常约108m-1
和更通常约109m-1
至10
10
m-1
或更强的亲和力常数;
[0127]-抑制或减少igfbp3与其受体tmem的结合;
[0128]-特异性结合至tmem219上的表位,例如,表2-19和表3.1-3.4中定义的单克隆抗体tc01、tc03、tc04、tc04、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10识别的表位相同或相似的表位;
[0129]-与表2-19和表3.1-3.4中定义的单克隆抗体tc01、tc03、tc04、tc04、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10交叉竞争结合;
[0130]-显示与表2-19和表3.1-3.4中定义的tc01、tc03、tc04、tc04、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任何一个相同或相似的结合亲和力或特异性,或两者都是;
[0131]-显示出与表2-19中所述的抗体分子(例如,重链可变区和轻链可变区)相同或相似的结合亲和力或特异性,或两者都是;
[0132]-显示出与具有表4、5、10、11、16、17中所示的氨基酸序列的抗体分子(例如,重链可变区和轻链可变区)相同或相似的结合亲和力或特异性,或两者都是;
[0133]-显示出与由表6-7和12、13、16、17所示的核苷酸序列编码的抗体分子(例如,重链可变区和轻链可变区)相同或相似的结合亲和力或特异性,或两者都是;
[0134]-结合至与针对tmem219的第二抗体分子相同或重叠的表位,其中所述第二抗体分子是如本文所述的抗体分子,例如,选自表2-19和表3.1-3.4定义的抗体分子tc01、tc03、tc04、tc04、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10;
[0135]-具有本文所述的抗体分子的一种或多种生物学特性,例如,选自,例如,表2-19和表3.1-3.4中定义的tc01、tc03、tc04、tc04、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10的任一种的抗体分子;
[0136]-具有本文所述的抗体分子的一种或多种药代动力学特性,例如,选自,例如,表2-19和表3.1-3.4中定义的tc01、tc03、tc04、tc04、ta02、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10的任一种的抗体分子;
[0137]-抑制igfbp3的一种或多种活性,例如,导致以下一种或多种:与未处理的样品相比,ibd患者衍生的组织样品的迷你肠发展增加至少20%,和/或与未经处理的样品相比,在igfbp3存在的情况下,迷你肠生长的发展增加了至少20%,或与未经处理的样品相比,在存在糖尿病性肠病血清的情况下,迷你肠生长的发展增加了至少20%;
[0138]-与igfbp3处理的样品相比,诱导ephb2和lgr5增加至少50%;或与igfbp3处理的样品相比,胱天蛋白酶8表达水平降低至少50%;或
[0139]-抑制igfbp3的一种或多种活性,例如,导致以下一种或多种:β细胞损失减少,或胰岛素增加;与igfbp3处理的样品相比,β细胞损失减少或胰岛素增加至少10%;
[0140]-抑制、降低或中和igfbp3的一种或多种活性,导致阻断或减少igfbp3诱导的细胞凋亡;
[0141]-结合人tmem219并可与食蟹猴tmem219交叉反应。
[0142]
还提供了编码抗体分子的核酸分子、表达载体、宿主细胞和用于制备抗体分子的方法。还提供了免疫偶联物、多特异性抗体或双特异性抗体分子和包含该抗体分子的药物组合物。
[0143]
不受任何理论的约束,认为igfbp3/tmem219轴在炎性肠病(ibd)中功能失调,从而
导致isc损失和粘膜屏障功能改变,粘膜屏障进一步被触发和维持免疫应答激活和炎症的微生物入侵。在ibd中使用阻断igfbp3-tmem219相互作用的药剂可以保护isc并保留肠屏障完整性,从而防止局部炎症的发展。
[0144]
此外,tmem219信号传导的激活通过上调胱天蛋白酶8表达和降低胰岛素表达增加β细胞的凋亡。在t1d前期(pre-t1d)和t2d前期(pre-t2d)患者以及新诊断和长期糖尿病患者的血清中igfbp3增加,并且tmem219在β细胞中表达。tmem219的表达或过表达有利于β细胞的破坏,并影响β细胞群,由此引起的高血糖/炎症在糖尿病的发生和发展过程中起作用。糖尿病前期血糖控制和炎症的改变有利于igfbp3肝脏生成的增加,其可靶向胰腺β细胞上表达的tmem219,并触发其中tmem219过度表达与igfbp3释放增加相平行的循环。然后tmem219可触发β细胞死亡,因此靶向igfbp3/tmem219轴可防止此类细胞死亡。
[0145]
本文公开的抗tmem抗体分子可(单独或与其它药剂或治疗方式组合)用于治疗、预防和/或诊断疾病,例如糖尿病,以及肠道疾病和/或肠病、吸收不良综合征、炎性肠病、恶病质、ibd、乳糜泻、糖尿病性肠病。此外,本文公开的方法和组合物包含两种、三种或更多种治疗剂的组合,所述治疗剂选自以下类别(i)-(iii)中的一种、两种或全部:(i)治疗糖尿病的药剂;(ii)抗炎剂;或(iii)免疫治疗剂。
[0146]
其他治疗剂可以选自治疗糖尿病的药剂,包括:胰岛素、如vandana,2014(19,通过引用纳入)中详述的甘精胰岛素、双胍类、葡糖苷酶抑制剂、噻唑烷二酮、dpp-4抑制剂、如george等2013(20,通过引用纳入))中详述的glp-1受体激动剂、用于预防糖尿病的药剂、阿司匹林、抗凝和血小板抗聚集剂(例如依诺肝素、肝素(eparin)、舒洛地特);降胆固醇药物(如他汀类药物、胆汁酸螯合剂、依折麦布、如marsha等2011(21,通过引用纳入)中详述的贝特类);其他降压药(如噻嗪类、ace抑制剂、β和α受体阻滞剂);抗凋亡剂、抗炎剂、皮质类固醇和免疫抑制剂(22,通过引用纳入)、器官移植中的辅助治疗、细胞治疗方法中的保护剂、止痛剂、抗生素、益生菌、tnf-α阻断剂(23,通过引用纳入)、sglt2抑制剂(如格列净衍生物)、整合素抑制剂(24,通过引用纳入)。
[0147]
测量与存在igfbp3和/或存在糖尿病性肠病血清时的迷你肠生长相比迷你肠生长增加的方法是本领域已知的,并且在若干出版物(4、18、27、28)中描述。
[0148]
测量与存在igfbp3时的表达相比ephb2、lgr5或胱天蛋白酶8表达的增加和/或减少的方法是本领域已知的,并且包括定量rt-pcr、实时rt-pcr、微阵列、northern印迹、rna seq(29,30)或如下文方法部分所述。
[0149]
测量与存在igfbp3时的β细胞损失相比β细胞损失减少的方法在本领域是已知的,并且包括细胞增殖测定(cfse染色、钙黄绿素/pi染色、台盼蓝排除、brdu染色、mtt)凋亡测定(tunel、胱天蛋白酶激活和检测,膜联蛋白v结合)或下文方法部分所述。
[0150]
测量与存在igfbp3时的胰岛素水平相比胰岛素水平增加的方法在本领域是已知的,并且包括蛋白质印迹、elisa质谱(31-33)。
[0151]
与存在igfbp3时的凋亡相比凋亡减少的方法在本领域是已知的,并且包括dna片段化、胱天蛋白酶活化分析、微导管膜通透性、膜联蛋白v结合(34)或如下文方法部分所述。
[0152]
在一些实施方式中,抗体分子以高亲和力结合到igfbp3,例如,具有与鼠抗tmem抗体分子或嵌合抗tmem抗体分子或市售抗tmem抗体分子的kd大致相同或至少高或低约10%、20%、30%、40%、50%、60%、70%、80%或90%的kd。在一些实施方式中,鼠类或嵌合抗
tmem抗体分子的kd小于约0.4、0.3、0.2、0.1或0.05nm,例如,通过biacore方法或kinexa=动力学排阻试验测量。在一些实施方式中,鼠类或嵌合抗tmem219抗体分子的kd为小于约0.2nm。在其他实施方式中,鼠类或嵌合抗igfbp3抗体分子的kd为小于约10、5、3、2或1nm,例如,通过在表达igfbp3的细胞(例如,300.19细胞)上结合测量。在一些实施方式中,鼠类或嵌合抗igfbp3抗体分子的kd为小于约1nm。
[0153]
测量与tmem219结合的方法在本领域中称为蛋白质-蛋白质相互作用测定,包括elisa、共免疫沉淀、表面等离子体共振、fret-福斯特共振能量转移(35)或下文方法部分所述。
[0154]
在一些实施方式中,抗体分子的表达水平比鼠或嵌合抗体分子(例如鼠、市售或嵌合抗tmem抗体分子)的表达水平高,例如至少约0.5、1、2、3、4、5、6、7、8、9或10倍。在一些实施方式中,在hek293细胞、cho细胞或任何本领域已知的合适的哺乳动物细胞系中表达抗体分子。
[0155]
在一些实施方式中,抗tmem219抗体分子降低一种或多种tmem相关活性,其ic50(50%抑制时的浓度)约等于或低于鼠、市售或嵌合抗tmem抗体分子,例如,本文所述的鼠市售或嵌合抗tmem抗体分子的ic50,例如,至少约10%、20%、30%、40%、50%、60%、70%、80%或90%。
[0156]
在一些实施方式中,如下文材料部分所定义的,抗tmem抗体分子具有改进的稳定性,例如,在体内或体外的稳定性比鼠、市售或嵌合抗tmem抗体分子(例如hpa051870)高至少约0.5、1、2、3、4、5、6、7、8、9或10倍。
[0157]
在一个实施方式中,抗tmem抗体分子是人源化抗体分子。
[0158]
在另一实施方式中,抗tmem抗体分子包含至少一个抗原结合区域(例如,可变区或其抗原结合片段),其来自本文所述抗体,例如选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,如表2-5,8-11中所述定义的或由表6、7、12、13中的核苷酸序列编码的;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高程度地相同)的序列。
[0159]
在又一实施方式中,抗tmem抗体分子包含至少一个、两个、三个或四个可变区域,其来自本文所述抗体,例如选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,如表2-5,8-11中所述定义的或由表6、7、12、13中的核苷酸序列编码的;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高程度地相同)的序列。
[0160]
在又一实施方式中,抗tmem抗体分子包含至少一个或两个重链可变区,其来自本文所述抗体,例如选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,如表2-5,8-11中所述定义的或由表6、7、12、13中的核苷酸序列编码的;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高程度地相同)的序列。
[0161]
在又一实施方式中,抗tmem抗体分子包含至少一个或两个轻链可变区,其来自本文所述抗体,例如选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,如表2-5,8-11中所述定义的或由表6、7、12、13中的核苷酸序列编码的;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、
97%、98%、99%或更高程度地相同)的序列。
[0162]
在又一实施方式中,抗tmem抗体分子包括igg4(例如人igg4)的重链恒定区。在一个实施方式中,人igg4在228位包含取代(例如ser至pro取代)。在一个实施方式中,人igg4在235位包含取代(例如leu至glu取代)。在一个实施方式中,人igg4在228位包含取代(例如ser至pro取代)和235位包含取代(例如leu至glu取代)。在又一实施方式中,抗tmem抗体分子包括igg1(例如人igg1)的重链恒定区。在一个实施方式中,人igg1在297位包含取代(例如asn至ala取代)。在一个实施方式中,人igg1在250位包含取代、428位包含取代或两者都有(例如250位thr至gln取代和/或428位met至leu取代)。在一个实施方式中,人igg1在234位包含取代、235位包含取代或两者都有(例如234位leu至ala取代和/或235位leu至ala取代)。
[0163]
在又一个实施方式中,抗tmem抗体分子包括κ轻链恒定区,例如,人κ轻链恒定区。在一个实施方式中,轻链恒定区包含表8中所述的氨基酸序列,或与其基本相同的序列(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高程度地相同)。
[0164]
在另一个实施方式中,抗tmem抗体分子包括igg4的重链恒定区,例如,人igg4,和κ轻链恒定区,例如人κ轻链恒定区。在一个实施方式中,人igg1或igg4包括可变区的取代以减少聚集、减少电荷异质性、增加亲和力和调节抗原结合;通过突变除去cdr中不稳定性热点(instability hotspot),可变区的推定的n-糖基化位点,如(26)中所述,通过引用纳入。
[0165]
在另一实施方式中,抗tmem抗体分子包括重链可变结构域和恒定区、轻链可变结构域和恒定区,或两者,其包含ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的氨基酸序列,如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高程度地相同)的序列。抗-tmem抗体分子,任选地,包括来自重链、轻链或两者都有的前导序列。
[0166]
在又一实施方式中,抗tmem抗体分子包含至少一个、两个、三个来自重链可变区的互补决定区(cdr),其来自本文所述抗体,例如选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,如表2-5,8-11中所述定义的或由表6、7、12、13中的核苷酸序列编码的;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高程度地相同)的序列。
[0167]
在又一实施方式中,抗tmem抗体分子包括来自重链可变区的至少一个、两个或三个cdr(或全部cdr的集合),所述重链可变区包含表2-5、8-11中所示的氨基酸序列或由表6-7、12、13中所示的核苷酸序列编码。在一个实施方式中,一个或多个cdr(或全部cdr的集合)具有一个、两个、三个、四个、五个、六个或更多变化,例如氨基酸取代或缺失,相对于表2-5、8-11中所示的氨基酸序列或由表6-7、12、13所示的核苷酸序列编码的氨基酸序列。
[0168]
在又一实施方式中,抗tmem抗体分子包含至少一个、两个、三个来自轻链可变区的cdr,其来自本文所述抗体,例如选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,如表2-5,8-11中所述定义的或由表6、7、12、13中的核苷酸序列编码的;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高程度地相同)的序列。
[0169]
在又一实施方式中,抗tmem抗体分子包括来自轻链可变区的至少一个、两个或三
个cdr(或全部cdr的集合),所述轻链可变区包含表2-5、8-11中所示的氨基酸序列或由表6、7、12、13中所示的核苷酸序列编码。在一个实施方式中,一个或多个cdr(或全部cdr的集合)具有一个、两个、三个、四个、五个、六个或更多变化,例如氨基酸取代或缺失,相对于表2-5、8-11中所示的氨基酸序列或由表6、7、12、13所示的核苷酸序列编码的氨基酸序列。在某些实施方式中,抗tmem抗体分子包括轻链cdr中的取代,例如,轻链的cdr1、cdr2和/或cdr3中的一个或多个取代。
[0170]
在另一实施方式中,抗tmem抗体分子包括来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个cdr(或全部cdr的集合),所述重链和轻链可变区包含表2-5、8-11中所示的氨基酸序列,或由表6、7、12、13中所示的核苷酸序列编码。在一个实施方式中,一个或多个cdr(或全部cdr的集合)具有一个、两个、三个、四个、五个、六个或更多变化,例如氨基酸取代或缺失,相对于表2-5、8-11中所示的氨基酸序列或由表6、7、12、13所示的核苷酸序列编码的氨基酸序列。
[0171]
在一个实施方式中,抗tmem抗体分子包括全部六个cdr来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中的任何一个的抗体,或如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码,或密切相关的cdr,例如,等同或至少有一个氨基酸改变但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的cdr。在一个实施方式中,抗tmem抗体分子可包括本文所述的任何cdr。在某些实施方式中,抗tmem抗体分子包括轻链cdr中的取代,例如,轻链的cdr1、cdr2和/或cdr3中的一个或多个取代。在另一实施方式中,抗tmem抗体分子包括重链可变区的至少一个、两个或三个根据kabat等的cdr(例如,根据表2-5中所列的kabat定义的至少一个、两个或三个cdr)来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,如表2-5、8-11所定义的,或由表6、7、12、13中的核苷酸序列编码的;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高程度的相同性)的序列;或相对于根据kabat等的一个、两个或三个cdr,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的序列,如表2-5、8-11所示。
[0172]
在另一实施方式中,抗tmem抗体分子包括轻链可变区的至少一个、两个或三个根据kabat等的cdr(例如,根据表2-5、8-11中所列的kabat定义的至少一个、两个或三个cdr)来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,或如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高相同性)的序列;或相对于根据kabat等的一个、两个或三个cdr,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的序列,如表2-5、8-11所示。
[0173]
在又一实施方式中,抗tmem抗体分子包括重链和轻链可变区的至少一个、两个、三个、四个、五个或六个根据kabat等的cdr(例如,根据表2-5、8-11中所列的kabat定义的至少一个、两个、三个四个、五个或六个cdr)来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,或如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码;或与任何上述序列基本相同
(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高相同性)的序列;或相对于根据kabat等的一个、两个、三个、四个、五个或六个cdr,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的序列,如表2-5、8-11所示。
[0174]
在又一实施方式中,抗tmem抗体分子包括重链和轻链可变区的全部六个根据kabat等的cdr(例如,根据表2-5、8-11中所列的kabat定义的全部六个cdr)来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,或如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高相同性)的序列;或相对于根据kabat等全部六个cdr,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的序列,如表2-5、8-11所示。在一个实施方式中,抗tmem抗体分子可包括本文所述的任何cdr。
[0175]
在另一实施方式中,抗tmem抗体分子包括重链可变区的至少一个、两个或三个chothia或kabat高变环(例如,根据表2-5、8-11中所列的chothia或kabat定义的至少一个、两个或三个高变环)来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,或如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码;或至少来自与tmem接触的那些高变环的氨基酸;或相对于根据chothia等的一个、两个或三个高变环,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代),如表2-5、8-11所示。
[0176]
在另一实施方式中,抗tmem抗体分子包括轻链可变区的至少一个、两个或三个chothia高变环(例如,根据表2-5、8-11中所列的chothia定义的至少一个、两个或三个高变环)来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,或如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码;或至少来自与tmem接触的那些高变环的氨基酸;或相对于根据chothia等的一个、两个或三个高变环,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代),如表2-5、8-11所示。
[0177]
在又一实施方式中,抗tmem抗体分子包括重链和轻链可变区的至少一个、两个、三个、四个、五个或六个高变环(例如,根据表2-5、8-11中所列的chothia定义的至少一个、两个、三个、四个、五个或六个高变环)来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,或如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码;或至少来自与tmem接触的那些高变环的氨基酸;或相对于根据chothia等的一个、两个、三个、四个、五个或六个高变环,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代),如表2-5、8-11所示。
[0178]
在一个实施方式中,抗tmem抗体分子包括的全部六个高变环(例如,根据表2-5、8-11中所述的chothia定义的全部六个高变环)来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体(如表2-5、8-11中所定义的,或由表6、7、12、13中的核苷酸序列编码的),或密切相关的高变环,例如相同或具有至少一个氨基酸改变但不超过两个、三个或四个改变(例如取代、缺
失或插入,例如保守取代)的高变环;或相对于chothia等的全部六个高变环具有至少一个氨基酸改变但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代),如表2-5、8-11所示。在一个实施方式中,抗tmem抗体分子可包括本文所述的任何高变环。
[0179]
在又一实施方式中,抗tmem抗体分子包括至少一个、两个或三个高变环,其具有与本文所述抗体的相应高变环相同的标准结构,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中的任一个的抗体,如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码,例如,与本文所述抗体的重链和/或轻链可变结构域的至少环1和/或环2相同的标准结构。高变环标准结构的描述参见例如,chothia等,(1992)j.mol.biol.227:799-817;tomlinson等,(1992)j.mol.biol.227:776-798。这些结构可以通过查阅这些参考文献中描述的表格来确定。
[0180]
在某些实施方式中,抗tmem抗体分子包括根据kabat等和chothia等定义的cdr或高变环的组合。
[0181]
在一个实施方式中,抗tmem抗体分子包括重链可变区的至少一个、两个或三个cdr或高变环来自本文所述抗体,例如,选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,或如表2-5、8-11所定义,或由表6、7、12、13中的核苷酸序列编码,根据kabat和chothia定义(例如表2-5、8-11中所列的根据kabat和chothia定义的至少一个、两个或三个cdr或高变环);或由表6、7、12、13中的核苷酸序列编码;或与任何上述序列基本相同(例如,至少80%、85%、90%、92%、95%、97%、98%、99%或更高相同性)的序列;或相对于根据kabat和/或chothia的一个、两个或三个cdr或高变环,具有至少一个氨基酸改变的序列,但不超过两个、三个或四个改变(例如取代、缺失或插入,例如保守取代),如表2-5、8-11所示。
[0182]
例如,抗tmem抗体分子可包括根据kabat等的vh cdr1或根据chothia等的vh高变环1或其组合,例如,如表2-5、8-11所示。抗tmem抗体分子可进一步包括,例如,根据kabat等的vh cdr 2-3和根据kabat等的vl cdr1-3,例如,如表2-5、8-11所示。因此,在一些实施方式中,基于根据kabat等定义的cdr和根据chothia等定义的高变环的组合定义框架区。例如,抗tmem抗体分子可包括基于根据chothia等的vh高变环1定义的vh fr1和基于根据kabat等的vh cdr 1-2定义的vh fr2,例如,如表2-5、8-11、6、7、12、13所示。抗tmem抗体分子可进一步包括,例如,基于根据kabat等的vh cdr 2-3定义的vh fr 3-4和基于根据kabat等的vl cdr 1-3定义的vl fr 1-4。
[0183]
根据kabat和chothia的定义,抗tmem抗体分子可以包含cdr或高变环的任何组合。在一个实施方式中,抗tmem抗体分子包含至少一个、两个、三个来自轻链可变区的cdr,其来自本文所述抗体,例如选自ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中任一个的抗体,如表2-5,8-11中所述定义的或由表6、7、12、13中的核苷酸序列编码的,根据kabat和chothia定义(例如,根据kabat和chothia定义如表3.3-3.4所示的至少一个、两个或三个cdr)。优选的抗tmem抗体为如表2-5、8-11中定义或表6、7、12、13中核苷酸序列编码的tc01和tm1。在一个实施方式中,例如,一个包含可变区、cdr(例如,chothia cdr或kabat cdr)或本文(例如,在表2-5、8-11中)提及的其他序列的实施方式中,抗体分子是单特异性抗体分子、双特异性抗体分子,或是包含抗体的抗原结合片段的抗体分子,例如,半抗体或半抗体的抗原结合片段。在实施方式中,抗体分子是具
有对igfbp3的第一结合特异性和对tnfα、整合素、il1、il12和il23、cd3、cd20、cd80、cd86的第二结合特异性的双特异性抗体分子。
[0184]
在一个实施方式中,抗tmem抗体分子包括:
[0185]
(i)重链可变区(vh),其包括选自seq id no:1、4、8、10、56、59、62、65和68中的任一个的vhcdr1氨基酸序列;选自seq id no:2、5、11、57、60、63、66和69中的任一个的vhcdr2氨基酸序列;和选自seq id no:3、6、7、9、12、13、58、61、64、67和70中的任一个的vhcdr3氨基酸序列;和
[0186]
(ii)轻链可变区(vh),其包括选自seq id no:14、17、20、23、26、29、71、77、80、82和85中的任一个的vlcdr1氨基酸序列;选自seq id no:15、18、21、24、27、30、72、78、83和86中的任一个的vlcdr2氨基酸序列;和选自seq id no:16、19、22、25、28、31、73、74、75、76、79、81、84和87中的任一个的vlcdr3氨基酸序列。
[0187]
在一个实施方式中,抗tmem抗体分子的轻链或重链可变框架(例如,包含至少fr1、fr2、fr3和任选fr4的区域)可选自:(a)轻链或重链可变框架,包括至少80%、85%、87%90%、92%、93%、95%、97%、98%,或优选100%的来自人轻链或重链可变框架的氨基酸残基,例如来自人成熟抗体、人种系序列或人共有序列的轻链或重链可变框架残基;(b)轻链或重链可变框架,包括20%至80%、40%至60%、60%至90%,或70%至95%的来自人轻链或重链可变框架的氨基酸残基,例如来自人成熟抗体、人种系序列或人共有序列的轻链或重链可变框架残基;(c)非人框架(例如啮齿动物框架);或(d)经修饰的非人框架,例如,经修饰以去除抗原或细胞毒性决定簇,例如,去免疫或部分人源化。在一个实施方式中,轻链或重链可变框架区域(特别是fr1、fr2和/或fr3)包括与人种系基因的vl或vh区段的框架至少70、75、80、85、87、88、90、92、94、95、96、97、98、99%相同或相同的轻链或重链可变框架序列。
[0188]
在某些实施方式中,抗tmem抗体分子包括重链可变结构域,其具有至少一个、两个、三个、四个、五个、六个、七个、十个、十五个、二十个或更多变化,例如氨基酸取代或缺失。
[0189]
在一个实施方式中,抗tmem抗体分子的重链或轻链可变区或两者均包括由本文所述核酸序列或与本文所述核酸序列杂交(例如,在低严格性、中严格性或高严格性或本文所述的其它杂交条件下杂交)的核酸(例如,如表6、7、12、13所示的核酸序列)或其互补物编码的氨基酸序列。
[0190]
在另一实施方式中,抗tmem抗体分子包含至少一个、两个、三个或四个抗原结合区,例如可变区,其具有如表2-5、8-11中所述的氨基酸序列或与其基本相同的序列(例如,至少约85%、90%、95%、99%或更多相同的序列,或与表2-5、8-11所示序列相差不超过1、2、5、10或15个氨基酸残基的序列)。在另一实施方式中,抗tmem抗体分子包括由具有如表2-5、8-11所述的核苷酸序列,或与其基本相同的序列(例如,至少约85%、90%、95%、99%或更多相同的序列,或与表2-5、8-11所示序列相差不超过3、6、15、30或45个核苷酸的序列)的核酸编码的vh和/或vl结构域。
[0191]
在又一实施方式中,抗tmem抗体分子包含来自重链可变区的至少一个、两个或三个cdr,所述重链可变区具有如表2-5、8-11所述的氨基酸序列,或与其基本同源的序列(,例如,与其至少约85%、90%、95%、99%或更多相同性的序列,和/或具有一个、两个、三个或
更多的取代、插入或缺失,例如保守取代)。在又一实施方式中,抗tmem抗体分子包含来自轻链可变区的至少一个、两个或三个cdr,所述重链可变区具有如表2-5、8-11所述的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%、90%、95%、99%或更多相同性的序列,和/或具有一个、两个、三个或更多的取代、插入或缺失,例如保守取代)。在又一实施方式中,抗tmem抗体分子包含来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个cdr,所述重链和轻链可变区具有如表2-5、8-11所述的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%、90%、95%、99%或更多相同性的序列,和/或具有一个、两个、三个或更多的取代、插入或缺失,例如保守取代)。
[0192]
在其他实施方式中,抗tmem抗体分子所具有的重链恒定区(fc)选自例如:igg1、igg2、igg3、igg4、igm、iga1、iga2、igd和ige的重链恒定区;具体而言,选自例如igg1、igg2、igg3和igg4的重链恒定区,更具体地,igg1或igg4的重链恒定区(例如,人igg1、igg2或igg4)。在一个实施方式中,重链恒定区是人igg1。在另一个实施方式中,抗tmem抗体分子具有轻链恒定区选自例如κ或λ轻链恒定区。在一个实施方式中,可改变(例如突变)恒定区以修饰抗tmem抗体分子的特性(例如以增加或减少如下一项或多项:fc受体结合、抗体糖基化、半胱氨酸残基数、效应细胞功能、补体功能、半衰期、聚集和稳定性)。在某些实施方式中,抗tmem抗体分子包括突变的人igg4。
[0193]
在一个实施方式中,抗tmem抗体分子是分离的或重组的。
[0194]
在一个实施方式中,抗tmem抗体分子是人源化或人抗体分子。
[0195]
本发明还具有如下所述的核酸分子,其包含编码本文所述的抗tmem抗体分子的重链和轻链可变区、cdr、高变环、框架区的一个或两个核苷酸序列。在某些实施方式中,编码抗-tmem抗体分子的核苷酸序列是密码子优化的。例如,本发明的特征在于分别编码抗tmem抗体分子的重链和轻链可变区的第一和第二核酸,所述抗体选自,例如ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10的任一个或多个,如表2-5、8-11所定义的,或由表6,7,12,13中核苷酸序列编码的,或与其基本相同的序列。例如,核酸可包含如表6、7、12、13中所述的核苷酸序列,或与其基本相同的序列(例如,与其至少约85%、90%、95%、99%或更多相同性的序列,或与表6、7、12、13中所示的序列相差不超过3、6、15、30或45个核苷酸的序列)。
[0196]
在其它实施方式中,所述核酸分子包含编码重链可变结构域和/或重链恒定区的核苷酸序列,其包含ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中的任一个的氨基酸序列,如表2-5、8-11中所定义,或由表6、7、12、13中的核苷酸序列编码;或与上述任何序列基本相同的序列(例如,至少约85%、90%、95%、99%或更多相同性的序列)。
[0197]
在其它实施方式中,所述核酸分子包含编码轻链可变结构域和/或轻链恒定区的核苷酸序列,其包含ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中的任一个的氨基酸序列,如表2-5、8-11中所定义,或表6、7、12、13中的核苷酸序列,或与上述任何序列基本相同的序列(例如,至少约85%、90%、95%、99%或更多相同性的序列)。
[0198]
上述编码抗tmem重链和轻链可变结构域和恒定区的核苷酸序列可以存在于分开的核酸分子中,也可以存在于同一核酸分子中。在某些实施方式中,核酸分子包含编码前导
序列的核苷酸序列。
[0199]
在某些实施方式中,核酸分子包含编码来自重链可变区的至少一个,两个或三个cdr,或高变环的核苷酸序列,所述重链可变区具有表2-5、8-11中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同性的序列,和/或具有一个、两个、三个或更多取代、插入或缺失,例如保守取代)。
[0200]
在另一个实施方式中,核酸分子包含编码来自轻链可变区的至少一个,两个或三个cdr,或高变环的核苷酸序列,所述轻链可变区具有表2-5、8-11中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同性的序列,和/或具有一个、两个、三个或更多取代、插入或缺失,例如保守取代)。
[0201]
在另一个实施方式中,核酸分子包含编码来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个cdr,或高变环的核苷酸序列,所述重链和轻链可变区具有表2-5、8-11中列出的氨基酸序列,或与其基本同源的序列(例如,与其至少约85%,90%,95%,99%或更多相同性的序列,和/或具有一个、两个、三个或更多取代、插入或缺失,例如保守取代)。
[0202]
在另一实施方式中,核酸分子包括一个或多个重链框架区(例如,vhfw1(a型)、vhfw1(b型)、vhfw1(c型)、vhfw1(d型)、vhfw2(a型)、vhfw2(a
′
型)、vhfw2(b型)、vhfw2(c型)、vhfw2(d型)、vhfw2(e型)、vhfw3(a型)、vhfw3(b型)、vhfw3(c型)、vhfw3(d型)、vhfw3(e型)或vhfw4中的任一个,或其任何组合,例如本文所述的框架组合),针对ta02、tc01、tc02、td01、te01、tg02、tm1、te02.1、te02.2、te02.3、te03、te04、te07、te10中的任何一个,如表2-5、8-11中定义的,或与其基本相同的序列。例如,核酸分子可包含如表6、7、12、13中所述的核苷酸序列,或与其基本相同的序列(例如,与其至少约85%、90%、95%、99%或更多相同性的序列,或与表6、7、12、13中所示的序列相差不超过3、6、15、30或45个核苷酸的序列)。
[0203]
在另一实施方式中,核酸分子包括一个或多个轻链框架区(例如,vlfw1(a型)、vlfw1(b型)、vlfw1(c型)、vlfw1(d型)、vlfw1(e型)、vlfw1(f型)、vlfw2(a型)、vlfw2(c型)、vlfw3(a型)、vlfw3(b型)、vlfw3(c型)、vlfw3(d型)、vlfw3(e型)、vlfw3(f型)、vlfw3(g型)或vlfw4中的任一个,或其任何组合,例如本文所述的框架组合),针对e01、e02、e08、e14、e19、e20、e23、e24或m1中的任何一个,如表2-5、8-11中所定义的,或与其基本相同的序列。例如,核酸分子可包含如表6、7、12、13中所述的核苷酸序列,或与其基本相同的序列(例如,与其至少约85%、90%、95%、99%或更多相同性的序列,或与表6、7、12、13中所示的序列相差不超过3、6、15、30或45个核苷酸的序列)。
[0204]
在另一实施方式中,核酸分子包括如本文所述的一个或多个重链框架区域和一个或多个轻链框架区域。重链和轻链框架区可以存在于同一载体中或分开的载体中。
[0205]
在另一方面,本技术的特征在于宿主细胞和载体,所述宿主细胞和载体包含本文所述或根据已知方法为密码子优化而修饰的核酸。核酸可存在于同一宿主细胞或非同一宿主细胞中的单个载体中或分开的多个载体中。宿主细胞可以是真核细胞,例如哺乳动物细胞、昆虫细胞、酵母细胞,或原核细胞,例如大肠杆菌。例如,哺乳动物细胞可以是培养细胞或细胞系。示例性的哺乳动物细胞包括淋巴细胞系(如nso)、中国仓鼠卵巢细胞(cho)、cos细胞、卵母细胞,和来自转基因动物的细胞,如乳腺上皮细胞。
[0206]
在一方面,本发明的特征在于提供本文所述抗体分子的方法。该方法包括:提供
tmem抗原(例如,包括至少一部分tmem表位的抗原);获得与tmem多肽特异性结合的抗体分子;以及评估该抗体分子是否与tmem多肽特异性结合,或评估该抗体分子在调节(例如,抑制)tmem的活性方面的功效。该方法可进一步包括将抗体分子给予对象,例如,人或非人动物。
[0207]
在另一方面,本发明提供组合物,例如药物组合物,其包括药学上可接受的运载体、赋形剂或稳定剂以及本文所述的抗tmem抗体分子中的至少一种。在一个实施方式中,该组合物,例如,药物组合物,包括抗体分子和一种或多种药剂(例如,治疗剂或其他抗体分子)的组合,如本文所述。在一个实施方式中,抗体分子与标记物或治疗剂偶联。
[0208]
本文公开的抗tmem抗体分子可抑制、降低或中和如上所述的igfbp3的一种或多种活性。因此,这种抗体分子可用于治疗或预防病症,在这种情况下,需要抑制、减少或中和对象体内igfbp3诱导活性。
[0209]
抗tmem抗体分子的用途
[0210]
本发明抗体用于治疗各种疾病或病症的方法,例如糖尿病,以及肠道疾病、吸收不良综合征、炎性肠病、恶病质、克罗恩病、溃疡性结肠炎、乳糜泻、糖尿病性肠病。
[0211]
因此,在另一方面中,提供一种调节对象中的igfbp3/tmem219轴的方法。该方法包括单独地或与一种或多种药剂或操作组合地向对象给予本文公开的抗tmem抗体分子(例如,治疗有效量的抗tmem抗体分子),使得对象中的igfbp3/tmem219轴被调节。在一个实施方式中,抗体分子抑制、降低或中和或阻断对象中的igfbp3/tmem219轴活性。对象可以是哺乳动物,例如灵长类动物,优选高级灵长类动物,例如人(例如,患有或有风险患有本文所述疾病的患者)。在一个实施方式中,对象需要抑制、降低、中和或阻断igfbp3/tmem219轴。在一个实施方式中,对象具有或处于具有本文所述的疾病的风险中,例如,糖尿病或炎性肠病(ibd)、吸收不良综合征、肠易激综合征、恶病质、乳糜泻、糖尿病性肠病,如本文所述。
附图说明
[0212]
图1.新生的抗tmem mab对小鼠中dss-诱导的结肠炎的作用。dss-诱导的小鼠结肠炎研究的实验时间线:c57bl/6小鼠在饮用水中给予2.5%dss持续5天,并从诱导结肠炎之前3天开始每天腹膜内给予抗tmem mab 0.5mg/只鼠,直到最后一次dss给予之后7天进行安乐死。
[0213]
图2.(a)疾病活动指数(dai),用于确定小鼠结肠炎严重程度的评分系统,(b)组织学评分,用于评估炎症严重程度和范围的检查,粘膜中细胞浸润的强度,其在粘膜下层中的延伸,上皮病灶的存在和粘膜再生,在伤口愈合/慢性期开始时最后一次给予dss后7天评估。值为平均值
±
sem。*p≤0.05,**p≤0.01,对比dss组。
[0214]
图3.安乐死时获得结肠石蜡切片,即最后一次给予dss之后7天,用(a)may-grunwald-giemsa染色进行组织学检查。(b)用tunel试验检测凋亡细胞,并用dapi复染。(c)用pcna试验检测细胞增殖,并用dapi复染。
[0215]
图4.新产生的抗tmem219 mab对t1d小鼠模型中糖尿病发病的影响。nod小鼠研究的实验时间线。
[0216]
图5.(a)抗-tmem219 mab对防止nod小鼠在22周龄糖尿病发病的效果,和(b)在保护血糖水平中的效果。100%的小鼠中观察到通过使用抗tmem219 mab获得了预防糖尿病的
效果。通过mantel-cox分析,与未治疗的小鼠相比,*p<0.05。无糖尿病是指正常血糖的小鼠。
[0217]
连续三次测量血糖>250mg/dl定义糖尿病发病。无糖尿病小鼠在连续三次测量中没有血糖>250mg/dl。
[0218]
图6.制备安乐死时获得的胰腺组织的连续石蜡切片,用h&e染色,显微镜下分析胰岛面积和形态。(a)显示代表性图像;原始放大倍数20x。(b)显示了胰腺炎评分。在(b)中,细胞浸润程度评分从0至4。胰腺炎评分是通过检查每只动物至少30个胰岛进行的。*p<0.05,通过曼-惠特尼检验(mann whitney test),所有与未治疗的小鼠相比。
[0219]
图7.制备安乐死时获得的胰腺组织连续石蜡切片,显示胰岛素的免疫组织化学染色(棕色)。显示代表性图像;原始放大倍数20x。
[0220]
图8.抗-tmem219 mab在暴露于igfbp3的β细胞系中下调casp8表达的效果。
[0221]
图9.抗-tmem219 mab在暴露于富含igfbp3的t1d血清的β细胞系中下调casp8表达的效果。
[0222]
图10.抗-tmem219 mab在暴露于igfbp3的人胰岛中下调casp8表达的效果。
[0223]
图11.抗-tmem219 mab在暴露于igfbp3的人胰岛中减少凋亡的效果。
[0224]
图12.抗-tmem219 mab在暴露于t1d血清的人胰岛中减少凋亡的效果。
[0225]
图13.抗-tmem219 mab在暴露于t1d血清的β细胞系中下调casp8表达的效果。
[0226]
图14.抗tmem219 mab对β细胞系凋亡的影响。
[0227]
图15.抗tmem219 mab对β细胞系中casp8 mrna表达的影响。
[0228]
图16.新产生的抗tmem219 mab对糖尿病小鼠模型中糖尿病发病的影响。低剂量链脲佐菌素糖尿病模型的实验时间线。
[0229]
图17.b6小鼠注射多次低剂量链脲佐菌素(streptozotocin)(ldstz,50mg/kg),用抗-tmem219 mab治疗或不治疗(n=5),测得的血糖水平示于线图。
[0230]
图18.b6小鼠在注射ld-stz和使用/不使用抗-tmem219 mab,在第10天(n=5),在ipgtt(1g/kg)期间60分钟测量的血糖。*p<0.05,**p<0.01。
[0231]
图19.注射ldstz和使用/不使用抗tmem219 mab治疗(n=3)的b6小鼠获得的连续胰岛组织切片的代表性h&e染色。20x原始放大倍数,比例尺,100μm。
具体实施方式
[0232]
本发明的抗体特异性结合人tmem219。如本文所讨论的,本发明的抗体统称为“抗tmem或抗tmem219抗体”。所有这种抗体由本文讨论涵盖。在本发明的方法中,分别的抗体可以单独或组合使用。
[0233]
通过“抗体特异性结合”tmem219意指使抗体不会与另一、非同源、人多肽有实质性地交叉反应。通过“基本上不交叉反应”意指抗体或片段对非同源蛋白质的结合亲和力小于10%、更优选小于5%、甚至更优选小于1%的对tmem219的结合亲和力。
[0234]
在多个实施方式中,如本文所使用的,
″
特异性结合
″
tmem219的抗体包括结合tmem219或其胞外部分的抗体(例如外-tmem),其kd小于约1000nm、小于约500nm、小于约300nm、小于约200nm、小于约100nm、小于约90nm、小于约80nm、小于约70nm、小于约60nm、小于约50nm、小于约40nm、小于约30nm、小于约20nm、小于约10nm、小于约5nm、小于约4nm、小于
约3nm、小于约2nm、小于约1nm或约0.5nm,如用octet生物层干涉仪或表面等离子体共振分析中测得,例如,使用biacore
tm
系统(新泽西州皮斯卡塔韦ge医疗(ge healthcare)的biacore生命科学部门)或动力学排阻试验或本领域任何己知方法。
[0235]
本文所用术语
″
抗体
″
是在本领域所理解的最广泛的意义上使用的,包括在(25)中描述为抗体的所有多肽,通过引用纳入本文。
[0236]
例如,本文所用的术语
″
抗体
″
包括单克隆抗体、多克隆抗体、单特异性和多特异性抗体(如双特异性抗体)以及抗体片段,只要该片段表现出所需的抗原结合活性(抗原结合片段)。该术语具有其最广泛的本领域公认含义,并包括所有已知形式,包括但不限于:二价单特异性单克隆抗体、二价双特异性抗体、三价三特异性抗体、f(ab)片段、f(ab)’2片段、scfv片段、双抗体、单域抗体,包括骆驼科动物vhh单域抗体、tandab和柔性体。
[0237]
本文所使用的术语抗体的
″
抗原结合片段
″
或等同于抗体的
″
抗原结合部分
″
等,包括任何天然存在的、可通过酶法获得的、合成的或基因工程的多肽或糖蛋白,其中包括部分抗体,并能特异性地结合抗原以形成复合物。抗体的抗原结合片段可以使用任何合适的标准技术,如蛋白酶解或重组基因工程技术从完整的抗体分子中衍生出来,这些技术涉及对编码抗体可变结构域和(任选地)恒定结构域的dna的操作和表达。这种dna是已知的和/或容易从例如商业来源、dna文库(包括,例如,噬菌体-抗体文库)中获得的,或者可以被合成的。该dna可以通过化学方法或使用分子生物学技术进行测序和操作,例如,将一个或多个可变结构域和/或恒定结构域排列成合适的构型,或引入密码子,创建半胱氨酸残基,修饰、添加或缺失氨基酸等。
[0238]
与全抗体分子一样,抗原结合片段可以是单特异性或多特异性(例如,双特异性)。抗体的多特异性抗原结合片段通常包括至少两个不同的可变结构域,其中每个可变结构域能够特异性地结合至分离的抗原或同一抗原上的不同表位。
[0239]
在特别的实施方式中,抗体的抗原结合片段包含共价连接至至少一个恒定结构域的至少一个可变结构域。在抗体的抗原结合片段内可找到的可变域和恒定域的非限制性示范性的构象包括:(i)vh-ch1;(ii)vh-ch2;(iii)vh-ch1-ch2;(v)vh-ch1-ch2-ch3;(vi)vh-ch2-ch3;(vii)vh-cl;(viii)vl-ch1;(ix)vl-ch2;(x)vl-ch3;(xi)vl-ch1-ch2;(xii)vl-ch1-ch2-ch3;(xiii)vl-ch2-ch3;和(xiv)vl-cl。在可变域和恒定域的任何构型中,包括上面列出的任何示例性构型,可变域和恒定域可以彼此直接连接,或者可以通过完全或部分铰链或接头区连接。铰链区在不同的实施方式中可由至少2个(如5、10、15、20、40、60或更多)氨基酸组成,这些氨基酸在单个多肽分子中相邻的可变和/或恒定结构域之间形成柔性或半柔性的连接。此外,抗体的抗原结合片段在各种实施方式中可包含上文所列任何可变和恒定结构域构型的同二聚体或异二聚体(或其他多聚体),它们彼此非共价联合和/或与一个或多个单体vh或vl结构域(例如,通过一个或多个二硫键)非共价联合。
[0240]
术语抗体的“抗原结合片段”进一步包括单域抗体。
[0241]
单域抗体是由单个单体可变抗体结构域组成的抗体片段。在一些实施方式中,单域抗体来源于骆驼科动物的抗体重链的可变结构域(也被称为纳米抗体,或vhh片段)。在一些实施方式中,单域抗体是来自鲨鱼的自主人重链可变结构域(avh)或vnar片段。
[0242]
抗原结合片段的非限制性实例包括:(i)fab片段;(ii)f(ab
′
)2片段;(iii)fd片段;(iv)fv片段;(v)单链fv(scfv)分子;(vi)dab片段;和(vii)由模拟抗体高变区的氨基酸
残基组成的最小识别单元(例如,一种分离的互补决定区(cdr),例如cdr3肽),或限制的fr3-cdr3-fr4肽。其他工程改造的分子,如结构域特异性抗体、单结构域抗体、结构域缺失抗体、嵌合抗体、cdr移植抗体、双抗、三抗、四抗、迷你抗体、纳米抗体(如单价纳米抗体和二价纳米抗体)、小模块免疫药物(smip)和鲨鱼可变ignar结构域,也包含在本文所用的
″
抗原结合片段
″
的表述中。
[0243]
抗体的抗原结合片段将通常包含至少一个可变结构域。可变结构域可以是任何大小或氨基酸组成,将通常包含至少一个cdr,其邻近一个或多个框架序列或在框内。在具有与vl结构域相关联的vh结构域的抗原结合片段中,vh和vl结构域可以以任何合适的排列方式彼此相对。例如,可变结构域可以是二聚体,包括vh-vh、vh-vl或vl-vl二聚体。或者,抗体的抗原结合片段可以包含单体vh或vl结构域。
[0244]
本发明的抗体或结合分子可以进一步连接至活性物质,优选纳米颗粒或放射性核苷酸。
[0245]
如本文所用,术语
″
抗原结合分子
″
在其最广泛的意义上是指特异性结合抗原决定簇的分子。抗原结合分子的例子是抗体,包括抗原结合片段和支架抗原结合蛋白。
[0246]
术语
″
抗原结合部分
″
是指与抗原决定簇特异结合的抗原结合分子的部分。抗原结合部分包括抗体和其抗原结合片段,例如scfv,其能够特异性结合至靶细胞上的抗原。在特定方面,抗原结合部分能够将它所附接的实体(例如细胞)引导到靶位点。
[0247]
此外,能够特异性结合到靶细胞抗原的抗原结合部分包括如下文所定义的支架抗原结合蛋白质,例如,基于设计的重复蛋白质或设计的重复结构域的结合结构域,例如设计的锚蛋白重复序列蛋白(darpin)(参见例如wo 2002/020565)或脂质运载蛋白(lipocalin)(anticalin)。
[0248]
设计的锚蛋白重复序列蛋白(darpin)衍生自锚蛋白(ankyrin),是介导整合膜蛋白与细胞骨架附接的蛋白家族。单个锚蛋白重复是由两个α-螺旋和一个β-转角组成的33个残基基序。它们可以被工程化改造成通过随机化每个重复的β-转角和第一α-螺旋中的残基来结合不同的靶抗原。可以通过增加模块数量(亲和力成熟法)来增加它们的结合接触面。更多细节见j.mol.biol.332,489-503(2003),pnas 100(4),1700-1705(2003)和j.mol.biol.369,1015-1028(2007)以及us200401320028。
[0249]
在某些实施方式中,改变本文提供的抗体和抗原结合分子以增加或减少抗原结合部分糖基化的程度。可以通过改变氨基酸序列,使一个或多个糖基化位点被创建或去除,而方便地获得分子的糖基化变体。当抗原结合分子包含fc区域时,其上附接的碳水化合物可以被改变。一方面,提供抗原结合分子的变体,其碳水化合物结构缺乏(直接或间接地)附接至fc区的岩藻糖。此类岩藻糖基化变体可具有改进的adcc功能,参见例如美国专利公开号us 2003/0157108(presta,l.)或us 2004/0093621(协和发酵工业株式会社(kyowa hakko kogyo co.,ltd))。本发明的抗原结合分子的其他变体包括那些具有二等分寡糖(bisected oligosaccharide)的分子,例如,其中附接到fc区域的双触角寡糖(biantennary oligosaccharide)被glcnac二等分。这种变体可以减少岩藻糖基化和/或改进adcc功能,参见,例如,wo 2003/011878(jean-mairet等);美国专利号6,602,684(umana等);和us2005/0123546(umana等)。还提供了在低聚糖中具有至少一个半乳糖残基附接至fc区的变体。此类抗体变体可具有改进的cdc功能,并在例如wo 1997/30087(patel等)、wo 1998/58964
(raju,s.)和wo 1999/22764(raju,s.)中描述。
[0250]
在某些实施方式中,可能希望创建本发明的抗体或抗原结合分子的半胱氨酸工程化变体,例如
″
thiomab
″
,其中分子的一个或多个残基被半胱氨酸残基取代。在特定的实施方式中,取代的残基出现在该分子的可及位点。通过用半胱氨酸取代这些残基,活性巯基由此定位于抗体的可及位点并且可用于将抗体与其它部分(例如药物部分或接头-药物部分)偶联以产生免疫偶联物。在某些实施方式中,以下残基中的任一个或多个可以被半胱氨酸取代:轻链的v205(kabat编号);重链的a118(eu编号);和重链fc区的s400(eu编号)。半胱氨酸工程改造的抗原结合分子可以如,例如,美国专利号7,521,541中所述生成。
[0251]
在某些方面,本文提供的抗体或抗原结合分子可经进一步修饰以包含本领域已知且容易获得的其它非蛋白质部分。适合用于对抗体或抗原结合分子进行衍生化的部分包括但不限于水溶性聚合物。水溶性聚合物的非限制性实例包括但不限于聚乙二醇(peg)、乙二醇/丙二醇的共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧杂环戊烷、聚-1,3,6-三氧杂环己烷、乙烯/马来酸酐共聚物、聚酰胺酸(均聚物或无规共聚物)、葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、丙二醇均聚物、环氧丙烷/环氧乙烷共聚物、聚氧乙烯化多元醇(例如甘油)、聚乙烯醇及其混合物。由于聚乙二醇丙醛在水中的稳定性,在制造上可能具有优势。所述聚合物可具有任何分子量,并且可以是支化或非支化的。附接在抗体上的聚合物的数量可以不同,如果附接了一个以上的聚合物,它们可以是相同或不同的分子。一般来说,用于衍生化的聚合物的数量和/或类型可以根据包括但不限于待改进的抗体的特殊性质或功能、抗体衍生物是否将在规定的条件下用于治疗等因素来决定。
[0252]
在另一方面,提供抗体与可通过暴露于辐射而选择性加热的非蛋白质部分的偶联物。在一个实施方式中,非蛋白质部分是碳纳米管(kam,n.w.等,proc.natl.acad.sci.usa 102(2005)11600-11605)。辐射可以是任何波长,并且包括但不限于不伤害普通细胞,但将非蛋白质部分加热到使接近该抗体非蛋白质部分的细胞被杀伤的温度的波长。另一方面,可以获得本文提供的抗原结合分子的免疫偶联物。
″
免疫偶联物
″
是与一种或多种异源性分子(包括但不限于细胞毒性剂)偶联的抗体。
[0253]
抗体恒定区对抗体固定补体和介导细胞依赖性细胞毒性的能力是重要的。因此,抗体的同种型可以根据抗体是否需要介导细胞毒性来选择。在某些实施方式中,恒定区是igg1、igg2、igg3或igg4恒定区。
[0254]
本发明在多种实施方式中涵盖了在铰链区、ch2或ch3区具有一个或多个突变的抗体,其可能是理想的,例如在生产中,以改进所需抗体形式的产量。在一些实施方式中,例如,本文所述抗体包括人igg4恒定区。在特定的实施方案中,igg4恒定区在人igg4铰链的铰链区具有单个氨基酸取代,这使fab臂交换(angal等(1993)molecular immunology 30:105)降低到通常使用人igg1铰链观察到的水平。
[0255]
在某些实施方式中,抗体在恒定区包含一个或多个突变,其增加血清半衰期,其包括描述于美国专利号7,083,784、8,323,962和dall’aqua等,j.biol.chem.281(33):23514-23524(2006);hinton等,j.immunology 176:346-356(2006);yeung等,j.immunology 182:7663-7671(2009);和petkova等,intn’l immunology,18:1759-1769(2006)中的那些,通过引用全文纳入本文。
[0256]
如本文所使用的术语
″
人抗体
″
意在包括具有衍生自人种系免疫球蛋白序列的可
变和恒定区的抗体。尽管如此,本发明中所述的人抗体在各种实施方式中可包括未由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性突变或通过体内体细胞突变引入的突变),例如在cdr中和在一些实施方式中cdr3中。然而,本文所用术语
″
人抗体
″
不旨在包括这样的抗体,其中源自另一种哺乳动物物种(如小鼠)的种系的cdr序列已嫁接到人框架序列上。
[0257]
本文所用的术语“重组人抗体”旨在包括通过重组方法制备、表达、创造或分离的所有人抗体,诸如使用转染到宿主细胞的重组表达载体表达的抗体(下文进一步描述),分离自重组、组合人抗体库的抗体(下文进一步描述),分离自人免疫球蛋白基因转基因动物(例如,小鼠)的抗体(参见例如,taylor,l.d.等(1992)nucl.acids res.20:6287-6295,通过引用并入本文)或通过涉及切割人免疫球蛋基因序列成其他dna序列的任何其他方法制备、表达、创造或分离的抗体。这类重组人抗体可以具有源自人种系免疫球蛋序列的可变和恒定区。然而,在某些实施方式中,这类重组人抗体经历体外诱变(或者,当使用人ig序列转基因动物时,体内体细胞诱变),由此重组抗体的vh和vl区的氨基酸序列是虽然衍生自且与人种系vh和vl序列相关,但可能并不天然出现在体内人抗体种系库(repertoire)内的序列。
[0258]
如本文所用的
″
分离的抗体
″
是指已被鉴定和分离和/或从其自然环境的至少一个组分中回收的抗体。例如,从生物体的至少一个组分,或从抗体自然存在或自然产生的组织或细胞中分离或移出的抗体是
″
分离的抗体
″
。在多个实施方式中,分离的抗体也包括重组细胞内的原位抗体。在其他实施方式中,分离的抗体是已经经过至少一个纯化或分离步骤的抗体。在多个实施方式中,分离的抗体可以基本不含其他细胞物质和/或化学物质。
[0259]
术语
″
表位
″
是指与抗体分子可变区域中的特定抗原结合位点相互作用的抗原决定簇,称为副表位。单一抗原可能具有多于一个表位。因此,不同的抗体可以结合至抗原上不同的区域且可以具有不同的生物学作用。表位可以是构象的或线性的。构象表位是由线性多肽链的不同区段的氨基酸在空间上并列产生的。线性表位是由多肽链中相邻的氨基酸残基产生的。在某些情况下,表位可包括抗原上的糖类、磷酰基或磺酰基的部分。
[0260]
用于本文所述方法的本文所述的抗tmem219抗体在各种实施方式中可包括与衍生抗体的相应种系序列相比的重链和轻链可变结构域的框架和/或cdr区中的一个或多个氨基酸取代、插入和/或缺失。这种突变可以通过比较本文所公开的氨基酸序列和例如可以获取自公共抗体序列数据库的种系序列而容易地确定下来。
[0261]
本发明在多种实施方式中包括抗体和涉及使用抗体的方法以及其抗原结合片段,这些抗体和抗原结合片段来源于本文公开的任何氨基酸序列,其中一个或多个框架和/或cdr区域内的一个或多个氨基酸被突变为抗体所来源的种系序列的一个或多个相应残基,或另一个人种系序列的一个或多个相应残基,或一个或多个相应种系残基的保守氨基酸取代(这种序列变化在此统称为
″
种系突变
″
)。
[0262]
可以构建多个抗体和抗原结合片段,其中包括一个或多个单独的种系突变或其组合。在某些实施方式中,vh和/或vl结构域内的所有框架和/或cdr残基都被突变回抗体来源的原始种系序列中发现的残基。在其他实施方式中,只有某些残基被突变回原始种系序列,例如,只有在fr1的前8个氨基酸或fr4的最末8个氨基酸内发现的突变残基,或只有在cdr1、cdr2或cdr3内发现的突变残基。在其他实施方式中,一个或多个框架和/或cdr残基被突变
为不同种系序列的一个或多个相应残基(即不同于抗体最初来源的种系序列的种系序列)。此外,抗体可以包含框架和/或cdr区域内两个或更多个种系突变的任何组合,例如,其中某些单独的残基被突变为某个种系序列的相应残基,而与原始种系序列不同的某些其他残基被保留或被突变为不同种系序列的相应残基。一旦获得,含有一个或多个种系突变的抗体和抗原结合片段可以很容易地测试一种或多种所需的特性,例如改进的结合特异性、增加的结合亲和力、改进或增强的拮抗或激动的生物特性(视情况而定)、减少的免疫原性等。以这种一般方式获得的抗体和抗原结合片段的使用都包含在本发明中。
[0263]
本发明还包括抗tmem219抗体和涉及使用抗tmem219抗体的方法,所述抗体包含本文公开的具有一个或多个保守取代的hcvr、lcvr和/或cdr氨基酸序列的任一者的变体。例如,本发明包括使用具有hcvr、lcvr和/或cdr氨基酸序列的抗il-6r抗体,其相对于本文公开的任何hcvr、lcvr和/或cdr氨基酸序列具有例如10个或更少、8个或更少、6个或更少、4个或更少等保守的氨基酸取代。
[0264]
本文所使用的术语“生物等效性”是指在相同摩尔剂量和类似条件(例如,相同给药途径)下给药后具有类似生物利用度(利用率和程度)的分子,使得在疗效和安全性方面,可以预期基本上与比较分子相同。两种包含抗igfbp3抗体的药物组合物如果在药理学上是等效的,即它们含有相同量的活性成分(如igfbp3抗体),以相同的剂型,给药途径相同,并符合相同或相当的标准,则其为生物等效的。生物等效性可以通过体内研究来确定,例如,比较两种组合物的药代动力学参数。生物等效性研究中常用的参数包括峰值血浆浓度(c
最大值
)和血浆药物浓度时间曲线下面积(auc)。
[0265]
在某些实施方式中,本发明涉及抗体和包括向对象给予抗体的方法,所述抗体包含重链可变区和轻链可变区,所述重链可变区包含选自seq id no:32至seq id no:37或seq id no:88至seq id no:95的序列,所述轻链可变区包含选自seq id no:38至seq id no:43或seq id no:96至seq id no:103的序列。本发明提供了包含这种抗体的药物组合物,以及使用这些组合物的方法。
[0266]
在各种实施方式中,抗体以包含合适运载体、赋形剂和其他药剂的制剂给予对象,以提供改善的转移、递送、耐受性等,并且适合于静脉或皮下注射。
[0267]
可注射制剂可以通过已知快速方法制备。例如,可以制备可注射制剂,例如,通过将上述抗体或其盐溶解、悬浮或乳化于无菌水介质或常规用于注射的油性介质中。作为注射用的水性介质,例如,生理盐水、含有葡萄糖和其他助剂等的等渗溶液,其可与适当的增溶剂结合使用,例如,醇(如乙醇)、多元醇(如丙二醇、聚乙二醇)、非离子表面活性剂[如聚山梨酸酯20或80、hco-50(氢化蓖麻油的聚氧乙烯(50mol)加合物)]等。作为油性介质,采用了例如芝麻油、大豆油等,其可与增溶剂如苯甲酸苄酯、苄醇等组合使用。这样制备的可注射制剂可以被装填于合适的安瓿中。
[0268]
根据本发明的抗体可以使用任何可接受的装置或机构给予对象。例如,可以用注射器和针头或用可重复使用的笔和/或自动注射器递送装置来完成给药。本发明的方法包括使用许多可重复使用的笔和/或自动注射器递送装置来给予抗体(或包含抗体的药物制剂)。此类装置的示例包括但不限于autopen
tm
(欧文蒙福德有限公司(owen mumford,inc.),英国伍德斯托克),disetronic
tm
笔(瑞士柏格多夫的迪思康医疗系统公司(disetronic medical systems)),humalog mix 75/25
tm
笔,humalog
tm
笔,humalin 70/30
tm
笔(伊利诺伊
州印第安纳波利斯市礼来公司),novopen
tm i、ii和iii(诺和诺德,丹麦哥本哈根),novopen junior
tm
(诺和诺德,丹麦哥本哈根),bd
tm
笔(新泽西州富兰克林湖的bd公司)、optipen
tm
,optipen pro
tm
、optipen starlet
tm
,和opticlik
tm
(赛诺菲安万特,德国法兰克福),仅举几个例子。应用于皮下递送本发明药物组合物的一次性笔和/或自动注射器递送装置的实例包括但不限于solostar
tm
笔(赛诺菲-安万特),flexpen
tm
(诺和诺德)和kwikpen
tm
(礼来(eli lilly)),sureclick
tm
自动注射器(安进,加利福尼亚州千橡),penlet
tm
(海斯迈有限责任公司(haselmeier),德国斯图加特),epipen(dey,l.p.),humira
tm
笔(伊利诺伊州雅培公园雅培实验室)、自动注射器(shl集团)和任何具有pushclick
tm
技术的自动注射器(shl集团),仅举几个例子。
[0269]
在一个实施方式中,用预先填充的注射器给予抗体。在另一个实施方式中,用预先填充的含有安全系统的注射器给予抗体。例如,安全系统可以防止意外的针刺伤害。在各种实施方式中,用含有安全系统(西部医药服务公司(west pharmaceutical services inc.))的预填充注射器给予抗体。另请参见美国专利号5,215,534和9,248,242,通过引用将其全文并入本文。
[0270]
在另一实施方式中,用自动注射器给予抗体。在各种实施方式中,用具有pushclick
tm
技术(shl基团)的自动注射器给予抗体。在各种实施方式中,自动注射器是一种包括注射器的装置,其允许将一定剂量的组合物和/或抗体给予对象。另请参见美国专利号9,427,531和9,566,395,通过引用将其全文并入本文。
[0271]
根据本发明,“对象”是指人对象或人患者。
[0272]
实施例
[0273]
方法
[0274]
重组蛋白
[0275]
重组人igfbp3来自生命技术公司(life technologies)(igfbp3,生命技术公司,10430h07h5)。外-tmem219,其为tmem219受体的胞外结构域,是通过genescript定制蛋白服务获得的。该蛋白质(大肠杆菌中生产的)具有以下氨基酸序列:
[0276]
人外-tmem氨基酸序列:
[0277]
thrtglrspdipqdwvsflrsfgqltlcprngtvtgkwrgshvvgllttlnfgdgpdrnktrtfqatvlgsqmglkgssagqlvlitarvttertagtclyfsavpgilpssqppiscseegagnatlsprmgeecvsvwsheglvltklltseelalcgsr(seq id no:125)
[0278]
鼠外-tmem氨基酸序列:
[0279]
thttglrspdipqdwvsflrsfgqlslcpmnetvtgtwqgphvvgllttlnfgdgpdrnktqtfqakihgsqigltgssagesvlvtarvasgrtpgtclyfsgvpkvlpssqppiscseegvgnatlspvmgeecvrvwsherlvltelltseelalcgs(seq id no:126)
[0280]
从原始人噬菌体展示文库中开发单克隆抗体
[0281]
使用人外tmem219(从genescript定制蛋白服务中获得)作为用于筛选的抗原,从原始人噬菌体展示文库中选择单克隆抗tmem抗体。外tmem抗原通过直接吸附或通过抗外tmem多克隆抗体捕捉被固定到96孔elisa板上。在用bsa洗涤和封闭孔后,添加抗体-噬菌体文库。粘性或交叉反应性抗体噬菌体先前被从文库中清除。
[0282]
展示抗原特异性抗体的噬菌体被捕捉到板表面。用pbs-t洗涤以去除未结合/弱结
合的噬菌体后,抗原特异性噬菌体被洗脱和扩增。在更严格的条件下,即增加洗涤步骤的数目以清除未结合或弱结合的噬菌体时,再次选择该扩增的文库子集进行靶向结合共进行了三轮筛选以富集抗原特异性抗体-噬菌体。
[0283]
在选择过程的最后,通过elisa对选择输出进行抗原特异性抗体筛选。为此目的,从选择输出的克隆中产生了单克隆scfv抗体。然后用elisa法检测其特异性抗原结合。鉴定了15个靶特异性命中。其中11个包含独特的cdr序列。这些抗体被克隆到哺乳动物scfv-fc表达载体中,导致scfv与人igg4 fc的遗传融合。
[0284]
通过瞬时转染hek293细胞,这些抗体中的6个可以以scfv-fc形式生产。该抗体通过亲和层析(蛋白a)进行纯化,并在pbs中重新缓冲。蛋白浓度通过uv/vis光谱确定,纯度通过考马斯染色检查。
[0285]
基于杂交瘤的单克隆抗体开发
[0286]
单克隆抗-tmem抗体是通过利用转基因小鼠鉴定的,其中相关的人类免疫球蛋白序列已经通过遗传工程改造(trianni mouse
tm
(trianni))被引入到动物基因组中。
[0287]
通过这种技术,生产了含有完整的人重链和轻链可变结构域的库且保留了小鼠恒定结构域的嵌合单克隆抗体。
[0288]
基本上,两个队列的trianni mouse
tm
(队列1:ald/mdp佐剂,队列2:sas/ribi佐剂)用人ectotmem219(genescript的定制蛋白服务)进行免疫,每周注射两次,持续4周,然后延长2周,每周注射一次。然后,从小鼠身上回收表达抗体的淋巴细胞(如b细胞),将此类细胞与髓系细胞系融合,以制备永生化杂交瘤细胞系,并对此类杂交瘤细胞系进行筛选和选择,以通过elisa鉴定产生对人外-tmem219特异性抗体的杂交瘤细胞系。对感兴趣的抗原有反应的杂交瘤细胞系被扩增。测序是通过rna分离完成的,然后用sanger测序方法对人vh和人vk进行cdna测序。
[0289]
抗体可以在杂交瘤细胞系以外的细胞系中表达。编码抗体的序列可用于转化合适的哺乳动物宿主细胞。
[0290]
在cho细胞中表达重组蛋白的方法
[0291]
对应的tc01和tm1 cdna被克隆进evitria的载体系统,使用常规的(基于非-pcr的)克隆技术以产生完整的人igg4 mab。evitria载体质粒是基因合成的。在低内毒素条件下基于阴离子交换色谱法制备质粒dna。序列的正确性用sanger测序验证(每个质粒多达2次测序反应,取决于cdna的大小)。
[0292]
悬浮适应型cho k1细胞(evitria)被用于生产。接种物在evigrow培养基中生长,其为化学组成明确的、不含动物组分的、无血清的培养基。用evitria定制的专有的转染试剂evifect转染细胞,转染后细胞在不含动物组分的、无血清的培养基evimake中生长,37℃下5%co2中维持7天。通过离心和随后的过滤(0.2μm过滤器)收获上清液。
[0293]
使用mabselect
tm
sure
tm
纯化抗体,用dulbecco的pbs(隆萨(lonza)be17-512q)作为洗涤缓冲液,0.1m甘氨酸ph 3.5作为洗脱缓冲液。随后在hiload superdex 200pg柱上进行尺寸排阻色谱,使用最终缓冲液作为运行缓冲液。
[0294]
用agilent advancebio sec柱(300a 2.7um 7.8x300mm)和dpbs作为运行缓冲液以0.8ml/分钟通过分析性尺寸排阻色谱确定单体性(monomericity)。
[0295]
下表2-7报告了来自人噬菌体展示文库的6种新的抗tmem抗体的序列。
[0296][0297][0298]
[0299][0300]
cdr定义也是使用来自http://www.abysis.org/的注释工具提供的,基于表4、5、10和11中定义的完整vh和vl氨基酸序列。
[0301]
例如,本文公开的任何抗体的vh氨基酸序列被插入注释工具中,并5提供kabat定义的cdr序列。
[0302]
参考seq id no.33(tc01的vh)的例子如下所示。
[0303]
表3.1:kabat定义的cdr序列
[0304][0305][0306]
本文公开的任何抗体的vh氨基酸序列也可以被插入注释工具中,并提供imgt定义的cdr序列。
[0307]
参考seq id no.33(tc01的vh)的例子如下所示。
[0308]
表3.2:imgt定义的cdr序列
[0309]
区域定义imgt
[0310][0311]
此外,本文公开的任何抗体的vh氨基酸序列也可以被插入注释工具中,并提供“全部并列(all,side by side)”定义的cdr序列。
[0312]
参考seq id no.33(tc01的vh)的例子如下所示。
[0313]
表3.3:全部并列定义的cdr序列
[0314]
区域 定义 全部并列
[0315]
[0316][0317]
还报告了基于tc01(seq id no.39)的完整vl氨基酸的使用来自http://www.abysis.org/的注释工具提供的cdr定义。
[0318]
表3.4:全部并列定义的cdr序列
[0319]
[0320]
[0321]
[0322][0323]
[0324][0325][0326]
[0327]
[0328]
[0329]
[0330][0331]
下表8-13报告了8种基于杂交瘤的新的抗tmem抗体的序列。
[0332]
[0333][0334]
[0335]
[0336][0337][0338]
[0339]
[0340]
[0341][0342]
[0343]
[0344]
[0345][0346]
其他抗体
[0347]
igg产生
[0348]
氨基酸序列被反向翻译成dna,并为hek表达进行密码子优化。经优化的dna序列被化学合成并克隆进人igg4(s228p l235e突变的)表达载体中。制备了转染级dna并用于hek细胞的瞬时转染。通过亲和层析(蛋白a)从hek培养物上清液中纯化产生的抗体。蛋白浓度通过uv/vis光谱确定,纯度通过还原sds-page分析检查。
[0349][0350][0351]
[0352][0353][0354]
[0355]
[0356]
[0357]
[0358][0359]
[0360]
[0361][0362]
[0363][0364]
使用完整人igg4抗体进行所有研究。
[0365]
实施例1:亲和力测量
[0366]
基于octet bli的分析
[0367]
抗体对靶标tmem拥有高亲和力。结合亲和力测量是使用octet仪器(octet bmia)进行的,其为基于生物分子相互作用分析的生物层干涉测量(bli)平台。为了建立试验,靶
单克隆抗体(30μg/ml,在pbs中)通过fc固定在抗小鼠igg fc捕捉(amc)或抗人igg fc捕捉(amc)生物传感器上,并测量与抗原、人和鼠外-tmem219(genescript的定制蛋白服务)在150nm的相互作用。
[0368]
表21中报告了抗tmem mab对靶人和鼠外-tmem219的亲和力测量。
[0369][0370]
新生成的抗tmem mab表现出良好的人抗原结合亲和力,kd小于2x10-8
m。该抗体也显示出鼠交叉反应性。这一数据证实,小鼠可以被认为是临床前开发过程中测试单克隆抗体的相关动物物种。
[0371]
通过elisa测量抗体结合活性
[0372]
用elisa法测量纯化的igg4(tc03、tc04、tc05)与重组的外tmem蛋白的结合活性。简言之,将外tmem在pbs中稀释至5μg/ml,并在96孔elisa板上涂布(100μl/孔),在rt下1小时。封闭和清洗板后,将抗体连续稀释加入到板中,并在rt下孵育1小时。洗板后,通过二抗-人fc hrp偶联抗体检测结合的抗体。在另一个洗涤步骤后,进行tmb反应,用硫酸停止,并测量吸光度。根据吸光度的读数,计算饱和抗体的ec50值。
[0373]
表22中报告了抗tmem mab对靶人外-tmem219的ec50。
[0374][0375]
实施例2:腹膜内(ip)给药后,抗tmem mab在ibd小鼠模型中的疗效
[0376]
c57bl/6j小鼠中右旋糖酐硫酸钠(dss)诱导的结肠炎模型是评价和证实ibd中药物抗炎和伤口愈合作用的有效动物模型。dss(在饮用水中口服)诱发明显的腹泻,然后是炎症。该模型充分表征,可靠,可重复并被监管部门所接受。[参见例如,eichele和kharbanda,“右旋糖酐硫酸钠结肠炎鼠模型:推进我们对炎性肠病发病机制的理解的一个不可或缺的
工具(dextran sodium sulfate colitis murine model:an indispensable tool for advancing our understanding of inflammatory bowel disease pathogenesis),”world j.gastroenterol.23(33):6016-6028(2017)]。该研究在c57bl/6j小鼠中进行。在这种特定的遗传背景下,小鼠在最后一次dss给药后3天分析时出现急性结肠炎,或者在最后一次dss给药后7天分析时出现慢性类似炎症。
[0377]
抗炎和伤口愈合的效果是在临床和组织学水平上使用经验证的临床评分,即疾病活动指数(dai)(表23)和经验证的组织学分析评分(表24)来评估的。
[0378]
动物
[0379]
雄性c57bl/6j小鼠由法国阿尔布雷斯勒的查尔斯河实验室提供。小鼠被笼养于20
±
5℃并提供自由饮水和进食。所有的实验方案都是在里尔的巴斯德研究所的认证机构中根据政府的指导方针进行的。
[0380]
dss诱导的小鼠结肠炎模型的建立和治疗
[0381]
通过用溶解于饮用水中的2.5%(w/v)dss(45kd;tdb consultancy ab,瑞典乌普萨拉,批号db001-41)喂养小鼠5天诱导急性结肠炎。小鼠被随机分为五组:对照组;dss 载剂;dss humira(阿达木单抗)0.3mg/小鼠(abbvie,1108722)、dss tm1 0.5mg/小鼠和dss tc01 0.5mg/小鼠。为了评估抗tmem mab对dss诱导的c57bl/6j小鼠急性结肠炎的影响,从结肠炎诱导前3天开始,每天用指示剂量的抗tmem mab对小鼠进行腹膜内给药治疗,直到最后一次给予dss后7天进行安乐死。动物模型的实验时间线在图1中描述。
[0382]
tmem mab的治疗特性与阳性对照humira(阿达木单抗)进行了比较,后者被批准用于治疗克罗恩病和溃疡性结肠炎。(taghipour n.等gastroenterol hepatol bed bench 2016;9(1):45-52).
[0383]
由于dss鼠模型需要每种抗体
‑‑
tmem mab和阳性对照humira
‑‑
与其同源的人类抗原的鼠正交物(分别为tmem219和tnfα)发生交叉反应
‑‑
所以无法衡量人类的相对疗效。
[0384]
临床评分
[0385]
每天记录所有组的小鼠体重、大便稠度和便血。疾病活动指数(dai)是基于体重、大便稠度和便血(hemoccult bleeding)的变化,根据标准的评分系统评分。这些参数是按照表23中描述的尺度进行评估的。dai数据是以这些每天取得的参数的平均分来表示的。在麻醉状态下,通过颈脱位法处死动物。安乐死时,仔细解剖结肠,测量结肠重量和大小。使用隐血检验(hemoccult)记录隐血(occult blood)(ob)的存在。
[0386][0387][0388]
如图2a所示,在最后一次给予dss的7天后,与健康对照组(仅接受载剂的组)相比,接受载剂的dss小鼠组的dai评分显著增加(p值=0.0012),表明结肠炎的严重程度。与只接
受载剂的dss小鼠相比,接受tco1(p值=0.002)、tm1(p值=0.05)和humira(p值=0.02)的结肠炎小鼠的dai评分有显著下降。这一结果表明新产生的抗tmem mab具有很强的抗炎作用。
[0389]
组织学结肠病变的评估
[0390]
为了评估炎症水平和组织再生情况,结肠样品被包埋到石蜡中并进行分析。为了进行组织学评估,结肠组织的切片(4μm)用may-grunwald-giemsa染色并进行评估。如dieleman等人1998年所述的多参数评分(0至18)(表24),由两名研究人员盲态进行。组织学检查对炎症的严重程度和范围、粘膜中细胞浸润的强度、其在粘膜下层的延伸、上皮病变的存在和组织再生进行分级。
[0391]
进一步检查石蜡包埋的结肠样品,根据制造商的方案,使用tunel测定试剂盒(西格玛(sigma),参考11684795910),通过免疫荧光染色脱氧核苷酸转移酶介导的脱氧尿苷三磷酸(tunel)检测细胞凋亡。tunel方法是用于测量细胞内核酸酶凋亡激活后产生的dna片段的有效方法。
[0392]
同时,为了确定细胞增殖水平,根据制造商的方案,使用pcna测定试剂盒(novus,nb600-1331)对增殖细胞核抗原(pcna)进行免疫荧光染色。pcna是细胞周期相关的蛋白,其在增殖细胞的g1后期和s期最大限度地升高。
[0393]
使用dapi核染色复染切片。通过荧光显微镜检测局部的荧光。
[0394][0395]
如图2b所示,在最后一次dss给药7天后,由may-grunwald-giemsa染色切片对各组的组织学评分进行了量化(图3a)。与没有结肠炎的健康对照组相比,接受载剂的dss小鼠组在组织学水平上仍记录到持续而显著的结肠炎症(p值=0.002)。在ip给予tc01 0.5mg/小鼠后,观察到与接受载剂的结肠炎小鼠相比,在组织学水平上炎症水平和粘膜再生有显著改善(p值=0.01)。此外,与接受载剂的结肠炎小鼠相比,以0.5mg/小鼠的量ip给予tm1在组织学水平上显示出炎症水平和粘膜再生的改善。
[0396]
tc01和tm1抑制了dss诱导的小鼠肠道细胞凋亡,如用tunel染色试剂盒染色的结肠组织切片所示,tunel染色试剂盒是检测凋亡过程中产生的dna片段的方法(图3b)。使用
dapi复染切片以提供核染色。与dss组相比,tc01和tm1组的tunel阳性细胞较少。
[0397]
在用dss治疗的小鼠组中,pcna的表达被抑制,表明结肠炎的严重程度。而在tc01和tm1治疗组中,pcna在结肠中的表达保持不变,与没有接受dss的对照组的表达相当,如用pcna染色试剂盒染色的结肠组织切片中所示(图3c)。
[0398]
使用dapi复染切片以提供核染色。
[0399]
统计学分析
[0400]
所有比较均采用两个独立样本的排列检验(permutation test)进行分析。使用graphpad prism 7.0(加利福尼亚州圣地亚哥格拉夫派得(graphpad)软件公司)进行统计学计算。如果p值≤0.05,差异被认为是统计学显著的。
[0401]
实施例3:腹膜内(ip)给药后,抗tmem mab在t1d小鼠模型中的疗效
[0402]
动物
[0403]
雌性非肥胖糖尿病(nod)小鼠(10周龄)来自查尔斯河实验室,意大利瓦雷泽卡尔科(库存号613)。所有小鼠的护理和使用都符合意大利关于动物护理的法律n
°
116/1992和欧洲共同体委员会指令eec/609/86。
[0404]
糖尿病监测和治疗
[0405]
显性糖尿病(最晚期,以空腹血糖浓度升高和典型症状为特征)定义为连续三次测量血糖水平高于250mg/dl。每周监测血糖两次。我们设置了以下处理组:
[0406]
1)未治疗的
[0407]
2)外-tmem219 0.1mg/天(i.p),持续10天
[0408]
3)抗-tmem219 tm1 0.5mg/天(i.p),持续10天
[0409]
4)抗-tmem219 tc01 0.5mg/天(i.p),持续10天
[0410]
外-tmem和抗体溶于pbs。
[0411]
每个处理组包括n=10只小鼠。当小鼠10周龄时的第1天开始处理。小鼠被随访至22周龄。当评估糖尿病时或在第22周时,收获小鼠。采集血浆样品和胰腺进行离体分析。实验时间线述于图1。
[0412]
胰腺炎评分和胰岛组织病理学检查
[0413]
胰腺炎评分是在5-μm-厚的福尔马林固定、石蜡包埋、苏木精和伊红(h&e)以及胰岛素染色的胰腺切片上进行的,如前所述(vergani a等diabetes 2010;ben nasr m等sci transl med 2017)。对苏木精和伊红(h&e)染色的胰腺切片进行胰腺炎评分。由经验丰富的病理学家基于胰岛浸润进行0至4分的评分。胰腺炎评分如下分级:0级,正常的胰岛;1级,外围轻度单核浸润(25%);2级,25-50%的胰岛浸润;3级,(50%的胰岛浸润);4级,胰岛完全浸润,没有剩余的实质残留。至少分析每组30个胰岛,并从获取自不同小鼠的切片中汇集。
[0414]
统计学分析
[0415]
除非另有报告,数据以平均值和平均值的标准误差(sem)表示。用双尾的t-检验(曼-惠特尼检验)来测试统计学上显著的差异。不同组间的糖尿病发病率用对数秩(mantel-cox)检验进行分析。使用graphpad prism 7.0(加利福尼亚州拉由拉市的格拉夫派得(graphpad)软件公司)进行统计学分析。所有的统计学检验在5%显著性水平进行。
[0416]
如图4和5所示,发明人评估了新产生的抗tmem219 mab的10天给药是否能防止nod小鼠的临床糖尿病发病,nod小鼠是选择性研究自身免疫性1型糖尿病(t1d)的模型。值得注
意的是,抗-tmem219 mab能长期保持血糖水平的控制,并能有效预防t1d nod小鼠模型的糖尿病发病。有趣的是,用tm1和tc01抗体治疗的小鼠在第22周时100%没有患糖尿病,相对的未治疗的对照组为50%(p<0.05,全体与未治疗相比)。
[0417]
接下来,分析从未治疗小鼠、tm1治疗、tc01治疗和外-tmem219治疗小鼠获得的nod小鼠的胰腺组织切片的胰岛浸润(胰腺炎)、胰岛面积和形态(图6a)以及胰岛素染色(图7)。tm1和tc01治疗组都显示出良好的胰岛形态,此外,tm1治疗的小鼠中面积似乎略有增加,这表明用抗tmem mab治疗可以防止胰岛破坏,使β细胞的功能正常。此外,与未经治疗的对照组相比,tm1和tc01治疗的小鼠显示出良好保留的胰岛素阳性,这进一步支持了胰岛的功能被保留下来。事实上,与未治疗的小鼠相比,经治疗的小鼠的胰岛浸润明显减少,从而支持了抗体的保护作用(图7)。
[0418]
那么本数据显示了抗tmem单克隆抗体对预防和/或治疗糖尿病的功效。
[0419]
实施例4:新产生的单克隆抗tmem219抗体抑制人β细胞系的凋亡
[0420]
为了证实新产生的单克隆抗tmem219抗体可以阻止igfbp3对胰腺内表达tmem219的细胞的促凋亡作用,我们在体外的β细胞系
‑‑
betalox-5中进一步测试。通过暴露于igfbp3诱导的casp8的上调被新产生的抗tmem219 mab所抵消,casp8减少了近30%。此外,将β细胞暴露于富含igfbp3的合并的t1d血清中会增加casp8的表达,而抗tmem219 mab能够抵消这种影响,使casp8至少减少30%,从而支持这些新产生的单克隆抗tmem219抗体在防止胰岛β细胞凋亡方面的有益作用(图8和9)。
[0421]
实施例5:新产生的单克隆抗tmem219抗体抑制人胰岛的细胞凋亡
[0422]
为了证实新产生的单克隆抗tmem219抗体可以阻止igfbp3对胰腺内表达tmem219的细胞的促凋亡作用,我们在体外的人胰岛(celprogen)中进一步测试。新产生的抗tmem219 mab抵消了通过igfbp3暴露诱导的casp8的上调以及细胞凋亡(图10和11),casp8减少40%,细胞凋亡减少30%。有趣的是,将人胰岛暴露在天然地富含igfbp3的合并的t1d血清中,增加了casp8的表达和细胞凋亡,而抗tmem219 mab能够抵消这种影响,使casp8和细胞凋亡减少近50%,从而支持新产生的单克隆抗tmem219抗体在防止胰岛细胞凋亡中的有益作用(图12和13)。
[0423]
实施例6:新产生的单克隆抗tmem219抗体对β细胞没有毒性
[0424]
为了证明新产生的单克隆抗tmem219抗体在没有igfbp3连接的情况下不会激活tmem219的下游信号转导从而诱发细胞凋亡,我们进行了两个主要的试验。首先,我们证明,与那些受到igfbp3挑战的细胞相比,抗tmem219处理的β细胞不会经历凋亡,igfbp3挑战的细胞死亡增加了近30%(图14)。接下来,我们评估了casp8 mrna表达,证明在用igfbp3培养的β细胞中,casp8 mrna表达如预期的那样上升(近70%),而在抗tmem219培养的β细胞中,casp8保持不变(图15)。这些数据共同支持抗tmem219 mab没有任何毒性/凋亡作用。
[0425]
实施例7:抗tmem219 mab对链脲佐菌素诱导的β细胞死亡糖尿病模型的作用
[0426]
我们进一步测试了通过抗tmem219 mab的igfbp3/tmem219药理阻断在第二个β细胞破坏和糖尿病模型中的效果,多次低剂量链脲佐菌素(ldstz,50mg/kg,持续5天)。
[0427]
用注射链脲佐菌素化学诱导的糖尿病被用来评估主要针对β细胞团的靶向策略的效果。它与轻度炎症的发展有关,但没有发生像在nod小鼠中观察到的那种自身免疫反应。因此,化合物在保持血糖水平方面的成功主要在于保护β细胞团不受损害和保持胰岛素分
泌。
[0428]
当使用50mg/kg的低剂量方案连续5天给药时,链脲佐菌素诱导β细胞死亡,如在糖尿病中观察到的那样,糖尿病/高血糖通常在给药后的前2周内发生(图16)。因此,我们对b6小鼠给予低剂量stz持续5天,同时其以0.5mg/天的剂量接受抗tmem219 mab,持续10天。与未治疗的动物相比,抗tmem219 mab治疗成功地保持了经治疗的小鼠的血糖水平(图17),腹膜内葡萄糖耐量测试(ipgtt)中60分钟检测的血糖水平也有改善(图18)。形态学分析也显示,与未治疗的小鼠相比,接受抗tmem219 mab治疗的动物的胰岛数量和面积被良好保留(图19)。总的来说,这证实了抗tmem219可以保留β细胞团,并在β细胞破坏的模型中保持血糖水平,从而突出了这种策略在保护胰岛免受糖尿病诱发的β细胞损失和功能障碍的益处。
[0429]
抗tmem219抗体(如tc01)能有效地保护β细胞不受损伤,防止其损失,进一步保留其对葡萄糖刺激的反应能力。另外,在用抗tmem219 tc01治疗的小鼠的胰岛中检测不到炎症,从而证实了对胰岛形态的保护作用。
[0430]
实施例4-7的方法
[0431]
重组蛋白和干预性研究
[0432]
50ng/ml(igfbp3)的重组人igfbp3(生命技术公司(life technologies),10430h07h5)和130ng/ml外-tmem219被加入到迷你肠培养的 1天的培养物中。
[0433]
与浓度为10μg/ml的igfbp3相比,以1∶1的分子比加入新产生的抗tmem219单克隆抗体。
[0434]
β细胞系(β-lox5)
[0435]
细胞用dmem 10%fbs、0.02%bsa、15mm hepes、nea 1x、1g/l葡萄糖、pen/strep培养。细胞通常被接种到35-mm的孔中,密度为10,000个细胞/孔。细胞在80%融合度时被传代。按照重组蛋白和干预性研究部分的描述,在有/无重组蛋白/抗体的情况下,将细胞培养3天。
[0436]
人胰岛
[0437]
从健康对象中分离出的人胰岛langherans(编号35002-04)也是从商业渠道购买的(celprogen,加利福尼亚州托伦斯菲),并按照制造商的说明用标准培养基和10%fbs进行培养。为了模拟糖尿病状况,从已建立的t1d(n=5/组)获得的人类糖尿病血清以10%的浓度加入到人类胰岛/β细胞系中,以代替常规fbs。
[0438]
胰岛/β细胞细胞死亡
[0439]
为了评估纯化的人胰岛和β细胞系中的细胞凋亡/细胞死亡,我们采用了光度酶免疫分析(罗氏诊断(roche diagnostics)gmbh,11544675001,德国曼海姆),该方法在体外对细胞质裂解物和细胞上清液中诱导细胞应激后的组蛋白相关联的dna片段进行量化。
[0440]
stz-诱导的糖尿病研究
[0441]
通过连续5天注射低剂量的链脲佐菌素(50mg/kg,腹膜内给予;西格玛奥德里奇(sigma aldrich)s0130)化学诱导糖尿病,并在接下来的15天里监测血糖。对照组由野生型b6小鼠组成,也注射了低剂量的链脲佐菌素并进行相应的监测。从第0天到第10天,分别以0.5mg/天和0.1mg/天的剂量腹膜内给予抗tmem219 mab和外-tmem219,并在随后的15天内监测血糖。最后进行腹膜内葡萄糖耐量试验(ipgtt),在小鼠饥饿一夜后注射葡萄糖1kg/g,在0、30、60和120分钟监测血糖。
[0442]
统计分析
[0443]
数据以平均值和平均值的标准误差(sem)表示。用双尾的t-检验来测试统计学上显著的差异。统计学显著的区别通过双侧斯氏t检验确定。对于多重比较,使用bonferroni校正的方差分析检验。使用graphpad prism 5.0(加利福尼亚州拉由拉市的格拉夫派得(graphpad)软件公司)生成图表。所有的统计学检验在5%显著性水平进行。
[0444]
参考文献
[0445]
1.baxter rc.j cell commun signal.2013;7(3):179-89。
[0446]
2.oh y,等,prog growth factor res.1995;6(2-4):503-12。
[0447]
3.ingermann ar,等jbc.2010;285(39):30233-46。
[0448]
4.d
′
addio f,等cell stem cell.2015;17(4):486-98。
[0449]
5.brennand k,和melton d.j.cellular and molecular med..2009;13(3):472-87。
[0450]
6.yi p,park js,和melton da.cell.2014;159(3):467-8。
[0451]
7.ben nasr m,等,pharmacological res.:the official journal of the italian pharmacological society.2015;98:31-8。
[0452]
8.keenan ha,等diabetes.2010;59(11):2846-53。
[0453]
9.meier jj,等,diabetologia.2005;48(11):2221-8。
[0454]
10.atkinson ma,等,diabetes care.2015;38(6):979-88。
[0455]
11.nguyen kh,等,endocrinology.2011;152(6):2184-96。
[0456]
12.yakar s,等,faseb j.2009;23(3):709-19。
[0457]
13.drogan d,等,am j epidemiol.2016;183(6):553-60。
[0458]
14.peet a,等,eur j endocrinol.2015;173(2):129-37。
[0459]
15.kaplan gg.nat rev gastroenterol hepatol.2015;12(12):720-7。
[0460]
16.cui s,和chang py.world j gastroenterol.2016;22(31):7099-110。
[0461]
17.yancu d,等,j gastroenterol hepatol.2017;32(1):146-53。
[0462]
18.jung p,等,nature medecine 2011;17:1225-1227。
[0463]
20.george mj,等,curr diab rep 2013;13(1):72-80。
[0464]
21.marsha jd.am health drug benefits 2011;4(5):312-322。
[0465]
22.dhingra ak等,antiinflamm antiallergy agents med chem.2015;14(2):81-97。
[0466]
23.pithadia ab,sunitaj.pharmacoligal rep 2011;63:629-642。
[0467]
24.zhe wang,等,expert opin drug deliv.2010 feb;7(2):159-71。
[0468]
25.sumit g,wei w,tsutomu和satoshi o,antibodies 2013;2:452-500。
[0469]
26.beck a,等,nat rev imm 2010;10:345-352。
[0470]
27.huch m,等,nature 2013;494(7436):247-250。
[0471]
28.mah
éꢀ
mm,等,curr protoc mouse biol2013;3:217-240。
[0472]
29.shimkets ra,基因表达概况分析(gene expression profiling).《分子生物学方法(meth.in mol.biol.)》;258.胡马纳出版社(humana press)。
[0473]
30.raghavachari n,等,基因表达概况分析(gene expression profiling),《分
子生物学方法(meth.in mol.biol.)》;1783.胡马纳出版社(humana press)。
[0474]
31.kurien bt,等,蛋白质印迹(western blotting),《分子生物学方法(methods in molecular biology)》;1312.胡马纳出版社(humana press)。
[0475]
32.hnasko r,elisa,《分子生物学方法(methods in molecular biology)》,1318.胡马纳出版社(humana press)。
[0476]
33.lipton ms,等,蛋白质和肽的质谱(mass spec.of proteins and peptides),《分子生物学方法(meth.in mol.biol.)》,492.胡马纳出版社(humana press)。
[0477]
34.brady h,凋亡方法和方案(apoptosis meth.and protocols),《分子生物学方法(meth.in mol.biol.)》,282.胡马纳出版社(humana press)。
[0478]
35.cheryl l等,蛋白质蛋白质相互作用(protein-protein interactions),《分子生物学方法(meth.in mol.biol.)》,1278.胡马纳出版社(humana press)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。