1.本发明属于诱导性多能干细胞培养技术领域,具体涉及将外周血单个核细胞重编程为诱导多能干细胞的系统和方法。
背景技术:
2.胚胎干细胞是一种多能干细胞,有潜力分化成各种组织器官的多种类型细胞,能够应用于临床上器官组织移植和细胞治疗,也可以用来为研究疾病提供细胞模型。但因为其来源于胚胎发育早期囊胚的内细胞团,建系时不可避免要对卵细胞进行操作,所以涉及到很多伦理问题,一直以来饱受争议。
3.2006年日本京都大学的yamanaka实验室利用oct3/4、sox2、klf4、c-myc 4 四种转录因子将鼠成纤维细胞重编程为诱导多功能干细胞,标志着一种新型类胚胎干细胞的问世。诱导多能干细胞(induced pluripotent stem cell,ipsc)几乎可以从所有的成体组织细胞制备获得,使得制备病人自体的多能干细胞成为可能,且可有效避免胚胎干细胞临床应用的局限性。因此,ips细胞在新药筛选,体外疾病模型的建立,细胞替代性治疗以及再生医学方面具有广泛的应用前景。
4.目前,国际上已经开发出多种ipsc重编程方法,但各种方法均存在一定的局限性。如利用仙台病毒或者慢病毒携带不同的外源性转录因子在细胞中表达从而启动细胞重编程,该类方法的缺点在于基因组的随即插入可能会带来潜在风险,而且病毒诱导实验成本较高。利用脂质体包裹携带外源性转录因子重编程法,即在载体两侧插入了loxp位点,在完成诱导后通过瞬时表达cre重组酶而删除此重编程构件,该系统在重编程完成后可对外源基因进行删除,可以避免重编程因子的激活,从而降低了肿瘤生成的风险,但是此系统的重编程因子去除效率极低,并且删除重编程构件后,细胞内仍残留含loxp位点的载体。
5.此外,为了给细胞生长提供充足的营养,现有的诱导多能干细胞重编程过程中使用的培养基中添加了大量动物来源的组份,使得ipsc临床应用上受到限制。
6.总之,目前现有的诱导人体细胞为ips细胞的技术体系普遍面临着效率低、诱导时间长,制备成本高等问题。为使人ips细胞在再生医学和疾病发生机制研究中得到广泛应用,必须探索一种高效的诱导策略,即能够缩短ips细胞诱导时间的重编程培养基以及重编程方法。
技术实现要素:
7.本发明针对现有ips细胞重编程效率低,诱导时间长的技术问题,提供了一种用于将外周血单个核细胞(pbmc)重编程为人诱导性多能干细胞的重编程系统以及重编程方法。
8.本发明的一个方面提供了用于将外周血单个核细胞(pbmc)重编程为人诱导性多能干细胞的重编程系统,其特征在于,所述重编程系统包含重编程诱导培养液和一个或多个载体,所述一个或多个载体能够表达人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂;其中所述重编程诱导培养液包含ix-psc基础培养基以及gsk-3抑制剂、去乙
酰化酶抑制剂、mek抑制剂、rock抑制剂和4-羟乙基哌嗪乙磺酸;其中ix-psc基础培养基是以dmem/f12为基础培养基,添加抗坏血酸、fgf2、tgfβ1、神经调节蛋白1、igf-1、超氧化物歧化酶、过氧化氢酶、人血清白蛋白、转铁蛋白和亚硒酸钠。
9.在一些实施方案中,所述p53基因表达抑制剂和/或cohesin基因表达抑制剂是抑制性rna分子;优选地,所述抑制性rna分子是反义rna、mirna、sirna或shrna;更优选地,所述抑制性rna分子是shrna。
10.在一些实施方案中,所述一个或多个载体是非基因组整合的载体;更优选地,所述一个或多个载体是质粒。
11.在一些实施方案中,所述gsk-3抑制剂为chir99021,所述去乙酰化酶抑制剂为vpa,所述mek抑制剂为 pd0325901和/或所述rock抑制剂为thiazovivin。
12.在一些实施方案中,在所述重编程诱导培养液中,所述人血清白蛋白浓度为1-10mg/ml,所述gsk-3抑制剂浓度为0.5-3μm,所述去乙酰化酶抑制剂浓度为0.3-3μm,所述mek抑制剂浓度为10-100nm,所述rock抑制剂浓度为0.5-5μm,和/或所述4-羟乙基哌嗪乙磺酸浓度为1-10mm;优选地,在所述重编程诱导培养液中,所述人血清白蛋白浓度为5mg/ml,所述gsk-3抑制剂浓度为2μm,所述去乙酰化酶抑制剂浓度为2μm,所述mek抑制剂浓度为50nm,所述rock抑制剂浓度为2.5μm,和/或所述4-羟乙基哌嗪乙磺酸浓度为5mm 。
13.本发明的另一方面提供一种将外周血单个核细胞(pbmc)重编程为诱导性多能干细胞的方法,所述方法包括:i)用一个或多个载体转染外周血单个核细胞,所述一个或多个载体能够表达人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂,获得表达人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂的外周血单个核细胞;ii)在重编程诱导培养液中培养所述外周血单个核细胞,获得诱导性多能干细胞;其中所述重编程诱导培养液包含ix-psc基础培养基、gsk-3抑制剂、去乙酰化酶抑制剂、mek抑制剂、rock抑制剂以及4-羟乙基哌嗪乙磺酸;其中ix-psc基础培养基是以dmem/f12为基础培养基,添加抗坏血酸、fgf2、tgfβ1、神经调节蛋白1、igf-1、超氧化物歧化酶、过氧化氢酶、人血清白蛋白、转铁蛋白和亚硒酸钠。
14.在一些实施方案中,所述p53基因表达抑制剂和/或cohesin基因表达抑制剂是抑制性rna分子;优选地,所述抑制性rna分子是反义rna、mirna、sirna或shrna;更优选地,所述抑制性rna分子是shrna。
15.在一些实施方案中,所述一个或多个载体是非基因组整合的载体;更优选地,所述一个或多个载体是质粒。
16.在一些实施方案中,所述一个或多个载体的总浓度为1-3μg载体 /1.0
×
105血细胞,优选为2μg载体 /1.0
×
105血细胞。
17.在一些实施方案中,所述gsk-3抑制剂为chir99021,所述去乙酰化酶抑制剂为vpa,所述mek抑制剂为 pd0325901和/或所述rock抑制剂为thiazovivin。
18.在一些实施方案中,在所述重编程诱导培养液中,所述人血清白蛋白浓度为1-10mg/ml,所述gsk-3抑制剂浓度为0.5-3μm/ml,所述去乙酰化酶抑制剂浓度为0.3-3μm/ml,所述mek抑制剂浓度为10-100nm,所述rock抑制剂浓度为0.5-5μm,和/或所述4-羟乙基哌嗪
乙磺酸浓度为1-10mm;优选地,在所述重编程诱导培养液中,所述人血清白蛋白浓度为5mg/ml,所述gsk-3抑制剂浓度为2μm,所述去乙酰化酶抑制剂浓度为2μm,所述mek抑制剂浓度为50nm,所述rock抑制剂浓度为2.5μm,和/或所述4-羟乙基哌嗪乙磺酸浓度为5mm。
19.在一些实施方案中,所述方法包括以下步骤:步骤1) :将外周血单个核细胞(pbmc)在35~39℃、3~7% co2和0.5-2
×
106细胞/孔的条件下于孔板中培养1-3天;步骤2) :按照每种载体1-3μg /1.0
×
105血细胞将所述一种或多种载体转染导入步骤1)获得的外周血单个核细胞中,并将其接种到组织培养板上,用stempro
™ꢀ‑
34培养基在35~39℃、3~7% co2和3~7%o2的条件下培养1-3天;步骤3):转染后第2-3天,更换为新鲜的stempro
™ꢀ‑
34培养基;此后每隔1-3天更换为所述重编程诱导培养液,并于35~39℃、3~7% co2和3~7%o2的条件下培养,直至出现诱导多能干细胞克隆;优选地,所述方法包括以下步骤:步骤1):将外周血单个核细胞(pbmc)在37℃、5%co2和1
×
106细胞/孔的条件下于孔板中培养2天;步骤2):按照总浓度为2μg载体 /1.0
×
105血细胞将所述一种或多种载体转染导入外周血单核细胞中,将其接种到组织培养板上,用stempro
™ꢀ‑
34培养基在37℃、5%co2和5%o2的条件下培养2天;步骤3):转染后第2天,更换新鲜的stempro
™ꢀ‑
34;此后每隔2天更换为所述重编程诱导培养液,并在37℃、5%co2和5%o2的条件下培养,直至出现诱导多能干细胞克隆;任选地,所述方法还包括:步骤4):出现诱导多能干细胞克隆后更换所述重编程诱导培养液,于35~39℃和3~7% co2的条件下继续培养,培养期间每隔1-2天更换干细胞培养基。
20.本发明的又一方面提供包含上述任一种重编程系统的试剂盒。
21.本发明的再一方面提供上述任一种重编程系统或如上述任一种试剂盒用于诱导外周血单个核细胞(pbmc)重编程为人诱导性多能干细胞的用途。
22.本发明的积极效果在于:本发明在细胞重编程时在重编程诱导培养基中添加了gsk-3抑制剂、去乙酰化酶抑制剂、mek抑制剂、rock抑制剂,并且还使用人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂促进细胞重编程,在pbmc重编程为ips的过程中,各组分协同发挥作用,在维持细胞生长增殖的同时,提高了细胞诱导重编程的效率,与现有技术相比,缩短了诱导重编程产生ips细胞克隆的时间,仅需10-12天,大大节约了制备成本,而且所需的转录因子少,节约了制备成本。在本发明的优选方案中,采用非基因组整合的载体,还避免了传统病毒转染所面临的基因随机插入的风险。
附图说明
23.图1为分离获得的外周血单个核细胞(pbmc)显微镜照片;图2为不同重编程方法获得的克隆数量;图3为所获细胞系的eb分化鉴定照片;
图4为所获细胞系的多能性免疫荧光鉴定照片;图5为所获细胞系的流式鉴定照片;图6为所获细胞系的核型鉴定照片。
具体实施方案
24.本发明提供用于诱导pbmc重编程为诱导多能干细胞的重编程系统。所述重编程系统为多种组分的组合,其中的各组分可协同诱导细胞重编程,提高细胞重编程效率,缩短诱导重编程时间。包含人血清白蛋白的ix-psc基础培养基能够为细胞生长增殖提供丰富的营养和必须的细胞因子。gsk-3抑制剂chir99021可以通过竞争atp结合位点的方式来抑制gsk-3α和gsk-3β的活性,从而抑制细胞凋亡,提高细胞在重编程过程中的存活率以及增强wnt信号通路,增强体细胞重编程为ipsc的效率。去乙酰化酶抑制剂vpa可以促进组蛋白乙酰化,使染色质采取松散的结构,从而促进转录因子的结合,提高重编程的效率。mek抑制剂 pd0325901可以通过与mek结合使其与atp结合位点的构象发生变化达到抑制mek的作用,通过抑制mek-erk这条调节细胞增殖、凋亡相关的信号通路,显著提高ipsc的存活、增殖和重编程效率。rock抑制剂thiazovivin能够增强胚胎干细胞的存活,提高ipsc的生成效率,缩短ipsc细胞的重编程诱导时间。4-羟乙基哌嗪乙磺酸(hepes)能够在细胞培养时维持稳定的ph值,从而促进细胞的生长和增殖。p53基因表达抑制剂和cohesin基因表达抑制剂在重编程过程中促进细胞存活的同时,可以显著改变染色质的三维结构,使其变得松散和开放,从而加强oct4和所添加的诱导小分子(如vpa、chir99021和pd0325901等)的作用频率,显著加快重编程进程。
25.本发明所述的“外周血单个核细胞(pbmc)”是指从外周血分离的单个核细胞,主要包括淋巴细胞,也包括少数单核细胞、浆细胞、造血干细胞和其他祖细胞等。用于本发明的pbmc可以是从血液分离的或是冻存的pbmc。从血液分离的pbmc通常可以是从冻存或新鲜采集的血液样本用ficoll-paque密度梯度离心法分离获得,例如,在一些实施方案中,可以将冻存或新鲜采集的血液样本用ficoll-paque密度梯度离心法分离外周血单个核细胞(pbmc),于35~39℃优选37℃、3~7% co2优选5%co2、0.5-2
×
106细胞密度优选1
×
106细胞/孔接种于超低吸附24孔板中进行培养,培养1-3天优选2天,所获得的pbmc可用于进行载体的转染。在另一些实施方案中,使用冻存的pbmc,例如将冻存后经复苏后用于载体的转染,例如,在一些实施方案中,取冻存的pbmc,37℃水浴快速化冻。用1ml移液枪轻柔吹打细胞1-2次后将细胞转移到15ml 离心管中。用1ml室温预热后的 stempro
™ꢀ‑
34基础培养基润洗冻存管1次,将润洗后的细胞悬液转到上述离心管中,再逐滴向离心管中添加9ml stempro
ꢀ™ꢀ‑
34基础培养基;200g,3min 离心。弃上清,用stempro
™ꢀ‑
34完全培养基重悬细胞,接种到超低吸附24孔板中,并于35~39℃优选37℃、3~7% co2优选5%co2培养箱中培养1-3天优选2天。在一些实施方案中,所述pbmc可以是人pbmc。
26.本文所述的“重编程”是指将体细胞去分化为多能性干细胞的过程。
27.本发明的重编程诱导培养液是在ix-psc基础培养基中添加gsk-3抑制剂、去乙酰化酶抑制剂、mek抑制剂、rock抑制剂和4-羟乙基哌嗪乙磺酸。本发明所述的ix-psc基础培养基是以dmem/f12为基础培养基,添加抗坏血酸、fgf2、tgfβ1、神经调节蛋白1、igf-1、超氧化物歧化酶、过氧化氢酶、人血清白蛋白、转铁蛋白和亚硒酸钠获得的培养基。在优选的实
施方案中,所述ix-psc基础培养基可以是在dmem/f12的基础上添加10-30 μg/ml抗坏血酸、30-50 ng/ml fgf2、0.5-2 ng/ml tgfβ1、3-9 ng/ml神经调节蛋白1、10-20 ng/ml igf-1、2-3 μg/ml超氧化物歧化酶、2-3 μg/ml过氧化氢酶、1-10 mg/ml人血清白蛋白、10-30 μg/ml转铁蛋白和10-30 μg/ml亚硒酸钠。在更优选的实施方案中,所述ix-psc基础培养基可以是在dmem/f12的基础上添加20μg/ml抗坏血酸、40ng/ml fgf2、1ng/ml tgfβ1、6ng/ml神经调节蛋白1、15ng/ml igf-1、2.5μg/ml超氧化物歧化酶、2.5μg/ml过氧化氢酶、5mg/ml人血清白蛋白、20μg/ml转铁蛋白和20μg/ml亚硒酸钠。
28.本发明所述的“dmem/f12(dulbecco's modified eagle medium/nutrient mixture f-12)”是dmem 和 ham's f-12的 1:1 混合物,是一种广泛使用的基础培养基,可用于支持多种哺乳动物细胞生长,可以从多个供应商(例如thermo fisher scientific)购买获得。
29.本发明所述的“fgf2”是指成纤维细胞生长因子(fibroblast growth factor)2.本发明所述的“tgfβ1”是指转化生长因子β1(transforming growth factorβ1)。
30.本发明所述的“神经调节蛋白1”也可被称为或ngr1( neuregulin-1)。
31.本发明所述的“igf-1”是指胰岛素样生长因子-1(insulin-like growth factor-1)。
32.本发明的重编程诱导培养基中含有4-羟乙基哌嗪乙磺酸(hepes),其浓度为1-10mm,优选为5mm。
33.本发明所述的“rock抑制剂”是指rho相关蛋白激酶(rho-associated protein kinase, rock)的抑制剂,包括但不限于thiazovivin、y-27632和kd-025(也称slx-2119)。本发明的培养液中可以包括一种或更多种rock抑制剂。本发明的培养液中rock抑制剂的含量可以是0.5-5μm,优选为2-2.5μm,更优选为2.5μm。
34.本发明所述的“mek抑制剂”是指有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase, mapk/erk kinase)的抑制剂,包括但不限于pd0325901。本发明的培养液中可以包括一种或更多种mek抑制剂。本发明的培养液中mek抑制剂的含量可以是10-100nm,优选为25-50nm,更优选为50nm。
35.本发明所述的“去乙酰化酶抑制剂”也可以被称为组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,hdaci),是能够抑制组蛋白去乙酰化酶(hdac)活性的试剂,包括但不限于vpa(丙戊酸,valproic acid)、nabu(丁酸钠,sodium butyrate)、tsa( 曲古菌素,trichostatin a)和saha(辛二酰苯胺异羟肟酸,suberoylanilide hydroxamic acid)。本发明的培养液中可以包括一种或更多种去乙酰化酶抑制剂。本发明的培养液中去乙酰化酶抑制剂的含量可以是0.3-3μm,优选为1-2μm,更优选为1.5-2μm,更优选为2μm。
36.本发明所述的“gsk-3抑制剂”是指糖原合成酶激酶-3(glycogen synthase kinase-3)的抑制剂,包括但不限于chir99021、sb 216763、tws119、ly2090314、tideglusib和小分子化合物bio(6-溴靛玉红-3-肟,6-bromoindirubin-3-oxime)。本发明的培养液中可以包括一种或更多种gsk-3抑制剂。本发明中的rock抑制剂、ahr抑制剂、去乙酰化酶抑制剂和gsk-3抑制剂均可以从多个供应商购买获得。本发明的培养液中去gsk-3抑制剂的含量可以是0.5-3μm,优选为1-2μm,更优选为2μm。
37.本发明的重编程诱导培养液中还可以进一步添加微量元素b和微量元素c,微量元
素b和微量元素c能够为参与蛋白质的合成与核酸的代谢,也能够促进细胞的存活。
38.本发明所述的微量元素b为多种微量元素的组合物,优选包含钼酸铵,钒酸铵,硫酸锰,硫酸镍,硅酸钠,氯化亚锡和盐酸。所述微量元素b可以从供应商购买,例如购自corning的trace elements b,货号25-022。
39.本发明所述的微量元素c为多种微量元素的组合物,优选包含氯化铝,醋酸钡,氯化镉,氯化铬,二氯化钴,二氧化锗,溴化钾,碘化钾,氯化铷,硝酸银,氟化钠和氯化氧锆。所述微量元素c可以是从供应商购买,例如购自corning的trace elements c,货号25-023。
40.微量元素b和c稀释浓度为300-1000
×
,优选500
×
。其中稀释浓度是指添加到培养基中时稀释的倍数,例如“300-1000
×”
表示添加到培养基中时稀释300-1000倍,类似地,“500
×”
表示添加到培养基中时稀释500倍。
41.本发明的重编程系统和方法包括通过载体将人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂递送至细胞中。因此,本发明的重编程系统中包含一个或多个载体,所述一个或多个载体用于表达人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂。当所述一个或多个载体被转入细胞(例如pbmc)后,可以在pbmc中表达人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂。
42.术语“oct4”是指八聚体结合转录因子4( octamer-binding transcription factor 4),也可以被称为oct3或oct3/4,是一种蛋白质,包含pou结构域。参见a k ryan and m g rosenfeld, genes dev. 1997, 11, 1207-1225。在一些实施方案中,oct3/4为人oct3/4(hoct3/4)。在一些实施方案中,hoct3/4的编码序列为:atggcgggacacctggcttcggatttcgccttctcgccccctccaggtggtggaggtgatgggccaggggggccggagccgggctgggttgatcctcggacctggctaagcttccaaggccctcctggagggccaggaatcgggccgggggttgggccaggctctgaggtgtgggggattcccccatgccccccgccgtatgagttctgtggggggatggcgtactgtgggccccaggttggagtggggctagtgccccaaggcggcttggagacctctcagcctgagggcgaagcaggagtcggggtggagagcaactccgatggggcctccccggagccctgcaccgtcacccctggtgccgtgaagctggagaaggagaagctggagcaaaacccggaggagtcccaggacatcaaagctctgcagaaagaactcgagcaatttgccaagctcctgaagcagaagaggatcaccctgggatatacacaggccgatgtggggctcaccctgggggttctatttgggaaggtattcagccaaacgaccatctgccgctttgaggctctgcagcttagcttcaagaacatgtgtaagctgcggcccttgctgcagaagtgggtggaggaagctgacaacaatgaaaatcttcaggagatatgcaaagcagaaaccctcgtgcaggcccgaaagagaaagcgaaccagtatcgagaaccgagtgagaggcaacctggagaatttgttcctgcagtgcccgaaacccacactgcagcagatcagccacatcgcccagcagcttgggctcgagaaggatgtggtccgagtgtggttctgtaaccggcgccagaagggcaagcgatcaagcagcgactatgcacaacgagaggattttgaggctgctgggtctcctttctcagggggaccagtgtcctttcctctggccccagggccccattttggtaccccaggctatgggagccctcacttcactgcactgtactcctcggtccctttccctgagggggaagcctttccccctgtctccgtcaccactctgggctctcccatgcattcaaactgatgatga(seq id no:1)术语“p53基因”是一种肿瘤抑制基因,编码p53蛋白,p53蛋白和p53基因是本领域技术人员熟知。在一些实施方案中,抑制p53基因表达的shrna的序列是ccgggtccagatgaagctcccagaactcgagttctgggagcttcatctggacttttt(seq id no:2)术语“cohesin基因”是指染色体粘连蛋白(cohesin)的编码基因,cohesin通常用于连接染色体的环形结构骨架,cohesin蛋白及其编码基因也是本领域技术人员熟知的。在
一些实施方案中,cohesin的mrna序列可参见genbank accession no. nc_000008。在一些实施方案中,抑制cohesin基因表达的shrna的序列caccgccttcatgttgtttgcattccgaagaatgcaaacaacatgaaggc(seq id no:3)本发明中,“基因表达抑制剂”是指可以抑制目标基因的表达的抑制性分子,这种分子可以通过例如抑制mrna的产生或者降解mrna等机制,使得所述的基因不能表达出mrna或该基因所编码的蛋白,或者使表达的mrna或蛋白质的量相对于未使用所述抑制剂的情况有所减少,例如减少10%以上、20%以上、30%以上、40%以上、50%以上、60%以上、70%以上、80%以上或90%以上。所述“基因表达抑制剂”可以是通过反义抑制或rnai方式抑制目标基因表达的分子,例如抑制性rna分子,作为示例,可以举出反义rna、sirna、shrna或mirna等。应当理解,所述基因表达抑制剂还可以是其他形式的抑制剂,例如目标基因的显性失活突变体等。本发明中,所述基因表达抑制剂可以是对目标基因具有特异性抑制作用。“特异性抑制”通常是指所述抑制剂抑制目标基因,而不抑制或基本上不抑制其他基因。
43.如本领域技术人员所知,术语“rnai”是指rna干扰,即核酸分子介导的 抑制或下调细胞中的基因表达的生物过程。
44.如本领域技术人员所知,术语“shrna”是指由自身互补的rna单链形成的双链结构。含有与靶基因的编码序列或非编码序列的一部分相同的核苷酸序列的shrna构建体可用于抑制靶基因的表达。当shrna在细胞中表达时,其经过一系列步骤被加工成小干扰rna(sirna),用于引导基因沉默。shrna可具有约50-100bp的长度。shrna的双链形成部分的长度可以为至少20、21或22个核苷酸。
45.如本领域技术人员所知,术语“sirna
”ꢀ
是指诱导rna干扰(rnai)途径的小的抑制性rna双链体(通常介于17-30个碱基对之间,但也有较长的碱基对例如31-50 bp)。
46.如本领域技术人员所知,术语“反义rna
”ꢀ
是指与靶mrna的所有或部分互补的rna转录物,可通过干扰mrna 的加工,转运和/或翻译来阻断靶基因的表达。反义rna可与靶mrna的任何部分互补,包括5'非编码序列、3'非编码序列、内含子和编码序列。
47.如本领域技术人员所知,术语“mirna”是指是指单链rna分子(或其合成衍生物),其能够结合靶基因(mrna或dna)并对该基因的表达进行调控。
48.术语“载体”在本发明中通常是指表达载体,可用于表达目标基因。在优选的实施方案中,所述载体是非整合型的载体,即不会在整合到其所转染的细胞的基因组中。非整合型载体是本领域技术人员熟知的,例如但不限于质粒、非整合型的重组病毒载体(如非整合型的腺病毒载体或腺相关病毒载体等)。表达载体中通常包括待表达的目的基因和与该目的基因可操作相连的调节序列,例如启动子、增强子、转录后调控序列等。
49.本发明中,人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂可以在一个载体中表达,在两个载体中表达,或者分别在三个载体中表达。例如可以使用一个载体表达人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂中的任意两个(例如人转录因子oct4和p53基因表达抑制剂),用另一个载体表达另一个。再例如,可以用三个载体,每个载体表达人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂中的一个。
50.术语“转染”是指向细胞中,优选向真核细胞,例如向哺乳动物细胞中,如向pbmc细胞中引入核酸分子,如dna或rna分子。“转染”可以通过任何本领域技术人员所知的将dna
(例如质粒载体)转入细胞的方法进行,例如通过感受态细胞法、人工脂质体法、显微注射法、基因枪法或电穿孔法(在本发明中也被称为电转、电转化或电转染)等。
51.利用本发明所述的一个或多个载体转染外周血单个核细胞后,能够使得被转染的单个核细胞表达人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂,其中p53基因表达抑制剂和cohesin基因表达抑制剂在外周血单个核细胞中的表达使得该外周血单个核细胞中p53基因和cohesin基因的表达受到抑制。
52.外周血单个核细胞在进行转染之前,可以预先培养适当的时间,以使细胞活化,例如可以培养1-3天,优选2天。所述预先培养的条件是本领域技术人员熟知的,例如可以在35~39℃优选37℃、3~7% co2优选5%co2、0.5-2
×
106细胞/孔优选1
×
106细胞/孔的密度进行培养。所述预先培养可以使用任何适当的器皿,例如可以在超低吸附孔板中进行培养。所述预先培养可以使用任何适当的培养基,例如stempro
™ꢀ‑
34培养基培养。
53.用所述一个或多个载体转染外周血单个核细胞时,所述载体的使用量可以根据实际情况确定,例如可以为载体总量1-3μg载体/1.0
×
105个外周血单个核细胞,优选为载体总量2μg载体/1.0
×
105个外周血单个细胞。当使用超过一种载体时,各载体之间的比例可以根据实际情况确定,例如可以是等质量比例,即质量比为1:1。
54.转染完成后,被载体转染的外周血单个核细胞可以直接使用本发明的重编程诱导培养液进行培养,也可以先使用其他适当的培养基(例如stempro
™ꢀ‑
34培养基)一段时间,然后更换本发明的重编程诱导培养液。例如,在一些实施方案中,可以将转染后的外周血单个核细胞先使用其他适当的培养基培养1-3天,优选2天,然后更换本发明的重编程诱导培养液。培养的条件可以是本领域中通常对pbmc进行重编程培养时使用的条件,例如可以在35~39℃优选37℃、3~7% co2优选5%co2、3~7% o2优选5%o2的条件下进行,所述培养可以使用任何适当的器皿,例如可以在包被有层粘连蛋白的培养板上进行,例如在包被有1μg/cm2的lamnin521的培养板上进行。
55.在本发明的重编程诱导培养液中培养外周血单个核细胞的条件可以是本领域中通常对pbmc进行重编程培养时使用的条件,例如可以在35~39℃优选37℃、3~7% co2优选5%co2、3~7% o2优选5%o2的条件下进行。培养过程中,可以根据情况在适当的时间更换新鲜的重编程诱导培养液,例如可以每隔1-3天优选2天更换新鲜的重编程诱导培养液。
56.本领域技术人员知道如何判断诱导多能干细胞(ipsc)克隆的出现,例如可以根据人胚胎干细胞(es细胞)的独有特征进行形态学判断,例如出现形态扁平、均质且边界轮廓明显的细胞克隆,即是诱导多能干细胞克隆。
57.出现诱导多能干细胞克隆之后,为了促进其生长,可以在本发明的重编程诱导液中继续培养,培养条件是本领域技术人员熟知的,例如可以在35~39℃优选37℃、3~7% co2优选5%co2的条件下培养,例如在培养期间可以每隔1-2天优选1天更换干细胞培养基。
58.诱导多能干细胞克隆长大后,可以挑取单个克隆接种到培养板中进一步培养,并任选地进行传代培养,以纯化诱导多能干细胞并扩增其数量以进行后续操作(例如检测或进一步应用)。诱导多能干细胞的培养和传代培养的条件是本领域技术人员熟知的,例如可以挑取诱导多能干细胞克隆并接种到新的包被有基质胶的培养板中于35~39℃优选37℃、3~7% co2优选5%co2条件下继续传代培养,在培养期间可以每隔1-2天优选一天更换一次培养基,每隔3-5优选3天传代一次,其中的培养基可以采用本发明的重编程诱导培养液或其它
干细胞培养基。
实施例
59.下面通过实施例,并结合附图,对本发明的技术方案作进一步详细的说明,但本发明不限于下面的实施例。
60.实施例1 不同重编程方法出克隆情况实验组1-3采用重编程质粒电穿孔法转染(即电转)pbmc细胞,实验步骤包括:步骤1):取冻存的pbmc,37℃水浴快速化冻。用1ml移液枪轻柔吹打细胞1-2次后将细胞转移到15ml 离心管中。用1ml室温预热后的 stempro
™ꢀ‑
34基础培养基润洗冻存管1次,将润洗后的细胞悬液转到上述离心管中,再逐滴向离心管中添加9ml stempro
™ꢀ‑
34基础培养基;200g,3min 离心。弃上清,用stempro
™ꢀ‑
34完全培养基重悬细胞,计数并接种到超低吸附24孔板中。pbmc于37℃、5%co
2 培养箱中培养2天。
61.步骤2) :pbmc电转染,提前约1小时向包被6孔板的1个孔中加入2ml stempro
™ꢀ‑
34完全培养基,将培养板放入37℃培养箱中平衡。收集24孔板中pbmc,1ml stempro
™ꢀ‑
34基础培养基润洗,200g,3 min离心;弃上清,用dpbs重悬洗涤,计数。200g,3min离心;在离心过程中,向电转杯中加入5ml电转buffer e。设置电转参数为:1650v,10ms,3pulses;离心结束,吸去dpbs, 重悬细胞,按照两种质粒等比(质量比)且总量为2μg质粒/1.0
×
105血细胞,加入重编程质粒混匀,按电转参数完成电转,记为第0天;将电转完的细胞接种到1μg/cm2的lamnin521包被的含有stempro
™ꢀ‑
34培养基的6孔组织培养板上,于37℃、5%co2、5%o2条件下培养2天;步骤3) :电转后第2天,更换新鲜stempro
™ꢀ‑
34培养基;此后每隔2天更换重编程诱导培养基,并于37℃、5%co2、5%o2条件下进行培养,直至出现克隆;步骤4) :电转后第10-12天出现诱导多能干细胞克隆,更换重编程诱导培养基于37℃、5%co2条件下继续培养,培养期间每隔1天更换培养基,计算出现的诱导多能干细胞克隆数量;步骤5) :待重编程的多能干细胞克隆长大到适合挑取时,挑取诱导多能干细胞克隆并接种到新的包被有基质胶的培养板中于37℃、5%co2条件下继续传代培养,培养期间,每隔1天更换一次重编程诱导培养基,每隔3天传代一次。
62.实验组1-3中使用的重编程质粒和重编程诱导培养基如表1所示,其中质粒pcxle-hoct3/4-shp53来自addgene,#27077),质粒中所包含的hoct3/4的编码序列为:atggcgggacacctggcttcggatttcgccttctcgccccctccaggtggtggaggtgatgggccaggggggccggagccgggctgggttgatcctcggacctggctaagcttccaaggccctcctggagggccaggaatcgggccgggggttgggccaggctctgaggtgtgggggattcccccatgccccccgccgtatgagttctgtggggggatggcgtactgtgggccccaggttggagtggggctagtgccccaaggcggcttggagacctctcagcctgagggcgaagcaggagtcggggtggagagcaactccgatggggcctccccggagccctgcaccgtcacccctggtgccgtgaagctggagaaggagaagctggagcaaaacccggaggagtcccaggacatcaaagctctgcagaaagaactcgagcaatttgccaagctcctgaagcagaagaggatcaccctgggatatacacaggccgatgtggggctcaccctgggggttctatttgggaaggtattcagccaaacgaccatctgccgctttgaggctctgcagcttagcttcaagaacatgtgtaagctgcggcccttgctgcagaagtgggtggaggaagctgacaacaatgaaaatcttcaggagatatgcaaagcagaaaccc
tcgtgcaggcccgaaagagaaagcgaaccagtatcgagaaccgagtgagaggcaacctggagaatttgttcctgcagtgcccgaaacccacactgcagcagatcagccacatcgcccagcagcttgggctcgagaaggatgtggtccgagtgtggttctgtaaccggcgccagaagggcaagcgatcaagcagcgactatgcacaacgagaggattttgaggctgctgggtctcctttctcagggggaccagtgtcctttcctctggccccagggccccattttggtaccccaggctatgggagccctcacttcactgcactgtactcctcggtccctttccctgagggggaagcctttccccctgtctccgtcaccactctgggctctcccatgcattcaaactgatgatga(seq id no:1)。
63.该质粒中所包含的shp53的序列为:ccgggtccagatgaagctcccagaactcgagttctgggagcttcatctggacttttt(seq id no:2)。
64.质粒pcxle-sh cohesin为通过限制性核酸内切酶bamhi将cohesin shrna dna序列整合入pcxle(addgene, #37626)载体中得到,cohesin的mrna序列可参见genbank accession no. xm_011512331.2,所使用的cohesin shrna dna序列为: caccgccttcatgttgtttgcattccgaagaatgcaaacaacatgaaggc(seq id no:3)。
65.实验重编程诱导培养液的成分为:ix-psc基础培养基(包含dmem/f12、20μg/ml抗坏血酸、40ng/ml fgf2、1ng/ml tgfβ1、6ng/ml神经调节蛋白1、15ng/ml igf-1、2.5μg/ml超氧化物歧化酶、2.5μg/ml过氧化氢酶、5mg/ml人血清白蛋白、20μg/ml转铁蛋白和20μg/ml亚硒酸钠)、以及2μm chir99021、2μm vpa、50nm pd0325901、2.5μm thiazovivin以及500
×
微量元素b、500
×
微量元素c和2mm 4-羟乙基哌嗪乙磺酸。其中微量元素b为trace elements b,厂家corning,货号25-022;微量元素c为trace elements c,厂家corning,货号25-023。电转仪系统购自赛默飞世尔科技(中国)有限公司(mpk5000,mpk10096),电转条件为1650v、10ms。
66.实验组4的重编程方法为仙台病毒(gibco, a16517 , a16518)转染pbmc细胞,重编程诱导培养基采用市售诱导多能干细胞培养基mtesr
tm
1(厂家stemcell technologies inc.,货号85850),参见表1。
67.表1 不同重编程方法设计
实验组重编程方式重编程诱导培养基实验组1pcxle-hoct3/4-shp53和pcxle-shcohesin转染mtesr
tm
1实验组2pcxle-hoct3/4-shp53转染实验重编程诱导培养液实验组3pcxle-hoct3/4-shp53和pcxle-shcohesin转染实验重编程诱导培养液实验组4仙台病毒转染mtesr
tm1在重编程过程中,在当出现形态扁平、均质且边界轮廓明显的细胞克隆即为出现诱导多能干细胞克隆,通过统计各实验组出现诱导多能干细胞克隆(以下简称出克隆)的情况(即对出现的诱导多能干细胞克隆的计数),研究所选质粒和试剂对重编程效率的有效性。
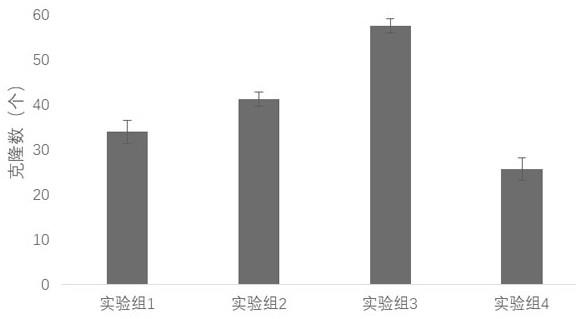
68.图2为不同实验组每1
×
106个pbmc重编程后出克隆的情况。由图2可知,实验组1-3得到的诱导多能干细胞均多于实验组4,而将实验组3与实验组1和2对比可知,实验组3得到的诱导多能干细胞最多,说明上述实验重编程诱导培养液和pcxle-sh cohesin对干细胞诱导发挥了关键作用。将实验组3与实验组4相比可知,实验组3比实验组4平均多了15个克隆。目前,血细胞重编程公认的方法为仙台病毒转染,并在mtesr
tm
1中进行诱导培养进一步得到
干细胞克隆,mtesr
tm
1为经典的诱导多能干细胞培养基,以上实验证明,联合pcxle-sh cohesin质粒和上述实验重编程诱导培养液能够获得更高的多能干细胞克隆产量。
69.实施例2 诱导多能干细胞向三胚层组织分化潜能鉴定对实施例1中实验组3经步骤1)-5)获得的诱导多能干细胞进行eb分化功能鉴定,具体步骤为:用kosr eb分化完全培养基诱导获得的细胞向eb分化,通过对eb进行免疫荧光染色,检测外胚层标志性蛋白β-tubulin iii,中胚层标志性蛋白sma,内胚层标志性蛋白afp。
70.图3为所获细胞系eb分化鉴定结果,说明由所述重编程方法获得的细胞系具有向三胚层各组织分化的潜能。
71.实施例3 诱导多能干细胞多能性免疫荧光鉴定将实施例1中实验组3经步骤1)-5)获得的诱导多能干细胞获得的克隆细胞在4孔板中用mtesr
tm
1完全培养基培养,在4倍镜及10倍镜下观察细胞密度及细胞生长状态,在20倍镜下观察细胞有无细菌及真菌污染,观察细胞密度,若细胞密度达到30%,则进行免多能性免疫荧光检测,检测干细胞特征性因子nanog,oct4,sox2和ssea4。
72.图4为所获细胞的多能性免疫荧光检测结果,结果显示,获得的细胞表达多能性基因nanog,oct4,sox2和ssea4,为多能性干细胞。
73.实施例4 诱导多能干细胞多能性流式鉴定用mtesr
tm
1完全培养基培养实施例1中实验组3经步骤1)-5)获得的诱导多能干细胞获得的细胞,待细胞长到90%左右,用accutase消化,将细胞悬液轻柔转移至15ml离心管中,混匀后进行细胞计数,确保每做1个marker 的流式有2
×
106个细胞。离心去上清后,向离心管中加入90%冷甲醇固定细胞,处理后在流式细胞仪上进行流式检测表面抗原nanog,oct4和ssea4。
74.图5为所获细胞系流式鉴定结果,结果表明该细胞中表达多能性基因nanog,oct4和ssea4的细胞纯度均达97%以上,说明所获的诱导多能干细胞纯度高。
75.实施例5 诱导多能干细胞核型鉴定具体步骤:用mtesr
tm
1完全培养基培养实施例1中实验组3经步骤1)-5)获得的诱导多能干细胞获得的诱导多能干细胞。细胞数量取6孔板一个孔的细胞即可,当细胞密度达到70%左右即可做核型分析,每孔加药0.2μg /ml秋水仙素,处理2小时,accutase消化后,kcl低渗30分钟,加固定液(冰甲醇:乙酸=3:1)处理后进行核型检测。
76.图6为所获细胞系的核型检测结果,结果显示,所获细胞系核型分析结果正常。
77.本发明可由取自患者血液中的外周血单个核细胞重编程人诱导多能性干细胞。本发明的诱导多能干细胞方法的优势在于:1)取材方便,外周血单个核细胞可取自患者血液,数量无限制且可避免道德争议;2)细胞重编程时采用人转录因子oct4、p53基因表达抑制剂和cohesin基因表达抑制剂,所需的因子少;3)所述的电转重编程诱导培养基添加了gsk-3抑制剂、乙酰化酶抑制剂、mek抑制剂、rock抑制剂以及4-羟乙基哌嗪乙磺酸,各组分协同发挥作用,在ips细胞重编程过程中在维持细胞生长增殖的同时,提高了细胞诱导重编程的效率;与现有技术相比,大大缩短了诱导的时间,仅需10-12天,可用于大规模工业化制备。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。