耐高糖乳酸生产菌株及其在d-乳酸生产中的应用
技术领域
1.本发明涉及微生物领域,具体涉及一种耐高糖乳酸生产菌株及其在d-乳酸生产中的应用。
背景技术:
2.聚乳酸是以光学纯乳酸(光学纯度大于99%)为原料生产的可生物降解的高分子聚合物。聚乳酸具有较好的可塑性,能够使用与通用的热塑性塑料一样的工艺进行加工,制成一次性餐具、包装材料、骨科内固定材料、免拆手术缝合线等产品,具有非常广阔的市场前景。聚乳酸还具有良好的生物可降解性,可以在海水中被微生物吸收,也能在堆肥或土壤条件下被完全降解成二氧化碳和水。随着人们环境保护意识的增强,聚乳酸作为一种新型的环境友好型高分子材料,逐步受到人们的重视。
3.光学纯l-乳酸是聚乳酸聚合的主要单体,但是纯l-乳酸制成的聚乳酸具有对热不稳定、性脆等弱点,向聚l-乳酸中添加光学纯d-乳酸可以增强聚乳酸的机械性能与热稳定性。此外,d-乳酸作为一个重要的手性中间体,已被用于多种手性物质的合成。如以d-乳酸为原料可以制备光学活性的r-2-氯丙酸,进而以r-2-氯丙酸为前体可以制备一大类旋光性除草剂。又如以高光学纯度d-乳酸(光学纯度大于99%)和甲醇酯化形成的d-乳酸甲酯可以用来合成r-1,2-丙二醇、r-2-羟基羧酸酯以及多取代脯氨酸等多种手性化合物,进而可以合成重要的医药中间体。微生物发酵法是d-乳酸生产的主要方法。微生物发酵法生产d-乳酸可以利用可再生资源作为碳源,实现绿色制造,可有效解决化石燃料带来的能源危机与坏境污染。在乳酸发酵过程中,生产菌株常常会受到各种因素胁迫,其中发酵初期高浓度底物的渗透作用是制约乳酸生产的瓶颈之一。此外,有机氮源占乳酸生产成本的38%,因此,降低有机氮源的添加量也可以大大降低生产成本。另外,目前大部分的d-乳酸发酵菌株均为常温菌,生产过程容易染菌,对设备和操作条件要求较高。因此,开发获得高糖耐受和可以利用低浓度有机氮源的耐高温d-乳酸生产菌株具有重要的现实意义。
4.凝结芽孢杆菌(bacillus coagulans)dsm1是光学纯l-乳酸生产菌株,本团队前期敲除了该菌l-乳酸脱氢酶,将来源于德氏乳杆菌的d-乳酸脱氢酶整合到菌株dsm1基因组中,构建得到光学纯d-乳酸生产菌株d-dsm1(zhang,et al.non-sterilized fermentation of high optically pure d-lactic acid by a genetically modified thermophilic bacillus coagulans strain.microb.cell fact.(2017)16:213)。该菌可以在50℃条件下利用葡萄糖生产d-乳酸,产量为145g/l,糖酸转化率达到0.98g/g,d-乳酸光学纯度达到99.9%。虽然该菌具有发酵温度高,糖酸转化率高、产物纯度高等优点,但是高浓度葡萄糖对该菌生长存在抑制现象,而且发酵过程中需要添加大量的酵母粉,增加了生产成本。
技术实现要素:
5.本发明的目的是提供一种耐高糖乳酸生产菌株及其在d-乳酸生产中的应用。
6.第一方面,本发明要求保护一种凝结芽孢杆菌(bacillus coagulans)g35。
7.本发明要求保护的凝结芽孢杆菌(bacillus coagulans)g35,其在中国普通微生物菌种保藏管理中心的保藏编号为cgmcc no.21293。
8.第二方面,本发明要求保护一种凝结芽孢杆菌(bacillus coagulans)g35-ljldh。
9.本发明要求保护的凝结芽孢杆菌(bacillus coagulans)g35-ljldh为将前文所述凝结芽孢杆菌(bacillus coagulans)g35自身的d-乳酸脱氢酶基因(d-ldh)替换为来源于詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)后得到的重组菌株。
10.进一步地,来源于所述詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)可通过同源重组的方式原位替换所述凝结芽孢杆菌(bacillus coagulans)g35自身的d-乳酸脱氢酶基因(d-ldh)。
11.更进一步地,进行所述同源重组时的上游同源臂可如seq id no.1所示(菌株g35的d-乳酸脱氢酶(d-ldh)基因上游834bp序列),下游同源臂可如seq id no.2所示(菌株g35的d-乳酸脱氢酶(d-ldh)基因下游833bp序列)。来源于所述詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)可如seq id no.3所示。
12.在本发明的具体实施方式中,所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh具体是按照包括如下步骤的方法制备得到的:将所述上游同源臂、来源于所述詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)和所述下游同源臂顺次连接后构建到pmh77质粒中,得到重组载体;然后将所述重组载体导入所述凝结芽孢杆菌(bacillus coagulans)g35,通过2次同源重组得到所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh。
13.第三方面,本发明要求保护一种用于生产d-乳酸的成套产品。
14.本发明要求保护的用于生产d-乳酸的成套产品含有:
15.(1)前文所述凝结芽孢杆菌(bacillus coagulans)g35或前文所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh;
16.(2)后文所述的发酵培养基。
17.第四方面,本发明要求保护如下任一应用:
18.p1、前文所述凝结芽孢杆菌(bacillus coagulans)g35或前文所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh或前文所述成套产品在生产d-乳酸中的应用;
19.p2、前文所述凝结芽孢杆菌(bacillus coagulans)g35或前文所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh在制备前文所述成套产品中的应用。
20.其中,所述生产d-乳酸为在如下1)和/或2)和/或3)的条件下生产d-乳酸:1)利用高糖;2)利用低氮;3)在高温下;所述高糖为180-200g/l葡萄糖;所述低氮为0.5~1g/l有机氮;所述高温为50-55℃。
21.进一步地,所述有机氮包括但不限于酵母粉、玉米浆干粉、豆粕粉等。
22.在本发明的具体实施方式中,所述有机氮具体为酵母粉。
23.第五方面,本发明要求保护一种生产d-乳酸的方法。
24.本发明要求保护的生产d-乳酸的方法,可包括如下步骤:将前文所述凝结芽孢杆菌(bacillus coagulans)g35或前文所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh接种在发酵培养基中进行培养,从发酵产物中得到d-乳酸。
25.其中,所述发酵培养基中含有180-200g/l葡萄糖;0.5~1g/l有机氮;进行所述培养的温度为50-55℃。
26.进一步地,所述有机氮包括但不限于酵母粉、玉米浆干粉、豆粕粉等。
27.在本发明的具体实施方式中,所述有机氮具体为酵母粉。
28.进一步地,所述发酵培养基的溶剂为水,溶质及浓度如下葡萄糖180-200g/l(如200g/l);酵母粉0.5~1g/l(如0.5g/l或1g/l);硫酸铵4g/l;氯化铵4g/l;磷酸氢二钾0.2g/l;磷酸二氢钾0.2g/l;硫酸锌,0.2g/l;碳酸钙100g/l。当采用发酵罐进行发酵培养时,由于发酵罐可以流加碱液,所以所述发酵培养基中可以不含有碳酸钙。
29.进一步地,进行所述培养的过程中,控制培养体系的ph恒定为6.5;和/或,培养时间为48h。
30.进一步地,进行所述培养的过程中,对培养体系进行搅拌,搅拌转速为120转/分,搅拌半径为38mm。
31.第六方面,本发明要求保护前文所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh的制备方法。
32.本发明要求保护的前文所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh的制备方法,可包括如下步骤:将前文所述凝结芽孢杆菌(bacillus coagulans)g35自身的d-乳酸脱氢酶基因(d-ldh)替换为来源于詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)。
33.进一步地,来源于所述詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)通过同源重组的方式原位替换所述凝结芽孢杆菌(bacillus coagulans)g35自身的d-乳酸脱氢酶基因(d-ldh)。
34.更进一步地,进行所述同源重组时的上游同源臂如seq id no.1所示(菌株g35的d-乳酸脱氢酶(ldh)基因上游834bp序列),下游同源臂如seq id no.2所示(菌株g35的d-乳酸脱氢酶(ldh)基因下游833bp序列)。来源于所述詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)如seq id no.3所示。
35.在本发明的具体实施方式中,所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh具体是按照包括如下步骤的方法制备得到的:将所述上游同源臂、来源于所述詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)和所述下游同源臂顺次连接后构建到pmh77质粒中(如插入酶切位点bamhi和hindiii之间),得到重组载体;然后将所述重组载体导入所述凝结芽孢杆菌(bacillus coagulans)g35,通过2次同源重组得到所述凝结芽孢杆菌(bacillus coagulans)g35-ljldh。
36.本发明以凝结芽孢杆菌(bacillus coagulans)d-dsm1为出发菌株,采用常压室温等离子体(artp)诱变技术,并结合适应性进化技术,筛选得到了可以耐受高浓度初糖(200克每升初糖),在低酵母粉(低于1克每升)培养基生产d-乳酸的菌株g35,其d-乳酸产量可达134克/升发酵液。并进一步用来源于詹氏乳杆菌的d-乳酸脱氢酶基因(ljldh)原位替换菌株g35自身的d-乳酸脱氢酶编码基因(d-ldh)(蔡昱萌等,来自詹氏乳杆菌的耐热d-乳酸脱氢酶的酶学性质研究,微生物学通报,2015,vol.03,460-466),最终获得可以在高初始葡萄糖和低酵母粉培养基生产光学纯d-乳酸的菌株g35-ljldh,其d-乳酸产量可达166克/升发酵液,且发酵液中l-乳酸浓度低于检测限。本发明所开发的获得的高糖耐受和可以利用低浓度有机氮源的耐高温d-乳酸生产菌株具有重要的现实意义。
37.保藏说明
38.菌株名称:凝结芽孢杆菌
39.拉丁名:bacillus coagulans
40.参椐的生物材料(株):g35
41.保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
42.保藏机构简称:cgmcc
43.地址:北京市朝阳区北辰西路1号院3号
44.保藏日期:2020年12月4日
45.保藏中心登记入册编号:cgmcc no.21293
附图说明
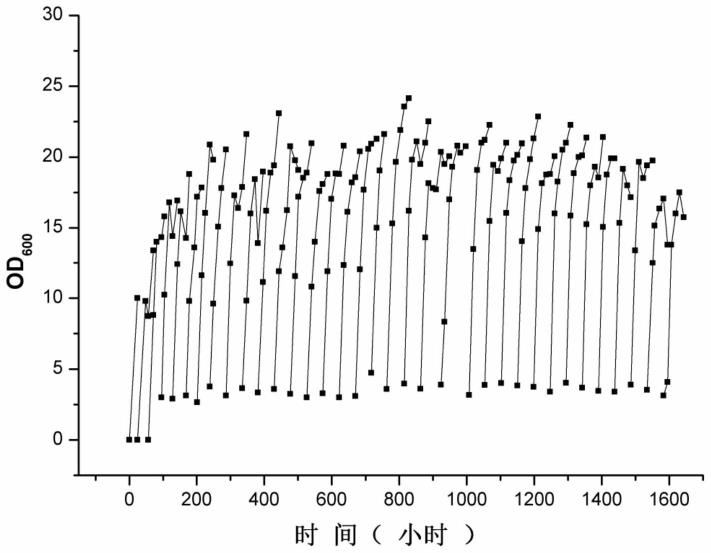
46.图1为高初始葡萄糖培养基适应性进化过程中菌体生物量(od
600
)的变化。
47.图2为高初始葡萄糖培养基适应性进化过程中葡萄糖浓度的变化。
48.图3为菌株g35发酵液液相色谱图。
49.图4为菌株g35-ljldh发酵液液相色谱图。
具体实施方式
50.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
51.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
52.凝结芽孢杆菌(bacillus coagulans)d-dsm1:记载于“zhang,et al.non-sterilized fermentation of high optically pure d-lactic acid by a genetically modified thermophilic bacillus coagulans strain.microb.cell fact.(2017)16:213”一文,公众可从申请人处获得,尽快用于重复本发明实验使用,不得他用。
53.实施例1、凝结芽孢杆菌(bacillus coagulans)g35和g35-ljldh的获得及发酵特性鉴定
54.本实施例以凝结芽孢杆菌(bacillus coagulans)d-dsm1为出发菌株,采用常压室温等离子体(artp)诱变技术,并结合适应性进化技术,筛选得到了可以耐受高浓度初糖(200克每升初糖),在低酵母(低于1克每升)培养基生产d-乳酸的菌株g35,其d-乳酸产量可达134克/升发酵液。具体如下:
55.1、artp诱变
56.1.1诱变流程
57.凝结芽孢杆菌(bacillus coagulans)d-dsm1用513液体培养基(包含葡萄糖50g/l、酵母粉10g/l和中和剂30g/l)活化12小时后,划线513固体培养基(含有葡萄糖50g/l、酵母粉10g/l,中和剂30g/l,琼脂17-20%(w/v))。用灭菌的0.9%(w/v)生理盐水制备菌悬液(od
600
=1),取10微升菌悬液均匀涂抹至照射金属片,进行artp诱变。用氦气作为工作气体,工作功率为140w,气体流量为10slpm,处理时间为0s,25s,50s,75s,100s,125s和150s。诱变结束,用无菌生理盐水梯度稀释,涂布于513固体培养基(配方见前文)中。将平板倒置于50
~55℃培养箱培养过夜,将单菌落转接到含有200克每升初始葡萄糖和含有1克每升酵母粉的固体筛选培养基中,筛选溶解圈大的菌株。接种于含有200克每升初始葡萄糖和含有1克每升酵母粉的液体培养基复筛,筛选出在高初始葡萄糖和低酵母粉培养基中d-乳酸生成量有所提升的菌株。
58.1.2葡萄糖的测定方法:
59.采用sba-40c分析仪。样品离心后收集上清,经适当稀释后由进样针吸取25μl,并注入反应池,底物透过酶膜圈与固定化酶层接触并反应,并产生电流信号,该电流信号与底物的浓度成线性比例关系,经微机控制的信号,可直接显示并打印结果。
60.1.3l-乳酸和d-乳酸测定方法
61.采用agilent 1260液相色谱仪,配备手性分离柱(日本三菱化学公司,mci gel-crs10w,4.6mm id
×
50mm)。具体操作条件为:2mm的硫酸铜作为流动相,流量0.5ml/min,进样量5μl,紫外检测器,检测波长254nm,操作温度25℃。分别利用l-乳酸和d-乳酸标准品做出标准曲线,再根据标准曲线计算出发酵液(发酵体系)中l-乳酸和d-乳酸的含量。
62.1.4结果
63.存活率测定与计算方法:取1毫升诱变的菌悬液,用0.9%生理盐水梯度稀释(稀释倍数为1
×
102,1
×
103,1
×
104),将不同稀释度的菌悬液涂布513固体培养基(配方见前文),50~55℃培养24小时后菌落计数。测定三次,取平均值。
64.存活率(%)=(各处理组的菌株/对照试验平均菌落数)
×
100
65.结果如表1所示。
66.表1、artp诱变结果
67.照射时间(s)0255075100125存活率(%)1002010510
68.挑选平板中菌落生长较快,并且溶钙圈较大的单菌落,接种于含有200克每升初始葡萄糖和含有1克每升酵母粉的液体培养基(配方:含有葡萄糖180-200g/l,酵母粉1g/l,硫酸铵3g/l,氯化铵3g/l,磷酸氢二钾0.2g/l,磷酸二氢钾0.2g/l,硫酸锌0.2g/l,碳酸钙60g/l)复筛。用生物传感器检测葡萄糖消耗速度较快,并且没有l-乳酸生成的菌株。筛选得到在高初始葡萄糖和在低酵母粉培养基中葡萄糖消耗较快的菌株g1。经过第二轮artp诱变处理,获得在高初始葡萄糖培养基葡萄糖和在低酵母粉培养基中葡萄糖消耗较快的菌株g2。
69.2、高初始葡萄糖和低酵母粉培养基生长菌株适应性进化
70.将artp诱变获得的菌株g2进行适应性进化实验。适应性进化使用的活化培养基成分(克每升):葡萄糖,50;酵母粉,10;碳酸钙,30。筛选培养基成分为(克每升):葡萄糖,200;酵母粉,1;硫酸铵,3;氯化铵,3;磷酸氢二钾,0.2;磷酸二氢钾,0.2;硫酸锌,0.2。氢氧化钙作为中和剂,ph值为6.5。温度为50℃。第一代:取12小时活化的g2菌种种子液,按照10%(v/v)接种量,接种到高初始葡萄糖的筛选培养基中,50℃培养48小时,测定发酵液中残留葡萄糖含量。第二代:将第一代适应性进化得到的菌液,按照10%(v/v)接种量,接种到高初始葡萄糖的筛选培养基中,50℃培养48小时,测定发酵液中残留葡萄糖含量。按照上述方法,逐级活化菌株。直到筛选获得耗糖快的菌株。发酵验证其在高初始葡萄糖培养基中发酵生产d-乳酸的能力。
71.结果:在高初始葡萄糖培养基中,菌株连续转接了35代,随着传代次数的增加,菌
株生物量逐渐增大(图1)。从第8代开始,菌株的生物量(od
600
)稳定在20左右,随着传代次数的增加,菌体生物量由轻微波动。在葡萄糖消耗方面,从第1代到第5代,菌株在初始葡萄糖浓度为200克每升的培养基中,葡萄糖消耗速度比较慢,培养40小时发酵液中残留的葡萄糖达到153克每升。随着传代次数的增加,菌株耗糖速度逐渐加快,当菌株传到第35代后,发酵液中残留葡萄糖为34克每升(图2)。将耗糖快的菌株命名为g35。
72.菌株g35已经于2020年12月4日保藏于中国微生物菌种保藏管理委员会普通微生物中心,菌株名称为凝结芽孢杆菌(bacillus coagulans),参椐的生物材料(株)为g35,保藏编号为cgmcc no.21293。
73.将菌株g35在无菌条件下接种于装有50毫升513液体培养基(配方见前文)的三角瓶中,50℃,120rpm培养12小时,制得种子培养液。在装有50毫升高初始葡萄糖液体培养基(培养基成分为(克每升):葡萄糖,200;酵母粉,1;硫酸铵,4;氯化铵,4;磷酸氢二钾,0.2;磷酸二氢钾,0.2;硫酸锌,0.2;碳酸钙,100)的三角瓶中接入5毫升种子培养液,放置于50℃,120rpm培养48小时。筛选获得菌株g35可以在高初始葡萄糖条件下利用葡萄糖生成d-乳酸,产量为134克每升,l-乳酸低于检测限(图3)。
74.3、重组菌株g35-ljldh构建与发酵验证
75.3.1将詹氏乳杆菌d-乳酸脱氢酶基因(ljldh)整合到菌株g35基因组
76.以詹氏乳杆菌(lactobacillus jensenii)269-3(蔡昱萌等,来自詹氏乳杆菌的耐热d-乳酸脱氢酶的酶学性质研究.微生物学通报,2015,vol.03,460-466),基因组为模板,采用引物ljldh-f和ljldh-r扩增詹氏乳杆菌d-乳酸脱氢酶基因(ljldh)(genbank:eeq23913.1)。当然,也可以直接通过人工合成的方式获得ljldh基因(即seq id no.3)。
77.ljldh-f:5
’‑
gaatggaaaggaagctgtcgt-atgacaaagatttttgcttatgc-3’;
78.ljldh-r:5
’‑
caattataaaaaatctgcttatgttct-ttaacctaacttaactggag-3’。
79.以凝结芽孢杆菌(bacillus coagulans)d-dsm1基因组为模板,采用引物up-f和up-r扩增菌株g35自身d-乳酸脱氢酶(d-ldh)基因上游834bp序列(即上游同源臂,seq id no.1)。
80.up-f:5
’‑
cttagtgactcggatcctctagacacgttgagcgttggtttaatg-3’;
81.up-r:5
’‑
gcataagcaaaaatctttgtcat-acgacagcttcctttccattc-3’。
82.以凝结芽孢杆菌(bacillus coagulans)d-dsm1基因组为模板,采用引物down-f和down-r扩增菌株g35自身d-乳酸脱氢酶(d-ldh)基因下游833bp序列(即下游同源臂,seq id no.1)。
83.down-f:5
’‑
gttaagttaggttaa-agaacataagcagattttttataattgtgag-3’;
84.down-r:5
’‑
catgattacgccaagcttctcgtcattctccacagcactaaaaaag-3’。
85.利用gibson方法将三段序列连接在一起,插入到质粒pmh77(zhang,et al.non-sterilized fermentation of high optically pure d-lactic acid by a genetically modified thermophilic bacillus coagulans strain.microb.cell fact.(2017)16:213)的酶切位点(bamhi,hindiii),构建质粒pmh77-ldhup-ljldh-ldhdown,并经测序验证正确。
86.将质粒pmh77-ldhup-ljldh-ldhdown转入菌株g35。
87.第一次同源重组:45℃液体培养含敲除质粒(pmh77-ldhup-ljldh-ldhdown)的菌
株12小时,转接至新的含氯霉素(7微克每毫升)的bc液体培养基(配方:蔗糖50g,酵母提取物10g,磷酸氢二铵2g,硫酸胺3.5g,bis-tris 10g,琼脂15g(固体培养基),ph调节至6.6~6.7,蒸馏水定容至1000ml,115℃高压灭菌10min。固体培养基灭菌后加1g氯化镁。培养基使用前过滤添加氯化钙0.003g,氯化镁0.005g,六水合氯化钴0.2
×
10-3
g,二水合氯化铜0.01
×
10-3
g,硼酸0.3
×
10-3
g,二水合钼酸钠0.03
×
10-3
g,六水合硫酸镍0.02
×
10-3
g,四水合氯化锰0.03
×
10-3
g,氯化锌0.05
×
10-3
g),并在60℃继续培养12小时,然后离心收集菌体并涂布在含氯霉素(7微克每毫升)的bc固体培养基上,60℃培养1-2天,至有单菌落长出。用g35自身d-乳酸脱氢酶(d-ldh)基因中间700bp处引物(正向引物:gagacgagggcggatgaattccccttatttc;反向引物:gagcgcatccgtatccacttcagcaccat)和詹氏乳杆菌d-乳酸脱氢酶基因(ljldh)引物(正向引物:gaatggaaaggaagctgtcgtatgacaaagatttttgcttatgc;反向引物:caattataaaaaatctgcttatgttctttaacctaacttaactggag)pcr验证第一次同源重组的发生。阳性克隆会得到两条亮度相同的条带,分别为1000bp和700bp。
88.第二次同源重组:将已验证发生第一次同源重组的菌株(阳性)在45℃液体培养3-4代,然后稀释适当的倍数(105、106、107),涂布在无抗bc固体培养基上,45℃培养1-2天,有单菌落长出后对点到有氯霉素和无抗的bc固体培养基上。挑选不能在对应的氯霉素抗性培养基上生长的菌,为成功替换ljldh基因的重组菌,标记为g35-ljldh。
89.3.2菌株g35-ljldh在高初始葡萄糖培养基生产d-乳酸
90.(1)种子培养:将菌株g35-ljldh,在无菌条件下接种513液体培养基(含有葡萄糖50g/l,酵母粉10g/l,碳酸钙30g/l),50℃,120rpm培养12小时,制得种子培养液;
91.(2)发酵培养:上海保兴biotech 5升发酵罐中加入配制为2.0l但定溶到1.8升的发酵培养基,在发酵培养基中接入200ml种子培养液,使用25%(v/v)氢氧化钙溶液控制整个发酵过程中的ph值恒定为6.5。发酵培养基成分为(克每升):葡萄糖,200;酵母粉,0.5;硫酸铵,4;氯化铵,4;磷酸氢二钾,0.2;磷酸二氢钾,0.2;硫酸锌,0.2。50~55℃培养48小时,搅拌转速120转/分,搅拌半径38mm。
92.发酵结束时,取发酵液,10,000转/分钟离心5分钟,取上清液,按照上述检测方法,检测发酵液中葡萄糖、d-乳酸和l-乳酸浓度。实验重复三次,结果取平均值。
93.光学纯度(optical purity)的计算:是衡量旋光性样品中一个对映体超过另一个对映体的量的量度。本发明中d-乳酸的光学纯度按以下公式计算:d-乳酸含量
÷
(l-乳酸含量 d-乳酸含量)
×
100%。
94.糖酸转化率定义为:l-乳酸产量(克/升)
÷
总葡萄糖的消耗量(克/升)
×
100%。
95.结果:菌株g35-ljldh在高初始葡萄糖条件下可以利用葡萄糖生成d-乳酸,产量为166克每升,l-乳酸低于检测限(表2,图4)。
96.表2、利用葡萄糖发酵d-乳酸3次重复实验的结果
97.重复d-乳酸产量(g/l)糖酸转化率(%)d-乳酸光学纯度(%)1158.090.21002165.089.81003174.092.9100平均值
±
标准差165.7
±
8.091.0
±
1.7100
98.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和
范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。