1.本发明涉及一种具有多通道信号输出半花菁分子光学探针及其合成方法和用途。
背景技术:
2.近年来,对于环境以及生理生化重要分析物的识别和检测已成为化学和生物学领域的重要研究课题。将光学测量与合适的分子光学探针相结合的分析方法,因为具有便捷、成本低、对分析物高度敏感、选择性好,没有破坏性,而且在体内代谢快,不易造成生物体内毒性的优势,而被广泛采用。
3.随着科研工作者的艰辛探索,光学检测方法发展日新月异,出现了许多各具特色的新型检测方法,包括:近红外区域具有吸收和发射的光学探针,上转换发光分子探针,光声分子探针以及比率荧光探针。上述光学检测方法具有各自优势,但不可否认,也有自己的弱点与不足。比率荧光探针激发、发射多位于紫外-可见光区,易受到组织吸收、自发荧光的干扰,且组织穿透能力弱,无法满足在生物体内及其他一些复杂条件下的检测要求。而近红外区域具有吸收和发射的光学探针、光声分子探针及上转换发光分子探针又易受环境和仪器波动引起的干扰,导致准确度不足。因此,开发一种具有多种光学输出信号的探针,集多种模式的优势于一身,同时实现不同通道信号之间的校准、验证,以保证检测的准确性显得迫在眉睫,据发明人所知,这样的“自校准分子光学探针”鲜有报道。
技术实现要素:
4.本发明的目的在于提供一种具有多通道信号输出半花菁分子光学探针。
5.本发明的目的是通过以下技术方案实现的:
6.结构如式i所示的具有多通道信号输出半花菁分子光学探针(记为s-nhr):
[0007][0008]
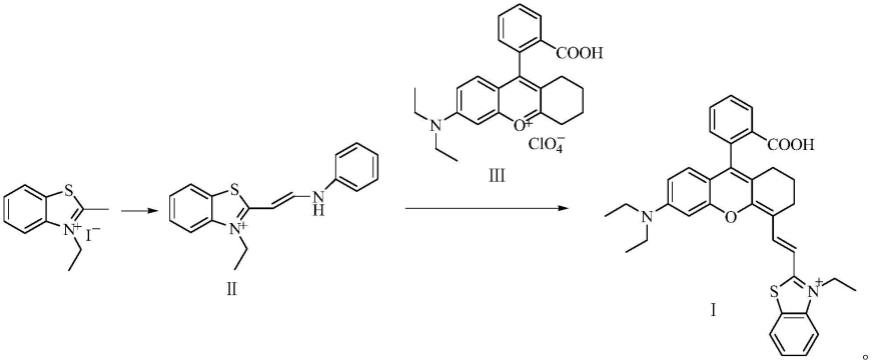
本发明的另一个目的是提供一种所述的半花菁分子光学探针的合成方法,反应路线如下:
[0009][0010]
包括:
[0011]
步骤(1)、以无水乙醇为反应溶剂,3-乙基-2-甲基碘化苯并噻唑鎓、原甲酸三乙酯和n,n'-二苯基甲脒,加热反应,反应液冷却至室温,倒入适量冰中,待冰融化后,减压抽滤,固体用冰冷的乙醚洗涤,得到化合物ii;
[0012]
步骤(2)、以乙酸酐为反应溶剂,在氩气或氮气保护下,以醋酸钾为催化剂,催化化合物ii与6-(n,n-二乙氨基)-9-(2-羧苯基)-1,2,3,4四氢呫吨鎓高氯酸盐(式iii)反应,得到半花菁分子光学探针。
[0013]
步骤(1)中,所述的3-乙基-2-甲基碘化苯并噻唑鎓、原甲酸三乙酯和n,n'-二苯基甲脒的摩尔比为1:1:1。
[0014]
所述的3-乙基-2-甲基碘化苯并噻唑鎓与无水乙醇的用量比为1mol:350ml~1mol:1000ml。
[0015]
所述的加热反应的温度为50℃~130℃。
[0016]
无水乙醇与冰的用量比为3ml:35g。
[0017]
步骤(2)中,化合物ii与6-(n,n-二乙氨基)-9-(2-羧苯基)-1,2,3,4四氢呫吨鎓高氯酸盐的摩尔比为1:1。
[0018]
所述的醋酸钾与6-(n,n-二乙氨基)-9-(2-羧苯基)-1,2,3,4四氢呫吨鎓高氯酸盐的摩尔比为1:1。
[0019]
所述的6-(n,n-二乙氨基)-9-(2-羧苯基)-1,2,3,4四氢呫吨鎓高氯酸盐与乙酸酐的用量比为1mol:5000ml
[0020]
所述的反应的温度为50℃~130℃。
[0021]
反应结束后,加水终止反应,减压抽滤,得到粗产物,粗产物干燥,采用硅胶柱层析,以二氯甲烷和甲醇体积比为200:1~10:1的混合溶剂为洗脱剂,分离得到半花菁分子光学探针。
[0022]
所述的硅胶柱层析的填充剂为300~400目硅胶。
[0023]
发明人测定半花菁分子光学探针的s-nhr光学性质,并与已有的分子光学探针nhr的相关性质进行比较:s-nhr在dmf/水=1:9的溶液中,近红外区域具有最大吸收,近红外激发时会有近红外区域的发射,近红外激发时会有近红外区域的频率上转换发射,以及在短波长激发时有双发射峰,说明通过本发明半花菁分子光学探针与检测物的相互作用,可以实现多通道光学信号(光声信号、比率荧光信号、近红外激发和发射的下转换荧光信号或近
红外激发和发射的频率上转换发光信号)的变化,有望被开发成为自校准光学探针;s-nhr尺寸小,易被生物样品吞噬且具有大的组织穿透深度和生物体内快速排泄能力,且与nhr相比,s-nhr在各种溶剂中的最大吸收以及最大发射波长均显著红移,使得其在体内成像及传感时的组织穿透深度大幅度提升,增加了其应用于体内成像的可能性。
[0024]
本发明的另一个目的是提供所述的半花菁分子光学探针在制备体内成像试剂的用途。半花菁分子光学探针有望通过近红外区域光声信号、比率荧光信号、近红外激发和发射的下转换荧光信号或近红外激发和发射的频率上转换发光信号的变化,通过光声成像,荧光成像及频率上转化发光成像监测生物体内生理生化指标,例如ph、温度、粘度等可能的变化,疾病标志物,例如血清白蛋白、aβ蛋白,h2s、亚硫酸氢根等可能的变化。
[0025]
优选的,所述的用途为所述的半花菁分子光学探针在制备光声成像,荧光成像或频率上转化发光成像试剂的用途。
[0026]
本发明的另一个目的是提供所述的半花菁分子光学探针在制备用于监测生物体内生理生化指标、疾病标志物的试剂盒的用途。
[0027]
所述的生理生化指标为ph、温度、粘度;所述的疾病标志物为血清白蛋白、aβ蛋白,h2s、亚硫酸氢根等。
[0028]
本发明的有益效果:
[0029]
本发明多通道信号输出半花菁分子光学探针具有优良的光学性质,包括:近红外区域具有最大吸收,近红外激发时会有近红外区域的发射,近红外激发时会有近红外区域的频率上转换发射,以及在短波长激发时有双发射峰。通过半花菁分子光学探针与检测物的相互作用,可以实现多通道光学信号的变化,使其有望被开发成为自校准光学探针,可兼具各种通道的优势,准确、灵敏、选择性好、有效避免环境及仪器变化的波动,可实现复杂基质情况下的检测。
[0030]
与已有类似分子相比,本发明多通道信号输出半花菁分子光学探针的最大吸收波长、发射波长均显著红移,使得其在体内成像及传感时的组织穿透深度大幅度提升,增加了其应用于体内成像的可能性。
附图说明
[0031]
图1为分子光学探针nhr(10.0μm)在dmf/水=1:9混合溶剂中的紫外-可见吸收谱图。
[0032]
图2为分子光学探针nhr(10.0μm)在dmf/水=1:9混合溶剂中的荧光谱图(λ
ex
=478nm)。
[0033]
图3为分子光学探针nhr(10.0μm)在dmf/水=1:9混合溶剂中的荧光谱图(λ
ex
=711nm)。
[0034]
图4为分子光学探针nhr(10.0μm)在dmf/水=1:9混合溶剂中的频率上转换发光谱图(λ
ex
=808nm)。
[0035]
图5为分子光学探针s-nhr(50.0μm)在dmf/水=1:9混合溶剂中的紫外-可见吸收谱图。
[0036]
图6为分子光学探针s-nhr(30.0μm)在dmf/水=1:9混合溶剂中的荧光谱图(λ
ex
=465nm)。
[0037]
图7为分子光学探针s-nhr(30.0μm)在dmf/水=1:9混合溶剂中的荧光谱图(λ
ex
=718nm)。
[0038]
图8为分子光学探针s-nhr(30.0μm)在dmf/水=1:9混合溶剂中的频率上转换发光谱图(λ
ex
=808nm)。
具体实施方式
[0039]
下面通过具体实施方式对本发明的技术方案进行详细说明。
[0040]
除非特别说明,本发明使用的原材料和设备为本领域常规使用的原材料和设备。
[0041]
实施例1
[0042]
分子光学探针s-nhr(式i)的合成
[0043]
s1.化合物1(式ii)的合成:以无水乙醇(3ml)为反应溶剂,将n,n
′‑
二苯基甲脒(5mmol)、原甲酸三乙酯(5mmol)和3-乙基-2-甲基碘化苯并噻唑鎓(5mmol)在搅拌下、90℃加热回流2小时;反应液冷却至室温,然后倒入25g冰中,待冰融化后,减压过滤,得到黄色固体,固体用冰冷乙醚洗涤3次,真空干燥,得到化合物1,esi-ms:计算得c
17h17
n2s
281.1107[m]
;得281.1104[m]
.
[0044]
s2.化合物2(式iii)的合成:将新鲜蒸馏的环己酮(63.7mmol)滴加到浓硫酸(70ml)中,待得到的溶液冷却到0℃,在剧烈搅拌下分次加入2-(4-二乙基氨基-2-羟基苯甲酰)苯甲酸(32mmol);将混合物加热至90℃并保温1.5h,冷却至室温;将反应液倒入300g冰中,将70%的高氯酸(7ml)加入到得到的溶液中,减压过滤分离产物,用冷水(100ml)冲洗,得到化合物2,即6-(n,n-二乙氨基)-9-(2-羧苯基)-1,2,3,4四氢呫吨鎓高氯酸盐。
[0045]
s3.分子光学探针s-nhr(式i)的合成:将化合物1(3mmol)、化合物2(3mmol)和醋酸钾(3mmol)加入到烧瓶中,溶解在15ml乙酸酐中,然后在氩气保护下,50℃搅拌0.5h;将100ml水倒入烧瓶中来结束反应,减压抽滤,得到粗产物,粗产物干燥,采用硅胶柱层析(300~400目硅胶),以二氯甲烷:甲醇(200:1~10:1v/v)为洗脱剂,得到分子光学探针s-nhr,绿色固体粉末。
[0046]
esi-ms:计算得c
35h35
n2o3s
563.2363[m]
;得563.2366[m]
.1h nmr(500mhz,meod)δ8.56(d,j=9.4hz,1h),8.26(d,j=7.8hz,1h),8.00(d,j=7.7hz,1h),7.80(t,j=8.5hz,2h),7.69(t,j=7.7hz,2h),7.55(t,j=7.6hz,1h),7.31(d,j=7.1hz,1h),6.88(s,1h),6.71(q,j=9.0hz,2h),4.59(q,j=7.0hz,2h),3.60
–
3.56(m,4h),2.71(t,j=6.0hz,2h),2.37
–
2.30(m,2h),1.88
–
1.81(m,3h).
13
c nmr(126mhz,meod)δ162.81,156.92,152.87,143.36,142.77,134.13,132.42,131.06,130.35,129.85,128.94,127.82,127.34,126.05,125.33,124.24,121.74,114.89,114.45,114.33,112.27,97.34,58.48,45.95,43.39,32.28,30.94,30.85,28.06,25.99,23.83,21.86,13.19,13.06.
[0047]
实施例2
[0048]
测定半花菁分子光学探针s-nhr的光学性质,并与分子光学探针nhr的相关性质进行比较。
[0049]
分子光学探针nhr的合成:采用等摩尔1-乙基-2,3,3-三甲基-3h-溴化吲哚替换3-乙基-2-甲基碘化苯并噻唑鎓,其余均与实施例1半花菁分子光学探针s-nhr的合成方法相同,具体参见申请人于2022年1月21日的中国发明专利申请(申请号:2022100691682)实施
例1。半花菁分子光学探针nhr结构如式ⅳ所示:
[0050][0051]
取分子光学探针nhr、s-nhr溶于dmf中,涡旋混匀,制成一定浓度储备液;取储备液适量,加入一定量纯化水中,配制成一定浓度nhr或s-nhr测试液(溶剂为dmf/水=1:9v/v);测定上述测试液的紫外-可见吸收谱图,短波长激发荧光光谱,近红外激发荧光光谱,近红外激发频率上转换发光光谱。
[0052]
分子光学探针nhr在dmf:水=1:9v/v混合溶液中的光学性质
[0053]
具体为:取分子光学探针nhr溶于dmf中,涡旋混匀,配制成100.0μm储备液。从储备液中取出200μl加入到5ml离心管当中,加入1800μl纯化水,涡旋混匀,配制成10.0μm的nhr测试液。
[0054]
在dmf/水(1:9,v/v)中测定探针nhr(10.0μm)的吸收性质,紫外-可见吸收谱图如图1,nhr在711nm处具有显著吸收峰,同时在478nm处也有明显吸收;但是,在808nm处没有吸收。
[0055]
在dmf/水(1:9,v/v)中,以478nm为激发光测定探针nhr(10.0μm)的荧光发射性质,如图2所示,nhr在596nm和756nm具有双发射峰。
[0056]
在dmf/水(1:9,v/v)中,以711nm为激发光测定探针nhr(10.0μm)的荧光发射性质,如图3所示,nhr在752nm具有发射峰。
[0057]
在dmf/水(1:9,v/v)中,以808nm激光器激发测定探针nhr(10.0μm)的频率上转换发射性质,如图4所示,nhr在759nm具有发射峰。
[0058]
分子光学探针s-nhr在dmf/水=1:9v/v混合溶液中的光学性质
[0059]
具体为:取实施例1制备的分子光学探针s-nhr溶于dmf中,涡旋混匀,配制成500.0μm储备液。从储备液中取出200μl加入到5ml离心管当中,加入1800μl纯化水,涡旋混匀,配制成50.0μm的s-nhr测试液。
[0060]
在dmf/水(1:9,v/v)中测定探针s-nhr(50.0μm)的吸收性质,紫外-可见吸收谱图如图5,s-nhr在718nm处具有显著吸收峰,同时在465nm处也有明显吸收;但是,在808nm处没有吸收。
[0061]
取实施例1制备的分子光学探针s-nhr溶于dmf中,涡旋混匀,配制成300.0μm储备液。从储备液中取出200μl加入到5ml离心管当中,加入1800μl纯化水,涡旋混匀,配制成30.0μm的s-nhr测试液。
[0062]
在dmf/水(1:9,v/v)中,以465nm为激发光测定探针s-nhr(30.0μm)的荧光发射性
质,如图6所示,s-nhr在590nm与760nm具有双发射峰。
[0063]
在dmf/水(1:9,v/v)中,以718nm为激发光测定探针s-nhr(30.0μm)的荧光发射性质,如图7所示,s-nhr在758nm具有发射峰。
[0064]
在dmf/水(1:9,v/v)中,以808nm激光器激发测定探针s-nhr(30.0μm)的频率上转换发射性质,如图8所示,s-nhr在764nm具有发射峰。
[0065]
分子光学探针nhr的溶致变色效应
[0066]
取分子光学探针nhr,分别溶于甲醇、乙醇、乙腈、正己烷、三氯甲烷、dmso、dmf、1-甲基-2-吡咯烷酮、丙酮、乙酸乙酯和四氢呋喃中,制成10.0μm储备液。分别测定样品的最大吸收波长、在808nm激光器激发下的最大发射波长、在650nm激发下的最大发射波长、在450nm激发下双发射峰的最大发射波长及双发射峰荧光强度的比值(i2/i1)。
[0067]
结果如表1所示。
[0068]
表1.nhr在不同溶剂中的光物理学参数
[0069][0070]
注:a探针的最大吸收波长;b探针的最大发射波长。
[0071]
分子光学探针s-nhr的溶致变色效应
[0072]
取分子光学探针s-nhr,分别溶于甲醇、乙醇、乙腈、正己烷、三氯甲烷、dmso、dmf、1-甲基-2-吡咯烷酮、丙酮、乙酸乙酯和四氢呋喃中,制成10.0μm储备液。分别测定样品的最大吸收波长、在808nm激光器激发下的最大发射波长、在650nm激发下的最大发射波长、在450nm激发下双发射峰的最大发射波长及双发射峰荧光强度的比值(i2/i1)。
[0073]
结果如表2所示。
[0074]
对比nhr与s-nhr的相关光学数据,发现:与nhr相比,s-nhr在各种溶剂中,最大吸收波长及最大发射波长上均有显著红移,使得其在体内成像及传感时的组织穿透深度会有大幅度提升,增加了其应用于体内成像的可能性。
[0075]
表2.s-nhr在不同溶剂中的光物理学参数
[0076][0077]
注:a探针的最大吸收波长;b探针的最大发射波长。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。