1.本发明涉及动物细胞成分提取和定量技术领域,具体涉及一种中性粒细胞胞外诱捕网提取和定量的方法。
背景技术:
2.中性粒细胞是人体中含量最为丰富的免疫细胞,在感染性疾病、肿瘤和自身免疫性疾病中发挥了重要作用。近年来研究发现,中性粒细胞除了具有经典的趋化、吞噬、脱颗粒以及呼吸爆发功能外,中性粒细胞还可以生成中性粒细胞胞外诱捕网(neutrophil extracellular traps,nets)。nets是指中性粒细胞收到特定刺激后染色质膨胀,dna从胞内释放至胞外所形成的网状结构,该网状结构中还包含了组蛋白、髓过氧化物酶和中性粒细胞弹性蛋白酶等颗粒蛋白。nets可能参与了一系列的生理和病理学过程调控,其在感染、自身免疫性疾病、肿瘤及血栓形成等方面可能存在重要作用,对其进行研究可能发现新的致病机制,寻找到新的治疗途径。因此,开发一种能稳定提取nets的方法对于临床研究具有重要意义。
3.传统的nets提取方法是使用刺激物诱导中性粒细胞生成nets,而后直接将细胞培养液作为nets进行后续研究,但是该方法存在以下缺点:1、约有30%
‑
50%中性粒细胞不能形成nets,导致nets中混有较多的中性粒细胞;2、中性粒细胞刺激后颗粒蛋白释放至培养液中,难以区分溶解颗粒蛋白还是nets中固定的颗粒蛋白发挥的作用;3、无法去除刺激物;4、nets难以定量。
4.例如中国专利cn109112103a公开了一种中性粒细胞胞外诱捕网的诱导物及其快速诱导方法,其采用包含igg2、igg4、apd、pma、脂多糖的诱导物诱导中性粒细胞,从而生成nets,但由于nets中混有较多的中性粒细胞,导致nets纯度较低,因此需要重复采用pbs洗涤白细胞,留取沉淀以达到提纯目的,操作繁琐。
5.因此,目前尚缺少简便、稳定的nets提取方法以及定量方法。
技术实现要素:
6.针对现有技术存在的不足,本发明要解决的技术问题是提供一种中性粒细胞胞外诱捕网提取和定量的方法,以达到快速简便提取nets并对其进行定量的目的。
7.为解决上述技术问题,本发明提供以下技术方案:
8.一种中性粒细胞胞外诱捕网提取和定量的方法,包括以下步骤:
9.s1.中性粒细胞的提取:取受试动物骨髓组织碾碎,用pbs冲洗后于600
‑
800
×
g离心5
‑
7min,1
‑
2ml pbs重悬骨髓细胞,得细胞悬液;向离心管中依次缓慢加入2
‑
4ml 78%percoll、2
‑
4ml 69%percoll、2
‑
4ml 52%percoll和细胞悬液,于1500
‑
1700
×
g室温下梯度密度离心30
‑
35min;取出78%percoll和69%percoll中间的细胞层,加入pbs冲洗,于600
‑
800
×
g室温离心5
‑
7min后去除上清液;用3
‑
5ml红细胞裂解液重悬细胞,于冰上裂解3
‑
5分钟,吹打细胞悬液3
‑
5次,加入10
‑
12ml pbs停止裂解,于600
‑
800
×
g室温离心5
‑
7min后
弃去上清;
10.s2.中性粒细胞的培养:采用含10%fbs的rpmi1640溶液作为培养基重悬细胞,将受试动物中性粒细胞接种于多聚赖氨酸包被的培养皿中进行培养;
11.s3.nets的诱导:采用1
‑
3μmol/l ionomycin刺激中性粒细胞6
‑
8小时,诱导nets生成;
12.s4.nets的收集:吸除上清后加入含10%fbs的rpmi1640培养基反复冲洗培养皿底5
‑
7次,收集冲洗液;将冲洗液于1000
‑
1200
×
g、4℃离心5
‑
7分钟,弃沉淀取上清即得nets;
13.s5.nets的定量:采用蛋白核酸分析仪对nets中的dna和蛋白进行精确定量。
14.在本发明前期预实验中,对步骤中影响提取中性粒细胞纯度、诱导中性粒细胞生成nets效率的相关因素进行了研究,结果如下:(1)采用不同浓度的percoll对中性粒细胞纯度有影响,例如其余步骤相同的情况下,步骤s1中采用76%percoll、64%percoll、52%percoll,最终提取的中性粒细胞纯度约83%;而采用78%percoll、69%percoll、52%percoll,提取的中性粒细胞纯度可达95%,因此步骤s1中选择78%percoll、69%percoll、52%percoll为最佳浓度。(2)采用不同的诱导剂诱导中性粒细胞生成nets的效率不同,例如其余步骤相同的情况下,步骤s3中分别采用1μmol/l pma、1μg/ml lps诱导中性粒细胞生成nets,效率均没有采用ionomycin高,因此步骤s3中选择ionomycin作为诱导剂。
15.具体地,步骤s1中受试动物骨髓组织碾碎,用pbs冲洗后于600
×
g离心5min。
16.具体地,步骤s1中,向离心管中依次缓慢加入2ml 78%percoll、2ml 69%percoll、2ml 52%percoll和细胞悬液,于1500
×
g室温下梯度密度离心30min。
17.在一种具体的实施方式中,是先将2ml 78%percoll加入离心管底部,再45
°
倾斜离心管,延管壁依次缓慢加入2ml 69%percoll和2ml 52%percoll,最后将细胞悬液延管壁缓慢加入最上层。
18.具体地,步骤s1中所述的78%percoll、69%percoll和52%percoll是用percoll原液与pbs按相应比例配制而成。
19.在一种具体的实施方式中,是将9倍体积的percoll原液与1体积的10
×
pbs充分混合,得到100%percoll溶液;再用100%percoll溶液和1
×
pbs配出浓度分别为52%、69%、78%的percoll溶液。
20.具体地,步骤s1中,取出78%percoll和69%percoll中间的细胞层,加入pbs冲洗,于600
×
g室温离心5min后去除上清液。
21.具体地,步骤s1中,用3ml红细胞裂解液重悬细胞,于冰上裂解3分钟,吹打细胞悬液3次,加入10ml pbs停止裂解,于600
×
g室温离心5min后弃去上清。
22.具体地,步骤s3中,采用1μmol/l ionomycin刺激中性粒细胞6小时,诱导nets生成。
23.具体地,步骤s4中,加入含10%fbs的rpmi1640培养基反复冲洗培养皿底5次,收集冲洗液。
24.具体地,步骤s4中,将冲洗液于1000
×
g、4℃离心5分钟。
25.相对于现有技术,本发明具有以下有益效果:
26.(1)本发明方法针对nets的形成过程,以较低的诱导物ionomycin浓度和较短的诱导时间达到了预料不到的技术效果,并克服了现有技术中采用较高浓度诱导物pma和较长
诱导时间存在强烈致癌性风险的问题。
27.(2)通过本发明方法能快速、简便、稳定诱导提取nets,采用蛋白核酸分析仪即可观测到直观的nets图像。
28.(3)本发明方法在建立nets快速检测方法或试剂盒、筛选促进或抑制nets相关药物或针对性治疗药物的等研究中十分重要,在生物医学检测领域也具有显著的重要意义。
附图说明
29.图1为nets染色示意图。
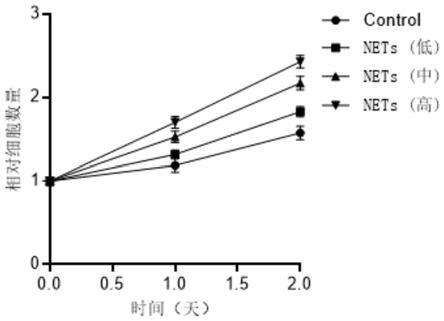
30.图2为nets促进胰腺癌kpc细胞系增殖的结果。
31.图3为不同诱导剂诱导中性粒细胞生成nets的结果。
具体实施方式
32.下面结合说明书附图及具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
33.仪器和试剂:
34.co2培养箱(thermo),离心机(eppendorf),蛋白核酸分析仪(thermo nanodrop one),尼龙滤器(corning),培养板(corning),离心管(thermo),pbs(gibco),异氟烷(雅培),dmem(gibco),rpmi1640(gibco),fbs(gibco),红细胞裂解液(bd),percoll(sigma),ionomycin(碧云天),cck8(mce)。
35.受试动物:小鼠。
36.实施例
37.一种中性粒细胞胞外诱捕网提取和定量的方法,包括以下具体步骤:
38.(1)co2窒息法处死小鼠,将小鼠浸于75%酒精中消毒10min后将其固定于泡沫板上,利用无菌剪刀小心剪开小鼠双下肢皮肤,于近端股骨处剪断,取下小鼠双下肢;
39.(2)剪除小鼠双足,剔除骨骼上附着的肌肉组织,并将腿骨的各节干骺端剪除,剩余骨组织浸泡于不含钙、镁离子的pbs缓冲液中,移至超净台冰盒中;
40.(3)用20ml注射器抽取pbs后与1ml针头相连,将针头插入小鼠腿骨骨髓腔中,冲洗骨髓腔,将骨髓冲入70μm尼龙网中,将骨髓组织碾碎,pbs冲洗后于600
×
g离心5min,少量(1
‑
2ml)pbs重悬骨髓细胞;
41.(4)配percoll试剂:将9倍体积的percoll原液与1体积的10
×
pbs充分混合,得到100%percoll溶液;再用100%percoll溶液和1
×
pbs配出浓度分别为52%、69%、78%的percoll溶液;
42.(5)取15ml离心管,用含1%fbs的pbs溶液润滑离心管后,将液体吸出,2ml 78%percoll加入离心管底部,45
°
倾斜离心管,延管壁依次缓慢加入2ml 69%percoll,和2ml 52%percoll,最后将细胞悬液延管壁缓慢加入最上层,室温下于1500
×
g,梯度密度离心30min(加减速度为0);
43.(6)离心结束,中性粒细胞层于78%和69%percoll中间,用塑料软管将该层细胞
吸出移入另一15ml离心管,并加入pbs冲洗,于600
×
g室温离心5min;
44.(7)去除上清液,使用3ml红细胞裂解液重悬细胞,冰上裂解3分钟,期间吹打细胞悬液3次,加入10ml pbs停止裂解,于600
×
g室温离心5min;
45.(8)弃上清,培养基重悬细胞,将提取出的小鼠中性粒细胞接种于多聚赖氨酸包被的培养皿中,培养基为含10%fbs的rpmi1640溶液;
46.(9)加入ionomycin(1μmol/l),置于37℃、5%co2环境中,刺激中性粒细胞6小时,诱导nets生成;
47.(10)小心吸除上清后加入培养基反复冲洗培养皿底5次,每次约2ml液体,收集冲洗液;
48.(11)冲洗液于1000
×
g、4℃离心5分钟,弃沉淀取上清即得nets;
49.(12)用蛋白核酸分析仪对nets中的dna和蛋白进行精确定量。
50.运用dapi染料标记dna,运用cith3抗体标记,二者共染的区域即为nets(如图1所示)。
51.此外,还采用cck8试剂盒检测不同浓度nets对kpc细胞增殖的影响。具体步骤为:配置kpc胰腺癌细胞系培养基(含10%fbs的dmem溶液),将kpc细胞接种于96孔板中,于37℃、5%co2环境中培养,待细胞长至对数生长期时加入低(100ng dna)、中(500ng dna)和高(2500ng dna)浓度的nets,连续2天检测cck8评价细胞数量增长。结果显示:nets可促进kpc细胞生长增殖,并且具有剂量依赖性(如图2所示)。
52.对比例1
53.本对比例针对影响提取中性粒细胞纯度的相关因素进行了研究,结果如下:采用不同浓度的percoll对中性粒细胞纯度有影响,例如,其余步骤相同的情况下,步骤s1中采用76%percoll、64%percoll、52%percoll,最终提取的中性粒细胞纯度约83%;而采用78%percoll、69%percoll、52%percoll,提取的中性粒细胞纯度可达95%,因此步骤s1中选择78%percoll、69%percoll、52%percoll为最佳浓度。
54.对比例2
55.本对比例针对影响诱导中性粒细胞生成nets效率的相关因素进行了研究,结果如下:如图3所示,采用不同的诱导剂诱导中性粒细胞生成nets的效率不同,例如,其余步骤相同的情况下,步骤s3中分别采用1μmol/l pma、1μg/ml lps诱导中性粒细胞生成nets(二者均约为28%),效率均没有采用1μmol/l ionomycin高(约为61%),因此步骤s3中选择1μmol/l ionomycin作为诱导剂。
56.最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。