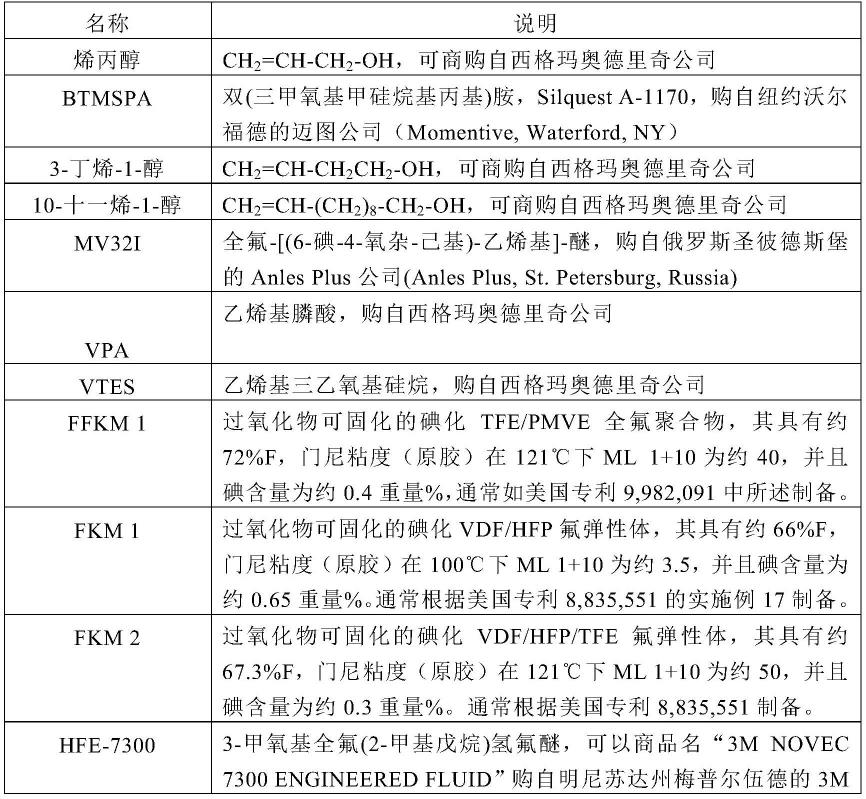
1.本发明涉及折射率高且聚合性优异的化合物、以及包含该化合物的聚合性组合物。另外,本发明涉及使用了该聚合性组合物或其聚合物的全息记录介质、光学材料以及光学部件。
背景技术:
2.以往,在光学部件中多使用玻璃。例如,对于光学透镜,即使是相同焦距的透镜,若使用折射率高的材料制造,则能够使透镜实现薄壁化,具有轻量化、提高光学路径设计自由度的优点。高折射率光学透镜对于光学摄像装置的小型化、高分辨率化、广角化也是有效的。
3.近年来,作为代替玻璃的光学材料,透明性高的塑料引起了人们的关注。与玻璃相比,塑料材料具有容易轻量化、容易改善机械强度、容易进行加工成型等优点。随着周边技术的发展,对于塑料光学材料的性能提高的要求也日渐增高。例如在光学透镜用途的材料中,要求容易聚合(易聚合性)、固化性良好、聚合物的折射率高(高折射率)。
4.迄今为止,以提高折射率为目的,进行了多种树脂的开发。例如可以举出邻苯基苯酚eo改性丙烯酸酯(专利文献1)、9,9-双[4-(2-丙烯酰氧基乙氧基)苯基]芴(专利文献2)等。另外,将对这些化合物进行修饰而成的分子结构的各种化合物作为均聚物、共聚物进行了开发,为了提高折射率进行了研究(专利文献3、4)。
[0005]
9,9-双[4-(2-丙烯酰氧基乙氧基)苯基]芴被频繁用作高折射率丙烯酸酯,但其粘度比较高,并且单体的折射率为1.62左右、还不能说足够高(专利文献5)。
[0006]
为了提高折射率,除了导入芳香环以外,在分子内引入硫原子也是有效的。例如,专利文献6中记载了一种在一分子中具有1~2个萘硫基的季戊四醇骨架的二丙烯酸酯单体,其折射率为1.62~1.65。
[0007]
专利文献7中记载了一种在1分子内具有2个苯并噻唑环的甘油骨架的丙烯酸酯化合物,其折射率为1.63。
[0008]
这些物质均不能说足以应对要求超过1.65的超高折射率的用途。
[0009]
另一方面,面向光记录介质的进一步大容量化、高密度化,开发出了一种使记录层的折射率根据由光的干涉引起的光强度分布而变化、以全息图形式记录信息的全息方式的光记录介质。另外,近年来进行了将面向存储器用途开发出的全息记录介质应用于ar眼镜导光板的光学元件用途中的研究。
[0010]
专利文献8中,关于全息记录介质中使用的光学材料,作为超高折射率化合物记载了具有3个芳香环的季戊四醇型的(甲基)丙烯酸酯化合物,其中具有为了得到高折射率而形成使(甲基)丙烯酰基直接结合在季戊四醇骨架上而成的结构的记载。但是,该结构中,由于(甲基)丙烯酰基周边的立体位阻而得不到充分的聚合性能,可能使全息记录特性降低。
[0011]
专利文献1:日本特开2013-95833号公报
[0012]
专利文献2:日本特开2000-7741号公报
[0013]
专利文献3:日本特开2008-94987号公报
[0014]
专利文献4:日本特开2012-82387号公报
[0015]
专利文献5:日本特开平6-220131号公报
[0016]
专利文献6:日本特表2008-527413号公报
[0017]
专利文献7:日本特开2005-133071号公报
[0018]
专利文献8:日本特开2017-14213号公报
技术实现要素:
[0019]
本发明的课题在于提供作为光学材料或光学部件有用的、具有易聚合性的高折射率化合物。
[0020]
用于解决技术问题的手段
[0021]
本发明人发现,具有3个芳香环且经由特定的连接基团而与聚合性基团连结的结构的季戊四醇型化合物为易聚合性的高折射率化合物,使用了该化合物的聚合性组合物和聚合物的折射率高,从而实现了本发明。
[0022]
本发明的要点在于下述方案。
[0023]
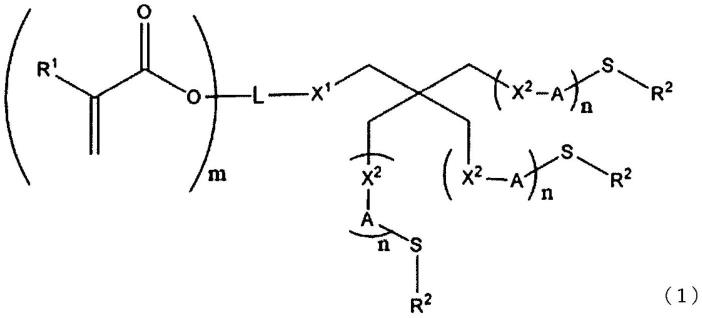
[1]由下式(1)所表示的化合物。
[0024]
[化1]
[0025][0026]
[式中,r1表示氢原子或甲基。r2表示具有或不具有取代基的芳香环基、或者被具有或不具有取代基的芳香环基所取代的烷基。x1表示(硫代)酯键、(硫代)碳酸酯键、(硫代)酰胺键、(硫代)氨基甲酸酯键、(硫代)脲键或(硫代)醚键、或者氧、硫或者具有或不具有取代基的氮原子。x2表示氧、硫或者具有或不具有取代基的氮原子。a表示具有或不具有取代基的2价基团。l表示具有或不具有取代基的(m 1)价连接基团。m表示1~3的整数。n表示0或1。]
[0027]
[2]如[1]中所述的化合物,其中,上述n为0。
[0028]
[3]如[1]或[2]中所述的化合物,其中,上述l为具有或不具有取代基的碳原子数1~8的烃基。
[0029]
[4]如[3]中所述的化合物,其中,上述l为具有或不具有取代基的碳原子数1~8的脂肪族烃基。
[0030]
[5]如[4]中所述的化合物,其中,上述l为具有或不具有取代基的碳原子数1~8的
链状脂肪族烃基。
[0031]
[6]如[1]~[5]中任一项所述的化合物,其中,上述r2为具有或不具有取代基的稠合芳香族杂环基、或者具有稠合杂环作为取代基的芳香族烃基。
[0032]
[7]如[6]中所述的化合物,其中,上述r2为含硫稠合芳香族杂环基、或者具有含硫稠合杂环基作为取代基的芳香族烃基。
[0033]
[8]如[7]中所述的化合物,其中,上述r2为二苯并噻吩基、苯并噻唑基和噻蒽基中的任一者,或者为具有二苯并噻吩基、苯并噻唑基和噻蒽基中的任一者作为取代基的芳香族烃基。
[0034]
[9]一种聚合性组合物,其含有[1]~[8]中任一项所述的化合物和聚合引发剂。
[0035]
[10]一种全息记录介质,其包含[9]中所述的聚合性组合物。
[0036]
[11]一种聚合物,其是将[9]中所述的聚合性组合物聚合而成的。
[0037]
[12]一种光学材料,其包含[11]中所述的聚合物。
[0038]
[13]一种光学部件,其包含[11]中所述的聚合物。
[0039]
[14]一种大容量存储器,其包含[10]中所述的全息记录介质。
[0040]
[15]一种光学元件,其是在[10]中所述的全息记录介质上进行全息记录而得到的。
[0041]
[16]一种ar眼镜,其包含[15]中所述的光学元件。
[0042]
发明的效果
[0043]
根据本发明,提供一种作为光学材料有用的易聚合性高折射率化合物。该化合物作为光学透镜或光学部件的硬涂层、全息记录介质中使用的反应性化合物特别有用。
[0044]
通过使用本发明的化合物,能够实现衍射效率高、透光率高、收缩率小的光学材料、光学部件。
附图说明
[0045]
图1是示出全息记录中使用的装置的构成的概况的示意图。
具体实施方式
[0046]
以下对本发明的实施方式进行具体说明。本发明并不限于以下的实施方式,可以在其要点的范围内进行各种变形来实施。
[0047]
本发明中,“(硫代)酯键”是酯键和硫代酯键的总称。“(硫代)碳酸酯键”是碳酸酯键和硫代碳酸酯键的总称。“(硫代)酰胺键”是酰胺键和硫代酰胺键的总称。“(硫代)氨基甲酸酯键”是氨基甲酸酯键和硫代氨基甲酸酯键的总称。“(硫代)脲键”是脲键和硫代脲键的总称。“(硫代)醚键”是醚键和硫代醚键的总称。
[0048]
本发明中,“(甲基)丙烯酸酯”是丙烯酸酯和甲基丙烯酸酯的总称。“(甲基)丙烯酰基”是丙烯酰基和甲基丙烯酰基的总称。“(甲基)丙烯酸”是丙烯酸和甲基丙烯酸的总称。
[0049]
本发明中,“具有或不具有取代基”是指具有1个以上的取代基或不具有取代基。
[0050]
1.关于本发明的化合物
[0051]
本发明的化合物为下式(1)所表示的具有作为聚合性官能团的(甲基)丙烯酰基的化合物。
[0052]
[化2]
[0053][0054]
[式中,r1表示氢原子或甲基。r2表示具有或不具有取代基的芳香环基、或者被具有或不具有取代基的芳香环基所取代的烷基。x1表示(硫代)酯键、(硫代)碳酸酯键、(硫代)酰胺键、(硫代)氨基甲酸酯键、(硫代)脲键或(硫代)醚键、或者氧、硫或者具有或不具有取代基的氮原子。x2表示氧、硫或者具有或不具有取代基的氮原子。a表示具有或不具有取代基的2价基团。l表示具有或不具有取代基的(m 1)价连接基团。m表示1~3的整数。n表示0或1。]
[0055]
1-1.关于式(1)中的r1[0056]
r1表示氢原子或甲基。为了得到聚合性更高的化合物,r1优选为氢原子。
[0057]
式(1)中,m为2或3、r1存在2个以上的情况下,2个以上的r1可以相同、也可以不同。
[0058]
1-2.关于式(1)中的r2[0059]
r2表示具有或不具有取代基的芳香环基、或者被具有或不具有取代基的芳香环基所取代的烷基。r2中包含的芳香环可以为稠环。
[0060]
r2的芳香环大致分为芳香族烃环和芳香族杂环。另外,被具有或不具有取代基的芳香环基所取代的烷基为在芳香环上具有或不具有取代基的芳烷基或杂芳烷基。
[0061]
作为该芳香族烃环,可以举出苯环、萘环、蒽环、菲环、苝环、并四苯环、芘环、苯并芘环、环、亚联苯基环、三亚苯环、苊环、荧蒽环、芴环等的基团。
[0062]
作为该芳香族杂环,可以举出:呋喃环、苯并呋喃环、二苯并呋喃环、萘并呋喃环、苯并萘并呋喃环、二萘并呋喃环、噻吩环、苯并噻吩环、二苯并噻吩环、萘并噻吩环、苯并萘并噻吩环、二萘并噻吩环、吡咯环、吲哚环、咔唑环、吡啶环、喹啉环、异喹啉环等包含1个杂原子的芳香族杂环;咪唑环、三唑环、四唑环、噁唑环、噻唑环、哒嗪环、嘧啶环、吡嗪环、三嗪环、噻二唑环等包含2个以上杂原子的芳香族杂环;苯并噁唑环、噻吩并噁唑环、噻唑并噁唑环、噁唑并噁唑环、噁唑并咪唑环、噁唑并吡啶环、噁唑并哒嗪环、噁唑并嘧啶环、噁唑并吡嗪环、萘并噁唑环、喹啉并噁唑环、二噁唑并吡嗪环、吩噻嗪环、苯并噻唑环、呋噻唑(furothiazole)环、噻吩并噻唑环、噻唑并噻唑环、噻唑并咪唑环、噻吩并噻二唑环、噻唑并噻二唑环、噻唑并吡啶环、噻唑并哒嗪环、噻唑并嘧啶环、噻唑并吡嗪环、萘并噻唑环、喹啉并噻唑环、噻蒽环以及吩噻嗪环等包含含有2个以上杂原子的芳香族杂环的2个或3个环稠合而成的环。这些环结构可以在任意位置与杂原子连结,并且也可以带有任意取代基。
[0063]
作为芳烷基,可以举出苄基、2-苯基乙基、萘基甲基。作为杂芳烷基,可以举出呋喃基甲基、噻吩基甲基、苯并噻吩基甲基等。它们可以带有任意取代基。
[0076]
x1表示(硫代)酯键、(硫代)碳酸酯键、(硫代)酰胺键、(硫代)氨基甲酸酯键、(硫代)脲键或(硫代)醚键、或者氧、硫或者具有或不具有取代基的氮原子。可以取代在氮原子上的基团没有特别限制,优选可以举出甲基、乙基等碳原子数1~8的烷基、苯基、萘基等芳香族烃基。
[0077]
从式(1)的化合物的合成容易、并且降低粘度的方面出发,作为x1,可以选择氧、硫、具有或不具有取代基的氮原子,优选可以选择氧或硫原子。尤其可以采用构成能够由比较廉价的季戊四醇三溴化物制造的化合物的氧原子。
[0078]
从提高本发明的化合物的聚合性的方面出发,x1优选为酯键、碳酸酯键、酰胺键、氨基甲酸酯键、脲键或醚键中的任一者,其中更优选为酰胺键、氨基甲酸酯键、脲键中的任一者。
[0079]
以提高本发明的化合物的折射率为目的,作为x1也可以选择硫代酯键、硫代碳酸酯键、硫代酰胺键、硫代氨基甲酸酯键、硫代脲键或硫代醚键中的任一者。
[0080]
1-4.关于式(1)中的x2[0081]
x2表示氧、硫或者具有或不具有取代基的氮原子。可以取代在该氮原子上的基团没有特别限制,优选可以举出甲基、乙基等碳原子数1~8的烷基、苯基、萘基等芳香族烃基。
[0082]
关于x2,从将本发明的化合物的吸水率抑制得很低的方面出发,优选氧或硫原子,更优选为对本发明的化合物赋予高折射率的硫原子。
[0083]
1-5.关于式(1)中的a
[0084]
a表示具有或不具有取代基的2价基团。
[0085]
此处的2价基团为可以具有支链的2价有机基团,优选碳原子数为1~8且可以具有支链的2价有机基团,更优选为乙叉基、丙叉基、亚甲基、亚乙基、亚丙基、2-羟基亚丙基、氧代亚丙基、氧代亚丁基、3-氧代亚戊基、亚环己基、亚苯基、亚二甲苯基,特别优选为亚甲基、亚乙基、亚丙基、2-羟基亚丙基。a的碳原子数为8以下时,本发明的化合物可实现高折射率化、并且粘度降低,具有加工性提高的倾向。
[0086]
作为a可以具有的取代基,例如可以举出氯、溴、碘等卤原子、羟基、巯基、碳原子数1~8的烷基、碳原子数2~8的烯基、碳原子数1~8的烷氧基、苯基、均三甲苯基、甲苯基、萘基、氰基、乙酰氧基、碳原子数2~9的烷基羰氧基、碳原子数2~9的烷氧羰基、氨磺酰基、碳原子数2~9的烷基氨磺酰基、碳原子数2~9的烷基羰基、苯乙基、羟基乙基、乙酰胺基、键合有碳原子数1~4的烷基而成的二烷基氨基乙基、三氟甲基、碳原子数1~8的烷硫基、碳原子数6~10的芳硫基、硝基。
[0087]
其中,优选碳原子数1~8的烷基、碳原子数1~8的烷氧基、氰基、乙酰氧基、碳原子数2~8的烷基羰氧基、氨磺酰基、碳原子数2~9的烷基氨磺酰基、苯基、萘基。
[0088]
1-6.关于式(1)中的m和n
[0089]
m表示1~3的整数。出于本发明的化合物的折射率倾向于进一步升高的原因,m优选为1或2、更优选为1。
[0090]
n表示0或1。随着n增大,化合物的分子量增加,本发明的聚合性组合物的粘度上升,可能使加工性降低。因此,n优选为0。n为0时,本发明的化合物的折射率倾向于进一步升高。
[0091]
1-7.关于式(1)中的l
[0092]
l为具有或不具有取代基的(m 1)价连接基团,可以根据本发明的化合物的目的适宜地选择。
[0093]
作为l,可以适当地选择采用直链状、支链状、环状的连接基团,从缓和本发明的化合物的(甲基)丙烯酰基周边的立体位阻的方面出发,优选为链状。
[0094]
作为构成l的链状连接基团,m=1的情况下,可以举出亚甲基、亚乙基、1,3-亚丙基、1,2-亚丙基、亚丁基、2-羟基亚丙基、氧代亚乙基、氧代亚丙基、氧代亚丁基、氧代亚己基、氧代亚庚基、3-氧代亚戊基、-ch2ch2nhc(o)-、-ch2ch2och2ch2nhc(o)-、-ch2ch2nhc(o)-、-ch2ch2sch2ch
2-、-ch2ch2nhc(s)-、-ch2ch2och2ch2nhc(s)-、-ch2ch2sch2ch2nhc(s)-、-ch2ch2nhc(s)-等,可以将它们组合使用。m=2或3情况下,上述链状化合物中的任意氢原子可以被(甲基)丙烯酰基取代,也可以通过支链结构与(甲基)丙烯酰基键合。
[0095]
作为l可以具有的取代基,可以举出卤原子(氯原子、溴原子、碘原子)、羟基、巯基、碳原子数1~8的烷基、碳原子数2~8的烯基、碳原子数1~8的烷氧基、苯基、均三甲苯基、甲苯基、萘基、氰基、乙酰氧基、碳原子数2~9的烷基羰氧基、碳原子数2~9的烷氧羰基、氨磺酰基、碳原子数2~9的烷基氨磺酰基、碳原子数2~9的烷基羰基、苯乙基、羟基乙基、乙酰胺基、键合有碳原子数1~4的烷基的二烷基氨基乙基、三氟甲基、碳原子数1~8的烷硫基、碳原子数6~10的芳硫基、硝基等。
[0096]
从确保本发明的化合物相对于各种介质的溶解性和避免着色的方面出发,l优选为脂肪族烃基。这种情况下,出于能够抑制本发明的化合物的折射率降低、抑制本发明的聚合性组合物的粘度上升的原因,l的脂肪族烃基的碳原子数优选为1~8(其中不包括取代基的碳原子数)。另外,从缓和上述立体位阻的方面出发,该脂肪族烃基优选为链状。
[0097]
以本发明的化合物的高折射率化为目的,作为l也可以选择环状的连接基团。这种情况下,l可以具有单环结构或稠环结构,构成l的环数优选为1~4、更优选为1~3、进一步优选为1~2。构成l的环未必一定是芳香性的,但为了确保减小在分子整体中所占的大小并且维持高折射率,优选为芳香族烃环。此处,作为构成l的芳香族烃环,可以举出苯环、茚环、萘环、甘菊环、芴环、苊烯环、蒽环、菲环、芘环等。
[0098]
以提高本发明的化合物的聚合性为目的,在l中也可以采用酯键、碳酸酯键、酰胺键、氨基甲酸酯键、脲键或醚键中的至少一者。这种情况下,更优选为酰胺键、氨基甲酸酯键、脲键中的任一者。
[0099]
以提高本发明的化合物的折射率为目的,在l中也可以采用硫代酯键、硫代碳酸酯键、硫代酰胺键、硫代氨基甲酸酯键、硫代脲键或硫代醚键中的任一者。
[0100]
1-8.分子量
[0101]
本发明的化合物中,从将粘度抑制得很低、良好地保持加工性的方面出发,其分子量优选为2000以下、更优选为1500以下。另外,从降低聚合时的收缩率的方面出发,本发明的化合物的分子量优选为400以上、更优选为500以上、进一步优选为550以上。
[0102]
1-9.水溶性
[0103]
从提高保存稳定性、防止因固化后的吸湿所致的变形等理由,本发明的化合物优选为水不溶性。此处的“水不溶性”是指在25℃、1气压的条件下在水中的溶解度通常为0.1质量%以下、优选为0.02质量%以下、更优选为0.01质量%以下。另一方面,通过具有一定程度的水溶性,可具有改善在水或极性溶剂中进行聚合时的分散性、提高与基板的粘接性
等效果,因此这种情况下在水中的溶解度优选为0.1质量%以上、更优选为1质量%以上。
[0104]
本发明中,通过适宜地选择式(1)所表示的化合物的结构,可以设定与目的/用途相应的水溶解性。
[0105]
1-10.分子结构与物性的关系
[0106]
在季戊四醇骨架的季碳的4条分子链中的3条分子链中导入了具有芳香环的r2的本发明的高折射化合物中,r2的3个芳香环通过硫原子以适当的分子间距离进行配设。因此,聚合反应前的化合物(单体)对于以有机溶剂为代表的各种介质显示出高溶解度。另一方面,该聚合物中,分子间的芳香环通过聚合反应而配置在附近,因此使局部的芳香环密度增加。作为结果,聚合物能够表现出高折射率。
[0107]
如此,在聚合物中,为了表现出高折射率,需要充分进行聚合反应。
[0108]
本发明的化合物中,通过使用适当的连接基团l将导入至季戊四醇骨架中的高折射部位与作为聚合性基团的(甲基)丙烯酰基进行连接,可减轻聚合性基团周边的立体位阻,能够兼顾高聚合性和高折射率。
[0109]
式(1)所表示的本发明的化合物中,可以将l、a、x1、x2之类的连接结构夹在季戊四醇骨架与(甲基)丙烯酰基部位和sr2部位之间,通过这些连接结构的存在,能够根据用途对本发明的化合物的物性进行调节。
[0110]
本发明的化合物具有包含化学稳定的季碳的季戊四醇骨架,因此在合成、加工、保存的所有情况下均具有热稳定性和化学稳定性。
[0111]
1-11.例示化合物
[0112]
以下例示出式(1)所表示的本发明的化合物的具体例。只要不超出其要点,本发明并不限于这些示例。
[0113]
上述式(1)中的m=1、n=0所表示的化合物的具体例如下。
[0114]
[化3]
[0115][0116]
[化4]
[0117][0118]
[化5]
[0119][0120]
[化6]
[0121][0122]
[化7]
[0123][0124]
[化8]
[0125][0126]
[化9]
[0127][0128]
[化10]
[0129][0130]
[化11]
[0131][0132]
式(1)中,m=1、n=0以外的情况的具体例如下。
[0133]
[化12]
[0134][0135]
1-12.合成方法
[0136]
式(1)所表示的本发明的化合物可以通过将公知的各种方法进行组合来合成。使用下述的结构式对于式(1)所表示的化合物的合成方法的一例进行说明。
[0137]
《式(1)中的n=0的情况下的合成例》
[0138]
首先,通过具有3个y的化合物(a)与硫醇化合物(b)或二硫化物化合物(b’)的偶联反应合成中间体(c),之后通过与具有离去基团的化合物(d)的反应合成出具有连接基团l的前体(f)。也可以使用通过与亲核剂发生反应而生成羟基的化合物(d’)来代替(d),由此合成出前体(f)。另外,也可以在向中间体(c)中导入离去基团后,与具有氨基和巯基x3的亲核剂(e)发生反应,由此来合成前体(f)。
[0139]
通过使(甲基)丙烯酸酯化剂(g-1)(丙烯酰氯、丙烯酸酐、丙烯酸酯等)作用于前体(f),得到化合物(1a)。
[0140]
通过使预先导入有(甲基)丙烯酰基的(g-2)作用于中间体(c),也能够直接合成出化合物(1a)。通过使具有离去基团的(h-1)与中间体(c)反应而得到前体(i)并使(甲基)丙烯酸(g-3)与该前体(i)进行偶联,也能够合成出化合物(1a)。
[0141]
在亲核剂(e)中,x3表示选自羟基、氨基和巯基等中的基团,l和l1表示具有或不具有取代基的(m 1)价基团。y为卤原子,优选为溴或碘,但也可以为氯。y1~y3表示卤原子、酯基、磺酸酯基、碳酸酯基、异氰酸酯基中的任一者。z表示卤原子、羧基、烷氧基、磺酰基中的任一者。
[0142]
[化13]
[0143][0144]
中间体(c)可以通过使碱存在下的化合物(b)、或者碱和还原剂存在下的化合物(b’)作用于化合物(a)而得到。
[0145]
在中间体(c)的合成时,作为有机溶剂,可以将二甲氧基乙烷、四氢呋喃、甲醇、乙醇、甲苯、n,n-二甲基甲酰胺、丙酮、水等单独或组合使用。
[0146]
作为碱,可以将三乙胺、吡啶、碳酸氢钠、碳酸钠、碳酸钾、叔丁醇钾等单独或组合使用。
[0147]
作为还原剂,可以将甲醛次硫酸氢钠(雕白粉)、连二亚硫酸钠、硫代硫酸钠、硼氢化钠、氢化铝锂等对二硫键进行还原而提供硫醇的还原剂单独或组合使用。
[0148]
通过使化合物(a)的y全部与化合物(b)和化合物(b’)的“r
2-s”部分发生置换,得到中间体(c)。该置换是逐次进行的,因此在通过适当的方法确认全部置换后停止反应。作为用于确认得到中间体(c)的反应状况的方法,可以举出薄层色谱、液相色谱、气相色谱、核磁共振法测定、红外吸收测定等。
[0149]
为了提高中间体(c)的纯度,也可以使用填充有硅胶的柱色谱。
[0150]
通过使这样得到的中间体(c)与具有连接基团l的化合物(d)发生反应,得到前体
(f)。(c)与(d)的连接反应可以在酸性、碱性的任一条件下进行。另外还可以采用使用金属催化剂的交叉偶联反应或自由基偶联。通过使用化合物(d’)来代替化合物(d)的方法也能够合成前体(f)。在将硫或者具有或不具有取代基的氮原子等导入至前体(f)的x1的情况下,通过与具有选自羟基、氨基和巯基等中的x3的亲核剂(e)发生反应,能够合成出前体(f)。此时可以利用在将中间体(c)的羟基转换成卤原子、磺酸酯、酰基等离去基团后使亲核剂(e)作用而得到前体(f)的方法。
[0151]
与中间体(c)的情况同样地,为了提高前体(f)的纯度,也可以使用填充有硅胶的柱色谱、或者进行使用适当溶剂的重结晶。
[0152]
当前体(f)与三乙胺、吡啶或咪唑等有机碱性化合物或者碳酸钠、碳酸钾等无机碱性化合物单独或组合共存时,通过与(甲基)丙烯酸酯化剂(g-1)(丙烯酰氯、丙烯酸酐、丙烯酸酯等)作用,能够得到化合物(1a)。
[0153]
此时,作为有机溶剂,可以将二甲氧基乙烷、二氯甲烷、四氢呋喃、甲苯、n,n-二甲基甲酰胺等单独或组合使用。
[0154]
与中间体(c)和前体(f)的情况同样地,为了提高化合物(1a)的纯度,也可以使用填充有硅胶的柱色谱、或者进行使用适当溶剂的重结晶。
[0155]
化合物(1a)也可以由具有4个卤原子等离去基团的化合物(j)来合成。通过使具有选自羟基、氨基和巯基等中的基团的亲核剂(e)、以及硫醇化合物(b)或二硫化物化合物(b’)进行偶联,可以合成前体(f)。这种情况下,对反应顺序没有限制,以任意次序、任意方法合成即可。通过使(g-1)作用于前体(f)可以合成化合物(1a),这一点与上述相同。
[0156]
通过利用任意次序、任意方法使化合物(h-2)以及硫醇化合物(b)或二硫化物化合物(b’)进行偶联而由化合物(j)得到化合物(i),通过使(甲基)丙烯酸(g-3)作用于该化合物(i),也可合成出化合物(1a)。
[0157]
[化14]
[0158][0159]
《式(1)中的n=1的情况下的合成例》
[0160]
对于在季戊四醇骨架上具有3个y的化合物(a)、分别各具有1个选自羟基、氨基和巯基中的基团和y的化合物(k)、硫代化合物(b)、具有(甲基)丙烯酰基的化合物(g-2),通过将公知的各种方法进行组合,可以合成出本发明的化合物。例如,通过使化合物(a)、化合物
9h-咔唑-3-基]-1-(o-乙酰肟)乙酮等。
[0174]
这些光聚合引发剂可以单独使用任一种,也可以将2种以上以任意组合和比例合用。
[0175]
关于本发明的聚合性组合物中的光聚合引发剂的含量,在设聚合性组合物中的可进行自由基聚合的全部化合物合计为100质量份时,该含量通常为0.01质量份以上、优选为0.02质量份以上、进一步优选为0.05质量份以上。其上限通常为10质量份以下、优选为5质量份以下、进一步优选为3质量份以下。光聚合引发剂的添加量若过多,则聚合急剧进行,不仅会增大固化体的双折射,而且还可能使色调变差。另一方面,若该添加量过少,则聚合性组合物可能未充分进行聚合。
[0176]
《热聚合引发剂》
[0177]
作为辅助本发明的聚合性组合物的聚合的热聚合引发剂,只要为公知的热自由基聚合引发剂,任何一种均可使用。例如可以举出有机过氧化物类和偶氮化合物类。其中,从由聚合反应得到的聚合物中不容易产生气泡的方面出发,优选有机过氧化物类。
[0178]
作为有机过氧化物的具体例,可以举出:过氧化甲基乙基酮等过氧化酮;1,1-二(叔己基过氧化)-3,3,5-三甲基环己烷、1,1-二(叔己基过氧化)环己烷、1,1-二(叔丁基过氧基)环己烷等过氧化缩酮;1,1,3,3-四甲基丁基过氧化氢、氢过氧化枯烯、萜烷过氧化氢等氢过氧化物;二枯基过氧化物、二叔丁基过氧化物等二烷基过氧化物;过氧化二月桂酰、过氧化二苯甲酰等过氧化二酰;二(4-叔丁基环己基)过氧化二碳酸酯、二(2-乙基己基)过氧化二碳酸酯等过氧化二碳酸酯;以及过氧化(2-乙基己酸)叔丁酯、过氧化异丙基单碳酸叔己酯、过氧化苯甲酸叔丁酯、1,1,3,3-四甲基丁基-2-乙基己酸酯等过氧化酯。
[0179]
作为偶氮化合物的具体例,可以举出2,2
’‑
偶氮二异丁腈、2,2
’‑
偶氮二(2-甲基丁腈)、2,2
’‑
偶氮双(2,4-二甲基戊腈)、1,1
’‑
偶氮二-1-环己烷甲腈、二甲基-2,2
’‑
偶氮二异丁酸酯、4,4
’‑
偶氮二-4-氰基戊酸以及2,2
’‑
偶氮二-(2-脒基丙烷)二氢氯化物。
[0180]
这些热聚合引发剂可以单独使用任一种,也可以将2种以上以任意组合和比例合用。
[0181]
关于本发明的聚合性组合物中的热聚合引发剂的含量,在设聚合性组合物中的可进行自由基聚合的全部化合物合计为100质量份时,该含量通常为0.1质量份以上、优选为0.5质量份以上、进一步优选为0.8质量份以上。其上限通常为10质量份以下、优选为5质量份以下、进一步优选为2质量份以下。热聚合引发剂若过多,则聚合急剧进行,不仅会损害所得到的聚合物的光学均匀性,而且还可能使色调变差。另一方面,若该添加量过少,则可能使热聚合未充分进行。
[0182]
在将光聚合引发剂与热聚合引发剂合用的情况下,其质量比通常为“100:1”~“1:100”(“光聚合引发剂:热聚合引发剂”,在以下的本段落中同样)、优选为“10:1”~“1:10”。若热聚合引发剂过少,则聚合可能不充分,若过多,则可能会发生着色。
[0183]
2-1-2.氧化还原系聚合引发剂
[0184]
氧化还原系聚合引发剂是利用基于过氧化物与还原剂的组合的氧化还原反应的自由基引发剂,其即使在低温下也能够产生自由基,通常用于乳液聚合等。
[0185]
作为氧化还原系聚合引发剂的具体例,可以举出:作为过氧化物的过氧化二苯甲酰与作为还原剂的n,n-二甲基苯胺、n,n-二甲基-对甲苯胺、n,n-双(2-羟基丙基)-对甲苯
胺等芳香族叔胺类的合用体系;作为过氧化物的氢过氧化物与作为还原剂的金属皂类的合用体系;作为过氧化物的氢过氧化物与作为还原剂的硫脲类的合用体系等。
[0186]
在水溶性氧化还原系聚合引发剂中,将过硫酸盐、过氧化氢、氢过氧化物之类的过氧化物与水溶性无机还原剂(fe
2
、nahso3等)或有机还原剂(醇、多元胺等)组合使用。
[0187]
本发明的聚合性组合物中的氧化还原系聚合引发剂的含量的优选范围与热聚合引发剂相同。
[0188]
2-1-3.阴离子聚合引发剂
[0189]
作为本发明的聚合性组合物中使用的阴离子聚合引发剂,可例示出碱金属、正丁基锂、氨基钠、萘钠、格氏试剂、锂醇盐、碱金属二苯甲酮羰自由基等。它们可以单独使用任一种,也可以将2种以上以任意组合和比例合用。
[0190]
2-1-4.阳离子聚合引发剂
[0191]
作为本发明的聚合性组合物中使用的阳离子聚合引发剂,可例示出高氯酸、硫酸、三氯乙酸等布朗斯台德酸类;三氟化硼、三氯化铝、三溴化铝、四氯化锡等路易斯酸类;碘、三苯基氯甲烷等。它们可以单独使用任一种,也可以将2种以上以任意组合和比例合用。
[0192]
关于本发明的聚合性组合物中的阴离子聚合引发剂或阳离子聚合剂的量,相对于聚合性组合物中的可进行阴离子或阳离子聚合的全部化合物的合计100质量份,通常为0.001质量份以上、优选为0.005质量份以上、进一步优选为0.01质量份以上。其上限通常为5质量份以下、优选为1质量份以下、进一步优选为0.5质量份以下。若阴离子或阳离子聚合引发剂少于0.001质量份,则不能引起充分的反应;若混配超过5质量份,则难以兼顾可使用时间和聚合速度。
[0193]
2-1-5.光阳离子聚合引发剂
[0194]
本发明中的光阳离子聚合引发剂是在光的作用下产生阳离子种的引发剂。作为光阳离子聚合引发剂,只要为在光照射下产生阳离子种的化合物就没有特别限定,通常广为人知的是鎓盐。作为鎓盐,可以举出路易斯酸的重氮盐、路易斯酸的碘鎓盐、路易斯酸的锍盐等。具体地说,可以举出四氟化硼的苯基重氮盐、六氟化磷的二苯基碘鎓盐、六氟化锑的二苯基碘鎓盐、六氟化砷的三-4-甲基苯基锍盐、四氟化锑的三-4-甲基苯基锍盐等。优选使用芳香族锍盐。
[0195]
作为光阳离子聚合引发剂的具体例,可以举出s,s,s’,s
’‑
四苯基-s,s
’‑
(4、4
’‑
硫代二苯基)二锍双六氟磷酸盐、二苯基-4-苯基噻吩基锍六氟磷酸盐、二苯基-4-苯基噻吩基锍六氟锑酸盐等,例如可例示出陶氏化学制造的商品名:uvi6992、san-apro公司制造的商品名:cpi-100p、san-apro公司制造的商品名:cpi-101a、san-apro公司制造的商品名:cpi-200k、basf公司制造的商品名:irgacure 270等(irgacure是basf公司的注册商标)。
[0196]
这些光阳离子聚合引发剂可以单独使用任一种,也可以将2种以上以任意组合和比例合用。
[0197]
关于本发明的聚合性组合物中的光阳离子聚合引发剂的量,相对于聚合性组合物中的可进行光阳离子聚合的全部化合物的合计100质量份,优选为0.02质量份以上20质量份以下、更优选为0.1质量份以上10质量份以下。光阳离子聚合引发剂若少于0.02质量份,则不能引起充分的反应;若混配超过20质量份,则难以兼顾可使用时间和聚合速度。
[0198]
在光阳离子聚合引发剂的使用中,可以合用上述阳离子聚合引发剂。这种情况下,
相对于聚合性组合物中的阳离子聚合性化合物100质量份,阳离子聚合引发剂以通常为0.1~10质量份、优选为1~5质量份的范围使用。若阳离子聚合引发剂的用量过少,则聚合速度变慢,另一方面,若用量过多,则所得到的聚合物的物性可能会降低。
[0199]
另外,在光阳离子聚合引发剂的使用中,也可以合用光阳离子聚合敏化剂。光阳离子聚合敏化剂是指,在光阳离子聚合中使用的光源的照射光与光阳离子聚合引发剂的吸收波长未完美匹配的情况下,合用光阳离子聚合敏化剂而使照射光的能量有效地传递至光阳离子聚合引发剂的配方,已知有甲氧基苯酚等酚系化合物(日本特开平5-230189号公报)、噻吨酮化合物(日本特开2000-204284号公报)、二烷氧基蒽化合物(日本特开2000-119306号公报)等。
[0200]
光阳离子聚合敏化剂以相对于光阳离子聚合引发剂1质量份通常为0.2~5质量份、优选为0.5~1质量份的范围使用。若光阳离子聚合敏化剂过少,则可能难以表现出敏化效果;另一方面,若过多,则聚合物的物性可能会降低。
[0201]
2-2.关于聚合性化合物
[0202]
作为本发明的聚合性组合物中含有的聚合性化合物,可以单独包含式(1)所表示的本发明的化合物的任一种,也可以以任意组合和比例包含2种以上。
[0203]
本发明的聚合性组合物也可以包含本发明的化合物以外的其他聚合性化合物。
[0204]
关于本发明的聚合性组合物中的本发明的化合物的含量,以相对于本发明的聚合性组合物的总固体成分的比例计,优选为1质量%以上、99质量%以下,尤其为5质量%以上、95质量%以下。本发明的化合物的含有比例若小于1质量%,则不能充分发挥出由使用本发明的化合物所带来的效果;另一方面,若超过于99质量%,则固化性趋于降低。
[0205]
作为其他聚合性化合物的示例,可以举出阳离子聚合性单体、阴离子聚合性单体、自由基聚合性单体等。这些聚合性化合物可以单独使用任一种,也可以将2种以上以任意组合和比例合用。另外,也可以使用在1分子中具有2个以上的聚合性官能团的聚合性化合物(有时称为多官能单体)。在使用多官能单体的情况下,在聚合物内部形成交联结构,因此也可提高热稳定性、耐候性、耐溶剂性等。
[0206]
本发明的聚合性组合物含有本发明的化合物以外的其他聚合性化合物的情况下,其含量以相对于本发明的聚合性组合物的总固体成分的比例计优选为0.1质量%以上、10质量%以下,尤其为0.3质量%以上、5质量%以下。若其他聚合性化合物的含有比例小于0.1质量%,则不能充分发挥出由于该添加所带来的特性赋予效果,另一方面,若超过5质量%,则具有容易发生光学特性、强度受损等问题的倾向。
[0207]
《阳离子聚合性单体》
[0208]
作为阳离子聚合性单体的示例,可以举出具有环氧乙烷环的化合物、苯乙烯及其衍生物、乙烯基萘及其衍生物、乙烯基醚类、n-乙烯基化合物、具有氧杂环丁烷环的化合物等。
[0209]
其中优选至少使用具有氧杂环丁烷环的化合物,进一步优选将具有氧杂环丁烷环的化合物与具有环氧乙烷环的化合物合用。
[0210]
作为具有环氧乙烷环的化合物,可以具有在1分子内含有2个以上的环氧乙烷环的预聚物。
[0211]
作为这样的预聚物的示例,可以举出脂环式聚环氧类、多元酸的聚缩水甘油基酯
类、多元醇的聚缩水甘油醚类、聚亚氧烷基二醇的聚缩水甘油醚类、芳香族多元醇的聚缩水甘油基醚类、芳香族多元醇的聚缩水甘油醚类的氢化化合物类、氨基甲酸酯多环氧化合物和环氧化聚丁二烯类等。
[0212]
作为苯乙烯及其衍生物的示例,可以举出苯乙烯、对甲基苯乙烯、对甲氧基苯乙烯、β-甲基苯乙烯、对甲基-β-甲基苯乙烯、α-甲基苯乙烯、对甲氧基-β-甲基苯乙烯、二乙烯基苯等。
[0213]
作为乙烯基萘及其衍生物的示例,可以举出1-乙烯基萘、α-甲基-1-乙烯基萘、β-甲基-1-乙烯基萘、4-甲基-1-乙烯基萘、4-甲氧基-1-乙烯基萘等。
[0214]
作为乙烯基醚类的示例,可以举出异丁醚、乙基乙烯基醚、苯基乙烯基醚、对甲基苯基乙烯基醚、对甲氧基苯基乙烯基醚等。
[0215]
作为n-乙烯基化合物的示例,可以举出n-乙烯基咔唑、n-乙烯基吡咯烷酮、n-乙烯基吲哚、n-乙烯基吡咯、n-乙烯基吩噻嗪等。
[0216]
作为具有氧杂环丁烷环的化合物的示例,可以举出日本特开2001-220526号公报、日本特开2001-310937号公报等中记载的公知的各种氧杂环丁烷化合物。
[0217]
这些阳离子聚合性单体可以单独使用任1种,也可以将2种以上以任意的组合和比例合用。
[0218]
《阴离子聚合性单体》
[0219]
作为阴离子聚合性单体的示例,可以举出烃单体、极性单体等。
[0220]
作为烃单体的示例,可以举出苯乙烯、α-甲基苯乙烯、丁二烯、异戊二烯、乙烯基吡啶、乙烯基蒽和它们的衍生物等。
[0221]
作为极性单体的示例,可以举出甲基丙烯酸酯类(例如甲基丙烯酸甲酯、甲基丙烯酸乙酯、甲基丙烯酸异丙酯等);丙烯酸酯类(例如丙烯酸甲酯、丙烯酸乙酯等);乙烯基酮类(例如甲基乙烯基酮、异丙基乙烯基酮、环己基乙烯基酮、苯基乙烯基酮等);异丙烯基酮类(例如甲基异丙烯基酮、苯基异丙烯基酮等);其他极性单体(例如丙烯腈、丙烯酰胺、硝基乙烯、亚甲基丙二酸酯、氰基丙烯酸酯、偏二氰乙烯等)等。
[0222]
这些阴离子聚合性单体可以单独使用任1种,也可以将2种以上以任意的组合和比例合用。
[0223]
《自由基聚合性单体》
[0224]
自由基聚合性单体是在1分子中具有1个以上的烯键式不饱和双键的化合物,作为式例,可以举出(甲基)丙烯酸酯类、(甲基)丙烯酰胺类、乙烯基酯类、苯乙烯类等。
[0225]
作为(甲基)丙烯酸酯类的示例,可以举出(甲基)丙烯酸甲酯、(甲基)丙烯酸乙酯、(甲基)丙烯酸(正或异)丙酯、(甲基)丙烯酸(正、异、仲或叔)丁酯、(甲基)丙烯酸戊酯、(甲基)丙烯酸金刚烷基酯、(甲基)丙烯酸氯乙酯、(甲基)丙烯酸-2-羟乙酯、(甲基)丙烯酸-2-羟基丙酯、(甲基)丙烯酸2-羟基戊酯、(甲基)丙烯酸环己酯、(甲基)丙烯酸烯丙酯、三羟甲基丙烷单(甲基)丙烯酸酯、季戊四醇单(甲基)丙烯酸酯、(甲基)丙烯酸苄酯、(甲基)丙烯酸甲氧基苄酯、(甲基)丙烯酸氯苄酯、(甲基)丙烯酸羟基苄酯、(甲基)丙烯酸羟基苯乙酯、(甲基)丙烯酸二羟基苯乙酯、(甲基)丙烯酸糠酯、(甲基)丙烯酸四氢糠基酯、(甲基)丙烯酸苯酯、(甲基)丙烯酸羟基苯酯、(甲基)丙烯酸氯苯酯、(甲基)丙烯酸氨磺酰基苯酯、(甲基)丙烯酸-2-苯氧基乙酯、(甲基)丙烯酸2-(羟基苯基羰氧基)乙酯、苯酚eo改性(甲基)丙烯酸
酯、苯基苯酚eo改性(甲基)丙烯酸酯、对枯基苯酚eo改性(甲基)丙烯酸酯、壬基苯酚eo改性(甲基)丙烯酸酯、n-丙烯酰氧基乙基六氢化邻苯二甲酰亚胺、双酚f eo改性二丙烯酸酯、双酚a eo改性二丙烯酸酯、(甲基)丙烯酸二溴苯酯、(甲基)丙烯酸三溴苯酯、(甲基)丙烯酸双环戊烯氧基乙酯、丙烯酸双环戊酯、三环癸烷二甲醇二(甲基)丙烯酸酯、双苯氧基乙醇芴二(甲基)丙烯酸酯、三羟甲基丙烷三(甲基)丙烯酸酯、季戊四醇三(甲基)丙烯酸酯、季戊四醇四(甲基)丙烯酸酯、二季戊四醇五(甲基)丙烯酸酯、二季戊四醇六(甲基)丙烯酸酯等。此处的“eo”是指“环氧乙烷”。
[0226]
作为(甲基)丙烯酰胺类的示例,可以举出(甲基)丙烯酰胺、n-甲基(甲基)丙烯酰胺、n-乙基(甲基)丙烯酰胺、n-丙基(甲基)丙烯酰胺、n-丁基(甲基)丙烯酰胺、n-苄基(甲基)丙烯酰胺、n-羟基乙基(甲基)丙烯酰胺、n-苯基(甲基)丙烯酰胺、n-甲苯基(甲基)丙烯酰胺、n-(羟基苯基)(甲基)丙烯酰胺、n-(氨磺酰基苯基)(甲基)丙烯酰胺、n-(苯磺酰基)(甲基)丙烯酰胺、n-(甲苯基磺酰基)(甲基)丙烯酰胺、n,n-二甲基(甲基)丙烯酰胺、n-甲基-n-苯基(甲基)丙烯酰胺、n-羟基乙基-n-甲基(甲基)丙烯酰胺等。
[0227]
作为乙烯基酯类的示例,可以举出乙酸乙烯酯、丁酸乙烯酯、苯甲酸乙烯酯、安息香酸乙烯酯、叔丁基安息香酸乙烯酯、氯安息香酸乙烯酯、4-乙氧基安息香酸乙烯酯、4-乙基安息香酸乙烯酯、4-甲基安息香酸乙烯酯、3-甲基安息香酸乙烯酯、2-甲基安息香酸乙烯酯、4-苯基安息香酸乙烯酯、特戊酸乙烯酯等。
[0228]
作为苯乙烯类的示例,可以举出苯乙烯、对乙酰基苯乙烯、对苯甲酰基苯乙烯、2-丁氧基甲基苯乙烯、4-丁基苯乙烯、4-仲丁基苯乙烯、4-叔丁基苯乙烯、2-氯苯乙烯、3-氯苯乙烯、4-氯苯乙烯、二氯苯乙烯、2,4-二异丙基苯乙烯、二甲基苯乙烯、对乙氧基苯乙烯、2-乙基苯乙烯、2-甲氧基苯乙烯、4-甲氧基苯乙烯、2-甲基苯乙烯、3-甲基苯乙烯、4-甲基苯乙烯、对甲基苯乙烯、对苯氧基苯乙烯、对苯基苯乙烯、二乙烯基苯等。
[0229]
这些自由基聚合性单体可以单独使用任1种,也可以将2种以上以任意的组合和比例合用。
[0230]
上述例示的阳离子聚合性单体、阴离子聚合性单体、自由基聚合性单体可以使用任一种,另外也可以合用两种以上。
[0231]
出于不容易阻碍形成树脂基体的反应的理由,在全息记录介质用途中,作为与式(1)所表示的本发明的化合物合用的其他聚合性化合物,优选使用自由基聚合性单体。
[0232]
2-3其他添加成分
[0233]
在本发明的聚合性组合物中,可以在不损害本发明的效果的范围内混配其他成分。
[0234]
作为其他成分,例如可以举出溶剂、抗氧化剂、增塑剂、紫外线吸收剂、敏化剂、链转移剂、消泡剂、阻聚剂、由有机物或无机物等构成的任意填充剂、分散剂、颜料、荧光体等波长转换材料等的各种添加剂。
[0235]
本发明的聚合性组合物可以含有用于调整粘度的溶剂。
[0236]
作为溶剂的具体例,根据聚合性组合物的物性,可以举出例如乙醇、丙醇、异丙醇、乙二醇、丙二醇等醇类;己烷、戊烷、庚烷等脂肪族烃类;环戊烷、环己烷等脂环式烃类;甲苯、二甲苯等芳香族烃类;二氯甲烷、氯仿等卤代烃类;二甲醚、二乙醚等链状醚类;二氧六环、四氢呋喃等环状醚类;乙酸甲酯、乙酸乙酯、乙酸丁酯、乳酸乙酯、丁酸乙酯等酯类;丙
酮、乙基甲基酮、甲基异丁基酮、环己酮等酮类;甲基溶纤剂、乙基溶纤剂、丁基溶纤剂等溶纤剂类;甲基卡必醇、乙基卡必醇、丁基卡必醇等卡必醇类;丙二醇单甲醚、丙二醇单乙醚、丙二醇单正丁醚等丙二醇单烷基醚类;乙二醇单甲基醚乙酸酯、丙二醇单甲基醚乙酸酯等二醇醚酯类;n,n-二甲基甲酰胺、n,n-二甲基乙酰胺等酰胺类;二甲基亚砜等亚砜类;乙腈、苯甲腈等腈类;n-甲基吡咯烷酮等有机溶剂。
[0237]
这些溶剂可以单独或作为混合溶剂使用。另外,根据聚合方法(乳液聚合、悬浮聚合等),也可以使用水。
[0238]
在使用溶剂(或分散介质)的情况下,对其量没有特别限制,按照与聚合法、加工法、用途相应地成为合适粘度的聚合性组合物的方式进行调整来使用即可。
[0239]
本发明中,为了使所得到的聚合物的耐热黄变性良好,优选在聚合性组合物中混配抗氧化剂作为添加剂。
[0240]
作为抗氧化剂的具体例,可以举出2,6-二叔丁基苯酚、2,6-二叔丁基-对甲酚、3-(3’,5
’‑
二叔丁基-4
’‑
羟苯基)丙酸正十八烷醇酯、四-[亚甲基-3-(3’,5
’‑
二叔丁基-4
’‑
羟苯基)丙酸酯]甲烷、三乙二醇双[3-(3-叔丁基-5-甲基-4-羟苯基)丙酸酯]、1,6-己二醇双[3-(3,5-二叔丁基-4-羟苯基)丙酸酯]等酚系抗氧化剂;以及亚磷酸三苯酯、亚磷酸三异癸酯、亚磷酸三(十三烷基)酯、三(2,4-二叔丁基苯基)亚磷酸酯等磷系抗氧化剂。它们可以单独使用或将2种以上合并使用。
[0241]
作为抗氧化剂,优选将酚系抗氧化剂与磷系抗氧化剂合用。作为酚系抗氧化剂与磷系抗氧化剂的优选组合,可以举出作为酚系抗氧化剂的选自四-[亚甲基-3-(3’,5
’‑
二叔丁基-4
’‑
羟苯基)丙酸酯]甲烷、3-(3’,5
’‑
二叔丁基-4
’‑
羟苯基)丙酸正十八烷醇酯中的至少一种与作为磷系抗氧化剂的三(2,4-二叔丁基苯基)亚磷酸酯的组合。
[0242]
作为本发明的聚合性组合物中的抗氧化剂的混配量,从使所得到的聚合物的耐热黄变性良好的方面出发,相对于聚合性组合物的总量100质量份优选为0.01~5质量份、更优选为0.05~3质量份、进一步优选为0.1~2质量份。
[0243]
2-4聚合性组合物的制造方法
[0244]
本发明的聚合性组合物可以将各成分混合来制造,也可以将聚合引发剂以外的成分预先混合,在即将进行聚合反应前添加聚合引发剂来制造。
[0245]
3.本发明的聚合性组合物的聚合方法
[0246]
本发明的聚合性组合物的聚合方法没有特别限定,有照射活性能量射线使其聚合的方法、加热使其聚合的方法。
[0247]
3-1.聚合引发法(活性能量射线)
[0248]
在使本发明的聚合性组合物进行光自由基聚合的情况下,照射活性能量射线来实施聚合。
[0249]
作为所使用的活性能量射线,优选电子射线、或者紫外到红外的波长范围的光。作为光源,例如若活性能量射线为紫外线则可使用超高压水银光源或金属卤化物光源,若为可见光线则可以使用金属卤化物光源或卤素光源,若为红外线则可使用卤素光源。此外还可以使用激光、led等光源。
[0250]
活性能量射线的照射量根据光源的种类、涂膜的膜厚等适宜地设定,优选按照使式(1)所表示的本发明的化合物及其他聚合化合物的聚合性官能团的总量的反应率为80%
以上、更优选为90%以上的方式适宜地设定。反应率利用红外吸收光谱根据反应前后的聚合性官能团的吸收峰强度的变化而计算出。
[0251]
在照射活性能量射线进行聚合后,可以根据需要进行加热处理或退火处理,进一步进行聚合。此时的加热温度优选为80~200℃的范围。加热时间优选为10~60分钟的范围。
[0252]
3-2.聚合引发法(加热)
[0253]
在为了本发明的聚合性组合物的聚合而进行加热处理的情况下,加热温度优选为80~200℃的范围、更优选为100~150℃的范围。若加热温度低于80℃,则需要延长加热时间,具有欠缺经济性的倾向;若加热温度高于200℃,则要花费能量成本,并且要花费加热升温时间和降温时间,因此具有欠缺经济性的倾向。
[0254]
4.聚合物
[0255]
下面对于使本发明的聚合性组合物聚合而成的本发明的聚合物进行说明。
[0256]
4-1.折射率
[0257]
通常,通过聚合反应,整体的密度会提高,因此聚合物的折射率倾向于比作为其前体的聚合前的化合物(称为单体)高。通过使用具有高折射率的单体充分进行聚合反应,可以提高所得到的聚合物的折射率,因此通过单体的分子结构设计来提高聚合物的折射率被认为是重要的。
[0258]
关于折射率,当用短波长的照射光进行评价时,显示出较大的值;但在短波长下显示出相对较大的折射率的样品在长波长下仍显示出相对较大的折射率,其关系不会发生逆转。因此,通过在一定波长下对折射率进行评价来进行比较,能够比较出该材料的实质折射率的大小。本发明中,以在587nm的照射光波长下的值为基准。
[0259]
本发明的聚合物的折射率优选为1.55以上、更优选为1.60以上、特别优选为1.63以上、最优选为1.65以上。本发明的聚合物的折射率的上限没有特别限定,通常为2.0以下。
[0260]
将本发明的聚合物作为透镜等的光学材料使用的情况下,若折射率小于1.55,则光学透镜等的中央部增厚,作为塑料的特征的轻质性可能会受损,因而不优选。另外,在透镜等精密光学部件的开发中,通过将具有2个以上的折射率的光学材料组合来实现适合于部件的光学特性也是很重要的。从这方面出发,折射率大于1.63的聚合物可以说是特别有用的适合于光学部件的材料。
[0261]
将本发明的聚合物作为全息记录介质的记录层材料使用的情况下,本发明的聚合物的折射率通常为1.68以上、1.78以下、优选为1.77以下的范围。折射率若小于1.68,则衍射效率低,多重度不充分。另外,若折射率大于1.78,则与基体树脂的折射率之差变得过大,散射增大,由此使透射率降低,在记录、再生时需要更大量的能量。
[0262]
4-2.玻璃化转变温度
[0263]
本发明的聚合物的玻璃化转变温度优选为90℃以上、更优选为100℃以上、进一步优选为110℃以上、特别优选为120℃以上,另外,优选为250℃以下、更优选为220℃以下、进一步优选为200℃以下。若低于该范围,则在使用环境下,光学物性可能会与设计值相比发生变化,可能不满足实用所需的耐热性。另外,若高于该范围,则聚合物的加工性降低,可能得不到外观良好、尺寸精度高的成型体,而且聚合物变脆、机械强度降低,成型体的处理性可能变差。
[0264]
5.光学材料和光学部件
[0265]
本发明的化合物、聚合性组合物以及聚合物具有高折射率、易加工性、低收缩率之类的性能,因此能够适用于各种光学材料和光学部件。
[0266]
作为光学材料,可以举出光学用外涂层、硬膜剂、光学部件用粘接剂、光纤维用树脂、丙烯酸系树脂改性剂等。
[0267]
作为光学部件,可以举出透镜、滤光片、衍射光栅、棱镜、光导子、显示装置用盖板玻璃、光传感器、光电开关、led、发光元件、光导波路、光分路器、光纤维粘接剂、显示元件用基板、彩色滤光片用基板、触控面板用基板、偏振片、显示屏背光源、导光板、防反射膜、视角扩大膜、光记录、光造形、光凸版印刷等。
[0268]
另外,也可以作为这些的层使用。例如可以举出显示屏保护膜等。
[0269]
这些之中,特别是由于本发明的聚合物的高折射率特性,能够优选适用于塑料透镜。作为透镜,可以举出照相机(车载照相机、数码照相机、pc用照相机、移动电话用照相机、监控摄像机等)的摄像用透镜、眼镜片、光束聚光透镜、光漫射用透镜等。
[0270]
在使用了本发明的聚合物的透镜中,为了在必要时进行防反射、赋予高硬度性、提高耐磨耗性、提高耐化学药品性、赋予防雾性、或者赋予时尚性等的改良,可以实施表面研磨、抗静电处理、硬膜处理、无反射涂布处理、染色处理等物理或化学处理。
[0271]
6.全息记录介质
[0272]
本发明的聚合性组合物能够适当地用于全息记录介质的记录层。此时,本发明的聚合性组合物优选为除了包含本发明的化合物以外还包含基体树脂、光聚合引发剂以及自由基捕捉剂的光反应性组合物。下面对作为面向全息记录介质的材料使用时的详细情况进行说明。
[0273]
6-1.关于基体树脂
[0274]
本发明的聚合性组合物优选包含基体树脂。特别是构成全息记录介质的记录层的基体树脂为不会由于光的照射而显著发生化学和物理变化的有机物,主要由有机化合物的聚合物构成。
[0275]
基体树脂与上述的聚合性化合物、后述的光聚合引发剂等一起构成本发明的聚合性组合物,因此强烈要求其与聚合性化合物、光聚合引发剂等的相容性优异。若基体树脂与上述其他成分的相容性低,则在材料相互之间形成界面,通过光在界面处的折射或反射而导致光泄露到非必要部分,因此可能使干涉条纹扭曲或被切割而记录在不适当的部分,由此可能引起信息的劣化。关于基体树脂与上述其他成分的相容性,例如可以如日本专利第3737306号公报等中所记载,对于样品在与透射光不同的方向设置检测器,基于由此得到的散射光强度等进行评价。
[0276]
作为本发明的聚合性组合物的基体树脂,可以使用由在聚合性组合物中能够溶解于溶剂的多种材料构成、在形成为使用状态后使它们进行三维交联而成的树脂,例如可以举出以下说明的热塑性树脂、热固化性树脂、光固化性树脂。
[0277]
三维交联而成的树脂为溶剂不溶性的,是常温下为液态的聚合性化合物与对于聚合性化合物具有反应活性的化合物的反应固化物。三维交联而成的树脂会成为物理障碍,因此可抑制记录时的体积变化。即,在记录后的记录层中,明部发生膨胀、暗部发生收缩,具有在全息记录介质表面产生凹凸的倾向。为了抑制该体积变化,在记录层中更优选使用包
含三维交联而成的树脂基体的聚合性组合物。
[0278]
其中,从与支撑体的密合性的方面出发,作为基体树脂,优选热固化性树脂。以下对于可作为基体树脂使用的树脂材料进行详细说明。
[0279]
6-1-1.热塑性树脂
[0280]
作为热塑性树脂的具体材料的示例,可以举出氯化聚乙烯、聚甲基丙烯酸甲酯树脂(pmma)、甲基丙烯酸甲酯与其他丙烯酸烷基酯的共聚物、氯乙烯与丙烯腈的共聚物、聚乙酸乙烯酯树脂(pvac)、聚乙烯醇、聚乙烯醇缩甲醛、聚乙烯吡咯烷酮、乙基纤维素、硝基纤维素等之类的纤维素树脂、聚苯乙烯树脂、聚碳酸酯树脂等。他们可以单独使用一种,也可以合用两种以上。
[0281]
作为这些热塑性树脂的溶剂,只要可溶解这些树脂就没有特别限制,可以举出丙酮、甲基乙基酮等酮类、乙酸丁酯、丙二醇甲基醚乙酸酯等酯类、甲苯、二甲苯等芳香族烃类、四氢呋喃、1,2-二甲氧基乙烷等醚类、n,n-二甲基乙酰胺、n-甲基吡咯烷酮等酰胺类等。它们可以仅使用1种,也可以将2种以上混合使用。
[0282]
6-1-2.热固化性树脂
[0283]
在作为基体树脂使用热固化性树脂的情况下,固化温度根据交联剂或催化剂的种类具有多样性。
[0284]
作为在室温下固化的官能团组合的示例,环氧化物与胺、环氧化物与硫醇、异氰酸酯与胺为代表示例。另外,作为使用催化剂的示例,环氧化物与苯酚、环氧化物与酸酐、异氰酸酯与多元醇为代表示例。
[0285]
前者的情况下,在进行混合时立即发生反应,因而简便;但在伴有全息记录介质这样的成型的情况下,由于时间不充裕,因此难以调整。另一方面,后者的情况下,可通过适当地选择催化剂的种类和用量而自由地选择固化温度、固化时间,因此在伴有全息记录介质之类的成型的同时进行固化时是适当的。这些从低分子到高分子的各种种类的树脂原料有市售,因此可以在维持与聚合性的反应性化合物或光引发剂的相容性、与基板的密合性等的情况下进行选择。
[0286]
下面对各原材料进行说明,但任一种原材料均可以单独使用一种,也可以合用两种以上。
[0287]
《环氧化物》
[0288]
作为环氧化物,可以举出(聚)乙二醇、(聚)丙二醇、(聚)四亚甲基二醇、三羟甲基丙烷、甘油等多元醇的聚缩水甘油醚化合物、3,4-环氧环己基甲基-3,4-环氧环己基羧酸酯、3,4-环氧-1-甲基环己基-3,4-环氧-1-甲基己烷羧酸酯等具有4~7元环的环状脂肪族基团的脂环式环氧化合物、双酚a型环氧化合物、氢化双酚a型环氧化合物、双酚f型环氧化合物、苯酚或甲酚线型酚醛型环氧化合物等。
[0289]
环氧化物优选在1分子中具有2个以上的环氧基,对其种类没有特别限制。若环氧基数少,则可能得不到作为基体所需要的硬度。1分子中的环氧基数的上限没有特别限制,通常为8以下,其中优选为4以下。环氧基数若过多,则环氧基的消耗需要大量的时间,基体树脂的形成可能需要过长时间。
[0290]
《胺》
[0291]
作为胺,可以使用包含伯胺基或仲胺基的物质。作为这样的胺类的示例,可以举出
乙二胺、二亚乙基三胺或其衍生物等脂肪族多元胺、异佛尔酮二胺、薄荷烷二胺、n-氨基乙基哌嗪或其衍生物等脂环族多元胺、间苯二甲胺、二氨基二苯基甲烷或其衍生物等芳香族多元胺、二聚酸等二羧酸与上述多元胺的缩合物等聚酰胺、2-甲基咪唑或其衍生物等咪唑化合物、除它们以外的双氰胺、己二酸二酰肼等。
[0292]
《硫醇》
[0293]
作为硫醇,可以举出1,3-丁烷二硫醇、1,4-丁烷二硫醇、2,3-丁烷二硫醇、1,2-苯二硫醇、1,3-苯二硫醇、1,4-苯二硫醇、1,10-癸烷二硫醇、1,2-乙二硫醇、1,6-己二硫醇、1,9-壬烷二硫醇等二硫醇、thiokol(toray fine chemicals公司制造)、jercure qx40(三菱化学公司制造)等多硫醇等硫醇化合物。其中适于使用jercure qx40等市售的快速固化性多硫醇。
[0294]
《苯酚》
[0295]
作为苯酚,可以举出双酚a、酚醛清漆型的酚树脂、甲阶酚醛型的酚树脂等。
[0296]
《酸酐》
[0297]
关于酸酐,作为单官能性的酸酐可以举出邻苯二甲酸酐、四氢邻苯二甲酸酐或其衍生物等,作为二官能性的酸酐可以举出均苯四酸二酐、二苯甲酮四羧酸酐或其衍生物等。
[0298]
《胺、硫醇、苯酚、酸酐的用量》
[0299]
胺、硫醇、苯酚、酸酐的用量以相对于环氧基的摩尔数的比例计通常为0.1当量以上、尤其为0.7当量以上,并且通常为2.0当量以下、尤其为1.5当量以下的范围。胺、硫醇、苯酚、酸酐的用量过少或过多,未反应的官能团数均增多,保存稳定性可能会受损。
[0300]
《热固化性树脂用聚合引发剂》
[0301]
作为用于使热固化性树脂固化的催化剂,可以根据固化温度、固化时间使用阴离子聚合引发剂和阳离子聚合引发剂。
[0302]
阴离子聚合引发剂是通过热或活性能量射线照射而产生阴离子的物质,作为示例,可以举出胺类等。作为胺类的示例,可以举出二甲基苄基胺、二甲氨基甲基苯酚、1,8-二氮杂双环[5.4.0]十一碳烯-7等含氨基化合物以及它们的衍生物;咪唑、2-甲基咪唑、2-乙基-4-甲基咪唑等咪唑化合物及其衍生物等。它们可以根据固化温度、固化时间使用1种或2种以上。
[0303]
阳离子聚合引发剂是通过热或活性能量射线照射而产生阳离子的物质,作为示例,可以举出芳香族鎓盐等。作为具体例,可以举出由sbf
6-、bf
4-、asf
6-、pf
6-、cf3so
3-、b(c6f5)
4-等阴离子成分和包含碘、硫、氮、磷等原子的芳香族阳离子成分构成的化合物。其中优选二芳基碘鎓盐、三芳基锍盐等。它们可以根据固化温度、固化时间使用1种或2种以上。
[0304]
这些热固化性树脂用聚合引发剂的用量相对于基体树脂优选通常为0.001质量%以上、尤其为0.01质量%以上、并且通常为50质量%以下、尤其为10质量%以下的范围。这些热固化性树脂用聚合引发剂的用量若过少,则热固化性树脂用聚合引发剂的浓度过低,因此聚合反应可能过于花费时间。另一方面,若热固化性树脂用聚合引发剂的用量过多,作为聚合反应,有时不会发生连续的开环反应。
[0305]
《异氰酸酯》
[0306]
作为异氰酸酯,优选在1分子中具有2个以上的异氰酸酯基的物质,对其种类没有特别限制。若1分子中的异氰酸酯基数少,则可能得不到作为基体树脂所需要的硬度。1分子
中的异氰酸酯基数的上限没有特别限制,优选通常为8以下、尤其为4以下。1分子中的异氰酸酯基数若过多,则异氰酸酯基的消耗需要大量的时间,基体树脂的形成可能过于花费时间。1分子中的异氰酸酯基数的上限没有特别限制,通常为20以下的程度。
[0307]
作为异氰酸酯的示例,可以举出六亚甲基二异氰酸酯、赖氨酸甲酯二异氰酸酯、2,4,4-三甲基六亚甲基二异氰酸酯等脂肪族异氰酸酯;异佛尔酮二异氰酸酯、4,4
’‑
亚甲基双(环己基异氰酸酯)等脂环族异氰酸酯;甲苯二异氰酸酯、4,4
’‑
二苯基甲烷二异氰酸酯、苯二亚甲基二异氰酸酯、萘-1,5
’‑
二异氰酸酯等芳香族异氰酸酯;以及它们的多聚体等,其中优选3~7聚体。
[0308]
另外,除此以外,还可以举出水、三羟甲基乙烷、三羟甲基丙烷等多元醇类与上述异氰酸酯的反应物等、六亚甲基二异氰酸酯的多聚体或其衍生物。
[0309]
异氰酸酯的分子量以数均分子量计优选为100以上50000以下、更优选为150以上10000以下、进一步优选为150以上5000以下。若数均分子量过小,则由于交联密度提高而使基体树脂的硬度变得过高,可能会降低记录速度。另外,若数均分子量过大,则与其他成分的相容性降低、交联密度降低,因而使基体树脂的硬度变得过低,记录内容可能会消失。
[0310]
《多元醇》
[0311]
作为多元醇,可以举出聚丙烯多元醇、聚己内酯多元醇、聚酯多元醇、聚碳酸酯多元醇等。
[0312]
(聚丙烯多元醇)
[0313]
聚丙烯多元醇通过环氧丙烷与二醇或多元醇的反应而得到。作为二醇或多元醇,例如可以举出乙二醇、丙二醇、1,4-丁二醇、1,5-戊二醇、3-甲基-1,5-戊二醇、1,6-己二醇、新戊二醇、二乙二醇、1,4-环己二醇、1,4-环己烷二甲醇、癸二醇、聚乙二醇、聚四亚甲基二醇等。作为聚丙烯多元醇,其市售品有sanix gp-400、gp-1000(均由三洋化成公司制造、商品名)、adeka polyether g400、g700、g1500(均由adeka公司制造、商品名)等。
[0314]
(聚己内酯多元醇)
[0315]
聚己内酯多元醇通过内酯与二醇或多元醇的反应而得到。作为内酯,例如可以举出α-己内酯、β-己内酯、γ-己内酯、ε-己内酯、α-甲基-ε-己内酯、β-甲基-ε-己内酯等。
[0316]
作为二醇或多元醇,例如可以举出乙二醇、丙二醇、1,4-丁二醇、1,5-戊二醇、3-甲基-1,5-戊二醇、1,6-己二醇、新戊二醇、二乙二醇、1,4-环己二醇、1,4-环己烷二甲醇、癸二醇、聚乙二醇、聚四亚甲基二醇等。
[0317]
作为由ε-己内酯的反应得到的聚己内酯多元醇,市售品有placcel 205、placcel 205u、placcel 205ut、placcel 210、placcel 220、placcel 230、placcel 240、placcel 303、placcel 305、placcel 308、placcel 312、placcel 320、placcel 401、placcel l205al、placcel l212al、placcel l220al、placcel l320al、placcel t2103、placcel t2205、placcel p3403(均由daicel公司制造、商品名)等。
[0318]
(聚酯多元醇)
[0319]
作为聚酯多元醇,可以举出使二羧酸或它们的酸酐与多元醇进行缩聚而得到的物质。
[0320]
作为二羧酸,例如可以举出琥珀酸、己二酸、癸二酸、壬二酸、二聚酸、马来酸酐、间苯二甲酸、对苯二甲酸、偏苯三酸等。
丁磺酸、(4-氟苯基)二苯基锍三氟甲基磺酸、二苯基-4-甲基苯基锍三氟甲基磺酸、三苯基锍三氟甲基磺酸、双(烷基苯基)碘鎓六氟膦酸等鎓盐类、以氯化锌、氯化锡、氯化铁、氯化铝、bf3等路易斯酸作为主成分的催化剂、盐酸、磷酸等质子酸、三甲胺、三乙胺、三亚乙基二胺、二甲基苄基胺、二氮杂双环十一碳烯等胺类、2-甲基咪唑、2-乙基-4-甲基咪唑、偏苯三酸1-氰乙基-2-十一烷基咪唑啉鎓等咪唑类、氢氧化钠、氢氧化钾、碳酸钾等碱类、二月桂酸二丁基锡、二月桂酸二辛基锡、二辛酸二丁基锡等锡催化剂、三(2-乙基己酸)铋、三苯甲酰基氧基铋等铋催化剂、四(乙酰乙酸乙酯)锆、1,1
’‑
异亚丙基二氯化二茂锆、四(2,4-戊二酮基)锆等锆催化剂等。
[0336]
其中,为了提高保存稳定性,优选铋催化剂、锆催化剂。
[0337]
作为铋系催化剂,只要是含有铋元素的催化剂且为促进异氰酸酯和多元醇的反应的化合物就没有特别限制。
[0338]
作为铋系催化剂的示例,可以举出三(2-乙基己酸)铋、三苯甲酰基氧基铋、三乙酸铋、三(二甲基二硫代氨基甲酸)铋、氢氧化铋、三苯基铋(v)双(三氯乙酸酯)、三(4-甲基苯基)氧代铋(v)、三苯基双(3-氯苯甲酰基氧基)铋(v)等。
[0339]
其中,从催化活性的方面出发,优选3价的铋化合物,更优选羧酸铋、通式bi(ocor)3(r为直链或支链的烷基、环烷基、或者取代或无取代的芳香族基团)所表示的物质。上述铋系催化剂可以单独使用任1种,也可以以任意组合和比例合用两种以上。
[0340]
作为锆系催化剂,只要是含有锆元素的催化剂且为促进异氰酸酯和多元醇的反应的化合物就没有特别限制。
[0341]
作为其示例,可以举出环戊二烯基三氯化锆、十甲基二氯化二茂锆、1,1
’‑
二丁基二氯化二茂锆、1,1
’‑
异亚丙基二氯化二茂锆、四(2,4-戊二酮基)锆、四(三氟-2,4-戊二酮基)锆、四(六氟-2,4-戊二酮基)锆、丁醇锆、叔丁醇锆、丙醇锆、异丙醇锆、乙醇锆、双(乙酰乙酸乙酯)二丁醇锆、四(乙酰乙酸乙酯)锆、氧化锆、氧化钡锆、氧化钙锆、溴化锆、氯化锆、氟化锆、二(茚基)二氯化锆、碳酸锆等。
[0342]
其中,从与其他成分的相容性的方面出发,优选具有有机配位体的化合物,更优选具有醇盐或乙酰丙酮(2,4-戊二酮基)结构的化合物。上述锆化合物可以单独使用任一种,也可以以任意组合和比例合用两种以上。
[0343]
铋系催化剂和锆系催化剂分别可以单独使用,并且也可以混合使用。
[0344]
氨基甲酸酯聚合催化剂的用量以相对于基体树脂的比例计优选通常为0.0001质量%以上、尤其为0.001质量%以上、并且通常为10质量%以下、尤其为5质量%以下的范围。氨基甲酸酯聚合催化剂的用量若过少,则固化可能过于花费时间。另一方面,用量若过多,则固化反应的控制可能变得困难。
[0345]
通过使用氨基甲酸酯聚合催化剂,能够在室温下固化,但也可以升高温度来进行固化。作为此时的温度,优选为40℃至90℃之间。
[0346]
6-1-3.光固化性树脂
[0347]
作为基体树脂使用光固化性树脂的情况下,需要使用与所使用的波长相应的基体树脂用光引发剂来进行固化。由于通过在光照射期间进行固化会在成型、粘接方面产生故障,因此优选为在主要作业温度即室温附近稳定的固化反应。考虑到这一方面,可以说基于基体树脂用光引发剂的催化剂固化是优选的选择。
1-基ti等。
[0358]
6-2-2.酰基氧化膦化合物
[0359]
作为酰基氧化膦化合物的具体例,可以举出在1分子中仅具有1个基于光的裂解点的单官能引发剂、在1分子中具有2个基于光的裂解点的2官能性引发剂。
[0360]
作为单官能引发剂,例如可以举出三苯基氧化膦、二苯基(2,4,6-三甲基苯甲酰基)氧化膦、2,6-二氯苯甲酰基二苯基氧化膦等。
[0361]
作为2官能性引发剂,例如可以举出苯基双(2,4,6-三甲基苯甲酰基)氧化膦、双(2,6-二甲氧基苯甲酰基)-2,4,4-三甲基戊基氧化膦、双(2,6-二氯苯甲酰基)-4-丙基苯基氧化膦、双(2,6-二氯苯甲酰基)-2,5-二甲基苯基氧化膦等。
[0362]
6-2-3.肟酯系化合物
[0363]
作为肟酯系化合物的具体例,可以举出1-[4-(苯硫基)-2-(o-苯甲酰基肟)]-1,2-辛烷二酮、1-[9-乙基-6-(2-甲基苯甲酰基)-9h-咔唑-3-基]-1-(o-乙酰基肟)乙酮、4-(乙酰氧基亚氨基)-5-[9-乙基-6-(2-甲基苯甲酰基)-9h-咔唑-3-基]-5-氧代戊酸甲酯、1-(9-乙基-6-环己酰基-9h-咔唑-3-基)-1-(o-乙酰基肟)戊二酸甲酯、1-(9-乙基-9h-咔唑-3-基)-1-(o-乙酰基肟)戊二酸甲酯、1-(9-乙基-9h-咔唑-3-基)-1-(o-乙酰基肟)-3-甲基-丁酸等。
[0364]
6-2-4.光聚合引发剂的用量
[0365]
上述的各种的光聚合引发剂可以单独使用任一种,也可以将2种以上以任意组合和比例合用。
[0366]
本发明的聚合性组合物中的光聚合引发剂的含量以每单位重量聚合性组合物中的摩尔量计优选为0.5μmol/g以上。更优选为1μmol/g以上。另外,本发明的聚合性组合物中的光聚合引发剂的含量以每单位重量聚合性组合物中的摩尔量计优选为100μmol/g以下。更优选为50μmol/g以下。
[0367]
光聚合引发剂的含量若过少,则自由基的产生量减少,因此可能使光聚合的速度变慢、全息记录介质中的记录灵敏度降低。另一方面,光聚合引发剂的含量若过多,则通过光照射产生的自由基彼此再结合、发生歧化,因此对光聚合的贡献减少,全息记录介质中的记录灵敏度仍然可能会降低。在合用2种以上的光聚合引发剂的情况下,优选使它们的总量满足上述范围。
[0368]
6-3.自由基捕捉剂
[0369]
在全息记录中,为了将干涉光强度图案精度良好地以全息记录介质中的聚合物分布的形式进行固定,可以添加自由基捕捉剂。自由基捕捉剂优选具有捕捉自由基的官能团和通过共价键合固定于基体树脂的反应基团这两者。作为捕捉自由基的官能团,可以举出稳定氮氧自由基。
[0370]
6-3-1.自由基捕捉剂的种类
[0371]
作为通过共价键合固定于基体树脂的反应基团,可以举出羟基、氨基、异氰酸酯基、巯基。作为这样的自由基捕捉剂,可以举出4-羟基-2,2,6,6-四甲基哌啶-1-氧基自由基(tempol)、3-羟基-9-氮杂双环[3.3.1]壬烷n-氧基、5-ho-azado:5-羟基-2-氮杂三环[3.3.1.1
3,7
]癸烷n-氧基。
[0372]
6-3-2.自由基捕捉剂的含量
[0373]
上述各种自由基捕捉剂可以单独使用任一种,也可以将两种以上以任意组合和比例合用。
[0374]
本发明的聚合性组合物中的自由基捕捉剂的含量以每单位重量的聚合性组合物中的摩尔量计优选为0.5μmol/g以上、更优选为1μmol/g以上。另外,本发明的聚合性组合物中的自由基捕捉剂的含量优选为100μmol/g以下、更优选为50μmol/g以下。
[0375]
自由基捕捉剂的含量若过少,则捕捉自由基的效率降低,具有低聚合度的聚合物发生扩散、对信号没有贡献的成分增多的倾向。另一方面,若自由基捕捉剂的含量过多,则聚合物的聚合效率降低,具有不能进行信号记录的倾向。在将2种以上的自由基捕捉剂合用的情况下,优选使它们的总量满足上述范围。
[0376]
6-4.其他成分
[0377]
本发明的聚合性组合物中,只要不违反本发明的主旨,除了上述成分以外,也可以含有其他成分。
[0378]
作为其他成分,可以举出用于制备聚合性组合物的溶剂、增塑剂、分散剂、流平剂、消泡剂、粘接促进剂等,特别是用于全息记录介质的情况下,用于记录的反应控制的链转移剂、聚合终止剂、相容剂、反应辅助剂、敏化剂等。另外,作为改善其他特性可能需要的添加剂的示例,可以举出防腐剂、稳定剂、抗氧化剂、紫外线吸收剂等。这些成分可以单独使用任一种,也可以以任意组合和比例合用两种以上。
[0379]
《敏化剂》
[0380]
本发明的聚合性组合物中,可以添加对光聚合引发剂的激发进行控制的化合物。作为这样的化合物,可以举出敏化剂、敏化辅助剂等。
[0381]
作为敏化剂,可以从公知的各种敏化剂中选择任意的敏化剂来使用,通常作为敏化剂,为了吸收可见和紫外的激光,多数情况下使用色素等有色化合物。在用于全息记录介质的情况下,尽管根据记录中使用的激光的波长和所使用的引发剂的种类而不同,但在使用绿色激光的体系的情况下,作为优选的敏化剂的具体例,可以举出日本特开平5-241338号公报、日本特开平2-69号公报、日本特公平2-55446号公报等中记载的化合物。在使用蓝色激光的体系的情况下,可以举出日本特开2000-10277号公报、日本特开2004-198446号公报等中记载的化合物。这些敏化剂可以单独使用任一种,也可以将两种以上以任意组合和比例合用。
[0382]
在所得到的全息记录介质要求无色透明性的情况下,作为敏化剂优选使用花青系色素。花青系色素通常容易在光的作用下发生分解,因此通过进行后曝光、即通过在室内光或太阳光下放置数小时至数天,全息记录介质中的花青系色素发生分解,在可见区域不具有吸收,因此可得到无色透明的全息记录介质。
[0383]
敏化剂的量需要根据所形成的记录层的厚度进行增减,以相对于上述的6-2.光聚合引发剂的比例计优选通常为0.01质量%以上、尤其为0.1质量%以上、并且通常为10质量%以下、尤其为5质量%以下的范围。若敏化剂的用量过少,则引发效率降低,记录可能需要很长时间。另一方面,若敏化剂的用量过多,则记录、再生中使用的光的吸收增大,光可能难以达到深度方向。在将2种以上的敏化剂合用的情况下,使它们的总量满足上述范围。
[0384]
《增塑剂》
[0385]
为了提高反应效率、调整全息记录介质的记录层的物性,本发明的聚合性组合物
可以含有增塑剂。
[0386]
作为增塑剂的示例,可以举出邻苯二甲酸二辛酯、邻苯二甲酸二异壬酯、邻苯二甲酸二异癸酯、邻苯二甲酸二(十一烷基)酯等邻苯二甲酸酯类、己二酸双(2-乙基己基)酯、己二酸二异壬酯、己二酸二正丁酯等己二酸酯类、癸二酸二辛酯、癸二酸二丁酯等癸二酸酯类、磷酸三甲苯酯等磷酸酯类、乙酰基柠檬酸三丁酯等柠檬酸酯类、偏苯三酸三辛酯等偏苯三酸酯类、环氧化大豆油、氯化链烷烃、乙酰氧基甲氧基丙烷等烷氧基化(聚)亚烷基二醇酯、二甲氧基聚乙二醇等末端烷氧基化聚亚烷基二醇等。
[0387]
也可以使用日本专利第6069294号公报中所例示那样的具有氟元素的增塑剂。作为具有氟元素的增塑剂的示例,可以举出2,2,2-三氟乙基丁基氨基甲酸酯、双(2,2,2-三氟乙基)-(2,2,4-三甲基己烷-1,6-二基)双氨基甲酸酯、双(2,2,2-三氟乙基)-[4-({[(2,2,2-三氟乙氧基)羰基]氨基}-甲基)辛烷-1,8-二基]双氨基甲酸酯、2,2,3,3,4,4,5,5,6,6,7,7,8,8,9,9-十六氟壬基丁基氨基甲酸酯、2,2,2-三氟乙基苯基氨基甲酸酯等。
[0388]
这些增塑剂以相对于聚合性组合物的总固体成分的比例计以通常为0.01质量%以上50质量%以下、优选为0.05质量%以上20质量%以下的范围使用。增塑剂的含量若少于该比例,则对于反应效率的提高、物性的调整发挥不出效果;若多于该比例,则记录层的透明性降低、增塑剂的渗出变得显著。
[0389]
《流平剂》
[0390]
本发明的聚合性组合物中可以使用流平剂。作为流平剂,可以举出多元羧酸钠盐、多元羧酸铵盐、多元羧酸胺盐、硅系流平剂、丙烯酸系流平剂、酯化合物、酮化合物、氟化合物等。它们可以单独使用任一种,也可以以任意组合和比例合用两种以上。
[0391]
《链转移剂》
[0392]
本发明的聚合性组合物中可以使用链转移剂。作为链转移剂,可以举出亚磷酸钠、次磷酸钠等次磷酸盐类、巯基乙酸、巯基丙酸、2-丙硫醇、2-巯基乙醇、苯硫酚等硫醇类、乙醛、丙醛等醛类、丙酮、甲基乙基酮等酮类、三氯乙烯、全氯乙烯等卤代烃类、萜品油烯、α-萜品烯、β-萜品烯、γ-萜品烯等萜烯类、1,4-环己二烯、1,4-环庚二烯、1,4-环辛二烯、1、4-庚二烯、1,4-己二烯、2-甲基-1,4-戊二烯、3,6-壬烷二烯-1-醇、9,12-十八碳二烯醇等非共轭二烯类、亚麻酸、γ-亚麻酸、亚麻酸甲基、亚麻酸乙酯、亚麻酸异丙酯、亚麻酸酐等亚麻酸类、亚油酸、亚油酸甲酯、亚油酸乙酯、亚油酸异丙酯、亚油酸酐等亚油酸类、二十碳五烯酸、二十碳五烯酸乙酯等二十碳五烯酸类、二十二碳六烯酸、二十二碳六烯酸乙酯等二十二碳六烯酸类等。
[0393]
这些添加剂的用量以相对于本实施方式的聚合性组合物的总固体成分的比例计优选通常为0.001质量%以上、尤其为0.01质量%以上、并且通常为30质量%以下、尤其为10质量%以下的范围。在将2种以上的添加剂合用的情况下,使它们的总量满足上述范围。
[0394]
6-5.聚合性组合物中的各成分的组成比
[0395]
关于本发明的聚合性组合物中的各成分的含量,只要不违反本发明的主旨即为任意的。以下所示的各成分的比例以每单位质量聚合性组合物中的摩尔量为基准优选为以下的范围。
[0396]
包含本发明的化合物的聚合性化合物的含量优选为5μmol/g以上、更优选为10μmol/g以上、进一步优选为100μmol/g以上。另外,聚合性化合物的含量优选为2000μmol/g以
下、更优选为1000μmol/g以下、进一步优选为500μmol/g以下。
[0397]
通过使聚合性化合物的含量为上述下限值以上,在全息记录介质中可得到充分的衍射效率;通过使该含量为上述上限值以下,可确保记录层中的与树脂基体的相容性,具有可将因记录所致的记录层的收缩保持得较低的倾向。
[0398]
作为本发明的聚合性组合物中的基体树脂使用异氰酸酯和多元醇的情况下,它们的含量合计通常为0.1质量%以上、优选为10质量%以上、更优选为35质量%以上,通常为99.9质量%以下、优选为99质量%以下。通过使该含量为上述下限值以上,容易形成记录层。
[0399]
这种情况下,多元醇的异氰酸酯反应性官能团数相对于异氰酸酯的异氰酸酯基数之比优选为0.1以上、更优选为0.5以上,通常为10.0以下、优选为2.0以下。通过使该比例为上述范围内,未反应的官能团少,保存稳定性提高。
[0400]
另外,该聚合性组合物中,氨基甲酸酯聚合催化剂的含量优选考虑异氰酸酯和多元醇的反应速度来决定,优选为5质量%以下、更优选为4质量%以下、进一步优选为1质量%以下。另外,优选使用0.005质量%以上。
[0401]
上述成分以外的其他成分的总量为30质量%以下即可,优选为15质量%以下、更优选为5质量%以下。
[0402]
6-6.聚合性组合物的制造方法
[0403]
本发明中,包含聚合性化合物、基体树脂和光聚合引发剂的聚合性组合物的制造方法没有特别限定,进行混合的顺序等也可以适宜地调整。另外,在聚合性组合物包含上述以外的成分的情况下,各成分可以以任何组合、顺序进行混合。
[0404]
作为基体树脂使用异氰酸酯和多元醇的情况下的聚合性组合物例如可以通过以下的方法来得到,但本发明并不限于此。
[0405]
将聚合性化合物和光聚合引发剂、以及除了异氰酸酯和氨基甲酸酯聚合催化剂以外的全部成分进行混合,作为光反应性组合物(a液)。将异氰酸酯和氨基甲酸酯聚合催化剂进行混合,作为b液。
[0406]
或者也可以在聚合性化合物和光聚合引发剂中混合除了异氰酸酯以外的全部成分,作为光反应性组合物(a液)。
[0407]
各混合液优选进行脱水脱气。若脱水脱气不充分,则在制作全息记录介质时会产生气泡,可能无法得到均匀的记录层。在该脱水脱气时,只要无损于各成分,也可以进行加热、减压。
[0408]
将a液和b液进行混合而成的聚合性组合物的制造优选在全息记录介质即将成型前进行。此时,也可以使用基于现有方法的混合技术。另外,在a液和b液的混合时,为了除去残留气体,可以根据需要进行脱气。此外,对于a液和b液,为了分别、或在混合后除去异物、杂质,优选经历过滤工序,更优选将各液分别进行过滤。
[0409]
另外,通过作为异氰酸酯的具有过量的异氰酸酯基的异氰酸酯与多元醇的反应而得到的异氰酸酯官能性预聚物也可作为基体树脂使用。此外,通过作为多元醇的具有过量的异氰酸酯反应性官能团的多元醇与异氰酸酯的反应而得到的异氰酸酯反应性预聚物也可作为基体树脂使用。
[0410]
6-7.关于本发明的全息记录介质
[0411]
使用了本发明的聚合性组合物的本发明的全息记录介质具备记录层,根据需要进一步具备支撑体、其他层。通常,全息记录介质具有支撑体,记录层、其他层被层积在该支撑体上而构成全息记录介质。但是,记录层或其他层具有介质所需要的强度、耐久性的情况下,全息记录介质也可以不具有支撑体。作为其他层的示例,可以举出保护层、反射层、抗反射层(防反射膜)等。
[0412]
6-7-1.记录层
[0413]
本发明的全息记录介质的记录层是由本发明的聚合性组合物形成的层,是记录信息的层。信息通常以全息图的形式进行记录。如后述的记录方法项中所述,该记录层中包含的聚合性化合物(以下记载为聚合性单体)中,由于全息记录等,其一部分发生聚合等化学变化。因此,在记录后的全息记录介质中,聚合性单体的一部分被消耗,以聚合物等反应后的化合物的形式存在。
[0414]
对记录层的厚度没有特别限制,考虑记录方法等适宜地确定即可,优选为1μm以上、进一步优选为10μm以上,并且优选为1cm以下、进一步优选为3mm以下。通过使记录层的厚度为上述下限值以上,具有在进行全息记录介质中的多重记录时能够提高各全息图的选择性、提高多重记录的程度的倾向。通过使记录层的厚度为上述上限值以下,能够使记录层整体均匀地成型,具有能够使各全息图的衍射效率均匀且进行s/n比高的多重记录的倾向。
[0415]
从记录再现性的方面出发,因信息的记录、再生时的曝光所致的记录层的收缩率优选为0.25%以下。
[0416]
6-7-2.支撑体
[0417]
支撑体只要具有全息记录介质所需要的强度和耐久性即可,对其详细情况没有特别限制,可以使用任意的支撑体。
[0418]
对支撑体的形状也没有限制,通常形成为平板状或膜状。
[0419]
对构成支撑体的材料也没有限制,可以为透明的、也可以为不透明的。
[0420]
作为支撑体的材料,若举出透明材料,则可以举出亚克力(丙烯酸类)、聚对苯二甲酸乙二醇酯、聚萘二甲酸乙二醇酯、聚碳酸酯、聚乙烯、聚丙烯、无定形聚烯烃、聚苯乙烯、聚环烯烃、乙酸纤维素等有机材料;玻璃、硅、石英等无机材料。其中优选聚碳酸酯、亚克力(丙烯酸类)、聚酯、无定形聚烯烃、玻璃等,尤其是更优选聚碳酸酯、亚克力(丙烯酸类)、无定形聚烯烃、聚环烯烃、玻璃。
[0421]
作为支撑体的材料,若举出不透明的材料,则可以举出铝等金属、在上述透明支撑体上涂布金、银、铝等金属或者氟化镁、氧化锆等电介质而成的材料等。
[0422]
对支撑体的厚度也没有特别限制,优选为0.05mm以上、1mm以下的范围。支撑体的厚度为上述下限值以上时,能够得到全息记录介质的机械强度,能够防止基板的翘曲。支撑体的厚度为上述上限值以下时,可得到增加光的透射量、削减全息记录介质的重量和成本等优点。
[0423]
可以对支撑体的表面实施表面处理。该表面处理通常用于提高支撑体与记录层的粘接性。作为表面处理的示例,可以举出对支撑体实施电晕放电处理、或在支撑体上预先形成底涂层。作为底涂层的组合物,可以举出卤化苯酚、或者经部分水解的氯乙烯-乙酸乙烯酯共聚物、聚氨酯树脂等。
[0424]
支撑体的表面处理也可以为了提高粘接性以外的目的而进行。作为其示例,例如
可以举出形成以金、银、铝等金属作为材料的反射涂层的反射涂布处理;形成氟化镁或氧化锆等电介质层的电介质涂布处理等。这些层可以以单层形成,也可以形成2层以上。
[0425]
这些表面处理也可以为了控制基板的气体、水分的透过性的目的而进行。例如通过使夹持记录层的支撑体还具有抑制气体或水分的透过性的作用,能够更进一步提高全息记录介质的可靠性。
[0426]
支撑体可以仅设于本发明的全息记录介质的记录层的上侧和下侧的任意一侧,也可以设于这两侧。但是,在支撑体设于记录层的上下两侧的情况下,支撑体中的至少任一者按照可透射活性能量射线(激发光、参照光、再生光等)的方式透明地构成。
[0427]
在记录层的一侧或两侧具有支撑体的全息记录介质的情况下,能够记录透射型或反射型的全息图。在记录层的单侧使用具有反射特性的支撑体的情况下,能够记录反射型的全息图。
[0428]
在支撑体上可以设置数据地址用的图案结构。对这种情况下的图案化方法没有限制,例如可以在支撑体自身形成凹凸,也可以在后述的反射层形成图案,还可以通过将它们组合的方法来形成。
[0429]
6-7-3.保护层
[0430]
保护层是用于防止记录层的记录再生特性的劣化等的层。保护层的具体构成没有限制,可以任意地应用公知的构成。例如可以形成由水溶性聚合物、有机/无机材料等构成的层来作为保护层。
[0431]
保护层的形成位置没有特别限制,例如可以在记录层表面或记录层与支撑体之间形成,也可以在支撑体的外表面侧形成。保护层还可以在支撑体与其他层之间形成。
[0432]
6-7-4.反射层
[0433]
反射层在以反射型构成全息记录介质时形成。在为反射型的全息记录介质的情况下,反射层可以在支撑体与记录层之间形成,也可以在支撑体的外侧面形成,通常优选位于支撑体与记录层之间。
[0434]
作为反射层,可以任意地应用公知的反射层,例如可以使用金属的薄膜等。
[0435]
6-7-5.防反射膜
[0436]
对于透射型和反射型的任一种全息记录介质,均可在信息光、参照光和再生光的入射和出射侧、或者在记录层与支撑体之间设置防反射膜。防反射膜起到提高光的利用效率、且抑制噪声的产生的作用。
[0437]
作为防反射膜,可以任意地使用公知的物质。
[0438]
6-7-6.全息记录介质的制造方法
[0439]
对本发明的全息记录介质的制造方法没有限制。例如可以在无溶剂下将本发明的聚合性组合物涂布至支撑体上来形成记录层,制造出本发明的全息记录介质。此时,作为涂布方法,可以使用任意方法。若举出具体例,则可以举出喷雾法、旋涂法、绕线棒法、浸渍法、气刀涂布法、辊涂法以及刮板涂布法、刮辊涂布法等。
[0440]
在形成记录层时,特别是在形成膜厚较厚的记录层的情况下,可以采用装入模具进行成型的方法、或者涂布在离型膜上并冲压模具的方法。另外,也可以将本发明的聚合性组合物与溶剂或添加剂混合来制备涂布液,将其涂布在支撑体上并进行干燥来形成记录层,进行制造。这种情况下,作为涂布方法,也可以使用任意方法,例如可以采用与上述相同
的方法。
[0441]
涂布液中使用的溶剂没有限制,通常优选使用对于所使用的成分具有充分的溶解度、可赋予良好的涂膜性、不会侵入树脂基板等支撑体的溶剂。溶剂可以单独使用一种,也可以以任意组合和比例合用两种以上。另外,对溶剂的用量没有限制。但是,从涂布效率、处理性的方面出发,优选制备固体成分浓度1~100质量%左右的涂布液。
[0442]
若举出溶剂的示例,则可以举出丙酮、甲基乙基酮、甲基异丁基酮、环己酮、甲基戊基酮等酮系溶剂;甲苯、二甲苯等芳香族系溶剂;甲醇、乙醇、丙醇、正丁醇、庚醇、己醇、二丙酮醇、糠醇等醇系溶剂;二丙酮醇、3-羟基-3-甲基-2-丁酮等酮醇系溶剂;四氢呋喃、二氧六环等醚系溶剂;二氯甲烷、二氯乙烷、氯仿等卤素系溶剂;甲基溶纤剂、乙基溶纤剂、丁基溶纤剂、甲基溶纤剂乙酸酯、乙基溶纤剂乙酸酯等溶纤剂系溶剂;丙二醇单甲醚、丙二醇单乙醚、丙二醇单丁醚、丙二醇单甲基醚乙酸酯、丙二醇单乙基醚乙酸酯、丙二醇单丁醚乙酸酯、二丙二醇二甲醚等丙二醇系溶剂;乙酸乙酯、乙酸丁酯、醋酸戊酯、乙酸丁酯、乙二醇二乙酸酯、乙二酸二乙酯、丙酮酸乙酯、2-羟基丁酸乙酯乙酰乙酸乙酯、乳酸甲酯、乳酸乙酯、2-羟基异丁酸甲酯、3-甲氧基丙酸甲酯等酯系溶剂;四氟丙醇、八氟戊醇、六氟丁醇等全氟烷基醇系溶剂;二甲基甲酰胺、二甲基乙酰胺、n-甲基吡咯烷酮、二甲基亚砜等高极性溶剂;正己烷、正辛烷等链状烃系溶剂;环己烷、甲基环己烷、乙基环己烷、二甲基环己烷、正丁基环己烷、叔丁基环己烷、环辛烷等环状烃系溶剂;或它们的混合溶剂等。
[0443]
作为全息记录介质的制造方法,还可以举出例如下述方法:将在热的作用下熔解的聚合性组合物涂布至支撑体,进行冷却使其固化形成记录层来进行制造的方法;将液态的聚合性组合物涂布至支撑体,使其热聚合,由此使其固化形成记录层来进行制造的方法;将液态的聚合性组合物涂布至支撑体,通过使其光聚合而固化形成记录层来进行制造的方法;等等。
[0444]
这样制造的全息记录介质可以采取自立型板或盘的形态,可以用于三维图像显示装置或衍射光学元件以及大容量存储器等。
[0445]
特别是使用了本发明的聚合性组合物的本发明的全息记录介质具有高totalδn,作为ar眼镜导光板也是有用的。
[0446]
6-7-7.全息记录介质的用途
[0447]
《大容量存储器用途》
[0448]
信息在本发明的全息记录介质上的写入(记录)和读取(再生)通过任何光的照射来进行。
[0449]
在信息记录时,将能够产生聚合性单体的化学变化、即产生其聚合和浓度变化的光用作物体光(也被称为记录光)。
[0450]
例如,在将信息以体积全息图形式进行记录的情况下,将物体光与参照光一起照射至记录层,使记录层中的物体光和参照光发生干涉。由此,利用该干涉光产生记录层内的聚合性单体的聚合和浓度变化,其结果,干涉条纹在记录层内产生折射率差,通过记录在上述记录层内的干涉条纹,以全息图的形式记录于记录层。
[0451]
在进行记录于记录层中的体积全息图的再生的情况下,对记录层照射特定的再生光(通常为参照光)。所照射的再生光对应上述干涉条纹而产生衍射。该衍射光包含与上述记录层同样的信息,因此通过利用适当的检测手段读取上述衍射光,能够进行记录在记录
层的信息的再生。
[0452]
物体光、再生光和参照光的波长区域根据各自的用途为任意的,可以为可见光区域、也可以为紫外区域。这些光中,作为适宜的光,例如可以举出红宝石、玻璃、nd-yag、nd-yvo4等固体激光器;gaas、ingaas、gan等二极管激光器;氦-氖、氩、氪、准分子、co2等的气体激光器;具有色素的染料激光器等单色性和指向性优异的激光器等。
[0453]
物体光、再生光和参照光的照射量均没有限制,只要为能够记录和再生的范围,其照射量为任意的。在照射量极少的情况下,聚合性单体的化学变化过于不完全,具有不能充分表现出记录层的耐热性、机械特性的可能性;反之在照射量极多的情况下,记录层的成分(本发明的聚合性组合物的成分)可能会发生劣化。因此,关于物体光、再生光和参照光,根据记录层的形成中使用的本发明的聚合性组合物的组成、光聚合引发剂的种类和混合量等,以通常为0.1j/cm2以上、20j/cm2以下的范围进行照射。
[0454]
作为全息记录方式,有偏光同轴式全息记录方式、参照光入射角多重型全息记录方式等。将本发明的全息记录介质作为记录介质使用的情况下,利用任一记录方式均能够提供良好的记录品质。
[0455]
《ar眼镜导光板用途》
[0456]
对于本发明的全息记录介质,与上述的大容量存储器用途同样地记录体积全息图。
[0457]
对于记录于记录层的体积全息图,向记录层照射特定的再生光。所照射的再生光对应上述干涉条纹产生衍射。此时,即使再生光的波长与记录光的波长不一致,只要上述干涉条纹和布拉格条件成立,即发生衍射。因此,若根据希望发生衍射的再生光的波长和入射角来记录相对应的干涉条纹,则能够针对广泛波长区域的再生光发生衍射,能够扩展ar眼镜的显示色域。
[0458]
若根据再生光的波长和衍射角来记录相对应的干涉条纹,则能够使从全息记录介质的外部入射的再生光被导波至全息记录介质内部,或者使导波至全息记录介质内部的再生光发生反射、分波、扩大、缩小,或者使导波至全息记录介质内部的再生光射出到全息记录介质的外部,能够扩展ar眼镜的可视角。
[0459]
物体光、再生光的波长区域根据各自的用途为任意的,可以为可见光区域、也可以为紫外区域。这些光中,作为适宜的光,可以举出上述的激光。作为再生光,并不限于激光等,也可以举出液晶显示屏(lcd)或有机电致发光显示屏(oled)等显示装置作为适宜的器件。
[0460]
对物体光、再生光和参照光的照射量均没有限制,只要为能够记录和再生的范围,其照射量为任意的。在照射量极少的情况下,聚合性单体的化学变化过于不完全,具有不能充分表现出记录层的耐热性、机械特性的可能性;反之在照射量极多的情况下,记录层的成分(本发明的聚合性组合物的成分)可能会发生劣化。因此,关于物体光、再生光和参照光,根据记录层的形成中使用的本发明的聚合性组合物的组成、光聚合引发剂的种类和混合量等,以通常为0.1j/cm2以上、20j/cm2以下的范围进行照射。
[0461]
6-8.关于全息记录介质的性能指标
[0462]
全息记录介质的性能以多重记录整体中的衍射效率的总和totalδn作为指标。在透射全息图的情况下,全息图的衍射效率被赋予为衍射光强度相对于透射光强度和衍射光
强度之和的比。根据所得到的衍射效率,使用基于coupled wave theory(h.kogelnik,the bell system technical journal(1969),48,2909-2947)的下述式计算出δn,将多重记录整体中的总和作为totalδn。
[0463]
[数1]
[0464][0465]
totalδn=∑δn
[0466]
此处η为衍射效率,t为介质的厚度,λ为参照光的波长,θ为参照光的入射角。
[0467]
在大容量存储器的情况下,totalδn越高,意味着每单位体积可以记录越多的信息,这可以说是优选的。另外,在ar眼镜用途的情况下,totalδn越高,意味着越能够将投影仪的投影像明亮地传递到眼睛、抑制消耗电力、能够扩展可视角,这可以说是优选的。
[0468]
实施例
[0469]
以下通过实施例更详细地说明本发明。只要不超出其要点,本发明并不限于以下实施例。
[0470]
下文中,对于各化合物附上包括合成过程的化学式对合成方法进行详细说明。
[0471]
[使用原料]
[0472]
实施例和比较例中使用的组合物原料如下。
[0473]
《异氰酸酯》
[0474]
·
duranate(注册商标)tss-100:六亚甲基二异氰酸酯系多异氰酸酯(nco17.6%)(旭化成公司制造)
[0475]
《多元醇》
[0476]
·
placcel pcl-205u:聚己内酯二醇(分子量530)(daicel公司制造)
[0477]
·
placcel pcl-305:聚己内酯三醇(分子量550)(daicel公司制造)
[0478]
《光聚合引发剂》
[0479]
·
hli02:1-(9-乙基-6-环己酰基-9h-咔唑-3-基)-1-(o-乙酰基肟)戊二酸甲酯
[0480]
《自由基捕捉剂》
[0481]
·
tempol:4-羟基-2,2,6,6-四甲基哌啶-1-氧基自由基(东京化成公司制造)
[0482]
《氨基甲酸酯聚合催化剂》
[0483]
·
三(2-乙基己酸)铋的辛酸溶液(有效成分量56质量%)
[0484]
(合成例1)
[0485]
应用日本特开2017-14213号公报中记载的方法,通过以下的合成方法制造作为化合物s-1的双(4-二苯并噻吩基)二硫醚(dbtds),制造作为化合物s-2的4-二苯并噻吩硫醇(dbtsh)。
[0486]
[化16]
[0487][0488]
将二苯并噻吩20g溶解在thf300ml中,在冷却至0℃的同时加入浓度1.6m的正丁基锂己烷溶液74.6ml,升温至20℃,搅拌2小时。将所得到的褐色反应液冷却至-40℃,加入硫(粉末状、和光纯药制)3.8g。在-40℃下搅拌30分钟后,向反应液中加入水5ml,停止反应。
[0489]
将所得到的溶液用蒸发器浓缩,将所得到的固体用甲苯100ml清洗30分钟,滤除黄色固体,制造作为化合物s-1的dbtds。
[0490]
将化合物s-1分散在thf 200ml中后,加入硼氢化钠4.5g,在50℃搅拌1小时。其后将反应液过滤,将所得到的溶液用蒸发器浓缩,加入甲苯200ml。将该甲苯溶液用水、1当量盐酸、1当量氢氧化钠水溶液清洗后,将溶液浓缩。用己烷进行重结晶,得到作为化合物s-2的dbtsh 9.4g(40%收率)。
[0491]
向适量(大概10mg左右)的所得到的化合物s-2中加入数毫升氘代氯仿使其溶解,若有不溶组分则进行棉塞过滤,将溶液转移到专用样品管中并加盖。使用该溶液,利用400mhz的核磁共振装置(nmr)测定氢的共振状态,使各共振线归属于化合物的氢,确认得到了目的物。以下示出测定数据。对于以下记载的各目的物也同样地进行测定,确认得到了目的物。测定数据如下所示。
[0492]1hnmr(400mhz、cdcl3、δ、ppm)3.63(s、1h)、7.35(ar、1h)、7.45(ar、3h)、7.89(ar、1h)、8.05(ar、1h)、8.14(ar、1h)
[0493]
(合成例2)
[0494]
通过以下的合成方法制造作为化合物s-3的双[2-(2-苯并噻唑基)苯基]二硫醚(mpbtd)。
[0495]
[化17]
[0496][0497]
将硫代水杨酸170g和2-氨基苯硫醇165g溶解在多磷酸1.1l中,使混合物在170℃反应2小时。冷却至100℃以下后,注入到3l的水中,进行剧烈搅拌。在室温下搅拌2小时后,将固体物质滤出,将所得到的固体注入到3l的饱和碳酸氢钠水溶液中,搅拌20分钟。滤出固体物质后,进一步注入到3l的水中,进行悬浮清洗,滤出后得到260g的粗产物。
[0498]
将上述粗产物260g和碘化钠1.6g溶解于thf 5l中,对于所得到的混合物,在保持
内温15℃以下的同时缓慢地滴加30%双氧水78ml。在15℃下搅拌15分钟后,通过lc分析确认反应的完成。缓慢加入饱和亚硫酸钠500ml,使反应停止,之后加入水8l,将混合物稀释。滤出所生成的固体物质后,用300ml的去离子水进行2次悬浮清洗,得到约300g的粗产物。
[0499]
将其溶解在thf中后,通过硅胶色谱法进行精制,得到240g的淡黄色固体。利用thf 500ml悬浮清洗后进行过滤,利用20ml的thf进行2次清洗,以白色固体形式得到作为化合物s-3的mpbpd 220g。
[0500]
化合物s-3的nmr测定数据如下。
[0501]1hnmr(400mhz、cdcl3、δ、ppm)7.29(td、2h)、7.35(td、2h)、7.42(td、3h)、7.51(td、2h)、7.83(dd、2h)、7.90(dd、2h)、7.93(dd、2h)、8.13(d、2h)
[0502]
(实施例1)
[0503]
通过以下的合成方法进行化合物m-1的制造。
[0504]
[化18]
[0505][0506]
作为中间体的化合物s-4通过(a)、(b)两条反应路线来制备。
[0507]
反应路线(a):将合成例1中得到的dbtsh(化合物s-2)20g和碳酸铯50g溶解在甲基乙基酮(mek)200ml中。向该溶液中加入三溴化季戊四醇9g,升温至90℃,一边通过lc分析确认反应进行,一边搅拌5小时。向反应溶液中加入水后,加入乙酸乙酯100ml,萃取有机层。将所得到的有机层用水50ml萃取2次,将所生成的水层用乙酸乙酯100ml反相萃取2次。将所得到的有机层用芒硝干燥后进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物s-4:10g(49%收率)。
[0508]
反应路线(b):将合成例1中得到的dbtds(化合物s-1)8.3g、三溴化季戊四醇3.5g、
碳酸钾14g、甲醛次硫酸氢钠(雕白粉)10g悬浮在n,n-二甲基甲酰胺(dmf)25ml中。将反应混合物升温至100℃,一边通过lc分析确认反应进行,一边搅拌3小时。向反应溶液中加入水后,加入乙酸乙酯100ml,萃取有机层。将所得到的有机层用水60ml萃取2次,将所生成的水层用乙酸乙酯70ml反向萃取2次。将所得到的有机层用芒硝干燥后进行浓缩。将通过上述浓缩得到的粗产物利用己烷:乙酸乙酯2:1的混合溶剂进行悬浮清洗,得到化合物s-4:4.8g(61%收率)。
[0509]
化合物s-4的nmr测定数据如下。
[0510]1hnmr(400mhz、cdcl3、δ、ppm)3.38(s、6h)、3.75(d、2h)、7.22(dd、3h)、7.43(ar、9h)、7.77(ar、3h)、7.86(dd、3h)、8.02(ar、3h)
[0511]
将上述得到的化合物s-4(11g)溶解在四氢呋喃(thf)55ml中,加入二月桂酸二丁基锡190mg。向该溶液中加入丙烯酸2-异氰酸根合乙酯(昭和电工公司制造、karenz aoi)2.55g,在室温下进行反应。经过24小时后,追加添加丙烯酸2-异氰酸根合乙酯0.4g,进一步反应24小时。向反应溶液中加入乙酸乙酯100ml,浓缩至达到约50ml。除去不溶物后,将混合物浓缩,将所得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物m-1:7.6g(58%收率)。
[0512]
化合物m-1的nmr测定数据如下。
[0513]1hnmr(400mhz、cdcl3、δ、ppm)3.19(dt、2h)、3.36(s、6h)、4.02(m、2h)、4.21(s、2h)、4.42(m、2h)、5.79(dd、1h)、6.03(dd、1h)、6.37(d、1h)、7.19(ar、3h)、7.38(ar、3h)、7.43(ar、6h)、7.76(ar、3h)、7.84(ar、3h)、8.01(ar、3h)
[0514]
《全息记录介质1的制作》
[0515]
将作为聚合性单体的化合物m-1:0.269g、光聚合引发剂hli02:0.0097g、自由基捕捉剂tempol:3.33mg溶解在duranate(注册商标)tss-100:2.53g中,制成a液。
[0516]
另外将placcel pcl-205u:1.73g和placcel pcl-305:0.74g混合(placcel pcl-205u:placcel pcl-305=70:30(质量比)),溶解三(2-乙基己酸)铋的辛酸溶液:0.3mg,制成b液。
[0517]
将a液、b液分别在减压下在45℃进行2小时脱气后,将a液:2.39g和b液:2.11g搅拌混合,进一步在真空下脱气数分钟。
[0518]
接着,将真空脱气后的上述混合液流入到在对置的2端边部放置有厚度0.5mm的隔离片的载玻片上,在其上放置载玻片,利用夹子将周边固定,在80℃下加热24小时,制作出作为评价用样品的全息记录介质1。该评价用样品是在作为盖体的载玻片间形成了厚度0.5mm的记录层而成的。
[0519]
该全息记录介质1以a液中的异氰酸酯基数与b液中的异氰酸酯反应性基团数之比为1.0进行混配,聚合性单体为58.3μmol/g,光聚合引发剂为3.63μmol/g,自由基捕捉剂为3.63μmol/g。
[0520]
《全息记录介质2的制作》
[0521]
将作为聚合性单体的化合物m-1:0.568g、光聚合引发剂hli02:0.0204g、自由基捕捉剂tempol:7.04mg溶解在duranate(注册商标)tss-100:2.62g中,制成a液。
[0522]
另外将placcel pcl-205u:1.19g和placcel pcl-305:1.19g混合(placcel pcl-205u:placcel pcl-305=50:50(重量比)),溶解三(2-乙基己酸)铋的辛酸溶液:0.3mg,制
成b液。
[0523]
将a液、b液分别在减压下在45℃进行2小时脱气后,将a液:2.58g和b液:1.91g搅拌混合,进一步在真空下脱气数分钟。
[0524]
接着,将真空脱气后的上述混合液流入到在对置的2端边部放置有厚度0.5mm的隔离片的载玻片上,在其上放置载玻片,利用夹子将周边固定,在80℃下加热24小时,制作出作为评价用样品的全息记录介质2。该评价用样品是在作为盖体的载玻片间形成了厚度0.5mm的记录层而成的。
[0525]
该全息记录介质2以a液中的异氰酸酯基数与b液中的异氰酸酯反应性基团数之比为1.0进行混配,聚合性单体为116μmol/g,光聚合引发剂为7.26μmol/g,自由基捕捉剂为7.26μmol/g。
[0526]
[全息记录和评价方法]
[0527]
使用作为评价用样品制作出的全息记录介质1、2,通过以下说明的过程实施全息记录、以及全息记录介质的全息记录性能的评价。
[0528]
关于全息记录,使用波长405nm的半导体激光器,以每1根光束的曝光功率密度为7.5mw/cm2使用图1所示的曝光装置进行双光束平面波的全息记录。使介质从-18
°
旋转到18
°
,对同一位置进行角度多重记录。测定各多重记录中的衍射效率。由所得到的衍射效率计算δn,将多重记录整体中的总和作为totalδn。
[0529]
以下进行详细说明。
[0530]
(全息记录)
[0531]
图1为示出全息记录中使用的装置的概要的构成图。
[0532]
图1中,s为全息记录介质的样品,m1~m3均表示反射镜。pbs表示偏振光分束器,l1表示发出波长405nm的光的记录光用激光源(可得到波长405nm附近的光的toptica photonics制单模激光器(图1中“l1”))。l2表示发出波长633nm的光的再生光用激光源。pd1、pd2以及pd3表示光电检测器。1表示led单元。
[0533]
如图1所示,将波长405nm的光利用偏振光分束器(图中“pbs”)分束,按照2根光束所形成的角为37.3
°
的方式在记录面上交叉。此时按照下述方式进行照射:使2根光束所形成的角的2等分线相对于记录面垂直,进一步使通过分束得到的2根光束的电场矢量的振动面与包含交叉的2根光束的平面垂直。
[0534]
在全息记录后,使用可得到波长633nm的光的he-ne激光器(melles griot公司制造v05-lhp151:图中“l2”),相对于记录面以30.0
°
的角度照射该光,对于衍射出的光使用光电二极管和光电传感放大器(滨松光电子公司制造s2281、c9329:图中“pd1”)进行检测,由此判定是否正确进行了全息记录。
[0535]
(衍射效率的测定)
[0536]
对于样品以相对于光轴移动的角度(双光束,即来自图1的反射镜m1和m2的入射光相交的点的内角的二等分线与来自样品的法线所形成的角度)为-18
°
至18
°
以0.4
°
间隔进行了91次多重记录、或者以0.3
°
间隔进行了121次多重记录。
[0537]
在多重记录后,将led单元(图中1、中心波长405nm)点亮一定时间,由此将残留的引发剂和单体耗尽。将该工序称为后曝光。按照led的功率为100mw/cm2、积分能量为12j/cm2进行照射。
[0538]
全息图的衍射效率被赋予为衍射光强度相对于透射光强度和衍射光强度之和的比。照射来自图1中的反射镜m1的光(波长405nm),计测角度-19
°
到19
°
的衍射效率。根据所得到的衍射效率,使用基于coupled wave theory(h.kogelnik,the bell system technical journal(1969),48,2909-2947)的下述式计算出δn,将多重记录整体中的总和作为totalδn。
[0539]
[数2]
[0540][0541]
totalδn=∑θn
[0542]
在此η为衍射效率,t为介质的厚度,λ为参照光的波长,θ为参照光的入射角(18.65
°
)。
[0543]
使用所准备的多个样品,进行记录初期的照射能量的增减、合计照射能量的增减等照射能量条件的改变来进行多次评价,探索聚合性单体大致被耗尽(在多重记录中totalδn达到大致平衡)的条件,使totalδn达到最大值。并且将所得到的最大值作为该介质的totalδn。
[0544]
(记录前透射率、记录后透射率的测定)
[0545]
通过测定记录前的评价用样品的透射光功率相对于入射光功率的比例来测定记录前透射率。
[0546]
另外,通过测定全息记录后进行了后曝光的评价用样品的透射光功率相对于入射光功率的比例来测定记录后透射率。
[0547]
对于上述全息记录介质1、2利用上述方法进行评价,将结果示于下表1。
[0548]
(实施例2)
[0549]
通过以下的合成方法进行化合物m-2的制造。
[0550]
[化19]
[0551][0552]
将合成例2中得到的化合物s-3(mpbtd)1.12g、三溴化季戊四醇500mg、碳酸钾640mg、甲醛次硫酸氢钠(雕白粉)820mg悬浮在n,n-二甲基甲酰胺(dmf)2.5ml中。将反应混合物升温至80℃,一边通过lc分析确认反应进行,一边搅拌4小时。追加化合物s-3(190mg)和雕白粉140mg,进一步在80℃搅拌2小时。向反应溶液中加入水后,加入乙酸乙酯50ml,萃取有机层。将所得到的有机层用水30ml萃取2次,将所生成的水层用乙酸乙酯50ml反向萃取2次。所得到的有机层用芒硝干燥后进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物s-5:1.17g(93%收率)。
[0553]
化合物s-5的nmr测定数据如下。
[0554]1hnmr(400mhz、cdcl3、δ、ppm)3.17(s、6h)、3.28(t、1h)、3.64(d、2h)、7.23(ar、6h)、7.38(ar、3h)、7.48(ar、6h)、7.85(ar、3h)、7.88(ar、3h)、8.07(ar、3h)
[0555]
将上述得到的化合物s-5(1.8g)溶解在四氢呋喃(thf)9ml中,加入二月桂酸二丁基锡28mg。向该溶液中加入丙烯酸2-异氰酸根合乙酯(昭和电工公司制造、karenz aoi)375mg,在室温下进行反应。经过24小时后,追加添加丙烯酸2-异氰酸根合乙酯375mg,进一步反应24小时。向反应溶液中加入0.1m氢氧化钠水溶液后,加入乙酸乙酯50ml,萃取有机层。将所得到的有机层用水30ml萃取2次,将所生成的水层用乙酸乙酯50ml反向萃取2次。所得到的有机层用硫酸镁干燥后,在25℃以下进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物m-2:0.7g(33%收率)。
[0556]
化合物m-2的nmr测定数据如下。
[0557]1hnmr(400mhz、cdcl3、δ、ppm)3.27(dt、2h)、3.93(s、6h)、4.12(t、2h)、5.25(t、1h)、5.80(dd、1h)、6.10(dd、1h)、6.40(d、1h)、7.16(ar、3h)、7.23(ar、3h)、7.39(ar、6h)、7.48
(ar、3h)、7.85(ar、3h)、7.90(ar、3h)、8.04(ar、3h)
[0558]
除了使用作为聚合性单体的化合物m-2以外,与实施例1同样地制作全息记录介质1,进行其评价。将该结果示于下表1。
[0559]
(实施例3)
[0560]
通过以下的合成方法进行化合物m-3的制造。
[0561]
[化20]
[0562][0563]
将上述实施例1中得到的化合物s-4(1.4g)溶解于四氢呋喃10ml中,加入二月桂酸二丁基锡22mg。向该溶液中加入1,1-(双丙烯酰氧基甲基)乙基异氰酸酯(昭和电工公司制造、karenz bei)550mg,在室温下进行反应。经过24小时后,追加添加1,1-(双丙烯酰氧基甲基)乙基异氰酸酯110mg,进一步反应24小时。向反应溶液中加入饱和碳酸钠水溶液后,加入乙酸乙酯50ml,萃取有机层。将所得到的有机层用水50ml萃取2次,将所生成的水层用乙酸乙酯50ml反向萃取2次。将所得到的有机层用芒硝干燥后,在25℃以下进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)精制后,利用反相柱进一步进行精制,得到化合物m-3:1.5g(81%收率)。
[0564]
化合物m-3的nmr测定数据如下。
[0565]1hnmr(400mhz、cdcl3、δ、ppm)1.23(s、3h)、3.39(s、6h)、4.09(d、2h)、4.20(d、2h)、4.22(s、2h)、4.63(s、1h)、5.76(d、2h)、6.02(dd、2h)、6.35(d、2h)、7.20(ar、3h)、7.39(ar、3h)、7.45(ar、6h)、7.77(ar、3h)、7.86(ar、3h)、8.03(ar、3h)
[0566]
除了使用作为聚合性单体的化合物m-3与后述比较例9中制造的化合物m-9的混合物(摩尔比10/90)以外,与实施例1同样地制作全息记录介质2,进行其评价。将该结果示于下表1。
[0567]
(实施例4)
[0568]
通过以下的合成方法进行化合物m-4的制造。
[0569]
[化21]
[0570][0571]
将上述实施例1中得到的化合物s-4(3.0g)和三乙胺(3.5ml)溶解在二氯甲烷15ml中。将混合物冷却至0℃后,缓慢地滴加溴化溴乙酸540mg。在室温下搅拌1小时后,再次冷却至0℃,向所得到的反应混合物中追加滴加溴化溴乙酸540mg。在室温下搅拌1小时后,依次加入饱和碳酸氢钠水溶液20ml、乙酸乙酯50ml,进行萃取操作。将所得到的有机层用水50ml萃取2次,将所生成的水层用乙酸乙酯50ml反向萃取2次。将所得到的有机层用芒硝干燥后进行浓缩,得到化合物s-6的粗产物2.2g。
[0572]
将该粗产物溶解于丙酮11ml中,加入三乙胺1.6ml。向混合物中缓慢地加入丙烯酸500mg,在室温搅拌1小时。追加添加丙烯酸500mg,进一步搅拌1小时。向反应混合物中加入饱和碳酸氢钠水溶液20ml,用二氯甲烷50ml萃取。将水层重新用二氯甲烷50ml萃取,将所得到的有机层用水60ml清洗。将有机层用芒硝进行干燥-浓缩后,并利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物m-4:440mg(13%收率)。
[0573]
化合物m-4的nmr测定数据如下。
[0574]1hnmr(400mhz、cdcl3、δ、ppm)3.34(s、6h)、4.23(s、2h)、4.27(s、2h)5.76(dd、1h)、6.00(dd、1h)、6.32(d、1h)、7.21(ar、3h)、7.39(ar、3h)、7.43(ar、6h)、7.76(ar、3h)、7.87(ar、3h)、8.01(ar、3h)
[0575]
除了使用作为聚合性单体的化合物m-4以外,与实施例1同样地制作全息记录介质1,进行其评价。将该结果示于下表1。
[0576]
(实施例5)
[0577]
通过以下的合成方法进行化合物m-5的制造。
[0578]
[化22]
[0579][0580]
将2-溴苯硫醇13.60g、三溴化季戊四醇7.08g、碳酸钾9.04g悬浮在n,n-二甲基甲酰胺(dmf)21ml中。将反应混合物升温至100℃,一边通过lc分析确认反应进行,一边搅拌4小时。冷却至室温后,用乙酸乙酯萃取,用水进行清洗。将水层用乙酸乙酯反向萃取2次。将所得到的有机层用芒硝干燥后进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物s-7:13.2g(93%收率)。
[0581]
化合物s-7的nmr测定数据如下。
[0582]1hnmr(400mhz、cdcl3、δ、ppm)3.23(s、6h)、3.79(d、2h)、6.98(ar、3h)、7.19(ar、3h)、7.33(ar、3h)、7.47(ar、3h)
[0583]
将上述得到的化合物s-7(2.0g)、二苯并噻吩-4-硼酸3.5g、碳酸钾2.5g悬浮在thf20ml和水2.0ml中,通过氮气的流通进行脱气。向反应溶液中加入二氯双[二叔丁基(对
二甲基氨基苯基)膦]钯(ii)30mg,进一步通入10分钟氮气。在氮气气氛下将反应溶液加热,在回流下搅拌6小时。冷却至室温后,用乙酸乙酯萃取,用水进行清洗。将水层用乙酸乙酯萃取2次,向所得到的有机层中加入活性炭0.4g,搅拌30分钟。硅藻土过滤后,进行浓缩,将所得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物s-8:2.9g(98%收率)。
[0584]
化合物s-8的nmr测定数据如下。
[0585]1hnmr(400mhz、cdcl3、δ、ppm)2.62(s、6h)、3.00(d、2h)、7.16(ar、12h)、7.41(ar、12h)、7.70(ar、3h)、8.08(ar、3h)、8.15(ar、3h)
[0586]
将上述得到的化合物s-8(2.9g)溶解在四氢呋喃(thf)15ml中,加入二月桂酸二丁基锡40mg。向该溶液中加入丙烯酸2-异氰酸根合乙酯(昭和电工公司制造、karenz aoi)510mg,在室温下进行反应。经过24小时后,追加添加丙烯酸2-异氰酸根合乙酯500mg,进一步反应24小时。向反应溶液中加入水后,加入乙酸乙酯50ml,萃取有机层。将所得到的有机层用水30ml萃取2次,将所生成的水层用乙酸乙酯50ml反向萃取2次。将所得到的有机层用硫酸镁干燥后,在30℃以下进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物m-5:1.5g(45%收率)。
[0587]
化合物m-5的nmr测定数据如下。
[0588]1hnmr(400mhz、cdcl3、δ、ppm)2.53(s、6h)、3.07(m、2h)、3.53(s、2h)、3.99(t、2h)、4.14(dd、1h)、5.81(d、1h)、6.10(dd、1h)、6.40(d、1h)、7.11(ar、12h)、7.24(ar、3h)、7.36(ar、3h)、7.43(ar、6h)、7.71(ar、3h)、8.08(ar、3h)、8.16(ar、3h)
[0589]
除了使用作为聚合性单体的化合物m-5以外,与实施例1同样地制作全息记录介质1,进行其评价。将该结果示于下表1。
[0590]
(实施例6)
[0591]
通过以下的合成方法进行化合物m-6的制造。
[0592]
[化23]
[0593][0594]
将实施例5中得到的化合物s-7(2.0g)、噻蒽-1-硼酸2.7g、碳酸钾2.5g悬浮在thf20ml和水2.0ml中,通过氮气的流通进行脱气。向反应溶液中加入二氯双[二叔丁基(对二甲基氨基苯基)膦基]钯(ii)30mg,进一步通入氮气10分钟。在氮气气氛下将反应溶液加热,在回流下搅拌6小时。冷却至室温后,用乙酸乙酯萃取,用水进行清洗。将水层用乙酸乙酯萃取2次,向所得到的有机层中加入活性炭0.4g,搅拌30分钟。硅藻土过滤后进行浓缩,将所得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物s-9:2.2g(68%收率)。
[0595]
化合物s-9的nmr测定数据如下。
[0596]1hnmr(400mhz、cdcl3、δ、ppm)2.57(m、6h)、2.98(d、2h)、6.99(ar、6h)、7.07(ar、3h)、7.14(ar、12h)、7.22(ar、6h)、7.44(ar、6h)
[0597]
将上述得到的化合物s-9(1.1g)溶解在四氢呋喃(thf)7.5ml中,加入二月桂酸二丁基锡10mg。向该溶液中加入丙烯酸2-异氰酸根合乙酯(昭和电工公司制造、karenz aoi)290mg,在室温下进行反应。经过24小时后,追加添加丙烯酸2-异氰酸根合乙酯300mg,进一步反应24小时。向反应溶液中加入水后,加入乙酸乙酯50ml,萃取有机层。将所得到的有机层用水30ml萃取2次,将所生成的水层用乙酸乙酯50ml反向萃取2次。所得到的有机层用硫酸镁干燥后,在30℃以下进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物m-6:600mg(50%收率)。
[0598]
化合物m-6的nmr测定数据如下。
[0599]1hnmr(400mhz、cdcl3、δ、ppm)2.49(m、6h)、3.23(m、2h)、3.53(s、2h)、4.08(t、2h)、4.52(dd、1h)、5.82(d、1h)、6.08(dd、1h)、6.40(d、1h)、7.10(ar、27h)、7.44(ar、6h)
[0600]
除了使用作为聚合性单体的化合物m-6以外,与实施例1同样地制作全息记录介质1,进行其评价。将该结果示于下表1。
[0601]
(实施例7)
[0602]
通过以下的合成方法进行化合物m-7的制造。
[0603]
[化24]
[0604][0605]
将3-溴苯硫醇4.80g、三溴化季戊四醇2.50g、碳酸钾3.19g悬浮在n,n-二甲基甲酰胺(dmf)13ml中。将反应混合物升温至100℃,一边通过lc分析确认反应进行,一边搅拌4小时。冷却至室温后,用乙酸乙酯萃取,用水进行清洗。将水层用乙酸乙酯反向萃取2次。将所得到的有机层用芒硝干燥后进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物s-10:5.0g(100%收率)。
[0606]
化合物s-10的nmr测定数据如下。
[0607]1hnmr(400mhz、cdcl3、δ、ppm)3.15(s、6h)、3.66(d、2h)、7.09(ar、3h)、7.25(ar、6h)、7.45(ar、3h)
[0608]
将上述得到的化合物s-10(2.3g)、二苯并噻吩-4-硼酸3.2g、碳酸钾2.9g悬浮在thf 23ml和水3ml中,通过氮气的流通进行脱气。向反应溶液中加入二氯双[二叔丁基(对二甲基氨基苯基)膦基]钯(ii)70mg,进一步通入10分钟氮气。在氮气气氛下将反应溶液进行加热,在回流下搅拌6小时。冷却至室温后,用乙酸乙酯萃取,用水进行清洗。将水层用乙酸乙酯萃取2次,向所得到的有机层中加入活性炭0.5g,搅拌30分钟。硅藻土过滤后,进行浓缩,将所得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物s-11:2.9g(87%收率)。
[0609]
化合物s-11的nmr测定数据如下。
[0610]1hnmr(400mhz、cdcl3、δ、ppm)3.37(s、6h)、3.82(d、2h)、7.28(ar、3h)、7.34(ar、3h)、7.41(ar、15h)、7.71(ar、6h)、8.05(ar、3h)、8.11(ar、3h)
[0611]
将上述得到的化合物s-11(2.9g)溶解在四氢呋喃(thf)14.5ml中,加入二月桂酸二丁基锡40mg。向该溶液中加入丙烯酸2-异氰酸根合乙酯(昭和电工公司制造、karenz aoi)850mg,在室温下进行反应。经过24小时后,追加添加丙烯酸2-异氰酸根合乙酯400mg,进一步反应24小时。向反应溶液中加入水后,加入乙酸乙酯100ml,萃取有机层。将所得到的有机层用水50ml萃取2次,将所生成的水层用乙酸乙酯50ml反向萃取2次。将所得到的有机层用硫酸镁干燥后,在30℃以下进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物m-7:1.1g(33%收率)。
[0612]
化合物m-7的nmr测定数据如下。
[0613]1hnmr(400mhz、cdcl3、δ、ppm)3.22(m、2h)、3.37(s、6h)、3.99(t、2h)、4.30(s、2h)、4.70(dd、1h)、5.62(d、1h)、5.82(dd、1h)、6.23(d、1h)、7.27(ar、3h)、7.38(ar、18h)、7.71(ar、6h)、8.05(ar、3h)、8.11(ar、3h)
[0614]
除了使用作为聚合性单体的化合物m-7以外,与实施例1同样地制作全息记录介质1,进行其评价。将该结果示于下表1。
[0615]
(实施例8)
[0616]
通过以下的合成方法进行化合物m-8的制造。
[0617]
[化25]
[0618][0619]
将实施例7中得到的化合物s-10(1.0g)、噻蒽-1-硼酸1.6g、磷酸钾2.9g悬浮在甲苯14ml、乙醇7ml和水7ml中,通过氮气的流通进行脱气。向反应溶液中加入二氯双[二叔丁基(对二甲基氨基苯基)膦基]钯(ii)30mg,进一步通入10分钟氮气。在氮气气氛下将反应溶液加热,在回流下搅拌6小时。冷却至室温后,用乙酸乙酯萃取,用水进行清洗。将水层用乙酸乙酯萃取2次,向所得到的有机层中加入活性炭0.5g,搅拌30分钟。硅藻土过滤后,进行浓缩,将所得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物s-12:1.6g(98%收率)。
[0620]
化合物s-12的nmr测定数据如下。
[0621]1hnmr(400mhz、cdcl3、δ、ppm)3.27(s、6h)、3.73(d、2h)、7.01(ar、9h)、7.09(ar、6h)、7.19(ar、6h)、7.31(ar、6h)、7.38(ar、6h)
[0622]
将上述得到的化合物s-12(1.6g)溶解在四氢呋喃(thf)8.0ml中,加入二月桂酸二丁基锡20mg。向该溶液中加入丙烯酸2-异氰酸根合乙酯(昭和电工公司制造、karenz aoi)650mg,在室温下进行反应。经过24小时后,追加添加丙烯酸2-异氰酸根合乙酯650mg,进一步反应24小时。向反应溶液中加入水后,加入乙酸乙酯60ml,萃取有机层。将所得到的有机层用水30ml萃取2次,将所生成的水层用乙酸乙酯50ml反向萃取2次。所得到的有机层用硫酸镁干燥后,在30℃以下进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物m-8:1.0g(54%收率)。
[0623]
化合物m-8的nmr测定数据如下。
[0624]1hnmr(400mhz、cdcl3、δ、ppm)3.23(m、2h)、3.35(s、6h)、4.00(t、2h)、4.29(s、2h)、4.89(dd、1h)、5.68(d、1h)、5.86(dd、1h)、6.26(d、1h)、7.07(ar、9h)、7.19(ar、12h)、7.34(ar、6h)、7.45(ar、6h)
[0625]
除了使用作为聚合性单体的化合物m-8以外,与实施例1同样地制作全息记录介质1,进行其评价。将该结果示于下表1。
[0626]
(比较例1)
[0627]
通过以下的合成方法进行化合物m-9的制造。
[0628]
[化26]
[0629][0630]
将上述合成例1中得到的化合物s-2(dbtsh)5g和叔丁醇钾2.7g溶解在n,n-二甲基甲酰胺(dmf)50ml中。向该溶液中加入三溴化季戊四醇2.25g,升温至80℃,一边通过lc分析确认反应进行,一边搅拌5小时。进一步将反应溶液冷却至0℃,加入三乙胺1.3ml、丙烯酰氯0.68ml,升温至20℃,搅拌3小时。向反应溶液中加入水50ml后,加入乙酸乙酯150ml,萃取有机层。将所得到的有机层用1当量盐酸、1当量氢氧化钠水溶液清洗后,进行浓缩。将通过上述浓缩得到的粗产物利用硅胶柱(己烷-乙酸乙酯)进行精制,得到化合物m-9:2.3g(43%收率)。
[0631]
化合物m-9的nmr测定数据如下。
[0632]1hnmr(400mhz、cdcl3、δ、ppm)3.41(s、6h)、4.23(s、2h)、5.46(d、1h)、5.67(dd、1h)、6.01(d、1h)、7.17(ar、3h)、7.38(ar、9h)、7.76(ar、3h)、7.83(ar、3h)、8.05(ar、3h)
[0633]
除了使用作为聚合性单体的化合物m-9以外,与实施例1同样地制作全息记录介质1,2,进行其评价。将该结果示于下表1。
[0634]
[表1]
[0635][0636]
全息记录介质1中,聚合性组合物中的聚合性单体、光聚合引发剂、添加剂的摩尔浓度一致,仅改变了聚合性单体的种类。
[0637]
比较例1中,totalδn为0.0123。实施例1、2、4~8中,totalδn分别为0.0175、0.0180、0.0140、0.0187、0.0213、0.0209、0.0211,与比较例1的情况相比,增加至约1.1~1.7倍。
[0638]
如上所述,在ar眼镜导光板的光学元件用途中,totalδn越高,越能够明亮地得到投影图像,能够扩宽可视角。例如,δn=1.7倍(0.0123
→
0.0213)时,以衍射效率计相当于2.1倍,意味着投影像的亮度提高至2.1倍。这意味着,在相同投影像亮度的情况下,消耗电力为0.5倍、或者电池的使用时间延长到2.1倍。
[0639]
另外,在存储器用途中,totalδn的提高能够使记录容量提高。
[0640]
因此,在将全息记录介质用于这些用途时,可以说实施例中使用的本发明的化合物优于比较例的化合物。
[0641]
全息记录介质2中,与全息记录介质1相比,改变了聚合性组合物中的多元醇的混配比,并且使聚合性单体、光聚合引发剂、添加剂的摩尔浓度分别增至2倍。
[0642]
在作为聚合性单体仅使用化合物m-9的比较例1中,totalδn为0.0191。
[0643]
另一方面,在使用了化合物m-1的实施例1中,totalδn为0.0269;在将作为聚合性单体的化合物m-3与化合物m-9以摩尔比10:90进行混合的实施例3中,totalδn为0.0260,与比较例1的情况相比,增加至约1.4倍。
[0644]
因此可以说,即使改变多元醇的混配比、聚合性单体、光聚合引发剂、自由基捕捉剂的浓度,本发明的化合物也比比较例的化合物更适于在全息记录介质中的使用。
[0645]
[折射率]
[0646]
通过以下的方法测定在实施例和比较例中作为单体使用的化合物的折射率。
[0647]
将试样按照规定浓度溶解在丙烯酸3-苯氧基苄酯和三羟甲基丙烷三甲基丙烯酸
酯的质量比4∶1的混合溶液中,制备试验溶液。试验溶液为试样浓度10质量%、20质量%这两种。利用kalnew精密折射计(岛津制作所社产品名:kpr-2000)对各试验溶液的折射率进行测定。设试验溶液的温度为23℃、测定波长为氦灯d线(587.6nm)。基于测定结果制作表示试样浓度与折射率的相关性的校正曲线,根据所得到的校正曲线求出试样浓度为100质量%时的折射率,将其作为试样的折射率。
[0648]
[表2]
[0649] 化合物折射率实施例1m-11.679实施例2m-21.685实施例3m-31.666实施例5m-51.692实施例6m-61.672实施例7m-71.691实施例8m-81.679比较例1m-91.720
[0650]
[折射率推算值]
[0651]
对于实施例和比较例中作为聚合性单体使用的化合物进行固化后的折射率推算。软件使用dtw associates,inc制polymer-desgin tools version1.1,通过bicerano法推算出在25℃、589nm下的折射率值。将该值示于下表3。
[0652]
得到了与上述测定值等同的值。
[0653]
[表3]
[0654] 化合物固化后折射率推算值实施例1m-11.699实施例2m-21.676实施例4m-41.702比较例1m-91.719
[0655]
实施例的化合物的折射率稍低于比较例的化合物,但如上所述,全息记录介质的totalδn为更高的值。由该结果可知,本发明的化合物的聚合性优于比较例的化合物。
[0656]
本发明的化合物m-1中,三(硫代二苯并噻吩)基利用氨基甲酸酯键进行键合,本发明的化合物m-4中,三(硫代二苯并噻吩)基利用酯键进行键合,可以认为,由于与丙烯酸酯基的空间距离远等原因,因此丙烯酸酯基不容易受到立体位阻的影响,聚合性优异。另外可认为,在化合物m-2、m-3、m-5~m-8中,也由于同样的理由,聚合性优异。
[0657]
另一方面可以认为,在三(硫代二苯并噻吩)基利用乙基键合的比较例的化合物m-9中,丙烯酸酯基容易受到立体位阻的影响,因此发生了聚合性的降低。
[0658]
尽管使用特定的方式详细地说明了本发明,但对本领域技术人员来说,显然可在不脱离本发明的意图和范围的前提下进行各种变形。
[0659]
本技术基于2019年11月19日提交的日本专利申请2019-208980,以引用的方式援用其全部内容。
[0660]
符号的说明
[0661]
s 全息记录介质
[0662]
m1、m2、m3 反射镜
[0663]
l1 记录光用半导体激光源
[0664]
l2 再生光用激光源
[0665]
pd1、pd2、pd3 光电检测器
[0666]
pbs 偏振光分束器
[0667]
1 led单元
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。