含有nizo b40样eps基因簇的质地化乳酸乳球菌
技术领域
1.本发明涉及新的乳酸乳球菌(lactococcus lactis)乳酸菌菌株,其具有改善的质地化性质。本发明还涉及使用所述菌株制造食品产品的方法和包含所述菌株的食品产品。
背景技术:
2.乳酸菌(lab)由食品工业广泛用于食品的发酵。通过lab将鲜乳转化成发酵乳是延长乳的寿命并提供味道和质地的方式。
3.因此,用于乳发酵的菌株重要特征包括快速酸化,稳定(无/低)后酸化,长保存期限和优良质地。优良质地通常是高口腔厚度和粘度(使用流变仪测量为高剪切应力)以及高凝胶硬度。
4.一些lab菌株显著有助于改善质地,这与它们产生外-(或细胞外)多糖(eps)的能力有关,eps可以是荚膜(以荚膜的形式保持附着于细胞) 或分泌到培养基中。eps由单一类型的糖(同型-胞外多糖)组成或由不同的糖(异型-胞外多糖)构成的重复单元组成。生产eps的lab是受关注的,因为eps作为发酵食品的天然增粘剂和质地增强剂。此外,来自具有确定流变性质的食品级lab的eps有开发和利用为食品添加剂的潜力。已知eps通过影响粘度、脱水收缩、硬度和感官性质来改善lab发酵产品的流变性质。主要结构特征(单糖类型和构型,糖苷键,非糖修饰,电荷),构象和分子量,多糖的量以及多糖与其他系统组分的相互作用都是可能有助于和影响所展示的技术功能性质的因素(zeidan等人,2017)。
5.发酵乳可以由嗜中温lab,例如乳球菌属菌种(lactococcus sp.)产生,其导致产生例如酸乳(sour milk)或嗜热lab,例如用于酸奶(yoghurt) 的嗜热链球菌(streptococcus thermophilus)和德氏乳杆菌保加利亚亚种(lactobacillus delbruckii subsp.bulgaricus)。用嗜中温发酵剂培养物诸如乳酸乳球菌制备的乳制品诸如新鲜乳酪(fresh cheese)、酪乳(butter milk)、酸乳和酸奶油(sour cream)是消费者普遍需求的。另外,乳品替代产品的市场正在增长,其中用乳酸乳球菌(l.lactis)发酵的植物主要成分可以发挥作用。具有乳糖不耐受和牛奶过敏的消费者,以及关注牛奶激素和胆固醇,动物康乐和动物基食品对环境的影响的消费者在不断增加的需求中发挥作用。而且,据推测以植物为主的饮食比以肉为主的饮食更健康(tangyu等人,2019)。
6.wo 2017/108679涉及新的菌株乳酸乳球菌乳酸亚种(lactococcuslactis subsp.lactis)dsm 29291,其在根据tadm和流变仪两项测试的八个不同的乳酸乳球菌乳酸亚种(l.lactis subsp.lactis)菌株中具有最高的剪切应力(参见wo 2017/108679的实施例1和图1)。
7.由于嗜中温培养物用于发酵乳产品,并且质地是重要参数,因此需要进一步质地化嗜中温菌株,特别是改善的质地化嗜中温菌株,例如质地化乳酸乳球菌菌株。
技术实现要素:
8.在第一方面,本发明涉及一种乳酸乳球菌乳酸菌(lab)菌株,其包含能够产生胞外
多糖(eps)的活性eps基因簇,其中所述eps基因簇选自:
9.(i)如seq id no.:1所限定的核苷酸序列;
10.(ii)如seq id no.:2所限定的核苷酸序列,或与如seq id no.:2所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;
11.(iii)如seq id no.:3所限定的核苷酸序列,或与如seq id no.:3 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;
12.(iv)如seq id no.:4所限定的核苷酸序列,或与如seq id no.:4所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;和
13.(v)如seq id no.:5所限定的核苷酸序列,或与如seq id no.:5所限定的核苷酸序列相差不多于5个核苷酸的核苷酸序列,
14.其中,包含如seq id no.:1所限定的活性eps基因簇的所述乳酸乳球菌lab菌株属于mlst(多位点序列分型)组st76,其中如本说明书的实施例4中所述进行mlst分析,即,用在科汉森开发的12基因mlst方案。所述方案基于选自乳酸杆菌科的核心基因组的12个基因dnak、fusa、 groel、gyra、gyrb、iles、lepa、phes、reca、rpoa、rpob和rpoc(salvetti 等人,2018)。在此方案中使用了总共22493bp,因此其几乎占平均乳球菌属(lactococcus)基因组的1%。用illumina全基因组序列进行mlst 分型是在clc微生物基因组学模块的帮助下进行的,该模块是clc基因组学工作台v10(clc genomics workbench v10)的插件。在clc中,将mlst 整合到科汉森定制设计的标准基因组序列分析流水线中。它在从头重叠群 (contigs)和参考组件上都执行。
15.在第二方面,本发明涉及一种组合物,其包含至少一种如上所述根据本发明的乳酸菌菌株。
16.优选地,本发明的组合物包含至少一种如上所述根据本发明的乳酸菌菌株和至少一种包含能够产生胞外多糖(eps)的活性eps基因簇的另外的乳酸菌菌株(也称为“辅助菌株”或“共酸化剂菌株”),其中所述另外的乳酸菌菌株(“辅助菌株”或“共酸化剂菌株”)能够(i)在约15 h或更短时间内,优选在约12h或更短时间内,生成ph约4.55的发酵乳,并且能够(ii)生成具有以剪切速率300s-1
测量的40pa或更大剪切应力的发酵乳,在以下条件下测量:
17.将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph 4.55((i),达到ph 4.55的时间),然后在4℃下储存直到测量剪切应力,通常1-7天,诸如5天,然后轻轻搅拌并以剪切速率300 s-1
测量剪切应力((ii),剪切应力),其中所述接种温度是30℃。
18.更优选地,根据本发明第二方面的组合物包含至少一种根据本发明的乳酸乳球菌乳酸菌菌株与(a)包含能够产生胞外多糖(eps)的活性eps 基因簇的乳酸菌菌株的组合,其中所述eps基因簇包含如(vi)所限定的核苷酸序列(a)、(b)和(c)(c1至c4),或与(b)包含能够产生胞外多糖(eps)的活性eps基因簇的乳酸菌菌株乳酸乳球菌的组合,其中所述eps基因簇如(vii)所限定:
19.(vi)(a):编码具有聚合酶活性并与seq id no:1的核苷酸6955
‑ꢀ
8145(本文中称为wzy)编码的氨基酸序列具有至少95%同一性的多肽的核苷酸序列;
20.(b):编码具有多糖转运蛋白活性并与seq id no:1的核苷酸9309
‑ꢀ
10727(本文中称为wzx)编码的氨基酸序列具有至少95%同一性的多肽的核苷酸序列;和
21.(c):编码具有糖基转移酶(gt)活性的多肽的核苷酸序列,其包含:
22.(c1):与seq id no:1的核苷酸4008-4478编码的氨基酸序列(本文中称为gt1)具有至少95%同一性的核苷酸序列;
23.(c2):与seq id no:1的核苷酸4478-4960编码的氨基酸序列(本文中称为gt2)具有至少95%同一性的核苷酸序列;
24.(c3):与seq id no:1的核苷酸5015-5965编码的氨基酸序列(本文中称为gt3)具有至少95%同一性的核苷酸序列;和
25.(c4):与seq id no:1的核苷酸6026-6955编码的氨基酸序列(本文中称为gt4)具有至少95%同一性的核苷酸序列;
26.(vii)如seq id no.:5所限定的核苷酸序列。
27.本发明的组合物可以包含其他组分,诸如低温防护剂 (cryoprotectant)、冻干保护剂、抗氧化剂、营养素、填充剂、调味剂或其混合物,详细描述如下。
28.在第三方面,本发明涉及本发明的乳酸菌菌株和/或本发明的组合物用于增加发酵乳产品的粘度(如本发明所述,以剪切速率300s-1
测量的剪切应力)的用途。第三方面还涉及乳酸乳球菌乳脂亚种菌株dsm 25485和 /或乳酸乳球菌乳酸亚种菌株dsm 33192用于增加发酵乳产品的粘度(如本发明所述,以剪切速率300s-1
测量的剪切应力)的用途。发酵乳产品可以是哺乳动物基的发酵乳产品(即,发酵的乳基具有哺乳动物来源)或植物基的发酵乳产品(即,发酵的乳基源自植物,诸如豆乳)。
29.在第四方面,本发明涉及生产食品产品的方法,其包含至少一个阶段,其中使用至少一种如本发明第一方面所限定的乳酸菌菌株和/或如本发明第二方面所限定的组合物。本发明还涉及包含至少一种如本发明第一方面所限定的乳酸菌菌株和/或如本发明第二方面所限定的组合物的食品产品。食品产品可以包含另外的组分,诸如增稠剂或稳定剂或其混合物,详细描述如下。
30.在第五方面,本发明涉及一种制造乳酸乳球菌乳酸菌(lab)菌株的方法,其包含以下步骤:
31.(a)提供乳酸乳球菌乳酸菌(lab)菌株,其包含能够产生胞外多糖 (eps)的活性eps基因簇,其中所述eps基因簇选自:
32.(i)如seq id no.:1所限定的核苷酸序列;
33.(ii)如seq id no.:2所限定的核苷酸序列,或与如seq id no.:2 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;
34.(iii)如seq id no.:3所限定的核苷酸序列,或与如seq id no.:3 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;
35.(iv)如seq id no.:4所限定的核苷酸序列,或与如seq id no.:4 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;和
36.(v)如seq id no.:5所限定的核苷酸序列,或与如seq id no.:5 所限定的核苷酸序列相差不多于5个核苷酸的核苷酸序列;
37.(b)筛选乳酸乳球菌乳酸菌菌株(lab),所述菌株
38.(i)能够生成具有以剪切速率300s-1
测量的40pa或更大,优选50 pa或更大,更优选55pa或更大,甚至更优选大于56pa,诸如60pa、 61pa、62pa、63pa、64pa,65pa、66pa、67pa、
68pa、69pa、70 pa、75pa、80pa、85pa、86pa、87pa、88pa、89pa、90pa、95pa、 98pa、100pa、105pa、110pa、115pa、120pa或121pa或更大剪切应力的发酵乳,在以下条件下测量:
39.将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph 4.55,然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃;和/或
40.(ii)能够生成具有以剪切速率300s-1
测量的大于24pa,诸如约35 pa、36pa、45pa、47pa、54pa、56pa、57pa、60pa、62pa、63pa、 64pa、71pa、74pa、75pa、79pa、86pa、88pa、93pa、96pa、99 pa、102pa、106pa或更大剪切应力的发酵乳,在以下条件下测量:
41.将200ml添加2%葡萄糖的豆乳(如实施例2中所述)用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph~4.55(例如ph 4.49、 4.53、4.54、4.55或4.66),然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃。使用实施例2中所示的方法测量剪切应力。
附图说明
42.图1:乳酸乳球菌乳脂菌珠b40中的eps基因簇(pnz4000,genbankaf036485)。所用的命名法是由zeidan等人提出的命名法(2017)。
43.图2:显示菌株之间的差异。clustervis是一种用于可视化多元数据聚类的网络工具(https://biit.cs.ut.ee/clustvis/),其使用标准参数用于分析。乳酸化(milk acidification)数据(最小ph、vmax),菌株在不同碳源上生长的能力,质地化能力,噬菌体抗性和乳酸链球菌肽敏感性数据用于作图。(a)使用pga方法“带插补的svd”计算主成分。将单位方差缩放应用于行。x和y轴显示主成分1和主成分2,它们分别说明总方差的43.2%和21.3%。n=21个代表菌株的数据点。(b)对于热图构建,行居中;将单位方差缩放应用于行。行和列都使用相关距离和平均连琐进行聚类。25行代表不同的实验,21列代表菌株。
44.图3:用于表征菌株的质地化性质,乳酸化性质和培养基(例如;c源) 偏好的实验设置在96孔微量滴定板型中。将添加了ph指示剂的乳在微量滴定板中发酵,其在30℃下在平台式扫描仪上孵育;每6分钟扫描板底部,并且颜色的发展与乳中的ph变化相关(详见poulsen等人,2019)。使用液体处理机器人hamilton的tadm工具评估菌珠质地化性质,其中在移液样品过程中获得的压力与时间曲线用于评估样品的相对剪切应力。具有最高相对剪切应力的样品由具有最低压力值(pa)或最高曲线面积的抽吸曲线表示(详见poulsen等人,2019)。对于选择的样品,使用流变仪在200-ml规模上进行乳酸化直到ph 4.55并进行剪切应力测量。通过电极测量乳ph,并使用流变仪测量发酵乳的剪切应力。
45.序列表简要说明
46.seq id no:1列出乳酸乳球菌菌株dsm 33204、dsm 33205、dsm 33220、 dsm 33221、dsm 33218、dsm 33219、dsm 33224、dsm 33197、dsm 33196、 dsm 33195、dsm33194、dsm33226、dsm33193和dsm33192的eps基因簇的完整序列。
47.seq id no:2列出乳酸乳球菌菌株dsm 33200、dsm 33201、dsm 33202 和dsm 33203的eps基因簇的完整序列。
48.seq id no:3列出乳酸乳球菌菌株dsm 33222的eps基因簇的完整序列。
33193和dsm 33192的wzy基因编码的氨基酸序列(seq id no.:1的核苷酸6955-8145);
62.seq id no:17列出dsm 33204、dsm 33205、dsm 33220、dsm 33221、 dsm 33218、dsm 33219、dsm 33224、dsm 33197、dsm 33196、dsm 33195、 dsm 33194、dsm 33226、dsm 33193和dsm 33192的推定甘油磷酸转移酶 (glyphos trans)家族蛋白的氨基酸序列(seq id no.:1的核苷酸8132
‑ꢀ
9322);
63.seq id no:18列出由dsm 33204、dsm 33205、dsm 33220、dsm 33221、 dsm 33218、dsm 33219、dsm 33224、dsm 33197、dsm 33196、dsm 33195、 dsm 33194、dsm 33226、dsm 33193和dsm 33192的wzx基因编码的氨基酸序列(seq id no.:1的核苷酸9309-10727);
64.seq id no:19列出由dsm 33204、dsm 33205、dsm 33220、dsm 33221、 dsm 33218、dsm 33219、dsm 33224、dsm 33197、dsm 33196、dsm 33195、 dsm 33194、dsm 33226、dsm 33193和dsm 33192的epsl基因编码的氨基酸序列(seq id no.:1的核苷酸10825-11724);
65.seq id no:20列出dsm 33204、dsm 33205、dsm 33220、dsm 33221、 dsm 33218、dsm 33219、dsm 33224、dsm 33197、dsm 33196、dsm 33195、 dsm 33194、dsm 33226、dsm 33193和dsm 33192的lytr蛋白的氨基酸序列(seq id no.:1的互补链的核苷酸11749-12651);
66.seq id no:21列出由dsm 33200、dsm 33201、dsm 33202和dsm 33203 的epsr基因编码的氨基酸序列(seq id no.:2的核苷酸1-318);
67.seq id no:22列出由dsm 33200、dsm 33201、dsm 33202和dsm 33203 的epsx基因编码的氨基酸序列(seq id no.:2的核苷酸407-826);
68.seq id no:23列出由dsm 33200、dsm 33201、dsm 33202和dsm 33203 的epsc基因编码的氨基酸序列(seq id no.:2的核苷酸993-1772);
69.seq id no:24列出由dsm 33200、dsm 33201、dsm 33202和dsm 33203 的epsd基因编码的氨基酸序列(seq id no.:2的核苷酸1782-2477);
70.seq id no:25列出由dsm 33200、dsm 33201、dsm 33202和dsm 33203 的epsb基因编码的氨基酸序列(seq id no.:2的核苷酸2532-3296);
71.seq id no:26列出由dsm 33200、dsm 33201、dsm 33202和dsm 33203 的epse基因编码的氨基酸序列(seq id no.:2的核苷酸3318-3998);
72.seq id no:27列出dsm 33200、dsm 33201、dsm 33202和dsm 33203 的推定糖基转移酶(gt1)的氨基酸序列(seq id no.:2的核苷酸4008
‑ꢀ
4478);
73.seq id no:28列出dsm 33200、dsm 33201、dsm 33202和dsm 33203 的推定糖基转移酶(gt2)的氨基酸序列(seq id no.:2的核苷酸4478
‑ꢀ
4960);
74.seq id no:29列出dsm 33200、dsm 33201、dsm 33202和dsm 33203 的推定糖基转移酶(gt3)的氨基酸序列(seq id no.:2的核苷酸5015
‑ꢀ
5965);
75.seq id no:30列出dsm 33200、dsm 33201、dsm 33202和dsm 33203 的推定糖基转移酶(gt4)的氨基酸序列(seq id no.:2的核苷酸6026
‑ꢀ
6955);
76.seq id no:31列出由dsm 33200、dsm 33201、dsm 33202和dsm 33203 的wzy基因编码的氨基酸序列(seq id no.:2的核苷酸6955-8145);
77.seq id no:32列出dsm 33200、dsm 33201、dsm 33202和dsm 33203 的推定甘油磷酸转移酶(glyphos trans)家族蛋白的氨基酸序列(seq id no.:2的核苷酸8132-9322);
78.seqidno:33列出由dsm33200、dsm33201、dsm33202和dsm33203的wzx基因编码的氨基酸序列(seqidno.:2的核苷酸9309-10727);
79.seqidno:34列出由dsm33200、dsm33201、dsm33202和dsm33203的epsl基因编码的氨基酸序列(seqidno.:2的核苷酸10825-11724);
80.seqidno:35列出dsm33200、dsm33201、dsm33202和dsm33203的lytr蛋白的氨基酸序列(seqidno.:2的互补链的核苷酸11749-12651);
81.seqidno:36列出由dsm33222的epsr基因编码的氨基酸序列(seqidno.:3的核苷酸1-318)
82.seqidno:37列出由dsm33222的epsx基因编码的氨基酸序列(seqidno:3的核苷酸407-826);
83.seqidno:38列出由dsm33222的epsc基因编码的氨基酸序列(seqidno:3的核苷酸993-1772);
84.seqidno:39列出由dsm33222的epsd基因编码的氨基酸序列(seqidno:3的核苷酸1782-2477):
85.seqidno:40列出由dsm33222的epsb基因编码的氨基酸序列(seqidno:3的核苷酸2532-3296);
86.seqidno:41列出由dsm33222的epse基因编码的氨基酸序列(seqidno:3的核苷酸3318-3998);
87.seqidno:42列出dsm33222的推定糖基转移酶(gt1)的氨基酸序列(seqidno.:3的核苷酸4008-4478);
88.seqidno:43列出dsm33222的推定糖基转移酶(gt2)的氨基酸序列(seqidno.:3的核苷酸4478-4960);
89.seqidno:44列出dsm33222的推定糖基转移酶(gt3)的氨基酸序列(seqidno.:3的核苷酸5015-5965);
90.seqidno:45列出dsm33222的推定糖基转移酶(gt4)的氨基酸序列(seqidno.:3的核苷酸6026-6955);
91.seqidno:46列出由dsm33222的wzy基因编码的氨基酸序列(seqidno.:3的核苷酸6955-8145);
92.seqidno:47列出dsm33222的推定甘油磷酸转移酶(glyphostrans)家族蛋白的氨基酸序列(seqidno.:3的核苷酸8132-9322);
93.seqidno:48列出由dsm33222的wzx基因编码的氨基酸序列(seqidno.:3的核苷酸9309-10727);
94.seqidno:49列出由dsm33222的epsl基因编码的氨基酸序列(seqidno.:3的核苷酸10825-11724);
95.seqidno:50列出dsm33222的lytr蛋白的氨基酸序列(seqidno.:3的互补链的核苷酸11749-12651);
96.seqidno:51列出由dsm33225的epsr基因编码的氨基酸序列(seqidno.:4的核苷酸1-318);
97.seqidno:52列出由dsm33225的epsx基因编码的氨基酸序列(seqidno.:4的
核苷酸407-826);
98.seqidno:53列出由dsm33225的epsc基因编码的氨基酸序列(seqidno.:4的核苷酸993-1772);
99.seqidno:54列出由dsm33225的epsd基因编码的氨基酸序列(seqidno.:4的核苷酸1782-2477);
100.seqidno:55列出由dsm33225的epsb基因编码的氨基酸序列(seqidno.:4的核苷酸2532-3296);
101.seqidno:56列出由dsm33225的epse基因编码的氨基酸序列(seqidno.:4的核苷酸3318-3998);
102.seqidno:57列出dsm33225的推定糖基转移酶(gt1)的氨基酸序列(seqidno.:4的核苷酸4008-4478);
103.seqidno:58列出dsm33225的推定糖基转移酶(gt2)的氨基酸序列(seqidno.:4的核苷酸4478-4960);
104.seqidno:59列出dsm33225的推定糖基转移酶(gt3)的氨基酸序列(seqidno.:4的核苷酸5015-5965);
105.seqidno:60列出dsm33225的推定糖基转移酶(gt4)的氨基酸序列(seqidno.:4的核苷酸6026-6955);
106.seqidno:61列出由dsm33225的wzy基因编码的氨基酸序列(seqidno.:4的核苷酸6955-8145);
107.seqidno:62列出dsm33225的推定甘油磷酸转移酶(glyphostrans)家族蛋白的氨基酸序列(seqidno.:4的核苷酸8132-9322);
108.seqidno:63列出由dsm33225的wzx基因编码的氨基酸序列(seqidno.:4的核苷酸9309-10727):
109.seqidno:64列出由dsm33225的epsl基因编码的氨基酸序列(seqidno.:4的核苷酸10825-11724);
110.seqidno:65列出dsm33225的lytr蛋白的氨基酸序列(seqidno.:4的互补链的核苷酸11749-12651);
111.seqidno:66列出由dsm33133的epsr基因编码的氨基酸序列(seqidno.:5的核苷酸1-318);
112.seqidno:67列出由dsm33133的epsx基因编码的氨基酸序列(seqidno.:5的核苷酸407-826);
113.seqidno:68列出由dsm33133的epsc基因编码的氨基酸序列(seqidno.:5的核苷酸993-1772):
114.seqidno:69列出由dsm33133的epsd基因编码的氨基酸序列(seqidno.:5的核苷酸1782-2477);
115.seqidno:70列出由dsm33133的epsb基因编码的氨基酸序列(seqidno.:5的核苷酸2532-3296);
116.seqidno:71列出由dsm33133的epse基因编码的氨基酸序列(seqidno.:5的核苷酸3318-3998);
117.seqidno:72列出dsm33133的推定糖基转移酶(gt1)的氨基酸序列(seqidno.:5的核苷酸4008-4478);
118.seqidno:73列出dsm33133的推定糖基转移酶(gt2)的氨基酸序列(seqidno.:5的核苷酸4478-4960);
119.seqidno:74列出dsm33133的推定糖基转移酶(gt3)的氨基酸序列(seqidno.:5的核苷酸5015-5965);
120.seqidno:75列出dsm33133的推定糖基转移酶(gt4)的氨基酸序列(seqidno.:5的核苷酸6026-6955);
121.seqidno:76列出由dsm33133的wzy基因编码的氨基酸序列(seqidno.:5的核苷酸6955-8145);
122.seqidno:77列出dsm33133的推定甘油磷酸转移酶(glyphostrans)家族蛋白的氨基酸序列(seqidno.:5的核苷酸8132-9322);
123.seqidno:78列出由dsm33133的wzx基因编码的氨基酸序列(seqidno.:5的核苷酸9309-10727);
124.seqidno:79列出由dsm33133的epsl基因编码的氨基酸序列(seqidno.:5的核苷酸10825-11724);
125.seqidno:80列出dsm33133的lytr蛋白的氨基酸序列(seqidno.:5的互补链的核苷酸11749-12651)。
具体实施方式
126.定义
127.本文相关术语的所有定义都与本领域技术人员关于本文中相关技术上下文所理解的内容一致。
128.在本发明的任何实施方案的上下文中,表述“乳酸菌”(“lab”)表示产生乳酸作为碳水化合物发酵的主要代谢终产物的食品级细菌。这些细菌因其共同的代谢和生理特征而相关,并且通常是革兰氏阳性,低gc,耐酸,不结孢子(non-sporulating),不呼吸(non-respiring),棒状杆菌或球菌。在发酵阶段,这些细菌消耗碳水化合物导致乳酸的形成,降低ph并导致蛋白质凝结物的形成。因此,这些细菌是乳的酸化和乳制品的质地的原因。工业上最有用的乳酸菌见于“lactobacillales”目,其包括乳球菌属菌种(lactococcusspp.),链球菌属菌种(streptococcusspp.),乳酸杆菌属菌种(lactobacillusspp.),明串珠菌属菌种(leuconostocspp.),片球菌属菌种(pediococcusspp.)和丙酸杆菌属菌种(propionibacteriumspp.)。这些通常单独或与其它乳酸菌组合用作食品培养物。
129.本说明书和权利要求书中的“质地化菌株”是指优选生成发酵的哺乳动物的乳的菌株,在以下所述的条件下和如本文实施例1中举例说明的条件下,所述发酵的哺乳动物的乳具有以剪切速率300s-1
测量的优选大于40pa的剪切应力。乳酸乳球菌的菌株可以定义为强质地化的,因为它在相同条件下生成以剪切速率300s-1
测量的大于50pa的剪切应力的发酵乳。将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph4.55,然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,
其中所述接种温度是30 ℃。
130.另外,本说明书和权利要求书中的“质地化菌株”是指优选生成发酵的植物基的乳的菌株,在下述条件下和如本文实施例2中举例说明的条件下,所述发酵的植物基的乳具有或以剪切速率300s-1
测量的24pa或更大,优选30pa或更大,或甚至更优选42pa或更大的剪切应力。乳酸乳球菌的菌株可以定义为强质地化的,因为它生成在相同条件下具有以剪切速率 300s-1
测得的30pa或更大剪切应力的发酵乳。将1%体积过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖(诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的豆乳中,如实施例2中所述。在30℃下以 200-ml规模进行接种直到达到目标ph,例如ph在4和5之间,优选ph 在4.3至4.7之间,更优选ph在4.4至4.6之间,甚至更优选ph 4.45、 ph 4.50或ph 4.55,然后冷却至4℃并在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃。
131.本发明的质地化乳酸菌菌株可以是分离的菌株,例如分离自天然存在来源的菌株,或者可以是非天然存在的菌株,例如重组获得的菌株。重组菌株与天然存在的菌株的区别在于至少存在用于转化或转染母菌株的核酸构建体。
132.术语“序列同一性”涉及两个核苷酸序列之间或两个氨基酸序列之间的相关性。出于本发明的目的,两个核苷酸序列之间或两个氨基酸序列之间的序列同一性程度是使用具有标准参数的多序列比对工具clustalomega来确定的(https://www.ebi.ac.uk/tools/msa/clustalo/;sievers,f.等人, 2011,《使用clustal omega快速、可扩展地生成高质量的蛋白质多序列比对》(“fast,scalable generation of high-quality protein multiple sequencealignments using clustal omega”,mol.syst.biol.,7:539)。
133.在本上下文中,术语“菌株衍生自”,“衍生菌株”或“突变体”应理解为通过例如基因工程、辐射和/或化学处理,和/或选择、调适、筛选等从本发明的菌株衍生的菌株。优选地,衍生菌株是功能上等同的突变体,例如在质地化能力方面具有与母菌株基本相同或改善性质的菌株。此类衍生菌株是本发明的一部分。特别地,术语“衍生菌株”或“突变体”是指通过使本发明的菌株经受任何常规使用的诱变处理(包括用化学诱变剂诸如乙烷甲烷磺酸盐(ethabe methabe sulphonate,ems)或n-甲基-n
′‑
硝基
ꢀ‑
n-硝基胍(ntg),uv光处理)或者经受自发发生的突变体而获得的菌株。可以对突变体进行若干诱变处理(单一处理应理解为一个诱变步骤后进行筛选/选择步骤),但目前优选进行不大于20次、不大于10次或不大于5次处理。在目前优选的衍生菌株中,与母菌株相比,细菌基因组中小于1%、或小于0.1%、小于0.01%、小于0.001%或甚至小于0.0001%的核苷酸已被改变(例如通过置换,插入,缺失或其组合)。
134.本文中的术语“嗜热”是指在35℃以上的温度下生长最好的微生物。工业上最有用的嗜热细菌包括链球菌属菌种(streptococcus spp.)和乳酸杆菌属菌种(lactobacillus spp.)。本文中的术语“嗜热发酵”是指在约35 ℃以上,诸如在约35℃至约45℃之间的温度下发酵。术语“嗜热发酵乳产品”是指通过嗜热发酵剂培养物的嗜热发酵制备的发酵乳产品,并且包括发酵乳产品诸如凝固型酸奶(set-yoghurt)、搅拌型酸奶(stirred-yoghurt) 和饮用型酸奶(drinking yoghurt),例如养乐多(yakult)。另外,术语“嗜热发酵乳产品”是指通过嗜热发酵剂培养物在植物基乳基中嗜热发酵制备的发酵乳产品,所述植物基乳基诸
如豆乳或添加糖的豆乳,所述糖诸如例如果糖、蔗糖、高果糖玉米糖浆(hfcs)、蜂蜜、葡萄糖、转化糖、麦芽糖、半乳糖、乳糖或其任意组合。糖的浓度可以在0.5%至5%之间、0.5
‑ꢀ
2%、0.5%、1%、1.5%或2%,诸如例如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖。
135.本文中的术语“嗜中温”是指在中等温度(15℃-35℃)下生长最好的微生物。工业上最有用的嗜中温细菌包括乳球菌属菌种(lactococcus spp.) 和明串珠菌属菌种(leuconostoc spp.)。本文中的术语“嗜中温发酵”是指在约22℃和约35℃之间的温度下的发酵。术语“嗜中温食品产品”是指通过嗜中温发酵剂培养物的嗜中温发酵制备的食品产品。术语“嗜中温发酵乳产品”是指通过嗜中温发酵剂培养物的嗜中温发酵制备的发酵乳产品,并且包括发酵乳产品,诸如酪乳,酸乳,发酵奶(cultured milk),斯美塔那(smetana),酸奶油,开菲乳(kefir)和新鲜乳酪,诸如夸克干酪 (quark),特沃劳格(tvarog),奶油乳酪(cream cheese)和植物基益生菌酸奶(plantgurt)。另外,术语“嗜中温发酵乳产品”是指通过嗜中温发酵剂培养物在植物基乳基中的嗜中温发酵制备的发酵乳产品,所述植物基乳基诸如豆乳或添加糖的豆乳,所述糖诸如例如果糖、蔗糖、高果糖玉米糖浆(hfcs)、蜂蜜、葡萄糖、转化糖、麦芽糖、半乳糖、乳糖或其任意组合。糖的浓度可以在0.5%至5%之间,0.5-2%、0.5%、1%、1.5%或2 %,诸如例如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖。
136.本文中的术语“嗜中温发酵剂培养物”是指任何含有至少一种嗜中温细菌菌株的发酵剂培养物。嗜中温发酵剂培养物诸如乳酸乳球菌乳酸亚种菌株和乳酸乳球菌乳脂亚种菌株的组合用于生产发酵乳产品,诸如新鲜乳酪、酪乳、酸乳和酸奶油。
137.术语“发酵乳”和“乳品”在本文中可互换使用。在本发明的任何实施方案的上下文中,表述“发酵乳产品”是指食品产品或饲料产品,其中所述食品产品或饲料产品的制备涉及用乳酸菌发酵乳基。本文中所用的“发酵乳产品”包括但不限于如以上所限定的产品,诸如嗜热发酵乳产品或嗜中温发酵乳产品。另外,如上所述,本文中所用的“发酵乳产品”包括通过发酵植物基乳基制备的产品,所述植物基乳基诸如豆乳或添加糖的豆乳,所述糖诸如例如果糖、蔗糖、高果糖玉米糖浆(hfcs)、蜂蜜、葡萄糖、转化糖、麦芽糖、半乳糖、乳糖或其任意组合。糖的浓度可以在0.5 %至5%之间、0.5-2%、0.5%、1%、1.5%或2%,诸如例如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖。因此,根据本发明的“发酵乳产品”包括发酵的哺乳动物乳产品(即,乳基具有哺乳动物来源)和发酵的植物乳产品(即,乳基是植物源的乳基,诸如豆乳基)。
138.在本技术的上下文中,术语“乳”以其通常含义广泛地用于指由动物 (例如,牛、绵羊、山羊、水牛、骆驼等)的乳腺产生的液体或由植物产生的液体。术语“乳基”或“乳基质”可以是可根据本发明进行发酵的任何乳材料。因此,有用的乳基包括但不限于任何包含蛋白质的乳或乳类产品的溶液/悬浮液,诸如全脂乳或低脂乳、脱脂乳、酪乳、复原乳粉(reconstituted milk powder)、炼乳(condensed milk)、干乳(dried milk)、乳清、乳清渗透物、乳糖、来自乳糖结晶的母液、乳清蛋白浓缩物、奶油或植物基的乳。显然,乳基可以来源于任何哺乳动物,例如基本上纯的哺乳动物的乳或复原乳粉。乳的植物来源包括但不限于从大豆中提取的乳。优选地,植物基的乳是豆乳,其可优选地添加糖,诸如例如果糖、蔗糖、高果糖玉米糖浆(hfcs)、蜂蜜、葡萄糖、转化糖、麦芽糖、半乳糖、乳糖或其任何组合。糖
的浓度可以在0.5%和5%之间、0.5-2%、0.5%、1%、 1.5%或2%,诸如例如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2 %葡萄糖。
139.在发酵之前,可以根据本领域已知的方法将乳基均质化和巴氏消毒。如在本发明的任何实施方案的上下文中使用的“均质化”是指充分混合以获得可溶性悬浮液或乳液。如果在发酵之前进行均质化,则可以进行均质化以便将乳脂破碎成更小的尺寸,使得乳脂不再与乳分离。这可以通过迫使乳在高压下通过小孔来实现。
140.如在本发明的任何实施方案的上下文中所用的“巴氏消毒”是指处理乳基以减少或消除活生物体诸如微生物的存在。优选地,通过将指定温度保持在指定时间段来实现巴氏消毒。通常通过加热达到指定的温度。可以选择温度和持续时间以杀死或灭活某些细菌,诸如有害细菌。然后可以是快速冷却步骤。比如,乳基可以在92℃下热处理持续3min,冷却至38℃,然后如本发明工艺的步骤i.中所述接种。
141.如本文所用,术语“约”(或“大约”)是指其值的指示值
±
1%,或术语“约”是指其值的指示值
±
2%,或术语“约”是指其值的指示值
±
5 %,术语“约”是指其值的指示值
±
10%,或术语“约”是指其值的指示值
±
20%,或术语“约”是指其值的指示值
±
30%;优选地,术语“约”是指精确地表示指示值(
±
0%)。
142.在整个说明书和权利要求书中,词语“包含(comprise)”和该词语的变体(例如,“包含(comprising)”、“具有”、“包括”、“含有”) 通常不是限制性的,因此不排除其他特征,其可以是例如技术特征,添加剂,组分或步骤。然而,每当在本文中使用词语“包含”时,这也包括该词语被理解为限制性的具体实施方案;在该具体实施方案中,词语“包含”具有术语“由
…
组成”的含义。
143.在描述本发明的上下文中(特别是在所附权利要求书的上下文中)使用的术语“一”和“一个”和“所述”以及类似的指示物应被解释为涵盖单数和复数,除非本文另有说明或与上下文明显矛盾。除非本文中另有说明,否则本文中数值范围的叙述仅旨在用作单独提及落在该范围内的每个单独值的速记方法,并且每个单独值并入说明书中,如同其在本文中单独叙述一样。本文所述的所有方法可以任何合适的顺序进行,除非本文另有说明或与上下文明显矛盾。本文中提供的任何和所有实施例或示例性语言 (例如,“诸如”)的使用仅旨在更好地说明本发明,而不对本发明的范围构成限制,除非另有声明。说明书中的语言不应被解释为指示任何未要求保护的要素对于本发明的实践是必要的。
144.质地是发酵乳产品诸如酸奶的重要品质因素,并且消费者接受度通常与质地化性质密切相关。发酵乳的质地取决于用于发酵的细菌和工艺参数。产生多糖的细菌可以积极地影响产品特性诸如质地和感官性质。感官质地属性通常与来自仪器的文本结果相关,例如,剪切应力与粘度和感知的口腔厚度相关(poulsen等人,2019)。在本发明的上下文中,发酵乳产品的流变学性质(质地),诸如粘度,如下所述,可以作为发酵乳产品的剪切应力的函数来测量。
145.关于本发明,可以通过以下方法测量剪切应力:当发酵乳(例如,哺乳动物基或植物基的乳)的ph达到ph~4.55时,使发酵乳产品达到4℃,并通过装配有穿孔盘的棒轻轻手动搅拌直到样品均匀。在流变仪(具有 asc的安东帕物理流变仪,自动样品转换器,gmbh,奥地利 (anton paar physica rheometer with asc,automatic sample changer, antongmbh,austria))上通过使用摆锤杯(bob-cup)评估样品的流变性
质。在测量期间将流变仪设定为13℃的恒定温度。设置如下:
[0146]-保持时间(以重建至稍微原始的结构)
[0147]-5分钟没有对样品施加任何物理应力(振荡或旋转)。
[0148]-振荡步骤(以分别测量弹性和粘性模量g
′
和g
″
,因此计算复数模量g*)
[0149]
恒定应变=0.3%,频率(f)=[0.5
…
8]hz
[0150]
在60s期间6个测量点(每10s一个)
[0151]-旋转步骤(以在3001/s下测量剪切应力)
[0152]-两步设计:
[0153]-剪切速率=[0.3-300]1/s和2)剪切速率=[275-0.3]1/s。
[0154]
每一步在210s期间含有21个测量点(每10s一个)。选择3001/s (300s-1
)下的剪切应力用于进一步分析,因为这与吞咽发酵乳产品时的口腔厚度相关。
[0155]
优选地,通过以下方法测量剪切应力:通过在半脂乳(1.5%脂肪)中接种相同的微生物培养物获得剪切应力数据;将乳在90℃下加热20min 并冷却至接种温度(30℃),然后用1%过夜微生物培养物接种。接种在 30℃下以200-ml规模进行8-22h直到ph~4.55,然后冷却至4℃并在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天。储存后,通过装配有带孔盘的棒轻轻搅拌发酵乳直到样品均匀。使用以下设置在流变仪(具有asc的安东帕物理流变仪,自动样品转换器,gmbh,奥地利) 上评估样品的剪切应力:
[0156]-等待时间(以重建至稍微原始的结构)
[0157]-5分钟无振荡或旋转
[0158]-旋转(以在300s-1
下测量剪切应力等)
[0159]-y’=[0.2707-300]s-1
和y’=[275-0.2707]s-1
[0160]
在210s期间21个测量点(每10s一个)上升到300s-1
,并在210s 期间21个测量点(每10s一个)下降到0.2707s-1
。对于数据分析,选择在剪切速率300s-1
下的剪切应力。
[0161]
或者,通过以下方法测量剪切应力:将1%体积的过夜微生物培养物 (通过在30℃下将微生物培养物接种在添加2%葡萄糖的m17肉汤培养基中获得)接种在含有葡萄糖(诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的豆乳中。在30℃下以200-ml规模进行接种直到 ph~4.55,然后冷却至4℃并在4℃下储存直到测量剪切应力,通常从1-7 天,诸如5天。储存后,通过装配有带孔盘的棒轻轻搅拌发酵乳直到样品均匀。使用以下设置在流变仪(具有asc的安东帕物理流变仪,自动样品转换器,gmbh,奥地利)上评估剪切应力:
[0162]-等待时间(以重建至稍微原始的结构)
[0163]-5分钟无振荡或旋转
[0164]-旋转(以在300s-1
下测量剪切应力等)
[0165]-y’=[0.2707-300]s-1
和y’=[275-0.2707]s-1
[0166]
在210s期间21个测量点(每10s一个)上升到300s-1
,并在210s 期间21个测量点(每10s一个)下降到0.2707s-1
。对于数据分析,可以选择在剪切速率300s-1
下的剪切应力。
[0167]
乳酸乳球菌乳酸菌(lab)菌株
[0168]
本发明的一个目的是提供适用于制备食品产品的质地化lab菌株。特别地,本发明的一个目的是提供适用于制备嗜中温食品产品的质地化乳酸乳球菌菌株。此目的已经用本
文中所述的乳酸乳球菌菌株解决。如实施例(参见例如表1、2和3以及实施例1和实施例2)中所讨论的,公开的乳酸乳球菌菌株dsm 33204、dsm 33205、dsm 33220、dsm 33221、dsm33218、dsm 33219、dsm 33224、dsm 33197、dsm 33196、dsm 33195、 dsm 33194、dsm 33226、dsm 33193、dsm 33200、dsm 33201、dsm33202、dsm 33203、dsm 33222、dsm 33225、dsm 33133、dsm 33223 和dsm 33192具有优异的质地化性质。
[0169]
本发明人分析了上述菌株的eps基因簇,并鉴定了被认为与胞外多糖 (eps)的产生有关的基因序列,由此与上述用于发酵乳的乳酸乳球菌菌株的优良质地化性质的产生有关。
[0170]
在lab中,wzy依赖性途径是合成杂聚eps的所选途径。通过wzy 依赖性机制进行多糖生物合成的遗传位点在所有细菌中都是相似的,并且在肺炎链球菌(streptococcus pneumoniae)中得到了很好的研究。值得注意的是,肺炎链球菌(s.pneumoniae)仅产生荚膜胞外多糖(通常缩写为 cps),而lab可以产生cps和eps(eps代表“胞外多糖”,其分泌到培养基/乳中)。相同的基因簇是产生cps和eps的原因。对来自90种肺炎球菌血清型的cps位点的遗传分析证明了多糖操纵子的显著特征:每个关键酶类都存在许多高度不同的形式。因此,发现了多糖聚合酶的40个同源组别、13个脂肪酶组别以及糖基转移酶的巨大多样性。这些酶的多种非同源或高度不同形式的存在,以及这些酶编码区域中通常不同的g c含量,支持了这些基因已多次从不同和未知来源输入的观点。许多eps基因簇经历了由插入序列(is)元件介导的重排,并通过水平基因转移接收来自其他生物的基因。通常eps操纵子组织是在操纵子侧翼或操纵子内存在 is元件。在多糖生产基因位点中观察到过多的糖基转移酶为通过基因改组不断生成产生独特eps的新菌株提供机会。由于eps在单糖结构单元、异头构型、构象和立体化学方面表现出巨大的多样性,因此eps结构的多样性是不可思议的:比如,两个葡萄糖残基可以以30种不同的方式连接在一起。根据碳水化合物活性酶(cazy)数据库(cazy.org),糖基转移酶目前分为107个家族(2019年6月, http://www.cazy.org/glycosyltransferases.html),这有助于预测它们的作用方式。然而,这并不意味着一个家族的所有酶都识别相同的供体和受体,因为多特异性在糖基转移酶家族中很常见,因此对于纯粹基于这种分类的预测的过度解释应该谨慎。
[0171]
在lab中编码wzy依赖性细胞外多糖生物合成蛋白的基因通常以具有操纵子结构的簇的形式组织起来,并且通常在嗜热链球菌中存在于染色体上,但在乳酸乳球菌和乳酸杆菌属菌种(lactobacillus sp.)中可以存在于质粒或染色体上。一般来说,eps基因簇是高度多样化的,并且它们的核苷酸序列是lab基因组中变化最大的序列之一。然而,eps基因簇中的模块化基因组织是保守的(zeidan等人,2017)。根据zeidan等人(2017) 和poulsen等人(2019)的命名法,eps基因簇开头的保守基因参与多糖生物合成的调节和组装机制,被命名为epsrxcdb,末端的保守基因是epsl 和lytr,而聚合酶被命名为wzy,翻转酶(flippase)被命名为wzx。可变部分的基因包括聚合酶wzy、多糖转运蛋白(也称为翻转酶wzx)和葡糖基转移酶(gt)或其他聚合物修饰酶。质地化菌株的共同之处是它们都含有生产多糖所需的基因,例如epscdbe-wzy-wzx和gt(zeidan等人,2017)。还没有推定的功能分配给epsx和epsl。nizo b40 epsl可以通过使用内部基因片段的单次交叉来破坏,或者在不影响eps生产的情况下过度生产 (van kranenburg,1999)。但是,如果来自eps簇的拷贝不起作用,则 epsl的第二个拷贝可能会接替。
[0172]
epsr被认为是负责eps生物合成调控,因此某些突变会影响eps的产生。epscdb和atp被认为形成了一个稳定的复合物,作为酪氨酸激酶
ꢀ‑
磷酸酶系统,它可能通过epse的磷酸化控制eps合成,epse是一种糖基磷酸转移酶,其可催化eps重复单元组装的第一步并限定添加到脂质载体中用于eps形成的糖类型。负责酪氨酸磷酸化的所有三个基因对于肺炎球菌(pneumococcus)的完全包裹都是必不可少的,其中cpsc(对应于乳酸乳球菌中的epsc)是一种主要的毒力因子,通过其在cps生物合成调控中的作用至关重要(whittall等人,2015)。在乳酸乳球菌中,发现epsc 和epsd对eps生产至关重要,而epsb并非严格要求,因为删除它的效果是减少了eps的产生量(nierop groot和kleerebezem,2007)。基因epse 编码最初的糖磷酸转移酶,它不催化糖苷键,但参与将重复单元的第一个糖连接到脂质载体,这被证明对乳酸乳球菌的多糖生物合成是必不可少的,因为它的破坏消除了eps生产(dabour和lapointe 2005,van kranenburg 等人,1997)。
[0173]
其次,通常编码糖基转移酶、聚合酶和转运蛋白的eps簇的以下基因位于簇的可变部分,并且通常与已经表征的基因具有低程度的相似性,这使得预测它们的推定功能变得困难。比较来自90种肺炎球菌血清型的多糖合成操纵子,其中多糖生物合成得到了充分研究,揭示了负责重复单元的合成和聚合的中心基因是高度可变的,并且在血清型之间通常是非同源的(bentley等人,2006)。肺炎链球菌(s.pneumoniae)中wzy依赖性 cps生物合成类似于肽聚糖合成,其中重复单元建立在细胞质膜的内表面,通过wzx转运蛋白(也称为翻转酶)转运到膜的外表面,并由wzy聚合酶聚合。多糖聚合酶wzy连接各个重复单元以形成脂质连接的cps。在肺炎链球菌中,发现了40个多糖聚合酶的同源组别。重复寡糖单元的起始糖也是重复单元聚合中的供体糖,wzy聚合酶的特异性决定连接类型。对初始糖和随后的重复单元聚合连接的预测与聚合酶同源组别有很好的相关性。在肺炎链球菌中,有32个聚合酶同源组与wcha相关,5个与 wcii相关,4个与wcjg相关,1个与wcjh相关。这些关联大多是排他性的,只有五个聚合酶同源组别与两个初始转移酶相关,这表明初始转移酶具有高度特异性(bentley等人,2006)。
[0174]
不受理论的限制,目前认为与eps生物合成相关的基因的差异,特别是可变区域的差异,特别是wzy、wzx、gt基因(如果存在)和其它寡糖重复单元修饰基因的差异,可能是不同lab菌株产生的不同eps结构的原因。这可能对不同lab菌株的质地化能力的差异有影响。另外,不受理论的限制,据信每个特定菌株的遗传背景也可导致不同lab菌株的质地化能力的差异。
[0175]
如上所讨论的,本发明的第一方面涉及一种乳酸乳球菌乳酸菌菌株,其包含能够产生胞外多糖(eps)的活性eps基因簇,其中所述eps基因簇选自:
[0176]
(i)如seq id no.:1所限定的核苷酸序列;
[0177]
(ii)如seq id no.:2所限定的核苷酸序列,或与如seq id no.:2 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;
[0178]
(iii)如seq id no.:3所限定的核苷酸序列,或与如seq id no.:3 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;
[0179]
(iv)如seq id no.:4所限定的核苷酸序列,或与如seq id no.:4 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;和
[0180]
(v)如seq id no.:5所限定的核苷酸序列,或与如seq id no.:5 所限定的核苷酸
序列相差不多于5个核苷酸,优选不多于4个核苷酸,更优选不多于3个核苷酸,甚至更优选不多于2个核苷酸,最优选不多于1 个核苷酸的核苷酸序列。
[0181]
在一个优选的实施方案中,根据本发明的第一方面的乳酸乳球菌乳酸菌菌株,其包含能够产生胞外多糖(eps)的活性eps基因簇,所述eps基因簇选自:
[0182]
(i)如seq id no.:1所限定的核苷酸序列;
[0183]
(ii)如seq id no.:2所限定的核苷酸序列;
[0184]
(iii)如seq id no.:3所限定的核苷酸序列;
[0185]
(iv)如seq id no.:4所限定的核苷酸序列;和
[0186]
(v)如seq id no.:5所限定的核苷酸序列。
[0187]
在一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇如seq id no.:1所限定,所述乳酸乳球菌lab菌株属于mlst(多位点序列分型)组st76,其中如本说明书的实施例4中所述进行mlst分析,即,用在科汉森开发的12 基因mlst方案。所述方案基于选自乳酸杆菌科的核心基因组的12个基因dnak、fusa、groel、gyra、gyrb、iles、lepa、phes、reca、rpoa、rpob 和rpoc(salvetti等人,2018)。在此方案中使用了总共22493bp,因此其几乎占平均乳球菌属基因组的1%。用illumina全基因组序列进行mlst 分型是在clc微生物基因组学模块的帮助下进行的,该模块是clc基因组学工作台v10的插件。在clc中,将mlst整合到科汉森定制设计的标准基因组序列分析流水线中。它在从头重叠群和参考组件上都执行。
[0188]
优选地,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:2所限定的,或其中所述eps基因簇是与如seq id no.:2所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的,所述乳酸乳球菌lab菌株属于mlst(多位点序列分型)组st76。
[0189]
优选地,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:3所限定的,或其中所述eps基因簇是与如seq id no.:3所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的,所述乳酸乳球菌lab菌株属于mlst(多位点序列分型)组st76。
[0190]
优选地,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:4所限定的,或其中所述eps基因簇是与如seq id no.:4所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的,所述乳酸乳球菌lab菌株属于mlst(多位点序列分型)组st76。
[0191]
优选地,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:5所限定的,或其中所述eps基因簇是与如seq id no.:5所限定的核苷酸序列相差不多于1个核苷酸,优选不多于4个核苷酸,更优选不多于3个核苷酸,甚至更优选不多于2 个核苷酸,最优选不多于1个核苷酸的核苷酸序列所限定的,所述乳酸乳球菌lab菌株属于mlst(多位点序列分型)组st140。
[0192]
如上所讨论的,如实施例4中所述进行mlst分析,即,用在科汉森开发的12基因mlst方案。所述方案基于选自乳酸杆菌科的核心基因组的1 2个基因dnak、fusa、groel、gyra、gyrb、iles、lepa、phes、reca、 fpoa、rpob和rpoc(salvetti等人,2018)。在此方案中使用了总共22493 bp,因此其几乎占平均乳球菌属基因组的1%。用illumina全基因组序列
进行mlst分型是在clc微生物基因组学模块的帮助下进行的,该模块是clc基因组学工作台v10的插件。在clc中,将mlst整合到科汉森定制设计的标准基因组序列分析流水线中。它在从头重叠群和参考组件上都执行。
[0193]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:1中所限定的,所述乳酸乳球菌lab菌株能够在约15h或更短时间(15h或更短的“达到ph 4.55的时间”)内,优选在约13h或更短时间(13h或更短的“达到ph 4.55的时间”)内,更优选在约12h或更短时间(12h或更短的“达到ph 4.55的时间”)内,甚至更优选在约11h或更短时间(11 h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0194]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0195]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:1中所限定的,所述乳酸乳球菌lab菌株能够在约21h或更短时间(21h或更短的“达到ph 4.55的时间”)内,优选在约16h或更短时间(16h或更短的“达到ph 4.55的时间”)内,更优选在约11h或更短时间(11h或更短的“达到ph 4.55的时间”)内,甚至更优选在约8h或更短时间(8h 或更短的“达到ph 4.55的时间”)内生成ph约4.55(诸如ph约4.49、 4.53或4.55)的发酵乳,在以下条件下测量:
[0196]
将1%体积(2m1)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到如上所述的ph约4.55(诸如ph约4.49、4.53或4.55)。
[0197]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:2所限定的,或其中所述eps基因簇是与如seq id no.:2所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的,所述乳酸乳球菌lab菌株能够在约15h或更短时间(15h或更短的“达到ph 4.55的时间”)内,优选在约13h或更短时间(13h或更短的“达到ph 4.55的时间”)内,更优选在约12h或更短时间(12h或更短的“达到ph 4.55的时间”)内,甚至更优选在约9h或更短时间(9h或更短的“达到ph 4.55的时间”) 内生成ph约4.55的发酵乳,在以下条件下测量:
[0198]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0199]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:2所限定的,所述乳酸乳球菌lab菌株能够在约21h或更短时间(21h或更短的“达到ph 4.55的时间”)内,优选在约11h或更短时间(11h或更短的“达到ph 4.55的时间”)内,更优选在约10.5h或更短时间(10.5h或更短的“达到ph 4.55的时间”)内生成ph约4.55(诸如ph约4.54、 4.55或4.66)的发酵乳,在以下条件下测量:
[0200]
将1%体积(2ml)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到如上
所述的ph约4.55(诸如ph约4.54、4.55或4.66)。
[0201]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:3所限定的,或其中所述eps基因簇是与如seq id no.:3所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的,所述乳酸乳球菌lab菌株能够在约14h或更短时间(14h或更短的“达到ph 4.55的时间”)内,优选在约12h或更短时间(12h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0202]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0203]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:3所限定的,所述乳酸乳球菌lab菌株能够在约7.5h或更短时间(7.5h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0204]
将1%体积(2ml)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到ph约4.55。
[0205]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:4所限定的,或与如seq id no.:4所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的,所述乳酸乳球菌lab菌株能够在约13h或更短时间(13h或更短的“达到ph 4.55的时间”)内,优选在约11h或更短时间(11h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0206]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0207]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:4所限定的,所述乳酸乳球菌lab菌株能够在约10h或更短时间(10h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0208]
将1%体积(2ml)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖(诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到ph约4.55。
[0209]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:5所限定的,或其中所述eps基因簇是与如seq id no.:5所限定的核苷酸序列相差不多于1个核苷酸,优选不多于4个核苷酸,更优选不多于3个核苷酸,甚至更优选不多于2个核苷酸,最优选不多于1个核苷酸的核苷酸序列所限定的,所述乳酸乳球菌lab菌株能够在约10h或更短时间(10h或更短的“达到ph 4.55的时间”)内,优选在约8h或更短时间(8h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0210]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0211]
在另一个优选的实施方案中,乳酸乳球菌lab菌株包含能够产生胞外多糖的活性eps基因簇,其中所述eps基因簇是seq id no.:5所限定的,所述乳酸乳球菌lab菌株能够在约10.5h或更短时间(10.5h或更短的“达到ph4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0212]
将1%体积(2ml)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到ph约4.55。
[0213]
如实施例中所公开的,在具有优异的质地化性质的乳酸乳球菌乳酸菌中发现如上(i)至(v)所限定的活性eps基因簇(seq id no.:1-5)。
[0214]
术语“胞外多糖(eps)”是公知的,并且本领域技术人员可以常规地确定目的乳酸菌是否产生eps。如本领域技术人员已知和理解的,产生 eps的目的乳酸菌将包含活性eps基因簇。
[0215]
如本领域技术人员已知的,如上所述,活性eps基因簇包含参与eps 生物合成调控和调节的基因和参与寡糖重复单元的生物合成和输出的基因,包括糖基转移酶(gt),聚合酶和转运蛋白。简言之并且如本领域技术人员所理解的,由于第一方面的乳酸菌菌株能够产生和输出胞外多糖 (eps),因此它们包含活性eps基因簇。zeidan等人(2017)对通过lab 产生eps进行了综述,并提供lab中eps基因簇结构的详细信息。图1 显示乳酸乳球菌乳脂菌株b40中的eps基因簇(pnz4000,genbankaf036485)。
[0216]
优选地,乳酸乳球菌乳酸菌(lab)菌株包含能够产生胞外多糖(eps) 的活性eps基因簇,其中所述eps基因簇具有如seq id no.1所限定的序列,所述乳酸乳球菌乳酸菌(lab)菌株选自以下菌株:
[0217]-菌株dsm 33204,或其突变体或变体;
[0218]-菌株dsm 33205,或其突变体或变体;
[0219]-菌株dsm 33220,或其突变体或变体;
[0220]-菌株dsm 33221,或其突变体或变体;
[0221]-菌株dsm 33218,或其突变体或变体;
[0222]-菌株dsm 33219,或其突变体或变体;
[0223]-菌株dsm 33224,或其突变体或变体;
[0224]-菌株dsm 33197,或其突变体或变体;
[0225]-菌株dsm 33196,或其突变体或变体;
[0226]-菌株dsm 33195,或其突变体或变体;
[0227]-菌株dsm 33194,或其突变体或变体;
[0228]-菌株dsm 33226,或其突变体或变体;
[0229]-菌株dsm 33223,或其突变体或变体;
[0230]-菌株dsm 33193,或其突变体或变体;和
[0231]-菌株dsm 33192,或其突变体或变体。
[0232]
上述菌株属于mlst(多位点序列分型)组st76。如以下实施例4中所述进行mlst分析。
[0233]
优选地,乳酸乳球菌乳酸菌(lab)菌株包含能够产生胞外多糖(eps) 的活性eps基因簇,其中所述eps基因簇具有如seq id no.:2所限定的序列,所述乳酸乳球菌乳酸菌(lab)菌株选自以下菌株:
[0234]-菌株dsm 33200,或其突变体或变体;
[0235]-菌株dsm 33201,或其突变体或变体;
[0236]-菌株dsm 33202,或其突变体或变体;和
[0237]-菌株dsm 33203,或其突变体或变体。
[0238]
菌株dsm 33201和dsm 33203属于mlst(多位点序列分型)组st76。如以下实施例4中所述进行mlst分析。
[0239]
优选地,乳酸乳球菌乳酸菌(lab)菌株包含能够产生胞外多糖(eps) 的活性eps基因簇,其中所述eps基因簇具有如seq id no.:3所限定的序列,所述乳酸乳球菌乳酸菌(lab)菌株是菌株dsm 33222,或其突变体或变体。菌株dsm 33222属于mlst(多位点序列分型)组st76。如以下实施例4中所述进行mlst分析。
[0240]
优选地,乳酸乳球菌乳酸菌(lab)菌株包含能够产生胞外多糖(eps) 的活性eps基因簇,其中所述eps基因簇具有如seq id no.:4所限定的序列,所述乳酸乳球菌乳酸菌(lab)菌株是菌株dsm 33225,或其突变体或变体。菌株dsm 33225属于mlst(多位点序列分型)组st76。如以下实施例4中所述进行mlst分析。
[0241]
优选地,乳酸乳球菌乳酸菌(lab)菌株包含能够产生胞外多糖(eps) 的活性eps基因簇,其中所述eps基因簇具有如seq id no.:5所限定的序列,所述乳酸乳球菌乳酸菌(lab)菌株是菌株dsm 33133,或其突变体或变体。菌株dsm 33133属于mlst(多位点序列分型)组st140。如以下实施例4中所述进行mlst分析。
[0242]
如本文中工作实施例中所讨论的(参见例如表1)-本文中公开的新的乳酸乳球菌菌株在哺乳动物的乳中具有优异的质地化性质。另外,如实施例2、表2和3中所示,本文中公开的新的乳酸乳球菌菌株在植物基的乳中,特别是在添加葡萄糖(诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的豆乳中具有优异的质地化性质。
[0243]
优选地,如本文所述的质地化乳酸菌菌株是lab菌株,其生成具有以剪切速率300s-1
测量的大于50pa,更优选55pa或更大,甚至更优选大于56pa,诸如约51pa、55pa、58pa、60pa、61pa、62pa、64pa、 65pa、66pa、67pa、69pa、70pa、72pa、75pa、80pa、85pa、86pa、 87pa、88pa、89pa、90pa、95pa、100pa、105pa、110pa、115pa、 120pa、121pa或更大剪切应力的发酵乳,在以下条件下测量:
[0244]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph 4.55,然后在4℃下储存5天,然后轻轻搅拌并以剪切速率 300s-1
测量剪切应力,其中所述接种温度是30℃。使用实施例1中所示的方法测量剪切应力。
[0245]
另外,如本文所述的质地化乳酸菌菌株是lab菌株,其生成具有以剪切速率300s-1
测量的大于24pa,诸如约35pa、36pa、45pa、47pa、 54pa、56pa、57pa、60pa、62pa、63pa、64pa、71pa、74pa、75 pa、79pa、86pa、88pa、93pa、96pa、99pa、102pa、106pa或更大剪切应力的发酵
乳,在以下条件下测量:
[0246]
将200ml添加2%葡萄糖的豆乳(如实施例2中所述)用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph~4.55(诸如ph 4.49、 4.53、4.54、4.55或4.66),然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃。使用实施例2中所示的方法测量剪切应力。
[0247]
优选地,lab菌株产生具有以剪切速率300s-1
测量的55pa或更大,优选地大于56pa,诸如约58pa、60pa、64pa、65pa、70pa、75pa、 80pa、85pa、88pa、90pa、95pa、98pa的剪切应力的发酵乳,优选地在共酸化剂或辅助菌株的存在下,所述辅助菌株优选为菌株dsm 25485,在以下条件下测量:
[0248]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph 4.55,然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃。使用实施例1中所示的方法测量剪切应力。
[0249]
在一个优选的实施方案中,本发明提供以下乳酸乳球菌乳酸菌(lab) 菌株,其能够在约13h或更短时间(13h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0250]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55:
[0251]-菌株dsm 33193,或其突变体或变体
[0252]-菌株dsm 33204,或其突变体或变体;
[0253]-菌株dsm 33205,或其突变体或变体;
[0254]-菌株dsm 33220,或其突变体或变体;
[0255]-菌株dsm 33221,或其突变体或变体;
[0256]-菌株dsm 33218,或其突变体或变体;
[0257]-菌株dsm 33219,或其突变体或变体;
[0258]-菌株dsm 33224,或其突变体或变体;
[0259]-菌株dsm 33197,或其突变体或变体;
[0260]-菌株dsm 33196,或其突变体或变体;
[0261]-菌株dsm 33200,或其突变体或变体;
[0262]-菌株dsm 33201,或其突变体或变体;
[0263]-菌株dsm 33203,或其突变体或变体;
[0264]-菌株dsm 33222,或其突变体或变体;
[0265]-菌株dsm 33225,或其突变体或变体;和
[0266]-菌株dsm 33133,或其突变体或变体。
[0267]
由于上述菌株能够在约13h或更短时间内酸化乳(即,达到目标ph
‑ꢀ
例如,如上所述的ph 4.55),如上所述测量,它们可称为“快酸化”菌株。目标ph可以是例如ph在4和5之间,优选ph在4.3至4.7之间,更优选ph在4.4至4.6之间,甚至更优选ph 4.45、ph 4.50或ph 4.55。因此,这些菌株可单独使用或与其它菌株组合使用以生成发酵乳和发酵乳产品。
[0268]
在另一个优选的实施方案中,本发明提供以下乳酸乳球菌乳酸菌(lab) 菌株,其
不能在约13h或更短时间内生成ph约4.55的发酵乳(大于13 h的“达到ph 4.55的时间”),在以下条件下测量:
[0269]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55:
[0270]-菌株dsm 33226,或其突变体或变体;
[0271]-菌株dsm 33194,或其突变体或变体;
[0272]-菌株dsm 33195,或其突变体或变体;
[0273]-菌株dsm 33192,或其突变体或变体;
[0274]-菌株dsm 33223,或其突变体或变体;和
[0275]-菌株dsm 33202,或其突变体或变体。
[0276]
由于上述菌株不能在约13h或更短时间内酸化乳(即,达到目标ph
‑ꢀ
例如,如上所述的ph 4.55),如上所述测量,它们可称为“慢酸化”菌株。目标ph可以是例如ph在4和5之间,优选ph在4.3至4.7之间,更优选ph在4.4至4.6之间,甚至更优选ph 4.45、ph 4.50或ph 4.55。不受理论的限制,对于发酵乳的生产,目前优选尽可能快地进行乳发酵(酸化),例如,为了避免任何潜在的污染微生物的生长。因此,优选上述菌株与另外的乳酸菌菌株组合使用,在本发明的上下文中,所述乳酸菌菌株称为“共酸化剂”或“辅助”菌株。共酸化剂或辅助菌株将有助于“慢酸化”菌株在较短时间内酸化奶。
[0277]
不受理论的限制,目前认为共酸化剂或辅助菌株尤其比“慢酸化”菌株更快地代谢乳中存在的蛋白质(酪蛋白),使得“慢酸化”菌株具有更多的可用于其生长的氮源,从而促进其生长。lab需要外源的氨基酸或肽源,其通过乳蛋白例如酪蛋白的蛋白水解提供,酪蛋白是乳中最丰富的蛋白质和氨基酸的主要来源(savijoki,k.等人,appl microbiolbiotechnol(2006)71:394-406)。
[0278]
慢酸化菌株通常与低蛋白水解活性相关。蛋白水解是蛋白质分解成更小的多肽或氨基酸。细胞壁蛋白酶(prt)水解乳蛋白,诸如酪蛋白,提供氮源,这使得乳适于菌株的快速生长。除了prt活性之外的其它因素,诸如碳代谢,idh和cody活性也可以起作用。具有高prt活性不足以快速酸化乳。肽的摄取和进一步降解对于乳酸化速率也是重要的。此外,eps生产是高度能量需求的过程(zeidan等人,2017)。质地化乳酸乳球菌菌株在酸化乳中通常比非质地化菌株更慢(poulsen等人,2019)。
[0279]
根据本发明的“共酸化剂”或“辅助”菌株可以是任何乳酸菌菌株,其能够:
[0280]
i)在15h或更短,优选12h或更短时间内生成ph约4.55的发酵乳(15h或更短,优选12h或更短的“达到ph 4.55的时间”),在以下条件下测量:
[0281]
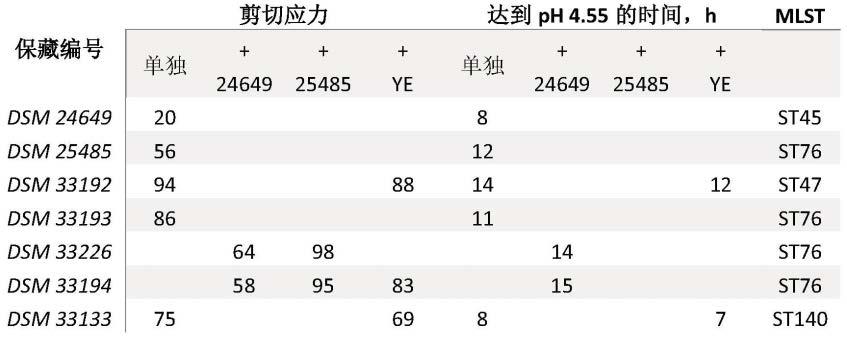
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph约4.55。因此,对某一乳酸菌菌株可计算“达到ph 4.55的时间”;和
[0282]
ii)生成具有以剪切速率300s-1
测量的40pa或更大剪切应力的发酵乳,在以下条件下测量:
[0283]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph 4.55(达到ph 4.55的时间),然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天,然后轻轻搅拌并以剪切速率
33200、dsm33201、dsm33203、dsm33204、dsm33205、dsm33218、dsm33219、dsm33220、dsm33221、dsm33222、dsm33224、dsm33225、dsm33140、dsm33142和/或dsm33137中任一项的用途,优选菌株dsm33193、dsm33196、dsm33197、dsm33200、dsm33201、dsm33205、dsm33218、dsm33220、dsm33221、dsm33222、dsm33224、dsm33225和/或dsm33137中任一项作为共酸化剂或辅助菌株的用途。
[0302]
包含本发明lab的组合物
[0303]
在第二方面,本发明提供一种组合物,其包含一种或多种如本发明第一方面所述的本发明的乳酸乳球菌菌株。
[0304]
特别地,本发明提供一种组合物,其包含一种或多种如本发明第一方面所述的本发明的质地化乳酸乳球菌菌株和如本发明第一方面所限定的共酸化剂或辅助菌株。在一个优选的实施方案中,本发明的组合物包含一种或多种如本发明第一方面所述的本发明的乳酸乳球菌菌株和如本发明第一方面所限定的共酸化剂或辅助菌株,比例为约9∶1(本发明的lab菌株:共酸化剂或辅助菌株)。
[0305]
优选地,本发明的组合物包含至少一种根据本发明第一方面的乳酸乳球菌乳酸菌菌株和一种或多种另外的乳酸菌菌株,其中所述一种或多种另外的乳酸菌菌株能够:
[0306]
i)在约15h或更短时间内,优选在约12h或更短时间内生成ph约4.55的发酵乳,在以下条件下测量:
[0307]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度直到达到ph约4.55。因此,可以计算某一乳酸菌菌株的“达到ph4.55的时间”;和
[0308]
ii)生成以剪切速率300s-1
测量的40pa或更大剪切应力的发酵乳,在以下条件下测量:
[0309]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph4.55(达到ph4.55的时间),然后在4℃下储存5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃,其中如本说明书(例如,实施例1)中所述测量剪切应力。
[0310]
更优选地,本发明的组合物包含至少一种根据本发明第一方面的乳酸乳球菌乳酸菌菌株和(a)乳酸菌菌株乳酸乳球菌,其包含能够产生胞外多糖的活性eps基因簇(eps),其中所述eps基因簇包含如(vi)所限定的核苷酸序列(a)、(b)和(c)(a至c4),或(b)乳酸菌菌株乳酸乳球菌,其包含能够产生胞外多糖(eps)的活性eps基因簇,其中所述eps基因簇如(vii)所限定:
[0311]
(vi)(a):编码具有聚合酶活性并与seqidno:1的核苷酸6955-8145(本文中称为wzy)编码的氨基酸序列具有至少95%的同一性的多肽的核苷酸序列;
[0312]
(b):编码具有多糖转运蛋白活性并与seqidno:1的核苷酸9309-10727(本文中称为wzx)编码的氨基酸序列具有至少95%的同一性的多肽的核苷酸序列;和
[0313]
(c):编码具有糖基转移酶(gt)活性的多肽的核苷酸序列,其包含:
[0314]
(c1):与seqidno:1的核苷酸4008-4478编码的氨基酸序列(本文中称为gt1)具有至少95%同一性的核苷酸序列;
[0315]
(c2):与seqidno:1的核苷酸4478-4960编码的氨基酸序列(本文中称为gt2)具
有至少95%同一性的核苷酸序列;
[0316]
(c3):与seq id no:1的核苷酸5015-5965编码的氨基酸序列(本文中称为gt3)具有至少95%同一性的核苷酸序列;和
[0317]
(c4):与seq id no:1的核苷酸6026-6955编码的氨基酸序列(本文称为gt4)具有至少95%同一性的核苷酸序列;
[0318]
(vii)如seq id no.:5所限定的核苷酸序列。
[0319]
在另一个优选的实施方案中,本发明的组合物包含至少一种根据本发明第一方面的乳酸乳球菌乳酸菌菌株和一种或多种选自菌株dsm 33193、 dsm 33133、dsm 33196、dsm 33197、dsm 33200、dsm 33201、dsm33203、dsm 33204、dsm 33205、dsm 33218、dsm 33219、dsm 33220、dsm 33221、dsm 33222、dsm 33224、dsm 33225、dsm 33140、dsm33142、dsm 33137、dsm 33192和/或dsm 25485的乳酸菌菌株,优选选自菌株dsm 33193、dsm 33196、dsm 33197、dsm 33200、dsm 33201、 dsm 33205、dsm 33218、dsm 33220、dsm 33221、dsm 33222、dsm33224、dsm 33225、dsm 33137、dsm 33192和/或dsm 25485的乳酸菌菌株。
[0320]
更优选地,本发明的组合物包含至少一种根据本发明第一方面的乳酸乳球菌乳酸菌菌株
[0321]
(i)乳酸菌菌株乳酸乳球菌乳脂亚种dsm 25485,或其突变体或变体;和/或
[0322]
(ii)乳酸菌菌株乳酸乳球菌乳酸亚种dsm 33192,或其突变体或变体;和/或
[0323]
(iii)乳酸菌菌株乳球菌dsm 33133,或其突变体或变体。
[0324]
例如,本发明的组合物包含菌株dsm 33195和菌株dsm 25485。例如,本发明的组合物包含菌株dsm 33226和菌株dsm 25485。例如,本发明的组合物包含菌株dsm 33194和菌株dsm 25485。例如,本发明的组合物可以包含菌株dsm 33202、dsm 33203、dsm 33204、dsm 33219 和/或菌株dsm 33223中的一种或多种以及如本发明的第一方面所限定的共酸化剂或辅助菌株中的一种或多种,优选以下菌株中的一种或多种: dsm 25485、dsm 33192和/或dsm 33133。
[0325]
在另一个实施方案中,本发明的组合物可以包含菌株dsm 33226和菌株dsm 24649。在另一个实施方案中,本发明的组合物可以包含菌株 dsm 33194和菌株dsm 24649。
[0326]
优选地,本发明的组合物在其任何实施方案中包含至少1
×
106cfu (菌落形成单位)/ml的总lab菌株。优选组合物可以包含至少1
×
10
8 cfu/ml的总lab菌株。
[0327]
如上所述,在本发明第一方面的上下文中,本发明的lab单独或与共酸化剂或辅助菌株组合,优选lab菌株乳酸乳球菌乳脂亚种dsm 25485,其能够在较短时间内生成具有高剪切应力的发酵乳和/或酸化乳(即,达到ph约4.55)。因此,如本发明第一方面的上下文所述,本发明的组合物能够单独或在共酸化剂或辅助菌株存在下产生至少与本发明的lab描述的剪切应力相同的剪切应力。
[0328]
乳酸菌是包括乳球菌属菌种的物种的细菌,通常以冷冻(f-dvs)或冻干(fd-dvs)培养物形式提供给乳品工业,用于大量发酵剂繁殖,或以所谓的“直投型(direct vat set)”(dvs)培养物形式提供给乳品工业,用于直接接种到发酵容器或槽中以生产乳制品,诸如发酵乳产品。这样的乳酸菌培养物通常称为“发酵剂培养物”或“起子”。因此,本发明的组合物可以是冷冻的或冻干的。另外,本发明的组合物可以以液体形式提供。因此,在一个实施方案中,组合物为冷冻、干燥、冻干或液体形式。
[0329]
本发明的组合物可以另外包含低温防护剂、冻干保护剂、抗氧化剂、营养素、填充剂、调味剂或其混合物。组合物优选包含一种或多种低温防护剂、冻干保护剂、抗氧化剂和/或营养素,更优选低温防护剂、冻干保护剂和/或抗氧化剂,最优选低温防护剂或冻干保护剂,或两者。保护剂诸如低温防护剂和冻干保护剂的用途是本领域技术人员已知的。合适的低温防护剂或冻干保护剂包括单糖、二糖、三糖和多糖(诸如葡萄糖、甘露糖、木糖、乳糖、蔗糖、海藻糖、棉子糖、麦芽糖糊精、淀粉和阿拉伯树胶(阿拉伯胶)等)、多元醇(诸如赤藓糖醇、甘油、肌醇、甘露醇、山梨醇、苏糖醇、木糖醇等)、氨基酸(诸如脯氨酸、谷氨酸)、复合物(诸如脱脂乳、蛋白胨、明胶、酵母提取物)和无机化合物(诸如三聚磷酸钠)。
[0330]
在一个实施方案中,本发明的组合物可以包含一种或多种冷冻保护剂 (cryoprotective agent),其选自由肌苷-5
′‑
单磷酸(imp)、腺苷-5
′‑
单磷酸(amp)、鸟苷-5
′‑
单磷酸(gmp)、尿苷-5
′‑
单磷酸(ump)、胞苷-5
′‑ꢀ
单磷酸(cmp)、腺嘌呤、鸟嘌呤、尿嘧啶、胞嘧啶、腺苷、鸟苷、尿苷、胞苷、次黄嘌呤(hypoxanthine)、黄嘌呤、次黄嘌呤、乳清苷、胸苷、肌苷和任何此类化合物的衍生物组成的组。合适的抗氧化剂包含抗坏血酸、柠檬酸及其盐、没食子酸盐、半胱氨酸、山梨醇、甘露醇、麦芽糖。合适的营养素包含糖、氨基酸、脂肪酸、矿物质、微量元素、维生素(诸如维生素b族、维生素c)。组合物可任选地包含其它物质,包括填充剂(诸如乳糖、麦芽糖糊精)和/或调味剂。
[0331]
在本发明的一个实施方案中,冷冻保护剂是一种试剂或试剂混合物,它除了具有低温保护作用外,还具有增强作用。
[0332]
表述“增强作用”用于描述这样的情况,其中在将冷冻保护剂接种到待发酵或待转化的培养基中时,冷冻保护剂赋予解冻或重建的培养物增加的代谢活性(增强作用)。生活力和代谢活性不是同义的概念。商业冷冻或冻干的培养物可以保持它们的生活力,尽管它们可能已经失去了很大一部分代谢活性,例如,当保持储存更短的时间,培养物可能失去它们的产酸(酸化)活性。因此,必须通过不同的测定来评价生活力和增强作用。而生活力通过生活力测定诸如菌落形成单位的确定来评估,增强作用通过相对于培养物的生活力定量解冻或重建的培养物的相关代谢活性来评估。术语“代谢活性”是指培养物的除氧活性,其产酸活性,即,生产例如,乳酸、乙酸、甲酸和/或丙酸或其产生活性的代谢物,诸如产生芳香化合物,诸如乙醛,(d-乙酰乳酸,乙偶姻,双乙酰和2,3-丁二醇(丁二醇))。
[0333]
在一个实施方案中,本发明的组合物含有或包含从0.2%至20%的冷冻保护剂或试剂混合物,以材料的重量百分比(%w/w)测量。然而,优选加入按重量计从0.2%至15%、从0.2%至10%、从0.5%至7%和从1 %至6%范围内的量,包括按重量计从2%至5%范围内的量的冷冻保护剂或试剂混合物,以冷冻材料的重量百分比(%w/w)测量。在一个优选的实施方案中,培养物包含按重量计约3%的冷冻保护剂或试剂混合物,以材料的重量百分比(%w/w)测量。约3%的冷冻保护剂的量对应于100 mm范围内的浓度。应当认识到,对于本发明实施方案的每个方面,范围可以是所述范围的增量。
[0334]
在一个实施方案中,本发明的组合物可以包含增稠剂和/或稳定剂,诸如果胶(pectin)(例如hm果胶、lm果胶)、明胶(gelatin)、cmc、大豆纤维/大豆聚合物、淀粉、改性淀粉、角叉菜胶(carrageenan)、藻酸盐(alginate)和瓜尔胶(guar gum)。
[0335]
在一个实施方案中,其中微生物在酸化的乳产品中产生引起高稠度/粘稠质地的多糖(诸如eps),酸化的乳产品基本上不含或完全不含任何添加的增稠剂和/或稳定剂,诸
如果胶(例如hm果胶、lm果胶)、明胶、 cmc、大豆纤维/大豆聚合物、淀粉、改性淀粉、角叉菜胶、藻酸盐和瓜尔胶。“基本上不含”应理解为产品包含从0%至20%(w/w)(例如从0%至10%、从0%至5%或从0%至2%或从0%至1%)的增稠剂和/或稳定剂。
[0336]
lab菌株用于增加发酵乳产品粘度的用途
[0337]
在第三方面,本发明提供如第一方面所述的lab或本发明的用途,和/或如第二方面所述的本发明的组合物用于增加发酵乳产品的粘度的用途。因此,在第三方面,本发明提供增加发酵乳产品的粘度(即,改进质地)的方法,其中所述方法包含如第一方面所述的lab或本发明的应用,和/或如第二方面所述的本发明的组合物的应用。
[0338]
如上所述,如第一方面所述的本发明的lab菌株和如第二方面所述的本发明的组合物能够生成具有以剪切速率300s-1
测量的大于50pa,优选大于55pa,诸如大于56pa,诸如约51pa、55pa、58pa、60pa、61 pa、62pa、64pa、65pa、66pa、67pa、69pa、70pa、72pa、75pa、80 pa、85pa、86pa、87pa、88pa、89pa、100pa、110pa、115pa、120pa、 121pa或更大剪切应力的发酵乳,在以下条件下测量:
[0339]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph 4.55,然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如 5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃。使用实施例1中所示的方法测量剪切应力。
[0340]
如上所述,如第一方面所述的本发明的lab菌株和如第二方面所述的本发明的组合物能够生成以剪切速率300s-1
测量的大于24pa,诸如约 35pa、36pa、45pa、47pa、54pa、56pa、57pa、60pa、62pa、63pa、 64pa、71pa、74pa、75pa、79pa、86pa、88pa、93pa、96pa、99pa、 102pa、106pa或更大剪切应力的发酵乳,在以下条件下测量:
[0341]
将200ml添加2%葡萄糖的豆乳(如实施例2中所述)用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph~4.55(或更高/更低,如果菌株在更高/更低ph下停止酸化,参见表3,诸如ph 4.49、4.53、4.54、 4.55或4.66),然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天。然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃。使用实施例2中所示的方法测量剪切应力。
[0342]
如第一方面所述的本发明的lab菌株和如第二方面所述的本发明的组合物能够生成具有以剪切速率300s-1
测量的55pa或更大,优选大于56 pa,诸如约58pa、60pa、64pa、65pa、70pa、75pa、80pa、90pa、95 pa或98pa的剪切应力的发酵乳,优选地,在酸化菌株的存在下,所述酸化菌株优选选自dsm 25485、dsm 33192和/或dsm 33133,甚至更优选 dsm 25485,在以下条件下测量:
[0343]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph 4.55,然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如 5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃。使用实施例1中所示的方法测量剪切应力。
[0344]
对于单独或在共酸化剂或辅助菌株存在下用本发明的特定lab菌株发酵的乳的特定剪切应力,我们参考本发明的第一方面和实施例中的表1
‑ꢀ
3。
[0345]
如本发明的第一方面的上下文中所讨论的,本发明的一些lab菌株能够在约13h或更短时间内酸化乳(“快酸化”菌株),如上所述测量,即,将200ml半脂乳(1.5%脂肪)加热至
90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph4.55。因此,这些菌株可以优选单独使用或与其它菌株组合使用以生成发酵乳,特别是使用粘度增加的发酵乳。
[0346]
另外,本发明的一些lab菌株不能在约13h或更短时间内酸化乳,如上所述测量,即,将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph4.55。它们可称为“慢酸化”菌株(例如dsm33192、dsm33226、dsm33194、dsm33202、dsm33223和/或dsm33195)。这些菌株可有利地在如本发明第一方面所限定的共酸化剂或辅助菌株的存在下使用。特别地,这些菌株可以有利地在菌株dsm25485,和/或菌株dsm33192,和/或菌株dsm33133的存在下,优选在菌株dsm25485的存在下使用。如上所述,优选地,如本发明第一方面所述的一种或多种乳酸乳球菌菌株和如本发明第一方面所限定的共酸化剂或辅助菌株以约9∶1的比例组合使用(本发明的lab菌株∶共酸化剂或辅助菌株)。
[0347]
如表1所示,当用菌株dsm33226、dsm33194和/或dsm33195以及共酸化剂菌株dsm25485发酵乳时,乳的剪切应力值增加和/或“达到ph4.55的时间”(如上所述来测量)减少。不受理论的限制,据信如上所述,dsm25485的蛋白水解性质允许和/或促进本发明lab的生长。另外,据信由dsm25485产生的eps和由本发明菌株产生的eps的组合可导致观察到的发酵乳的粘度增加,如上所述作为剪切应力测量。
[0348]
不受理论的限制,据信当乳与本发明的lab之一和菌株dsm33192发酵时,也可获得用本发明的lab之一和共酸化剂菌株dsm25485(参见表1)发酵的乳的剪切应力增加的效果。菌株dsm33192也是辅助菌株并且产生与由菌株dsm25485产生的eps的结构具有类似结构的eps。
[0349]
另外,不受理论的限制,据信当乳与如上所述的本发明的一种lab和一种或多种以下菌株一起孵育时也将获得用本发明的lab之一和共酸化剂菌株dsm25485(参见表1)发酵的乳的剪切应力增加的效果:dsm33193、dsm33133、dsm33196、dsm33197、dsm33200、dsm33201、dsm33203、dsm33204、dsm33205、dsm33218、dsm33219、dsm33220、dsm33221、dsm33222、dsm33224、dsm33225、dsm33140、dsm33142、dsm33137、dsm33192和/或dsm25485,优选以下菌株之一:dsm33193、dsm33196、dsm33197、dsm33200、dsm33201、dsm33205、dsm33218、dsm33220、dsm33221、dsm33222、dsm33224、dsm33225、dsm33137、dsm33192和/或dsm25485。这些菌珠能够:
[0350]
i)在约15h或更短时间内,优选在约12h或更短时间内生成ph约4.55的发酵乳,在以下条件下测量:
[0351]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph约4.55;和
[0352]
ii)生成具有以剪切速率300s-1
测量的40pa或更大剪切应力的发酵乳,在以下条件下测量:
[0353]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph4.55,达到ph4.55的时间),然后在4℃下储存直到测量剪切应力,通常从1-7天,诸如5天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃。
25485的用途和/或乳酸乳球菌乳酸亚种菌株dsm 33192的用途,作为共酸化剂或辅助菌株,优选地,共酸化剂或辅助菌株与如本发明第一方面所限定的其它质地化lab菌株组合用于增加发酵乳产品的粘度。优选地,菌株dsm 33192和/或dsm 25485与本发明第一方面所述的一种或多种本发明的lab以约9∶1的比例组合使用(本发明的lab菌株∶菌株dsm 33192和/或dsm 25485)。
[0367]
生产食品产品的方法和食品产品
[0368]
在第四方面,本发明涉及生产食品产品的方法,其包含至少一个阶段,其中使用至少一种如本发明第一方面所限定的乳酸菌菌株和/或如本发明第二方面所限定的组合物。食品产品的生产通过本领域技术人员已知的方法进行。
[0369]
在另一个实施方案中,本发明涉及一种生产包含至少一个阶段的食品产品的方法,在所述阶段中使用乳酸菌菌株乳酸乳球菌乳脂亚种dsm25485,或其突变体或变体。
[0370]
在另一个实施方案中,本发明涉及一种生产包含至少一个阶段的食品产品的方法,在所述阶段中使用乳酸菌菌株乳酸乳球菌乳酸亚种dsm33192,或其突变体或变体。
[0371]
在本发明的任何实施方案的上下文中,“发酵”是指通过微生物(lab) 的作用将碳水化合物转化成醇或酸。用于生产食品产品诸如乳制品的发酵工艺是公知的,并且本领域技术人员会知道如何选择合适的工艺条件,诸如温度,氧气,微生物的量和工艺时间。显然,选择发酵条件以支持本发明的实现,例如,在其任何实施方案中,获得食品产品,优选与用不涉及使用至少一种如本发明第一方面所述的lab或不涉及使用如本发明第二方面所述的组合物的方法生产的食品产品相比具有改善质地的食品产品。
[0372]
在一个优选的实施方案中,本发明的方法在其任何实施方案中包含用含至少1x106cfu,优选至少1x108cfu/ml的总lab菌株的组合物发酵乳基质,所述乳基质可以是哺乳动物基的乳基质或植物基乳基质,诸如豆乳。
[0373]
比如,本发明的方法包含用含至少1x106cfu,优选至少1x108cfu/ml 的一种或多种菌株的组合物发酵乳基质,菌株选自:dsm 33193、dsm33133、dsm 33196、dsm 33197、dsm 33200、dsm 33201、dsm 33202、 dsm 33195、dsm 33203、dsm 33204、dsm 33205、dsm 33218、dsm33219、dsm 33220、dsm 33221、dsm 33222、dsm 33223、dsm 33224 和/或dsm 33225。
[0374]
比如,本发明的方法包含用含至少1x106cfu,优选至少1x108cfu/ml 的菌株dsm 33226和dsm 25485的组合物发酵乳基质。
[0375]
比如,本发明的方法包含用含至少1
×
106cfu,优选至少1
×
10
8 cfu/ml的菌株dsm 33194和dsm 25485的组合物发酵乳基质。
[0376]
比如,本发明的方法包含用含至少1
×
106cfu,优选至少1
×
10
8 cfu/ml的菌株dsm 33195和dsm 25485的组合物发酵乳基质。
[0377]
在另一个优选的实施方案中,所述方法包含用本发明第二方面的任何实施方案中所述的组合物发酵乳底物。
[0378]
优选地,所述食品产品是乳制品,并且其任何实施方案中的方法包含用本发明的至少一种lab菌株和/或组合物(分别为第一方面和第二方面) 和/或用菌株dsm 25485和/或用菌株dsm 33192发酵乳基质(在本发明的上下文中也称为“乳基”)。
[0379]
优选地,所述食品产品是乳制品,并且其任何实施方案中的方法包含用本发明至少一种lab菌株和/或组合物(分别为第一方面和第二方面) 发酵植物基乳基质(在本发明
的上下文中也称为“植物基乳基”),诸如豆乳,优选添加葡萄糖的豆乳,诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖。
[0380]
有利地,根据本发明的食品产品可以进一步包含增稠剂和/或稳定剂,诸如果胶(例如hm果胶、lm果胶)、明胶、cmc、大豆纤维/大豆聚合物、淀粉、改性淀粉、角叉菜胶、藻酸盐和瓜尔胶。
[0381]
在一个具体的实施方案中,食品产品是乳制品、肉制品、蔬菜制品、水果制品或谷类制品。在一个优选的实施方案中,食品产品是乳制品。在另一个优选的实施方案中,食品产品是植物基食品产品,例如发酵的豆乳。
[0382]
本文中所用的术语“乳制品”是指由乳生产的食品产品。如上所述,在本技术的上下文中,术语“乳”以其通常含义广泛地用于指由动物(例如,牛、绵羊、山羊、水牛、骆驼等)的乳腺或由植物产生的液体。在一个优选的实施方案中,所述乳是牛乳。根据本发明,乳可以是已经加工的,术语“乳”包括全乳,脱脂乳,无脂乳(fat-free milk),低脂乳,全脂乳,降乳糖乳(1actose-reduced milk)或浓缩乳。无脂乳是无脂肪或脱脂乳产品。低脂乳通常定义为含有约1%至约2%脂肪的乳。全脂乳通常含有2%或更多的脂肪。术语“乳”包括来自不同哺乳动物和植物来源的乳。乳的哺乳动物来源包括但不限于牛、绵羊、山羊、水牛、骆驼、美洲驼(llama)、母马和鹿。乳的植物来源包括但不限于从大豆中提取的乳。在一个具体的实施方案中,所述乳是牛乳。在另一个具体的实施方案中,所述乳是植物基的乳,优选豆乳,其可以优选添加糖,诸如例如果糖、蔗糖、高果糖玉米糖浆(hfcs)、蜂蜜、葡萄糖、转化糖、麦芽糖、半乳糖、乳糖或其任意组合。糖的浓度可以在0.5%至5%之间、0.5-2%、0.5%、1%、1.5%或 2%,诸如例如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖。
[0383]
本发明优选的乳制品是发酵乳产品和乳酪。在一个具体的实施方案中,乳制品是嗜中温乳制品。
[0384]
在本发明的一个具体实施方案中,发酵乳产品选自由酪乳,酸乳,发酵奶,斯美塔那,酸奶油,浓奶油(thick cream),发酵奶油(cultured cream),衣梅尔(ymer),发酵乳清(fermented whey),开菲乳,养乐多(yakult) 和新鲜乳酪,诸如夸克干酪,特沃劳格(tvorog)和奶油乳酪组成的组。特别地,发酵乳产品选自由夸克干酪,酸奶油和开菲乳组成的组。在本发明的一个优选实施方案中,发酵乳产品含有选自由水果饮料,谷物产品,发酵谷物产品,化学酸化谷物产品,豆乳产品,发酵豆乳产品及其任何混合物组成的组的其它食品产品。在另一个优选的实施方案中,发酵乳产品是植物基的发酵乳产品,优选发酵豆乳,例如来自“alpro”的“植物基益生菌酸奶(plantgurt)”。
[0385]
发酵乳产品通常含有1.0重量%至12.0重量%,优选2.0重量%至 10.0重量%的蛋白质。在一个具体的实施方案中,酸奶油含有在1.0重量%至5.0重量%之间,优选在2.0重量%至4.0重量%之间的蛋白质。在一个具体的实施方案中,夸克干酪含有在4.0重量%至12.0重量%之间,优选在5.0重量%至10.0重量%之间的水平的蛋白质。
[0386]
优选地,在任何实施方案中,与用不涉及使用至少一种如本发明第一方面所述的lab和/或使用如本发明第二方面的所述的组合物和/或使用如上限定的共酸化剂或辅助菌株(优选菌株dsm 25485和/或菌株dsm33192)的相当的方法制备的食品产品相比,所述食品产品具有改善的质地 (改进的粘度,如本技术和例如实施例1和2中所述,以300s-1
测量为剪切应力)。
[0387]
本发明还涉及包含至少一种如本发明第一方面所述的lab菌株和/或如本发明第二方面所述的组合物的食品产品,优选乳制品。
[0388]
乳酸乳球菌乳酸菌(lab)菌株的制造方法
[0389]
在第五方面,本发明提供一种制造乳酸乳球菌乳酸菌(lab)菌株的方法,其包含以下步骤:
[0390]
(a)提供乳酸乳球菌乳酸菌(lab)菌株,其包含能够产生胞外多糖 (eps)的活性eps基因簇,其中所述eps基因簇选自:
[0391]
(i)如seq id no.:1所限定的核苷酸序列;
[0392]
(ii)如seq id no.:2所限定的核苷酸序列,或与如seq id no.:2 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;
[0393]
(iii)如seq id no.:3所限定的核苷酸序列,或与如seq id no.:3 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;
[0394]
(iv)如seq id no.:4所限定的核苷酸序列,或与如seq id no.:4 所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列;和
[0395]
(v)如seq id no.:5所限定的核苷酸序列,或与如seq id no.:5 所限定的核苷酸序列相差不多于5个核苷酸,优选不多于4个核苷酸,更优选不多于3个核苷酸,甚至更优选不多于2个核苷酸,最优选不多于1 个核苷酸的核苷酸序列,
[0396]
(b)筛选乳酸乳球菌乳酸菌(lab)菌株,所述菌株:
[0397]
(i)能够生成具有以剪切速率300s-1
测量的40pa或更大,优选50 pa或更大,诸如大于56pa,更优选60pa或更大,甚至更优选65pa或更大,诸如70pa或更大、75pa或更大、80pa或更大、85pa或更大、90pa 或更大、95pa或更大、100pa或更大或120pa或更大剪切应力的发酵乳,在以下条件下测量:
[0398]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度,并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph 4.55,然后在4℃储存直到测量剪切应力,通常从1-7天,诸如5 天,然后轻轻搅拌并以剪切速率300s-1
测量剪切应力,其中所述接种温度是30℃;和/或
[0399]
(ii)能够生成具有以剪切速率300s-1
测量的大于24pa,诸如约35 pa、36pa、45pa、47pa、54pa、56pa、57pa、60pa、62pa、63pa、64 pa、71pa、74pa、75pa、79pa、86pa、88pa、93pa、96pa、99pa、102 pa、106pa或更大剪切应力的发酵乳,在以下条件下测量:
[0400]
将200ml添加2%葡萄糖的豆乳(如实施例2中所述)用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到ph~4.55(例如ph 4.49、 4.53、4.54、4.55或4.66),然后在4℃下储存直到测量剪切应力,通常从 1-7天,诸如5天,然后轻轻搅拌并以剪切速率300s-1
下测量剪切应力,其中所述接种温度是30℃。使用实施例2中所示的方法测量剪切应力。
[0401]
在一个优选的实施方案中,步骤(a)中提供了乳酸乳球菌乳酸菌(lab) 菌株是包含能够产生胞外多糖(eps)的活性eps基因簇的乳酸乳球菌乳酸菌(lab)菌株,其中所述eps基因簇选自:
[0402]
(i)如seq id no.:1所限定的核苷酸序列;
[0403]
(ii)如seq id no.:2所限定的核苷酸序列;
[0404]
(iii)如seq id no.:3所限定的核苷酸序列;
[0405]
(iv)如seq id no.:4所限定的核苷酸序列;和
[0406]
(v)如seq id no.:5所限定的核苷酸序列。
[0407]
在一个优选的实施方案中,步骤(a)中提供了乳酸乳球菌乳酸菌(lab) 菌株,其包含如seq id no.:1所限定的eps基因簇,属于mlst(多位点序列分型)组st76,其中mlst分析如实施例4中所述进行,即,用在科汉森开发的12基因mlst方案。所述方案基于选自乳酸杆菌科的核心基因组的12个基因dnak、fusa、groel、gyra、gyrb、iles、lepa、phes、 reca、rpoa、rpob和rpoc(salvetti等人,2018)。在此方案中使用了总共22493bp,因此其几乎占平均乳球菌属基因组的1%。用illumina全基因组序列进行mlst分型是在clc微生物基因组学模块的帮助下进行的,该模块是clc基因组学工作台v10的插件。在clc中,将mlst整合到科汉森定制设计的标准基因组序列分析流水线中。它在从头重叠群和参考组件上都执行。
[0408]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:2所限定的eps基因簇,或其包含与如seq id no.:2所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株属于mlst (多位点序列分型)组st76。
[0409]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌(lab)菌株,其包含如seq id no.:3所限定的eps基因簇,或其包含与如seq id no.:3所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株属于mlst (多位点序列分型)组st76。
[0410]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:4所限定的eps基因簇,或其包含与如seq id no.:4所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株属于mlst (多位点序列分型)组st76。
[0411]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌(lab)菌株,其包含如seq id no.:5所限定的eps基因簇,或其包含与如seq id no.:5所限定的核苷酸序列相差不多于5个核苷酸,优选不多于4个核苷酸,更优选不多于3个核苷酸,甚至更优选不多于2个核苷酸,最优选不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株属于mlst(多位点序列分型)组st140。
[0412]
如上所讨论的,如实施例4所述进行mlst分析,即,用在科汉森开发的12基因mlst方案。所述方案基于选自乳酸杆菌科的核心基因组的 12个基因dnak、fusa、groel、gyra、gyrb、iles、lepa、phes、reca、rpoa、 rpob和rpoc(salvetti等人,2018)。在此方案中使用了总共22493bp,因此其几乎占平均乳球菌属基因组的1%。用illumina全基因组序列进行 mlst分型是在clc微生物基因组学模块的帮助下进行的,该模块是clc 基因组学工作台v10的插件。在clc中,将mlst整合到科汉森定制设计的标准基因组序列分析流水线中。它在从头重叠群和参考组件上都执行。
[0413]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:1所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约15h或更短时间(15h或更短的“达到ph 4.55的时间”)内,优选在约13h或更短时间(13h或更短的“达到ph 4.55的时间”)内,更优选在约12h或更短时间(12h或更短的“达到ph 4.55的时间”)内,甚至更优选在约11h或更短时间(11h或更短的“达到ph 4.55的时间”)内生成ph
约4.55的发酵乳,在以下条件下测量:
[0414]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌珠的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0415]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:1所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约21h或更短时间(21h或更短的“达到ph 4.55的时间”)内,优选在约16h或更短时间(16h或更短的“达到ph 4.55的时间”)内,更优选在约11h或更短时间(11h或更短的“达到ph 4.55的时间”)内,甚至更优选在约8h或更短时间(8h或更短的“达到ph 4.55的时间”)内生成ph约4.55(诸如ph约4.49、4.53或 4.55)的发酵乳,在以下条件下测量:
[0416]
将1%体积(2ml)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到如上所述的ph约4.55(诸如ph约4.49、4.53或4.55)。
[0417]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:2所限定的eps基因簇,或其包含与如seq id no.:2所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约 15h或更短时间(15h或更短的“达到ph 4.55的时间”)内,优选在约 13h或更短时间(13h或更短的“达到ph 4.55的时间”)内,更优选在约 12h或更短时间(12h或更短的“达到ph 4.55的时间”)内,甚至更优选在约9h或更短时间(9h或更短的“达到ph 4.55的时间”)内生成具有 ph约4.55的发酵乳,在以下条件下测量:
[0418]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0419]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:2所限定的eps基因簇,或其包含与如seq id no.:2所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约 21h或更短时间(21h或更短的“达到ph 4.55的时间”)内,优选在约 11h或更短时间(11h或更短的“达到ph 4.55的时间”)内,更优选在约10.5h或更短时间(10.5h或更短的“达到ph 4.55的时间”)内生成 ph约4.55(诸如ph约4.54、4.55或4.66)的发酵乳,在以下条件下测量:
[0420]
将1%体积(2ml)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到如上所述的ph约4.55(诸如ph约4.54、4.55或4.66)。
[0421]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:3所限定的eps基因簇,或其包含与如seq id no.:3所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约 14h或更短时间(14h或更短的“达到ph 4.55的时间”)内,优选在约 12h或更短时间(12h或更短的“达到ph 4.55的时间”)内生成ph约 4.55的发酵乳,在以下条件下测量:
[0422]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0423]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:3所限定的eps基因簇,或其包含与如seq id no.:3所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约 7.5h或更短时间(7.5h或更短的“达到ph4.55的时间”)内生成ph约 4.55的发酵乳,在以下条件下测量:
[0424]
将1%体积(2ml)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到ph约4.55。
[0425]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:4所限定的eps基因簇,或其包含与如seq id no.:4所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约13h或更短时间(13h或更短的“达到ph 4.55的时间”)内,优选在约 11h或更短时间(11h或更短的“达到ph 4.55的时间”)内生成ph约 4.55的发酵乳,在以下条件下测量:
[0426]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0427]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:4所限定的eps基因簇,或其包含与如seq id no.:4所限定的核苷酸序列相差不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约 10h或更短时间(10h或更短的“达到ph 4.55的时间”)内生成ph约 4.55的发酵乳,在以下条件下测量:
[0428]
将1%体积(2m1)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到ph约4.55。
[0429]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:5所限定的eps基因簇,或其包含与如seq id no.:5所限定的核苷酸序列相差不多于5个核苷酸,优选不多于4个核苷酸,更优选不多于3个核苷酸,甚至更优选不多于2个核苷酸,最优选不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约10h或更短时间(10h或更短的“达到ph-4.55的时间”)内,优选在约8h或更短时间(8h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0430]
将200ml半脂乳(1.5%脂肪)加热至90℃持续20min,然后冷却至接种温度(30℃),并且用2ml乳酸菌菌株的过夜培养物接种,并置于接种温度下直到达到ph 4.55。
[0431]
在另一个优选的实施方案中,在步骤(a)中提供了乳酸乳球菌乳酸菌 (lab)菌株,其包含如seq id no.:5所限定的eps基因簇,或其包含与如seq id no.:5所限定的核苷酸
序列相差不多于5个核苷酸,优选不多于4个核苷酸,更优选不多于3个核苷酸,甚至更优选不多于2个核苷酸,最优选不多于1个核苷酸的核苷酸序列所限定的eps基因簇,所述乳酸乳球菌乳酸菌(lab)菌株能够在约10.5h或更短时间(10.5h或更短的“达到ph 4.55的时间”)内生成ph约4.55的发酵乳,在以下条件下测量:
[0432]
将1%体积(2ml)过夜微生物培养物(通过在30℃下将微生物培养物接种于添加2%葡萄糖的m17肉汤培养基中获得)接种于含有葡萄糖 (诸如0.5-5%葡萄糖,优选0.5-2%葡萄糖,更优选约2%葡萄糖)的200 ml豆乳中,并置于接种温度(30℃)下直到达到ph约4.55。
[0433]
本领域技术人员知晓根据步骤a)提供乳酸乳球菌乳酸菌(lab)菌株的方法。比如,菌株可从不同来源分离,并且eps基因簇可通过本领域已知的手段测序。另外,可以获得突变体,并且可以通过本领域已知的手段对突变体的eps基因簇进行测序。根据步骤a)的乳酸乳球菌乳酸菌(lab) 菌株也可以通过基因工程提供。携带所需eps基因簇的寡核苷酸可用于通过pcr扩增特定dna片段。将携带所需序列的pcr片段克隆到载体质粒中并转化到另一乳酸菌(lab)目标菌株中。
[0434]
除非本文另有说明或与上下文明显矛盾,否则本发明包括上述要素、方面和实施方案在其所有可能变化中的任何组合。下面仅通过实施例描述本发明的实施方案。
[0435]
实施例
[0436]
实施例1.质地化菌株的高通量筛选和乳凝胶质地的测量
[0437]
乳酸乳球菌用于生产许多发酵乳制品,其包括乳酪和嗜中温发酵乳,诸如酪乳和酸奶油。产生多糖的菌株对于这些应用是非常有益的,因为释放到培养基中的多糖可以导致酪乳和酸奶油改善质地化性质,而荚膜多糖可以导致改善持水能力并因此改善产量,例如乳酪的产量。
[0438]
当用通常属于例如嗜热链球菌(streptococcus thermophilus)、乳酸杆菌属菌种(lactobacillus spp.)和乳酸乳球菌菌种(lactococcus lactis spp.) 的乳酸菌发酵时,乳(液体)通常转化为乳凝胶(软固体)。流变仪或质地分析仪通常用于评估发酵乳凝胶的流变学性质,诸如剪切应力。当通过感官小组评估乳凝胶的质地时,剪切应力测量与感知的口腔厚度相关。高口腔厚度被认为是发酵乳凝胶诸如酸奶的重要品质因素,并且消费者接受度通常与质地化性质如口腔厚度非常紧密相关,其为剪切应力的函数。
[0439]
如poulsen等2019年所介绍的,在单个移液器的排气筒内配备有压力传感器的液体处理单元(hamilton robotics microlab star)用于筛选质地化菌珠。液体处理器具有位于每个移液通道的顶部空间的压力传感器。来自每个传感器的压力数据由hamilton robotics microlab star液体处理器 (hamilton robotics)的tadm(total aspiration dispense monitoring)软件收集,并用于评估乳凝胶样品的相对剪切应力。
[0440]
如上所述,使用hamilton液体处理自动仪的tadm工具以2-ml规模筛选来自高通量筛选菌株库的乳酸乳球菌的质地化性质。压力与时间数据 (tadm)是从96孔微量滴定板中制备的2-ml样品获得的,其中b-乳在 30℃下在存在不同菌株(1%接种物)的情况下接种持续20h,除非另有说明,然后在4℃下储存1天。hamilton液体处理单元用于测量抽吸过程中的压力,并使用抽吸过程中获得的压力曲线上方的面积来比较菌株的质地化能力。
[0441]
通过在半脂乳(1.5%脂肪)中接种相同的微生物培养物获得剪切应力数据;乳在
90℃下加热20min并冷却至接种温度,然后接种1%体积的过夜微生物培养物。接种在30℃下以200-ml规模进行8-22小时,直到 ph~4.55,然后冷却至4℃并储存直到测量剪切应力,通常在4℃下1-7天,例如5天。储存后,通过装配有带孔盘的棒轻轻搅拌发酵乳直到样品均匀。使用以下设置在流变仪(具有asc的安东帕物理流变仪,自动样品转换器,gmbh,奥地利)上评估样品的剪切应力:
[0442]-等待时间(以重建至稍微原始的结构)
[0443]-5分钟无振荡或旋转
[0444]-旋转(以在300s-1
下测量剪切应力等)
[0445]-y’=[0.2707-300]s-1
和y’=[275-0.2707]s-1
[0446]
在210s期间21个测量点(每10s一个)上升到300s-1
,并在210s 期间21个测量点(每10s一个)下降到0.2707s-1
。对于数据分析,选择在剪切速率300s-1
下的剪切应力。
[0447]
使用如上所述的流变仪证实了22种新菌株dsm 33193、33226、33194、 33133、33195、33196、33197、33200、33201、33202、33203、33204、33205、 33218、33219、33220、33221、33222、33223、33224、33225和33192的优良的质地化能力。此外,使用如上所述的流变仪也证实了菌株dsm25485的优良的质地化能力。结果如表1所示。
[0448]
表1.在30℃下热处理的半脂乳中孵育的选择的质地化菌株(1%接种物)
±
酵母提取物(0.2%,详见下文)
±
潜在共酸化剂(dsm 24649或 dsm 25485)的剪切应力和达到ph 4.55的时间。一些正在研究的菌株是慢酸化剂,并且需要酵母提取物或共酸化剂菌株的存在以在可接受的时间内酸化乳,例如约13h或更短时间达到ph 4.55。菌株dsm 24649和dsm25485单独使用或与正在研究的菌株组合使用和/或用作潜在共酸化剂(10 %接种物-其对应于比例9∶1(选择的质地化菌株∶共酸化剂菌株))。通常,使用1%菌株在乳中的接种物(即,加入到200ml乳中的m17培养基中的2ml过夜接种物)。当使用单一菌株作为接种物时,将2ml(100 %)此菌株加入到200ml乳中(乳中1%接种物)。当菌株与共酸化剂一起使用时,使用90%的正在研究的菌株(1.8m1)和10%(0.2m1)的共酸化剂(10%的接种物用于共酸化剂,比例9∶1(选择的质地化菌株∶共酸化剂菌株))。
[0449]
[0450][0451]
由于增强的质地与多糖的产生有关,因此进行了eps基因簇的挖掘。 eps基因簇通常是乳酸乳球菌乳酸亚种的染色体,但可能存在于乳酸乳球菌乳脂亚种的质粒上(poulsen等人,2019)。一般来说,eps基因簇是高度多样化的,它们的核苷酸序列是lab基因组中最多变的序列。而且,多糖分子的结构多样性是巨大的。多糖的类型和大小及其与乳蛋白的相互作用是质地发展的决定因素。
[0452]
所有22种菌株(dsm 33193、33226、33194、33133、33195、33196、 33197、33200、33201、33202、33203、33204、33205、33218、33219、33220、 33221、33222、33223、33224、33225和33192)具有与nizo b40菌株相似的eps基因簇(图1)。由于已知乳酸乳球菌乳脂亚种nizo b40中的 eps簇位于质粒上,因此它很可能也位于上述菌株的质粒上。
[0453]
此外,据信上述菌株的基因组含量可能不同,表型也可能不同,参见实施例5。
[0454]
实施例2.豆乳质地的流变学测量
[0455]
对添加2%葡萄糖的豆乳中的22种乳酸乳球菌菌株进行流变学测量。
[0456]
本实施例中测试的菌株如下:dsm 24649;dsm 25485;dsm 33192; dsm 33193;dsm 33226;dsm 33194;dsm 33133;dsm 33195;dsm33196;dsm 33197;dsm 33200;dsm 33201;dsm 33202;dsm 33203; dsm 33204;dsm 33205;dsm 33218;dsm 33219;dsm 33220;dsm33221;dsm 33222;dsm 33223;dsm 33224和dsm 33225。
[0457]
所用的乳基是添加2%葡萄糖的豆乳:豆乳是有机的且不加糖的,获自天然食品公司(naturli
′
foods),每100ml具有以下成分:
[0458]
脂肪:2.1g-其中饱和脂肪:0.4g
[0459]
碳水化合物:0.1g-其中糖:0.1g
[0460]
纤维:0.6g
[0461]
蛋白质:3.7g
[0462]
盐:0.04g。
[0463]
该乳已经是无菌的,在使用前没有对其进行任何预处理。它添加了2%的葡萄糖。
[0464]
将1%体积的过夜微生物培养物(通过在30℃下将微生物培养物接种在添加2%葡萄糖的m17肉汤培养基中获得)接种在含2%葡萄糖的豆乳中。在30℃下以200-ml规模进行接种直到ph~4.55(每个培养物达到的具体ph值见表3),然后冷却至4℃并储存直到测量剪切应力,通常从1-7天,诸如5天。储存后,通过装配有带孔盘的棒轻轻搅拌发酵乳直到样品均匀。使用以下设置在流变仪(具有asc的安东帕物理流变仪,自动样品转换器,gmbh,奥地利)上评估样品的剪切应力:
[0465]-等待时间(以重建至稍微原始的结构)
[0466]-5分钟无振荡或旋转
[0467]-旋转(以在300s-1
下测量剪切应力等)
[0468]-y’=[0.2707-300]s-1
和y’=[275-0.2707]s-1
[0469]
在210s期间21个测量点(每10s一个)上升到300s-1
,并在210s期间21个测量点(每10s一个)下降到0.2707s-1
。对于数据分析,选择在剪切速率300s-1
下的剪切应力。
[0470]
剪切应力(pa)的结果示于下表2中。“alpro”是指“alpronaturellmild&creamyplantgurt”,一种来自“alpro”的市售发酵豆乳(https://www.alpro.com/se/produkter/vaxtbaserad-yoghurt-variant/mild-creamy/mild-creamy-naturell/),其中每100ml具有以下组成:
[0471][0472]
并且含有以下成分:水、去皮大豆(7.9%)、糖、柠檬酸三钙、稳定剂(果胶)、酸度调节剂(柠檬酸钠、柠檬酸)、海盐、抗氧化剂(富含生育酚的提取物、可食用脂肪酸的抗坏血酸
酯)、维生素(b12、d2)、酸奶培养物(嗜热链球菌(s.thermophilus),保加利亚乳杆菌(l. bulgaricus))。值得注意的是,alpro包含果胶,其增加了发酵乳的质地。然而,在此实施例中使用的基乳(添加2%葡萄糖的豆乳)不包括果胶。
[0473]
表2.如上所述,在不含2%葡萄糖的豆乳中孵育的选择的质地化菌株(1%的接种物)在若干剪切速率(s-1
)下的剪切应力(pa)。
[0474][0475]
从表2中可以看出,与阴性对照(dsm 24649)相比,当发酵豆乳添加2%葡萄糖时,所有选择的质地化菌株都表现出更高的剪切应力。另外,菌株dsm 33221、dsm 33224、dsm 33222、dsm 33203、dsm 33223、dsm 33205、dsm 33219、dsm 33195、dsm 33226、dsm 33204、dsm33194、dsm 33197、dsm 33196、dsm 33220和dsm 33193表现出与如上所述的包含果胶的市售发酵豆制品(“alpro”)相比更高的剪切应力。
[0476]
最后,各菌株达到的ph和达到此ph的时间(小时)示于表3中。
[0477]
表3.如上所述,在添加2%葡萄糖的豆乳中孵育选择的质地化菌株(1 %接种物)的达到ph的时间。
[0478][0479]
实施例3.测序乳球菌的菌株(lactococcal strains)基因组和表征它们的eps基因簇
[0480]
如等人(agersoe等人,2018)所述,菌株的基因组在科汉森内部测序。简而言之,纯化总dna并用于制备250bp配对末端文库,用于使用iilumina miseq系统进行基因组测序。使用clc基因组工作台,版本10.1.1(clc bio,qiagen bioinformatics)中的从头组装算法对测序读段进行质量微调(phred评分<25)并组装成重叠群。通过除去覆盖度为<15x 和/或<20%的组件中值覆盖度的重叠群,过滤得到基因组组件。剩余重叠群的共有序列以fasta格式输出,其称为基因组序列草图,并用于后续的序列分析。
[0481]
下表4显示上述菌株的eps基因簇的百分比同一性矩阵。使用具有标准参数的多序列比对工具clustal omega(clustal2.1) (https://www.ebi.ac.uk/tools/msa/clustalo/)评估菌株的eps基因簇的序列同一性(在核苷酸水平上)。
[0482]
表4.同一性矩阵。两种菌株之间的同一性表示为在相应菌株(通过其 dsm保藏号鉴定)之间的交叉上发现的数字(以%计),一个在一行中,另一个在一列中。
[0483][0484]
该nizo b40菌株包含42180bp eps-质粒pnz4000(van kranenburg 等人,2000),含有12kb nizo b40 eps基因簇和14个协同表达的基因。此菌株产生具有以下重复单元的聚合物:
→
4)[α-l-rhap-(1
→
2)][α-d-galp
‑ꢀ
1-po4-3]-β-d-galp-(1
→
4)-β-d-glcp-(1
→
4)-β-d-glcp-(1
→
(van casteren等人,1998):
[0485][0486]
乳酸乳球菌nizo b40的eps基因簇的基因功能性在kleerebezem等人 (2002)和van kranenburg等人(1999)的综述中。基于序列比较,推定的功能可以被分配给几个eps基因,通过向膜锚定的脂质载体按顺序添加糖来预测它们参与重复单元寡糖的生物合成,和后续输出(通过wzx)和聚合(通过wzy)这些脂质连接的寡糖。epse将葡萄糖-1-磷酸从udp-葡萄糖连接到脂质载体,gt1和gt2将葡萄糖从udp-葡萄糖连接到脂质连接的葡萄糖, gt3将半乳糖从udp-半乳糖连接到脂质连接的纤维二糖。含有glyphos_trans 结构域(pfam04464)的蛋白质是磷酸转移酶,似乎作为半乳糖基磷酸转移酶或作为从脂质载体释放骨架寡糖的酶参与eps生物合成。gt4似乎参与将鼠李糖连接到b40-eps重复单元(kleerebezem等人,2002;van kranenburg等人1999)。
[0487]
菌株dsm 33193、33226、31194、33133、33195、33196、33197、33200、 33201、33202、33203、33204、33205、33218、33219、33220、33221、33222、 33223、33224、33225和33192的eps基因簇与乳酸乳球菌nizo b40的eps 基因簇相似但不相同。它包括15个开放阅读框架(orf),除了簇的最后一个基因lytr外,以相同的转录方向定向(图1)。如同一性矩阵所示,这些 eps基因簇与菌株nizo b-40的eps基因簇相似但不相同。与菌株dsm 33193、 33226、33194、33133、33195、33196、33197、33200、33201、33202、33203、 33204、33205、33218、33219、33220、33221、33222、33223、33224、33225 和33192相比,在nizo b40菌株中发现了至少一个单核苷酸多态型。核苷酸1276在b40中是g,在所有科汉森的菌珠中是a。它导致蛋白质epsc中的氨基酸从nizo b40中的碱性氨基酸精氨酸(r,由cga表示)变为科汉森的菌株中的极性氨基酸谷氨酰胺(q,由caa表示)。氨基酸变化可能会影响例如产生的eps的量,进而可能对用这些菌株发酵的乳的质地产生影响。
[0488]
具有相同名称的eps基因在不同生物体中通常具有不同的功能,因为这些基因通常按字母顺序在给定位点中按出现顺序指定,而不是基于它们的功能(参见zeidan等人,2017年的综述)。在nizo菌株b40中,eps聚合酶命名为epsl,输出基因为epsk(例如vankranenburg等人,2000),而在smq
‑ꢀ
461中,具有相应功能的基因命名为epsh和epsm。我们根据zeidan等人 (2017)提出的命名法命名了菌株的保守基因(图1)。在本专利申请中,聚合酶和翻转酶基因分别被命名为wzy和wzx,而van kranenburg等人(2000) 的文献中的基因epsabcd对应于poulsen等人(2019)的文献中和在本专利申请中的epscdbe。
[0489]
实施例4.mlst(多位点序列分型)分析
[0490]
mlst(多位点序列分型)分析和指纹分析用于研究含有nizob40样eps 基因簇的菌株在基因组的剩余部分中是否彼此相似。
[0491]
乳球菌的菌株用在科汉森开发的12基因mlst方案分型。所述方案基于选自乳酸杆菌科的核心基因组的12个基因dnak、fusa、groel、gyra、gyrb、 iles、lepa、phes、reca、rpoa、rpob和rpoc(salvetti等人,2018)。在此方案中使用了总共22493bp,因此其几乎占平
and cell cultures inhoffenstr. 7b,38124 braunschweig,germany)。
[0499]
[0500][0501]
参考文献
[0502]
1.zeidan等人,2017,《乳酸菌生产多糖:从基因到工业应用》(polysaccharideproductionbylacticacidbacteria:fromgenestoindustrialapplications.femsmicrobiolrev41:168-200)。
[0503]
2.bentleys.d.等人,2006,《来自所有90种肺炎球菌血清型的荚膜生物合成位点的遗传分析》(geneticanalysisofthecapsularbiosyntheticlocusfromall90pneumococcalserotypes,plosgenet.2:e31)。
[0504]
3.dabourn.,lapointeg.,2005,《来自乳酸乳球菌乳脂亚种smq-461的染色体胞外多糖生物合成基因簇的鉴定和分子表征》(identificationandmolecularcharacterizationofthechromosomalexopolysaccharidebiosynthesisgeneclusterfromlactococcuslactissubsp.cremorissmq-461,applenvironmicrobiol.,71:7414-7425)。
[0505]
4.nieropgrootm.n.,kleerebezemm.,2007,《乳酸乳球菌nizob40胞外多糖(eps)基因簇的突变分析:eps生物合成与未磷酸化的epsb相关》(mutationalanalysisofthelactococcuslactisnizob40exopolysaccharide(eps)genecluster:epsbiosynthesiscorrelateswithunphosphorylatedepsb,japplmicrobiol.,103:
2645-2656)。
[0506]
5.pand.,meix.2010,《从乳酸乳球菌乳酸亚种12中纯化的胞外多糖的抗氧化活性》(antioxidantactivityofanexopolysaccharidepurifiedfromlactococcuslactissubsp.lactis12,carbohydratepolymers,80:908-914)。
[0507]
6.savijoki,k.等人,2006,《乳酸菌蛋白水解系统》(proteolyticsystemsoflacticacidbacteria,applmicrobiolbiotechnol,71:394-406)。
[0508]
7.suzukic.等人,2013,《乳酸乳球菌乳酸亚种生产的新的胞外多糖以及胞外多糖生物合成基因簇中epse基因的多样性》(novelexopolysaccharidesproducedbylactococcuslactissubsp.lactis,andthediversityofepsegenesintheexopolysaccharidebiosynthesisgeneclusters,bioscibiotechnolbiochem.,77:2013-2018)。
[0509]
8.tangyu等人,2019,《发酵植物基牛奶替代品以改进风味和营养价值》(fermentationofplant-basedmilkalternativesforimprovedflavourandnutritionalvalue,appliedmicrobiologyandbiotechnology,103:9263-9275)。
[0510]
9.vankranenburgr.等人,1999,《来自乳酸乳球菌和其他革兰氏阳性球菌的糖基转移酶基因的功能分析:互补、表达和多样性》(functionalanalysisofglycosyltransferasegenesfromlactococcuslactisandothergram-positivecocci:complementation,expression,anddiversity,jbacteriol.,181:6347-6353)。
[0511]
10.whittallj.j.等人,2015,《肺炎链球菌cpsc的拓扑结构,一种多糖共聚酶和by激酶衔接蛋白》(topologyofstreptococcuspneumoniaecpsc,apolysaccharideco-polymeraseandby-kinaseadaptorprotein,jbacteriol197:120-127)。
[0512]
11.kleerebezem等人(2002)《乳酸乳球菌的代谢工程:基因组学和代谢建模的影响》(metabolicengineeringoflactococcuslactis:theimpactofgenomicsandmetabolicmodelling.j.biotechnol.98:199-213)。
[0513]
12.vankranenburg等人(1999)《乳酸乳球菌nizob40中的胞外多糖生物合成:参与多糖骨架合成的糖基转移酶基因的功能分析》(exopolysaccharidebiosynthesisinlactococcuslactisnizob40:functionalanalysisoftheglycosyltransferasegenesinvolvedinsynthesisofthepolysaccharidebackbone,jbacteriol.,181:338-340)。
[0514]
13.vankranenburg等人(2000)《乳球菌eps质粒pnz4000的核苷酸序列分析》(nucleotidesequenceanalysisofthelactococcalepsplasmidpnz4000,plasmid,43:130-136)。
[0515]
14.vancasteren等人(1998)《乳酸乳球菌乳脂亚种b40产生的胞外多糖的表征和修饰》(characterisationandmodificationoftheexopolysaccharideproducedbylactococcuslactissubsp.cremorisb40,carbohydratepolymers,37:123-130)。
[0516]
15.agersoey等人(2018)《用于动物饲料添加剂或植物保护相关的五种芽孢杆菌的抗菌药物敏感性试验和暂定流行病学临界值》(antimicrobialsusceptibilitytestingandtentativeepidemiologicalcutoffvaluesforfivebacillusspeciesrelevantforuseasanimalfeedadditivesorforplantprotection,appl
environmicrobiol,84(19))。
[0517]
16.salvetti等人,2018,《乳酸杆菌属的比较基因组学揭示为重新分类提供基础的强大遗传谱系》(comparativegenomicsofthegenuslactobacillusrevealsrobustphylogroupsthatprovidethebasisforreclassification,applenvironmicrobiol.,84(17)doi:10.1128/aem.00993)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
