1.本发明涉及药物化学技术领域,具体涉及一种蒽甲基-双胍类化合物及其制备方法和其对宫颈癌细胞、胃癌细胞的杀灭应用。
背景技术:
2.双胍类化合物在现代药物研发中扮演了越来越重要的角色。目前,双胍类化合物在抗疟疾、抗菌、降糖药等领域有非常成功的应用(eur j.med.chem.,2021,219,113378.)。例如二甲双胍,自1879年首次被发现以来,已经成为糖尿病治疗的一线药物。近来有研究发现,二甲双胍不仅具有治疗糖尿病的功效,而且可以通过激活腺苷活化蛋白激酶(ampk),抑制mtor信号通路和胰岛素样生长因子信号转导、活化抑癌基因p53阻滞肿瘤细胞周期等途径,具有了预防和治疗多种类型的癌症的潜力(j.chem.soc.,trans.,1922,121,1790-1794)。有研究证明,接受二甲双胍治疗的糖尿病患者的肝癌、胰腺癌、结肠癌等癌症死亡率明显低于只接受磺脲类降糖药或胰岛素治疗的患者(trends pharmacol sci,2018,39,867-878)。双胍类化合物联合天然抗癌活性物质或铂类化合物联合用药,被发现可以有效增加抗癌药物对肿瘤细胞的敏感性。例如(1)二甲双胍被发现可以有效提高紫杉醇对肿瘤细胞的敏感性;(2)二甲双胍联合多柔比星可以显著抑制急性早幼粒细胞白血病细胞系nb的生长;(3)二甲双胍联合奥沙利铂可以通过抑制erk和akt信号通路,有效降低直肠癌细胞对奥沙利铂的抗药性。((a)j cell biochem,2018,119,6943-6952;(b)j thorac oncol,2018,13,1692-1704;(c)中国肿瘤生物治疗杂志,2013,20,575-579.)
3.可惜的是,二甲双胍因为组织生物利用度较低,而且对肿瘤细胞的半数致死浓度(ic
50
值)在毫摩尔范围内,使得二甲双胍的抗肿瘤作用难以在临床上使用(front pharmacol,2018,9,899)。然而,目前尚未见双胍结构与蒽类药物相结合的抗癌药物研发报道,因此本发明将提出一种蒽甲基-双胍类化合物及其合成方法和抗肿瘤应用。
技术实现要素:
4.本发明的目的在于提供蒽甲基-双胍类抗癌化合物及其制备方法和应用。具体的为一种蒽甲基-双胍类化合物及其制备方法,还包括对人宫颈癌细胞株hela、胃癌细胞株mkn45的杀灭应用,即制备抗癌药物中的应用。
5.为实现上述发明目的之一,本发明产物的技术方案实施如下:
6.本发明所述的一种蒽甲基-双胍类化合物,其具有如式x所示的结构,
7.8.其中,r1选自或者
9.为实现上述发明目的之二,本发明的合成方法的技术方案如下:
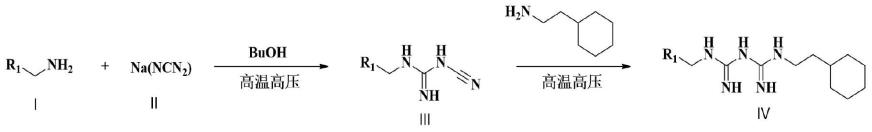
10.上述一种蒽甲基-双胍类化合物的合成方法,关键步骤包括:
[0011][0012]
其中,式ⅰ中,r1选自或者
[0013]
步骤1.在耐压瓶中将化合物ⅰ溶解于有机溶剂中,向反应体系中分别加入酸和二氰氨钠,高温加压反应后,柱色谱分离得到淡黄色固体化合物ⅲ。
[0014]
优选,步骤1)中的反应温度为120-150℃,有机溶剂可以为异丙醇、正丁醇、乙醇、甲苯、n,n-二甲基甲酰胺中的任意一种,酸可以为盐酸、硫酸、醋酸中的任意一种。
[0015]
步骤2.在耐压瓶中将化合物ⅲ和过量2-环己基乙胺溶解于有机溶剂中,向反应体系中分别加入酸后,在高温高压条件下直至反应结束,柱色谱得到淡黄色固体化合物ⅳ。
[0016]
优选,步骤2中的反应温度为120-150℃,有机溶剂可以为异丙醇、正丁醇、乙醇、甲苯、n,n-二甲基甲酰胺中的任意一种,酸可以为盐酸、硫酸、醋酸中的任意一种。
[0017]
为实现上述发明目的之三,本发明的合成方法的技术方案如下:
[0018]
上述一种蒽甲基-双胍类化合物制备抗肿瘤药物的应用。具体的,上述蒽甲基-双胍类化合物在制备胃癌治疗药物和宫颈癌治疗药物中的应用,并且所述肿瘤细胞株种类为人宫颈癌细胞株hela、胃癌细胞株mkn45。
[0019]
有益效果:
[0020]
首先,本发明提供了一种结构新颖的蒽甲基-双胍类化合物,为首次合成。其次,本发明的蒽甲基-双胍类化合物对宫颈癌细胞株hela、胃癌细胞株mkn45均表现出显著的杀灭作用,ic
50
值最低分别可达3.58μm和6.81μm,能够制备新型宫颈癌或胃癌治疗药物的应用,即作为新型抗癌药物的使用。最后,本发明所涉及的蒽甲基-双胍类化合物以市售化合物为底物,通过两步化学反应即可完成,具有制备条件简单,易于分离等优点。
附图说明
[0021]
附图用来提供对本发明技术方案的进一步理解,并且构成说明书的一部分,与本技术的具体实施方式一起用于解释本发明的技术方案,并不构成对本发明技术方案的限制。
[0022]
图1为化合物15的核磁波谱。
[0023]
图2为化合物16的核磁波谱。
[0024]
图3为化合物20的核磁波谱。
[0025]
图4为化合物21的核磁波谱。
[0026]
图5为化合物16对胃癌细胞株mkn45的半数抑制图。
[0027]
图6为化合物16对人宫颈癌细胞株hela的半数抑制图。
具体实施方式
[0028]
下面将参照附图对本发明进行更详细的描述,其中表示了本发明的优选实施例,应该理解本领域技术人员可以修改在此描述的本发明而仍然实现本发明的有益效果,其中,实施例1-2记载了本发明化合物的制备方法,实施例3记载了实施例的活性试验的有效数据。因此,下列描述应当被理解为对于本领域技术人员的广泛知道,而并不作为对本发明的限制。
[0029]
为了清楚,不描述实际实施例的全部特征。在下列描述中,不详细描述公知的功能和结构,因为它们会使本发明由于不必要的细节而混乱。应当认为在任何实际实施例的开发中,必须作出大量实施细节以实现开发者的特定目标。
[0030]
为使本发明的目的、特征更明显易懂,下面结合附图对本发明的具体实施方式作进一步的说明。需要说明的是,附图均采用非常简化的形式且均使用非精准的比率,仅用于方便、清晰地辅助说明本发明实施例的目的。
[0031]
实施例1蒽甲基-双胍类化合物16的制备:
[0032][0033]
步骤1.在氩气保护下,将蒽醌(10)(10.5g,50mmol)溶解在350ml干燥的四氢呋喃溶液中,将体系冷却至-78摄氏度后,将甲基锂的乙醚溶液(100ml,1.5m/l,150mmol)缓慢地逐滴加入到反应体系中,滴加完毕后,将反应混合液缓慢地升温到室温,继续搅拌并反应3小时。tlc监测反应完毕后,将100ml水加入到反应体系中淬灭反应。用二氯甲烷萃取(3
×
80ml)、合并有机相,无水硫酸钠干燥有机层,旋干无需进一步纯化,直接用于下一步反应。
[0034]
步骤2.将化合物11(10mmol)溶解在250ml四氢呋喃溶液中,将50ml 48%的氢溴酸加入到反应体系中后,常温继续反应1小时。体系中有大量淡黄色晶体出现,过滤、干燥后得目标化合物12,粗产率67%,产物无需纯化直接进行下一步反应。
[0035]
步骤3.将化合物12(5mmol)溶解于20ml二甲基亚砜溶液中,将10mmol的叠氮化钠
分批小心地加入到反应液中,加热至50摄氏度继续反应3小时后,向体系中加入50ml水淬灭反应,用二氯甲烷萃取(3
×
50ml)后,合并有机相,无水硫酸钠干燥,旋干,用v
石油醚
/v
乙酸乙酯
=8:1过柱,得到淡黄色固体化合物13,产率86%。
[0036]
化合物13:1h nmr(400mhz,cdcl3)δ:8.38(dd,j=1.6hz,j=8.4hz,2h),8.33(dd,j=1.2hz,j=8.4hz,2h),7.55-7.61(m,4h),5.34(s,2h),3.15(s,3h);esi-hrms calcd for c
16h13
n3na([m na]
)270.1002,found 270.1008。
[0037]
步骤4.在室温搅拌下,向圆底烧瓶中将3mmol叠氮化物13溶解于20ml甲醇中,加入0.1mmol 5%钯碳,氢气球还原条件下搅拌反应10h,tlc监测反应结束后,硅藻土过滤得到有机相,旋干,用v
石油醚
/v
乙酸乙酯
=10:1过柱,得到淡黄色固体化合物14,产率92%。化合物14:1h nmr(400mhz,cdcl3)δ:8.34-8.37(m,4h),7.51-7.60(m,4h),4.84(s,2h),3.07(s,3h);esi-hrms calcd for c
16h15
nna([m na]
)244.1097,found 244.1102。
[0038]
步骤5.在室温搅拌下,在耐压瓶中将1mmol化合物14溶解于5ml正丁醇中,向反应体系中分别加入3滴浓盐酸和2mmol二氰氨钠,加热到140℃并加压反应8小时后,直接旋干溶液,用v
石油醚
/v
乙酸乙酯
=1:1过柱,得到淡黄色固体化合物15,产率65%。
[0039]
化合物15:1h nmr(400mhz,d-dmso)δ:8.42(d,j=8.4hz,2h),8.36(d,j=8.4hz,2h),7.58-7.66(m,4h),5.26(d,j=4.4hz,2h),3.08(s,3h);esi-hrms calcd for c
18h16
n4na([m na]
)311.1267,found 311.1272。
[0040]
步骤6.在耐压瓶中将1mmol化合物15和1.5mmol 2-环己基乙胺15溶解于10ml正丁醇中,向反应体系中分别加入0.5ml 4n盐酸后,在140℃条件下继续反应8小时后,直接旋干溶液,用v
石油醚
/v
乙酸乙酯
=1:1过柱,得到淡黄色固体化合物16,产率24%。
[0041]
化合物16:1h nmr(400mhz,cdcl3)δ:8.34(d,j=9.6hz,2h),8.22(d,j=9.6hz,2h),7.49-7.58(m,4h),5.33(s,2h),4.09(t,j=8.8hz,1h),3.97-4.02(m,1h),3.11(s,3h),1.57-1.68(m,4h),1.30-1.44(m,4h),0.86-0.95(m,5h);esi-hrms calcd for c
26h33
n5na
([m na]
)438.2628,found 205.1015,438.2680。
[0042]
实施例2蒽甲基-双胍类化合物21的制备:
[0043][0044]
步骤1.将市售9-溴甲基蒽17(5mmol)溶解于20ml二甲基亚砜溶液中,将10mmol的叠氮化钠分批小心地加入到反应液中,加热至50摄氏度继续反应3小时后,向体系中加入50ml水淬灭反应,用二氯甲烷萃取(3
×
50ml)后,合并有机相,无水硫酸钠干燥,旋干,用v石油醚
/v
乙酸乙酯
=8:1过柱,得到淡黄色固体化合物18。
[0045]
步骤2.在室温搅拌下,向圆底烧瓶中将3mmol叠氮化物18溶解于20ml甲醇中,加入0.1mmol 5%钯碳,氢气球还原条件下搅拌反应10h,tlc监测反应结束后,硅藻土过滤得到有机相,旋干,用v
石油醚
/v
乙酸乙酯
=10:1过柱,得到淡黄色固体化合物19,两步产率45%。化合物19:1hnmr(400mhz,d-meoh)δ:8.55(s,1h),8.32(d,j=8.4hz,2h),8.06(d,j=8.4hz,2h),7.60-7.64(m,2h),7.51(t,j=8.4hz,2h),5.03(s,2h);esi-hrms calcd for c
15h13
nna([m na]
)230.0940,found 230.0954。
[0046]
步骤3.在室温搅拌下,在耐压瓶中将1mmol化合物19溶解于5ml正丁醇中,向反应体系中分别加入3滴浓盐酸和2mmol二氰氨钠,加热到140℃并加压反应8小时后,直接旋干溶液,用v
石油醚
/v
乙酸乙酯
=1:1过柱,得到淡黄色固体化合物20,产率62%。
[0047]
化合物20:1h nmr(400mhz,d-dmso)δ:8.62(s,1h),8.32(d,j=8.4hz,2h),8.11(d,j=8.4hz,2h),7.54-7.61(m,4h),7.12(s,br,1h),5.23(s,2h);esi-hrms calcd for c
17h14
n4na([m na]
)297.1111,found 297.1123。
[0048]
步骤4.在耐压瓶中将1mmol化合物20和1.5mmol 2-环己基乙胺15溶解于10ml正丁醇中,向反应体系中分别加入0.5ml 4n盐酸后,在140℃条件下继续反应8小时后,直接旋干溶液,用v
石油醚
/v
乙酸乙酯
=1:1过柱,得到淡黄色固体化合物21,产率24%。
[0049]
化合物21:1h nmr(400mhz,cdcl3)δ:8.47(s,1h),8.20(d,j=8.8hz,2h),8.01(d,j=8.0hz,2h),7.55(t,j=8.8hz,2h),7.47(t,j=8.8hz,2h),5.33(s,2h),3.98(t,j=7.2hz,2h),1.55-1.61(m,3h),1.24-1.38(m,2h),1.17-1.29(m,4h),0.85-0.92(m,4h);esi-hrms calcd for c
25h31
n5na([m na]
)424.2472,found 191.1024,424.2791.。
[0050]
实施例3药理试验
[0051]
评价蒽甲基-双胍类化合物16、21对人胶质瘤细胞株u251、宫颈癌细胞株hela、胃癌细胞株mkn45以及小鼠胶质瘤细胞株gl261的抑制活性。
[0052]
采用mtt(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)法测定蒽甲基-双胍类化合物对u251、mkn45、hela等三种人肿瘤细胞株及小鼠胶质瘤细胞株gl261的半数抑制浓度(ic
50
)。检测原理:mtt可透过细胞膜进入细胞内,活细胞线粒体中的琥珀脱氢酶能使外源性mtt还原为难溶于水的蓝紫色的针状甲瓒结晶并沉积在细胞中,结晶物能被二甲基亚砜(dmso)溶解,测定其吸光度可反应细胞存活率。半数抑制浓度(ic
50
)定义为当50%的肿瘤细胞存活时的药物浓度,根据测定的光密度(od值),制作细胞生长抑制率的标准曲线,进而在曲线上求得对应的药物浓度。
[0053]
测定方法如下:
[0054]
1.以2000个/孔的密度将细胞接种于96孔板,于co2培养箱培养24小时;
[0055]
2.将待测物(母液10mm)浓度稀释为20μm-10μm-5μm-2.5μm-1.25μm-0.627μm-0.3125μm;
[0056]
3.每个浓度设置三组平行孔,分别将待测化合物加入进接种好的细胞,继续培养72小时;
[0057]
4.取出96孔板,向每孔中加入20μl mtt溶液,培养箱孵育2小时;
[0058]
5.弃上层液体,每孔加入150μl dmso,15min摇匀,待甲瓒完全溶解;
[0059]
6.于570nm处测定吸光值。
[0060]
三次平行试验,实验结果取平均值,测得的ic
50
值见表1。
[0061]
表1
[0062][0063]
其中,dox(阿霉素)作为对照样。
[0064]
药理试验显示本发明的蒽甲基-双胍类化合物16对多种癌细胞株均表现出显著地抗肿瘤活性,其对人宫颈癌细胞株hela、胃癌细胞株mkn45的ic
50
值分别达到3.58μm和6.81μm。化合物16对人宫颈癌hela细胞株表现出与阳性对照阿霉素相近的抑制活性,具有良好的开发潜力。值得注意的是,化合物16蒽环结构中的甲基药效团,显然在抗癌活性维持中扮演了重要角色,相较于化合物21,化合物16对多种癌细胞株的杀灭活性均提高了2-3倍。
[0065]
本发明制备的蒽甲基-双胍类化合物抗癌机理被认为可能是通过抑制抗癌标靶蛋白mdmx/mdm2途径,激活癌细胞中的肿瘤抑制因子p53,造成癌细胞的凋亡,使得本发明的化合物16对人宫颈癌细胞株hela、胃癌细胞株mkn45显示出较好的抑制活性。
[0066]
以上实验结果详细描述了本发明的优选实施方式,但是本发明并不限于上述实施方式中的具体细节;在本发明的搭配构思范围内,可以对本发明的技术方案进行多种等同变换,这些变换均属于本发明保护范围。为避免不必要重复,本发明对各种结构上的可能组合方式不再另行说明;只要不违背本发明的思想,其同样应视为本发明所公开的内容。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。