(c
1-c6)烷基。
14.在式(ia)或(ib)的一些实施例中,该化合物由式(iia)或(iib)表示:
[0015][0016]
其中n是0或1;并且r2选自-h或-(c
1-c4)烷基。
[0017]
在一些实施例中,该免疫调节剂是免疫检查点抑制剂或免疫刺激剂。在一些实施例中,该免疫检查点抑制剂选自ctla-4受体抑制剂、pd-1受体抑制剂、pd-l1抑制剂、pd-l2抑制剂、nkg2a受体抑制剂、及其组合。在一些实施例中,该免疫刺激剂是tlr3激动剂。
[0018]
在一些实施例中,该免疫检查点抑制剂是抗体或其抗原结合片段。
[0019]
在一些实施例中,该免疫检查点抑制剂是抗ctla-4受体抗体、抗pd-1受体抗体、抗pd-l1抗体、抗pd-l2抗体、或抗nkg2a受体抗体。在一些实施例中,该免疫检查点抑制剂是抗ctla-4受体抗体、抗pd-l1抗体、抗nkg2a受体抗体、或其组合。
[0020]
在一些实施例中,该免疫检查点抑制剂是德瓦鲁单抗、曲美木单抗、莫纳利珠单抗、或其组合。
[0021]
在一些实施例中,该癌症是乳腺癌、膀胱癌、头颈癌、非小细胞肺癌、小细胞肺癌、结直肠癌、胃肠道间质瘤、胃食管癌、肾细胞癌、前列腺癌、肝癌、结肠癌、胰腺癌、卵巢癌、淋巴瘤(包括非霍奇金氏淋巴瘤)、皮肤t淋巴细胞瘤、或黑色素瘤。在一些实施例中,该癌症是恶性血液病,包括多发性骨髓瘤、急性髓细胞性白血病(aml)、骨髓增生异常综合征(mds)、慢性髓细胞性白血病(cml)、慢性淋巴细胞性白血病(cll)、慢性骨髓单核细胞性白血病(cmml)、和弥漫性大b细胞淋巴瘤(dlbcl)。
[0022]
在一些实施例中,该具有式(ia)或(ib)的化合物、或其药学上可接受的盐与该免疫调节剂顺序地、分开地或同时地施用。
[0023]
在一些实施例中,本披露提供了具有式(ia)或(ib)的化合物、或其药学上可接受的盐,用于在治疗患者的癌症中使用,其中将该具有式(ia)或(ib)的化合物、或其药学上可接受的盐与免疫调节剂顺序地、分开地或同时地向该患者施用。
[0024]
在一些实施例中,本披露提供了免疫调节剂,用于在治疗癌症中使用,其中将该免疫检查点抑制剂与具有式(ia)或(ib)的化合物、或其药学上可接受的盐顺序地、分开地或同时地向该患者施用。
附图说明
[0025]
图1a、1b、1c和1d展示了在mc38-ova研究中,精氨酸酶抑制剂(图1a和1b)、抗pdl1(图1a和1c)、和精氨酸酶抑制剂(arg inh)与抗pdl1的组合(图1a和1d)随时间推移导致的肿瘤体积减小。
[0026]
图2a、2b、2c和2d展示了在mc38-ova研究中,精氨酸酶抑制剂(图2a),精氨酸酶抑
制剂与抗pdl1的组合(图2b),精氨酸酶抑制剂与抗nkg2a的组合(图2c),和精氨酸酶抑制剂、抗pdl1与抗nkg2a的组合(图2d)随时间推移导致的肿瘤体积减小。
[0027]
图3a、3b、3c、3d、3e和3f展示了在mc38-ova研究中,媒介物(图3a)、精氨酸酶抑制剂(图3b、3e和3f)、tlr3激动剂(图3c、3e和3f)、和精氨酸酶抑制剂与tlr3激动剂的组合(图3d、3e和3f)随时间推移导致的肿瘤体积减小。
[0028]
图4a、4b和4c展示了在使用精氨酸酶抑制剂、抗pdl1、和精氨酸酶抑制剂与抗pdl1的组合的肿瘤中的免疫细胞变化。
[0029]
图4d、4e和4f展示了在使用精氨酸酶抑制剂、抗pdl1、和精氨酸酶抑制剂与抗pdl1的组合的肿瘤引流淋巴结中增加的cd8 (图4a和4b)和cd103 (图4f)t细胞功能。
[0030]
图5a和5b展示了在使用精氨酸酶抑制剂、抗pdl1、和精氨酸酶抑制剂与抗pdl1的组合的肿瘤引流淋巴结中增加的产生ifnγ(图5a)和tnfα(图5b)的cd8 t细胞功能。
[0031]
图6a展示了在路易斯肺同系肿瘤模型(lewis lung syngeneic tumor model)中精氨酸酶抑制剂(化合物12)与放射疗法(rt)的组合的抗肿瘤活性。
[0032]
图6b展示了精氨酸酶抑制剂(化合物12)与放射疗法(rt)的组合在研究结束时(第19天)使路易斯肺肿瘤体积减小。
具体实施方式
[0033]
本披露涉及治疗患者的癌症的方法。在一个实施例中,该方法包括向该患者施用具有式(ia)或(ib)的化合物、或其药学上可接受的盐,与免疫调节剂组合。该具有式(ia)或(ib)、或其任何亚类或种的化合物可在疗法中用作精氨酸酶抑制剂。
[0034]
除非用术语“完整”另外修饰,如在“完整抗体”中,否则如本文所用的术语“抗体”还包括抗体片段如fab、f(ab’)2、fv、scfv、fd、dab和保留抗原结合功能(例如,结合抗原如ctla-4、pd1、pd-l1、或nkg2a的能力)的其他抗体片段。典型地,此类片段将包含抗原结合结构域。
[0035]
术语“mab”是指单克隆抗体。本披露的抗体可以包含但不限于全天然抗体;双特异性抗体;嵌合抗体;fab、fab’、单链v区片段(scfv);融合多肽;以及非常规抗体。
[0036]
用语“治疗”(treat、treating和treatment)包括减少或抑制受试者中与精氨酸酶或癌症相关的酶或蛋白质活性,改善受试者中癌症的一种或多种症状,或者减缓或推迟受试者中癌症的进展。用语“治疗(treat、treating和treatment)”还包括减少或抑制受试者中肿瘤的生长或癌性细胞的增殖。
[0037]
用语“抑制(inhibit、inhibition或inhibiting)”包括生物活性或过程的基线活性的降低。
[0038]
用语“药物组合物”包括包含活性成分和药学上可接受的赋形剂、载体或稀释剂的组合物,其中该活性成分是如本文所述的具有式(ia)或(ib)(包括其任何亚类或种)的化合物、或其药学上可接受的盐、或免疫调节剂。用语“药学上可接受的赋形剂、载体或稀释剂”包括如本领域技术人员所确定的那样,在合理的医学判断范围内,适合用于与人类和动物的组织接触而无过度毒性、刺激、过敏反应或其他问题或并发症的化合物、材料、组合物和/或剂型。在一些实施例中,药物组合物呈固体剂型,如胶囊、片剂、颗粒剂、粉剂、小袋等。在一些实施例中,药物组合物呈以下形式:一种或多种水性或非水性无毒肠胃外可接受的缓
冲系统、稀释剂、增溶剂、共溶剂或载体中的无菌可注射溶液。无菌可注射制剂也可以是在非水性稀释剂、载体或共溶剂中的无菌可注射水性或油性悬浮液或悬浮液,其可以根据已知程序利用一种或多种合适的分散剂或润湿剂和悬浮剂配制。药物组合物可以是用于静脉内推注/输注的溶液,或用缓冲系统用或不用其他赋形剂重构的冻干系统(单独的或与赋形剂一起)。冻干的冷冻干燥材料可以由非水性溶剂或水性溶剂制备。剂型也可以是进一步稀释用于后续输注的浓缩物。
[0039]
术语“患者”包括温血哺乳类动物,例如灵长类、狗、猫、兔、大鼠和小鼠。在一些实施例中,受试者是灵长类,例如,人类。在一些实施例中,患者患有癌症。在一些实施例中,该癌症是乳腺癌、膀胱癌、头颈癌、非小细胞肺癌(nsclc)、小细胞肺癌、结直肠癌、胃肠道间质瘤、胃食管癌、肾细胞癌、前列腺癌、肝癌、结肠癌、胰腺癌、卵巢癌、淋巴瘤(包括非霍奇金氏淋巴瘤)、皮肤t淋巴细胞瘤、或黑色素瘤。在一些实施例中,该癌症是恶性血液病,包括多发性骨髓瘤、急性髓细胞性白血病(aml)、骨髓增生异常综合征(mds)、慢性髓细胞性白血病(cml)、慢性淋巴细胞性白血病(cll)、慢性骨髓单核细胞性白血病(cmml)、和弥漫性大b细胞淋巴瘤(dlbcl)。
[0040]
用语“有效量”包括如本文所述的具有式(ia)或(ib)(包括其任何亚类或种)的化合物的量和/或免疫调节剂的量,这样的量将引起受试者中的生物或医学反应,例如,减少或抑制与精氨酸酶或癌症相关的酶或蛋白质活性;改善癌症症状;或者减缓或推迟癌症的进展。在一些实施例中,用语“有效量”包括如本文所述的具有式(ia)或(ib)(包括其任何亚类或种)的化合物和/或免疫调节剂的量,这样的量在受试者中有效地至少部分减轻、抑制、和/或改善癌症或抑制精氨酸酶,和/或减少或抑制肿瘤的生长或癌性细胞的增殖。
[0041]
化合物
[0042]
在一个实施例中,将具有式(ia)的化合物、或其药学上可接受的盐与免疫调节剂组合向受试者施用,其中
[0043][0044]
n是0或1;
[0045]
r1是-h或-c(o)ch(r
1a
)nhr
1b
;
[0046]r1a
选自-h、-(c
1-c6)烷基和ch2or
1c
;
[0047]r1b
是-h;或者替代性地,r
1a
和r
1b
与它们所附接的原子一起形成5元杂环;并且
[0048]r1c
是h或-ch3。
[0049]
在一个实施例中,披露了具有式(ia)的化合物。在另一个实施例中,披露了具有式(ia)的化合物的药学上可接受的盐。
[0050]
在式(ia)的一些实施例中,r1是-h或-c(o)ch(r
1a
)nh2;并且r
1a
选自-h或-(c
1-c6)烷
基。
[0051]
在式(ia)的一些实施例中,r1是-h。
[0052]
在式(ia)的一些实施例中,r1是-c(o)ch(r
1a
)nhr
1b
;r
1a
是-h;并且r
1b
是-h。
[0053]
在式(ia)的一些实施例中,r1是-c(o)ch(r
1a
)nhr
1b
;r
1a
是-(c
1-c6)烷基;并且r
1b
是-h。
[0054]
在式(ia)的一些实施例中,r1是-c(o)ch(r
1a
)nhr
1b
;r
1a
是ch2or
1c
;并且r
1b
是-h。
[0055]
在式(ia)的一些实施例中,r1是-c(o)ch(r
1a
)nhr
1b
;并且r
1a
和r
1b
与它们所附接的原子一起形成5元杂环。
[0056]
在式(ia)的前述实施例的任一项中,该化合物由以下结构式中的任一项表示:
[0057][0058]
其中r1与上述式(ia)中所定义的相同。
[0059]
在一个实施例中,披露了具有式(iia)的化合物、或其药学上可接受的盐:
[0060][0061]
其中n是0或1;并且r2选自-h或-(c
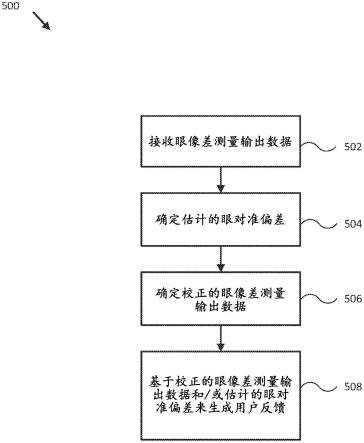
1-c4)烷基。
[0062]
在一个实施例中,披露了具有式(iia)的化合物。在另一个实施例中,披露了具有式(iia)的化合物的药学上可接受的盐。
[0063]
在式(iia)的一些实施例中,r3是-h。
[0064]
在式(iia)的一些实施例中,r3是-(c
1-c4)烷基。
[0065]
在式(iia)的前述实施例的任一项中,该化合物由以下结构式中的一项表示:
[0066][0067]
其中r2与上述式(iia)中所定义的相同。
[0068]
在一个实施例中,将具有式(ib)的化合物、或其药学上可接受的盐与免疫检查点抑制剂组合向受试者施用,其中
[0069][0070]
n是0或1;
[0071]
r1是-h或-c(o)ch(r
1a
)nhr
1b
;
[0072]r1a
选自-h、-(c
1-c4)烷基和ch2or
1c
;
[0073]r1b
是-h;或者替代性地,r
1a
和r
1b
与它们所附接的原子一起形成5元杂环;并且
[0074]r1c
是h或-ch3。
[0075]
在一个实施例中,披露了具有式(ib)的化合物。在另一个实施例中,披露了具有式(ib)的化合物的药学上可接受的盐。
[0076]
在式(ib)的一些实施例中,r1是-h。
[0077]
在式(ib)的一些实施例中,r1是-c(o)ch(r
1a
)nhr
1b
;r
1a
是-h;并且r
1b
是-h。
[0078]
在式(ib)的一些实施例中,r1是-c(o)ch(r
1a
)nhr
1b
;r
1a
是-(c
1-c6)烷基;并且r
1b
是-h。
[0079]
在式(ib)的一些实施例中,r1是-c(o)ch(r
1a
)nhr
1b
;r
1a
是ch2or
1c
;并且r
1b
是-h。
[0080]
在式(ib)的一些实施例中,r1是-c(o)ch(r
1a
)nhr
1b
;并且r
1a
和r
1b
与它们所附接的原子一起形成5元杂环。
[0081]
在式(ib)的前述实施例的任一项中,该化合物由以下结构式中的任一项表示:
[0082][0083]
其中r1与上述式(ib)中所定义的相同。
[0084]
在一个实施例中,披露了具有式(iib)的化合物、或其药学上可接受的盐:
[0085][0086]
其中n是0或1;并且r2选自-h或-(c
1-c4)烷基。
[0087]
在一个实施例中,披露了具有式(iib)的化合物。在另一个实施例中,披露了具有式(iib)的化合物的药学上可接受的盐。
[0088]
在式(iib)的一些实施例中,r2是-h。
[0089]
在式(iib)的一些实施例中,r2是-(c
1-c4)烷基。
[0090]
在式(iib)的一些实施例中,该化合物由以下结构式中的一项表示:
[0091][0092]
其中r2与上述式(iib)中所定义的相同。
[0093]
在一些实施例中,具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、和(iia2)(包括其任何亚类和种)的化合物经由分子内环化转化为具有式(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类和种)的化合物,反之亦然。也就是说,它是一个相互转化过程。具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、和(iia2)(包括其任何亚类和种)的化合物,以及具有式(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类和种)的化合物,各自根据如温度、压力、湿度、ph和/或介质(例如,溶剂)组成等条件部分或完全转化为另一者。在以下方案中进行了说明:
[0094][0095]
其中r1与上述式(ia)和(ib)中所定义的相同。
[0096]
在一些实施例中,披露了表1的化合物、或其药学上可接受的盐:
[0097]
表1
[0098]
[0099]
[0100]
[0101]
[0102]
[0103][0104]
用语“c
1-c4烷基”包括具有1至4个碳原子的非环烷基部分,并且“c
1-c6烷基”包括具有1至6个碳原子的非环烷基部分。c
1-c4烷基部分的实例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基和叔丁基。
[0105]
用语“药学上可接受的盐”包括保留了具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物的生物有效性和特性、并且通常不是生物学上或其他方面不希望的酸加成盐或碱加成盐。在许多情况下,具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物由于存在碱性和/或羧基基团或与之类似的基团,而能够形成酸式盐和/或碱式盐。
[0106]
药学上可接受的酸加成盐可以使用无机酸和有机酸来形成,例如,乙酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、溴化物/氢溴酸盐、碳酸氢盐/碳酸盐、硫酸氢盐/硫酸盐、樟脑磺酸盐、氯化物/盐酸盐、胆茶碱(chlortheophyllonate)、柠檬酸盐、乙二磺酸盐(ethanedisulfonate)、延胡索酸盐、葡庚糖酸盐、葡糖酸盐、葡糖醛酸盐、马尿酸盐、氢碘酸盐/碘化物、羟乙基磺酸盐、乳酸盐、乳糖酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、丙二酸
盐、扁桃酸盐、甲磺酸盐、甲基硫酸盐、萘甲酸盐、萘磺酸盐、烟酸盐、硝酸盐、十八酸盐、油酸盐、草酸盐、棕榈酸盐、扑酸盐(palmoate)、磷酸盐/磷酸氢盐/磷酸二氢盐、聚半乳糖醛酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、碱式水杨酸盐、硫酸盐/硫酸氢盐、酒石酸盐、甲苯磺酸盐和三氟乙酸盐。可以从中衍生盐的无机酸包括,例如,盐酸、氢溴酸、硫酸、硝酸、磷酸等。可以从中衍生盐的有机酸包括,例如,乙酸、丙酸、乙醇酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、扁桃酸、甲磺酸、乙磺酸、甲苯磺酸、三氟乙酸、磺基水杨酸等。
[0107]
药学上可接受的碱加成盐可以用无机碱和有机碱来形成。可以从中衍生盐的无机碱包括,例如,氨以及铵和来自周期表第i至xii列的金属的盐。在某些实施例中,盐衍生自钠、钾、铵、钙、镁、铁、银、锌和铜;特别适合的盐包括铵盐、钾盐、钠盐、钙盐和镁盐。可以从中衍生盐的有机碱包括,例如,伯、仲和叔胺;取代的胺(包括天然存在的取代的胺);环胺;碱性离子交换树脂等。某些有机胺包括异丙基胺、苄星青霉素(benzathine)、胆碱盐(cholinate)、二乙醇胺、二乙胺、赖氨酸、葡甲胺、哌嗪和氨丁三醇。
[0108]
具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物的药学上可接受的盐可以通过常规化学方法由碱性或酸性部分合成。通常,此类盐可以通过将这些化合物的游离酸形式与化学计算量的适当的碱(如na
、ca
2
、mg
2
或k
的氢氧化物、碳酸盐、碳酸氢盐等)反应,或通过将这些化合物的游离碱形式与化学计算量的适当的酸反应来制备。典型地,此类反应在水中或在有机溶剂中、或在这两者的混合物中进行。通常,在可行的情况下,使用非水性介质如醚、乙酸乙酯、乙醇、异丙醇、或乙腈是希望的。另外的合适的盐的列表可以例如见于以下中:“remington
′
s pharmaceutical sciences[雷明顿药物科学],”第20版,mack publishing company[马克出版公司],easton,pa.[宾夕法尼亚州伊斯顿],(1985);berge等人,“j.pharm.sci.[药物科学杂志],1977,66,1-19以及stahl和wermuth的“handbook of pharmaceutical salts:properties,selection,and use[药用盐手册:特性、选择和使用]”(wiley-vch[威利-vch出版社],weinheim,germany[德国魏因海姆],2002)。
[0109]
本文给出的任何式也旨在表示具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物的未标记形式以及同位素标记的形式。除了一个或多个原子由相同元素但具有不同质量数的原子替换之外,同位素标记的化合物具有由本文给出的式所描绘的结构。可掺入到具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物及其药学上可接受的盐中的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、氯和碘的同位素,如2h、3h、
11
c、
13
c、
14
c、
15
n、
35
s、
36
cl和
125
i。同位素标记的具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物通常可通过本领域技术人员已知的常规技术或通过与附随实例中所描述的那些过程类似的过程,使用适当的同位素标记的试剂替代先前采用的非标记试剂来制备。
[0110]
具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物可具有不同的异构体形式。用语“光学异构体”、“立体异构体”或“非对映异构体”是指对于给定的具有式(ia)、
(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物而言,可能存在的各种立体异构体构型中的任一种。应当理解的是,取代基可以附接在碳原子的手性中心,因此,所披露的化合物包括对映异构体、非对映异构体和外消旋体。术语“对映异构体”包括彼此为不可重叠的镜像的成对立体异构体。一对对映异构体的1∶1混合物是外消旋混合物。在适当的情况下,该术语用于指外消旋混合物。术语“非对映异构体(diastereomer或diastereoisomer)”包括具有至少两个不对称原子,但彼此不互为镜像的立体异构体。根据卡恩-英戈尔德-普雷洛格(cahn-ingold-prelog)r-s系统指定绝对立体化学。当化合物是纯的对映异构体时,每个手性中心处的立体化学可通过r或s指定。根据在钠d线波长处旋转平面偏振光的方向(右旋或左旋),可以将绝对构型未知的拆分化合物指定为( )或(-)。某些具有式(ia)、(ia1)、(ia2)、(iia)、(iia1)、(iia2)、(ib)、(ib1)、(ib2)、(iib)、(iib1)、和(iib2)(包括其任何亚类或种)的化合物以及表1的化合物含有一个或多个不对称中心或轴,并因此可产生对映异构体、非对映异构体或其他立体异构体形式,其就绝对立体化学而言,可定义为(r)-或(s)-。本披露意在包括所有此类可能的异构体,包括外消旋混合物、光学纯形式和中间体混合物。光学活性(r)-和(s)-异构体可以使用手性合成子或手性试剂来制备,或使用本领域中熟知的常规技术如手性hplc来拆分。
[0111]
免疫调节剂
[0112]
如本文所用,“免疫调节剂”是指增强免疫应答(例如抗肿瘤免疫应答)的试剂。免疫调节剂可以是抗体或其抗原结合片段、蛋白质、肽、dna或rna片段、小分子、或其组合。在一些实施例中,免疫调节剂是免疫检查点抑制剂。在一些实施例中,免疫调节剂是免疫刺激剂。如本文所用,“免疫检查点抑制剂”是指抑制阻断免疫系统例如攻击癌细胞的蛋白质或肽的试剂(即免疫检查点试剂)。在一些实施例中,阻断免疫系统的免疫检查点试剂防止t细胞的产生和/或活化。在一些实施例中,免疫检查点抑制剂是细胞毒性t淋巴细胞相关蛋白4(ctla-4)、程序性细胞死亡蛋白1(pd1)、或程序性死亡配体1(pd-l1)。pd-l1和pd1形成细胞表面结合的配体-受体对,在健康个体中,其阻抑免疫应答以防止免疫系统的过度反应。在一些实施例中,癌细胞通过过表达配体pd-l1(其结合效应cd8 t细胞上的pd1)劫持正常的pd-l1/pd1免疫检查点机制,从而防止t细胞建立对癌细胞和/或肿瘤的免疫应答。pd-l1在宽范围的癌症中高频率地表达。肿瘤pd-l1过表达与多种癌症的不良预后相关(参见例如hamid等人,expert opin biol ther[生物治疗专家评论]13(6):847-861,2013)。如本文所用,“免疫刺激剂”意指通过诱导免疫系统的任何组分活化或增加其活性来刺激免疫系统而在免疫应答中没有任何抗原特异性的物质。在一些实施例中,免疫刺激剂是toll样受体3(tlr3)激动剂,如聚肌苷酸∶聚胞苷酸,其也称为聚i∶c或聚(i∶c)。
[0113]
描述免疫检查点途径和用免疫检查点抑制剂化合物阻断这种途径的综述由pardoll在nature reviews cancer[癌症自然评论](2012年4月),第252-264页中提供。免疫检查点抑制剂化合物通过阻断下调抗肿瘤免疫应答的一种或多种内源免疫检查点途径而显示出抗肿瘤活性。典型地,免疫检查点途径的抑制或阻断涉及抑制检查点受体和配体与免疫检查点抑制剂化合物的相互作用,以减少或消除信号并导致抗肿瘤应答的减少。
[0114]
如本文所用,“免疫检查点抑制剂”是指抑制阻断免疫系统例如攻击癌细胞的蛋白质或肽的试剂(即免疫检查点试剂)。免疫检查点抑制剂可以是抗体或其抗原结合片段、蛋
白质、肽、小分子、或其组合。在一些实施例中,阻断免疫系统的免疫检查点试剂防止t细胞的产生和/或活化。在一些实施例中,免疫检查点试剂是细胞毒性t淋巴细胞相关蛋白4(ctla-4)、程序性细胞死亡蛋白1(pd1)、程序性死亡配体1(pd-l1)、或识别hla-e并由nk细胞和t细胞亚群表达的抑制性受体(如nkg2a)。pd-l1和pd1形成细胞表面结合的配体-受体对,在健康个体中,其阻抑免疫应答以防止免疫系统的过度反应。在一些实施例中,癌细胞通过过表达配体pd-l1(其结合效应cd8 t细胞上的pd1)劫持正常的pd-l1/pd1免疫检查点机制,从而防止t细胞建立对癌细胞和/或肿瘤的免疫应答。pd-l1在宽范围的癌症中高频率地表达。肿瘤pd-l1过表达与多种癌症的不良预后相关(参见例如hamid等人,expert opin biol ther[生物治疗专家评论]13(6):847-861,2013)。
[0115]
在本披露的一些实施例中,免疫检查点抑制剂化合物抑制免疫检查点受体与免疫检查点受体的相应配体之间的信号传导相互作用。免疫检查点抑制剂化合物可以通过阻断免疫检查点途径的活化而起作用,这是通过抑制(拮抗)免疫检查点受体(受体的一些实例包括ctla-4、pd-1、和nkg2a)或通过抑制免疫检查点受体的配体(配体的一些实例包括pd-l1和pd-l2)实现的。在此类实施例中,免疫检查点抑制剂化合物的作用是减少或消除肿瘤微环境中免疫系统抗肿瘤应答的某些方面的下调。
[0116]
在一些实施例中,免疫检查点抑制剂抑制ctla-4途径或pd-l1/pd1途径。在一些实施例中,免疫检查点抑制剂是抗体。在一些实施例中,免疫检查点抑制剂包含抑制ctla-4、pd1、或pd-l1的抗体。免疫检查点抑制剂、免疫检查点抑制剂及其实例在例如wo 2016/062722中提供。
[0117]
在一些实施例中,免疫检查点抑制剂是抗ctla-4抗体或其衍生物或抗原结合片段。在实施例中,抗ctla-4抗体选择性地结合ctla-4蛋白或其片段。抗ctla-4抗体及其衍生物和片段的实例描述于例如,us 6,682,736;us 7,109,003;us 7,123,281;us 7,411,057;us 7,807,797;us 7,824,679;us 8,143,379;us 8,491,895、和us 2007/0243184中。在一些实施例中,抗ctla-4抗体是曲美木单抗或伊匹单抗。
[0118]
免疫检查点受体细胞毒性t淋巴细胞相关抗原4(ctla-4)在t细胞上表达,并参与降低t细胞活化水平的信号传导途径。据信,ctla-4可以通过cd80和cd86的竞争性结合和螯合来下调t细胞活化。此外,已显示ctla-4参与增强t
reg
细胞的免疫抑制活性。
[0119]
在一些实施例中,免疫检查点抑制剂是抗pd-l1抗体或其衍生物或抗原结合片段。在一些实施例中,抗pd-l1抗体或其衍生物或抗原结合片段选择性地结合pd-l1蛋白或其片段。抗pd-l1抗体及其衍生物和片段的实例描述于例如,wo 01/14556、wo 2007/005874、wo 2009/089149、wo 2011/066389、wo 2012/145493;us 8,217,149、us 8,779,108;us 2012/0039906、us 2013/0034559、us 2014/0044738、和us 2014/0356353中。在一些实施例中,抗pd-l1抗体是medi4736(德瓦鲁单抗)、mdpl3280a、2.7a4、amp-814、mdx-1105、阿特珠单抗(mpdl3280a)、或bms-936559。
[0120]
免疫检查点受体程序性死亡1(pd-1)由活化的t细胞在延长暴露于抗原时表达。pd-1与其已知的结合配体(pd-l1和pd-l2)的接合主要发生在肿瘤微环境内,并导致抗肿瘤特异性t细胞应答的下调。pd-l1和pd-l2二者都已知在肿瘤细胞上表达。pd-l1和pd-l2在肿瘤上的表达与减少的存活结果相关。
[0121]
在一些实施例中,抗pd-l1抗体是medi4736,也称为德瓦鲁单抗。在一些实施例中,
抗pd-l1抗体包含与seq id no:1-8中任一个具有至少80%、至少85%、至少90%、至少95%、或至少99%同一性的氨基酸序列。medi4736是抗pd-l1抗体,其对pd-l1多肽具有选择性并阻断pd-l1与pd-1和cd80受体的结合。medi4736可以在体外解除pd-l1介导的对人t细胞活化的抑制,并且可以经由t细胞依赖性机制在异种移植物模型中进一步抑制肿瘤生长。medi4736进一步描述于例如us 8,779,108中。medi4736的片段可结晶(fc)结构域在igg1重链的恒定结构域中含有三重突变,该三重突变减少与负责介导抗体依赖性细胞介导的细胞毒性(adcc)的补体组分c1q和fcγ受体的结合。
[0122]
在一些实施例中,medi4736或其抗原结合片段包含重链和轻链或重链可变区和轻链可变区。在一些实施例中,用于使用的medi4736或其抗原结合片段包含轻链可变区和重链可变区,该轻链可变区包含seq id no:1的氨基酸序列,该重链可变区包含seq id no:2的氨基酸序列。在一些实施例中,medi4736或其抗原结合片段包含重链可变区和轻链可变区,其中该重链可变区包含seq id no:3-5的卡巴特(kabat)定义的cdr1、cdr2和cdr3序列,并且其中该轻链可变区包含seq id no:6-8的卡巴特定义的cdr1、cdr2和cdr3序列。本领域普通技术人员将能够容易地鉴定本领域普通技术人员已知的乔西亚(chothia)定义的、abm定义的或其他的cdr定义。在一些实施例中,medi4736或其抗原结合片段包含如在wo 2011/066389中描述的2.14h90pt抗体的可变重链和可变轻链cdr序列。
[0123]
在一些实施例中,免疫检查点抑制剂是抗pd-1抗体或其衍生物或抗原结合片段。在一些实施例中,抗pd-1抗体选择性地结合pd-1蛋白或其片段。在一些实施例中,抗pd1抗体是纳武单抗、派姆单抗、或匹地利珠单抗。
[0124]
nkg2a受体是与hla-e结合并且在肿瘤浸润性细胞毒性nk和cd8 t淋巴细胞上表达的抑制性受体。通过表达hla-e,癌细胞可以保护它们自身不被nkg2a 免疫细胞杀伤。hla-e经常在许多实体瘤或恶性血液病的癌细胞上上调。莫纳利珠单抗(iph2201)是人源化的igg4,其阻断nkg2a与hla-e的结合,从而允许nk细胞和细胞毒性t细胞应答的活化。抗nkg2a抗体及其衍生物和片段的实例描述于wo 2016/041947中,将其内容通过引用以其全文(包括但不限于序列表)特此并入。
[0125]
在本披露的一些实施例中,免疫检查点抑制剂化合物是有机小分子(分子量小于1000道尔顿)、肽、多肽、蛋白质、抗体、抗体片段或抗体衍生物。在一些实施例中,免疫检查点抑制剂化合物是抗体。在一些实施例中,该抗体是单克隆抗体,特别是人或人源化单克隆抗体。
[0126]
用于阻断免疫检查点途径的单克隆抗体、抗体片段和抗体衍生物可以通过本领域普通技术人员已知的几种方法中的任一种进行制备,这些方法包括但不限于体细胞杂交技术和杂交瘤方法。杂交瘤产生描述于antibodies,a laboratory manual[抗体:实验手册],harlow和lane,1988,cold spring harbor publications[冷泉港出版社],纽约中。可以通过在例如美国专利号5223409、5403484、5571698、6582915、和6593081中描述的方法通过筛选人免疫球蛋白基因的噬菌体展示文库来鉴定和分离人单克隆抗体。单克隆抗体可以使用在美国专利号6331415(cabilly)中描述的一般方法进行制备。
[0127]
作为实例,人单克隆抗体可以使用xenomouse
tm
(安根尼克斯公司(abgenix),加利福尼亚州弗里蒙特(fremont,ca))或来自xenomouse的b细胞的杂交瘤进行制备。xenomouse是具有功能性人免疫球蛋白基因的鼠科动物宿主,如在美国专利号6162963
(kucherlapati)中所描述。
[0128]
免疫检查点抗体的制备和使用方法描述于以下说明性出版物中。抗ctla-4抗体的制备和治疗性用途描述于美国专利号7229628(allison)、7311910(linsley)和8017144(korman)中。抗pd-1抗体的制备和治疗性用途描述于美国专利号8008449(korman)和美国专利申请号2011/0271358(freeman)中。抗pd-l1抗体的制备和治疗性用途描述于美国专利号7943743(korman)中。抗tim-3抗体的制备和治疗性用途描述于美国专利号8101176(kuchroo)和8552156(tagayanagi)中。抗lag-3抗体的制备和治疗性用途描述于美国专利申请号2011/0150892(thudium)和国际公开号wo 2014/008218(lonberg)中。抗kir抗体的制备和治疗性用途描述于美国专利号8119775(moretta)中。阻断btla调节的抑制性途径的抗体(抗btla抗体)的制备描述于美国专利号8563694(mataraza)中。
[0129]
在本披露的一些实施例中,免疫检查点抑制剂化合物是ctla-4受体抑制剂、pd-1受体抑制剂、lag-3受体抑制剂、tim-3受体抑制剂、btla受体抑制剂、或kir受体抑制剂。在一些实施例中,免疫检查点抑制剂化合物是pd-l1的抑制剂或pd-l2的抑制剂。
[0130]
在本披露的一些实施例中,免疫检查点抑制剂化合物是pd-l1/pd-1途径或pd-l2/pd-1途径的抑制剂。在一些实施例中,pd-l1/pd-1途径的抑制剂是medi4736。
[0131]
在本披露的一些实施例中,免疫检查点抑制剂化合物是抗ctla-4受体抗体、抗pd-1受体抗体、抗lag-3受体抗体、抗tim-3受体抗体、抗btla受体抗体、抗kir受体抗体、抗pd-l1抗体、或抗pd-l2抗体。
[0132]
在本披露的一些实施例中,抗ctla-4受体抗体是伊匹单抗或曲美木单抗。在一些实施例中,抗pd-1受体抗体是兰伯丽珠单抗(1ambrolizumab)、匹地利珠单抗、或纳武单抗。在一些实施例中,抗kir受体抗体是利瑞鲁单抗(lirilumab)。
[0133]
放射疗法
[0134]
放射疗法,也称为高剂量电离照射,与具有式(ia)或式(ib)的化合物、或其药学上可接受的盐组合使用,用于治疗癌症。在一些实施例中,本发明的方法包括向患者施用放射疗法,与具有式(ia)或式(ib)的化合物、或其药学上可接受的盐和免疫调节剂组合。
[0135]
放射疗法可以是x射线、γ射线或带电粒子。放射疗法可以是外部波束放射疗法或内部放射疗法(也称为近距离放射疗法(brachytherapy))。还可以采用使用放射性物质(如放射性碘)的全身放射疗法。外部波束放射疗法包括3d构象放射疗法、调强放射疗法、图像引导的放射疗法、断层放射疗法、立体定位放射手术、质子疗法或其他带电粒子束。
[0136]
放射疗法可以是x射线、γ射线或带电粒子。放射疗法可以是外部波束放射疗法或内部放射疗法(也称为近距离放射疗法)。还可以采用使用放射性物质(如放射性碘)的全身放射疗法。外部波束放射疗法包括3d构象放射疗法、调强放射疗法、图像引导的放射疗法、断层放射疗法、立体定位放射手术、质子疗法或其他带电粒子束。
[0137]
在一些实施例中,放射疗法是分割放射疗法。在一个实施例中,分割放射疗法包括2至14个部分。在另一个实施例中,分割放射疗法包括2至7个部分。在另一个实施例中,分割放射疗法包括3至6个部分。在一个实施例中,分割放射疗法包括2、3、4、5、6、或7个部分。在一个实施例中,分割放射疗法包括5个部分。在一些实施例中,这些放射疗法部分在连续多天中施用。在一个实施例中,放射疗法可以包括在一天的多于一个剂量和/或在连续多天的多个剂量。在一种模式中,这些放射疗法部分在第1天、第2天、第3天、第4天、以及第5天施
用。
[0138]
组合疗法
[0139]
本披露提供了治疗癌症的方法,其中以组合的方式施用具有式(ia)或(ib)(包括其任何亚类或种)的化合物、或其药学上可接受的盐和免疫调节剂。在另一个方面,本披露提供了治疗癌症的方法,其中以组合的方式施用具有式(ia)或(ib)(包括其任何亚类或种)的化合物、或其药学上可接受的盐和放射疗法(任选地以及免疫调节剂)。
[0140]
在一些实施例中,将具有式(ia)或(ib)的化合物或其药学上可接受的盐和免疫调节剂分开地、顺序地或同时地施用。在一些实施例中,将具有式(ia)或(ib)的化合物或其药学上可接受的盐和放射疗法在相同天或不同天中施用。在一个实施例中,在具有式(ia)或(ib)的化合物或其药学上可接受的盐和/或免疫调节剂的治疗之前采用放射疗法。在另一个实施例中,在具有式(ia)或(ib)的化合物或其药学上可接受的盐和/或免疫调节剂的治疗之后采用放射疗法。在另一个实施例中,与具有式(ia)或(ib)的化合物或其药学上可接受的盐和/或免疫调节剂的治疗同时施用放射疗法。
[0141]
在一些实施例中,具有式(ia)或(ib)的化合物选自表1中列出的化合物,即,化合物1至33,并且免疫调节剂选自德瓦鲁单抗、曲美木单抗、莫纳利珠单抗、或其组合。
[0142]
在一些实施例中,施用具有式(ia)或(ib)的化合物和免疫调节剂的组合导致累加效应和/或协同效应。如本文所用,术语“协同”是指比单一疗法的累加效应更有效的组合疗法(例如,如本文所述的medi4736或其抗原结合片段和精氨酸酶抑制剂的组合)。
[0143]
在一些实施例中,与仅施用一种试剂的方法相比,本文提供的方法(例如,施用具有式(ia)或(ib)的化合物和免疫调节剂的组合)有利地增强抗原呈递,和/或促进t细胞活化,从而为患者提供更安全和更有效的治疗。在一些实施例中,与单独施用免疫调节剂或单独施用具有式(ia)或(ib)的化合物相比,本文提供的方法导致cd8 t细胞、nk细胞、和/或cd103 树突细胞增加。在一些实施例中,与仅施用一种试剂的方法相比,本文提供的方法导致患者的干扰素-γ(ifnγ)水平升高。在一些实施例中,与仅施用一种试剂的方法相比,本文提供的方法导致患者的白细胞介素-2(il-2)水平升高。
[0144]
seq id no:1-8对应于为如本文实施例中所述的抗pd-l1抗体的medi4736的氨基酸序列。seq id no:3对应于medi4736的轻链可变区的氨基酸序列。seq id no:4对应于medi4736的重链可变区的氨基酸序列。seq id no:5-10对应于medi4736的cdr。
[0145]
seq id no:9-16对应于为如本文实施例中所述的抗ctla-4抗体的曲美木单抗的氨基酸序列。
[0146]
seq id no:17-24对应于为如本文实施例中所述的抗nkg2a抗体的莫纳利珠单抗的氨基酸序列。
[0147]
本文引用的所有参考文献,包括专利、专利申请、论文、教科书等以及其中引用的参考文献(如同它们还未曾引用过的程度)通过引用以其全文并入本文。
[0148]
实例
[0149]
本披露的多个方面可以通过参考以下非限制性实例进一步定义,这些实例详细描述了本披露的某些化合物和中间体的制备以及使用本披露的化合物的方法。本领域技术人员应当清楚的是可以在不偏离本披露的范围的情况下对材料和方法进行许多修改。
[0150]
除非另外说明:
c18(1.8μm,2.1x50mm)或shim-pack xr-ods(2.2μm,3.0x50mm)或phenomenex gemini-nx c18(3μm,3.0x50mm)柱的shimadzu uflc,以0.7ml/min(对于waters hss c18柱)、1.0ml/min(对于shim-pack xr-ods柱)或1.2ml/min(对于phenomenex gemini-nx c18)的流速,以95%a至95%b进行2.2min,保持0.6min,其中a=0.1%甲酸或0.05%三氟乙酸的水溶液(用于酸处理),或0.1%氢氧化铵或6.5mm碳酸铵的水溶液(用于碱处理),并且b=乙腈。除非另外说明,否则报告的分子离子对应于[m h] ;对于具有多个同位素模式的分子(br、cl等),除非另外说明,否则报告的值是对于最低同位素质量获得的值。
[0159]
(ix)离子交换纯化通常使用scx-2(拜泰齐公司(biotage))柱进行。
[0160]
(x)中间体纯度通过薄层色谱法、质谱法、lcms、uplc/ms、hplc(高效液相色谱法)和/或nmr分析来评估;
[0161]
(xi)使用了以下缩写:-[0162]
etoh:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙醇
[0163]
etoac:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸乙酯
[0164]
lda:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二异丙基氨基锂
[0165]
meoh:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
甲醇
[0166]
tfa:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
三氟乙酸
[0167]
mecn:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
乙腈
[0168]
lcms:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱法-质谱法
[0169]
rt或rt:
ꢀꢀꢀꢀꢀꢀꢀꢀ
室温
[0170]
aq:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
水溶液
[0171]
thf:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃
[0172]
khmds:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
双(三甲基甲硅烷基)氨基钾
[0173]
dcm:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二氯甲烷
[0174]
dmf:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基甲酰胺
[0175]
hatu:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐)
[0176]
boc:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁氧基羰基
[0177]
dtnb:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5,5
′‑
二硫代双(2-硝基苯甲酸)
[0178]
tnb:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-硝基-5-硫代苯甲酸
[0179]
hepes:
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(4-(2-羟基乙基)-1-哌嗪乙磺酸)
[0180]
表1中的化合物1至9的制备如以下实例1至9所说明。此外,表1中的化合物10至33的制备作为实例7至30在wo 2019/159120中描述,将其内容通过引用以其全文特此并入。
[0181]
实例1:(2r,4s)-4-氨基-2-(4-二羟硼基丁基)哌啶-2-甲酸
d),4.15(0.5h,s),4.65-4.74(0.1h,m),4.87(0.6h,br d),5.08(0.5h,br d),5.13-5.26(2.4h,m),7.31-7.40(6h,m);m/z:(es
)[m na]
=358。
[0187]
中间体3:(2r,4r)-4-((甲基磺酰基)氧基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0188]
在0℃下,将甲磺酸酐(3.59g,20.6mmol)分批添加至(2r,4r)-4-羟基哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体2,3.84g,11.5mmol;非对映异构体的5∶1混合物)和三乙胺(3.35ml,24.0mmol)在dcm(50ml)中的搅拌溶液中。允许冷却浴停止,并将反应升温至室温。6h后,将反应物用dcm(50ml)稀释,并依次用1m hcl(水溶液)(50ml)和饱和nacl水溶液(50ml)洗涤。将有机层经mgso4干燥,过滤并浓缩至干,得到粗的(2r,4r)-4-((甲基磺酰基)氧基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体3,4.73g,产率100%),其呈淡橙色胶状,并且为非对映异构体的混合物。粗材料不经进一步纯化而直接使用。m/z:(es
)[m na]
=436。
[0189]
中间体4:(2r,4s)-4-叠氮基哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0190]
将叠氮化钠(3.72g,57.2mmol)添加至(2r,4r)-4-((甲基磺酰基)氧基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体3,4.73g,11.4mmol;非对映异构体的混合物)在dmf(50ml)中的搅拌溶液中,并将反应升温至60℃持续20h。允许混合物冷却至室温,过滤并将滤液用水(400ml)和etoac(40ml)稀释。分离各相,并用etoac(4x40ml)萃取水相。将合并的有机物用饱和nacl水溶液(2x40ml)洗涤,经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(5%至30%etoac于己烷中)纯化,得到非对映异构纯的(2r,4s)-4-叠氮基哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体4,2.58g,产率63%),其呈无色胶状,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ1.39(4h,br s),1.46(5h,br s),1.63-1.73(1h,m),1.74-1.87(1h,m),1.95(1h,ddd),2.50-2.61(1h,m),3.03-3.44(1h,m),3.73-3.89(0.5h,m),3.90-4.01(1.5h,m),4.58-4.74(0.5h,m),4.88(0.5h,br s),5.15-5.34(2h,m),7.30-7.43(5h,m);m/z:(es
)[m-boc]
=261。
[0191]
中间体5:(4s)-4-叠氮基-2-(丁-2-烯-1-基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0192]
将(2r,4s)-4-叠氮基哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体4,1.94g,5.38mmol)和巴豆基溴(0.977ml,8.07mmol)溶于thf(30ml)中,并将溶液冷却至-78℃。在10min内逐滴添加khmds溶液(1m于2-甲基四氢呋喃中,7.0ml,7.0mmol)。将反应混合物缓慢升温至室温,并搅拌总计18h。将粗反应混合物用饱和nh4cl水溶液淬灭,然后用饱和nacl水溶液和etoac(50ml)稀释。分离各相,并用etoac(3x30ml)萃取水层。将合并的有机物用饱和nacl水溶液洗涤,经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(2%至30%etoac于己烷中)纯化,得到(4s)-4-叠氮基-2-(丁-2-烯-1-基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体5,2.106g,产率94%),其为顺式/反式非对映异构体混合物,并且为旋转异构体和e/z烯烃的混合物。1h nmr(500mhz,cd2cl2)δ1.40-1.42(4h,m),1.43(5h,br s),1.49-1.58(1h,m),1.59-1.66(0.6h,m),1.67-1.74(3.4h,m),1.86(0.5h,dd),1.89-2.05(2h,m),2.07-2.19(1h,m),2.42(0.5h,dd),2.58-2.69(1h,m),2.71-2.83(0.5h,m),3.01-3.16(0.5h,m),3.21(0.5h,br dd),3.31-3.44(0.5h,m),3.61-3.77(1.5h,m),3.97-4.07(0.5h,m),5.10-5.27(2h,m),5.36-5.45(1h,m),5.51-5.74(2h,m),7.32-7.47(5h,m);m/z:(es
)[m-boc]
=315。
[0193]
中间体6:(2r,4s)-4-叠氮基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0194]
将双(1,5-环辛二烯)二铱(i)二氯化物(50mg,0.074mmol)和双(二苯基膦基)甲烷(57mg,0.15mmol)添加至经烘箱干燥的圆底烧瓶中。将烧瓶密封并用n2吹扫。将固体溶于dcm(9ml)中,并将4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷(0.32ml,2.2mmol)缓慢添加至溶液中。将反应在室温下搅拌10min。将(4s)-4-叠氮基-2-(丁-2-烯-1-基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体5,616mg,1.49mmol)作为dcm(3ml)中的溶液添加至反应中,并将反应混合物在室温下搅拌66h。将反应混合物冷却至0℃,并小心地用meoh(1ml)和水(5ml)淬灭。分离各层,并用dcm(3x15ml)萃取水层。将合并的有机物经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(5%至15%etoac于己烷中)纯化,得到非对映异构纯的(2r,4s)-4-叠氮基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体6,261mg,产率32%),其呈透明、无色胶状。1h nmr(500mhz,cdcl3)δ0.79(2h,t),1.25(12h,s),1.29-1.35(1h,m),1.36-1.39(1h,m),1.41(9h,s),1.42-1.46(2h,m),1.57-1.68(1h,m),1.85-1.94(3h,m),1.95-2.01(1h,m),2.05(1h,dd),2.92-3.11(1h,m),3.49-3.72(1h,m),3.98-4.03(1h,m),5.09(1h,d),5.18(1h,d),7.29-7.42(5h,m);m/z:(es
)[m na]
=565。
[0195]
中间体7:(2r,4s)-4-氨基-1-(叔丁氧基羰基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸
[0196]
将pd/c(10%wt,50mg,0.047mmol)添加至(2r,4s)-4-叠氮基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体6,268mg,0.494mmol)在etoac(3ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌17h。将反应混合物用meoh(5ml)稀释,通过硅藻土过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(5%至45%meoh于dcm中)纯化,得到(2r,4s)-4-氨基-1-(叔丁氧基羰基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体7,156mg,产率74%),其呈白色干燥薄膜。1h nmr(500mhz,cd2cl2)δ0.71(2h,t),1.07-1.16(1h,m),1.19(14h,s),1.31-1.37(2h,m),1.40(9h,s),1.80-1.96(1h,m),2.02(3h,br d),2.33(1h,br s),3.00(1h,br s),3.53(1h,br s),3.92(1h,br s),8.60(3h,br s);m/z:(es
)[m h]
=427。
[0197]
实例1:(2r,4s)-4-氨基-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0198]
在室温下,将三氟乙酸(0.53ml,6.9mmol)逐滴添加至(2r,4s)-4-氨基-1-(叔丁氧基羰基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体7,146mg,0.342mmol)在dcm(2ml)中的搅拌溶液中。2h后,将溶液在减压下浓缩,并将所得残余物溶于1m hcl(水溶液)(3.0ml,3.0mmol)和et2o(3ml)中。添加苯基硼酸(125mg,1.03mmol),并将透明的双相溶液在室温下搅拌4h。将混合物用et2o(20ml)和水(5ml)稀释,并分离各层。用et2o洗涤水层。将水层冻干并通过离子交换色谱法(porapak rxn cx 20cc柱)纯化。使用5%氨的meoh溶液(20ml)从柱上洗脱所需的产物,得到呈白色固体的(2r,4s)-4-氨基-2-(4-二羟硼基丁基)哌啶-2-甲酸(62mg,产率74%)。1h nmr(500mhz,d2o)δ0.71-0.82(2h,m),1.10-1.30(2h,m),1.33-1.44(2h,m),1.45-1.55(1h,m),1.62(1h,dd),1.77(1h,ddd),1.84-1.93(1h,m),2.01-2.08(1h,m),2.18(1h,ddd),3.07(1h,td),3.22
(1h,dt),3.28-3.39(1h,m);m/z:(es
)[m h]
=245。
[0199]
实例2:(2r,4s)-4-((s)-2-氨基-3-甲基丁酰胺基)-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0200][0201]
中间体8:(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0202]
将锌(270mg,4.14mmol)和acoh(1.20ml,20.9mmol)添加至(2r,4s)-4-叠氮基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体6,748mg,1.38mmol)在thf(10ml)中的搅拌溶液中。将快速搅拌的混合物加热至30℃持续18h。将混合物冷却至室温,用dcm(30ml)稀释,并通过硅藻土过滤。将滤饼用dcm洗涤,并将滤液浓缩至干。将所得残余物在etoac(40ml)和饱和nahco3水溶液之间分配。分离各相,并用饱和nahco3水溶液和饱和nacl水溶液洗涤有机物。将有机物经mgso4干燥,过滤并浓缩至干,得到呈透明、无色胶状的(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体8,713mg,产率100%)。粗材料不经进一步纯化而直接使用。1h nmr(500mhz,cdcl3)δ0.79(2h,t),1.24(12h,s),1.32-1.38(2h,m),1.39-1.47(13h,m),1.68(2h,br t),1.83-1.99(4h,m),2.93(1h,td),2.97-3.07(1h,m),3.96-4.10(1h,m),5.06-5.23(2h,m),7.30-7.41(5h,m);m/z:(es
)[m h]
=517。
[0203]
中间体9:(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0204]
在室温下,将n,n-二异丙基乙胺(0.12ml,0.63mmol)缓慢添加至comu(270mg,0.63mmol)和boc-val-oh(137mg,0.631mmol)在dmf(2ml)中的搅拌溶液中。将溶液在室温下搅拌30min,然后冷却至0℃。添加(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体8,310mg,0.60mmol)在dmf(2ml)中的溶液和n,n-二异丙基乙胺(0.10ml,0.60mmol),并将反应搅拌17h,同时缓慢升温至室温。用水(40ml)稀释反应混合物,并通过过滤收集所得沉淀物。将固体溶于etoac中,经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(10%至
100%etoac于己烷中)纯化,得到(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体9,184mg,产率43%),其呈无色薄膜,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.73-0.80(2h,m),0.85(3h,d),0.89(3h,d),1.22(12h,br s),1.23-1.29(2h,m),1.37-1.45(20h,m),1.62-1.74(1h,m),1.86-1.99(3h,m),2.00-2.12(3h,m),2.97(1h,t),3.78(1h,t),3.94-4.06(1h,m),4.07-4.14(1h,m),5.00(1h,br s),5.05-5.24(2h,m),6.05(1h,br d),7.28-7.36(5h,m);m/z:(es
)[m h]
=716。
[0205]
中间体10:(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸
[0206]
将pd/c(10%wt,27mg,0.025mmol)添加至(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体9,184mg,0.257mmol)在etoac(2ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌16h。将反应混合物用etoac(20ml)和meoh(20ml)稀释,通过硅藻土过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(20%至100%etoac于己烷中,随后是10%meoh于dcm中)纯化,得到(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体10,116mg,产率72%),其呈白色固体,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.78(3h,br d),0.83-0.91(2h,m),0.94(3h,br d),1.20-1.25(12h,m),1.40(9h,br s),1.42-1.53(11h,m),1.51-1.66(1h,m),1.75-2.18(4h,m),2.19-2.34(1h,m),2.88-3.06(1h,m),3.85-4.06(2h,m),4.07-4.26(1h,m),5.14(1h,br s),5.93(1h,br s),6.73(1h,br s),7.30-7.48(1h,m);m/z:(es
)[m h]
=627。
[0207]
实例2:(2r,4s)-4-((s)-2-氨基-3-甲基丁酰胺基)-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0208]
在室温下,将三氟乙酸(0.433ml,5.63mmol)逐滴添加至(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体10,176mg,0.281mmol)在dcm(2ml)中的搅拌溶液中。3h后,将溶液在减压下浓缩,并将所得残余物溶于1m hcl(水溶液)(3.0ml,3.0mmol)和et2o(3ml)中。添加苯基硼酸(103mg,0.845mmol),并将透明的双相溶液在室温下搅拌4h。将混合物用et2o(20ml)和水(5ml)稀释,并分离各层。用et2o洗涤水层。将水层冻干并通过离子交换色谱法(porapak rxn cx 20cc柱)纯化。使用5%氨的meoh溶液(20ml)从柱上洗脱所需的产物,得到呈白色固体的(2r,4s)-4-((s)-2-氨基-3-甲基丁酰胺基)-2-(4-二羟硼基丁基)哌啶-2-甲酸(实例2,89mg,产率92%)。1h nmr(500mhz,d2o)δ0.73-0.83(2h,m),0.88-0.96(6h,m),1.14-1.24(1h,m),1.25-1.35(1h,m),1.37-1.50(2h,m),1.64-1.76(1h,m),1.79-1.99(4h,m),2.01-2.09(1h,m),2.17(1h,dd),3.11(1h,d),3.16-3.24(1h,m),3.31(1h,dt),4.10-4.22(1h,m);m/z:(es
)[m h]
=344。
[0209]
实例3:(2r,4s)-4-(2-氨基乙酰胺基)-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0210][0211]
中间体11:(2r,4s)-4-(2-((叔丁氧基羰基)氨基)乙酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0212]
在室温下,将n,n-二异丙基乙胺(0.12ml,0.63mmol)缓慢添加至comu(270mg,0.63mmol)和boc-gly-oh(110mg,0.63mmol)在dmf(2ml)中的搅拌溶液中。将溶液在室温下搅拌30min,然后冷却至0℃。添加(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体8,310mg,0.60mmol)在dmf(2ml)中的溶液和n,n-二异丙基乙胺(0.11ml,0.60mmol),并将反应搅拌17h,同时缓慢升温至室温。用水(60ml)稀释反应混合物,并用乙酸调节ph至约5。用etoac(4x15ml)萃取水相。将合并的有机物用饱和nacl水溶液(2x10ml)洗涤,经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(10%至100%etoac于己烷中)纯化,得到(2r,4s)-4-(2-((叔丁氧基羰基)氨基)乙酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体11,204mg,产率51%),其呈无色薄膜,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.75(2h,br t),1.21(14h,s),1.24(2h,br d),1.38(9h,s),1.40(10h,s),1.71(1h,dd),1.81-1.91(1h,m),1.93-2.04(3h,m),2.86-3.04(1h,m),3.62(2h,br s),3.93-4.04(1h,m),4.06-4.15(1h,m),5.11(2h,s),5.14(1h,br s),6.27(1h,br s),7.28-7.40(5h,m);m/z:(es
)[m h]
=674。
[0213]
中间体12:(2r,4s)-1-(叔丁氧基羰基)-4-(2-((叔丁氧基羰基)氨基)乙酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸
[0214]
将pd/c(10%wt,32mg,0.030mmol)添加至(2r,4s)-4-(2-((叔丁氧基羰基)氨基)乙酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体11,204mg,0.303mmol)在etoac(2ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌16h。将反应混合物用etoac(20ml)和meoh(20ml)稀释,通过硅藻土过滤,并将滤液浓缩至干。将所得残余物通过快速二氧化硅色谱法(25%至100%etoac于己烷中)纯化,得到(2r,4s)-1-(叔丁氧基羰基)-4-(2-((叔丁氧基羰基)氨基)乙酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体12,117mg,产率66%),其呈白色固体,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.78(2h,t),1.17-1.29(13h,m),1.40(10h,br s),1.45(9h,s),1.48-1.57(2h,m),1.76-2.01(3h,m),2.04-2.13(1h,m),2.98(1h,br t),3.47-3.66(1h,m),3.75(1h,s),3.90-4.06(2h,m),4.13-4.25(1h,m),5.41(1h,br s),5.92(1h,br s),6.73(1h,br s),7.65(1h,br s);m/z:(es
)[m h]
=584。
[0215]
实例3:(2r,4s)-4-(2-氨基乙酰胺基)-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0216]
在室温下,将三氟乙酸(0.31ml,4.0mmol)逐滴添加至(2r,4s)-1-(叔丁氧基羰基)-4-(2-((叔丁氧基羰基)氨基)乙酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体12,117mg,0.201mmol)在dcm(2ml)中的搅拌溶液中。
3h后,将溶液在减压下浓缩,并将所得残余物溶于1m hcl(水溶液)(3.0ml,3.0mmol)和et2o(3ml)中。添加苯基硼酸(73mg,0.60mmol),并将透明的双相溶液在室温下搅拌4h。将混合物用et2o(20ml)和水(5ml)稀释,并分离各层。用et2o洗涤水层。将水层冻干并通过离子交换色谱法(porapak rxn cx 20cc柱)纯化。使用5%氨的meoh溶液(20ml)从柱上洗脱所需的产物,得到呈白色固体的(2r,4s)-4-(2-氨基乙酰胺基)-2-(4-二羟硼基丁基)哌啶-2-甲酸(实例3,61mg,产率100%)。1h nmr(500mhz,d2o)δ0.72-0.84(2h,m),1.14-1.25(1h,m),1.26-1.34(1h,m),1.41(2h,quin),1.72(1h,dtd),1.79-1.94(2h,m),1.96-2.08(2h,m),2.10(1h,dd),3.14-3.25(1h,m),3.30-3.36(1h,m),3.37(2h,s),4.08-4.19(1h,m);m/z:(es
)[m h]
=302。
[0217]
实例4:(2r,4s)-4-[[(2s)-2-氨基丙酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0218][0219]
中间体13:(2r,4s)-4-[[(2s)-2-(叔丁氧基羰基氨基)丙酰基]氨基]-2-[4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基]哌啶-1,2-二甲酸2-苄基1-叔丁基酯
[0220]
在0℃下,将n,n-二异丙基乙胺(0.17ml,1.0mmol)缓慢添加至(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体8,245mg,0.474mmol)、boc-ala-oh(108mg,0.571mmol)和comu(244mg,0.571mmol)在dmf(1.5ml)中的搅拌溶液中。将反应搅拌1.5h,同时缓慢升温至室温。将反应混合物用水(20ml)和etoac(20ml)稀释,并分离各相。将水相用etoac(3x20ml)萃取,并将合并的有机物用饱和nacl水溶液洗涤,经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(15%至80%etoac于己烷中)纯化,得到(2r,4s)-4-[[(2s)-2-(叔丁氧基羰基氨基)丙酰基]氨基]-2-[4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基]哌啶-1,2-二甲酸2-苄基1-叔丁基酯(中间体13,191mg,产率59%),其呈淡黄色胶状,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.69-0.83(2h,m),1.22(12h,d),1.26(5h,td),1.38(9h,br s),1.40(9h,br d),1.42-1.49(3h,m),1.57-1.73(1h,m),1.83-1.98(3h,m),2.01-2.05(2h,m),2.91-3.03(1h,m),4.02(2h,br s),4.96(1h,br s),5.05-5.22(2h,m),6.21(1h,br s),7.27-7.36(5h,m);m/z:(es
)[m h]
=688。
[0221]
中间体14:(2r,4s)-1-叔丁氧基羰基-4-[[(2s)-2-(叔丁氧基羰基氨基)丙酰基]氨基]-2-[4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基]哌啶-2-甲酸
[0222]
将pd/c(10%wt,15mg,0.014mmol)添加至(2r,4s)-4-[[(2s)-2-(叔丁氧基羰基氨基)丙酰基]氨基]-2-[4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基]哌啶-1,2-二甲酸2-苄基1-叔丁基酯(中间体13,190mg,0.28mmol)在etoac(2ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌17h。将反应混合物用etoac(15ml)和meoh(2ml)稀释,通过硅藻土过滤并浓缩至干。将所得残余物通过快速二
((叔丁氧基羰基)氨基)丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体15,215mg,产率65%),其呈透明胶状,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.71-0.79(2h,m),0.87(3h,br t),1.19(4h,br s),1.21(9h,s),1.36(5h,br s),1.38(8h,s),1.39-1.41(8h,m),1.48-1.58(2h,m),1.68(1h,br dd),1.72-1.81(1h,m),1.84-1.98(3h,m),1.99-2.02(1h,m),2.88-3.04(1h,m),3.89(1h,br d),3.95-4.07(2h,m),5.00(1h,br d),5.05-5.22(2h,m),6.20(1h,br s),7.27-7.36(5h,m);m/z:(es
)[m h]
=703。
[0229]
中间体16:(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸
[0230]
将pd/c(10%wt,16mg,0.015mmol)添加至(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体15,215mg,0.31mmol)在etoac(3ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌24h。将反应混合物用etoac(10ml)和meoh(1ml)稀释,通过硅藻土过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(5%至100%etoac于己烷中)纯化,得到(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体16,147mg,产率78%),其呈干燥薄膜,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.75(2h,br s),0.89(3h,br s),1.20(12h,s),1.24-1.33(2h,m),1.37(10h,br s),1.40(10h,s),1.42-1.61(4h,m),1.85(3h,br s),1.98(2h,br s),2.01-2.06(1h,m),2.95(1h,br s),3.98(2h,br s),5.27(0.5h,br s),5.68(0.5h,br s),6.74(0.5h,br s),7.52(0.5h,br s);m/z:(es
)[m h]
=612。
[0231]
实例5:(2r,4s)-4-[[(2s)-2-氨基丁酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0232]
在室温下,将三氟乙酸(0.37ml,4.8mmol)逐滴添加至(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体16,147mg,0.24mmol)在dcm(1ml)中的搅拌溶液中。2h后,将溶液在减压下浓缩,并将所得残余物溶于1m hcl(水溶液)(2.0ml,2.0mmol)和et2o(2ml)中。添加苯基硼酸(88mg,0.72mmol),并将透明的双相溶液在室温下搅拌4h。将混合物用et2o(5ml)和水(2ml)稀释,并分离各层。用et2o洗涤水层。将水层冻干并通过离子交换色谱法(porapak rxn cx 20cc柱)纯化。使用5%氨的meoh溶液(20ml)从柱上洗脱所需的产物。将获得的材料通过反相色谱法(redisep rfc18,0至15%乙腈的水溶液)进一步纯化,得到呈白色固体的(2r,4s)-4-[[(2s)-2-氨基丁酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸(实例5,37mg,产率47%)。1h nmr(500mhz,d2o)δ0.76(2h,br t),0.87(3h,t),1.13-1.23(1h,m),1.24-1.34(1h,m),1.40(2h,quin),1.63(2h,dq),1.67-1.74(1h,m),1.78-1.85(1h,m),1.86-1.96(2h,m),1.99-2.07(1h,m),2.13(1h,br dd),3.10-3.24(1h,m),3.25-3.41(2h,m),4.07-4.21(1h,m);m/z:(es
)[m h]
=330。
[0233]
实例6:(2r,4s)-4-[[(2s)-2-氨基-4-甲基-戊酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0234][0235]
中间体17:(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)-4-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0236]
在0℃下,将n,n-二异丙基乙胺(0.17ml,0.94mmol)添加至(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体8,244mg,0.47mmol)、boc-leu-oh(96mg,0.47mmol)和comu(206mg,0.48mmol)在dmf(3ml)中的搅拌溶液中。将反应搅拌16h,同时缓慢升温至室温。将粗反应混合物用水(30ml)稀释,并用etoac(3x 10ml)萃取。将合并的有机物依次用饱和nahco3水溶液(20ml)和饱和nacl水溶液(15ml)洗涤。将有机层经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(15%至60%etoac于己烷中)纯化,得到(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)-4-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体17,224mg,产率65%),其呈白色泡沫,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.73-0.80(2h,m),0.89(3h,d),0.90(3h,d),1.22(12h,s),1.27(1h,br s),1.39(9h,s),1.40(9h,s),1.41-1.48(4h,m),1.55-1.64(2h,m),1.68(1h,br dd),1.85-1.98(3h,m),2.01(1h,br d),2.02-2.05(1h,m),2.93-3.02(1h,m),3.94-4.08(3h,m),4.83(1h,br d),5.05-5.22(2h,m),6.20(1h,br s),7.28-7.31(1h,m),7.33(4h,d);m/z:(es
)[m h]
=731。
[0237]
中间体18:(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-4-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸
[0238]
将pd/c(10%wt,13mg,0.012mmol)添加至(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)-4-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体17,174mg,0.24mmol)在etoac(2.5ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌23h。将反应混合物用etoac(10ml)和meoh(1ml)稀释,通过硅藻土过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(15%至100%etoac于己烷中)纯化,得到(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-4-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体18,149mg,产率98%),其呈干燥薄膜,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.78(2h,br t),0.91(6h,br d),1.23(11h,s),1.27-1.36(2h,m),1.40(10h,s),1.43(11h,s),1.46-1.55(2h,m),1.60-1.73(2h,m),1.78-1.96(3h,m),1.97-2.02(1h,m),2.05-2.14(1h,m),2.82-3.08(1h,m),3.92-4.08(2h,m),5.00(0.4h,br s),5.49(0.6h,br d),6.76(0.4h,br d),7.60(0.6h,br s);m/z:(es
)[m h]
=640。
[0239]
实例6:(2r,4s)-4-[[(2s)-2-氨基-4-甲基-戊酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0240]
在室温下,将三氟乙酸(0.36ml,4.7mmol)逐滴添加至(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-4-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体18,149mg,0.23mmol)在dcm(1ml)中的搅拌溶液中。2h后,将溶液在减压下浓缩,并将所得残余物溶于1m hcl(水溶液)(2.0ml,2.0mmol)和et2o(2ml)中。添加苯基硼酸(85mg,0.70mmol),并将透明的双相溶液在室温下搅拌4h。将混合物用et2o(10ml)和水(2ml)稀释,并分离各层。用et2o洗涤水层。将水层冻干并通过离子交换色谱法(porapak rxn cx 20cc柱)纯化。使用5%氨的meoh溶液(20ml)从柱上洗脱所需的产物,得到呈白色固体的(2r,4s)-4-[[(2s)-2-氨基-4-甲基-戊酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸(实例6,81mg,产率97%)。1h nmr(500mhz,d2o)δ0.74-0.82(2h,m),0.89(3h,d),0.91(3h,d),1.15-1.25(1h,m),1.24-1.34(1h,m),1.38-1.47(3h,m),1.47-1.54(1h,m),1.60(1h,dt),1.65-1.76(1h,m),1.79-1.98(3h,m),2.01-2.09(1h,m),2.14(1h,dd),3.15-3.23(1h,m),3.31(1h,dt),3.39(1h,t),4.10-4.17(1h,m);m/z:(es
)[m-h2o h]
=340。
[0241]
实例7:(2r,4s)-4-[[(2s,3s)-2-氨基-3-甲基-戊酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0242][0243]
中间体19:(2r4s)-4-((2s,3s)-2-((叔丁氧基羰基)氨基)-3-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0244]
在0℃下,将n,n-二异丙基乙胺(0.24ml,1.4mmol)缓慢添加至(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体8,355mg,0.687mmol)、boc-ile-oh(159mg,0.687mmol)和comu(300mg,0.70mmol)在dmf(4ml)中的搅拌溶液中。将反应搅拌16h,同时缓慢升温至室温。将粗反应混合物用水(30ml)稀释,并将混合物搅拌10min。通过过滤收集所得沉淀物。将固体溶于etoac(20ml)中,并用饱和nacl水溶液(5ml)洗涤,经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(5%至60%etoac于己烷中)纯化,得到(2r,4s)-4-((2s,3s)-2-((叔丁氧基羰基)氨基)-3-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体19,424mg,产率85%),其呈白色泡沫,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.73-0.80(2h,m),0.82-0.90(6h,m),0.97-1.11(1h,m),1.21(12h,s),1.26-1.31(1h,m),1.32-1.36(1h,m),1.38(9h,br s),1.39(9h,s),1.41-1.43(2h,m),1.67(1h,br dd),1.75-1.84(2h,m),1.86-1.98(3h,m),2.00(1h,br d),2.03(1h,br d),2.92-3.02(1h,m),3.81(1h,t),3.95-4.09(2h,m),4.98(1h,br s),5.04-5.21(2h,m),6.07(1h,br d),7.28-7.36(5h,m);m/z:(es
)[m h]
=730。
[0245]
中间体20:(2r,4s)-1-(叔丁氧基羰基)-4-((2s,3s)-2-((叔丁氧基羰基)氨基)-3-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸
[0246]
将pd/c(10%wt,22mg,0.021mmol)添加至(2r,4s)-4-((2s,3s)-2-((叔丁氧基羰基)氨基)-3-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体19,302mg,0.41mmol)在etoac(4ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌20h。将反应混合物用etoac(10ml)和meoh(1ml)稀释,通过硅藻土过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(15%至100%etoac于己烷中,随后是0至50%meoh于etoac中)纯化,得到(2r,4s)-1-(叔丁氧基羰基)-4-((2s,3s)-2-((叔丁氧基羰基)氨基)-3-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体20,223mg,产率84%),其呈干燥薄膜,并且为旋转异构体的混合物;以及硼酸副产物(2r,4s)-2-(4-二羟硼基丁基)-1-(叔丁氧基羰基)-4-((2s,3s)-2-((叔丁氧基羰基)氨基)-3-甲基戊酰胺基)哌啶-2-甲酸(30mg,产率13%),其呈白色固体,并且为混合物或旋转异构体。中间体20:1h nmr(500mhz,cdcl3)δ0.72-0.81(2h,m),0.82-0.88(3h,m),0.89-0.94(3h,m),0.98-1.11(1h,m),1.21-1.24(12h,m),1.26-1.31(1h,m),1.32-1.38(2h,m),1.40(10h,br s),1.42(10h,br s),1.45-1.55(1h,m),1.53-1.64(1h,m),1.76-1.97(4h,m),1.98-2.08(3h,m),2.83-3.10(1h,m),3.90-4.08(2h,m),5.15(0.5h,br d),5.81(0.5h,br s),6.74(0.5h,br s),7.48(0.5h,br s);m/z:(es
)[m h]
=640。硼酸副产物:1h nmr(500mhz,cdcl3)δ0.76-0.86(2h,m),0.86-0.96(6h,m),1.03-1.13(1h,m),1.43(9h,br s),1.44(12h,s),1.53-1.68(1h,m),1.78-1.90(2h,m),1.90-1.99(2h,m),1.99-2.04(1h,m),2.07-2.21(1h,m),2.98-3.11(1h,m),3.43-3.61(1h,m),3.90(1h,br s),3.96-4.12(2h,m),5.19(1h,br s),5.53-5.76(1h,m),6.72(1h,br s);m/z:(es
)[m h]
=558。
[0247]
实例7:(2r,4s)-4-[[(2s,3s)-2-氨基-3-甲基-戊酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0248]
在室温下,将三氟乙酸(0.62ml,8.1mmol)逐滴添加至(2r,4s)-1-(叔丁氧基羰基)-4-((2s,3s)-2-((叔丁氧基羰基)氨基)-3-甲基戊酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体20,223mg,0.35mmol)和硼酸副产物(2r,4s)-2-(4-二羟硼基丁基)-1-(叔丁氧基羰基)-4-((2s,3s)-2-((叔丁氧基羰基)氨基)-3-甲基戊酰胺基)哌啶-2-甲酸(30mg,0.05mmol)在dcm(2ml)中的搅拌溶液中。2h后,将溶液在减压下浓缩,并将所得残余物溶于1m hcl(水溶液)(3.0ml,3.0mmol)和et2o(3ml)中。添加苯基硼酸(147mg,1.21mmol),并将透明的双相溶液在室温下搅拌3h。将混合物用et2o(5ml)和水(1ml)稀释,并分离各层。用et2o洗涤水层。将水层冻干并通过离子交换色谱法(porapak rxn cx 20cc柱)纯化。使用5%氨的meoh溶液(20ml)从柱上洗脱所需的产物,得到呈白色固体的(2r,4s)-4-[[(2s,3s)-2-氨基-3-甲基-戊酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸(实例7,126mg,产率88%)。1h nmr(500mhz,d2o)δ0.78(2h,td),0.85-0.91(6h,m),1.11-1.25(2h,m),1.26-1.34(1h,m),1.37-1.49(3h,m),1.64-1.76(2h,m),1.80-1.91(2h,m),1.92-1.99(1h,m),2.01-2.09(1h,m),2.17(1h,dd),3.15-3.24(2h,m),3.31(1h,dt),4.10-4.21(1h,m);m/z:(es
)[m h]
=358。
[0249]
实例8:(2r,4s)-4-[[(2s)-2-氨基-3,3-二甲基-丁酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0250][0251]
中间体21:(2r.4s)-4-((s)-2-((叔丁氧基羰基)氨基)-3,3-二甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0252]
在0℃下,将n,n-二异丙基乙胺(0.24ml,1.4mmol)缓慢添加至(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体8,355mg,0.687mmol)、boc-叔-leu-oh(159mg,0.687mmol)和comu(300mg,0.70mmol)在dmf(4ml)中的搅拌溶液中。将反应搅拌16h,同时缓慢升温至室温。将粗反应混合物用水(30ml)稀释,并将混合物搅拌10min。通过过滤收集所得沉淀物。将固体溶于etoac(20ml)中,并用饱和nacl水溶液(5ml)洗涤,经mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(5%至55%etoac于己烷中)纯化,得到呈白色泡沫的(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)-3,3-二甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体21,372mg,产率74%)。1h nmr(500mhz,cdcl3)δ0.73-0.81(2h,m),0.95(9h,s),1.24(12h,s),1.41(10h,s),1.42-1.46(12h,m),1.68(1h,dd),1.87-1.95(1h,m),1.96-2.01(2h,m),2.02-2.05(2h,m),2.92-3.04(1h,m),3.69(1h,br d),3.98-4.12(2h,m),5.05-5.25(3h,m),5.50-5.62(1h,m),7.30-7.39(5h,m);m/z:(es
)[m h]
=730。
[0253]
中间体22:(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-3,3-二甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸
[0254]
将pd/c(10%wt,27mg,0.025mmol)添加至(2r,4s)-4-((s)-2-((叔丁氧基羰基)氨基)-3,3-二甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体21,372mg,0.511mmol)在etoac(4ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌20h。将反应混合物用etoac(10ml)和meoh(1ml)稀释,通过硅藻土过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(40%至100%etoac于己烷中,随后是0至40%meoh于etoac中)纯化,得到(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-3,3-二甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体22,265mg,产率81%),其呈干燥薄膜,并且为旋转异构体的混合物;以及硼酸副产物(2r,4s)-2-(4-二羟硼基丁基)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-3,3-二甲基丁酰胺基)哌啶-2-甲酸(32mg,产率11%),其呈透明干燥薄膜,并且为旋转异构体的混合物。中间体22:1h nmr(500mhz,cdcl3)δ0.75(2h,br t),0.93(9h,s),1.20(12h,s),1.24-1.33(2h,m),1.36(9h,s),1.38(9h,br s),1.40(3h,br s),1.51-1.64(1h,m),1.72-1.82
(1h,m),1.83-1.98(3h,m),2.03(1h,br s),2.79-3.06(1h,m),3.76(0.4h,br d),3.85-4.07(2.6h,m),5.42(0.6h,br d),6.39-6.71(1h,m),6.74-6.99(0.4h,m);m/z:(es
)[m h]
=640。硼酸副产物:1h nmr(500mhz,cdcl3)δ0.77-0.86(2h,m),0.97(9h,s),1.42(9h,br s),1.43(14h,br s),1.52-1.67(1h,m),1.75-1.90(2h,m),1.91-2.04(3h,m),2.08-2.19(1h,m),2.97-3.14(1h,m),3.44-3.63(1h,m),3.87(1h,br d),3.97-4.11(2h,m),5.50(1h,br s),6.53-6.79(1h,m);m/z:(es
)[m h]
=558。
[0255]
实例8:(2r,4s)-4-[[(2s)-2-氨基-3,3-二甲基-丁酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0256]
在室温下,将三氟乙酸(0.73ml,9.4mmol)逐滴添加至(2r,4s)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-3,3-二甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体22,265mg,0.414mmol)和硼酸副产物(2r,4s)-2-(4-二羟硼基丁基)-1-(叔丁氧基羰基)-4-((s)-2-((叔丁氧基羰基)氨基)-3,3-二甲基丁酰胺基)哌啶-2-甲酸(32mg,0.057mmol)在dcm(2ml)中的搅拌溶液中。2h后,将溶液在减压下浓缩,并将所得残余物溶于1m hcl(水溶液)(3.0ml,3.0mmol)和et2o(3ml)中。添加苯基硼酸(172mg,1.41mmol),并将透明的双相溶液在室温下搅拌4h。将混合物用et2o(5ml)和水(1ml)稀释,并分离各层。用et2o洗涤水层。将水层冻干并通过离子交换色谱法(porapak rxn cx 20cc柱)纯化。使用5%氨的meoh溶液(20ml)从柱上洗脱所需的产物,得到呈白色固体的(2r,4s)-4-[[(2s)-2-氨基-3,3-二甲基-丁酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸(实例8,158mg,产率94%)。1h nmr(500mhz,d2o)δ0.74-0.81(2h,m),0.95(9h,s),1.15-1.25(1h,m),1.26-1.34(1h,m),1.38-1.48(2h,m),1.65-1.75(1h,m),1.80-1.91(2h,m),1.96(1h,ddd),2.01-2.10(1h,m),2.19(1h,dd),3.05(1h,s),3.15-3.24(1h,m),3.30(1h,dt),4.10-4.23(1h,m);m/z:(es
)[m h]
=358。
[0257]
实例9:(2r,4s)-4-[[(2r)-2-氨基-3-甲基-丁酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0258][0259]
中间体23:(2r4s)-4-((r)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯
[0260]
在0℃下,将n,n-二异丙基乙胺(0.063ml,0.36mmol)缓慢添加至hatu(61mg,0.16mmol)和boc-d-val-oh(33mg,0.15mmol)在dmf(1ml)中的搅拌溶液中。将溶液搅拌10min,然后添加(2r,4s)-4-氨基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体8,75mg,0.15mmol)在dmf(1ml)中的溶液。将反应搅拌16h,同时缓慢升温至室温。将粗反应物用0.1m hcl(水溶液)(30ml)和etoac稀释。分离各相,并用etoac(3x15ml)萃取水相。将合并的有机物用饱和nacl水溶液洗涤,经
mgso4干燥,过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(5%至40%etoac于己烷中)纯化,得到(2r,4s)-4-((r)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体23,74mg,产率71%),其呈无色薄膜,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.75(2h,t),0.84(3h,d),0.89(3h,d),1.21(12h,s),1.30-1.35(1h,m),1.37(9h,s),1.39(9h,s),1.42(4h,br s),1.69(1h,dd),1.81-1.91(1h,m),1.92-2.01(3h,m),2.02(2h,s),2.94-3.02(1h,m),3.75(1h,dd),3.91-4.03(1h,m),5.03-5.19(3h,m),6.10(1h,d),7.28-7.39(5h,m);m/z:(es
)[m h]
=715。
[0261]
中间体24:(2r,4s)-1-(叔丁氧基羰基)-4-((r)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸
[0262]
将pd/c(10%wt,5mg,0.005mmol)添加至(2r,4s)-4-((r)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-1,2-二甲酸2-苄基1-(叔丁基)酯(中间体23,69mg,0.10mmol)在etoac(1ml)中的溶液中。在室温下,将悬浮液在氢气气氛(气球,将烧瓶抽真空并用氢气回填3次)下搅拌19h。将反应混合物用etoac(10ml)和meoh(1ml)稀释,通过硅藻土过滤并浓缩至干。将所得残余物通过快速二氧化硅色谱法(40%至100%etoac于己烷中,随后是0至40%meoh于etoac中)纯化,得到(2r,4s)-1-(叔丁氧基羰基)-4-((r)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体24,40mg,产率66%),其呈干燥薄膜,并且为旋转异构体的混合物。1h nmr(500mhz,cdcl3)δ0.77(2h,t),0.91(6h,br d),1.20-1.24(13h,m),1.29(1h,br d),1.33-1.42(11h,m),1.43(10h,s),1.70-1.82(1h,m),1.83-1.90(1h,m),1.91-2.02(4h,m),3.00(1h,t),3.83-3.94(1h,m),3.96-4.07(1h,m),4.13(1h,br s),5.40(1h,d),6.03-6.33(1h,m),6.90-7.22(1h,m);m/z:(es
)[m h]
=625。
[0263]
实例9:(2r,4s)-4-[[(2r)-2-氨基-3-甲基-丁酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸
[0264]
在室温下,将三氟乙酸(0.10ml,1.3mmol)逐滴添加至(2r,4s)-1-(叔丁氧基羰基)-4-((r)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)丁基)哌啶-2-甲酸(中间体24,40mg,0.06mmol)在dcm(1ml)中的搅拌溶液中。2h后,将溶液在减压下浓缩,并将所得残余物溶于1m hcl(水溶液)(1.0ml,1.0mmol)和et2o(1ml)中。添加苯基硼酸(24mg,0.20mmol),并将透明的双相溶液在室温下搅拌20h。将混合物用et2o(5ml)和水(1ml)稀释,并分离各层。用et2o洗涤水层。将水层冻干并通过离子交换色谱法(porapak rxn cx 20cc柱)纯化。使用5%氨的meoh溶液(20ml)从柱上洗脱所需的产物,得到呈白色固体的(2r,4s)-4-[[(2r)-2-氨基-3-甲基-丁酰基]氨基]-2-(4-二羟硼基丁基)哌啶-2-甲酸(实例9,20mg,产率91%)。1h nmr(500mhz,d2o)δ0.73-0.83(2h,m),0.87-0.95(6h,m),1.14-1.23(1h,m),1.24-1.33(1h,m),1.41(2h,quin),1.65-1.77(1h,m),1.79-1.87(1h,m),1.88-1.98(3h,m),2.01-2.09(1h,m),2.15(1h,dd),3.14(1h,d),3.15-3.24(1h,m),3.31(1h,dt),4.11-4.20(1h,m);m/z:(es
)[m-h2o h]
=326。
[0265]
实例10.化合物12(精氨酸酶1抑制剂)与抗pdl1或抗pdl1和抗nkg2a或聚i:c组合
在癌症临床前模型中的功效
[0266]
方法:
[0267]
mc38-ova:将表达ova抗原的小鼠mc38结直肠癌细胞(5x105个细胞/小鼠)皮下植入6至8周龄雌性c57bl/6小鼠的右胁中。在移植后第6天,将各组小鼠用媒介物(水)、30mg/kg化合物12、10mg/kg抗pdl1(medi4736)或组合处理。在水中配制化合物12,并每天两次口服给药。在1x pbs中配制medi4736,并每周两次腹膜内给药持续2周。用卡尺测量肿瘤长度和宽度,并且使用公式(长度x宽度2)*π/6来计算肿瘤体积,然后报告为计算的肿瘤体积。
[0268]
为了监测免疫细胞变化,在处理后四天、十天或十四天收获肿瘤。将肿瘤切除并机械切碎。然后在37℃下,将肿瘤与肿瘤解离酶混合物(美天旎生物技术公司(miltenyi biotec))在gentle macs仪器(美天旎生物技术公司)中孵育40min。制备单细胞悬浮液并对其进行多种免疫细胞标记物染色,以使用多色流式细胞术确定处理后的免疫细胞变化。此外,在分析前通过用佛波醇12-豆蔻酸-13-乙酸盐(pma)和离子霉素进行离体再刺激来评估cd8 细胞毒性t细胞的功能应答。
[0269]
ct.26wt:将小鼠ct.26wt结直肠癌细胞(5x105个细胞/小鼠)皮下植入6至8周龄雌性balb/c小鼠的右胁中。在植入后第6天,将各组小鼠用媒介物(水)、30mg/kg化合物12、10mg/kg抗pdl1(medi4736)或组合处理。将另外的组用10mg/kg抗nkg2a(莫纳利珠单抗)与化合物12或medi4736组合,或化合物12、莫纳利珠单抗和medi4736的三重组合处理。在水中配制化合物12,并每天两次口服给药。在1x pbs中配制medi4736,并每周两次腹膜内给药持续2周。在1x pbs中配制莫纳利珠单抗,并每周两次静脉内给药持续1.5周(3个剂量)。用卡尺测量肿瘤长度和宽度,并且使用公式(长度x宽度2)*π/6来计算肿瘤体积,然后报告为计算的肿瘤体积。
[0270]
ll/2:将小鼠路易斯肺(ll/2)癌细胞(1x106个细胞/小鼠)皮下植入6至8周龄c57bl/6小鼠的右胁中。在植入后第6天,将各组小鼠用媒介物(水)、30mg/kg化合物12、7.5mg/kg tlr3激动剂(聚i:c)或组合处理。在水中配制化合物12,并每天两次口服给药。在水中配制聚i:c,并每周3次腹膜内给药。用卡尺测量肿瘤长度和宽度,并且使用公式(长度x宽度2)*π/6来计算肿瘤体积,然后报告为计算的肿瘤体积。
[0271]
结果:如图1a至1d、图2a至2d、和图3a至3f中所示,化合物12单一疗法在所有三种小鼠同系肿瘤模型中均适度有效。仅给药抗pdl1也在两种结直肠癌肿瘤模型中显示出适度的功效。试剂组合展示出明显更强的功效:在mc38-ova中87%的肿瘤生长抑制和在ct.26wt模型中46%的总肿瘤生长抑制(有一例完全缓解)。向化合物12 抗pdl1治疗中添加抗nkg2a导致53%的总肿瘤生长抑制和3例完全缓解。tlr3激动剂(聚i:c)显示出中度的单一疗法活性,在第16天的tgi为76%。化合物12 聚i:c的组合导致87%的肿瘤生长抑制。
[0272]
如图4a至4f中所示,在mc38-ova模型中arg抑制剂与抗pdl1的体内pd组合研究显示出多个肿瘤免疫细胞群的增加(约4倍的cd8 t细胞、2倍的nk细胞、2倍的cd103 dc)和cd8 t细胞活化的增加。此外,如图5a和5b中所示,arg抑制剂导致外周(引流ln)中产生ifng和tnfa的cd8 t细胞的增加。在ct.26wt模型中抑制并有一例完全缓解。
[0273]
实例11.化合物12(精氨酸酶1抑制剂)与放射疗法(rt)组合在癌症临床前模型中的功效
[0274]
方法:将1e6 ll/2鼠科动物肺癌细胞皮下植入六至八周龄bl/6小鼠(查尔斯河实
验室(charles river labs))的右胁中。在植入后第6天,将动物按每笼的平均肿瘤体积随机分为四组(n=12只/组)。将第1组在第6天和第9天麻醉用于模拟照射,并从第6天起以po,bid给药媒介物(水)。将第2组在第6天和第9天麻醉并给予5gy的靶向肿瘤的放射。从第6天起向第3组以30mg/kg po bid施用az8400,并从第6天起向第4组以30mg/kg施用az8400,并且在第6天和第9天进行麻醉和照射。每周两次测量体重和肿瘤体积,直到肿瘤>1500mm3,此时将动物人道处死。
[0275]
结果:
[0276]
如图5a和5b中所示,在小鼠同系肺肿瘤模型ll/2中,与以30mg/kg每日两次给药化合物12和放射疗法(在植入后第6天和第9天5戈瑞;约30%的肿瘤生长抑制,与媒介物相比p>0.05)相比,化合物12和放射疗法的组合展示出明显更强的功效,达到约60%的肿瘤生长抑制(与媒介物和单一疗法治疗相比p<0.05)。
[0277]
[0278]
[0279]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。