1.本公开内容总体上涉及由木质纤维素材料形成储存稳定的水解产物的方法和系统,以及通过这样的方法形成的水解产物。其还涉及所述水解产物用以在储存和/或发酵期间降低和/或控制微生物污染的用途。此外,本公开内容涉及用于在单独的水解和发酵(分步水解和发酵,separate hydrolysis and fermentation,shf)工艺中降低和/或控制微生物污染的方法和系统。
背景技术:
2.由可再生资源生产商品的生物精制厂提供对基于减少的石油供应的炼油厂的替代,并且允许在改进能源安全方向上的转变。来自林业和农业的木质纤维素残留物作为原材料是有吸引力的,因为它们充足、相对便宜、并且不用于食物。木质纤维素主要由木质素和两类多糖(纤维素和半纤维素)组成。多糖在基于生物催化剂(诸如工业上重要的面包师酵母酿酒酵母(saccharomyces cerevisiae))的工艺中可水解成糖并且转化成各种发酵产物(诸如生物醇)。
3.在纤维素的水解之前典型地是预处理,在其中半纤维素降解并且愈发地使纤维素可易于为纤维素分解酶所用。在水解期间,存在的纤维素被部分转化为还原糖。水解是相对长久的工艺,并且可持续最高达150小时。
4.在后续发酵步骤中,剩余的纤维素材料被转化为还原糖。发酵当纤维素材料已经转化为可发酵糖时结束,并且这样的可发酵糖可被转化为目标生物化学品,诸如生物醇或酸以及二氧化碳。所述发酵步骤在完成之前可花费若干天。
5.微生物污染是既在水解期间也在发酵期间广泛存在的问题。乳酸杆菌(lactobacillus sp.)的各种物种通常是主要的细菌污染物。已知,乳酸杆菌细菌在发酵期间常用的大多其它细菌无法调节而存活的条件下充分调节而存活,所述条件诸如高乙醇浓度、低ph和低氧条件。不期望的此类污染物存在通常通过使用抗生素控制,其不仅可导致废物处置问题,还可导致引入抗生素耐受性的风险。还已知影响发酵的其它类型的生物体,诸如野生酵母和真菌,但是这些不如乳酸杆菌普遍。
6.如下工艺可被称为单独的水解和发酵(shf)工艺:其中水解和发酵是在单独步骤中潜在地在不同的工艺条件下诸如在不同ph和温度下进行的。
7.在shf工艺中,所述工艺可将水解和发酵步骤中断。在某些情形下,可期望在发酵之前将水解产物在一段时间期间储存。例如需要将所述水解产物可运输至不同地点,用于后续发酵。
8.在水解产物的储存期间,细菌生长风险增加,其可导致被感染(污染,infect)的糖水解产物。将这样的被感染的水解产物引入到发酵器皿中可显著损害发酵效率。由于乳酸杆菌可抑制微生物体(诸如酵母菌、大肠杆菌、或期望的乳酸杆菌菌株)发酵,目标化学品的产率可降低。被感染的水解产物还可导致发酵工艺必须被停机或推迟,其导致收益损失和生产成本增加。
9.因此,需要用以克服在水解期间和/或在后续发酵期间的感染问题的改进方法。特别地,需要提供来自木质纤维素材料的水解产物,其不含细菌污染物并且适用于在发酵之前的储存和运输。
技术实现要素:
10.鉴于上文所提及的问题,本公开内容的目的之一是提供关于如下的改进:在由木质纤维素材料且在单独的水解和发酵(shf)工艺中形成的水解产物中降低和/或控制污染。特别地,所述水解产物应当适用于在发酵之前的储存和运输。
11.根据本公开内容的第一方面,提供了用于由木质纤维素材料形成储存稳定的水解产物的方法,所述方法包括:
12.a)预处理所述木质纤维素材料以形成包含液体组分和固体组分的经预处理的木质纤维素组合物;所述固体组分至少包含木质素和纤维素
13.b)从所述经预处理的木质纤维素组合物除去至少80%、优选地至少90%的所述液体组分,以形成分离的木质纤维素组分,
14.c)使用稀释液稀释所述木质纤维素组分,以形成含水浆料
15.d)使所述含水浆料在至少一种糖化酶的存在下进行水解,以形成水解产物,
16.e)向所述水解产物以足以形成储存稳定的水解产物的量添加抗微生物化合物,其中所述抗微生物化合物包含至少一个硫氧阴离子。
17.如本文中所使用的,术语“储存稳定的水解产物”意指可在室温下储存至少三周、优选地至少五周、诸如至少八周而未受感染的水解产物。换言之,所述储存稳定的水解产物基本上不含细菌污染物,并且可因此被安全地引入后续发酵单元中。本发明的水解产物提供对于细菌生长和存活而言不利的环境,并且即使在长期的储存和运输期间也能够维持其储存稳定的性质。若所述水解产物是在4℃下储存的,则储存期可显著更长。
[0018]“木质纤维素材料”指如下材料:其包含单独的纤维素,或者纤维素、木质素、和可能的半纤维素的组合。所述木质纤维素材可为例如木残留物或林业残留物(诸如木屑、锯木厂或造纸厂废弃物),或者农业残留物(诸如甘蔗渣)。
[0019]“预处理所述木质纤维素材料”指预处理木质纤维素材料以改变其性质使得纤维素在后续水解期间变得更可用。所述预处理可牵涉技术人员已知的一种或多种预处理方法。所述预处理可通过水热/化学、物理和生物方法实现。例如,所述预处理可牵涉酸预处理,碱预处理,氨纤维爆炸,酸催化或非催化的蒸汽爆炸,自动水解,有机溶剂、亚硫酸盐或硫酸盐制浆。进一步,所述预处理可包括浸渍,其指将浸渍流体或气体吸收或物质转移至所述木质纤维素材料,之后进行上文所举例说明的加工和/或预处理。所述流体可例如为酸(诸如亚硫酸、硫酸)、氨、亚硫酸盐/亚硫酸氢盐、硫酸盐、氢氧化物和醇的溶剂或溶液。所述浸渍还可使用气体(诸如so2气体或co2气体)、或者使用具有任意给定组合、浓度和比例的气体和流体的组合进行。所述预处理还可包括汽蒸(steaming)。汽蒸指如下工艺:其用于从纤维素生物质逐出空气,以促进纤维素的进一步水解。汽蒸是用于预处理例如木质纤维素生物质的熟知方法。
[0020]
经预处理的木质纤维素组合物的“固体组分”可包含木质纤维素材料的固体的未水解或未溶解的材料,诸如木质素、纤维素、和/或半纤维素。
[0021]
经预处理的木质纤维素组合物的“液体组分”可包含水、一种或多种单糖、寡糖、和预处理工艺的副产物(诸如水解和发酵抑制剂、浸渍组分和有机酸)。水解和发酵抑制剂的实例包括酚类化合物、脂族酸、和呋喃醛。这些化合物可在水解和发酵期间分别抑制酶和酵母。
[0022]
所述液体组分中包含的组分,特别是水解和发酵抑制剂,可对水解和发酵工艺的效率具有负面效果。因此,将包含这样的化合物的液体组分从经预处理的木质纤维素组合物除去,如上文步骤b)中所定义的。除去的液体组分可在本公开内容的工艺中或之外,例如在乙醇发酵(其典型地在预处理和水解步骤之间不需要任何分离或洗涤)中利用。
[0023]
除去液体组分的步骤可包括经预处理的木质纤维素组合物的洗涤和/或离心。在实施方式中,根据本公开内容的方法包含另外的洗涤步骤,所述另外的洗涤步骤在已经于步骤b中从经预处理的木质纤维素组合物除去液体组分之后。
[0024]
所述“分离的木质纤维素组分”包含经预处理的木质纤维素组合物的固体组分(即未水解或未溶解的木质素、纤维素和/或半纤维素)和少量的液体组分。所述木质纤维素组分包含80:20、例如90:10、例如95:5的固体组分-对-液体组分之比,或者80:20-95:5的固体组分-对-液体组分之比。所述木质纤维素组分基本上是固体。
[0025]
应注意,典型地如此前所提及地洗涤所述分离的木质纤维素组分,并且随后进行稀释步骤c)的木质纤维素组分可包含40:60
–
70:30的固液比(其中得自步骤a)的经预处理的木质纤维素组合物的所述液体组分已经除去至少80%、优选地至少90%)。换言之,来自步骤a)中的预处理的经预处理的木质纤维素组合物的液体组分已经至少部分地置换为洗涤液体、典型地水。
[0026]
根据至少一种实例实施方式,经预处理的木质纤维素组合物的液体组分可被称为抑制性液体组分,因为其包含水解和发酵抑制剂。因此,步骤b)可以不同方式表述为:
[0027]
b)从所述经预处理的木质纤维素组合物除去至少80%、优选地至少90%的抑制性液体组分,以形成分离的木质纤维素组分。
[0028]
相应地,所述木质纤维素组分可包含80:20、例如90:10、例如95:5的固体组分-对-抑制性液体组分之比,或者80:20-95:5的固体组分-对-抑制性液体组分之比。如上文所陈述的,后续进行稀释步骤c)的木质纤维素组分可包含30%-60%之间的液体。
[0029]
随后,使用稀释液稀释所述分离的木质纤维素组分,以形成含水浆料。所述稀释液典型地为水或足够清洁的工艺液体。例如,可重新使用和利用从所述工艺的上游或下游点再循环的工艺液体(例如洗涤液)。优选地,所述稀释液为水。
[0030]
在步骤c)中形成的含水浆料基本上不含水解和发酵抑制剂和其它有害化合物。例如,水解和发酵抑制剂的量为小于10mg/ml。根据至少一种实例实施方式,此处,小于10mg/ml的水解和发酵抑制剂指与硫氧阴离子(诸如亚硫酸根或连二亚硫酸根)反应性的化合物,例如羟甲基糠醛hmf、糠醛、酚类和芳族抑制化合物。根据至少一种实例实施方式,所述小于10mg/ml的水解和发酵抑制剂不包括非反应性化合物,即不与硫氧阴离子反应的化合物(诸如脂族酸)。即,根据这样的实施方式,不与硫氧阴离子(例如亚硫酸根或连二亚硫酸根)反应的抑制剂与含水浆料无关,并且不包括在10mg/ml的限制中。
[0031]
因而,所述含水浆料可视为“洁净的”或纯化的物流,其中已经除去恰当量的有害副产物以及水解和发酵抑制剂。所述含水浆料可包含少量的在方法的步骤a)中形成的经预
处理的纤维素组合物的液体组分。
[0032]
因而,从经预处理的木质纤维素除去至少80%、优选地至少90%的所述液体组分(或抑制性液体组分)的步骤b)和使用稀释液稀释所述木质纤维素组分以形成含水浆料的步骤c)的组合效果导致浆料成为不具有或具有最小量的有害副产物和发酵抑制剂的经纯化的物流。
[0033]
所述含水浆料包含小于20%重量、优选地小于10%重量、并且更优选地小于5%重量的经预处理的木质纤维素组合物的液体组分。
[0034]
根据至少一个实例实施方式,稀释步骤c)包含添加至少0.1-6份、例如1-5份、例如2-4份的稀释液诸如水。因此,添加与所述木质纤维素组分(例如具有40:60-70:30的固液比的木质纤维素组分)相比至少10%的稀释液。换言之,向所述木质纤维素组分添加特定量的稀释液,使得所得含水浆料中的悬浮固体含量为10%至35%重量、或12%至35%重量、或15%至35%重量。
[0035]
根据至少一种实例实施方式,所述方法包含调整所述木质纤维素组分或含水浆料的ph。
[0036]
典型地,调整ph的步骤与稀释步骤c)是分开的。
[0037]
在这方面,应注意,向尚未进行分离(即步骤b))的经预处理的木质纤维素材料添加包含硫氧阴离子的抗微生物化合物将具有解毒效果;即,降低发酵抑制剂(诸如酚类化合物、脂族酸、和呋喃醛)的量,并且通常改进后续发酵工艺期间的条件。然而,向未分离的预处理物流添加硫氧阴离子事实上可增加细菌生长,如下文实施例1所说明的。为了产生这样的未分离物流的抗微生物效果,将需要显著量的硫氧阴离子。在此步骤中引入太高量的硫氧阴离子与不必要的成本和材料支出相关联。
[0038]
因此,分离、任选的洗涤和后续稀释允许形成富糖的含水浆料,其中存在较少抑制性化合物。
[0039]
随后,使步骤c)的含水浆料在至少一种糖化酶的存在下进行水解(步骤d),以形成水解产物。
[0040]
所述水解反应被至少一种糖化酶催化。“糖化酶”指如下的酶:其可将(木质)纤维素材料转化或水解为可发酵糖类,诸如单糖和/或二糖。这样的糖化酶可为将多糖水解的糖苷酶。糖苷酶的实例包括:纤维素水解用的糖苷酶,诸如纤维素酶、内切葡聚糖酶、外切葡聚糖酶、纤维二糖水解酶、和β-葡糖苷酶,半纤维素水解用的糖苷酶,诸如木聚糖酶、内切木聚糖酶、外切木聚糖酶、β-木糖苷酶、阿拉伯木聚糖酶、甘露聚糖酶、半乳聚糖酶、果胶酶、和葡糖醛酸内酯酶(glucuronase),以及淀粉水解用的糖苷酶,诸如淀粉酶、cc-淀粉酶、β-淀粉酶、葡糖淀粉酶、cc-葡糖苷酶、和异淀粉酶,或者存在于ec 3.2.1.x(诸如ec 3.2.1.4)中的酶组中的任意酶,其中ec为酶学委员会编号。
[0041]
本公开内容的工艺中形成的水解产物可包含来自木质纤维素生物质的糖,诸如葡萄糖、甘露糖、木糖、阿拉伯糖、半乳糖、蔗糖和果糖。
[0042]
在实施方式中,所述储存稳定的水解产物至少包含葡萄糖。
[0043]
在实施方式中,所述储存稳定的水解产物至少包含两种不同的糖。
[0044]
所述水解可在3至6、例如在5和5,5之间的范围中的ph下实施。水解期间的温度可在40至70℃、例如50和60℃之间的范围中。这些条件允许糖化酶以最优方式工作。进一步,
这些条件防止不期望的微生物体的生长。
[0045]
所述方法进一步包含如下的步骤e):向所述水解产物以足以形成储存稳定的水解产物的量添加抗微生物化合物,其中所述抗微生物化合物包含至少一个硫氧阴离子。
[0046]
包含至少一个硫氧阴离子的抗微生物化合物的实例为二亚硫酸盐(disulfite)、亚硫酸氢盐(bisulfite)、连二亚硫酸盐、连二硫酸盐、硫酸盐、亚硫酸盐、和硫代硫酸盐。
[0047]
本发明人已经发现,根据本公开内容的方法产生稳定且基本上“无感染”的水解产物,其中消除或实质上降低细菌污染物的存在。因此,这样的水解产物允许延长的储存期。本公开内容的储存稳定的水解产物可在室温下储存最高达三周、例如至少五周、诸如至少八周,而未受感染。若所述水解产物在4℃下储存,则储存期可显著更长。所述水解产物可用于后续发酵步骤中,以提供安全并且无污染的发酵。此外,为了产生显著的污染降低效果,仅需要添加少量的抗微生物化合物。所述方法牵涉在水解之前的分离步骤、以及只利用相对纯的糖物流的事实允许抗微生物化合物的添加以“助推(增进,boost)”所述水解产物并且保存其无感染的性质,使得水解产物变为对于在储存期间和后续发酵期间的感染是耐受的。
[0048]
根据至少一种实例实施方式,步骤e)在所述水解产物的任意储存之前,至少在所述水解产物储存至少1天、诸如至少7天、或至少14天、或至少21天之前进行。
[0049]
根据至少一种实例实施方式,步骤e)是在所述水解产物的任意发酵或后续发酵步骤之前进行的。
[0050]
在实施方式中,步骤c)中形成的含水浆料具有10%至35%重量的悬浮固体含量。取决于发酵工艺以及将产生的目标化学品和条件为何,可调整稀释和悬浮固体含量。若悬浮固体含量太高,则在后续水解步骤中将需要较大量的酶。这将显著增加生产成本。
[0051]
根据至少一种实例实施方式,步骤c)中形成的含水浆料具有12%至35%重量、或15%至35%重量、或20%至35%重量的悬浮固体含量。
[0052]“目标化学品”可为可由经预处理和经水解的纤维素材料在包含发酵的工艺中制备的任意化学品。所述目标化学品可例如为醇或酸、烷烃、烯烃、芳族化合物、醛、酮、生物聚合物、蛋白、肽、氨基酸、维生素、抗生素、和其它药物。例如,所述目标化学品为乳酸、丁醇、丁二酸、或异丁烯。乙醇典型地不是本公开内容的方法中的目标化学品,因为乙醇生产不需要在预处理和水解步骤之间的任何分离。
[0053]
在实施方式中,水解步骤b)是在存在氧的情况下进行的。优选地,所述水解步骤是在存在空气的情况下进行的。
[0054]
换言之,所述水解为需氧工艺。这是有益的,因为纤维素的水解得到改进。纤维素的酶促氧化降低使纤维素纤维保持在一起的力,由此增加水解酶的将纤维素水解成糖的可利用性和可接近性。
[0055]
可考虑在水解之前或在水解期间添加抗微生物化合物,然而若水解是在存在空气(和40℃或更高的温度)的情况下进行的,则亚硫酸根氧阴离子将解离,并且形成气态二氧化硫(so2),其将随气流离开水解。换言之,抗微生物效果将减少。因此,优选地,添加硫氧阴离子是在水解之后进行的。
[0056]
在实施方式中,所述抗微生物化合物的浓度在1和100mm之间、例如在5和50mm之间、例如在5和25mm之间。优选地,所述浓度在较低范围中,因为太高浓度可抑制在后续发酵
步骤中利用的微生物。
[0057]
如后文中实施例2所示,为了实现抗微生物效果,仅需要少量的抗微生物化合物。这主要是因为本公开内容的工艺形成的水解产物是基本上纯的,并且含有较少抑制剂和可使氧阴离子反应并且因而将其消耗的其它化合物,这是当这样的硫氧阴离子化合物用于对含有水解和发酵抑制剂的木质纤维素水解产物进行调节或解毒时所需的效果。
[0058]
在实施方式中,所述抗微生物化合物选自连二亚硫酸盐和亚硫酸盐。这样的化合物是硫氧阴离子的有利载体,硫氧阴离子被认为是抗微生物效果的主要原因。
[0059]
已知,连二亚硫酸盐和亚硫酸盐用作还原剂以改进发酵期间的可发酵性,典型地通过减轻发酵抑制剂的效果。这例如公开于wo2011/080129中。
[0060]
亚硫酸根(so
32-)用于若干大规模工业过程中。连二亚硫酸根([s2o4]
2-)是在制浆和造纸行业中用于还原性漂白和在纺织工业中作为染色工艺中的还原剂使用的工业化学品。因此,亚硫酸盐和连二亚硫酸盐均可以大量获得。进一步,应理解,抗微生物试剂可包含呈盐形式的(即与不同阳离子络合的)亚硫酸根和/或连二亚硫酸根。实例包括但是不限于na2so3、nahso3、khso3、和na2s2o4。根据至少一种实例实施方式,所述抗微生物化合物为na2so3、nahso3、khso3、或na2s2o4、或其任意混合物。
[0061]
连二亚硫酸盐当溶解在水解产物中时将形成亚硫酸根离子,并且从而具有如同添加亚硫酸盐的相应抗微生物效果。相应地,包含亚硫酸根或连二亚硫酸根的盐在溶解在水解产物中之后将(直接地或经由此前所描述的连二亚硫酸盐的溶解)形成亚硫酸根离子。
[0062]
连二亚硫酸根可以1-50、例如4至25mm的量添加。例如通过以1-50、例如4至25mm的量添加na2s2o4。
[0063]
亚硫酸根可以1-100、例如10至60mm的量添加。例如,通过以1-100、例如10至60mm的各自量添加na2so3、nahso3、或khso3。
[0064]
应注意,另外的化合物包含硫氧阴离子。
[0065]
根据至少一种实例实施方式,所述抗微生物化合物为含有硫的化合物,其当溶解在水解产物中时形成游离硫氧阴离子。所述含有硫的化合物以导致1-100、例如10至60mm的硫氧阴离子的量添加在水解产物中。
[0066]
根据至少一种实例实施方式,所述抗微生物化合物为含有亚硫酸根的化合物(例如亚硫酸盐)或者含有亚硫酸根的化合物的前体或衍生物,当溶解在水解产物中时形成呈亚硫酸根离子形式的硫氧阴离子。所述含有亚硫酸根的化合物以导致1-100、例如10至60mm的亚硫酸根离子的量添加于水解产物中。应理解,可使用不同于亚硫酸根的另外硫氧阴离子来源,并且抗微生物效果一般地与硫氧阴离子相关而非特别地与亚硫酸根有关。然而,根据至少一种实例实施方式,硫氧阴离子的抗微生物效果与在硫氧阴离子为亚硫酸根时有关,即亚硫酸盐的抗微生物效果。
[0067]
在实施方式中,本公开内容的方法进一步包含使步骤d)或步骤e)中形成的水解产物进行分离,以除去在水解期间形成的残留固体组分的至少一部分。
[0068]
这样的固体组分可包括不完全水解的纤维素和/或木质素。优选地,所述水解产物包含小于10%的这样的固体组分。
[0069]
应理解,用于除去在水解期间形成的残留固体组分的至少一部分的分离的步骤可被称为二次分离(相对于参考上文步骤b)所描述的分离,其可被称为一次分离)。因而,步骤
e)可在这样的二次分离之前或之后进行,但是总是在一次分离(其在步骤d)即水解步骤之前进行)之后。
[0070]
在实施方式中,所述方法进一步包含通过以下来控制储存稳定的水解产物中抗微生物化合物的量的步骤:
[0071]-测量储存稳定的水解产物中的硫离子含量
[0072]-将所述硫离子含量与参比硫值比较,并且任选地
[0073]-若所述硫离子含量低于所述参比硫值,则添加另外量的抗微生物化合物。
[0074]
在实施方式中,所述硫离子含量是在管线中(inline)测量的;即,所述测量是直接在工艺管线中进行的。在整个本技术文本中,硫离子可称为硫氧阴离子。
[0075]
在替代实施方式中,所述硫离子含量是在线测量的;即,所述测量是对从工艺管线分流、诸如在来自主工艺管线的旁路环路中的样品。
[0076]
管线中和在线的硫离子测量是有利的,因为可避免用于控制工艺参数的耗时的手动取样方法和后续实验室分析。换言之,在管线中和在线的硫离子测量提供用于矫正进行中的工艺的快捷和高效的方法。
[0077]
所述硫离子含量可通过滴定手段、硫探头或硫传感器测量,滴定手段、硫探头或硫传感器配置成反映硫离子(即存在于水解产物中的硫氧阴离子)的含量。
[0078]
将测量的硫含量与参比硫值比较,所述参比硫值可取决于工艺条件或者将在后续发酵期间产生的目标化学品而改变。所述参比硫值可为预定的阈值。例如,所述参比硫值为参比硫离子含量值,其例如代表预定的硫离子含量阈值。
[0079]
若所述硫离子含量低于所述参比硫值,则可添加另外的硫氧阴离子,例如更多的连二亚硫酸根和/或亚硫酸根。例如,若样品中存在小于1mm硫,则可需要添加更多的亚硫酸根/连二亚硫酸根。
[0080]
测量可直接在引入所述抗微生物化合物之后进行,以确保样品的品质和高效感染控制。
[0081]
测量还可在所形成的水解产物储存期间进行,或者正好在发酵之前进行,以确保待向发酵器皿添加的水解产物不含污染物。
[0082]
根据第二方面,提供通过如前文中所描述的方法形成的水解产物。
[0083]
在水解产物已经形成之后,其可在发酵并且加工成目标化学品之前储存。本公开内容的水解产物适于保持稳定并且不含细菌污染物,并且适用于在相对长期的时间期间的储存并且适用于运输至例如不同的发酵地点。
[0084]
根据至少一种实例实施方式,所述水解产物是基本上无感染的水解产物。因此,消除或实质上降低细菌污染物的存在。因此,这样的水解产物允许延长的储存期。根据至少一种实例实施方式,细菌污染水平在细菌污染阈值以下。细菌污染物阈值可例如修改为使得所述水解产物在室温下可储存最高达三周、例如至少五周、诸如至少八周而未受感染。所述水解产物可被称为储存稳定的水解产物。若所述水解产物是在4℃下储存的,则储存期可显著更长。所述水解产物可用于后续发酵步骤中,以提供安全并且无污染的发酵。进一步,为了产生显著的污染降低效果,所述水解产物可仅包含少量的抗微生物化合物。如下事实允许水解产物中的抗微生物化合物起到“助推剂”作用并且保存其无感染的性质,使得所述水解产物在储存期间和在后续发酵期间对感染是耐受的:水解产物是至少通过在水解之前的
分离步骤形成的,以及在水解产物的形成中只利用相对纯的糖物流。
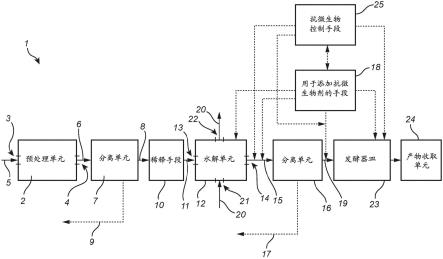
[0085]
根据至少一种实例实施方式,所述水解产物中细菌污染水平和抗微生物化合物的量修改成使得所述水解产物在室温下可储存三周、例如至少五周、诸如至少八周而未受感染。
[0086]
根据至少一种实例实施方式,所述细菌污染阈值为3*108个细菌细胞/ml。即,作为基本上无感染的水解产物的水解产物具有所述细菌污染阈值以下的细菌污染物的存在。根据至少一种实例实施方式,向所述水解产物以足以形成储存稳定的水解产物的量添加抗微生物化合物的步骤e)导致如下的水解产物:其在储存(例如至少1天、至少7天、或至少14天、或至少21天的储存)期间具有在所述细菌污染阈值以下的细菌污染物。
[0087]
根据至少一种实例实施方式,水解产物中抗微生物化合物的浓度在1和100mm之间、例如在5和50mm之间、例如在5和25mm之间。优选地,所述浓度在较低范围中,因为太高浓度可抑制在后续发酵步骤中利用的微生物。根据至少一种实例实施方式,所述抗微生物化合物选自连二亚硫酸盐和亚硫酸盐。这样的化合物是硫氧阴离子的有利载体,硫氧阴离子被认为是抗微生物效果的主要原因。根据至少一种实例实施方式,所述抗微生物化合物为na2so3、nahso3、khso3、或na2s2o4、或其任意混合物。在连二亚硫酸盐的情形中,所述水解产物可包含1-50、例如4至25mm的量。例如,na2s2o4以1-50、例如4至25mm的量。在亚硫酸盐的情形中,所述水解产物可包含1-100、例如10至60mm的量。例如,na2so3、nahso3、或khso3分别以1-100、例如10至60mm的量。
[0088]
根据至少一种实例实施方式,所述水解产物包含葡萄糖、水平在细菌污染阈值以下的细菌污染、和至少5mm抗微生物化合物,使得所述水解产物对于乳酸杆菌的添加耐受至少21天。因而,细菌污染水平在所述细菌污染阈值以上或小于5mm抗微生物化合物的乳酸杆菌的添加将会导致在添加之后的21天期间葡萄糖的显著降低(即葡萄糖由于感染而消耗),由于细菌污染阈值以下的细菌污染水平和至少5mm抗微生物化合物的组合而未导致所述水解产物的感染。换言之,细菌污染阈值修改成使得对于包含至少5mm抗微生物化合物的水解产物而言所述乳酸杆菌的添加未在至少21天期间导致所述水解产物的感染。这在下文实施例4中进一步举例说明。
[0089]
根据第三方面,提供通过如前文中所描述的方法形成的水解产物用于在储存和/或发酵成目标化学品期间降低和/或控制微生物污染的用途。替代地,提供根据本发明的第二方面的水解产物的用途。
[0090]
如本文中所使用的,“降低和/或控制微生物污染”意指贯穿储存和发酵期,将不期望的微生物污染物保持在最低或降低的水平下。从而,防止在储存和发酵期间通常发生的细菌感染。因而,微生物的控制是通过细菌污染物水平和抗微生物化合物的量实现的,如参考本发明的第二方面所描述的。
[0091]
储存水解产物的技术效果例如在下文实施例2和4中给出。从这些实施例明显的是,与对比样品相比,根据本发明的水解产物的储存不导致糖水平(在实施例4中作为葡萄糖浓度测量的)的任何(显著)降低。
[0092]
根据第四方面,提供用于在单独的水解和发酵(shf)工艺中降低和/或控制微生物污染的方法,所述方法包含:
[0093]-提供根据上文第二方面的或者通过上文第一方面的方法形成的储存稳定的水解
产物,
[0094]-使所述储存稳定的水解产物进行发酵。
[0095]
所述水解产物的发酵可通过发酵生物体;即能够将糖类发酵为目标化学品的生物体而进行。所述发酵生物体可为至少一种真核或原核微生物体,诸如细菌和/或酵母。能够将糖类发酵为其它化学化合物的细菌和酵母的实例是技术人员已知的。来自大肠杆菌(escherichia)、乳酸杆菌(lactobacillus)、和链霉菌(streptomyces)的细菌可用于发酵。来自酵母菌(saccharomyce)、毕赤酵母(pichia)和假丝酵母(candida)的酵母可用作发酵生物体。所述发酵生物体可例如为野生型、突变型或重组酿酒酵母(saccharomyces cerevisiae)。使用酿酒酵母用于通过发酵产生目标化学品是有利的,因为酿酒酵母在工业发酵方面是公认的并且提供高产物产率。
[0096]
同样,微生物污染的控制是通过细菌污染物水平和抗微生物化合物的量实现的,如参考本发明的第二方面所释。所述方法可进一步包含在使储存稳定的水解产物进行发酵之前储存所述储存稳定的水解产物的步骤。储存时间可例如为至少1天、或至少7天、或至少172h、或至少340h、或至少21天、或至少510h。由下文实施例2和4,改进发酵的技术效果是显然的。由所述实施例,明确的是,与参比样品相比,根据本发明的水解产物的储存不导致糖水平(在实施例4中作为葡萄糖浓度测量,并且在实施例2中作为低浓度的乳酸测量)的任何(显著)降低。因而,由于在储存后更多糖是可用的,所以发酵得到改进。
[0097]
优选地,所述发酵是间歇进料的或连续的发酵。
[0098]
换言之,所述发酵是半连续或连续的。因为在发酵期间水解产物物流是以(半)连续方式添加的,所以十分重要的是,保证所述水解产物物流中的感染控制。将被感染的水解产物连续引入可显著损害发酵。
[0099]
例如,可使用如下的间歇进料的发酵工艺:其分别包含至少一个间歇阶段、进料阶段、和结束阶段,并且在至少一个进料阶段期间使发酵培养基连续添加。
[0100]
在实施方式中,所述shf工艺包含在自动化或半自动化的发酵工艺中控制微生物发酵的步骤。
[0101]
换言之,所述发酵工艺可包含如下步骤:
[0102]-向发酵器皿连续或半连续添加如前文中所描述的储存稳定的水解产物
[0103]-向所述发酵器皿中提供初始的活性发酵微生物体菌群;
[0104]-在线测量残留糖指标参数rsi,该参数直接或间接指示在发酵期间发酵器皿中的残留糖浓度;
[0105]-基于测量的残留糖指标参数的变化率而测定rsi设定点,使得所述rsi设定点对应于最大变化率;以及
[0106]-响应于测量的残留糖指标参数rsi和rsi设定点,以预定方式自动修改向发酵器皿添加的糖量,以实现并且维持rsi设定点,由此获得高效的糖至发酵产物的共发酵。
[0107]
所述rsi设定点为目标参数;即对应于期望的或最优的工艺条件的目标值或区间。所述rsi设定点可为固定的和/或可变的。rsi设定点的测定可牵涉计算和/或在发酵工艺期间在线跟踪显出的rsi信号。所述rsi设定点对应于发酵器皿中的稳态条件。
[0108]
在如上文所描述的受控发酵方法中,在发酵中达到有利的稳态条件。所述稳态条件与微生物体的原位繁殖相关联,其使得另外的接种不必要。通过利用根据本公开内容的
储存稳定的水解产物,感染风险显著降低。
[0109]
pct/ep2019/060706公开了用于控制发酵工艺的方法和系统,本文中通过引用将其全部内容并入。
[0110]
通过本公开内容的方法,可以延长的时期储存所述水解产物。
[0111]
在实施方式中,所述方法进一步包含在发酵之前在室温下将所述水解产物储存至少三周、优选地至少五周、诸如至少八周的步骤。
[0112]
这是有利的,并且允许所述shf工艺在水解之后中断。从而,可将所述水解产物除去、储存并且潜在地运输至不同的发酵系统地点。
[0113]
应注意,若所述水解产物是在4℃下储存的,则储存期可显著更长。
[0114]
所述方法可进一步包含在发酵之前收取或浓缩所述水解产物的步骤。取决于将产生的目标化学品和发酵工艺条件,可将水解产物浓缩以增加所述水解产物的最终糖浓度。
[0115]
所述糖浓度可在8至75%、例如20至70、优选地40至70%的范围中,这取决于应用。
[0116]
换言之,所述水解产物的糖含量可为80g/l至750g/l、例如200至700g/l、例如400至700g/l。
[0117]
根据第五方面,提供用于由木质纤维素材料形成储存稳定的水解产物的系统,所述系统包含:
[0118]-预处理单元,用于预处理所述木质纤维素材料以形成经预处理的木质纤维素组合物,其包含液体组分和固体组分;所述固体组分至少包含木质素和纤维素
[0119]-用于从所述经预处理的木质纤维素组合物除去所述液体组分的至少80%、优选地至少90%以形成分离的木质纤维素组分的手段,
[0120]-用于将所述木质纤维素组分用稀释液例如水稀释以形成含水浆料的手段,
[0121]-水解单元,设置成接收所述含水浆料并且使所述含水浆料在至少一种糖化酶的存在下进行水解,以形成水解产物
[0122]-用于向所述水解产物添加抗微生物化合物以形成储存稳定的水解产物的手段,其中所述抗微生物化合物包含至少一个硫氧阴离子。
[0123]
用于从所述经预处理的木质纤维素组合物除去所述液体组分的至少80%、优选地至少90%以形成分离的木质纤维素组分的手段可例如为分离单元。所述分离单元包含以下分离装置的至少一者:筛网、过滤器、螺杆倾析器、离心机。由此,提供配置成从所述经预处理的木质纤维素组合物分离并且除去所述液体组分的装置。所述分离单元可包含洗涤手段,诸如洗涤液体(例如水)的供应器。
[0124]
用于将所述木质纤维素组分用稀释液(例如水)稀释以形成含水浆料的手段可例如为稀释单元。所述稀释单元可包含配置成向所述木质纤维素组分提供稀释液(例如水)的物流的稀释器皿或罐。
[0125]
用于向所述水解产物添加抗微生物化合物以形成储存稳定的水解产物的手段可例如包含抗微生物化合物来源(其包含在容器中)和相应的用于将所述抗微生物化合物从所述抗微生物化合物来源转移至所述系统内的所需位置的转移手段(例如管道等)。
[0126]
在实施方式中,所述系统进一步包含用于分离所述水解产物以将水解期间形成的残留固体组分的至少一部分除去的手段。这样的分离手段优选地设置成与所述水解单元流体连通并且在所述水解单元下游。
[0127]
用于分离所述水解产物以将水解期间形成的残留固体组分的至少一部分除去的手段可被称为第二或二次分离手段(相较于用于从经预处理的木质纤维素组合物除去所述液体组分的至少80%、优选地至少90%以形成分离的木质纤维素组分的手段,可被称为第一或一次分离手段)。所述第二分离手段可例如为第二分离单元。所述第二分离单元包含以下分离装置的至少一者:筛网、过滤器、螺杆倾析器、离心机。
[0128]
水解单元还可配置成通过所述水解单元的入口接收空气物流并且通过所述水解单元的出口排出所述空气物流。
[0129]
由此,使空气流经(flush through)所述水解单元并且与含水浆料混合。这增加了所述水解单元中的酶效率,产生更快和更高效的水解。
[0130]
在实施方式中,本公开内容的系统包含用于控制所述储存稳定的水解产物中抗微生物化合物的量的手段,其包含:
[0131]-用于测量所述储存稳定的水解产物的硫离子含量的手段,以及任选地
[0132]-用于在所述硫离子含量低于参比硫值的情形中添加另外的抗微生物化合物的手段。
[0133]
用于测量所述硫离子含量的手段可为滴定装置、硫探头或硫传感器,其布置成在已经向水解产物添加所述抗微生物化合物之后测量硫含量。用于在所述硫离子含量低于参比硫值的情形中添加另外的抗微生物化合物的手段可例如包括:阀门,其布置且配置成在需要时供应抗微生物化合物(所述阀门优选地被包含在用于向所述水解产物添加抗微生物化合物以形成储存稳定的水解产物的手段中),和控制单元,其配置成测定所述硫离子含量是否低于参比硫值,并且响应于硫离子含量低于所述参比硫值的测定来配置成控制所述阀门以供应抗微生物化合物(优选地从抗微生物化合物来源)。
[0134]
根据第六方面,提供用于在单独的水解和发酵(shf)工艺中降低和/或控制微生物污染的系统,所述系统包括:
[0135]-用于形成如上文所描述的储存稳定的水解产物的系统
[0136]-至少一个发酵器皿,布置成在用于形成储存稳定的水解产物的系统的下游并且与其流体连接。
[0137]
所述发酵器皿可包含用以混合水解产物、即发酵培养基与发酵微生物体的搅动手段。
[0138]
进一步地,所述发酵器皿可包括用于测量残留糖指标参数rsi的手段,残留糖指标参数rsi直接或间接指示发酵器皿中残留糖的浓度。测量手段可包括布置在发酵器皿中或在所述器皿外部的环路中的一个或多个传感器。传感器可例如布置在所述发酵器皿的入口和/或出口中以提供rsi信号。
[0139]
所述rsi可为例如使用光学测量或折射率(ri)测量获得的密度指示物。所述rsi还可由测量和计算二氧化碳(co2)生成而推导出,或者通过直接测量糖浓度获得。
[0140]
所述发酵器皿可进一步包括:用于基于测量的残留糖指标参数的变化率测定和设置rsi设定点使得rsi设定点对应于最大变化率的手段,和控制手段,用于响应于测量的残留糖指标参数rsi和rsi设定点以预定方式自动修改向发酵器皿添加的糖量,以实现和维持rsi设定点,由此获得高效的糖至发酵产物的共发酵。这样的手段可包括与传感器(或其它测量手段)通信连接的适合控制单元,和/或配置成基于控制单元而操作的阀门。
[0141]
响应于测量的残留糖指标参数rsi和rsi设定点,可以预定方式自动修改向发酵器皿添加的糖量,以实现和维持rsi设定点,由此获得高效的糖至发酵产物的共发酵。
[0142]
所述系统可进一步包括用于控制发酵器皿中抗微生物化合物的量的手段,包括:
[0143]-用于测量所述发酵器皿中硫离子含量的手段,以及任选地
[0144]-用于在所述硫离子含量低于参比硫值的情形中添加另外的抗微生物化合物的手段。
[0145]
这样的手段可布置在所述发酵器皿内,用于在发酵期间保证感染控制。可以如下方式布置和配置所述用于控制发酵器皿中抗微生物化合物的量的手段:该方式对应于本发明第五方面的用于控制储存稳定的水解产物中抗微生物化合物的量的手段。
[0146]
在实施方式中,在发酵之前(即对于储存稳定的水解产物)和在发酵期间两者测量硫离子含量。
[0147]
若所述发酵系统还包含借助于测量残留糖指标参数rsi控制微生物发酵的手段,则可与这样的rsi测量同时测量硫含量。
[0148]
若在所述发酵器皿中添加另外的硫氧阴离子,则这亦可对发酵具有正面效果,例如其可增加发酵反应的速率或者发酵反应中产生的目标产物的总量。
[0149]
根据第七方面,提供连二亚硫酸盐或亚硫酸盐用于减少由木质纤维素材料形成的水解产物的微生物污染的用途。
[0150]
如此前所提及的,连二亚硫酸盐(当溶解在水解产物中时)将形成亚硫酸根离子,并且从而具有如添加亚硫酸盐那样相应的抗微生物效果。相应地,包含亚硫酸根或连二亚硫酸根的盐在溶解在水解产物中之后将会(直接地或经由此前所描述的连二亚硫酸盐的溶解)形成亚硫酸根离子。因此,这样的化合物是硫氧阴离子的有利载体,硫氧阴离子被认为是抗微生物效果的主要原因。
附图说明
[0151]
由以下详细描述和附图将容易理解本公开内容的各种方面,包括其具体特征和优势,其中:
[0152]
图1示意性说明了根据本公开内容的单独的水解和发酵(shf)工艺。
[0153]
图2说明了在使用各种浓度的亚硫酸钠解毒的云杉水解产物中乳酸杆菌的生长和乳酸的产生。
[0154]
图3说明了在含有各种浓度的亚硫酸钠的纯的和富糖的水解产物中乳酸杆菌的生长和乳酸的产生。
具体实施方式
[0155]
现将在下文中参考附图更完整地描述本发明。然而,本发明可以多种不同形式具体化,并且不应解释为限于本文中阐述的实施方式;相反,这些实施方式是为了详尽性(深入性)和完整性而提供的,并且向技术人员完全传达本发明范围。
[0156]
图1说明了用于在单独的水解和发酵(shf)工艺中降低和/或控制微生物污染的系统。系统1包括木质纤维素材料在其中预处理的预处理单元2,其例如包含反应器、器皿或容器。本公开内容不限于特定类型的预处理方法,而是可利用任何预处理方法。典型地,在预
处理单元2中,温度为150至230℃,ph为1至3,并且预处理时间可为3分钟至60分钟。预处理单元2包含入口3和出口4。木质纤维素材料5的原料物流通过入口3进入预处理单元2,并且经预处理的木质纤维素组合物6通过出口4排出。经预处理的木质纤维素组合物6包含液体组分和固体组分(其包含木质素和纤维素和/或半纤维素)。
[0157]
系统包含用于从经预处理的木质纤维素组合物6除去至少80%、优选地至少90%的所述液体组分以形成分离的木质纤维素组分8的手段7。如图1中所示,这可通过分离单元7实现,分离单元7设置在预处理单元2下游并且与其流体连通。替代地,其可设置在预处理单元2内部。分离单元7配置成将大部分液体组分与所述固体组分分离。由于分离单元7除去液体组分,其还起脱水单元的功能。分离单元7可包括筛网、过滤器、螺杆倾析器、离心机或者用以将液体组分从经预处理的木质纤维素组合物分离和除去的相似设备。
[0158]
所述液体组分从所述分离装置除去,如液体物流9所示。所述液体组分包含水和在预处理工艺期间形成的副产物。液体物流9可在工艺外部利用,例如用于乙醇发酵。分离的木质纤维素组分8(包含经预处理的木质纤维素组合物的固体组分)从分离单元7排出并且之后被稀释。
[0159]
用于使用稀释液(优选地水)稀释所述木质纤维素组分8以形成含水浆料11的手段10可在单独的稀释器皿或罐中进行,如图1中所示。稀释可例如通过稀释螺杆或者带有稀释液添加的混合器/泵/立管而实现。在分离单元7下游向木质纤维素组分8添加稀释液(例如水)的物流,使得形成含水浆料11。还可想到,向分离单元7添加水物流,使得分离单元7起到既分离“脏”液体组分又将其更换为新鲜水的作用。
[0160]
系统1进一步包括用于水解含水浆料的水解单元12,所述含水浆料已经进行预处理和清洗两者,即分离并且用水稀释。
[0161]
水解单元12包含用于接收含水浆料11的入口13和用于在水解已经完成之后排出水解产物15的出口14。
[0162]
第二分离单元16可设置成接收水解产物15,以除去在水解期间形成的残留固体。如图1中所示,将残留固体组分17从水解产物15除去。
[0163]
系统还包括用于将抗微生物化合物添加到在第二分离单元16中的分离之前的水解产物15、或分离的水解产物物流19的手段18。还可考虑,在水解反应完成时直接向水解单元12添加抗微生物化合物。若需要,还可向发酵器皿23添加抗微生物化合物。图1中的虚线箭头说明工艺中可添加所述抗微生物化合物的点。
[0164]
水解单元12可配置成通过入口21接收空气物流20并且通过水解单元12的出口22排出空气物流20。
[0165]
换言之,在水解单元12内,空气物流20与原料混合。这可通过在水解单元12中同时搅拌原料实现。空气物流20允许存在于系统中的酶变得更高效,产生更快和更高效的水解。
[0166]
空气入口21可与用于接收含水浆料11的入口13相同,并且空气出口22可与用于排出水解产物物流15的出口14相同。替代地,空气入口21设置在水解单元12的底部中,并且空气出口22设置在水解单元12的顶部中,如图1中所示。
[0167]
系统1可连接至发酵器皿23,发酵器皿23设置成与水解单元12流体连通并且在其下游。
[0168]
产物收取单元24(诸如蒸馏装置或离子交换色谱装置)可在发酵器皿下游连接至
系统。
[0169]
系统还可包含用于控制抗微生物化合物的量的手段25。这样的手段25包括用于在已经添加足够量的抗微生物剂之后测量水解产物(15或19)的硫离子含量的手段。测量手段可为设置或插入至工艺中用以在已经向水解产物添加抗微生物化合物之后测量硫含量的硫探头或硫传感器。图1说明工艺中硫离子含量优选地在此时监测的合适位置(见从抗微生物剂控制手段25起的说明性虚线箭头)。在实施方式中,硫离子含量是在管线中测量的;即所述测量是直接在工艺管线中进行的。硫离子含量可在管线中或在线测量。若硫离子含量是在线测量的,则将样品从工艺管线,例如在来自主工艺管线的旁路环路(未显示)中,分流。在发酵器皿23内还可(或替代地)设置用于测量硫离子含量的手段,用以保证高效且无感染的发酵。
[0170]
若发酵器皿23还包含借助于测量残留糖指标参数(rsi)控制微生物发酵的手段,则硫的含量可与这样的参数同时测量。
[0171]
在已经形成储存稳定的水解产物之后,即在向水解产物物流15、或任选地水解产物物流19添加抗微生物剂之后,可将所述水解产物从工艺除去且在一段时间期间储存,之后用于后续的在发酵器皿23中的发酵。
[0172]
虽然图1说明了用于在单独的水解和发酵(shf)工艺中降低和/或控制微生物污染的系统1,但是在用于形成储存稳定的水解产物的系统中使用相同的组件(除发酵器皿23和产物收取单元24之外)。
[0173]
本公开内容的第一方面的术语、定义和实施方式经过必要的修正适用于本公开内容的其它方面,并且反之亦然。
[0174]
实施例1:未分离的木质纤维素水解产物中的细菌污染
[0175]
未解毒的云杉水解产物(添加有2g/l酵母提取物;0,5%磷酸钠;0,5g/l磷酸二铵;2g/l蛋白胨,并且用水稀释至30g/l葡萄糖)过滤灭菌,并且用作原料培养基的代表。使用mrs培养基和与前面实验中所使用的相同的被污染样品制备培菌液,并且在37℃下培育过夜(16小时)。向具有22,5ml的原料培养基的25ml血清瓶分别以0mm、5mm、10mm、20mm、和40mm的浓度添加亚硫酸钠。接种后,将瓶放置在室温下的多磁力搅拌盘上,其中定期取样并使用hplc分析。
[0176]
所使用的水解产物可代表预处理液体和固体组分的分离在其中尚未发生的原料物流。换言之,水解和发酵抑制剂仍存在于所述原料物流中。
[0177]
如图2中所示,将亚硫酸钠以5至40mm的量添加对所述水解产物不具有抗微生物效果。反而,所添加的亚硫酸盐对仍存在于所述水解产物中的发酵抑制剂起到解毒剂的作用。结果是当添加亚硫酸钠时细菌生长增加。
[0178]
实施例2:控制富糖水解产物中的细菌污染
[0179]
此试验的目的是测试亚硫酸钠的控制含有用于发酵之前的富糖水解产物物流的储罐中的细菌污染的潜力。所述水解产物代表根据本公开内容的水解产物。
[0180]
为了测试理论,制作了合成培养基,其含有约90g/l葡萄糖、0,5%磷酸钠/磷酸缓冲液(ph 5,5)、0,5g/l磷酸二铵、2g/l酵母提取物和2g/l蛋白胨。将此溶液(45ml)与磁力搅拌棒一起添加至50ml血清瓶,并且热压处理,之后以5、10、20和40mm的浓度添加亚硫酸钠,同时一些瓶不添加亚硫酸盐,其作为对照(0mm)。在锥形烧瓶(爱伦美氏烧瓶)中,使用先前
从位于sekab的污染的发酵(先前证明包括乳酸细菌)收集的样品接种150ml mrs培养基。此培养物在37℃下培育36小时,并且用于接种所有血清瓶(10%v/v)。随后,将血清瓶使用气密隔膜和金属环夹具密封,并且两根针穿过隔膜插入,以允许取样。在室温下将所述血清瓶置于磁力搅拌盘上(因为储罐典型地保持在室温下),伴随在100rpm的搅拌。定期取样,并且使用hplc对葡萄糖和乳酸分析。实验以三次进行。实验持续11天。
[0181]
在实验中发生的唯一生长在对照瓶中,这基于在任意其它瓶中均未指示生长或浊度的视觉评估以及使用hplc分析获得的乳酸数据两者。这似乎支持如下理论:亚硫酸钠抑制乳酸细菌在这些条件下的生长。如图3中所示,亚硫酸钠在所有的测试浓度(5、10、20、和40mm)下均抑制乳酸细菌的生长(乳酸浓度为0g/l)。
[0182]
实施例3:控制含10%未解毒的云杉水解产物的富糖水解产物中的细菌污染
[0183]
此实施例中的实验是根据实施例2中的描述进行的,不同之处在于:富糖水解产物含有10%(v/v)未解毒的云杉水解产物。这样做是为了模拟一些抑制性杂质存在的富糖水解产物,所述杂质可由于分离和/或洗涤不充分引起。
[0184]
在“实验a”样品中,将血清瓶在时刻0小时用乳酸杆菌接种且在室温下培育21天。定期取样,并且使用hplc对葡萄糖和乳酸进行分析(此处未显示)。
[0185]
在“实验b”样品中,将血清瓶接种两次——第一次在第一天时,且两周后再次进行,以模拟再感染和测试亚硫酸钠的抑制性效果的寿命。
[0186]
在实验“c”中,将第三组血清瓶在室温下储存两周之后接种,并且使用乳酸杆菌接种(在14天之后)。
[0187]
表1说明实验a-c在不同时刻的葡萄糖消耗。
[0188]
表1:在不同时刻的葡萄糖浓度
[0189][0190]
对于除含有40mm亚硫酸钠的样品之外的所有样品在所有三实验中都观察到生长,这通过在这些样品中的葡萄糖消耗指示(见表1)。
[0191]
与实施例1相似,在含有5-20mm亚硫酸钠的样品中观察到解毒效果,所述样品比未添加亚硫酸盐的样品(0mm)生长得快。因而,与实施例1(其中亚硫酸钠的添加导致解毒效果并且促进乳酸杆菌的生长)相反,在此实施例中40mm的亚硫酸钠水平反而引入抗微生物效果。尽管10%(v/v)的含木质纤维素水解产物的杂质可视为中等至低水平的杂质,但此实施例明确表明以最少的抑制性化合物产生富糖水解产物的重要性。这样的化合物的存在导致亚硫酸钠和抑制性化合物之间的反应,致使水解产物解毒并且促进细菌生长而不是引入抗微生物效果。为取代由亚硫酸钠的添加(甚至以中等水平的杂质)导致的解毒效果在此实验中需要比实施例2和4中的5mm高的亚硫酸钠量,即40mm。
[0192]
实施例4:富糖水解产物的储存
[0193]
富糖水解产物在添加5-40mm的情况下的储存是根据实施例2的描述进行的。在此实施例中,样品如同在实施例2中那样制备和操作。换言之,在此实施例中,“实验a”样品与实施例2的样品相同,并且它们用作“实验b”和“实验c”的参比以及用于验证实施例2的结果。
[0194]
将“实验b”样品用乳酸杆菌在时刻0小时接种,并且在336小时之后再次接种。这样做是为了测试暴露于不止一次乳酸杆菌培养物的样品(即在两周之后被再感染的样品)的耐感染性。
[0195]“实验c”中的样品在环境室温下储存2周,之后在336小时后向烧瓶添加乳酸杆菌。将样品培育另外7天,如与其它两个实验一样总共21天。表2说明了在整个储存期中各时刻的葡萄糖水平。
[0196]
表2:不同时刻的葡萄糖浓度
[0197][0198]“实验a”的结果验证在实施例2中观察到的效果;即细菌生长在不存在亚硫酸钠的情况下发生。添加有亚硫酸钠的烧瓶在三周期间未显示葡萄糖消耗,指示细菌不能生长,并且因此没有糖消耗是显然的。
[0199]“实验b”的结果与“实验a”的相同,但是允许证明添加亚硫酸钠的二次效果;即第二次添加乳酸杆菌达成的第一次添加乳酸杆菌并未显著降低的亚硫酸钠在5mm以上的任何浓度下的效果。对于含有5mm或更多亚硫酸钠的实验而言,在21天期间观察不到细菌生长的迹象。
[0200]
来自“实验c”的结果证明,含有浓度在5mm以上的亚硫酸钠的富糖水解产物在室温下储存14天未减少亚硫酸钠的抗微生物效果。如表2中所见,与未添加亚硫酸钠的参比相比,在这些样品中观察不到生长。因此,亚硫酸钠在所有的测试浓度(5、10、20、和40mm)下在三周的培育期间抑制乳酸杆菌的生长,而不含亚硫酸盐的样品允许细菌生长(见表2)。这些结果指明,(与例如实施例3相比),当可与亚硫酸钠反应的化合物不存在(或该化合物基本上不存在)时,通过添加5-40mm亚硫酸钠可实现至少三周的储存。这样的化合物的存在反而导致解毒效果,如在实施例1和实施例3中证明。
[0201]
尽管本公开内容已经参考其具体举例说明的实施方式予以描述,但是对本领域技术人员而言,很多不同改变、改动等也将变得明晰。
[0202]
通过研究附图、公开内容和所附权利要求,实践此公开内容的技术人员可理解并且实现对所公开实施方式的改变。进一步,在权利要求中,词“包含”不排除其它要素或步骤,并且不定冠词“一个(a)”、“一个(an)”不排除多个(plurality)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
