1.本发明涉及一种基于双组分体系的有机长余辉发光材料、制备及应用。
背景技术:
2.近期,在发光材料领域出现了一类有机长余辉发光材料(adv.funct.mater.2013,23,3386;nat.mater.2015,14,685;j.phys.chem.c 2010,114,6090),展现出优异性能。该材料发光寿命可超过0.1秒,在生物光学成像中可避开背景荧光干扰,有助于获得高衬度图像(nat.commun.2020,11,842;j.am.chem.soc.2019,141,5045;adv.mater.2017,29,1606665);对氧气敏感,可用于探测微环境中溶解氧浓度(nat.mater.2009,8,747;angew.chem.int.ed.2017,56,16207);余辉发光肉眼可辨别,可用于高级防伪标识(chem 2016,1,592;angew.chem.int.ed.2016,55,15589)。
3.目前报道的大部分有机长余辉发光性能来源于室温磷光分子体系(j.am.chem.soc.2007,129,8942;nat.commun.2018,9,2963;nat.chem.2011,3,205)。磷光是三线态激发态返回基态时发出的光,在普通有机分子体系中,三线态激发态不易形成且极易发生非辐射失活,室温下高效磷光发射的有机体系很少。为了提高磷光量子产率,需要在普通有机分子体系中引入重原子取代基,促进三线态激发态返回基态的磷光发射效率,而引入重原子取代基通常导致发光寿命的大幅下降(adv.mater.2015,27,6195;angew.chem.int.ed.2015,54,6270;adv.mater.2017,29,1701244;adv.mater.2017,29,1606829;angew.chem.int.ed.2019,58,14140;adv.funct.mater.2019,29,1807243;angew.chem.int.ed.2016,55,9872;angew.chem.int.ed.2018,57,16407;angew.chem.int.ed.2018,57,6449;j.am.chem.soc.2017,139,785;angew.chem.int.ed.2018,57,10854)。对于有机长余辉的单组分体系而言,难以兼顾磷光量子产率与磷光寿命(j.am.chem.soc.2019,141,1010)。
4.专利cn 106833622 a,申请号201710016832.6中的余辉材料为基于酰基咔唑的单组分体系,该发明中采用两亲性聚合物帮助酰基咔唑余辉材料实现水中分散,聚合物组分的加入并不是余辉产生的原因,聚合物组分主要是维材料提供水中分散性,因此,该专利中的材料不属于双组分体系室温余辉材料。专利cn 108117541 a,申请号201711182326.0,以及专利cn107987061 a,申请号201711183652.3中的基于三嗪结构的室温余辉材料也属于单组分室温余辉体系。专利cn 110272378 a,申请号201910614730.3和专利cn 110724087 a,申请号201910937050.5均为单组分室温余辉体系。专利cn 111574562 a,申请号202010509751.1中的三苯基氧化膦衍生物也属于单组分室温余辉体系。
5.专利cn 103694994 a,申请号201410012241.8中的纯有机长余辉复合材料主要成分为碳纳米点,碳纳米点的化学结构难以表征清楚,这区别于化学结构明确的有机室温余辉体系,另外,该专利中加入的第二组分为水溶性高分子聚乙烯醇,该组分提供水中分散性,碳纳米点本身具有室温余辉性能,聚乙烯醇对于余辉性能的产生并无贡献。严格讲,该专利中的余辉材料不属于双组分余辉体系,本专利中的双组分余辉体系指的是发光分子本
身只具有高的发光量子产率而不具有室温余辉性能,但与基体分子以适当条件混合后,在基体的协同帮助下,发光分子-基体分子展现出室温余辉性能。专利cn 110092716 a,申请号201811277988.0中也使用聚乙烯醇作为分散基体,芘甲酸磷光分子作为发光物,该专利获得了多种颜色的磷光发射,但未对磷光量子产率进行测定。
6.adachi课题组和唐本忠课题组通过双组分体系获得了余辉长度达到小时级别的发光体系。区别于单组分体系,在双组分体系中,组成材料的两种有机分子间不存在共价键。然而,到目前为止,双组分长余辉体系的发光量子产率较低,在空气中的发光量子产率难以突破15%(nature 2007,550,384;adv.mater.2020,32,2001026;j.phys.chem.lett.2019,10,6019)。双组分给体-受体的有机长余辉体系要求给体和受体的前线分子轨道匹配,给体的homo和lumo能级均需高于受体。与混合前给体和受体的紫外吸收和发光光谱相比,余辉混合物的紫外吸收和发光光谱红移,这是分子间发生给体-受体作用的光物理特征。双组分给体-受体的余辉机理相对比较清楚,余辉混合物吸收激发光之后,给体和受体之间发生电荷分离,在固态下各自形成自由基阳离子和自由基阴离子,由于固体介质中扩散受阻的关系,自由基阳离子和自由基阴离子的电荷重组速率发生数量级的下降,电荷重组时的发光就展现出延迟现象,有时长达小时级别。由于这类体系存在非常活泼的自由基阳离子和自由基阴离子中间体,受体-给体体系余辉性能受氧气和湿气的影响非常大。在空气中的发光量子产率较低。另外,由于给体-受体homo和lumo设计上的要求,目前双组分有机长余辉体系的发光颜色可调性较低,未见具有可见区全谱调节能力的余辉体系报道。
7.主体-客体的双组分余辉体系也有研究报道,其中客体分子发光,主体分子为刚性基体,主体和客体间不存在共价键,客体分子在单组分的分子溶液和固态均无余辉,与主体分子以合适方式混合后展现出余辉性能。adachi等报道了以刚性胆固醇为基体,有机发光分子为掺杂物的双组分余辉体系,发光量子产率低于15%,有一例橙色余辉体系的报道(adv.funct.mater.2013,23,3386),未见红色余辉体系的报道。专利cn 111534298 a,申请号202010378621.x中采用苯基吩噻嗪作为客体分子,掺杂到各种有机分子基体中,苯基吩噻嗪单一组分无室温余辉性能,掺杂后的混合物具有室温余辉性能,该专利属于双组分余辉体系,但该体系没有发光量子产率的测试。专利cn 110079301 a,申请号201811340131.9咔唑和二苯基膦酸酐的双组分室温余辉体系没有发光量子产率的测试。目前,在主体-客体余辉体系中,余辉机理被描述为:刚性基体抑制客体分子三线态激发态非辐射失活,使分子三线态激发态返回基态发出磷光,由于纯有机分子体系的磷光发射速率常数低,磷光寿命与磷光发射速率常数成反比,可达秒级。然而,并没有理性的选择主体分子和客体分子的系统方法,新型高效的室温余辉体系的发现主要基于不断尝试和广泛筛选,这是该研究领域的现状。
8.目前,绝大部分双组分余辉体系的发光量子产率低于15%。双组分余辉体系的发光颜色种类较少,很少有红色波长余辉材料的报道。
技术实现要素:
9.本发明所要解决的技术问题是室温双组分有机长余辉体系的发光量子产率较低;颜色可调性较低,为此,本发明提供一种基于双组分有机长余辉发光材料、制备及应用,本
发明所提供的基于双组分体系的有机长余辉发光材料相较于室温余辉材料具有较高的量子产率,发光颜色具有种类多样的特点。
10.本发明提供了一种有机长余辉发光材料,其包括基体分子和发光分子,所述的基体分子为被一个或多个r取代的苯基或其盐、三苯基氧膦或
11.其中,n为1、2、3、4、5或6;
12.r独立地为-cooh;
13.r1独立地为c1~c4烷基、苯基或
14.r2、r3、r4、r5、r6独立地为h、氰基、卤素、c1~c4烷氧基或被r’取代的c1~c4烷氧基;
15.或者,任选地,r1与r2连接在一起,与相连的基团一起形成一个4~7元环烷烃;
16.r7独立地为卤素;
17.r’选自被一个或多个x取代的苯基;
18.x为卤素。
19.在某一方案中,当基体分子为时,所述的为辛二酸、丙二酸、丁二酸或戊二酸。
20.在某一方案中,当基体分子为被一个或多个r取代的苯基或其盐时,所述的盐为钠盐、钾盐,例如钠盐。
21.在某一方案中,当基体分子为被一个或多个r取代的苯基或其盐时,所述的基体分子为对苯二甲酸二钠、对苯二甲酸二钾、苯甲酸钠、苯甲酸钾、均三苯甲酸三钠、均三苯甲酸三钾、均三苯甲酸、对苯二甲酸或苯甲酸,例如,对苯二甲酸二钠、均三苯甲酸或对苯二甲酸。
22.在某一方案中,当r1独立地为c1~c4烷基时,所述的c1~c4烷基为甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基或叔丁基,例如甲基。
23.在某一方案中,当所述的r1与r2可连接在一起形成一个4~7元环烷烃时,所述的4~7元环烷烃为环丁烷、环庚烷、环戊烷或环己烷,例如环戊烷或环己烷。
24.在某一方案中,当所述的r2、r3、r4、r5、r6为卤素时,所述的卤素可为f、cl、br或i,例如cl。
25.在某一方案中,当所述的r2、r3、r4、r5、r6为c1~c4烷氧基或被r’取代的c1~c4烷氧基时,所述的c1~c4烷氧基和被r’取代的c1~c4烷氧基里的c1~c4烷氧基可为甲氧基、乙氧基、丙氧基或丁氧基,例如甲氧基、乙氧基、正丙氧基。
26.在某一方案中,所述的r7选自f、cl、br或i,例如br。
27.在某一方案中,所述的x选自f、cl、br或i,例如cl或br。
28.在某一方案中,当所述的r’选自被一个或多个x取代的苯基时,所述的r’可为例如
29.在某一方案中,当r2、r3、r4、r5、r6为r’取代的c1~c4烷氧基时,所述的r2、r3、r4、r5、r6可为例如
30.在某一方案中,当基体分子为时,所述的基体分子为(苯甲酸苯酯)、(7-甲氧基-1-萘满酮)、(二苯甲酮)、(6-氰基-1-茚酮)、(7-[(2-溴-5-氯苯基)甲氧基]-3,4-二氢-1(2h)-萘酮)、(对甲氧基苯乙酮)或(4-氯代二苯甲酮)。
[0031]
在某一方案中,所述的发光分子为二氟硼类发光分子、罗丹明类发光分子、苯并异戊唑类发光分子、二氢蒽-9,10-二酮类发光分子或苯并噻二唑类发光分子。
[0032]
在某一方案中,当所述的发光分子为二氟硼类发光分子时,所述的发光分子为(bodipy)、(czbf2)、(tolbf2)、
(netcz-2b)、(二苯醚二氟化硼)、(p-ibf2)、(netcz-1b)、(产物831)或(产物923)。
[0033]
在某一方案中,当所述的发光分子为罗丹明类发光分子时,所述的发光分子可为(荧光素)或(罗丹明b)。
[0034]
在某一方案中,当所述的发光分子为苯并异戊唑类发光分子时,所述的发光分子可为(3,3'-二乙基氧杂羰花青碘)。
[0035]
在某一方案中,当所述的发光分子为二氢蒽-9,10-二酮类发光分子时,所述的发光分子可为(2-溴-13,13-二甲基-6h-茚并[1,2-b]蒽-6,11(13h)-二酮)。
[0036]
在某一方案中,当所述的发光分子为苯并噻二唑类发光分子,所述的发光分子可
为(4,7-双(5-溴-2-噻吩基)-2,1,3-苯并噻二唑)。
[0037]
在某一方案中,当所述的基体分子为时,所述的发光分子为二氟硼类发光分子。
[0038]
在某一方案中,当所述的基体分子为被一个或多个r取代的苯基或其盐时,所述的发光分子为二氟硼类发光分子、罗丹明类发光分子、苯并异戊唑类发光分子、二氢蒽-9,10-二酮类发光分子或苯并噻二唑类发光分子。
[0039]
在某一方案中,当所述的基体分子为三苯基氧磷时,所述的发光分子为二氟硼类发光分子。
[0040]
在某一方案中,当所述的基体分子为时,所述的发光分子为二氟硼类发光分子。
[0041]
在某一方案中,所述的基体分子和所述的发光分子为下述方案:
[0042]
方案一:当所述的基体分子为时,所述的发光分子为tolbf2。
[0043]
方案二:当所述的基体分子为被一个或多个r取代的苯基或其盐时,所述的发光分子为荧光素、4,7-双(5-溴-2-噻吩基)-2,1,3-苯并噻二唑、2-溴-13,13-二甲基-6h-茚并[1,2-b]蒽-6,11(13h)-二酮、3,3'-二乙基氧杂羰花青碘、产物831、二苯醚二氟化硼、罗丹明b和bodipy中的一种。
[0044]
方案三:当所述的基体分子为三苯基氧磷时,所述的发光分子为二苯醚二氟化硼或p-ibf2。
[0045]
方案四:当所述的基体分子为时,所述的发光分子为czbf2、产物831、产物923或netcz-2b。
[0046]
在某一方案中,所述的有机长余辉发光材料中,所述基体分子和所述的发光分子分别为如下所示的1-27的组:
[0047]
[0048][0049]
在本发明某些优选实施方案中,所述的基体分子和所述的发光分子的质量比为1:99~100000,例如1:99,1:999,1:1000,1:5000,1:10000,5:95,10:90、1:100000或1:1000000。
[0050]
在本发明某些优选实施方案中,所述的有机长余辉发光材料中,所述基体分子和所述的发光分子分别为如下所示的1-27组:
[0051][0052]
[0053]
在本发明某些优选实施方案中,所述的有机长余辉发光材料激发波波长为200nm~1000nm;优选365nm。
[0054]
在本发明的某些优选实施方案中,所述的有机长余辉发光材料由如下制备方法制备得到:将所述的基体分子、所述的发光分子与有机溶剂混合,挥发干燥即可。
[0055]
在本发明的某些优选实施方案中,所述的有机溶剂包括卤代烃类溶剂和/或醇类溶剂;例如二氯甲烷和/或乙醇。
[0056]
在本发明的某些优选实施方案中,所述的干燥的条件可为自然挥发、真空干燥和红外烘烧中的一种或多种。
[0057]
在本发明的某些优选实施方案中,所述的混合的方法可为研磨。
[0058]
在本发明的某些优选实施方案中,所述的混合的温度为15~30℃。
[0059]
在本发明的某些优选实施方案中,所述的有机长余辉发光材料的粒径在1μm~100μm范围内,例如10μm。
[0060]
在本发明的某些优选实施方案中,所述的有机长余辉发光材料由所述的基体分子、所述的发光分子组成。
[0061]
在本发明的某些优选实施方案中,所述的有机长余辉发光材料采用紫外灯照射。
[0062]
本发明还提供了一种有机长余辉发光材料的制备方法,包括如下步骤:
[0063]
将所述的基体分子与所述的发光分子和所述的有机溶剂混合,挥发干燥,得到有机长余辉发光材料;
[0064]
其中,所述基体分子、所述发光分子、所述有机溶剂定义如上所述;
[0065]
所述制备方法的的条件和步骤如上所述。
[0066]
本发明提供了一种化合物作为有机长余辉发光发光材料的基体分子的应用,所述的基体分子如上所述;所述的有机长余辉发光材料还包括发光分子,所述的发光分子如上所述。
[0067]
本发明提供了一种如上所述的有机长余辉发光发光材料在用于生物光学成像和光学传感检测中的应用。
[0068]
在本发明的某一方案中,所述的有机长余辉发光发光材料可为czbf2与7-甲氧基-1-萘满酮的双组分长余辉发光材料;又例如czbf2与7-甲氧基-1-萘满酮的质量比为1:99。
[0069]
本发明所用试剂和原料均市售可得。
[0070]
本发明的积极进步效果在于:(1)本发明所提供的基于双组分体系的有机长余辉发光材料具有较高的量子产率,发光量子产率可超过15%,部分体系超过30%;(2)发光颜色可调性好,具有可见区全谱调节能力;余辉颜色为蓝色,绿色,黄绿,黄色,橙色,红色等。
附图说明
[0071]
图1为实施例1中,室温下,365nm紫外光连续照射下,荧光素和对苯二甲酸混合物的数码照片。
[0072]
图2为实施例1中,为室温下,365nm紫外光关闭0.2秒后所拍摄的荧光素和对苯二甲酸混合物的数码照片。
[0073]
图3为实施例1中,为室温下,荧光素和对苯二甲酸混合物的稳态发光光谱。
[0074]
图4为实施例2中,室温下,365nm紫外光连续照射下,bodipy和对苯二甲酸混合物
的数码照片。
[0075]
图5为实施例2中,为室温下,365nm紫外光关闭0.5秒后所拍摄的bodipy和对苯二甲酸混合物的数码照片。
[0076]
图6为实施例2中,为室温下,bodipy和对苯二甲酸混合物的稳态发光光谱。
[0077]
图7为实施例3中,为室温下,365nm紫外光连续照射下,罗丹明b和对苯二甲酸混合物的数码照片。
[0078]
图8为实施例3中,为室温下,365nm紫外光关闭1秒后所拍摄的罗丹明b和对苯二甲酸混合物的数码照片。
[0079]
图9为实施例3中,为室温下,罗丹明b和对苯二甲酸混合物的稳态发光光谱。
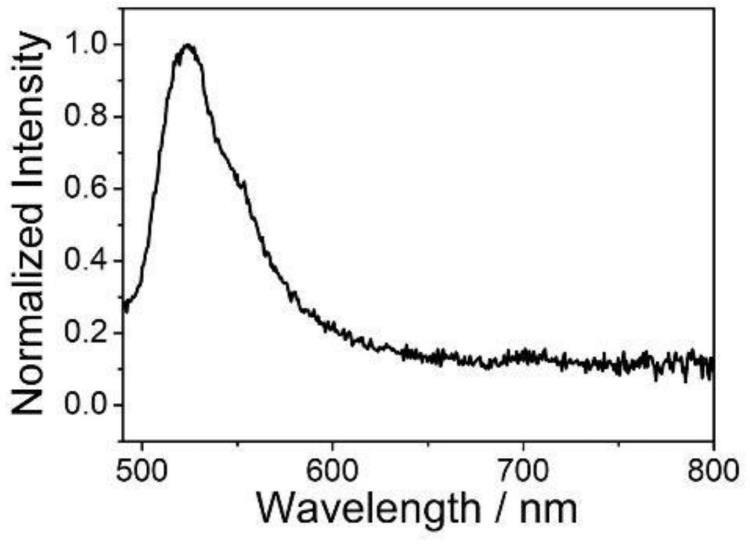
[0080]
图10为实施例4中,为室温下,365nm紫外光连续照射下,罗丹明b与均三苯甲酸混合物的数码照片。
[0081]
图11为实施例4中,为室温下,365nm紫外光关闭0.5秒后所拍摄的罗丹明b与均三苯甲酸混合物的数码照片。
[0082]
图12为实施例5中,为室温下,czbf2与7-甲氧基-1-萘满酮双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后不同时间黄绿色余辉持续的系列数码照片。
[0083]
图13为实施例5中,为室温下,czbf2和7-甲氧基-1-萘满酮混合物的稳态发光光谱。
[0084]
图14为实施例5中,为czbf2和7-甲氧基-1-萘满酮混合物的发光衰减曲线。
[0085]
图15为实施例5中,为室温下,365nm紫外灯下,czbf2和7-甲氧基-1-萘满酮混合物在pluronic f-127中的水分散液的数码照片。
[0086]
图16为实施例5中,为室温下,365nm紫外灯关闭0.5秒后,czbf2和7-甲氧基-1-萘满酮混合物在pluronic f-127中的水分散液的数码照片。
[0087]
图17为实施例5中,为室温下,365nm紫外光连续照射下(a)和紫外灯关闭0.5s后(b)czbf2与7-甲氧基-1-萘满酮的质量比为5:95的混合物的数码照片。
[0088]
图18为实施例5中,为为室温下,365nm紫外光连续照射下(a)和紫外灯关闭0.5s后(b)czbf2与7-甲氧基-1-萘满酮的质量比为10:90的混合物的数码照片。
[0089]
图19为实施例6中,为室温下,365nm紫外光连续照射下,czbf2和7-[(2-溴-5-氯苯基)甲氧基]-3,4-二氢-1(2h)-萘酮混合物的数码照片。
[0090]
图20为实施例6中,为室温下,365nm紫外光关闭1秒后所拍摄的czbf2和7-[(2-溴-5-氯苯基)甲氧基]-3,4-二氢-1(2h)-萘酮混合物的数码照片。
[0091]
图21为实施例7中,为室温下,365nm紫外光连续照射下,netcz-1b与对甲氧基苯乙酮混合物的数码照片。
[0092]
图22为实施例7中,为室温下,365nm紫外光关闭0.5秒后所拍摄的netcz-1b与对甲氧基苯乙酮混合物的数码照片。
[0093]
图23为实施例8中,为室温下,365nm紫外光连续照射下,netcz-1b与4-氯代二苯甲酮混合物的数码照片。
[0094]
图24为实施例8中,为室温下,365nm紫外光关闭1秒后所拍摄的netcz-1b与4-氯代二苯甲酮混合物的数码照片。
[0095]
图25为实施例9中,为室温下,365nm紫外光连续照射下,netcz-2b与对甲氧基苯乙
酮混合物的数码照片。
[0096]
图26为实施例9中,为室温下,365nm紫外光关闭0.5秒后所拍摄的netcz-2b与对甲氧基苯乙酮混合物的数码照片。
[0097]
图27为实施例10中,为室温下,365nm紫外光连续照射下,netcz-2b与4-氯代二苯甲酮混合物的数码照片。
[0098]
图28为实施例10中,为室温下,365nm紫外光关闭1秒后所拍摄的netcz-2b与4-氯代二苯甲酮混合物的数码照片。
[0099]
图29为实施例11中,为室温下,365nm紫外光连续照射下,4,7-双(5-溴-2-噻吩基)-2,1,3-苯并噻二唑和对苯二甲酸混合物的数码照片。
[0100]
图30为实施例11中,为室温下,365nm紫外光关闭0.2秒后所拍摄的4,7-双(5-溴-2-噻吩基)-2,1,3-苯并噻二唑和对苯二甲酸混合物的数码照片。
[0101]
图31为实施例12中,为室温下,365nm紫外光连续照射下,2-溴-13,13-二甲基-6h-茚并[1,2-b]蒽-6,11(13h)-二酮和对苯二甲酸混合物的数码照片。
[0102]
图32为实施例12中,为室温下,365nm紫外光关闭2秒后所拍摄的2-溴-13,13-二甲基-6h-茚并[1,2-b]蒽-6,11(13h)-二酮和对苯二甲酸混合物的数码照片。
[0103]
图33为实施例13中,为室温下,365nm紫外光连续照射下,荧光素和对苯二甲酸二钠混合物的数码照片。
[0104]
图34为实施例13中,为室温下,365nm紫外光关闭0.5秒后所拍摄的荧光素和对苯二甲酸二钠混合物的数码照片。
[0105]
图35为实施例14中,为室温下,365nm紫外光连续照射下,bodipy和对苯二甲酸混合物的数码照片。
[0106]
图36为实施例14中,为室温下,365nm紫外光关闭0.5秒后所拍摄的bodipy和对苯二甲酸混合物的数码照片。
[0107]
图37为实施例15中,为室温下,365nm紫外光连续照射下(a)和紫外灯关闭1s后(b)bodipy与对苯二甲酸的质量比为1:1000000的混合物的数码照片。
[0108]
图38为实施例16中,为室温下,365nm紫外光连续照射下,bodipy和均三苯甲酸混合物的数码照片。
[0109]
图39为实施例16中,为室温下,365nm紫外光关闭0.5秒后所拍摄的bodipy和均三苯甲酸混合物的数码照片。
[0110]
图40为实施例17中,为室温下,365nm紫外光连续照射下,tolbf2和丙二酸混合物的数码照片。
[0111]
图41为实施例17中,为室温下,365nm紫外光关闭1秒后所拍摄的tolbf2和丙二酸混合物的数码照片。
[0112]
图42为实施例18中,为室温下,365nm紫外光连续照射下,tolbf2和丁二酸混合物的数码照片。
[0113]
图43为实施例18中,为室温下,365nm紫外光关闭0.5秒后所拍摄的tolbf2和丁二酸混合物的数码照片。
[0114]
图44为实施例19中,为室温下,365nm紫外光连续照射下,tolbf2和戊二酸混合物的数码照片。
[0115]
图45为实施例19中,为室温下,365nm紫外光关闭0.5秒后所拍摄的tolbf2和戊二酸混合物的数码照片。
[0116]
图46为实施例20中,为室温下,365nm紫外光连续照射下,tolbf2和辛二酸混合物的数码照片。
[0117]
图47为实施例20中,为室温下,365nm紫外光关闭1秒后所拍摄的tolbf2和辛二酸混合物的数码照片。
[0118]
图48为实施例21中,为室温下,831与二苯甲酮双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后黄绿色余辉持续的系列数码照片。
[0119]
图49为实施例22中,为室温下,831与6-氰基-1-茚酮双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后黄绿色余辉持续的系列数码照片。
[0120]
图50为实施例23中,为室温下,831与苯甲酸苯酯双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后黄绿色余辉持续的系列数码照片。
[0121]
图51为实施例24中,为室温下,3,3'-二乙基氧杂羰花青碘与对苯二甲酸双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后黄绿色余辉持续的系列数码照片。
[0122]
图52为实施例25中,为室温下,二苯醚二氟化硼与三苯基氧膦双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后绿色余辉持续的系列数码照片。
[0123]
图53为实施例26中,为室温下,二苯醚二氟化硼与苯甲酸苯酯双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后绿色余辉持续的系列数码照片。
[0124]
图54为实施例27中,为室温下,p-ibf2与三苯基氧膦双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后绿色余辉持续的系列数码照片。
[0125]
图55为实施例28中,为室温下,923与二苯甲酮双组分余辉材料在365nm紫外灯下的数码照片以及紫外灯关闭后黄色余辉持续的系列数码照片。
[0126]
图56为实施例29中,本发明中部分化合物的homo和lumo数据。
具体实施方式
[0127]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0128]
本发明中,样品的核磁共振氢谱、碳谱、氟谱和硼谱在jeol公司的400mhz核磁共振波谱仪采集。样品发光的数码照片和视频在365nm led电筒(功率为5w)下用数码相机采集,样品经365nm led电筒辐照5s,样品距led电筒约10cm,继续增加辐照时间对样品余辉性能无明显影响。质谱分析在安捷伦科技5973n和赛默飞世尔科技ltq-ft-ultras质谱仪上进行。ft-ir光谱在nicolet avatar-360ft-ir分光光度计上记录。元素分析在carlo-erb1106系统上进行。在日立u-3310紫外可见分光光度计上记录了紫外-可见吸收光谱。使用爱丁堡fls1000荧光光谱仪和日立fl-7000荧光光谱仪记录发射光谱。用hamamatsu绝对pl量子产率测量系统测量了光致发光量子产率。
[0129]
实施例1
[0130]
配制1mg/ml的荧光素乙醇溶液(分子结构式如下),与对苯二甲酸通过研磨方式进行混合,粒径10μm左右,荧光素与对苯二甲酸的质量比为1:10000,真空干燥2h或红外灯烘
烤2h后进行测试表征。室温下,365nm紫外灯照射下,该混合物发出明亮黄绿光(发光峰位于510nm),关闭365nm紫外灯后,混合物的黄绿发光并不熄灭,保持黄绿发光3-5秒,即有机长余辉发光。图1展示的是该混合物在365nm紫外灯连续照射下的数码照片,图2展示的是该混合物在365nm紫外灯关闭0.2秒(从余辉视频中选取有代表性的照片作为余辉照片)后所拍摄的数码照片。经测定,该混合物固体样品光致发光量子产率为35.6%。图3为该混合物的稳态发光光谱,在450-650nm出现发光带,发光峰位于510nm。
[0131][0132]
对比例1
[0133]
操作方法与实施例1相同,区别仅在于仅对对苯二甲酸进行研磨。同等条件下测定其发光量子产率为10%。
[0134]
实施例2
[0135]
配制1mg/ml的bodipy乙醇溶液(分子结构式如下)。对苯二甲酸通过研磨方式进行混合,bodipy与对苯二甲酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出明亮黄绿光,关闭365nm紫外灯后,混合物保持黄绿发光3秒。图4展示的是该混合物在365nm紫外灯连续照射下的数码照片,图5展示的是该混合物在365nm紫外灯关闭0.5秒后所拍摄的数码照片。经测定,该混合物固体样品光致发光量子产率为32.5%。图6为该混合物的稳态发光光谱,在500-600nm出现发光带,发光峰位于520nm。
[0136][0137]
实施例3
[0138]
配制1mg/ml的罗丹明b乙醇溶液(分子结构式如下),与对苯二甲酸通过研磨方式进行混合,罗丹明b与对苯二甲酸的质量比为1:10000,自然挥发,真空干燥2h待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为明亮桃红发光,关闭365nm紫外灯后,混合物的桃红发光并不熄灭,保持桃红色发光4秒。图7展示的是该混合物在365nm紫外灯连续照射下的数码照片,图8展示的是该混合物在365nm紫外灯关闭1秒后所拍摄的数码照片。经测定,该混合物固体样品光致发光量子产率为11.1%。对苯二甲酸分子间作用强,罗丹明b在其中部分以单体形式分散,部分发射聚集淬灭。图9为该混合物的稳态发光光谱,在450-700nm出现发光带,发光峰位于590nm。
[0139][0140]
实施例4
[0141]
配制1mg/ml的罗丹明b乙醇溶液,与均三苯甲酸通过研磨方式进行混合,罗丹明b与均三苯甲酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为桃红发光,发光峰位于590nm,关闭365nm紫外灯后,混合物的发光并不熄灭,保持桃红发光3秒。图10展示的是该混合物在365nm紫外灯连续照射下的数码照片,图11展示的是该混合物在365nm紫外灯关闭0.5秒后所拍摄的数码照片。该混合物的光致发光量子产率达到70%。
[0142]
实施例5
[0143]
将300mg咔唑、5ml乙酸酐和0.4ml乙醚合三氟化硼在圆底烧瓶中混合,70℃加热反应4h,加水淬灭乙酸酐,烧瓶中有固体析出,用水洗涤3次,尽量去除水相后,加入二氯甲烷溶解固体,无水硫酸镁干燥,旋干后,石油醚/乙酸乙酯柱层析,获得亮黄色固体czbf2,光致发光量子产率为62%,二氯甲烷/正己烷重结晶两次,得到纯品。
[0144][0145]1h nmr(400mhz,dmso-d6)δ9.13(d,j=2.0hz,1h),8.48(d,j=9.0hz,1h),8.42(d,j=7.4hz,1h),8.33(dd,j=9.0,2.0hz,1h),8.28(d,j=8.4hz,1h),7.63(ddd,j=8.6,7.3,1.4hz,1h),7.53(t,j=7.4hz,1h),7.42(s,1h),2.95(s,3h),2.50(s,3h,overlapped with dmso solvent peak).1h nmr(400mhz,chloroform-d)δ8.78(d,j=2.0hz,1h),8.46(d,j=8.9hz,1h),8.16
–
8.05(m,3h),7.57(ddd,j=8.6,7.3,1.4hz,1h),7.52
–
7.44(m,1h),6.68(s,1h),2.93(s,3h),2.45(s,3h).
13
c nmr(101mhz,dmso-d6)δ192.83,180.89,170.87,142.40,138.71,128.44,128.05,126.21,125.35,124.60,124.10,121.89,120.81,116.80,116.25,97.90,27.51,24.34.
19
f-nmr(376mhz,d-dmso,298k,relative to cfcl3):δ-136.06(21%),-136.12(79%).
11
b nmr(160.5mhz,d-dmso,298k,relative to bf3·
et2o)δ0.08.lrms,m/z 341.hrms m/z found(calcd for c
18h14
bf2no3 na
):364.0934(364.0930).elemental analysis calcd(%)for c
18h14
bf2no3·
0.5h2o:c 61.75,h 4.32,n 4.00;found:c 62.01,h 4.58,n 3.74.
[0146]
配制7-甲氧基-1-萘满酮(化学结构如下)的二氯甲烷溶液,配制czbf2的二氯甲烷溶液,将两溶液混合,czbf2与7-甲氧基-1-萘满酮的质量比为1:99,自然挥发,真空干燥2h,二氯甲烷挥干后,得到czbf2与7-甲氧基-1-萘满酮的双组分长余辉发光材料。室温下,
365nm紫外灯照射下,该材料发黄绿光,余辉颜色为黄绿色(图12),余辉可持续5秒。图13为该混合物的稳态发光光谱,发光带位于400-600nm,发光峰位于510nm,发光衰减曲线显示三种衰减模式(图14),拟合得到材料激发态寿命为6.2ms、60ms和198ms,多种衰减模式的存在与czbf2发光分子所处的微环境有关。固体样品光致发光量子效率为21.0%。向该混合物中加入pluronic f-127水溶液,通过研磨可获得余辉发光材料的水中分散液(图15),在注射器中,该材料保持余辉发光性能(图16),展现出生物光学成像去除背景荧光干扰的应用潜能。czbf2与7-甲氧基-1-萘满酮的质量比为5:95和10:90的混合物也展现余辉性能(图17和图18)。
[0147][0148]
实施例6
[0149]
配制7-[(2-溴-5-氯苯基)甲氧基]-3,4-二氢-1(2h)-萘酮(化学结构如下)的二氯甲烷溶液,配制czbf2的二氯甲烷溶液,将两溶液混合,czbf2与7-[(2-溴-5-氯苯基)甲氧基]-3,4-二氢-1(2h)-萘酮的质量比为1:99,自然挥发,真空干燥2h,二氯甲烷挥干后,得到czbf2与7-[(2-溴-5-氯苯基)甲氧基]-3,4-二氢-1(2h)-萘酮的双组分长余辉发光材料。室温下,365nm紫外灯照射下,该材料发黄绿光(图19),余辉颜色为黄绿色(图20),余辉可持续2秒。
[0150][0151]
实施例7
[0152]
配制1mg/ml的netcz-1b的二氯甲烷溶液(化学结构如下),与对甲氧基苯乙酮的二氯甲烷溶液进行混合,netcz-1b与对甲氧基苯乙酮的质量比为1:99,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出蓝绿光(图21),关闭365nm紫外灯后,混合物的蓝绿色发光持续2秒(图22)。
[0153][0154]
实施例8
[0155]
配制1mg/ml的netcz-1b的二氯甲烷溶液,与4-氯代二苯甲酮的二氯甲烷溶液进行混合,netcz-1b与4-氯代二苯甲酮的质量比为1:99,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出黄绿光(图23),关闭365nm紫外灯后,混合物的黄绿色发光持续4秒(图24)。
[0156]
实施例9
[0157]
配制1mg/ml的netcz-2b的二氯甲烷溶液(化学结构如下),与对甲氧基苯乙酮的二氯甲烷溶液进行混合,netcz-2b与对甲氧基苯乙酮的质量比为1:99,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出蓝绿光(图25),关闭365nm紫外灯后,混合物的蓝绿色发光持续1秒(图26)。
[0158][0159]
实施例10
[0160]
配制1mg/ml的netcz-2b的二氯甲烷溶液,与4-氯代二苯甲酮的二氯甲烷溶液进行混合,netcz-2b与4-氯代二苯甲酮的质量比为1:99,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出黄绿光(图27),关闭365nm紫外灯后,混合物的黄绿色发光持续3秒(图28)。
[0161]
实施例11
[0162]
配制1mg/ml的4,7-双(5-溴-2-噻吩基)-2,1,3-苯并噻二唑二氯甲烷溶液(分子结构式如下),与对苯二甲酸通过研磨方式进行混合,4,7-双(5-溴-2-噻吩基)-2,1,3-苯并噻二唑与对苯二甲酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为明亮黄色发光,关闭365nm紫外灯后,混合物的黄色发光并不熄灭,保持2秒。图29展示的是该混合物在365nm紫外灯连续照射下的数码照片,图30展示的是该混合物在365nm紫外灯关闭0.5秒后所拍摄的数码照片。
[0163][0164]
实施例12
[0165]
配制1mg/ml的2-溴-13,13-二甲基-6h-茚并[1,2-b]蒽-6,11(13h)-二酮二氯甲烷溶液(分子结构式如下),与对苯二甲酸通过研磨方式进行混合,2-溴-13,13-二甲基-6h-茚并[1,2-b]蒽-6,11(13h)-二酮与对苯二甲酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为黄色发光,关闭365nm紫外灯后,混合物的黄色发光并不熄灭,保持2秒。图31展示的是该混合物在365nm紫外灯连续照射下的数码照片,图32展示的是该混合物在365nm紫外灯关闭0.5秒后所拍摄的数码照片。
[0166][0167]
实施例13
[0168]
配制1mg/ml的荧光素乙醇溶液,与对苯二甲酸二钠通过研磨方式进行混合,荧光
素与对苯二甲酸二钠的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为黄绿色发光,关闭365nm紫外灯后,混合物的黄绿色发光并不熄灭,保持1秒。图33展示的是该混合物在365nm紫外灯连续照射下的数码照片,图34展示的是该混合物在365nm紫外灯关闭0.5秒后所拍摄的数码照片。
[0169]
实施例14
[0170]
配制1mg/ml的bodipy乙醇溶液,与对苯二甲酸通过研磨方式进行混合,bodipy与对苯二甲酸的质量比为1:100000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为黄绿色发光,关闭365nm紫外灯后,混合物的黄绿色发光并不熄灭,保持2秒。图35展示的是该混合物在365nm紫外灯连续照射下的数码照片,图36展示的是该混合物在365nm紫外灯关闭0.5秒后所拍摄的数码照片。
[0171]
实施例15
[0172]
与实施例14相同条件下,区别仅在于bodipy与对苯二甲酸的质量比为1:1000000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为黄绿色发光,图37展示的是室温下,365nm紫外光连续照射下(a)和紫外灯关闭1s后(b)bodipy与对苯二甲酸的质量比为1:1000000的混合物的数码照片。
[0173]
实施例16
[0174]
配制1mg/ml的bodipy乙醇溶液,与均三苯甲酸通过研磨方式进行混合,bodipy与均三苯甲酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为黄绿色发光,关闭365nm紫外灯后,混合物的黄绿色发光并不熄灭,保持2秒。图38展示的是该混合物在365nm紫外灯连续照射下的数码照片,图39展示的是该混合物在365nm紫外灯关闭0.5秒后所拍摄的数码照片。
[0175]
实施例17
[0176]
在圆底烧瓶中加0.3ml甲苯,2ml乙酸酐,0.3ml醚合三氟化硼,80℃反应4h,加水淬灭乙酸酐,烧瓶中有固体析出,用水洗涤3次,尽量去除水相后,加入二氯甲烷溶解固体,无水硫酸镁干燥,旋干后,甲苯重结晶,得到二氟化硼二酮产物tolbf2。1h-nmr(400mhz,cdcl3):δ7.95(m,2h),7.32(d,j=7.9hz,2h),6.52(s,1h),2.45(s,3h),2.39(s,3h)。
[0177][0178]
配制1mg/ml的tolbf2的二氯甲烷溶液,与丙二酸通过研磨方式进行混合,tolbf2与丙二酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出蓝绿光(图40),关闭365nm紫外灯后,混合物的蓝绿色发光持续1秒(图41)。发光峰位于420nm,发光量子产率为29%。
[0179]
对比例2
[0180]
与实施例17相同条件下,tolbf2在二氯甲烷溶液中的发光量子产率仅为3%,tolbf2晶体的发光量子产率为15%。丙二酸与tolbf2的混合大幅度提升了发光量子产率。
[0181]
实施例18
[0182]
配制1mg/ml的tolbf2的二氯甲烷溶液,与丁二酸通过研磨方式进行混合,tolbf2与丁二酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出蓝绿光(图42),关闭365nm紫外灯后,混合物的蓝绿色发光持续1秒(图43)。
[0183]
实施例19
[0184]
配制1mg/ml的tolbf2的二氯甲烷溶液,与戊二酸通过研磨方式进行混合,tolbf2与戊二酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出蓝绿光(图44),关闭365nm紫外灯后,混合物的蓝绿色发光持续1秒(图45),上述有机长余辉材料发光量子产率为30%。
[0185]
实施例20
[0186]
配制1mg/ml的tolbf2的二氯甲烷溶液,与辛二酸通过研磨方式进行混合,tolbf2与辛二酸的质量比为1:5000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物发出蓝绿光(图46),关闭365nm紫外灯后,混合物的蓝绿色发光持续1秒(图47)。
[0187]
实施例21
[0188]
将500mg 9,9
’‑
螺二芴、5ml乙酸酐和0.8ml乙醚合三氟化硼在圆底烧瓶中混合,升温至60℃反应5h,tlc检测反应进程。反应结束后,加水淬灭乙酸酐,烧瓶中有固体析出,用水洗涤3-4次,除去水相并用适量二氯甲烷溶解固体,加入无水硫酸镁干燥,旋干除去溶剂后,柱层析分离产物,淋洗剂比例为石油醚/二氯甲烷=1:1,得到黄色固体,产率为50%,二氯甲烷/正己烷重结晶三次,得到产物831。
[0189][0190]1h nmr(400mhz,chloroform-d)δ8.16(dd,j=8.2,1.7hz,1h),7.98(d,j=8.1hz,1h),7.93(d,j=7.7hz,1h),7.89(d,j=7.8hz,2h),7.45
–
7.40(m,3h),7.36(d,j=1.7hz,1h),7.22(td,j=7.5,1.1hz,1h),7.13(td,j=7.5,1.1hz,2h),6.76(d,j=7.6hz,1h),6.69(d,j=7.6hz,2h),6.36(s,1h),2.30(s,3h).
19
f nmr(376mhz,298k,chloroform-d)δ-140.06(21%),-140.13(79%).
[0191]
配制二苯甲酮(化学结构如上)的二氯甲烷溶液,配制上述反应产物831的二氯甲烷溶液,将两溶液混合,产物831与二苯甲酮的质量比为1:99,自然挥发,真空干燥2h,二氯甲烷挥发干后,得到双组分长余辉发光材料。室温下,365nm紫外灯照射下,该材料发黄光,余辉颜色为黄绿色(图48),余辉可持续10秒。余辉发光峰值为520nm。上述有机长余辉材料发光量子产率为30%。
[0192]
实施例22
[0193]
配制6-氰基-1-茚酮(化学结构如下)的二氯甲烷溶液,配制上述反应产物831的二氯甲烷溶液,将两溶液混合,产物831与6-氰基-1-茚酮的质量比为1:1000,自然挥发,真空干燥2h,二氯甲烷挥发干后,得到双组分长余辉发光材料。室温下,365nm紫外灯照射下,该材料发黄光,余辉颜色为黄绿色(图49),余辉可持续约10秒。余辉发光峰值为520nm。
[0194][0195]
实施例23
[0196]
配制苯甲酸苯酯(化学结构如下)的二氯甲烷溶液,配制上述反应产物831的二氯甲烷溶液,将两溶液混合,产物831与苯甲酸苯酯的质量比为1:1000,自然挥发,真空干燥2h,二氯甲烷挥发干后,得到双组分长余辉发光材料。室温下,365nm紫外灯照射下,该材料发黄光,余辉颜色为黄绿色(图50),余辉可持续8秒。余辉发光峰值为520nm。上述有机长余辉材料发光量子产率为24%。
[0197][0198]
实施例24
[0199]
配制1mg/ml的3,3'-二乙基氧杂羰花青碘乙醇溶液(化学结构如下),与对苯二甲酸通过研磨方式进行混合,氧杂羰花青与对苯二甲酸的质量比为1:10000,自然挥发,真空干燥2h,待混合物完全挥发干燥。365nm紫外灯照射下,该混合物为黄色发光,关闭365nm紫外灯后,混合物的黄色发光并不熄灭(图51),保持2-3秒。
[0200][0201]
实施例25
[0202]
将0.2ml二苯甲醚、2ml乙酸酐和0.8ml乙醚合三氟化硼在25ml圆底烧瓶中混合,70℃加热反应4h,石油醚/二氯甲烷柱层析,获得淡黄色粉末,产率为32%,二氯甲烷/正己烷重结晶两次,得到纯品。
[0203][0204]1h nmr(400mhz,chloroform-d)δ8.05(d,j=2.2hz,1h),8.03(d,j=2.1hz,1h),7.44(t,j=7.9hz,2h),7.26(t,j=7.6,1h),7.10(d,j=7.8hz,2h),7.07
–
7.01(m,2h),6.48(s,1h),2.39(s,3h).
[0205]
配制二苯醚二氟化硼的二氯甲烷溶液,与三苯基氧膦(结构如图)混合,三苯基氧
膦与二苯醚二氟化硼的质量比为99:1,自然挥发,真空干燥2h,二氯甲烷挥干后,得到三苯基氧膦与二苯醚二氟化硼的双组分长余辉发光材料。室温下,365nm紫外灯照射下,该材料不发光,余辉颜色为绿色(图52),余辉可持续4秒。上述有机长余辉材料发光量子产率为20%。
[0206][0207]
实施例26
[0208]
配制二苯醚二氟化硼的二氯甲烷溶液,与苯甲酸苯酯(结构如图)混合,苯甲酸苯酯与二苯醚二氟化硼的质量比为999:1,自然挥发,真空干燥2h,二氯甲烷挥干后,得到苯甲酸苯酯与二苯醚二氟化硼的双组分长余辉发光材料。室温下,365nm紫外灯照射下,该材料不发光,余辉颜色为绿色(图53),余辉可持续5秒。
[0209][0210]
实施例27
[0211]
将369mg对碘苯乙酮、0.45ml丙酸、5ml三氟乙酸酐、0.5ml乙醚合三氟化硼在圆底烧瓶中混合,50℃加热回流反应2h,体系滴入水中淬灭反应,接着加入二氯甲烷,充分搅拌静置分层后去除水相,二氯甲烷相倒入分液漏斗,用水萃取3次,去除水相,二氯甲烷相用无水硫酸钠干燥,旋干后,石油醚/二氯甲烷柱层析,得淡黄色固体,产率为59%,二氯甲烷/石油醚重结晶两次,得到纯品。
[0212][0213]1h nmr(400mhz,chloroform-d)δ7.90(m,2h),7.75(m,2h),6.54(s,1h),2.68(q,2h),1.32(t,3h).
[0214]
配制三苯基氧膦(化学结构如下)的二氯甲烷溶液,配制p-ibf2的二氯甲烷溶液,将两溶液混合,控制p-ibf2与三苯基氧膦的质量比为1:99,自然挥发,真空干燥2h,二氯甲烷挥干后,得到p-ibf2与三苯基氧膦的双组分长余辉发光材料。室温下,365nm紫外灯照射下,该材料发淡蓝色荧光,余辉颜色为绿色(图54),余辉可持续2秒。
[0215][0216]
实施例28
[0217]
将300mg 9,9-二甲基芴、5ml乙酸酐和0.4ml乙醚合三氟化硼在圆底烧瓶中混合,
升温至60℃反应4h,tlc检测反应进程。反应结束后,加水淬灭乙酸酐,烧瓶中有固体析出,用水洗涤3次,除去水相并用适量二氯甲烷溶解固体,加入无水硫酸镁干燥,旋干除去溶剂后,柱层析分离产物,淋洗剂比例为pe/dcm=1:1,得到黄色固体,产率约为50%,二氯甲烷/正己烷重结晶三次,得到产物。
[0218][0219]1h nmr(400mhz,chloroform-d)δ8.17(d,j=1.7hz,1h),8.04(dd,j=8.1,1.8hz,1h),7.86-7.78(m,2h),7.53-7.48(m,1h),7.42(dtd,j=16.0,7.2,1.4hz,2h),6.62(s,1h),2.43(s,3h),1.54(t,6h).
[0220]
配制二苯甲酮(化学结构如上)的二氯甲烷溶液,配制上述反应产物923的二氯甲烷溶液,将两溶液混合,产物923与二苯甲酮的质量比为1:99,自然挥发,真空干燥2h,二氯甲烷挥发干后,得到双组分长余辉发光材料。室温下,365nm紫外灯照射下,该材料发黄绿光,余辉颜色为黄绿色(图55),余辉可持续约13秒。
[0221]
实施例29
[0222]
本发明中部分化合物的homo和lumo数据。pta为对苯二甲酸,ttl为7-甲氧基-1-萘满酮,fls为荧光素,rhb为罗丹明b,bdp为bodipy即氟硼二吡咯,czbf2见图56。基体分子,例如pta和ttl,分子共轭程度低,homo低,lumo高,而发光分子共轭程度较高,homo较高,lumo较低;因此,在本发明中,基体分子的lumo高于发光分子,基体分子的homo低于发光分子,在这一点上,本发明与文献中的给体-受体双组分余辉体系不同。
[0223]
对比例3
[0224]
基体分子与发光分子如下表所示,实验条件与实施例17相同,制备的基体分子和发光分子的混合物没有长余辉发光。
[0225]
[0226]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。