集成连续生物制造中的在线产物监测
1.相关申请的交叉引用
2.本技术要求2019年10月22日提交的美国临时专利申请62/924,551的优先权,其全部内容通过引用并入本文。
技术领域
3.本公开文本涉及用于在集成连续生物制造系统中使用的产物监测系统和方法。
背景技术:
4.含有编码重组蛋白的核酸的哺乳动物细胞通常用于生产在治疗上或商业上重要的蛋白质。集成连续生物制造是降低与基于此类蛋白质的疗法相关的成本的重要方面。监测系统用于生物制造以评定各种生物产物。
技术实现要素:
5.治疗性蛋白物质和其他生物分子的集成连续生物制造为将来生产拯救生命的药物和促进依赖于此类生物分子的可用性的疗法的广泛采用提供了巨大的希望。具有各种配置的双柱和多柱色谱系统可用于工业规模的生物制造。在此类系统中,各种洗脱液流的过程监测可用于调节过程相关参数和控制例如从某些柱进行的洗脱液流的选择性收集以及溶液缓冲特性(例如ph)的调节。
6.本公开文本的特征在于用于使用从色谱柱或生物反应器流出的溶液或进料至此类柱或反应器中的溶液的快速在线询问来确定溶液特性(诸如溶质浓度和ph)的方法和系统。使用角分辨折射测量值以及校准信息快速且准确地提供与这些溶液参数有关的定量信息。当溶液在容器之间流动时,所述方法可以直接在线实施而无需对所述溶液进行采样,或可替代地可以对从柱、反应器或传输线中取出的溶液样品实施。将折射角测量值与溶液特异性校准信息组合,以得到溶液特性,然后可使用此信息控制各种与过程有关的生物制造参数和/或操作。
7.在一方面,本公开文本的特征在于用于控制生物制造系统的方法,所述方法包括引导光束穿过含有由所述生物制造系统产生的第一流体的容器的壁,测量所述光束在所述第一流体中的折射角,所述折射角对应于所述光束在所述第一流体中的传播方向与所述容器壁和所述第一流体之间的界面的法线之间的角,基于所测量的折射角确定关于所述第一流体的信息,并且基于所述关于所述第一流体的信息调节所述生物制造系统的参数。
8.所述方法的实施方案可以包括以下特征中的任何一个或多个。
9.所述关于所述第一流体的信息可以包括所述第一流体中物质的浓度和/或所述第一流体的ph值和/或所述第一流体的离子强度。所述第一流体可以包括从所述系统的纯化单元排出的流体。所述纯化单元可以包括至少一个色谱柱。
10.所述第一流体可以包括引入到所述系统的反应器中的进料流体。所述第一流体可以包括从所述系统的过滤单元(例如,渗滤单元)排出的流体。
11.所述生物制造系统的参数可以包括流体流动路径,所述流体流动路径将所述第一流体的连续部分选择性地引导至所述系统的多个纯化单元之一。所述生物制造系统的参数可以包括物质进入所述系统的反应器的进料速率。所述生物制造系统的参数可以包括物质进入所述系统的渗滤单元的进料速率。
12.所述生物制造系统的参数可以包括物质进入所述系统的纯化单元的进料速率。所述生物制造系统的参数可以包括所述第一流体的连续部分进入所述系统的纯化单元的进料速率。
13.所述方法可以包括由从所测量的校准数据得到的校准方程确定所述物质的浓度,其中所述校准方程将浓度表示为所述折射角的函数。所述校准方程可以将所述浓度表示为所述折射角的线性函数。所述校准方程可以将所述浓度表示为所述折射角的非线性函数。所述方法可以包括将所述浓度信息传输到所述系统的控制器,其中所述控制器被配置为接收所述浓度信息并调节所述系统的参数。
14.所述物质可以包括蛋白质和/或基于重组蛋白的药物产物和/或基于核酸的产物。
15.所述第一流体可以是作为生物制造过程的一部分由所述系统产生的过程流体。所述第一流体可以包括从色谱柱排出的洗脱液。所述第一流体可以包括来自所述系统的第一纯化单元的洗脱溶液,并且所述信息可以包括所述第一流体中物质的浓度,并且所述参数调节可以包括当所述第一流体中所述物质的浓度超过阈值时,将来自所述第一纯化单元的洗脱溶液引导至第二纯化单元的入口中。所述第一纯化单元和第二纯化单元可以各自包括至少一个色谱柱。
16.所述第一流体可以包括来自所述系统的第一纯化单元的洗脱溶液,所述信息可以包括所述第一流体中物质的浓度,并且所述第一纯化单元的入口可以与向所述第一纯化单元递送进料溶液的导管连接,并且所述方法可以包括当所述第一流体中所述物质的浓度超过阈值时,将所述第一纯化单元的入口与所述导管断开,以及将所述系统的第二纯化单元的入口与所述导管连接以将所述进料溶液递送至所述第二纯化单元。
17.所述方法可以包括引导第二光束穿过含有由所述生物制造系统产生的第二流体的第二容器的壁,测量所述第二光束在所述第二流体中的折射角,所述折射角对应于所述第二光束在所述第二流体中的传播方向与所述第二容器的壁和所述第二流体之间的界面的法线之间的角,基于所测量的第二光束的折射角确定关于所述第二流体的信息,并且基于所述关于所述第二流体的信息调节所述生物制造系统的第二参数。所述关于所述第二流体的信息可以包括所述第二流体中缓冲溶液组分的浓度。所述关于所述第二流体的信息可以包括所述第二流体中离子化合物或其溶解盐的浓度。调节所述第二参数可以包括调节所述第二流体进入所述系统的纯化单元的进料速率。
18.所述方法可以包括重复所述引导、测量、确定和传输步骤,以将所述浓度信息作为反馈信号提供给所述控制器,从而调节生物制造过程期间所述系统的参数。
19.所述方法的实施方案还可以包括本文描述的任何其他特征或步骤,包括结合相同或不同实施方案单独描述的特征和/或步骤的组合,除非另外明确陈述,否则可以是任何组合。
20.在另一方面,本公开文本的特征在于如下生物制造系统,所述生物制造系统包括:容器,所述容器被配置为容纳或输送由所述系统产生的第一流体并具有限定所述容器的至
少一部分的壁;被配置为引导光束穿过所述壁的光源;检测器,所述检测器被配置为测量所述光束在所述第一流体中的折射角,所述折射角对应于所述光束在所述第一流体中的传播方向与所述壁和所述第一流体之间的界面的法线之间的角;以及第一控制器,所述第一控制器与所述检测器连接并被配置为:从所述检测器接收关于所述折射角的信息,并且基于所测量的折射角确定关于所述第一流体的信息;并且基于所述关于所述第一流体的信息调节所述系统的参数。
21.所述系统的实施方案可以包括以下特征中的任何一个或多个。
22.所述关于所述第一流体的信息可以包括所述第一流体中物质的浓度和/或所述第一流体的ph值。
23.所述系统可以包括纯化单元,其中所述第一流体包括从所述纯化单元排出的流体。所述纯化单元可以包括至少一个色谱柱。所述系统可以包括反应器,其中所述第一流体包括引入所述反应器中的进料流体。所述系统可以包括过滤单元(例如,渗滤单元),其中所述第一流体包括从所述过滤(例如,渗滤)单元排出的流体。
24.所述系统可以包括多个纯化单元,其中所述系统的参数包括流体流动路径,所述流体流动路径将所述第一流体的连续部分选择性地引导至多个纯化单元之一。所述系统可以包括反应器,其中所述系统的参数包括物质进入所述反应器的进料速率。所述系统可以包括过滤(例如,渗滤)单元,其中所述系统的参数包括物质进入所述过滤(例如,渗滤)单元的进料速率。所述系统可以包括纯化单元,其中所述系统的参数包括物质进入所述纯化单元的进料速率。所述系统可以包括纯化单元,其中所述系统的参数包括所述第一流体的连续部分进入所述纯化单元的进料速率。
25.所述第一控制器可以被配置为由从所测量的校准数据得到的校准方程确定所述物质的浓度,其中所述校准方程将所述浓度表示为所述折射角的函数。所述校准方程可以将所述浓度表示为所述折射角的线性函数。所述校准方程可以将所述浓度表示为所述折射角的非线性函数。
26.所述物质可以包括蛋白质。所述物质可以包括基于重组蛋白的药物产物。所述物质可以包括基于核酸的产物。
27.所述第一流体可以是作为生物制造过程的一部分由所述系统产生的过程流体。所述系统可以包括纯化单元,其中所述第一流体包括从所述纯化单元排出的洗脱液。
28.所述系统可以包括第一纯化单元和第二纯化单元,其中所述第一流体包括来自所述第一纯化单元的洗脱溶液,所述信息包括所述第一流体中物质的浓度,并且所述参数调节可以包括当所述第一流体中所述物质的浓度超过阈值时,将来自所述第一纯化单元的洗脱溶液引导至所述第二纯化单元的入口中。所述第一纯化单元和第二纯化单元可以各自包括至少一个色谱柱。
29.所述系统可以包括第一纯化单元和第二纯化单元,所述第一纯化单元具有与将进料溶液递送至所述第一纯化单元的导管连接的入口,其中所述第一流体包括来自所述第一纯化单元的洗脱溶液,所述信息包括所述第一流体中物质的浓度,并且所述参数调节包括当所述第一流体中所述物质的浓度超过阈值时,将所述第一纯化单元的入口与所述导管断开,以及将所述第二纯化单元的入口与所述导管连接以向所述第二纯化单元递送所述进料溶液。
30.所述系统可以包括第二容器,所述第二容器被配置为容纳或输送由所述系统产生的第二流体并具有限定所述第二容器的至少一部分的第二壁;被配置为引导第二光束穿过所述第二壁的第二光源;以及第二检测器,所述第二检测器被配置为测量所述第二光束在所述第二流体中的折射角,所述折射角对应于所述第二光束在所述第二流体中的传播方向与所述第二壁和所述第二流体之间的界面的法线之间的角,其中所述第一控制器与所述第二检测器连接并被配置为:从所述第二检测器接收关于所述折射角的信息,并且基于所测量的折射角确定关于所述第二流体的信息;并且基于所述关于所述第二流体的信息调节所述系统的第二参数。
31.所述关于所述第二流体的信息可以包括所述第二流体中缓冲溶液组分的浓度。所述关于所述第二流体的信息可以包括所述第二流体中离子化合物或其溶解盐的浓度。
32.所述系统可以包括纯化单元,其中调节所述第二参数包括调节所述第二流体进入所述纯化单元的进料速率。
33.在生物制造过程期间,所述光源可以被配置为重复引导所述光束穿过所述壁,所述检测器可以被配置为重复测量所述光束在所述第一流体中的折射角,并且所述第一控制器可以被配置为重复地:从所述检测器接收关于所述折射角的信息;基于所测量的折射角确定关于所述第一流体的信息;并且基于所述关于所述第一流体的信息调节所述系统的参数。
34.所述系统可以包括多个纯化单元,所述多个纯化单元各自具有至少一个色谱柱、柱切换机构和与所述柱切换机构连接并与所述第一控制器通信的第二控制器,其中所述第一控制器被配置为通过向所述第二控制器传输信号,从而使所述第二控制器调节所述柱切换机构以将流体选择性地引导至所述多个纯化单元之一中来调节所述系统的参数。被选择性引导的流体可以包括所述第一流体的另一部分。
35.所述系统可以包括含有第二流体的储器和与所述第一控制器通信的第二控制器,其中所述第一控制器被配置为通过基于所述关于所述第一流体的信息向所述第二处理器传输控制信号来调节所述系统的参数,并且所述第二控制器被配置为响应于所述控制信号将来自所述储器的所述第二流体的一部分引入所述第一流体的连续部分中。所述第二流体可以包括缓冲溶液。所述第二流体可以包括离子化合物或其溶解盐的溶液。
36.所述系统的实施方案还可以包括本文描述的任何其他特征或步骤,包括结合相同或不同实施方案单独描述的特征和/或步骤的组合,除非另外明确陈述,否则可以是任何组合。
37.除非另外定义,否则在本文所使用的所有技术和科学术语具有与本公开文本所属领域的普通技术人员通常所理解相同的含义。尽管与本文所述的方法和材料类似或等同的那些方法和材料可以用于本文主题的实践或测试,但下面描述了合适的方法和材料。本文提及的所有出版物、专利申请、专利和其他参考文献都通过引用以其整体而并入。在矛盾的情况下,将以包括定义在内的本说明书为准。此外,材料、方法以及实施例仅仅是说明性的并不意在是限制性的。
38.在下面的附图和说明书中阐述了一个或多个实施方案的细节。从说明书、附图和权利要求中,其他特征和优势将变得清楚。
附图说明
39.图1是显示光束穿过两种材料之间的一个界面并在所述界面处折射的示意图。
40.图2是显示光束穿过不同材料之间的多个界面并且在界面处折射的示意图。
41.图3是显示用于对光束进行角分辨折射测量的系统的示意图。
42.图4是显示溶液的溶质浓度值随折射角变化的示意图。
43.图5是显示用于对光束进行角分辨折射测量的在线系统的示意图。
44.图6是显示用于以反射模式对光束进行角分辨折射测量的系统的示意图。
45.图7是连续生物制造系统的示意图。
46.图8是显示用于连续生物制造系统的色谱柱切换程序中的步骤的示意图。
47.图中相同的符号指示相同的元件。
具体实施方式
48.介绍
49.工业规模的生物制造可以通过在双柱和多柱色谱系统中以各种配置进行中间物和/或产物纯化来进行。在这些复杂系统中,产物产量、纯度和废弃物率是大量与过程相关的参数和步骤的函数。在制造治疗性蛋白和其他具有商业价值的生物分子期间,产物结果可受这些参数和步骤的强烈影响。因此,适当控制此类参数和步骤是大规模制造的重要方面。例如,在pct专利申请公开号wo 2014/137903中公开了生物制造系统的特征和方面,将所述申请的全部内容通过引用并入本文。
50.通过对中间物溶液流的过程内在线监测,特别是监测此类流中的中间物和产物的浓度以及此类流的其他特性(诸如像ph),来促进对生物制造参数运用适当控制(包括自动控制)。用于溶液监测的常规方法包括诸如uv吸光度测量的技术。然而,不幸的是,由于诸如温度、湿度,环境光强度和局部样品不均匀性的因素,此类方法在几天的测量时段内会发生漂移。
51.本文公开了使用角分辨折射测量来确定过程溶液特性的方法和系统,所述特性包括产物和中间组分浓度以及缓冲剂浓度/ph水平。此类折射测量是快速的,高度可重复的,并且当与合适的校准信息组合时,可以用于确定关于溶液的准确定量信息。此定量信息又可以用作对自动或半自动过程控制系统的反馈,所述过程控制系统调节过程条件并启动或中止某些过程步骤。
52.在线角分辨折射测量
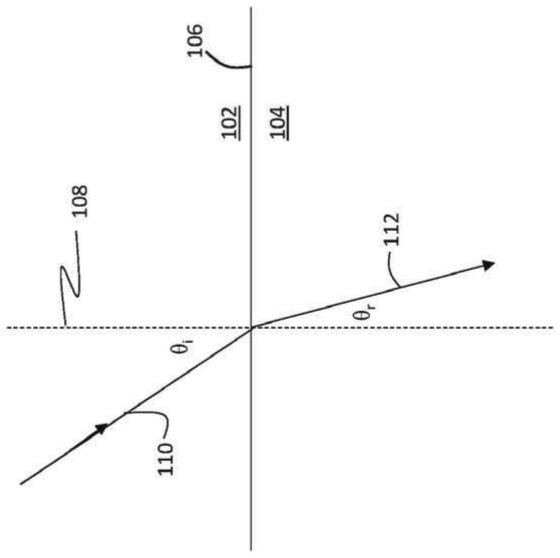
53.图1是显示光束从气体环境(例如,空气)进入液体环境(例如,水溶液)的示意图。在图1中,界面106将气体环境102与液体环境104分开。入射光束110传播通过气体环境102,穿过界面106,然后以折射光束112的形式传播通过液体环境104。入射光束110以相对于界面106的法线108的角θi入射在界面106上。折射光束112与法线108形成角θr。
54.折射角θr取决于入射角θi以及气体和液体环境各自的折射率n
气体
和n
液体
。这些变量之间的关系是斯涅尔定律(snell's law):
55.n
气体
sin(θi)=n
液体
sin(θr)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1.56.因此,通过重排方程(1),可以如下计算θr:
57.θr=sin-1
(n
气体
sinθi/n
液体
)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2.58.当n
液体
已知时,可以从方程(2)确定θr。已测量了多种纯液体的n
液体
值。对于由溶解在溶剂中的溶质组成的溶液,折射率n
溶液
≈n
溶剂
-n
溶质
,其中-n
溶质
表示由于溶质的存在而对溶液的折射率的额外贡献。通常,溶解的溶质使溶液比纯液体溶剂更具光密性,这意味着在大多数情况下,n
溶液
》n
溶剂
。
59.随着溶液中溶质的浓度增加,溶液的光密度和折射率典型地也增加。还没有通用的分析形式描述特定溶质在特定溶剂中的浓度与所得溶液的折射率之间的关系。而是只有以下通用关系成立:
60.n
溶液
=f(c)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3.61.其中c是特定溶质在形成溶液的特定溶剂中的浓度,并且f(c)是未知的函数形式。
62.如果假设f(c)是线性函数,使得f(c)=uc v,其中u和v是未知常数,则
63.n
溶液
=uc v
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4.64.代入方程(1),得到
65.n
气体
sinθi=(uv c)sinθrꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5.66.重排溶质浓度c的方程(5),得到以下表达式:
[0067][0068]
方程(6)将浓度c表示为csc(θr)的线性函数,形式为c=m
·
csc(θr) b,其中斜率m=(n
气体
/u)
·
sin(θi),并且截距b=-(v/u)。如果对于某些θr值,条件csc(θr)≈θr成立,则
[0069]
c=m
·
θr b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[7]
[0070]
其中m和b的值如上。换句话说,如果常数m和b的值是已知的,例如,从溶解在特定溶剂中的特定溶质的校准信息获知,则对于具有未知浓度的所述溶质溶解在所述溶剂中的溶液,溶质浓度c可以从方程(7)和折射角θr的测量值来直接确定。
[0071]
当询问光束穿过容纳溶液或溶液所流动的容器或导管的壁时,情况稍微更复杂。图2是显示光束210传播通过气体202的示意图。光束被引导通过含有液体204的管或容器的固体、半透明或透明壁203。界面206将气体202与固体壁203分离,并且第二界面207将固体壁203与液体204分离。气体202具有折射率n
气体
,固体壁203由具有折射率n
固体
的材料形成,并且液体204具有折射率n
液体
。
[0072]
光束210以相对于界面206的法线208的角θ1入射在界面206上,并在固体壁203内以相对于法线208的角θ2折射,从而形成折射光束212。假设界面206和207平行,则折射光束212以相对于界面207的法线209的角θ2入射在界面207上,并在液体204中以相对于法线209的角θ3折射,从而形成折射光束214。
[0073]
在界面206处,斯涅尔定律描述了折射率与入射角和折射角之间的以下关系:
[0074]n气体
sinθ1=n
固体
sinθ2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[8]
[0075]
类似地,在界面207处,斯涅尔定律得到:
[0076]n固体
sinθ2=n
液体
sinθ3ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[9]
[0077]
组合方程(8)和(9)消除了对固体壁203的依赖:
[0078]n气体
sinθ1=n
液体
sinθ3ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[10]
[0079]
方程(10)具有与方程(1)相同的形式,其中θi=θ1,并且θr=θ3。因此,对于溶解在
特定溶剂中以形成液体204的特定溶质,在与上述相同的相应假设的情形下,溶解溶质的浓度c可以表示为:
[0080]
c=m
·
θ3 b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[11]
[0081]
其中斜率m=(n
气体
/u)
·
sin(θ1),并且截距b=-(v/u)。换句话说,如果常数m和b的值是已知的,例如从校准数据获知,则可以从折射角θ3的测量值和方程(11)来直接确定浓度c。
[0082]
图3是显示用于测量光束在液体中的折射角的测量系统300的实施方案的示意图。系统300包括光源308和耦合到控制器312的角分辨光检测器310。液体304,例如中间物或产物溶液,其包括一定量的生物制造产物,诸如溶解在溶剂中的蛋白质,包含在容器或导管的壁302和306之间。液体304可以在容器或导管内静止,或者移动,即流动。壁302和306由固体、半透明或透明材料诸如玻璃或聚合物材料形成,并且具有折射率n
壁
。液体304具有折射率n
溶液
。
[0083]
在操作期间,控制器312引导光源产生入射光束314,所述入射光束314以相对于界面322的法线318的角θ1入射在壁302与液体304之间的界面322上。折射光束316以相对于法线318的角θ2折射。
[0084]
折射光束316以相对于界面法线320的角θ2入射在位于界面324处的检测器310上。检测器310被配置为测量光束316的折射角θ2,并且将关于θ2的信息传输至控制器312。图3的几何布置类似于图1的布置,其中θi=θ1,并且θr=θ2。因此,斯涅尔定律得出:
[0085]n壁
sinθ1=n
溶液
sinθ2ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[12]
[0086]
因此,对于溶解在特定溶剂中以形成液体304的特定溶质,在与上述相同的相应假设的情形下,溶解溶质的浓度c可以表示为:
[0087]
c=m
·
θ2 b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[13]
[0088]
其中斜率m=(n
壁
/u)
·
sin(θ1),并且截距b=-(v/u)。即如果常数m和b的值是已知的,例如从校准数据获知,则可以从折射角θ2的测量值和方程(13)来直接确定浓度c。
[0089]
为了获得特定溶质在特定溶剂中的定量浓度c,首先测量校准数据。典型地,对于一系列溶液,其各自具有已知浓度的目标溶质溶解在目标溶剂中,使用系统300测量每种溶液,产生一组校准数据,包括溶质浓度c和相应折射角θ2。图4是显示具有已知浓度c的特定溶质的溶液的一组测量的折射角θ2的示意图。
[0090]
在测量数据之后,将数据传输至控制器312以进行分析。控制器312被配置为确定方程(13)中的常数m和b的值。在一些实施方案中,例如,控制器312执行线性回归分析以确定通过(c,θ2)校准数据点组的最佳拟合线402。回归分析从方程(13)确定常数m和b的值。确定了m和b的值之后,对系统300进行校准,并且系统300准备好对生物制造系统中的过程溶液进行在线测量。
[0091]
图5是包括测量系统300的生物制造系统500的一部分的示意图。在图5中,含有溶解在溶剂中的产物或中间物质诸如蛋白质、多肽、抗体或另一种生物分子(即,溶质)的过程溶液508通过导管506从第一容器502(例如,色谱柱、生物反应器或其他反应或纯化容器,或槽)流向第二容器504(例如色谱柱、生物反应器或其他反应或纯化容器,或槽)。将光源308集成至导管506中并将角分辨检测器310与控制器312连接。如图5所示,控制器312还包括与调节与生物制造过程相关的各种操作参数和/或过程步骤的另一个控制/逻辑单元的连接
510。
[0092]
如上所述,在操作期间,控制器312包括针对溶解在溶质中的产物或中间物质确定的校准信息(即,m和b的值)。在一些实施方案中,控制器312在对溶液508进行在线测量之前确定此信息。可替代地,在某些实施方案中,控制器312从存储单元370(例如,存储单元或其他永久性存储介质,诸如磁或光存储介质)检索校准信息。作为另一替代方案,在一些实施方案中,校准信息被编码在控制器312内,例如在控制器的固件中。作为另一个例子,在某些实施方案中,校准信息存储在网络可访问的数据库中,并且控制器312被配置为经由有线或无线网络接口(例如,连接两个或更多个计算设备的局域网、广域网或任何其他类型的分布式网络架构的接口)从数据库检索校准信息。
[0093]
为了测量溶液508,光源308产生光束,光束在进入溶液508时折射,并且检测器310测量折射角θ2。控制器312从检测器310接收关于折射角θ2的信息,然后使用方程(13)中的角信息和校准信息确定溶液508中产物或中间物质的浓度c。任选地,控制器312可以经由连接510将溶液508的浓度信息传给另一个控制/逻辑单元。
[0094]
通常,导管506由对光源308产生的光束透明或半透明的材料形成。在一些实施方案中,例如,导管506由柔性聚合物材料,诸如但不限于聚乙烯、聚丙烯或聚丁烯形成。在某些实施方案中,导管506可以由一种或多种玻璃材料形成。
[0095]
可以使用多种设备来实现光源308。在一些实施方案中,例如,光源308具有一个或多个发光二极管(led)。可替代地或另外地,在某些实施方案中,光源308包括一个或多个激光二极管。在一些实施方案中,光源308包括一个或多个激光器(例如,气体激光器、固态激光器、基于有机染料的激光器)。在某些实施方案中,光源308包括一个或多个荧光和/或白炽光源,诸如基于闪光灯的光源。
[0096]
光源308可以被配置为产生具有各种光谱区域中的中心波长的光束。在一些实施方案中,例如,光束具有光谱的可见光区域中的中心波长,为约400nm至约800nm。在某些实施方案中,光束具有光谱的近红外或红外区域中的中心波长,其波长大于800nm。在一些实施方案中,光束具有光谱的紫外区域中的中心波长,其波长小于400nm。光谱可见光区域中的波长的有利之处可能在于其很容易观察到以调节和校准测量系统300。光谱的近红外和红外区域中的波长的有利之处可能在于其可以至少部分穿过对电磁光谱的可见光区域中的波长相对不透明的材料。
[0097]
在一些实施方案中,光源308是相对宽带的光源,并且产生半最大值全宽(fwhm)光谱带宽为5nm或更大(例如,7nm或更大、10nm或更大、12nm或更大、15nm或更大、20nm或更大、25nm或更大、30nm或更大、50nm或更大)的光束。在某些实施方案中,光源308是相对窄带的光源,并且产生fwhm光谱带宽为3nm或更小(例如,2nm或更小、1nm或更小、0.5nm或更小)的光束。
[0098]
通常,在检测器310中可以使用能够对穿过溶液508的光进行角分辨的测量的任何传感器。即,可以使用能够测量穿过溶液508的光束的折射角θ2的多种传感器。作为一个例子,在某些实施方案中,检测器310可以包括cr288浓度监测器(购自马萨诸塞州比勒里卡市entegris公司(entegris,inc.,billerica,ma))。
[0099]
在图5中,光源308与导管506的表面接触,并且由光源308产生的光束直接耦合到导管506的壁中。然而,更通常,光源308不必与导管506直接接触,并且可以与导管506间隔
开。如果光源308与导管506间隔开,使得光束在进入导管壁之前传播通过气体(例如,空气),则类似于方程(12)和(13)的关系仍然成立,其中用n
气体
代替n
壁
,并且θ1是指光束在导管壁上的入射角。
[0100]
在图3和图5中,检测器310在与光源308大致相对(并且从侧面横向移位)的位置处集成到含有待分析溶液的容器或导管的壁306中。因此,测量系统300对折射通过溶液508的光束进行透射模式测量。
[0101]
光源308和检测器310中的任一个或两个可以任选地集成到含有待分析溶液的容器或导管的壁中。可以使用各种不同的实现方式将这些组件集成到容器壁中。例如,在一些实施方案中,容器壁包括孔,所述孔的尺寸被设计来接收光源308或检测器310。光源308或检测器310可被定位在孔内,并使用合适的粘合剂固定在适当位置。在某些实施方案中,光源308或检测器310被定位在孔内,使得穿过容器壁突出的光源308或检测器310的表面与容器壁的内表面对齐,从而在容器内流动的溶液不受光源或检测器的阻碍。
[0102]
在一些实施方案中,测量系统300可以被配置为对折射通过溶液508的光束执行反射模式测量。图6是显示用于进行反射模式测量的测量系统600的示意图。系统600包括光源308、检测器310和控制器312。光源308被定位来产生入射光束314,所述入射光束314如先前结合图3所述在界面322处折射,并且以相对于界面法线320的角θ2入射在界面324上。
[0103]
在测量系统600中,镜606被定位来拦截折射光束316,否则折射光束316将穿过界面324。镜606反射折射光束316,形成反射光束602,所述反射光束602以相对于法线320的角θ2反射。然后,反射光束602以相对于界面法线604的角θ2入射在界面322上。在界面322处,反射光束602被检测器310拦截,所述检测器310测量角θ2。由于测量系统600中的对称性,反射光束602相对于法线604的入射角θ2与折射光束316相对于法线318的折射角相同。因此,方程(12)和(13)对于由系统600进行的反射模式测量仍然有效,并且可以以上述方式进行校准和定量浓度确定。
[0104]
溶剂/溶质特异性校准
[0105]
通常,所测量的校准数据特异于目标溶质和溶剂,因为溶液的折射率n
溶液
和溶质浓度c之间具有复杂的非分析性关系。因此,对于溶质与溶剂的每个新组合,测量系统300和600通常测量或检索特异于目标溶质和溶剂的新校准数据组。在一些实施方案中,测量系统300和600可以各自存储多组校准数据,每组校准数据对应于溶质和/或溶剂的不同组合。当控制器312从生物制造系统中的控制/逻辑单元接收到指示要测量溶质与溶剂的特定组合的适当控制信号时,控制器312从存储单元314检索适当的校准数据组,或者测量特异于溶质与溶剂组合的新校准数据组。
[0106]
应该注意,存储的校准数据可以采用多种形式。在一些实施方案中,存储的校准数据包括测量的数据点(c,θ2)。在某些实施方案中,存储的校准数据包括测量的数据点和为方程(13)确定的常数m和b的值两者。相反地,在一些实施方案中,所存储的校准数据仅包括m和b的值;未存储原始数据点。
[0107]
通常,方程(13)中浓度c与折射角θ2之间的关系(其一个例子在图4中示出)在相对高溶质浓度下近似呈线性,并且在相对低溶质浓度下较具非线性。c与θ2之间的关系的确切性质是复函数,并且取决于溶质浓度c的变化引起折射率n
溶液
变化的方式,而这又取决于溶质与溶剂之间的相互作用的特定性质,以及纯溶剂的折射率n
溶剂
。
[0108]
在方程(13)中,假设溶质浓度c与折射角θ2线性相关。然而,如图4所示,此线性关系未必对所有浓度c均成立。因此,尽管出于校准和浓度计算的目,假设c与θ2之间的线性关系很方便,但更通常,在一些实施方案中,还可以假设c为θ2的非线性函数。此外,可以使用各种非线性函数形式将c表示为θ2的函数。例如,在某些实施方案中,c可以被表示为以下中的一个或多个:θ2的多项式函数、θ2的双曲函数、θ2的指数函数、θ2的对数函数以及θ2的三角函数。
[0109]
在对于c与θ2之间的关系假设这些或任何其他非线性函数形式的情况下,控制器312可以使用各种方法,包括例如非线性回归分析,来确定假设的函数形式的可调节参数的适当值。在校准信息中存储测量数据点(c,θ2)的一个有利之处在于是,控制器312可以容易地改变为控制c与θ2之间关系的函数形式的不同假设。如果可以检索测量的数据点,并且如果在校准信息中还不存在新函数形式的参数值,则控制器312可以例如通过对原始测量数据点进行回归分析来确定参数值。任选地,控制器312然后可以通过存储参数值来更新校准信息。
[0110]
作为一个例子,考虑方程(6),其中浓度c是csc(θr)的线性函数。在小角度下,csc(θr)≈1/θr。因此,对于小θr,
[0111]
c≈m/θr b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[14]
[0112]
因此,如果折射角θr较小,则c可以被表示为1/θr的线性函数,其中常数m和b具有以上对于方程(6)所述的值。即,c可以被表示为θr(或θ2)的双曲函数,并且c与1/θr的图可能近似为具有斜率m和y截距b的直线。
[0113]
尽管前面的论述集中于根据测量的折射角θ2确定溶质的浓度c,但是更通常,还可以根据折射角θ2来测量其他参数。例如,在一些实施方案中,可以将溶液的ph确定为折射角的通用函数g:
[0114]
ph=g(θ2)
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[15]
[0115]
通常,ph可以是折射角的线性或非线性函数,并且可以具有本文所述的与浓度c的任何函数形式。此外,方程(15)也可以应用于可以用本文所述的系统测量的其他溶液参数,包括但不限于poh、粘度、张力、渗透压和光散射(例如,光散射强度)。
[0116]
报告信息
[0117]
如上所述,本文公开的测量系统可以用于测量多种溶质-溶剂溶液对的溶质浓度。通常,要进行测量的溶液包括但不限于从色谱柱、生物反应器、储槽和生物制造系统中的其他容器中流出的产物溶液。可替代地或另外地,溶液可以是中间物溶液、流出物或洗脱液,或者来自色谱柱、生物反应器、储槽和生物制造系统中的其他容器的其他液体过程流。
[0118]
可以定量确定浓度信息的特定溶质包括蛋白质、多肽、氨基酸、抗体和各种其他生物分子。在某些实施方案中,目标溶质是重组治疗性蛋白。此类蛋白的例子包括但不限于免疫球蛋白(包括轻链和重链免疫球蛋白、抗体或抗体片段(例如,本文所述的任何抗体片段))、酶(例如,半乳糖苷酶(例如,α-半乳糖苷酶)、美而赞(myozyme)或思而赞(cerezyme))、蛋白质(例如,人促红细胞生成素、肿瘤坏死因子(tnf)或干扰素α或β)或免疫原性或抗原性蛋白质或蛋白质片段(例如,用于疫苗的蛋白质)。重组治疗性蛋白可以是工程改造的抗原结合多肽,其含有至少一个多功能重组蛋白支架(参见例如以下文献中所述的重组抗原结合蛋白:gebauer等人,current opin.chem.biol.13:245-255,2009;和美国
专利申请公开第2012/0164066号(两者均通过引用以其整体并入本文)。作为抗体的重组治疗性蛋白的例子包括但不限于:帕尼单抗(panitumumab)、奥马珠单抗(omalizumab)、阿巴伏单抗(abagovomab)、阿昔单抗(abciximab)、阿克托克单抗(actoxumab)、阿达木单抗(adalimumab)、阿德木单抗(adecatumumab)、阿非莫单抗(afelimomab)、阿芙土珠单抗(afutuzumab)、阿拉西马单抗(alacizumab)、阿拉西马单抗、阿伦单抗(alemtuzumab)、阿里罗单抗(alirocumab)、阿妥莫单抗(altumomab)、阿玛妥昔单抗(amatuximab)、阿玛妥昔单抗、安那莫单抗(anatumomab)、安芦珠单抗(anrukinzumab)、阿博丽珠单抗(apolizumab)、阿西莫单抗(arcitumomab)、阿替奴单抗(atinumab)、托珠单抗(tocilizumab)、巴斯利兹单抗(basilizimab)、贝妥莫单抗(bectumomab)、贝利木单抗(belimumab)、贝伐珠单抗(bevacizumab)、贝索单抗(besilesomab)、贝洛托单抗(bezlotoxumab)、比西单抗(biciromab)、卡那津单抗(canakinumab)、培塞利珠单抗(certolizumab)、西妥昔单抗(cetuximab)、西妥木单抗(cixutumumab)、达克珠单抗(daclizumab)、地诺单抗(denosumab)、迪诺赛单抗(densumab)、依库珠单抗(eculizumab)、依决洛单抗(edrecolomab)、依法利珠单抗(efalizumab)、依芬古单抗(efungumab)、依帕珠单抗(epratuzumab)、厄妥索单抗(ertumaxomab)、依他斯珠单抗(etaracizumab)、芬妥木单抗(figitumumab)、戈利木单抗(golimumab)、替伊莫单抗(ibritumomab tiuxetan)、伊戈伏单抗(igovomab)、依米土珠单抗(imgatuzumab)、英夫利昔单抗(infliximab)、伊诺莫单抗(inolimomab)、英妥珠单抗(inotuzumab)、拉贝珠单抗(labetuzumab)、来瑞组单抗(lebrikizumab)、莫昔土莫单抗(moxetumomab)、那他珠单抗(natalizumab)、阿托珠单抗(obinutuzumab)、奥戈伏单抗(oregovomab)、帕利珠单抗(palivizumab)、帕尼单抗、帕妥珠单抗(pertuzumab)、兰尼单抗(ranibizumab)、利妥昔单抗(rituximab)、托珠单抗(tocilizumab)、托西莫单抗(tositumomab)、曲罗芦单抗(tralokinumab)、图口土珠单抗(tucotuzumab)、曲妥珠单抗(trastuzumab)、维妥珠单抗(veltuzumab)、扎鲁木单抗(zalutumumab)和扎妥昔单抗(zatuximab)。可以测量的重组治疗性蛋白的其他例子包括:阿葡糖苷酶α、拉罗尼酶(laronidase)、阿巴西普(abatacept)、半乳糖苷酶、促黄体素α、抗血友病因子、半乳糖苷酶β、干扰素β-1a、达贝泊汀α(darbepoetin alfa)、替奈普酶(tenecteplase)、依那西普(etanercept)、凝血因子ix、卵泡刺激素、干扰素β-1a、伊米苷酶(imiglucerase)、阿法链道酶(dornase alfa)、阿法依泊汀(epoetin alfa)、胰岛素或胰岛素类似物、美卡舍明(mecasermin)、因子viii、因子viia、抗凝血酶iii、蛋白c、人白蛋白、促红细胞生成素、粒细胞集落刺激因子、粒细胞巨噬细胞集落刺激因子、白细胞介素-11、拉罗尼酶、艾杜硫酶(idursuphase)、半乳糖苷酶、α-1-蛋白酶抑制剂、乳糖酶、腺苷脱氨酶、组织纤溶酶原激活物、促甲状腺激素α(例如,)和阿替普酶(alteplase)。可以测量的重组蛋白的其他例子包括酸性α-葡萄糖苷酶、阿葡糖苷酶α(例如,和)、α-l-艾杜糖苷酶(例如,)、艾杜糖醛酸硫酸酯酶、乙酰肝素n-硫酸酯酶、半乳糖-6-硫酸酯酶、酸性β-半乳糖苷酶、β-葡萄糖苷酸酶、n-乙酰葡糖胺-1-磷酸转移酶、α-n-乙酰半乳糖胺酶、酸性脂肪酶、溶酶体酸性神经酰胺酶、酸性鞘磷脂酶、β-葡萄糖苷酶(例如,和)、半乳糖基神经酰胺酶、α-半乳糖苷酶-a(例如,)、酸性β-半乳糖苷酶、β-半乳糖苷酶、神经氨酸酶、己糖胺酶a和己糖
胺酶b。
[0119]
因为校准数据用于建立溶质浓度(或另一个目标参数)与溶液的折射率之间的分析关系,所以可以使用本文公开的方法和系统实时或近乎实时地确定溶质浓度的值,这对于生物制造过程的反馈和控制很重要。特别地,在一些实施方案中,折射率测量开始与确定溶质浓度的时间之间的经过时间可以是1分钟或更少(例如,30秒或更少、15秒或更少、10秒或更少、5秒或更少、3秒或更少、2秒或更少、1秒或更少)。
[0120]
浓度、ph和任何其他前述类型的信息可以由控制器312传输至生物制造系统内的另一个控制/逻辑单元,以用于各种过程参数和步骤的质量监测和反馈控制。如将在下一章节中更详细地说明,传输的信息可以用于各种目的,包括提高有价值的产物的产量,减少不希望的副产物和废弃物流的产生以及控制作为制造过程的一部分发生的反应的速率。
[0121]
当特别地作为用于连续生物制造的在线测量系统的一部分实施时,本文公开的方法和系统可以实现重要的优点。例如,某些常规的测量技术(诸如uv吸光度和电导率测量)可能会随着时间的流逝而遭受信号衰减/漂移的影响,并且可能需要相对频繁地进行再校准以确保准确性。然而,对于连续的生物制造操作,由于可能需要近乎连续的过程监测,所以频繁间隔的再校准可能非常不便,或甚至是不可能的。相比之下,基于反射的测量和测量系统典型地不会遭受信号衰减/漂移的影响,因此非常适合连续制造应用。
[0122]
与生物制造系统集成
[0123]
本文公开的测量系统可以与生物制造系统集成,以提供对合成过程中各种组件和步骤的反馈控制。如图5所示,测量系统典型地在制造系统的组件之间在线实施,使得能够在无需采样或转移的情况下实时分析流动或静止的溶液。测量系统还可以更常规地用于在进行折射测量之前,从反应容器、储槽或色谱柱提取的样品。
[0124]
生物制造系统中除下文所述以外的方面如美国专利9,650,412、10,071,364和10,087,214中以及美国专利公开us 2018/0051054和us 2020/0063082中所述,所述文献各自的全部内容通过引用并入本文。
[0125]
(a)产物和中间物的纯化
[0126]
用于制造治疗性蛋白药物和其他物质的集成与全连续过程可包括,例如,提供含有基本上无细胞的重组治疗性蛋白的液体培养基,然后将所述液体培养基进料到第一多柱色谱系统(mccs1)中。下一步骤涉及使用mccs1在所述液体培养基中捕获重组治疗性蛋白,然后将含有重组治疗性蛋白的mccs1洗脱液连续进料到第二多柱色谱系统(mccs2)中,并使用mccs2对所述蛋白质进行纯化和精处理。来自mccs2的所得洗脱液被认为是治疗性蛋白药品。所述过程是集成的,并且可以从液体培养基连续运行到来自mccs2的洗脱液(即治疗性蛋白药品)。
[0127]
生物制造系统典型地用于进行上述过程。例如,此类系统可包括mccs1(其包括入口)和mccs2(其包括出口)。在这些系统中,第一mccs与第二mccs彼此处于流体连通。这些系统还被配置为使得流体可被传送进入入口、通过第一mccs和第二mccs,并通过出口离开所述制造系统。
[0128]
此类系统可以从液体培养基中提供连续的、具有时效性的治疗性药品的生产。例如,在将含有治疗性蛋白的流体(例如,液体培养基)进料到第一mccs与从第二mccs的出口洗脱治疗性蛋白药品(含有治疗性蛋白)之间的经过时间可以是例如约4小时与约48小时之
间。
[0129]
图7是显示生物制造系统的例子的示意图。系统1包括第一mccs,即四柱周期逆流色谱系统(pccs)2,其中四柱pccs 2的四个柱中的三个(柱3、4和5)进行从含有重组治疗性蛋白的流体(例如,基本无哺乳动物细胞的液体培养基)中捕获重组治疗性蛋白的单元操作,并且pccs 2的柱中的一个(柱6)进行灭活洗脱液中存在的病毒的单元操作,所述洗脱液来自含有重组治疗性蛋白的pccs 2的柱3、4和5。柱3、4和5可以含有利用蛋白a结合捕获机制的树脂。柱6能够将ph为约3.75的流体保持约1小时。pccs 1还具有入口7。入口7可以是,例如,接受流体进入pccs 1的孔口。
[0130]
系统1还包括第二mccs(其为ppcs 8),所述第二mccs包括三个色谱柱9、10和11以及一个色谱膜12。pccs 8中的柱9、10和11可以含有阳离子交换树脂。pccs 8中的色谱膜12可以含有阳离子交换树脂。pccs 8还具有设置在pccs 8中的柱9、10和11与pccs 8中的色谱膜12之间的流体导管13。pccs 8还具有与流体导管13处于流体连通的在线缓冲剂调节储器14,并且配置为使得容纳于在线缓冲调节储器14内的缓冲剂被引入存在于流体导管13中的流体中。pccs 8还包括出口15。出口15可以是例如允许流体从pccs 8排出的孔口。
[0131]
系统1可还包括设置在pccs 2与pccs 8之间的流体导管16。系统1还可包括与流体导管16处于流体连通的在线缓冲调节储器17,其被配置为使得容纳于在线缓冲调节储器17内的缓冲剂可被引入存在于流体导管16中的流体中。系统1还可包括设置在流体导管16中的过滤器18,以过滤存在于流体导管16中的流体。系统1还可包括断流槽19,所述断流槽被设置在流体导管16中并且被配置为容纳流体导管16中的任何不能容易地进料至pccs 8中的流体。
[0132]
系统1可还包括与入口7处于流体连通的泵系统20。泵系统20可包括用于将流体推入入口7的泵21。系统1还可包括设置在泵21与入口7之间的流体导管22。系统1还可包括设置在流体导管22中的过滤器23,以过滤存在于流体导管22中的流体(例如,液体培养基)。系统1还可包括设置在流体导管22中的断流槽24,其被配置为使得断流槽24与流体导管22处于流体连通并且能够存储存在于流体导管22中的不能进入入口7的任何流体。
[0133]
系统1还可包括生物反应器25和设置在生物反应器25与泵21之间的流体导管26。过滤系统27可以设置在流体导管26中,以对存在于流体导管26中的液体培养基进行过滤(例如,从中除去细胞)。
[0134]
第一mccs(pccs 2)包括入口,通过所述入口,流体(例如,基本上无细胞的液体培养基)可被传送进入第一mccs。所述入口可以是本领域已知的用于此类目的的任何结构。它可包括,例如,允许插入流体导管的螺纹、肋材或密封件,这样使得在将流体导管插到入口中之后,流体将通过入口进入第一mccs而没有大量流体从入口渗出。
[0135]
第一mccs包括至少两个色谱柱、至少两个色谱膜,或者至少一个色谱柱和至少一个色谱膜,以及入口。例如,第一mccs可包括总共四个色谱柱,或者三个色谱柱与一个色谱膜,或本文所述的任何其他的示例性mccs,或者具有本文所述的mccs的任何示例性特征(以任意组合)中的一个或多个。
[0136]
存在于第一mccs中的一个或多个色谱柱和/或一个或多个色谱膜可以含有各种树脂中的一种或多种。例如,包含于在第一mccs中存在的一个或多个色谱柱和/或一个或多个色谱膜中的一个或多个中的树脂可以是利用捕获机制(例如,蛋白a结合捕获机制、蛋白质g
结合捕获机制、抗体或抗体片段结合捕获机制、底物结合捕获机制、辅因子结合捕获机制、适体结合捕获机制、和/或标签结合捕获机制)的树脂。包含于第一mccs的一个或多个色谱柱和/或一个或多个色谱膜中的一个或多个中的树脂可以是阳离子交换树脂、阴离子交换树脂、分子筛树脂或疏水性相互作用树脂、或其任意组合。可用于纯化重组治疗性蛋白的树脂的其他例子是本领域已知的,并且可包含于在第一mccs中存在的一个或多个色谱柱和/或一个或多个色谱膜中的一个或多个中。存在于第一mccs中的一个或多个色谱柱和/或色谱膜可以含有相同的和/或不同的树脂(例如,本文所述的或本领域已知的用于重组蛋白纯化的任何树脂)。
[0137]
存在于第一mccs中的两个或更多个色谱柱和/或色谱树脂可以进行一种或多种单元操作(例如,捕获重组治疗性蛋白、纯化重组治疗性蛋白、精处理重组治疗性蛋白、灭活病毒、调节含有重组治疗性蛋白的流体的离子浓度和/或ph、或过滤含有重组治疗性蛋白的流体)。在非限制性例子中,第一mccs可进行从流体(例如液体培养基)中捕获重组治疗性蛋白并且灭活存在于含有重组治疗性蛋白的流体中的病毒的单元操作。第一mccs可进行本文描述的或本领域已知的两个或更多个单元操作的任意组合。
[0138]
存在于第一mccs中的一个或多个色谱柱和/或一个或多个色谱膜可以通过切换机制(例如,柱切换机制)相对于彼此连接或移动。第一mccs还可包括一个或多个(例如,两个、三个、四个或五个)泵(例如,自动化的,例如自动蠕动泵)。柱切换事件可通过检测经过第一mccs的流体(例如,进入和/或来自第一mccs中的一个或多个色谱柱和/或色谱膜中的一个或多个的输入和/或洗脱液)中的重组治疗性蛋白的水平、特定的液体(例如缓冲剂)体积或特定的经过时间来触发。柱切换通常是指允许mccs中至少两个不同的色谱柱和/或色谱膜(例如,mccs(例如,第一或第二mccs)中存在的两个或更多个不同的色谱柱和/或色谱膜)在过程的至少部分期间基本上同时地通过不同步骤(例如,平衡、装载、洗脱或洗涤)的机制。
[0139]
作为第一mccs的pccs 2可包括四个色谱柱,其中前三个柱进行从流体(例如液体培养基)中捕获重组治疗性蛋白的单元操作,并且pccs的第四个柱进行在含有重组治疗性蛋白的流体中灭活病毒的单元操作。作为第一mccs的pccs可以使用柱切换机制。pcc系统可以利用能够运行多至例如四个、五个、六个、七个或八个柱、或者更多柱的改良的系统(新泽西州皮斯卡塔韦镇ge healthcare(ge healthcare,piscataway,nj))。
[0140]
如上所述,柱切换事件可通过检测流体中特定蛋白质或其他物质的浓度来触发,所述流体从pccs 2或pccs 8的一个柱中洗脱出、流动通过在mccs中的过滤器、包含在mccs的断流槽中、或流动通过mccs中的导管(例如,在mccs 1与mccs 2之间)。本文公开的角分辨折射测量系统可用于测量此类蛋白质的浓度,并将所述浓度信息传输至系统1中的控制器,所述控制器在系统1中启动诸如柱切换、过滤和流体输送的事件。
[0141]
第一mccs可以配备有:一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)角分辨折射测量系统(例如,系统300、600)、一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)阀、一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个、或十个)ph计和/或一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)电导率计。第一mccs还可配备执行操作系统的控制器,所述操作系统利用软件(例如,基于unicorn的软件(新泽西州皮斯卡塔韦镇ge healthcare))来确定何时应发生柱切换(例如,基于从折射测量得到的浓度信息、液体体积或经过时间)并影响(触
发)柱切换事件。角分辨折射测量系统可任选地放置在第一mccs中的一个或多个色谱柱和/或一个或多个色谱膜中的一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)的入口处,和/或在第一mccs中的一个或多个色谱柱和/或一个或多个色谱膜中的一个或多个的出口处。
[0142]
第一mccs可还包括一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个、十个、十一个、十二个、十三个、十四个、十五个、十六个、十七个、十八个、十九个、二十个、二十一个、二十二个、二十三个或二十四个)在线缓冲剂调节储器和/或缓冲剂储器。在其他例子中,第一mccs可包括一个或多个(例如,两个、三个、四个、五个或六个)断流槽,所述一个或多个断流槽可容纳不能容易地进入第一mccs中的一个或多个色谱柱和/或色谱膜的流体。本文所述的系统可在第一和/或第二mccs中含有一个或多个断流槽(例如,本文所述的断流槽)。本文所述的系统的其他例子不包括在第一mccs或第二mccs中的断流槽,或者在整个系统中不包括断流槽。所述系统的其他例子包括在整个系统中最多一个、两个、三个、四个或五个断流槽。
[0143]
第二mccs包括至少两个色谱柱,至少两个色谱膜,或者至少一个色谱柱与至少一个色谱膜,以及出口。例如,第二mccs可包括总共四个色谱柱,三个色谱柱与一个色谱膜,或本文所述的任何其他的示例性mccs,或者可以具有本文所述的mccs的任何示例性特征(以任意组合)中的一个或多个。存在于第二mccs中的一个或多个色谱柱和/或一个或多个色谱膜可具有以下的一种或多种:本文所述的任何形状、尺寸、体积(床体积)和/或单元操作。包含于在第二mccs中存在的一个或多个色谱柱和/或一个或多个色谱膜中的一个或多个中的树脂可以是利用捕获机制(例如,蛋白a结合捕获机制、蛋白质g结合捕获机制、抗体或抗体片段结合捕获机制、底物结合捕获机制、辅因子结合捕获机制、标签结合捕获机制、和/或适体结合捕获机制)的树脂。有用的树脂包括,例如,阳离子交换树脂、阴离子交换树脂、分子筛树脂和疏水相互作用树脂。存在于第二mccs中的一个或多个色谱柱和/或色谱膜可以含有相同的和/或不同的树脂(例如,本文所述的或本领域已知的用于重组蛋白纯化的任何树脂)。
[0144]
存在于第二mccs中的一个或多个色谱柱和/或一个或多个色谱膜可进行一个或多个单元操作(例如,本文所述的任何单元操作或本文所述的单元操作的任何组合)。在非限制性例子中,第二mccs可进行从流体中纯化重组治疗性蛋白并且精处理存在于含有重组治疗性蛋白的流体中的重组治疗性蛋白的单元操作。在其他非限制性例子中,第二mccs可以进行纯化存在于流体中的重组治疗性蛋白、精处理存在于流体中的重组治疗性蛋白、以及过滤含有重组治疗性蛋白的流体的单元操作。在另一个例子中,第二mccs可以进行纯化存在于流体中的重组治疗性蛋白、精处理存在于流体中的重组治疗性蛋白、过滤含有重组治疗性蛋白的流体、以及调节含有重组治疗性蛋白的流体的离子浓度和/或ph的单元操作。第二mccs可进行本文描述的或本领域已知的两个或更多个单元操作的任何组合。
[0145]
第二mccs还可包括一个或多个(例如,两个、三个、四个或五个)泵(例如,自动化的,例如自动蠕动泵)。
[0146]
存在于第二mccs中的一个或多个色谱柱和/或一个或多个色谱膜可以通过切换机制(例如,柱切换机制)相对于彼此连接或移动。柱切换事件可以通过如上所述经由角分辨反射比测量检测重组治疗性蛋白或其他物质的水平以确定通过第二mccs的流体(例如,进
入和/或来自第二mccs中的一个或多个色谱柱和/或色谱膜中的一个或多个的输入物和/或洗脱液)中的重组治疗性蛋白的水平)、特定的液体(例如缓冲剂)体积或特定的经过时间来触发。
[0147]
形成第二mccs的pccs 8可以含有三个柱(进行从流体中纯化重组治疗性蛋白的单元操作)和一个色谱膜(进行精处理在流体中存在的重组治疗性蛋白的单元操作)。例如,进行从流体中纯化重组治疗性蛋白的单元操作的三个柱可以含有例如阳离子交换树脂,并且进行精处理的单元操作的色谱膜可以含有阳离子交换树脂。作为第二mccs的pccs可以使用柱切换机制。例如,pccs可利用能够运行多至例如四个、五个、六个、七个或八个柱、或者更多柱的改良的系统(新泽西州皮斯卡塔韦镇ge healthcare)。
[0148]
与第一mccs类似,第二mccs还可以配备有:一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)角分辨折射测量系统(例如,系统300和/或600)、一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)阀、一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个、或十个)ph计和/或一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)电导率计。一个或多个角分辨折射测量系统将测量的流体中蛋白质或其他物质的浓度信息传输至控制器,所述控制器使用浓度信息来确定是否触发柱切换事件。第二mccs可配备由接收浓度信息的控制器执行的操作系统,所述操作系统利用软件(例如,基于unicorn的软件,新泽西州皮斯卡塔韦镇ge healthcare)来确定何时应发生柱切换事件(例如,基于角分辨折射测量、液体体积或经过时间)并启动柱切换事件。在第二mccs包括一个或多个角分辨折射测量系统的例子中,折射测量系统可任选地放置在第二mccs中的一个或多个色谱柱和/或一个或多个色谱膜中的一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)的入口处,和/或在第二mccs中的一个或多个色谱柱和/或一个或多个色谱膜中的一个或多个的出口处。
[0149]
第二mccs可还包括一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个、十个、十一个、十二个、十三个、十四个、十五个、十六个、十七个、十八个、十九个、二十个、二十一个、二十二个、二十三个或二十四个)在线缓冲剂调节储器和/或缓冲剂储器。在其他例子中,第二mccs可包括一个或多个(例如,两个、三个、四个、五个或六个)断流槽(例如,本文所述的任何断流槽),所述一个或多个断流槽可容纳不能容易地进入第二mccs中的一个或多个色谱柱和/或色谱膜的流体。
[0150]
第二mccs包括出口,治疗性蛋白药品可以通过所述出口离开系统。出口可包括,例如,允许插入流体导管的螺纹、肋材或密封件,或设计用于容纳或储存治疗性蛋白药品的小瓶。出口可以含有可用于将无菌小瓶或其他此类储存容器密封在出口上的表面,以允许重组蛋白药物产物直接流入无菌小瓶或储存容器中。
[0151]
如本文所公开的一个或多个角分辨折射测量系统也可以被定位为测量流出出口的蛋白质药品(或另一种物质)的浓度。此信息可被传输至mccs控制器,所述控制器可以基于所述信息确定所述物质的纯度。
[0152]
本文描述的系统还可包括设置在第一mccs与第二mccs之间的流体导管。可沿流体导管设置一个或多个角分辨折射测量系统,以确定关于容纳于(例如流动通过)导管内的流体的信息(例如浓度信息)。此信息可被传输至mccs控制器,所述控制器如上所讨论可以基于所述信息确定是否启动柱切换事件。
[0153]
本文所述的任何流体导管可以是例如由例如聚乙烯、聚碳酸酯或塑料制成的管。设置在第一mccs与第二mccs之间的流体导管可以还包括以下任何组合中的一个或多个:一个或多个在线缓冲剂调节储器,其与流体导管处于流体连通并且被定位为使得储存于一个或多个在线缓冲剂调节储器中的缓冲剂被添加到存在于流体导管中的流体中;断流槽(例如,本文所述的任何一个或多个断流槽),其与流体导管处于流体连通并且被定位为使得其可以容纳存在于流体导管中的不能容易地进料到第二mccs的任何多余流体;以及一个或多个过滤器,其被设置于流体导管中使得它们能够对存在于流体导管中的流体进行过滤(例如,除去细菌)。任何在线缓冲剂调节储器可以含有例如体积是约0.5l至50l之间的缓冲剂(例如,在25℃、15℃或10℃或低于25℃、15℃或10℃的温度下)。
[0154]
本文所述的系统可任选地包括设置在第二mccs中的最终色谱柱或色谱膜与出口之间的流体导管。本文所述的系统可以还包括一个或多个过滤器,所述一个或多个过滤器与设置在第二mccs中的最终色谱柱或色谱膜与出口之间的流体导管处于流体连接,使得过滤器可以从存在于流体导管中的流体除去例如沉淀材料、微粒物质或者细菌,所述流体导管设置在第二mccs中的最终色谱柱或色谱膜与出口之间。
[0155]
本文提供的系统的一些例子还包括与第一mccs的入口处于流体连接的生物反应器。本文所述或本领域中已知的任何示例性生物反应器都可以用于本发明的系统中。
[0156]
本文提供的系统的一些例子还包括泵系统。泵系统可以包括以下中的一个或多个:一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)泵(例如,本文所述或本领域中已知的任何泵),一个或多个(例如,两个、三个、四个或五个)过滤器(例如,本文所述或本领域中已知的任何过滤器),一个或多个(例如,两个、三个、四个、五个、六个、七个、八个、九个或十个)uv检测器,以及一个或多个(例如,两个、三个、四个或五个)断流槽(例如,本文所述的任何断流槽)。本文提供的系统的一些例子还包括设置在泵与第一mccs的入口之间的流体导管(例如,本文所述的或本领域已知的任何示例性流体导管)。在一些例子中,此特定流体导管可包括一个或多个(例如,两个、三个或四个)泵(例如,本文所述的或本领域已知的任何泵)和/或一个或多个(例如,两个、三个或四个)断流槽(例如,本文所述的任何示例性断流槽),其中这些泵和/或断流槽与存在于流体导管中的流体处于流体连接。
[0157]
本文所述的系统的一些例子还包括连接至在泵与入口之间的流体导管的另一个流体导管,其中另一个流体导管的一端流体地连接至生物反应器,并且另一端流体地连接至在泵与入口之间的流体导管。此另外的流体导管可包括过滤器,所述过滤器能够从取自生物反应器(例如,atf细胞保留系统)的液体培养基中除去细胞。
[0158]
前述生物制造系统允许连续生产治疗性蛋白药品。例如,本文提供的系统允许重组治疗性蛋白(自起始材料,例如起始液体培养基)的产率百分比大于约70%、大于约80%、大于约82%、大于约84%、大于约86%、大于约88%、大于约90%、大于约92%、大于约94%、大于约96%、或大于约98%。本文所述的系统还可导致重组治疗性蛋白(自起始材料,例如起始液体培养基)的产率百分比为约80%至约90%之间、约82%至约90%之间、约84%至约90%之间、约84%至约88%之间、约84%至约94%之间、约82%至约92%之间、或约85%至约95%之间。
[0159]
本文描述的系统还可导致如下治疗性蛋白药品的产生,其含有的重组治疗性蛋白
的浓度大于约1.0mg/ml、大于约1.5mg/ml、大于约2.0mg/ml、大于约2.5mg/ml、大于约3.0mg/ml、大于约3.5mg/ml、大于约4.0mg/ml、大于约4.5mg/ml、大于约5.0mg/ml、大于约5.5mg/ml、大于约6.0mg/ml、大于约6.5mg/ml、大于约7.0mg/ml、大于约7.5mg/ml、大于约8.0mg/ml、大于约8.5mg/ml、大于约9.0mg/ml、大于约10.0mg/ml、大于约12.5mg/ml或大于约15.0mg/ml。
[0160]
如上所述,在一些实施方案中,第一和/或第二mccs可以是周期性逆流色谱系统(pccs)。pccs可以例如包括两个或更多个色谱柱(例如,三个柱或四个柱),将其切换以允许从两个或更多个色谱柱连续洗脱重组治疗性蛋白。pccs可包括两个或更多个色谱柱,两个或更多个色谱膜,或者至少一个色谱柱与至少一个色谱膜。柱操作通常由装载、洗涤、洗脱以及再生步骤组成。在pccs中,将多个柱用于以循环方式离散地且连续地运行相同的步骤。由于柱是串联操作的,因此经过一个柱的流和来自所述柱的洗液由另一个柱捕获。pccs的此独特特征允许树脂的装载接近其静态结合能力而不是动态结合能力,这在分批模式色谱过程中是典型的。
[0161]
用于含有三个柱的pccs中的三柱切换技术的例子显示于图8。一个循环被定义为三个完整的柱操作,其产生来自柱切换技术中使用的三个柱中的各个的洗脱池。一旦完成循环中的所有步骤,循环重新开始。由于连续循环与洗脱,进入pccs的流体被连续地处理,而重组治疗性蛋白从各个柱的洗脱是离散的和周期性的。
[0162]
为了从pccs循环中的一个步骤前进到另一个步骤,诸如图8中所显示的示例性循环,采用柱切换策略。柱切换方法在图8所显示的示例性pccs系统的三柱中采用每柱两个自动切换操作,其中第一个与初始产物穿透有关,而第二个与柱饱和相符。确定何时应发生柱切换操作是基于关于在来自pccs的各个色谱柱的洗脱液中重组治疗性蛋白的浓度的信息。
[0163]
如以上所讨论的,本文公开的角分辨折射测量系统可用于确定来自pccs柱的洗脱液中重组治疗性蛋白的浓度。浓度信息,其作为生物制造系统的反馈控制而发挥作用,被传输至mccs控制器,所述控制器在确定切换被授权之后启动柱切换。
[0164]
例如,在柱装载(步骤1;图3)期间,所述pcc控制系统可以使用上述角分辨折射测量系统确定从柱洗脱的治疗性蛋白物质的基线浓度(其典型地为零浓度)。在活性洗脱期间,当蛋白质物质穿透(步骤2;图3)时,测量的蛋白质浓度增加(例如,高于基线浓度)。系统继续监测渐增的蛋白质浓度,并且当浓度达到预定的阈值时,来自柱1的流被引导到柱2上而不是到废弃物。名义上,这发生在时间t1。
[0165]
随着继续向柱1内进料,柱1最终几乎被蛋白质产物饱和。此时,测量的洗脱液中蛋白质浓度已达到另一个预定值,其发生在时间t2。此时,mccs控制器将入口进料切换到柱2。
[0166]
无论进料产物浓度和容量如何,上述柱切换策略都允许对柱进行均匀装载。可以基于检测到的在来自各个柱的洗脱液中的重组蛋白水平实施柱的类似切换。柱切换还可以基于通过第一或第二mccs中的一个或多个色谱柱和/或色谱膜的流体(例如,缓冲剂)的经过时间或量。
[0167]
本文公开的角分辨折射测量系统除了提供反馈信息以控制柱切换事件之外,还可以提供用于调节各种其他生物制造步骤和操作参数的反馈信息。此类调节的一个例子是在生物制造过程的各个阶段控制性调节缓冲剂浓度。
[0168]
通常,在本文所述的任何过程中使用两个或更多个mccs期间,可采用一个或多个
(例如,三个、四个、五个、六个、七个、八个、九个、十个、十一个、十二个、十三个、十四个、十五个、十六个、十七个、十八个、十九个、二十个、二十一个、二十二个、二十三个或二十四个)不同类型的缓冲剂。如本领域已知的,在本文所述的过程中使用的用于两个或更多个mccs中的一种或多种类型的缓冲剂将取决于:存在于所述两个或更多个mccs(例如,第一mccs和第二mccs)的一个或多个色谱柱和/或一个或多个色谱膜中的树脂,重组治疗性蛋白,和单元操作(例如,本文所述的任何示例性单元操作)-其通过所述两个或更多个mccs的特定的一个或多个色谱柱和/或一个或多个色谱膜进行。在本文所述的任何过程中使用两个或更多个mccs期间,所采用的缓冲剂的体积和类型也可以由本领域技术人员确定(例如,下面将更详细地讨论)。例如,可以选择在本文所述的任何过程中使用两个或更多个mccs期间所采用的缓冲剂的体积和一个或多个类型,以优化重组蛋白药物产物中的以下中的一个或多个:重组治疗性蛋白的总产量、重组治疗性蛋白的活性、重组治疗性蛋白的纯度水平、以及从含有重组治疗性蛋白的流体中除去生物污染物(例如,不存在活性病毒、分枝杆菌、酵母菌、细菌或哺乳动物细胞)。
[0169]
调节含有重组治疗性蛋白的流体的离子浓度和/或ph的单元操作可以使用mccs(例如,第一和/或第二mccs)来进行,所述mccs包括并利用缓冲剂调节储器(例如,在线缓冲剂调节储器)以将新的或另外的缓冲溶液添加到含有重组治疗性蛋白的流体中(例如在单个mccs中的柱之间,或在倒数第二个mccs(例如第一mccs)中的最后一个柱之后并且在将含有重组治疗性蛋白的流体进料至下一个mccs(例如第二mccs)的第一个柱之前。在线缓冲剂调节储器可以是任何尺寸(例如,大于100ml)并且可以含有任何缓冲溶液(例如具有以下中的一个或多个的缓冲溶液:与含有重组治疗性蛋白的流体相比升高或降低的ph;与含有重组治疗性蛋白的流体相比增加或减少的离子(例如盐)浓度;和/或增加或减少的试剂浓度,所述试剂与重组治疗性蛋白竞争地结合于存在于mccs(例如第一或第二mccs)的至少一个色谱柱或至少一个色谱膜中的树脂)。
[0170]
(b)上游鉴别、验证和定量测量
[0171]
角分辨折射测量也可以用于上游(即,在获得经纯化产物之前)连续生物制造操作中。例如,在一些实施方案中,目标溶质包括用于维持色谱柱和生物反应器内特定ph范围的缓冲溶液的组分。这些缓冲溶液组分的浓度也可以定量确定。另外,在定量缓冲溶液组分时,控制器312还可以计算与测量的溶液有关的其他信息,包括溶液的ph值(即,基于缓冲剂组成)。
[0172]
在一些实施方案中,mccs控制器确定添加到过程流体中的缓冲溶液的量是基于关于从如前面所讨论的进行角分辨折射测量得到的过程流体组分的浓度信息。例如,用于此类测量的溶质可以是缓冲溶液组分或过程流体组分,其浓度与流体缓冲剂组成、过程流体的ph、和/或过程流体的离子强度有关。将组分的浓度信息的测量作为反馈信息提供给mccs控制器,其使用反馈信息来确定将一种或多种缓冲溶液在何时和以多少量排放到过程流体中。角分辨折射测量系统通常可以被定位在生物制造系统中的任何位置(图7),来测量过程流体以向mccs控制器提供与缓冲剂相关的反馈信息。
[0173]
在某些实施方案中,角分辨折射测量可以用于涉及一种或多种缓冲溶液的在线稀释、掺合和/或调节操作中使用。例如,对于涉及缓冲溶液的质量控制验证的操作,可以在掺合组分以形成缓冲溶液之前使用此类测量来验证缓冲溶液组分的身份。类似地,在将溶液
引入进料流,与其他溶液掺合,注入生物反应器中或以其他方式引入连续生物制造系统之前,可以使用此类测量验证一种或多种所制备的缓冲溶液的身份。
[0174]
还可以在将缓冲溶液引入色谱柱以分离和/或纯化分析物、中间物和废弃物之前,使用角分辨折射测量进行缓冲溶液鉴别。
[0175]
还可以通过角分辨折射测量对除缓冲剂以外的其他组分进行引入此类系统的组分的身份验证。此类组分包括但不限于消泡剂、各种类型的反应器营养物和泊洛沙姆(poloxamer)(例如pluronics、synperonics和/或kolliphor)。
[0176]
为了验证上述缓冲剂组分、缓冲溶液和其他组分的身份,典型地将角分辨折射测量值与各种物质的存储信息(例如,库或数据库记录)比较。典型地,例如,库记录包括一组校准信息,其包括折射角和相应的物质浓度。物质身份的验证可以通过证实在一个或多个测量波长下测量的折射角对应于其库记录中与所述物质相关的角(或角的范围)来进行。此类验证可以由本文所述的系统自动进行,当特定物质的身份未被验证(例如,验证过程失败)时,所述系统还可以产生警报消息(或执行其他控制功能)。
[0177]
除了验证缓冲剂组分、缓冲剂和其他组分的身份以外,角度分辨折射测量还可以提供上述这些分析物的浓度信息。此浓度信息可以用于各种在线稀释、掺合和调节过程,所述过程在各个点将缓冲剂、试剂和其他物质引入生物制造系统中。例如,在一些生物制造系统中,使用具有流量调节器的一个或多个定量泵和/或流量计动态地掺合缓冲剂组分以形成缓冲溶液,然后将所述缓冲溶液引入生物反应器中的进料流中。除了如上所述验证掺合组分的身份以外,角分辨折射测量还向调节定量泵的控制器提供反馈信号以组合合适量的每种组分而产生按需构成的掺合缓冲溶液。例如,可以在执行掺合操作之前,对缓冲剂组分的储备溶液进行测量以确定每种组分的浓度。
[0178]
在某些实施方案中,还可以使用角分辨折射测量在掺合或稀释操作期间获得组分的浓度信息,所述掺合或稀释操作涉及其他物质,包括但不限于生长培养基和营养物,诸如铁。如上所述,掺合和/或稀释溶液中这些物质的身份和浓度可以在将溶液引入生物反应器的进料流之前验证。
[0179]
例如,在灌注生物反应器中,介质进料在制造运行过程中是连续的。角分辨折射测量可以用作反馈回路的一部分,以调节随时间推移引入进料流中的生长培养基的量。生长培养基的储备溶液可以由控制器计量(例如,通过定量泵或流量调节器),并与水和/或其他组分组合以产生用于递送到生物反应器中的进料流。生长培养基溶液的计量可以由与泵或调节器连接的控制器进行,所述控制器接收关于从角分辨折射测量得到的进料流中生长培养基浓度的信息。
[0180]
除了证实进料流中生长培养基的浓度以外,此类测量还可用于动态调节随时间推移递送至生物反应器的生长培养基的量。例如,随着反应器中细胞群体的增加,可以使用角分辨折射测量来增加递送至反应器中以支持更大细胞数量的生长培养基的量。
[0181]
在一些实施方案中,可以使用角分辨折射测量提供反馈信号,以在产物过滤操作期间选择过滤器。例如,某些反应产物可以进行渗滤和/或超滤过程(例如,连续渗滤过程),其中使用一个或多个分子大小选择性过滤器将生物反应器产物流中的反应中间物或产物与反应副产物和其他物质分离。如上述进行的角分辨折射测量可用于鉴别反应产物或中间物,并确定一个或多个过滤器的一侧或两侧上这些物质的浓度。例如,此类测量可用于证实
已达到目标缓冲剂、盐和/或产物浓度。可替代地或另外地,可以基于在一个或多个过滤器的一侧或两侧上所测量的物质的浓度来调节(例如,插入溶液流动路径或从溶液流动路径去除)一个或多个过滤器,以促进产物、缓冲剂和盐组分的目标浓度的实现。
[0182]
如上所述,可以在将储备溶液、组分和其他试剂掺合以形成递送至生物反应器中和/或生物反应器下游的一个或多个纯化单元中的进料流溶液之前,使用角分辨折射测量来测量这些物质的浓度。由于储备溶液浓度的可变性(这是相对常见的),所以当在涉及储备溶液和其他物质的掺合操作期间将测量的浓度值用于定量泵和/或流量调节器的反馈控制时能实现对最终溶液中组分浓度的更精确控制。
[0183]
角分辨折射测量特别适合于控制此类操作,因为可以以相对高的速度进行此类测量,并且无需进行常规校准。此类方法特别适用于校准相关的停机时间不适宜的连续生物制造操作。相比之下,替代测量方法诸如ph检测和电导率监测典型地展现出校准漂移(例如,ph检测系统可能需要每天再校准),和/或可能不够灵敏,无法确定一些物质的身份和浓度。此外,已经观察到一些盐溶液可以有效地“遮盖”某些ph和电导率传感器,因此在某些生物制造条件下很难使用。
[0184]
更进一步地,某些ph传感器包括电解质溶液,并且当此种传感器用于在线监测时,电解质溶液可能泄漏至传感器所位于的过程流中,从而污染所述流并导致测量不准确。一些ph传感器还具有特定的储存要求(诸如浸入式储存在溶液中),因此在不使用传感器或在活化传感器以进行测量时,可能需要系统操作者采取干预步骤。根据上述系统和方法进行的角分辨测量不涉及电解液泄漏或活化或停用传感器的干预步骤。
[0185]
可以使用基于电导率的测量来确定缓冲剂组分的浓度。但是,此类测量可能与温度高度相关,并且已经观察到,对于某些缓冲剂,甚至1℃的温度变化也可能导致电导率变化超过数量级。为了抵消此类变化,一些基于电导率的测量技术使用温度补偿值来调节电导率测量。但是,此类值典型地仅适用于溶液的单个组分。因此,通常将一组此类值用于多组分溶液,并且所述组的值根据温度与理想或基线测量温度的偏差而变化。根据上述系统和方法进行的角分辨测量不受此类温度变化影响,因此,不需要使用复杂的温度补偿校准值来调节测量值。代替地,此类测量值可以与不依赖温度的一组校准数据一起使用,以产生多种不同分析物的浓度值。
[0186]
还可以使用角分辨折射测量来提高效率,并降低生物制造系统中某些操作步骤的成本。例如,如上所述,可以在产生产物之后,将携带一种或多种产物的产物流从生物反应器引导至一个或多个色谱柱以进行纯化和表征。向此过程中使用的柱装载产物流(或来自另一个柱的洗脱液流),并且使所述流的组分依次从柱分离和洗脱。柱的生产率曲线通常先上升,然后随着时间推移而下降,因为柱先进行装载,然后洗脱。
[0187]
在此类操作期间,典型地可以将柱装载至容量的约80%,以确保流中的一种或多种产物不会从柱的下游(即,洗脱)端倾卸。但是,这会降低整个过程的效率,因为柱装载容量的约20%未使用。此外,相对于柱装载得更接近其全容量时将要使用的缓冲剂的量,会使用额外量的在洗脱过程中使用的任何缓冲剂。
[0188]
可以使用动态角分辨折射测量来监测柱下游端的产物浓度,以增加柱中的负荷,从而提高纯化过程的效率。可以使用浓度测量来向调节产物流进料速率的泵或流量调节器提供反馈信号,以便当在柱的下游端检测到产物时,可以停止流的进料。在下游端检测到产
物时,柱即已装载至其有效容量,这确保使用柱标称装载容量的最大部分。
[0189]
更进一步地,可以使用柱暂时最大装载终点的检测通过在柱装载(并且在某些应用中平衡)后使缓冲溶液和其他物质流过柱,而触发柱的产生。以此方式,可以减少纯化等待时间,并且可以更有效地纯化衍生自产物流的产物。
[0190]
硬件和软件实施
[0191]
控制器312可以包括一个或多个处理器、一个或多个存储单元以及用于与本文所述系统的其他组件互连的一个或多个接口。接口可以包括有线和/或无线接口,以用于接收信息并向系统的组件以及本文所述的其他组件和设备传输信息和控制指令。如图5所示,控制器312与存储单元370连接。
[0192]
一个或多个处理器可以处理用于在控制器内执行的指令,包括存储在一个或多个存储单元中和/或在存储单元370中的指令。例如,指令可以指示一个或多个处理器执行本文公开的任何分析和控制步骤。
[0193]
一个或多个存储单元可以存储用于一个或多个处理器的可执行指令、关于系统参数的信息以及测量的信息,诸如测量的折射和/或反射角信息以及测量的折射和/或反射光强度。存储单元370可以是计算机可读介质,诸如软盘设备、硬盘设备、光盘设备或磁带设备、闪存或其他类似的固态存储设备或者一系列设备,包括存储区域网络或其他配置中的设备。存储单元370可以存储可以由上述一个或多个处理器执行的指令,以及可以由一个或多个存储单元存储的任何其他信息。
[0194]
在一些实施方案中,控制器312可以包括图形处理单元,以在外部输入/输出设备上显示图形信息(例如,使用gui或文本界面)。图形信息可以由显示设备(例如,crt(阴极射线管)或lcd(液晶显示器)监测器)显示,以显示本文公开的任何信息。用户可以使用输入设备(例如,键盘、定点设备、触摸屏、语音识别设备)来向控制器312提供输入。
[0195]
本文所述系统的用户可以经由输入设备向控制器312提供各种不同类型的指令和信息。指令和信息可以包括例如校准信息、关于系统正在测量的一个或多个参数的信息以及关于用于使测量角度与参数相关的模型的信息。控制器312可以使用这些各种类型的信息中的任一种来执行本文所述的方法和功能。还应该注意,这些类型的信息中的任一种均可以被存储(例如,在存储单元370中)并在需要时被控制器312调用。
[0196]
本文所述的方法、步骤和功能可以由控制器312通过执行可由控制器312执行和/或解释的一个或多个计算机程序中的指令来实施。这些计算机程序(也称作程序、软件、软件应用或代码)包括用于可编程处理器的机器指令,并且可以用高级程序和/或面向对象的编程语言、和/或汇编/机器语言实施。例如,计算机程序可以含有如下指令,所述指令可以存储在一个或多个存储单元中、存储单元370中和/或有形计算机可读介质上,并由上述控制器312的一个或多个处理器执行。如本文所用,术语“计算机可读介质”是指任何计算机程序产品、装置和/或设备(例如,磁盘、光盘、存储器、可编程逻辑设备(pld)、asic和电子电路),其用于将机器指令和/或数据提供给可编程处理器,包括接收机器指令的机器可读介质。
[0197]
可替代地或另外地,本文所述的方法、步骤和功能可以通过特别配置为执行所述方法、步骤和功能的电子电路和电路元件以硬件的方式全部或部分地实施。电路和电路元件可以是可编程的或非可编程的。例如,在某些实施方案中,电路可以是应用专用集成电路
(asic)。
[0198]
其他实施方案
[0199]
已经描述了多个实施方案。然而,本领域普通技术人员应理解,其他实施方案也属于本公开文本和以下权利要求书的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。