一种丹酚酸a的制备方法
技术领域
1.本发明涉及药物制备领域,具体涉及一种丹酚酸a的制备方法。
背景技术:
2.丹酚酸a(salvianicacid a)是唇形科植物丹参药材中所含的一种水溶性酚酸类化合物,在药材中含量极低,最早由黎莲娘教授于1984年从丹参中分离得到(li lian-niang,etal.planta medica,1984,50:227)。丹酚酸a是目前已知的最强的抗氧化性化合物之一,在抗氧化、心肌缺血保护、抗血栓、神经保护、抗肝纤维化、防治糖尿病等多个方面具有广泛的药理活性(杜冠华,裘月,张均田.丹酚酸a对大鼠心肌缺血再灌注性损伤的保护作用[j].1995,(10):731;任梓华.丹酚酸a的药理作用研究进展[j].医学信息,2013(1):322-322等)。其结构式如下:
[0003][0004]
现有大量关于丹酚酸a制备方法的专利和文献,如:1)cn101041620a公开的丹参丹酚酸a的制备方法,其丹酚酸a为从药材中提取后直接进行纯化所得,该法由于药材中丹酚酸a含量极低,此法制备所得最终产品纯度偏低,生产成本较高,且萃取溶剂选用的多为二类溶剂,存在安全性隐患,上述因素均不利于工业化生产及制备。2)cn103570548a公开的一种丹酚酸a的制备方法,此工艺解决了丹酚酸a来源问题,但由于提取液未经醇沉纯化除杂直接进行加热反应,存在如下不利因素:提取液中含有蛋白质、胶体及多糖等物质,加热反应会与丹酚酸a结合,增加后续分离难度,减少后续色谱填料使用寿命,从而增加生产成本。3)cn103242161a公开的一种制备丹酚酸a的方法中对加热反应生产丹酚酸a的途径及条件未做深入的研究,且最终制备得到的丹酚酸a纯度仅达到90%,远远低于现在新药研究过程中对原料药的要求。4)cn103044251a,该方法转化过程中加入催化剂(如氯化锌),丹酚酸a采取微波真空干燥,且采用了聚酰胺纯化,聚酰胺是一种高分子化合物,多为粉末状物质。颗粒大小不均一,使用前多需要滤去细粉并进行活化处理去除产品自身残留的杂质,使用过程较复杂,不利于产业化生产。
[0005]
综上所述,现有技术中,虽然有的丹酚酸a的提取和收率有一定的提高,但仍存在分离纯化难度大、操作繁琐且不利于工业化/产业化生产、成本高、最终成品纯度及含量偏低的问题。
技术实现要素:
[0006]
为了克服现有技术的不足,本发明提供一个低成本、分离纯化简单,易于操作、利于工业化生产,最终得到高含量、高纯度的丹酚酸a的制备方法。
[0007]
本发明提供一种高纯度、高含量的丹酚酸a的制备方法,包括如下步骤:
[0008]
(1)中低压树脂纯化步骤:取丹酚酸a转化液,以1cv
·
h-1
~3cv
·
h-1
的流速通过已处理合格的苯乙烯型大孔吸附树脂柱,树脂用量为m
丹酚酸a
:m
大孔吸附树脂
=1:35~1:60,径高比=1:5~1:10。以2cv
·
h-1
~4cv
·
h-1
流速,依次用水洗脱3~5cv,15~30%酸性乙醇(ph=2.5~3.5)洗脱8~12cv,35~55%酸性乙醇(ph=2.5~3.5)洗脱4~8cv,分流份收集35~55%酸性乙醇洗脱液,hplc检测各流份纯度,合并纯度≥80%流份,得大孔吸附树脂纯化液;
[0009]
(2)丹酚酸a萃取步骤:取步骤(1)大孔吸附树脂纯化液,减压浓缩,用叔丁基甲基醚或乙酸乙酯萃取,得萃取液;
[0010]
(3)正相硅胶纯化:将步骤(2)的萃取液浓缩至含丹酚酸a浓度150mg/ml~250mg/ml,与硅胶拌样后,装入硅胶柱层析,采用环己烷:叔丁基甲基醚混合溶剂梯度洗脱,得正相硅胶纯化液;
[0011]
(4)结晶:将步骤(3)的正相硅胶纯化液浓缩,加水溶解,浓缩至溶液中丹酚酸a浓度为100mg/ml~300mg/ml,调ph值至3.5~3.8,样品置(0~15℃)环境中,静置析晶,滤过,得一次结晶粗品;
[0012]
(5)重结晶:将步骤(4)的一次结晶粗品重结晶纯化:
[0013]
(6)萃取、浓缩、干燥:将步骤(5)所得结晶加水溶解,边搅拌边滴加10%~20%酸溶液,调ph值至1.5~3.0;用叔丁基甲基醚萃取数次(例如3次),合并萃取液,即得结晶萃取液;减压浓缩、冷冻真空干燥。
[0014]
优选的,丹酚酸a转化液经丹酚酸b提取、醇沉、丹酚酸b转化步骤制得;
[0015]
更优选的,其中:
[0016]
(a)提取:取丹参药材,破碎,过筛,加水75~85℃温浸,提取2-4次(例如3次,加水量6-10倍),得丹酚酸b提取液;或取丹参药材,破碎,过筛,加20-40%乙醇回流提取,得丹酚酸b提取液;
[0017]
和/或,(b)醇沉:取步骤(1)中提取液,在t≤65℃下(例如50℃~60℃)减压浓缩至浸膏相对密度1.10~1.15(优选1.10~1.15),合并浓缩液;加90~95%乙醇调溶液中乙醇浓度70%~75%,10℃~35℃下静置醇沉24h以上,过滤,滤液减压浓缩至溶液中乙醇浓度≤5%,得醇沉浓缩液;
[0018]
和/或,(c)转化步骤:取步骤(2)醇沉浓缩液,加纯化水稀释至丹酚酸b浓度约5~30mg/ml(优选5~15mg/ml),调ph至3.5~4.0,在110~130℃下反应2.5~4.5h,冷却,离心,得丹酚酸a转化液。
[0019]
优选的,步骤(1)中,苯乙烯型大孔吸附树脂为hpd-100s、lx-1180、d101b、hpd-300、d101-i或hpd-600,优选填料粒径为0.30~1.25mm,耐压为2~10bar(优选2~5bar);
[0020]
优选的,步骤(1)中,丹酚酸a转化液的浓度为1.59mg/ml~6.56mg/ml;
[0021]
优选的,步骤(1)中,丹酚酸a转化液的上样流速为1cv速为-1
~2cv
·
h-1
;
[0022]
优选的,步骤(1)中,洗脱液流速为2cv流速-1
~3cv
·
h-1
;
[0023]
优选的,步骤(2)中,取丹酚酸a大孔吸附树脂纯化液,在t≤85℃下减压浓缩至溶
液乙醇浓度≤15%,用叔丁基甲基醚萃取多次,合并萃取液,除水;
[0024]
更优选的,用叔丁基甲基醚萃取三次,和/或加无水硫酸钠静置除水2h以上。
[0025]
优选的,步骤(3)中,纯化时采用的硅胶为300~400目,粒径为40~150μm(优选40~60μm,更优为40~45μm),压力500~1500bar(优选800~1200bar);
[0026]
优选的,步骤(3)中,拌样硅胶用量满足:m
丹酚酸a
:m
硅胶
为1:2.0~1:3.0(优选1:2.0~1:2.5),柱层析硅胶用量满足:m
丹酚酸a
:m
硅胶
为1:10~1:50,优选为1:15~1:20;
[0027]
优选的,步骤(3)中,环己烷:叔丁基甲基醚混合溶剂的体积比为6:4~2:8,优选5:5~3:7;
[0028]
优选的,步骤(3)中,梯度洗脱为:依次用环己烷:叔丁基甲基醚(5:5~4:6)洗脱8~12cv,环己烷:叔丁基甲基醚(4:6~3:7)洗脱4~8cv,流速2.5cv
·
h-1
~7.5cv
·
h-1
,分流份收集环己烷:叔丁基甲基醚(4:6~3:7)洗脱液。
[0029]
优选的,步骤(3)为:将步骤(2)的萃取液在t≤50℃下减压浓缩至丹酚酸a浓度为130mg/ml~250mg/ml(优选150-210mg/ml),用m
丹酚酸a
:m
硅胶(300-400目)
=1:2~1:3.0(优选1:2~1:2.5)与硅胶进行拌样,取拌样硅胶装柱,硅胶柱层析用量m
丹酚酸a
:m
硅胶(300-400目)
为1:15~1:20,依次用环己烷:叔丁基甲基醚(5:5~4:6)洗脱8~12cv,环己烷:叔丁基甲基醚(4:6~3:7)洗脱4~8cv,流速2.5cv
·
h-1
~7.5cv
·
h-1
,分流份收集环己烷:叔丁基甲基醚(4:6~3:7)洗脱液,hplc检测各流份纯度,合并丹酚酸a纯度≥90%,得丹酚酸a正相硅胶纯化液;
[0030]
优选的,步骤(4)中,丹酚酸a浓度为100mg/ml~300mg/ml,优选为150mg/ml~250mg/ml;
[0031]
优选的,步骤(4)中,ph调节剂为选自葡甲胺、碳酸氢钠、碳酸钠、碳酸氢钾、碳酸氢镁、碳酸镁、氢氧化钙、碳酸氢钙、碳酸钙中的一种或多种,优选碳酸氢钠;
[0032]
优选的,步骤(4)中,静置析晶12h以上;
[0033]
优选的,步骤(4)为:将步骤(3)的正相硅胶纯化液,在t≤50℃下减压浓缩至干,加纯化水或注射用水溶解成含丹酚酸a浓度约为80mg/ml,在t≤65℃下减压浓缩至溶液中丹酚酸a浓度为150mg/ml~250mg/ml,调ph值至3.5~3.8,样品置(0~15℃)环境中,静置析晶12h以上,过滤得一次结晶粗品。
[0034]
优选的,步骤(5)为:
[0035]
步骤(4)的一次结晶粗品在温度为50~65℃条件下加纯化水搅拌溶解,趁热过滤,定容至丹酚酸a的浓度为200~250mg/ml,样品置0~15℃环境中,持续搅拌析晶24h以上,结晶过滤,抽干。
[0036]
优选的,步骤(6)中,所述水为纯化水或注射用水;
[0037]
优选地,步骤(6)中,溶液中丹酚酸a浓度为25mg/ml~50mg/ml;
[0038]
优选的,步骤(6)中,酸溶液为盐酸或磷酸溶液;
[0039]
优选的,步骤(6)中,调ph至1.5~2.0;
[0040]
优选的,所述减压浓缩、冷冻真空干燥步骤为:重结晶萃取液在t≤65℃下减压浓缩后丹酚酸a浓度在200mg/ml以上,溶液稀释至丹酚酸a浓度为150mg/ml~200mg/ml,冷冻真空干燥;
[0041]
优选的,步骤(6)为:将步骤(5)所得结晶加纯化水或注射用水溶解成含丹酚酸a浓度为25mg/ml~50mg/ml溶液,边搅拌边滴加10%~20%酸溶液,调ph值至1.5~2.0;用叔丁
基甲基醚萃取数次(例如3次),合并萃取液,即得结晶萃取液;重结晶萃取液在t≤65℃下减压浓缩后丹酚酸a浓度在200mg/ml以上,溶液稀释至丹酚酸a浓度为150mg/ml~200mg/ml,冷冻真空干燥。
[0042]
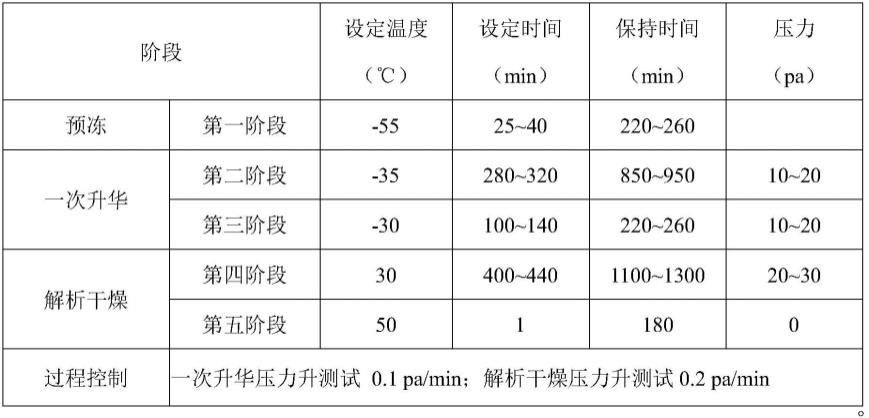
优选的,步骤(6)中冷冻真空干燥条件为:
[0043][0044]
本发明的有益技术效果:
[0045]
1、采用特定工艺、溶剂获得高纯度高含量产品:
[0046]
(1)本发明中采用工业化中高压色谱系统正相硅胶纯化丹酚酸a,采用300-400目粒度的硅胶作为填料,在6:4~2:8范围内不同体积比例(如6:4,5:5,3:7)的环己烷、叔丁基甲基醚的混合溶剂进行梯度洗脱,可有效的去除色素、热源性及过敏性杂质;进一步去除胶体类杂质、酚酸类化合物,去除丹酚酸a邻近杂质,富集、纯化丹酚酸a。经过正相硅胶纯化使丹酚酸a的纯度达到95%以上,含量90%以上。
[0047]
(2)为进一步提升丹酚酸a原料的含量、纯度及稳定性,采用结晶纯化的方法,精制纯化丹酚酸a。根据丹酚酸a的结构特性,丹酚酸a属多酚酸类化合物,可通过调节样品溶液的ph值改变溶解度析出,创造性的采用碱性物质(如饱和碳酸氢钠水溶液)为ph调节剂,中和丹酚酸a结构中的羧基,使丹酚酸a以离子形式结晶析出,得到丹酚酸a盐。再将其溶于水中,用稀酸性溶液调节ph至1.5~2.0,使丹酚酸a以分子形式游离出来,再用溶剂(如叔丁基甲基醚或乙酸乙酯萃取)萃取,丹酚酸a的纯度在98%以上,得率在80%以上。说明采用结晶的方式纯化丹酚酸a工艺参数科学、合理其操作过程简单,利于工业化/产业化生产,且生产成本低、最终成品纯度及含量达到预期目标。
[0048]
(3)为了进一步提高最终丹酚酸a的纯度,控制杂质限度,根据产品需要还可以进一步重结晶。采用结晶晶体加水溶解进行重结晶的方式,得到纯度更高丹酚酸a盐,丹酚酸a盐用纯化水溶解分散,采用稀盐酸溶液调节样品溶液ph,使丹酚酸a以分子形式游离,用叔丁基甲基醚萃取样品溶液中丹酚酸a,经浓缩、冷冻真空干燥得到高纯度(99.5%以上)、高含量(99.5%以上)的丹酚酸a原料,杂质少,可作为化学原料药使用;采用冷冻真空干燥,有利于保障产品的质量。
[0049]
2、相对现有技术产生显著更好的效果:
[0050]
(1)与cn103044252a中的方法相比,本发明采用工业化中高压色谱系统进行纯化,分离纯化时间缩短至原来的1/3~1/2,并减轻劳动强度,同时保证产品在各工序的收得率
与常压柱相比提升10%以上。
[0051]
(2)cn103044251a中采用了聚酰胺纯化,聚酰胺填料是一种高附加值精细高分子填料,多为粉末状物质,颗粒大小不均一,使用前需要滤去细粉并进行活化处理去除产品自身残留的杂质,预处理过程较复杂,不利于产业化生产;采用催化剂;且微波干燥容易使物质结构发生改变,不利于工业化生产。本发明未采用现有技术中常用聚酰胺填料纯化,而是采用两次萃取并结合结晶方法,操作简单、成本低;未使用催化剂,生产过程可控性强,利于工业化/产业化生产。
[0052]
(3)cn103044251a中采用的是正戊烷-叔丁基甲醚,正戊烷极易燃,其蒸汽与蒸汽可形成爆炸性混合物,遇明火、高热极易燃烧爆炸,与氧化剂接触发生强烈反应,甚至引起燃烧,生产操作风险大;高浓度可引起眼与呼吸道黏膜轻度刺激症状和麻醉状态,甚至意识丧失,慢性作用为眼和呼吸道的轻度刺激,可引起轻度皮炎,需采取更高级别的有效劳动防护措施。本发明工艺过程中使用的溶剂(环己烷、叔丁基甲基醚或乙酸乙酯)安全、可重复利用,有利于环保。
[0053]
3、本发明获得的丹酚酸a纯度高(99.5%以上),含量高(99.5%以上),杂质少,可以作为化学原料药使用;本发明的制备方法工艺路线设计科学、合理,充分考虑兼顾制药经济学和实际生产的可行性,工艺重现性良好,可以实现连续的大生产。
具体实施方式
[0054]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0055]
药材来源于唇型科植物丹参salvia miltiorrhiza bge.的干燥根及根茎,该药材及下述实施例中提到的溶剂和试剂均可从市场上直接购买获得。
[0056]
实施例1-4:丹酚酸b水提醇沉
[0057]
实施例1
[0058]
取丹参药材(饮片,厚片),4份,每份100g,破碎,过四目筛,加水温浸78℃
±
2℃提取三次(10倍量、8倍量、6倍量),每次提取1h。提取液在60℃下减压浓缩至浸膏相对密度1.15,合并浓缩液,加95%乙醇调溶液中乙醇浓度70%,25℃
±
2℃下静置醇沉36h,过滤,滤液在t≤65℃(60℃)下减压浓缩至溶液中乙醇浓度≤5%(4%),得醇沉浓缩液。
[0059]
实施例2
[0060]
取丹参药材(短段),4份,每份100g,破碎,过四目筛,加水温浸75℃
±
2℃提取三次(10倍量、8倍量、6倍量),每次提取1.5h。提取液在50℃下减压浓缩至浸膏相对密度1.05,合并浓缩液,加90%乙醇调溶液中乙醇浓度75%,35℃
±
2℃下静置醇沉24h,过滤,滤液在t≤65℃(50℃)下减压浓缩至溶液中乙醇浓度≤5%(5%),得醇沉浓缩液。
[0061]
实施例3
[0062]
取丹参药材(长段),4份,每份100g,破碎,过四目筛,加水温浸85℃
±
2℃提取三次(10倍量、8倍量、6倍量),每次提取2h。提取液在55℃下减压浓缩至浸膏相对密度1.10,合并浓缩液,加92%乙醇调溶液中乙醇浓度72%,10℃
±
2℃下静置醇沉25h,过滤,滤液在t≤65℃(55℃)下减压浓缩至溶液中乙醇浓度≤5%(3%),得醇沉浓缩液。
[0063]
实施例4
[0064]
取丹参药材(饮片,厚片),4份,每份100g,破碎,过四目筛,加水温浸82℃
±
2℃提取三次(10倍量、8倍量、6倍量),每次提取1.5h。提取液在50℃下减压浓缩至浸膏相对密度1.15,合并浓缩液,加95%乙醇调溶液中乙醇浓度75%,20℃
±
2℃下静置醇沉48h,过滤,滤液在t≤65℃(55℃)下减压浓缩至溶液中乙醇浓度≤5%(4%),得醇沉浓缩液。
[0065]
实施例5-8:转化步骤
[0066]
实施例5
[0067]
实施例1的醇沉浓缩液加纯化水稀释至丹酚酸b浓度约10mg/ml,调ph至3.8,在120℃下反应3.5h,冷却,离心,得丹酚酸a转化液。
[0068]
实施例6
[0069]
实施例2的醇沉浓缩液加纯化水稀释至丹酚酸b浓度约30mg/ml,调ph至4.0,在110℃下反应4.5h,冷却,离心,得丹酚酸a转化液。
[0070]
实施例7
[0071]
实施例3的醇沉浓缩液加纯化水稀释至丹酚酸b浓度约5mg/ml,调ph至3.5,在130℃下反应2.5h,冷却,离心,得丹酚酸a转化液。
[0072]
实施例8
[0073]
实施例4的醇沉浓缩液加纯化水稀释至丹酚酸b浓度约15mg/ml,调ph至4.0,在115℃下反应3h,冷却,离心,得丹酚酸a转化液。
[0074]
实施例9-12:丹酚酸a中低压树脂纯化
[0075]
实施例9
[0076]
取实施例5丹酚酸a转化液,丹酚酸a为浓度为3.00mg/ml,以1.5cv
·
h-1
的流速通过已处理合格的苯乙烯型大孔吸附树脂柱,大孔吸附树脂为hpd-100s,填料粒径为0.3~1.25mm,压力2bar,m
丹酚酸a
:m
大孔吸附树脂
=1:35,径高比=1:5;以3cv
·
h-1
流速,依次用纯化水洗脱4cv,20%酸性乙醇(ph=3.0)洗脱9cv,三废处理,45%酸性乙醇(ph=3.0)洗脱5cv,分流份收集45%酸性乙醇洗脱液,hplc检测各流份纯度,合并丹酚酸a纯度≥80%,得丹酚酸a大孔吸附树脂纯化液。
[0077]
实施例10
[0078]
取实施例6丹酚酸a转化液,丹酚酸a浓度为1.59mg/ml,以2cv
·
h-1
的流速通过已处理合格的苯乙烯型大孔吸附树脂柱,大孔吸附树脂为hpd-100s,填料粒径为0.3~1.25mm,压力5bar,m
丹酚酸a
:m
大孔吸附树脂
=1:50,径高比=1:10;以2cv
·
h-1
流速,依次用纯化水洗脱3cv,30%酸性乙醇(ph=3.5)洗脱8cv,三废处理,55%酸性乙醇(ph=3.5)洗脱4cv,分流份收集55%酸性乙醇洗脱液,hplc检测各流份纯度,合并丹酚酸a纯度≥80%,得丹酚酸a大孔吸附树脂纯化液。
[0079]
实施例11
[0080]
取实施例7丹酚酸a转化液,丹酚酸a浓度控制6.56mg/ml,以1cv
·
h-1
的流速通过已处理合格的苯乙烯型大孔吸附树脂柱,大孔吸附树脂为lx-1180,填料粒径为0.3~1.25mm,压力10bar,m
丹酚酸a
:m
大孔吸附树脂
=1:40,径高比=1:8;以2.5cv
·
h-1
流速,依次用纯化水洗脱5cv,25%酸性乙醇(ph=2.5)洗脱12cv,三废处理,40%酸性乙醇(ph=2.5)洗脱6cv,分流份收集40%酸性乙醇洗脱液,hplc检测各流份纯度,合并丹酚酸a纯度≥80%,得丹酚酸a大
孔吸附树脂纯化液。
[0081]
实施例12
[0082]
取实施例8丹酚酸a转化液,丹酚酸a浓度控制5.00mg/ml,以3cv
·
h-1
的流速通过已处理合格的苯乙烯型大孔吸附树脂柱,大孔吸附树脂为lx-1180,填料粒径为0.3~1.25mm,压力0bar,m
丹酚酸a
:m
大孔吸附树脂
=1:60,径高比=1:10;以4cv
·
h-1
流速,依次用纯化水洗脱3cv,15%酸性乙醇(ph=3.5)洗脱10cv,三废处理,35%酸性乙醇(ph=3.5)洗脱8cv,分流份收集35%酸性乙醇洗脱液,hplc检测各流份纯度,合并丹酚酸a纯度≥80%,得丹酚酸a大孔吸附树脂纯化液。
[0083]
实施例13-16:丹酚酸a一次萃取
[0084]
实施例13
[0085]
取实施例9的丹酚酸a大孔吸附树脂纯化液,在t≤85℃下(70℃)减压浓缩至溶液乙醇浓度≤15%(10%),用叔丁基甲基醚萃取三次,每次叔丁基甲基醚用量分别为浓缩液量的1/2、1/3、1/3,合并萃取液。
[0086]
实施例14
[0087]
取实施例10的丹酚酸a大孔吸附树脂纯化液,在t≤85℃下(60℃)减压浓缩至溶液乙醇浓度≤15%(15%),用乙酸乙酯萃取三次,每次叔丁基甲基醚用量分别为浓缩液量的1/2、1/3、1/3,合并萃取液。
[0088]
实施例15
[0089]
取实施例11的丹酚酸a大孔吸附树脂纯化液,在t≤85℃下(65℃)减压浓缩至溶液乙醇浓度≤15%(12%),用叔丁基甲基醚萃取,得萃取液。
[0090]
实施例16
[0091]
取实施例12的丹酚酸a大孔吸附树脂纯化液,在t≤85℃下(50℃)减压浓缩至溶液乙醇浓度≤15%(6%),用叔丁基甲基醚萃取,得萃取液。
[0092]
实施例17-20:丹酚酸a中高压色谱纯化
[0093]
实施例17
[0094]
取实施例13的萃取液,加无水硫酸钠静置除水2h以上(2.5h),在t≤50℃(40℃)下减压浓缩至丹酚酸a浓度为200mg/ml,拌样硅胶及硅胶柱中采用的硅胶为:300~400目,粒径为60μm,压力为800bar,用m
丹酚酸a
:m
硅胶
=1:2拌样,硅胶柱层析用量m
丹酚酸a
:m
硅胶
为1:20,依次用环己烷:叔丁基甲基醚(4:6)洗脱10cv,环己烷:叔丁基甲基醚(3:7)洗脱4cv,流速4.0cv
·
h-1
,分流份收集环己烷:叔丁基甲基醚(3:7)洗脱液,hplc检测各流份纯度,合并纯度≥90%流份,得丹酚酸a正相硅胶纯化液,丹a得率81.23%,经进一步液相检测丹酚酸a的含量93.02%,纯度98.51%。
[0095]
实施例18
[0096]
取实施例14的萃取液,加无水硫酸钠静置除水2h以上(3.5h),在t≤50℃(30℃)下减压浓缩至丹酚酸a浓度为150mg/ml,拌样硅胶及硅胶柱中采用的硅胶为:300~400目,粒径为120μm,压力为1200bar;用m
丹酚酸a
:m
硅胶
=1:2.5,拌样,硅胶柱层析用量m
丹酚酸a
:m
硅胶
为1:15,依次用环己烷:叔丁基甲基醚(5:5)洗脱12cv,环己烷:叔丁基甲基醚(4:6)洗脱8cv,流速7.5cv
·
h-1
,分流份收集环己烷:叔丁基甲基醚(4:6)洗脱液,hplc检测各流份纯度,合并纯度≥90%流份,得丹酚酸a正相硅胶纯化液,丹a得率80.29%,经进一步液相检测丹酚酸a的
含量92.39%,纯度96.67%。
[0097]
实施例19
[0098]
取实施例15的萃取液,加无水硫酸钠静置除水2h以上(3h),在t≤50℃(40℃)下减压浓缩至丹酚酸a浓度为250mg/ml,拌样硅胶及硅胶柱中采用的硅胶为:300~400目,粒径为150μm,压力为1500bar;用m
丹酚酸a
:m
硅胶
=1:2,硅胶300~400目,拌样,硅胶柱层析用量m
丹酚酸a
:m
硅胶
为1:18,依次用环己烷:叔丁基甲基醚(4:6)洗脱8cv,环己烷:叔丁基甲基醚(3:7)洗脱5cv,流速2.5cv
·
h-1
,分流份收集环己烷:叔丁基甲基醚(3:7)洗脱液,hplc检测各流份纯度,合并纯度≥90%流份,得丹酚酸a正相硅胶纯化液,丹a得率84.45%,经进一步液相检测丹酚酸a的含量92.58%,纯度96.92%。
[0099]
实施例20
[0100]
取实施例16的萃取液,加无水硫酸钠静置除水2h以上(2.5h),在t≤50℃(25℃)下减压浓缩至丹酚酸a浓度为180mg/ml,拌样硅胶及硅胶柱中采用的硅胶为:300~400目,粒径为40μm,压力为500bar;用m
丹酚酸a
:m
硅胶
=1:2.5,硅胶300-400目拌样,硅胶柱层析用量m
丹酚酸a
:m
硅胶
为1:16,依次用环己烷:叔丁基甲基醚(5:5)洗脱12cv,环己烷:叔丁基甲基醚(3:7)洗脱6cv,流速6.0cv
·
h-1
,分流份收集环己烷:叔丁基甲基醚(3:7)洗脱液,hplc检测各流份纯度,合并纯度≥90%流份,得丹酚酸a正相硅胶纯化液,丹a得率83.82%,经进一步液相检测丹酚酸a的含量92.98%,纯度95.31%。
[0101]
实施例21-24:结晶及重结晶
[0102]
实施例21
[0103]
取实施例17的丹酚酸a正相硅胶纯化液,在t≤50℃(40℃)下减压浓缩至干,加纯化水溶解成含丹酚酸a浓度约为80mg/ml,在t≤65℃下减压浓缩至溶液中丹酚酸a浓度为150mg/ml,边搅拌边滴加饱和碳酸氢钠溶液,调ph值至3.5,0-15℃下静置析晶25h,晶体过滤,得丹酚酸a一次结晶粗品,纯度99.04%,得率81.21%。
[0104]
可进一步进行重结晶:取上述丹酚酸a一次结晶粗品,在温度为50℃条件下加纯化水搅拌溶解,趁热过滤,定容至丹酚酸a的浓度为240mg/ml,0-15℃下,持续搅拌析晶25h,结晶过滤,抽干,得丹酚酸a重结晶,纯度99.74%,得率86.54%。
[0105]
实施例22
[0106]
取实施例18的丹酚酸a正相硅胶纯化液,在t≤50℃(45℃)下减压浓缩至干,加纯化水或注射用水溶解成含丹酚酸a浓度约为80mg/ml,在t≤65℃下减压浓缩至溶液中丹酚酸a浓度为200mg/ml,边搅拌边滴加饱和碳酸氢钠溶液,调ph值至3.8,0-15℃下静置析晶30h,晶体过滤,得丹酚酸a一次结晶粗品,纯度99.19%,得率84.11%。
[0107]
可进一步进行重结晶:取上述丹酚酸a一次结晶粗品,在温度为60℃条件下加纯化水或注射用水搅拌溶解,趁热过滤,定容至丹酚酸a的浓度为250mg/ml,0-15℃下,持续搅拌析晶30h,结晶过滤,抽干,得丹酚酸a重结晶,纯度99.66%,得率83.28%。
[0108]
实施例23
[0109]
取实施例19的丹酚酸a正相硅胶纯化液,在t≤50℃(45℃)下减压浓缩至干,加纯化水溶解成含丹酚酸a浓度约为80mg/ml,在t≤65℃下减压浓缩至溶液中丹酚酸a浓度为200mg/ml边搅拌边滴加饱和碳酸氢钾溶液,调ph值至3.7,0-15℃下静置析晶25h,晶体过滤,得丹酚酸a一次结晶粗品,纯度99.03%,得率84.05%。
[0110]
可进一步进行重结晶:取上述丹酚酸a一次结晶粗品,在温度为55℃条件下加纯化水搅拌溶解,趁热过滤,定容至丹酚酸a的浓度为220mg/ml,0-15℃下,持续搅拌析晶28h,结晶过滤,抽干,得丹酚酸a重结晶,纯度99.69%,得率84.29%。
[0111]
实施例24
[0112]
取实施例20的丹酚酸a正相硅胶纯化液,在t≤50℃(40℃)下减压浓缩至干,加纯化水溶解成含丹酚酸a浓度约为80mg/ml,在t≤65℃下减压浓缩至溶液中丹酚酸a浓度为250mg/ml,边搅拌边滴加葡甲胺溶液,调ph值至3.5,0-15℃下静置析晶25h,晶体过滤,得丹酚酸a一次结晶粗品,纯度99.36%,得率82.29%。
[0113]
可进一步进行重结晶:取上述丹酚酸a一次结晶粗品,在温度为65℃条件下加纯化水搅拌溶解,趁热过滤,定容至丹酚酸a的浓度为200mg/ml,0-15℃下,持续搅拌析晶26h,结晶过滤,抽干,得丹酚酸a重结晶,纯度99.67%,得率81.87%。
[0114]
实施例25-29:丹酚酸a二次萃取
[0115]
实施例25
[0116]
取实施例21丹酚酸a重结晶粗品,加适量纯化水搅拌溶解成含丹酚酸a浓度为30mg/ml溶液,溶液边搅拌边滴加10%盐酸溶液,调溶液ph值至2.0。用叔丁基甲基醚萃取3次,每次叔丁基甲基醚用量分别为溶液量的1/2、1/3、1/3,合并萃取液。
[0117]
实施例26
[0118]
取实施例22丹酚酸a重结晶粗品,加适量纯化水搅拌溶解成含丹酚酸a浓度为40mg/ml溶液,溶液边搅拌边滴加20%盐酸溶液,调溶液ph值至1.5。用叔丁基甲基醚萃取3次,每次叔丁基甲基醚用量分别为溶液量的1/2、1/3、1/3,合并萃取液。
[0119]
实施例27
[0120]
取实施例23丹酚酸a重结晶粗品,加适量纯化水搅拌溶解成含丹酚酸a浓度为50mg/ml溶液,溶液边搅拌边滴加10%磷酸溶液,调溶液ph值至2.0。用叔丁基甲基醚萃取3次,每次叔丁基甲基醚用量分别为溶液量的1/2、1/3、1/3,合并萃取液。
[0121]
实施例28
[0122]
取实施例24丹酚酸a重结晶粗品,加适量纯化水搅拌溶解成含丹酚酸a浓度为25mg/ml溶液,溶液边搅拌边滴加10%盐酸溶液,调溶液ph值至3.0。用叔丁基甲基醚萃取3次,每次叔丁基甲基醚用量分别为溶液量的1/2、1/3、1/3,合并萃取液。
[0123]
实施例29
[0124]
取实施例21丹酚酸a结晶粗品,加适量纯化水搅拌溶解成含丹酚酸a浓度为25mg/ml溶液,溶液边搅拌边滴加20%磷酸溶液,调溶液ph值至2.0。用乙酸乙酯萃取3次,每次乙酸乙酯用量分别为溶液量的1/2、1/3、1/3,合并萃取液。
[0125]
实施例30-34:浓缩干燥
[0126]
实施例30
[0127]
取实施例25所得的萃取液,在t≤50℃(40℃)下减压浓缩至干,加纯化水溶解至含丹酚酸a浓度约100mg/ml,在t≤65℃下减压浓缩至溶液中含丹酚酸a浓度200mg/ml以上(220mg/ml),溶液稀释至丹酚酸a浓度为160mg/ml,冷冻真空干燥,条件:
[0128][0129]
经hplc检测,其干燥品丹酚酸a的含量99.3%,纯度为99.70%,溶剂残留:甲基叔丁基醚为0.002%,环己烷未检出,乙醇未检出。
[0130]
实施例31
[0131]
取实施例26所得的萃取液,在t≤50℃(30℃)下减压浓缩至干,加纯化水溶解至含丹酚酸a浓度约100mg/ml,在t≤65℃下减压浓缩至溶液中含丹酚酸a浓度200mg/ml以上(200mg/ml),溶液稀释至丹酚酸a浓度为150mg/ml,冷冻真空干燥,条件:
[0132][0133]
经hplc检测,其干燥品丹酚酸a的含量99.9%,纯度为99.57%,溶剂残留:甲基叔丁基醚为0.008%,环己烷未检出,乙醇为0.007%。
[0134]
实施例32
[0135]
取实施例27所得的萃取液,在t≤50℃(35℃)下减压浓缩至干,加纯化水溶解至含丹酚酸a浓度约100mg/ml,在t≤65℃下减压浓缩至溶液中含丹酚酸a浓度200mg/ml以上(250mg/ml),溶液稀释至丹酚酸a浓度为200mg/ml,冷冻真空干燥,条件:
[0136][0137]
经hplc检测,其干燥品丹酚酸a的含量100.0%,纯度为99.53%,溶剂残留:甲基叔丁基醚为0.004%,环己烷未检出,乙醇为0.015%。
[0138]
实施例33
[0139]
取实施例28所得的萃取液,在t≤50℃(30℃)下减压浓缩至干,加纯化水溶解至含丹酚酸a浓度约100mg/ml,在t≤65℃下减压浓缩至溶液中含丹酚酸a浓度200mg/ml以上(250mg/ml),溶液稀释至丹酚酸a浓度为180mg/ml,冷冻真空干燥,条件:
[0140][0141]
经hplc检测,其干燥品丹酚酸a的含量99.9%,纯度为99.54%,溶剂残留:甲基叔丁基醚未检出,环己烷未检出,乙醇为0.006%。
[0142]
实施例34
[0143]
取实施例29所得的萃取液,在t≤50℃(50℃)下减压浓缩至干,加纯化水溶解至含丹酚酸a浓度约100mg/ml,在t≤65℃下减压浓缩至溶液中含丹酚酸a浓度200mg/ml以上(250mg/ml),溶液稀释至丹酚酸a浓度为200mg/ml,冷冻真空干燥,条件:
[0144][0145]
经hplc检测,其干燥品丹酚酸a的含量99.7%,纯度为99.72%,溶剂残留:甲基叔丁基醚为0.002%,环己烷未检出,乙酸乙酯未检出,乙醇未检出。
[0146]
对比实验
[0147]
对比例组一cn103044251a的实施例
[0148]
取丹参药材,切成饮片,加15倍量水煎煮提取,共提取3次,每次提取4小时;提取液减压浓缩至相对密度1.20(60℃),加入乙醇使含醇量在65%,静置,滤过,滤液减压回收乙醇并浓缩至无醇味,丹参提取液加水稀释至每1ml含丹酚酸b 30mg,水溶液用碱调ph至4.5,加入与丹酚酸b摩尔百分比0.3%的氯化锌作为催化剂,在140℃温度加热转化6小时;转化液用酸调ph值至3.5,静置、离心,上清液减压浓缩至每1ml含丹酚酸a10mg,经hpd-100大孔树脂柱层析分离,丹酚酸a上样量与大孔吸附树脂比为1:50,树脂柱径高比为1:10,分别用8倍柱体积水、10倍柱体积30%乙醇洗脱,除去杂质,再用10倍柱体积50%乙醇洗脱,hplc检测,收集含有丹酚酸a的50%乙醇洗脱部分,减压回收乙醇并浓缩至无醇味;水溶液浓缩至每1ml含10mg丹酚酸a的溶液,通过聚酰胺层析柱分离,丹酚酸a上样量与聚酰胺比为1:20,树脂柱径高比为1:10,分别用10倍柱体积水、10倍柱体积40%乙醇溶液洗脱除杂,再用10倍柱体积80%乙醇溶液洗脱,收集含有丹酚酸a的80%乙醇溶液部分,减压回收乙醇并浓缩至无醇味水溶液,调酸ph至4.0,用水溶液8倍量的叔丁基甲基醚,分3次萃取,分离有机层,减压回收叔丁基甲基醚,制成每1ml含丹酹酸a10g的萃取液,加入3倍量硅胶,搅拌,挥干;把搅拌样硅胶加到已装好的20倍量干硅胶柱上,硅胶柱径高比为1:10,以正戊烷-叔丁基甲基醚为洗脱剂,梯度洗脱,分别用正戊烷-叔丁基甲基醚(4:6)洗脱20倍柱体积,正戊烷-叔丁基甲基醚出(6:4)洗脱20倍柱体积,减压回收洗脱剂,回收后的丹酚酸a加10倍量水溶解,微波真空干燥,得丹酚酸a,经hplc检测,含量95.7%,纯度98.58%。
[0149]
对比例组二正相硅胶纯化步骤参数的考察
[0150]
对比例2-1萃取液浓缩程度考察
[0151]
取丹酚酸a萃取液2000ml,hplc测定萃取液中丹酚酸a的浓度,计算丹酚酸a的量,萃取液在t≤50℃减压浓缩至不同浓度(对比例2-1-1组约150mg/ml、对比例2-1-2组约200mg/ml、对比例2-1-3组约250mg/ml),观察不同浓度下样品的溶解情况和流动性,结果见表1:
[0152]
表1:萃取液不同浓缩程度考察结果
[0153][0154]
数据分析与结论:
[0155]
由表1中不同浓度下样品的溶解情况和流动性考察结果可知,将丹酚酸a萃取液浓缩至含丹酚酸a浓度150mg/ml~250mg/ml时,样品呈溶解状态,流动性好,便于硅胶拌样。后续硅胶拌样均将丹酚酸a萃取液浓缩至含丹酚酸a浓度150mg/ml~250mg/ml。
[0156]
对比例2-2洗脱溶剂和洗脱梯度考察
[0157]
根据丹酚酸a的性质,利用薄层色谱法初步摸索柱层析洗脱溶剂条件。可用于丹酚酸a硅胶色谱纯化的低极性溶剂有正己烷、正戊烷、环己烷、石油醚等,高极性溶剂有甲醇、乙醇、异丙醇、乙酸乙酯和叔丁基甲基醚等。根据溶剂的本身的性质(安全性、质量可控性、沸点等)、溶剂使用原则及溶剂价格,筛选出正己烷/叔丁基甲基醚、正己烷/乙酸乙酯、环己烷/叔丁基甲基醚、环己烷/乙酸乙酯四个溶剂体系纯化丹酚酸a。通过预实验的结果,摸索柱层析洗脱溶剂系统和洗脱梯度,再通过柱层析对洗脱溶剂系统和洗脱梯度进行确认。
[0158]
用点样毛细管分别取少量样品和对照品点于gf254硅胶板(离板底部0.5cm~1.0cm),将点好样品的薄层板放入不同体系不同比例展开剂的展缸中,浸入展开剂的深度为距原点2~3mm为宜(切勿将样点侵入展开剂中),密封顶盖,待展开至溶剂前沿达到规定的展距,取出薄层板,晾干,置于紫外灯下观察(254nm),计算相对应的rf值(rf为比移值:原点至组分点中心的距离/原点至流动前沿的距离),以薄层层析第一个点的rf=0.2~0.3左右的展开系统为柱层析的第一个洗脱梯度。结果见表2、表3:
[0159]
表2:洗脱溶剂和洗脱梯度考察结果(前沿第一个杂质的rf值)
[0160][0161]
表3:洗脱溶剂和洗脱梯度考察结果(丹酚酸a的rf值)
[0162][0163]
数据分析与结论:
[0164]
根据薄层色谱实验结果和溶剂的安全性,丹酚酸a正相硅胶色谱纯化,拟采用环己烷/叔丁基甲基醚系统(二类溶剂)进行洗脱,洗脱梯度通过薄层色谱进行初步判断,再经柱层析色谱进行确认。
[0165]
对比例2-3洗脱条件考察
[0166]
对比例2-3-1:取拌样均匀的硅胶适量,含丹酚酸a约10g,填入已装有200g硅胶(300-400目)的层析柱中进行柱层析(m
丹酚酸a
与m
层析硅胶(300-400目)
比例为1:20),采用动态轴向压缩柱,用环己烷:叔丁基甲基醚(4:6)作为洗脱剂,洗脱剂用量为20cv,洗脱流速40ml/min,350ml每流份收集。hplc测定流份中丹酚酸a浓度及纯度,合并丹酚酸a纯度大于90%的流份,计算丹酚酸a的量及得率。结果见表4:
[0167]
对比例2-3-2:取拌样均匀的硅胶适量,含丹酚酸a约10g,填入已装有200g硅胶(300-400目)的层析柱中进行柱层析(m
丹酚酸a
与m
层析硅胶(300-400目)
比例为1:20),采用动态轴向压缩柱,用环己烷:叔丁基甲基醚(3:7)作为洗脱剂,洗脱剂用量为10cv,洗脱流速40ml/min,350ml每流份收集。hplc测定流份中丹酚酸a浓度及纯度,合并丹酚酸a纯度大于90%的流份,计算丹酚酸a的量及得率。结果见表4:
[0168]
本发明:取已经拌样均匀的硅胶适量,含丹酚酸a约10g,填入已装有200g硅胶(300-400目)的层析柱中进行柱层析(m
丹酚酸a
与m
层析硅胶(300-400目)
比例为1:20),采用动态轴向压缩柱,采用不同梯度的环己烷:叔丁基甲基醚作为洗脱剂,梯度为环己烷:叔丁基甲基醚(5:5~4:6)洗脱10cv,环己烷:叔丁基甲基醚(4:6~3:7)洗脱6cv,洗脱流速40ml/min,350ml每流份收集(紫外检测器配合)。hplc测定流份中丹酚酸a浓度及纯度,合并丹酚酸a纯度大于90%的流份,计算丹酚酸a的量及得率。结果见表4:
[0169]
表4:洗脱条件考察实验数据
[0170][0171]
数据分析与结论:
[0172]
(1)采用对比例2-3-1环己烷:叔丁基甲基醚(4:6)等洗脱时,杂质去除比较明显,但目标物丹酚酸a洗脱较慢,直至最后,丹酚酸a仍未被完全洗脱,此洗脱条件所得样品质量
虽然符合要求,但收率低,费物料,费时间,生产成本大。
[0173]
(2)采用对比例2-3-2环己烷:叔丁基甲基醚(3:7)等洗脱时,洗脱流份较少,但目标产物丹酚酸a和杂质不能有效的分离,且样品得率低,工艺不可控。
[0174]
(3)采用环己烷:叔丁基甲基醚梯度洗脱,环己烷:叔丁基甲基醚5:5~4:6洗脱10cv可将大部分杂质除去,环己烷:叔丁基甲基醚4:6~3:7洗脱可得到纯度90%以上的丹酚酸a,且丹酚酸a样品集中,得率最高。为了有效去除前杂,提高目标产物丹酚酸a的纯度及得率,选择环己烷:叔丁基甲基醚5:5~4:6作为洗脱杂质的洗脱剂,再用环己烷:叔丁基甲基醚(4:6~3:7)洗脱高纯度丹酚酸a。
[0175]
实验结果表明,正相硅胶纯化采用环己烷:叔丁基甲基醚溶剂系统,如以5:5~3:7梯度洗脱,丹酚酸a分离纯化效果好,且丹酚酸a的得率、纯度均能满足工艺研究要求。
[0176]
对比例组三结晶条件的考察
[0177]
对比例3-1结晶溶液ph考察
[0178]
取丹酚酸a正相硅胶纯化后粗品,约含丹酚酸a15g,加纯化水超声溶解(含丹酚酸a浓度约80mg/ml),在t≤65℃条件下减压浓缩至溶液中丹酚酸a浓度为150~250mg/ml,边搅拌边滴加饱和碳酸氢钠溶液,分别调样品溶液ph值至3.0、3.5、4.0、4.5,样品冷藏(2~8℃),静置析晶24h,观察样品的析出情况。结晶滤过,样品真空干燥(t≤45℃),称重,计算结晶得率。hplc检测结晶纯度。结果见表5:
[0179]
表5:结晶溶液ph考察结果
[0180][0181]
备注:saa盐得率(%)=结晶干重(g)/结晶前saa量(g)
×
100%。“/”表示该条件下无晶体析出。丹酚酸a英文名称缩写为:saa。
[0182]
数据分析与结论:
[0183]
由实验现象和检验结果可知,通过调节溶液ph,丹酚酸a可结晶析出。ph 3.0-4.0时纯度达99%以上。其中最优的,调节溶液ph=3.5时,样品得率最高,丹酚酸a纯度由95%提升至99%以上,杂质去除效果明显。
[0184]
对比例3-2结晶溶液ph优化
[0185]
取丹酚酸a正相硅胶纯化后粗品,约含丹酚酸a10g,加纯化水超声溶解(含丹酚酸a浓度约80mg/ml),在t≤65℃条件下减压浓缩至溶液中丹酚酸a浓度为150mg/ml~250mg/ml,边搅拌边滴加饱和碳酸氢钠溶液,调ph值至3.4、3.5、3.6、3.7、3.8、3.9,样品置(0~15℃)环境中,静置析晶24h以上,结晶过滤。样品置真空干燥箱(t≤45℃)真空干燥12h,称重,计算结晶得率。hplc检测结晶纯度。结果见表6:
[0186]
表6:结晶溶液ph优化结果
[0187][0188]
数据分析与结论:
[0189]
由实验现象和检测结果可知:结晶溶液ph值调至3.5、3.6、3.7、3.8后,结晶得率均在80%以上,晶体纯度99%以上。因此经过优化研究,将结晶前样品溶液ph值由3.5调整为3.5~3.8。
[0190]
对比例组四干燥方式的考察
[0191]
对比例4-1微波干燥
[0192]
微波干燥是利用物质分子与高频的微波相互作用产生的热效应,从而使物料中水分蒸发达到干燥,在此过程中使得物质结构发生改变。
[0193]
对比例4-2真空干燥
[0194]
取丹酚酸a结晶萃取纯化后萃取液(约含丹酚酸a10g)。样品1:在t≤50℃下浓缩至干;样品2在t≤50℃下浓缩至干后,加纯化水溶解(含丹酚酸a浓度约为100mg/ml),继续在t≤65℃下浓缩至干;上述样品1、2置真空干燥箱(t≤45℃)真空干燥12h,称重;考察丹酚酸a得率、有关物质纯度、含量、水分及残留溶剂。结果见表7:
[0195]
表7:干燥前样品处理方式考察结果
[0196][0197]
备注:表7中
“-”
表示,干燥前后丹酚酸a纯度降低。
[0198]
数据分析与结论:
[0199]
综合丹酚酸a纯度、含量、水分及残留溶剂数据分析,丹酚酸a采用不同方式前处理后,经真空干燥,成品质量不合格。考虑到丹酚酸a的热不稳定性,为使丹酚酸a纯度、含量、水分及残留溶剂等能达到质量标准,采用冷冻真空干燥方式干燥丹酚酸a粗品较优。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。