1.本发明属于多倍体育种技术领域,尤其涉及利用秋水仙素诱导蝴蝶兰(例如象鼻兰)种子产生多倍体并提高种子萌发率。
背景技术:
2.蝴蝶兰属(phalaenopsis)植物因其花大色艳而备受欢迎,象鼻兰 (phalaenopsis zhejiangensis),原为兰科象鼻兰属(nothodoritis)植物,后来被归类于蝴蝶兰属植物,是我国特有珍稀兰科植物
1.,已作为一级保护植物列入国家重点保护野生植物名录(二)。象鼻兰植物个体极少,主要分布在浙江,又因环境因素、人为采摘等濒临灭绝,染色体数目为2n=2x=38
[2][3]
,而蝴蝶兰栽培种主要为四倍体、三倍体和非整倍体
[4],[5][6]
。象鼻兰植株小,花朵小,花量大,花型奇特,萼片、花瓣为白色且内面具紫色横纹
1.,是培育趣味蝴蝶兰、小花型蝴蝶兰的优良亲本。由于染色体大小和倍性差异,很难将二倍体原生种的优良基因转入栽培种
[7][8]
。通过多倍体诱导可以更好的融合象鼻兰与其他蝴蝶兰的优良基因。且多倍体常具有植株粗壮、花朵较大、抗逆性较强等优点,因此多倍体诱导是培育蝴蝶兰新品种的一项重要育种技术。
[0003]
在兰科植物中,现有技术一般采用秋水仙素、氨磺灵等化学试剂对种子
[9][10]
、原球茎
[11]-[15]
、从生芽
[16]-[18]
、茎段
[19]
、叶片
[20][21]
等在组织培养的条件下进行染色体加倍诱导,但在蝴蝶兰属植物中尚未有对种子进行染色体加倍技术的研究。
[0004]
针对目前蝴蝶兰属植物染色体加倍技术不稳定、加倍率较低的问题,且缺乏对种子染色体加倍技术的相关研究,亟需一种新的技术来提高蝴蝶兰属植物多倍体诱导率,同时提高种子萌发率,从而为培育观赏价值高的蝴蝶兰新种质奠定基础。
技术实现要素:
[0005]
针对现有技术存在的问题,本发明的第一方面提供了一种诱导蝴蝶兰(例如象鼻兰)种子产生多倍体及提高种子萌发率的方法,包括以下步骤:
[0006]
(a)收集蝴蝶兰种子并分装到茶叶袋中;
[0007]
(b)将所述种子灭菌;
[0008]
(c)在液体培养基中培养灭菌后的所述种子,持续第一时间段,其中所述第一时间段为例如0-10d(例如0、5、10d);
[0009]
(d)向所述液体培养基中添加秋水仙素,使所述秋水仙素的浓度为例如0.05%-0.2%(例如0.05%、0.1%、0.2%),处理第二时间段,其中所述第二时间段为例如1-5d(例如1、3、5d);以及
[0010]
(e)将步骤(d)所得种子播种至第一固体培养基,任选地,60d后统计其萌发率。
[0011]
在一些实施方案中,其中步骤(c)中,所述液体培养基为: 1/2ms 20g.l-1
蔗糖 100g.l-1
椰汁。在一些实施方案中,其中步骤(e) 中,所述第一固体培养基为:1/2ms 20g.l-1
蔗糖 100g.l-1
椰汁 5.0 g.l-1
琼脂。
[0012]
在一些实施方案中,其中步骤(a)包括:采集蝴蝶兰果荚,用无菌水清洗,然后将不同果荚的种子混匀放入经灭菌的茶叶袋中。在一些实施方案中,其中步骤(b)包括:用无菌水清洗所述种子,再用75%酒精灭菌30s,之后用无菌水清洗,再用0.1%升汞灭菌10min,最后用清水清洗。在一些实施方案中,其中步骤(e)包括:将经过步骤(d) 处理的种子晾干,然后播种到在固体培养基中。
[0013]
在一些实施方案中,所述方法还包括步骤(f):在种子萌发后,将其转接至第二固体培养基,所述第二固体培养基为:1/2ms 1.0 mg
·
l-16-ba 0.2mg
·
l-1naa 5.0g
·
l-1琼脂 20g
·
l-1蔗糖。
[0014]
在一些实施方案中,本发明的方法包括以下步骤:
[0015]
(a)收集蝴蝶兰种子并分装到茶叶袋中:采收的果荚用无菌水清洗后,用剪刀剪开,将不同果荚的种子混匀放入提前灭菌的茶叶袋,用回形针固定;
[0016]
(b)将所述种子灭菌:先用无菌水清洗两次,再用75%酒精灭菌30s,之后用无菌水清洗一次,再用0.1%升汞灭菌10min,最后用清水清洗2-3次;
[0017]
(c)在液体培养基中培养灭菌后的所述种子:将灭菌后的茶叶袋放入液体培养基1/2ms 20g.l-1
蔗糖 100g.l-1
椰汁中震荡培养,摇床转速为100r/min,每个培养瓶约100ml,持续第一时间段0-10d, (例如0、5、10d);
[0018]
(d)秋水仙素处理:向所述液体培养基中添加秋水仙素,使所述秋水仙素的浓度为例如0.05%-0.2%(例如0.05%、0.1%、0.2%),处理第二时间段,例如1-5d(例如1、3、5d);
[0019]
(e)将步骤(d)所得种子播种至第一固体培养基:步骤(d)结束后,将茶叶袋剪开,种子晾干后播种到在第一固体培养基(1/2ms 20g.l-1
蔗糖 100g.l-1
椰汁 5.0g.l-1
琼脂)中,60d后统计其萌发率。
[0020]
在一些实施方案中,本发明的方法还任选地包括步骤(f)统计萌发率:种子萌发后,将其转接至第二固体培养基(1/2ms 1.0 mg.l-1
6-ba 0.2mg.l-1
naa 5.0g.l-1
琼脂 20g.l-1
蔗糖)进行继代培养;和/或步骤(g)倍性鉴定:组培苗长到至少4片叶时,(例如采用流式细胞仪)鉴定统计加倍后的四倍体、嵌合体诱导率,之后对二倍体及四倍体进行形态学、气孔指标鉴定。
[0021]
在一些实施方案中,其中所述第一时间段为例如0-5d(例如 0.5-5、1-5、2-5、3-5、4-5、3.5、4、4.5、5d),优选5d。在一些实施方案中,其中步骤(d)中,所述秋水仙素的浓度为0.1%-0.2%(例如 0.12-0.18%、0.15-0.2%、0.18-0.2%),优选0.2%。在一些实施方案中,其中步骤(d)中,所述第二时间段为1-3d(例如1-2.5、1-2d),优选1d。在一些实施方案中,所述蝴蝶兰为象鼻兰。
[0022]
本发明的第二方面提供了一种确定诱导蝴蝶兰(例如象鼻兰)种子产生多倍体及提高种子萌发率的条件的方法,包括以下步骤:
[0023]
(a)收集蝴蝶兰种子并分装到茶叶袋中;
[0024]
(b)将所述种子灭菌;
[0025]
(c)在液体培养基中培养灭菌后的所述种子,持续第一时间段,其中所述第一时间段为例如0-10(例如0、5、10d)d;
[0026]
(d)向所述液体培养基中添加秋水仙素,使所述秋水仙素的浓度为例如0.05%-0.2%(例如0.05%、0.1%、0.2%),处理第二时间段,其中所述第二时间段为例如1-5d(例
如1、3、5d);
[0027]
(e)将步骤(d)所得种子播种至第一固体培养基(例如1/2ms 20 g
·
l-1
蔗糖 100g.l-1
椰汁 5.0g.l-1
琼脂),60d后统计其萌发率;
[0028]
(f)将萌发后的种子转接至第二固体培养基(例如1/2ms 1.0 mg.l-1 6-ba 0.2mg.l-1
naa 5.0g.l-1
琼脂 20g.l-1
蔗糖)继代培养,;以及
[0029]
(g)组培苗长到至少4片叶时,采用例如流式细胞仪鉴定统计加倍后的四倍体、嵌合体诱导率,之后对二倍体及四倍体进行形态学、气孔指标鉴定。
[0030]
在第二方面的一些实施方案中,本发明的方法包括:
[0031]
(a)分装蝴蝶兰种子:采收的果荚用无菌水清洗后,用剪刀剪开,将不同果荚的种子混匀放入提前灭菌的茶叶袋,用回形针固定;
[0032]
(b)种子灭菌:先用无菌水清洗两次,再用75%酒精灭菌30s,之后用无菌水清洗一次,再用0.1%升汞灭菌10min,最后用清水清洗 2-3次;
[0033]
(c)震荡培养第一时间段(例如0、5、10d):将灭菌后的茶叶袋放入液体培养基1/2ms 20g.l-1
蔗糖 100g.l-1
椰汁中震荡培养,摇床转速为100r/min,每个培养瓶约100ml;
[0034]
(d)秋水仙素处理:液体培养基震荡培养不同时间后,加入不同量的秋水仙素配成浓度为0.05%、0.1%、0.2%的秋水仙素,处理第二时间段(例如1、3、5d);
[0035]
(e)播种至第一固体培养基1/2ms 20g.l-1
蔗糖 100g.l-1
椰汁 5.0g
·
l-1琼脂:液体培养基震荡培养、秋水仙素处理完后,将茶叶袋剪开,晾干后播种到在固体培养基中,60d后统计其萌发率;
[0036]
(f)统计萌发率:种子萌发后,将其转接至第二固体培养基 1/2ms 1.0g.l-1
6-ba 0.2mg.l-1
naa 5.0g.l-1
琼脂 20g.l-1
蔗糖;以及
[0037]
(g)倍性鉴定:主要采用流式细胞仪鉴定统计加倍后的四倍体、嵌合体诱导率,之后对二倍体及四倍体进行形态学、气孔指标鉴定。
[0038]
在一些实施方案中,所述流式细胞仪鉴定包括:当蝴蝶兰(例如象鼻兰)组培苗长到至少4片叶时,以未处理的植株叶片为对照,以秋水仙素处理后的各组为材料进行倍性鉴定,采用流式细胞仪进行倍性鉴定。在一些实施方案中,采用sysmex cystain uv precise p试剂盒,以蝴蝶兰二倍体植株为对照,对秋水仙素处理后的植株进行倍性测定。
[0039]
在一些实施方案中,通过如下步骤确定处理后的植株的倍性:(1) 取待测植株新鲜叶片0.5cm2,置于培养皿中,取400μl cystain uvprecise p nuclei extraction buffer萃取液滴加在叶片上,用刀片将叶片先横向再纵向充分切碎;(2)2min后,将切碎后的悬浮液用50μm微孔滤膜过滤到样品管中,再加入1600μl cystain uv precise p stainingbuffer染液,避光染色2min;以及(3)用(例如cy-s-3039)流式细胞仪进行分析,每个样品重复2次,并以流式细胞仪倍性分析结果为标椎,统计四倍体、嵌合体数量、计算比率。
[0040]
在一些实施方案中,所述形态学指标鉴定包括:随机选取流式细胞仪鉴定后的二倍体和四倍体进行植株表型和气孔指标的观察记录,并对植株叶片长宽、气孔长宽及单位面积气孔数进行测量统计。
[0041]
在一些实施方案中,采用指甲油涂抹技术测定法(例如强等
[20]
的方法)鉴定所述气孔指标。在一些实施方案中,所述气孔指标鉴定包括:(1)取二倍体和四倍体植株各10株
相同部位的叶片,在叶片下表皮涂抹一层无色透明指甲油;(2)10min后,待叶片自然干燥后,用镊子轻轻撕取叶片下表皮,平铺在载玻片上,盖上盖玻片压平;以及(3)在leica倒置显微镜(例如北京东方澳洲科技发展有限公司,北京丰台区)下观察并拍照。在一些实施方案中,在10
×
10倍的显微镜下随机选择六个气孔分布均匀的视野,观测单位面积内的气孔数量,并(例如用camera measure)随机测量10
×
40倍显微镜下30 个气孔长度和宽度。
[0042]
在一些实施方案中,本发明的方法还包括步骤(h):对获得的数据进行统计和分析,以确定适宜的诱导条件。在一些实施方案中,步骤(h)包括例如进行方差分析和采用lsd多重比较方法,其中数据变动范围值均为所有处理数据值的标准差。在一些实施方案中,采用 excel2016进行数据分析,spss2.0进行方差分析,采用lsd多重比较方法,表中数据变动范围值(
±
)为均值
±
标准差,百分数进行多重比较时均将百分数进行反正弦转换后再进行分析。
[0043]
在一些实施方案中,所述蝴蝶兰包括象鼻兰。
[0044]
本发明以象鼻兰种子为材料,采用浸泡法诱导多倍体来探究秋水仙素处理对蝴蝶兰种子染色体加倍的效果,得到了秋水仙素浸泡法诱导象鼻兰种子染色体加倍的适宜诱导条件,并且提高了象鼻兰种子的萌发率,为蝴蝶兰多倍体育种技术的优化提供了数据支撑。在此基础上,本发明提供了一种诱导蝴蝶兰(例如象鼻兰)种子产生多倍体及提高种子萌发率的方法。本发明的方法在蝴蝶兰育种中具有重要的价值,有广阔的应用前景。
附图说明
[0045]
为了更清楚地说明本发明的技术方案,下面将对本发明的附图做简单的介绍。应当理解,下面所描述的附图仅仅是出于阐释本发明的目的,而非意在限制本发明的保护范围。
[0046]
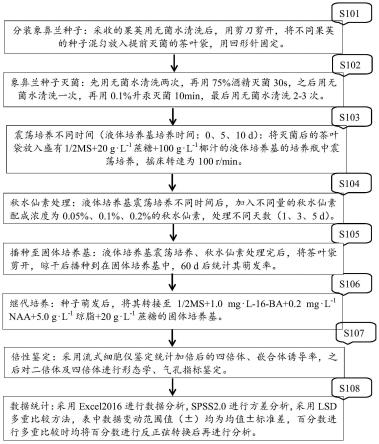
图1是根据本发明的实施方案的、利用诱导象鼻兰种子产生多倍体的方法流程图。
[0047]
图2是照片,显示根据本发明的实施方案的、象鼻兰花朵形态 (2a)、象鼻兰果荚形态(2b)、象鼻兰种子(2c)。
[0048]
图3是流式出峰图,显示根据本发明的实施方案的、秋水仙素处理后二倍体植株出峰图(3a)、四倍体植株出峰图(3b)、嵌合体植株出峰图(3c)。
[0049]
图4是显微镜照片,显示根据本发明的实施方案的、秋水仙素处理后二倍体植株形态图(4a)、四倍体植株形态图(4b)、嵌合体植株形态图(4c)。
[0050]
图5是显微镜照片,显示根据本发明的实施方案的、秋水仙素处理后二倍体气孔形态图
×
10(5a)、四倍体气孔形态图
×
10(5b)、二倍体气孔形态图
×
40(5c)、四倍体气孔形态图
×
40(5d)。
具体实施方式
[0051]
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
[0052]
在本发明中,术语“处理后的植株”一般是指经过本发明第一方面所述的方法处理后的种子长成的植株,例如经本发明的方法处理后的种子长成的具有至少4片叶的蝴蝶兰
属植株。除非上下来另有说明。
[0053]
在本发明中,当提及秋水仙素的浓度为例如0.05%、0.1%、0.2%时,指的是质量比,即秋水仙素重量分别占总溶液质量的0.05%、 0.1%、0.2%。
[0054]
在本发明中,当提及所述第一时间段为例如0-5d(天)时,指的是在液体培养基中培养灭菌后的种子达0-5d,以此类推。例如,当所述第一时间段为例如5d时,指的是在液体培养基中培养灭菌后的种子达5d;而当所述第一时间段为例如0d时,指的是不在液体培养基中培养灭菌后的种子。
[0055]
针对现有技术存在的问题,本发明提供了一种诱导蝴蝶兰(例如象鼻兰)种子产生多倍体及提高种子萌发率的方法。另一方面,本发明提供了一种确定诱导蝴蝶兰(例如象鼻兰)种子产生多倍体及提高种子萌发率的条件的方法。
[0056]
参考图1,在根据本发明的第一方面的一些实施方案的方法中,本发明的方法包括以下步骤:
[0057]
s101,分装象鼻兰种子:采收的果荚用无菌水清洗后,用剪刀剪开,将不同果荚的种子混匀放入提前灭菌的茶叶袋,用回形针固定;
[0058]
s102,象鼻兰种子灭菌:先用无菌水清洗两次,再用75%酒精灭菌30s,之后用无菌水清洗一次,再用0.1%升汞灭菌10min,最后用无菌水清洗2-3次;
[0059]
s103,震荡培养不同时间(液体培养基培养时间:0、5、10d):将灭菌后的茶叶袋放入盛有1/2ms 20g.l-1
蔗糖 100g.l-1
椰汁的液体培养基的培养瓶中震荡培养,摇床转速为100r/min;
[0060]
s104,秋水仙素处理:液体培养基震荡培养不同时间后,加入不同量的秋水仙素配成浓度为0.05%、0.1%、0.2%的秋水仙素,处理不同天数(1、3、5d);以及
[0061]
s105,播种至固体培养基:液体培养基震荡培养、秋水仙素处理完后,将茶叶袋剪开,晾干后播种到在固体培养基中,60d后统计其萌发率。
[0062]
在根据本发明的第二方面的一些实施方案的方法中,本发明的方法包括上述步骤s101-s105以及以下步骤:
[0063]
s106,继代培养:种子萌发后,将其转接至1/2ms 1.0 mg.l-1
6-ba 0.2mg.l-1
naa 5.0g.l-1
琼脂 20g.l-1
蔗糖的固体培养基;
[0064]
s107,倍性鉴定:采用流式细胞仪鉴定统计加倍后的四倍体、嵌合体诱导率,之后对二倍体及四倍体进行形态学、气孔指标鉴定;以及
[0065]
s108,数据统计:采用excel2016进行数据分析,spss2.0进行方差分析,采用lsd多重比较方法,表中数据变动范围值(
±
)均为均值
±
标准差,百分数进行多重比较时均将百分数进行反正弦转换后再进行分析。
[0066]
本发明通过用液体培养基培养种子不同的时间段,然后用不同浓度的秋水仙素对象鼻兰种子进行不同时间的诱导处理,并对处理后的结果进行统计分析,获得了用于诱导象鼻兰种子产生多倍体的适宜条件(例如液体培养时间、秋水仙素处理种子的浓度及时间)。基于此,本发明提出了一种用于诱导蝴蝶兰(例如象鼻兰)种子产生多倍体的方法,该方法能够产生较多的四倍体和嵌合体,为多倍体诱导培育花大色艳、观赏价值高的蝴蝶兰新品种奠定基础。下面结合实施例对本发明进行进一步的描述。
[0067]
实施例
[0068]
1.材料
[0069]
以2019年自交得到的象鼻兰自交结实的种子群体为材料进行染色体加倍处理,试验在中国农业科学院蔬菜花卉研究所进行,表型性状详见图2。
[0070]
2.实验方法
[0071]
试验为因素三水平实验,采用l9(34)正交设计:液体培养基培养时间(0、5、10d)、秋水仙素浓度(0.05%、0.1%、0.2%)、秋水仙素处理时间(1、3、5d)。
[0072]
3.数据统计
[0073]
采用excel2016进行数据分析,spss2.0进行方差分析,采用lsd 多重比较方法,表中数据变动范围值(
±
)均为均值
±
标准差,百分数进行多重比较时均将百分数进行反正弦转换后再进行分析。
[0074]
实施例1:秋水仙素诱导象鼻兰产生多倍体植株
[0075]
将采收的果荚用无菌水清洗后,用剪刀剪开,将不同果荚的种子混匀放入提前灭菌的茶叶袋,用回形针固定。种子灭菌程序为:先用无菌水清洗两次,再用75%酒精灭菌30s,之后用无菌水清洗一次,再用0.1%升汞灭菌10min,最后用清水清洗2-3次。将灭菌后的茶叶袋放入盛有1/2ms 20g.l-1
蔗糖 100g.l-1
椰汁的液体培养基的培养瓶中震荡培养,摇床转速为100r/min,每个培养瓶约100ml,培养时间分别为0d(即,不用液体培养基处理)、5d、10d。然后,向培养基中加入不同量的秋水仙素配成浓度为0.05%、0.1%、0.2%的秋水仙素,处理时间分别为1、3、5d。
[0076]
根据l9(34)的方法进行3因素3水平的正交设计。一共9个处理,每个处理重复三次。实验处理完后,将茶叶袋剪开,晾干后播种到在固体培养基中,60d后统计其萌发率。种子萌发后,将其转接至 1/2ms 1.0mg.l-1
6-ba 0.2mg.l-1
naa 5.0g.l-1
琼脂 20g.l-1
蔗糖的固体培养基继代培养2~3次,将苗转接至1/2ms 5.0g.l-1
琼脂 20g.l-1
蔗糖 0.3mg.l-1
naa的培养基上生根培养。培养条件:光照强度为2 000lx,每日光照时间:12~14h,温度:25
±
2℃,ph5.8。
[0077]
当象鼻兰组培苗长到至少4片叶时,以未处理的象鼻兰植株叶片为对照,对秋水仙素处理后的各组材料进行倍性鉴定。采用流式细胞仪进行倍性鉴定,统计四倍体、嵌合体数量、计算比率,结果示于表 1。同时进行方差分析,以确定不同条件对诱导结果的影响,结果见表2。
[0078]
表1液体培养基培养时间和秋水仙素处理对象鼻兰种子的诱导结果
[0079]
[0080][0081]
1表示液体培养基培养的时间
[0082]
2表示秋水仙素的浓度
[0083]
3表示秋水仙素处理的时间
[0084]
实验结果表明,浸泡法诱导产生多倍体时,液体培养时间和秋水仙素处理条件均对象鼻兰种子的成苗率有较大影响。结合表1和下面表2可知,液体培养基培养时间和秋水仙素处理浓度均对象鼻兰种子的萌发有显著影响,而秋水仙素处理时间对植株的萌发率则无显著差异。当种子在液体培养基中处理10d时,即试验号7、8、9号,种子萌发的萌发率均较低,远低于无处理时1.96%的自然萌发率,分析原因可能是液体培养时间较久会使氧气不足而使种子不能萌发。当液体培养基培养时间为0d(即,不用液体培养基处理)、5d,秋水仙素浓度低于0.2%时,萌发率较高。当液体培养基培养时间为0d,秋水仙素浓度为0.2%,秋水仙素处理时间为5d时,种子均未萌发,可能是高浓度秋水仙素处理5d对种子毒害较大。
[0085]
由表1可知,试验号6处理组合,即液体培养基培养时间为5d、 0.2%秋水仙素处理1d,可以得到最高萌发率的植株,而试验号5处理组合(即,秋水仙素浓度为0.1%)的萌发率很低,仅有0.5%。分析原因可能是,试验号6秋水仙素浓度为0.2%仅处理了1d,对种子毒害较小,而试验号5的秋水仙素处理时间较长加上液体培养基培养的时间一共有10d,种子在液体培养基中时间较长对试验结果有一定的影响。因此液体培养基培养一定时间后再用秋水仙素处理象鼻兰的萌发率较高,但种子总的处理时间和秋水仙素处理时间不宜过长。
[0086]
表2萌发率的多因素方差分析
[0087][0088][0089]
以二倍体植株为对照,采用流式细胞仪对处理后的植株进行倍性鉴定。通过流式细胞仪测定可以发现对照组均未加倍(如图3-a),秋水仙素处理后得到了四倍体植株(如图3-b)及嵌合体植株(如图3-c)。根据实验结果,当液体培养基培养5d、0.2%秋水仙素处理1d时,处理结果最好,其萌发率和四倍体、嵌合体诱导率分别为6.41%、 27.75%、34.84%,多倍体诱导率为66.59%。
[0090]
随机选取流式细胞仪鉴定后的二倍体和四倍体进行植株表型和气孔指标的观察记录,并对植株叶片长宽、气孔长宽及单位面积气孔数进行测量统计,结果示于表3中。
[0091]
表3秋水仙素所诱导蝴蝶兰植株的指标比较
[0092][0093]
注:不同大写字母上标表示差异极显著(p<0.01)。
[0094]
秋水仙素处理后的四倍体植株和二倍体植株在形态特征和气孔 特征均表现明显差异。从图4和表3可知,形态特征变化主要表现为植 株生长较为粗壮,根系多且粗壮,四倍体植株较强壮且叶片较大,叶 片长宽分别增长44.44%和111.53%;气孔特征(图5)表现为气孔增大, 气孔长宽比相差不大,气孔长宽分别增长25.19%和26.19%,单位面 积气孔数量减少,单位气孔数量降低37.41%。
[0095]
蝴蝶兰育种最常规的使用方法是杂交育种,已有100多年的历史,优势明显,但获得新品种的周期较长。多倍体育种也是获得蝴蝶兰新品种的重要方式,四倍体通常为大花型,三倍体通常为小花型或者中花型,且花量大。多倍体常具有植株粗壮、花朵较大、抗逆性较强等优点,因此多倍体诱导是培育蝴蝶兰新品种的一项重要育种技术。市场上经久不衰的蝴蝶兰品种大多为多倍体,如
‘
满天红’、
‘
大辣椒’等[4],
[5]
。象鼻兰植株小,花朵小,花量大,花型奇特,萼片、花瓣为白色且内面具紫色横纹
1.,是培育趣味蝴蝶兰,小花型蝴蝶兰的优良亲本。而且象鼻兰分布于浙江临安、宁波及安徽黄山等地,是分布纬度最高的蝴蝶兰原生种之一,推测其抗寒性较强。通过多倍体诱导产生四倍体,可以使其与其他蝴蝶兰杂交,更好地融合象鼻兰与其他蝴蝶兰的优良基因。
[0096]
蝴蝶兰加倍技术主要采用化学诱导的方式,且大多为秋水仙素离体加倍。秋水仙素离体加倍研究对象主要为原球茎、丛生芽等植物组织,未见以种子为外植体进行染色体加倍技术研究。本发明首次采用浸泡种子的方法诱导多倍体植株。本试验在加秋水仙素之前,首先把种子放在液体培养基震荡培养,当液体培养基处理时间为5d、0.2%秋水仙素处理1d时可以得到最高萌发率以及较高的四倍体和嵌合体诱导率。
[0097]
共培法也是染色体加倍技术的常用方式,张静静
[10]
采用共培法诱导铁皮石斛种子,当秋水仙素浓度为50mg.l-1
处理4个月时获得了纯合多倍体。我们也尝试采用共培法即将象鼻兰种子播种在含有浓度为 0.0002%-0.004%秋水仙素培养基上培养60-70d,再把种子播种在生根固体培养基上。但除对照组外均未获得植株,分析原因可能是因为象鼻兰种子不易萌发,且秋水仙素对种子有一定的危害,因此秋水仙素处理后的种子不易萌发。
[0098]
在本发明中,象鼻兰种子经秋水仙素浸泡诱导后获得的四倍体植株在形态特征和气孔特征方面与二倍体植株相比均发生了明显的变化,形态特征表现为,植株粗壮、根系发达且粗壮、植株生长较快等;气孔特征表现为,单位面积气孔数减少,气孔增大,长宽分别增长25.19%和26.19%。一般多倍体育种技术中,由于秋水仙素伤害植株等原因,四倍体植株一般具有生长缓慢的特征,但在本发明中,四倍体植株生长较快。原因可能是秋水仙素在种
子在萌发前期进行处理,对植株体的伤害较低,且四倍体植株吸收营养较多,使得二倍体植株生长较慢。二倍体、四倍体植株形态与气孔特征存在较大变化,因此可以将植株形态与气孔特征作为鉴定植株加倍成功的间接指标。
[0099]
参考文献
[0100]
[1]祁门发现极小种群保护物种象鼻兰[j].安徽林业科技,2017,43(04):29.
[0101]
[2]shindok,kamemotoh.2009.karyotypeanalysisofsomespeciesofphalaenopsis.cytologia,28(4):390
–
398.
[0102]
[3]kaoyy,changsb,linty,hsiehch,chenyh,chenwh,chencc.2001.differentialaccumulationofheterochromatinasacauseforkaryotypevariationinphalaenopsisorchids.annalsofbotany,87(3):387
–
395.
[0103]
[4]张迪,朱根发,叶庆生,陈和明.2013.50份蝴蝶兰种质的染色体数目与倍性分析.热带作物学报.34:1871
–
1876.
[0104]
[5]陈和明,关龙辉,朱根发,吕复兵.蝴蝶兰19个品种染色体数目分析[j].亚热带植物科学,2013,42(03):223-226.
[0105]
[6]庄东红,曲莹,许大熊,李军,陈志玲.2007.蝴蝶兰若干品种(系)的染色体数和形态分析.园艺学报,(05):1257
–
1262.
[0106]
[7]chenwh,kaoyl,tangcy,jeangt.2015.endopolyploidyinphalaenopsisorchidsanditsapplicationinpolyploidbreeding.orchidbiotechnologyii.singapore:worldscientific.
[0107]
[8]chenwh,tangcy.2018.aprotocolfortheinductionofpolyploidsinphalaenopsisorchidsbyinvitromethodwithoutusinganti-microtubuleagents.orchidpropagation:fromlaboratoriestogreenhouses—methodsandprotocols.newyork:humanapress.
[0108]
[9]nakasonehy.1960.artificialinductionofpolyploidyinorchidsbytheuseofcolchicine[ph.d.dissertation].hawaii:universityofhawaii.
[0109]
[10]张静静.2013.铁皮石斛多倍体的诱导及其鉴定[硕士论文].杭州:浙江农林大学.
[0110]
[11]王爱华.秋水仙素诱导黑喉石斛多倍体研究.2017.西南大学学报(自然科学版),39(01):55
–
60.
[0111]
[12]张青华,李枝林,唐敏,许春城,席会鹏.2011.秋水仙碱诱导铁皮石斛多倍体研究初报.云南农业大学学报(自然科学),26(5):678
–
682.
[0112]
[13]griesbachrj.1981.colchicine-inducedpolyploidyinphalaenopsisorchids.plantcelltissueandorganculture,1(1):103
–
107
[0113]
[14]griesbachrj.1985.polypioidyinphalaenopsisorchidimprovement.journalofheredity.76(1):74
–
75.
[0114]
[15]putriaa,sukmad,azizsa,danms.2019.komposisimediapertumbuhanprotokormsebelumperlakuankolkisinuntukmeningkatkanpoliploidipadaphalaenopsisamabilis(l.)blume.jurnalagronomiindonesia,46(3):306
–
313.
[0115]
[16]huynp,tamdtt,luanvq,tunght,hienvt,nganhtm.2019.invitropolyploidinductionofpaphiopedilumvillosumusingcolchicine.scientiahorticulturae,252:283
–
290.
[0116]
[17]杨丽娟.2009.大花蕙兰离体快繁关键技术及多倍体诱变研究[硕士论文].成都:四川农业大学.
[0117]
[18]刘译阳.2012.蝴蝶兰远缘杂交不亲和性及异源多倍体的创建[硕士论文].广州:华南农业大学.
[0118]
[19]choos.2019.effectofcolchicineonsurvivalrateandploidylevelofhydridbetweendendrobiumsantanaxd.friedericksianumorchid.internationaljournalofagriculturaltechnology,15(2):249
–
260.
[0119]
[20]程强强.2011.蝴蝶兰栽培品种叶片培养及八倍体诱导的研究[硕士论文].汕头:汕头大学.
[0120]
[21]刘亮.2008.蝴蝶兰离体培养再生体系的建立与多倍体诱导的研究[硕士论文].长沙:湖南农业大学。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。