1.本发明涉及生物医药技术领域,具体而言,涉及一种检测毛霉菌病病原体的试剂盒及方 法。
背景技术:
2.毛霉菌病(mucormycosis)是一种侵袭性真菌病,以前称为接合菌病,是由毛霉菌目真菌 引起的危害较大的感染性疾病。其特征为菌丝侵犯血管,引起血栓形成及坏死,产生鼻、脑、 消化道及呼吸道等处病变,预后严重。“毛霉菌病”可能造成眼、鼻发红疼痛,并伴有发烧、头 疼、咳嗽、呼吸急促等症状,严重情况下还可能造成上颌骨受损甚至失明。毛霉菌病是一种 严重但罕见的真菌感染,可能导致病人失明或其他严重问题,致死率高达50%。对免疫力低 下的人群(比如糖尿病、癌症、器官移植、艾滋病以及长期应用细胞毒类药物与皮质类固醇 等患者)致死率甚至达到80%。
3.作为机会性感染病的致病菌,icu中的新冠患者往往会使用大剂量的类固醇用于治疗炎 症,但这同时也会抑制人体免疫系统,给毛霉菌可乘之机。
4.毛霉菌目包括了55个属261个钟,其中至少有38种能明确导致人类感染,主要致病菌 包括根霉属(rhizopus spp)、毛霉属(mucor spp)和横梗霉属(lichtheimia spp,旧称absidia spp), 其次是根毛霉属(rhizomucor spp)、小克银汉霉属(cunninghamella spp)、鳞质霉属 (apophysomyces spp)等。
5.目前,毛霉病诊断方法主要包括常规检查法、血清免疫方法、分子生物学方法等,其中 常规检查法主要包括影像学、组织病理学和真菌培养等。即采用mri或ct等影像学检查的 方式可以确定疾病程度,但是不能鉴定病原菌。采用组织病理切片he、pas或银染色或直接 镜检,根据真菌特征进行判断进行初步判断,但不具有特异性,鉴定不准确。真菌培养可以 进行属和种鉴定及抗真菌药敏试验等,但是周期较长,通常需要几天到几周的时间,导致病 情延误或用药不准,增加死亡率。血清免疫学检测特异性交叉,同时很难覆盖毛霉菌多种病 原体,因此在应用时难以排出真菌间的抗原交叉反应导致假阳性或假阴性从而导致误判,比 如2012年美国加州大学洛杉矶海滨分校医学中心的洛杉矶生物医学研究所申请的《利用coth 的毛霉菌病的免疫疗法和诊断》(专利号:103998057a)可以用于检测米根霉(r.oryzae)引起 的毛霉菌病,但是对于其他类型的毛霉菌可能会存在漏检。分子检测方法是《2019年欧洲毛 霉病诊疗指南》中强烈推荐的方法,分子鉴定相对于形态学更可靠,优先推荐内部转录间隔 区(its)测序,是分子鉴定的最佳技术,可以用于流行病学研究,用于临床相对周期较长。 maldi-tof鉴定依赖内部数据库,许多实验室不具备此条件。博奥生物2018年申请的专利 《引物组及其应用》(cn109706145b)采用了lamp技术,提供的引物组合鉴定用于检测常 见的四种毛霉目真菌,即稻根霉菌(rhizopus oryzae)、伞状毛霉菌(lichtheimia corymbifera)、 卷枝毛霉菌(mucor circinelloides)和/或微小根毛霉(rhizomucor pusillus)等4种毛霉菌病致 病菌,具有高特异性和高灵敏度,但是该专利检测的毛霉菌种类较少,只针对于4种毛霉菌 病致病菌进行检测,在临床上存在假阴性的问
题。因此综上所述,由于引起毛霉菌病的致病 菌种类较多,主要涉及毛霉菌目12个属38个种,不同地区毛霉病致病菌存在一些差异,比 如apophysomyces variabilis和apophysomyces elegans在全球范围比较罕见,但是在印度引起 的毛霉病占总发病率的7.9%~25%,仅次于米根霉引起的毛霉病,目前市面上针对于毛霉菌检 测的产品或专利均是根据国际上最常见的几种毛霉菌致病菌株进行设计和检测,不能很好地 覆盖印度地区的毛霉病致病菌种类,因此存在很大漏检的风险。
6.另外,市面上基于荧光定量pcr技术的毛霉菌核酸检测试剂盒采用常规qpcr技术,运 行时间长,不包括核酸提取,仅仅核酸扩增环节一般需要1~1.5小时,甚至更长,满足不了患 者的现场检测需求。进一步的,市面上或专利中基于荧光定量pcr技术的毛霉菌核酸检测试 剂盒均采用液体试剂的形式,该产品形式需要-20℃的环境运输和保存,这种产品形式不适合 长时间运输,也不利于保存。
技术实现要素:
7.本发明旨在提供一种检测毛霉菌病病原体的试剂盒及方法,以实现准确的检测毛霉菌病 病原体。
8.为了实现上述目的,根据本发明的一个方面,提供了一种检测毛霉菌病病原体的试剂盒。 该试剂盒包括毛霉菌病病原体寡核苷酸探针,毛霉菌病病原体寡核苷酸探针包括以下探针中 的至少一种:毛霉菌病病原体寡核苷酸探针1:5'-agtcataataaacavgcccaa-3';毛霉 菌病病原体寡核苷酸探针2:5'-agtcaaaagaaacacgcccaa-3';毛霉菌病病原体寡核苷 酸探针3:5'-agccttaatagccaagccc-3';毛霉菌病病原体寡核苷酸探针4: 5'-tgtccaaaggatcaagcc-3';毛霉菌病病原体寡核苷酸探针5: 5'-aagccatagagcaaaccc-3';或毛霉菌病病原体寡核苷酸探针6: 5'-ctgccagtggcgaggac-3'。
9.进一步地,试剂盒还包括:毛霉菌病病原体正向引物1: 5'-accacaaactatgccgactagagat-3'和毛霉菌病病原体反向引物1: 5'-cccaaaaactttactttcgctaag-3';或毛霉菌病病原体正向引物2:5'
‑ꢀ
gggatcgaagacgattagataccg-3'和毛霉菌病病原体反向引物2:5'
‑ꢀ
cagaacccaaaaactttactttcgc-3'。
10.进一步地,毛霉菌病病原体寡核苷酸探针的5’端标记有荧光报告基团,3’端标记有荧光淬 灭基团和/或mgb。
11.进一步地,荧光报告基团选自fam、nex、rox、tet、tamra、joe、vic、cy3、 cy5或texas red。
12.进一步地,荧光淬灭基团选自bhq、tamra、eclipse、dabcyl、lowa blacktm rq或 lowa blacktm fq。
13.进一步地,试剂盒还包括pcr反应液和酶制剂。
14.进一步地,pcr反应液包括datps、dutps、dgtps和dctps四种核苷酸及含有镁离子 的缓冲液。
15.进一步地,酶制剂为包含有热启动的taq dna聚合酶和udg酶;可选地,试剂盒还包 括质控品,优选为阳性质控品。
16.根据本发明的另一个方面,提供一种检测毛霉菌病病原体的方法。该方法包括采
用上述 任一种检测毛霉菌病病原体的试剂盒进行pcr检测,包括以下步骤:样本dna提取,得到 样本dna;将样本dna、毛霉菌病病原体寡核苷酸探针加入到复溶液复溶的酶制剂中制得 pcr反应体系进行pcr扩增,检测毛霉菌病病原体。
17.进一步地,pcr扩增的程序为:93~97℃1~3min,93~97℃3~7s和58~62℃18~22s 45个 循环;优选的,pcr反应体系中还包括:毛霉菌病病原体正向引物和毛霉菌病病原体反向引 物:优选的,pcr检测为荧光pcr检测,毛霉菌病病原体寡核苷酸探针的5’端标记有荧光报 告基团,3’端标记有荧光淬灭基团,pcr扩增采用的pcr仪设定包括信号收集:fam通道信 号收集和vic通道信号收集。
18.本技术结合国际上毛霉菌病和印度毛霉菌病致病菌流行病学研究资料,主要针对于引起 毛霉菌的根霉属(rhizopus spp)、毛霉属(mucor spp)、横梗霉属(lichtheimia spp)、根毛霉属 (rhizomucor spp)、鳞质霉属(apophysomyces spp)、小克银汉霉属(cunninghamella spp)、以 及伞状犁头霉(absidia corymbifera)等6个属和1个种的18s rdna序列设计通用引物,以及 针对于以上种属设计各自的特异性探针,该引物探针组合适配于pcr仪平台,可以在保证检 测的特异性和灵敏度的基础上出检测结果。
附图说明
19.构成本技术的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实 施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
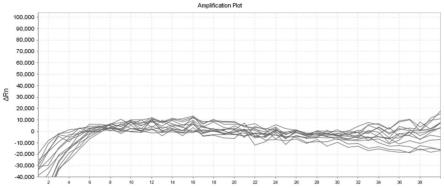
20.图1示出了引物筛选-三组引物探针组合扩增米根霉(rhizopus oryzae)阳性质粒的扩增曲 线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引物探针数据);
21.图2示出了引物筛选-三组引物探针组合扩增同合根霉(rhizopus homothallicus)阳性质粒 的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引物探针 数据);
22.图3示出了引物筛选-三组引物探针组合扩增小孢根霉(rhizopus microsporus)阳性质粒 的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引物探针 数据);
23.图4示出了引物筛选-三组引物探针组合扩增刺囊毛霉(mucor spinosus)阳性质粒的扩增 曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引物探针数据);
24.图5示出了引物筛选-三组引物探针组合扩增暗褐色毛霉(mucor fuscus)阳性质粒的扩增 曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引物探针数据);
25.图6示出了引物筛选-三组引物探针组合扩增横梗霉(lichtheimia ramosa)阳性质粒的扩 增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引物探针数据);
26.图7示出了引物筛选-三组引物探针组合扩增微小根毛霉(rhizomucor pusillus)阳性质粒 的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引物探针 数据);
27.图8示出了引物筛选-三组引物探针组合扩增雅致小克银汉霉(cunninghamella elegans) 阳性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组 引物探针数据);
28.图9示出了引物筛选-三组引物探针组合扩增雅致鳞质霉(apophysomyces elegans)阳性 质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引物 探针数据);
29.图10示出了引物筛选-三组引物探针组合扩增黑曲霉(aspergillus niger)样本核酸、健康 人唾液样本核酸和阴性对照的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针 数据;下:第3组引物探针数据);
30.图11示出了灵敏度实验数据(上:米根霉(rhizopus oryzae)1000copies/ml浓度扩增曲 线;中:米根霉500copies/ml浓度扩增曲线;下:米根霉250copies/ml浓度扩增曲线);
31.图12a、图12b和图12c示出了灵敏度实验数据(1:米根霉(rhizopus oryzae)500copies/ml 浓度扩增曲线;2:同合根霉(rhizopus homothallicus)500copies/ml浓度扩增曲线;3:小孢 根霉(rhizopus microsporus)500copies/ml浓度扩增曲线;4:刺囊毛霉(mucor spinosus) 500copies/ml浓度扩增曲线;5:暗褐色毛霉(mucor fuscus)500copies/ml浓度扩增曲线;6: 横梗霉(lichtheimia ramosa)500copies/ml浓度扩增曲线;7:微小根毛霉(rhizomucor pusillus) 500copies/ml浓度扩增曲线;8:雅致小克银汉霉(cunninghamella elegans)500copies/ml浓 度扩增曲线;9:雅致鳞质霉(apophysomyces elegans)500copies/ml浓度扩增曲线);
32.图13示出了特异性检测实验扩增曲线数据;以及
33.图14示出了精密度实验数据(上:米根霉(rhizopus oryzae)1.0e 05copies/ml浓度扩 增曲线;下:米根霉500copies/ml浓度扩增曲线)。
具体实施方式
34.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。 下面将参考附图并结合实施例来详细说明本发明。
35.针对本技术背景技术中提到的一系列技术问题,本技术提出了下列技术方案。
36.本技术结合国际上毛霉菌病和印度毛霉菌病致病菌流行病学研究资料,主要针对于引起 毛霉菌的根霉属(rhizopus spp)、毛霉属(mucor spp)、横梗霉属(lichtheimia spp)、根毛霉属 (rhizomucor spp)、鳞质霉属(apophysomyces spp)、小克银汉霉属(cunninghamella spp)、以 及伞状犁头霉(absidia corymbifera)等6个属和1个种的18s rdna序列设计通用引物,以及 针对于以上种属设计各自的特异性探针,该引物探针组合适配于pcr仪平台,可以在保证检 测的特异性和灵敏度的基础上出检测结果。
37.根据本发明一种典型的实施方式,提供检测毛霉菌病病原体的试剂盒。该试剂盒包括毛 霉菌病病原体寡核苷酸探针,毛霉菌病病原体寡核苷酸探针包括以下探针中的至少一种:
38.毛霉菌病病原体寡核苷酸探针1(seq id no.1):5'-agtcataataaacavgcccaa-3', 其中v代表a或g或c,其中,v代表a时检测毛霉属,v代表g时检测多变根毛霉,v代 表c是检测
根霉属;
39.毛霉菌病病原体寡核苷酸探针2(seq id no.2):5'-agtcaaaagaaacacgcccaa-3';
40.毛霉菌病病原体寡核苷酸探针3(seq id no.3):5'-agccttaatagccaagccc-3';
41.毛霉菌病病原体寡核苷酸探针4(seq id no.4):5'-tgtccaaaggatcaagcc-3';
42.毛霉菌病病原体寡核苷酸探针5(seq id no.5):5'-aagccatagagcaaaccc-3';
43.毛霉菌病病原体寡核苷酸探针6(seq id no.6):5'-ctgccagtggcgaggac-3'。
44.为了方便检测且检测结果准确,该探针的5’端标记有荧光报告基团,3’端标记有荧光淬灭 基团。作为本发明的进一步改进,以上荧光报告基团选自fam、nex、rox、tet、tamra、 joe、vic、cy3、cy5或texas red;荧光淬灭基团选自bhq、tamra、eclipse、dabcyl、 lowa blacktm rq或lowa blacktm fq等。另外,还可以采用mgb(minor groovebinder) 修饰基团对探针进行进一步改良。探针3’端连接有mgb修饰基团,可以将探针的tm值提高 10℃左右,从而可以加大的加强定量pcr反应过程中的特异性。
45.为了进一步提高本发明试剂盒的检测准确性,该试剂盒还还包括:毛霉菌病病原体正向 引物1(seq id no.7):5'-accacaaactatgccgactagagat-3'和毛霉菌病病原体反向引 物1(seq id no.8):5'-cccaaaaactttactttcgctaag-3';或毛霉菌病病原体正向引物 2(seq id no.9):5'-gggatcgaagacgattagataccg-3'和毛霉菌病病原体反向引物2 (seq id no.10):5'-cagaacccaaaaactttactttcgc-3'。
46.该探针的5’端标记有荧光报告基团,3’端标记有荧光淬灭基团。作为本发明的进一步改进, 以上荧光报告基团选自fam、nex、rox、tet、tamra、joe、vic、cy3、cy5或texasred;荧光淬灭基团选自bhq、tamra、eclipse、dabcyl、lowa blacktm rq或lowa blacktmfq等。另外,还可以采用mgb(minor groovebinder)修饰基团对探针进行进一步改良。探 针3’端连接有mgb修饰基团,可以将探针的tm值提高10℃左右,从而可以加大的加强定 量pcr反应过程中的特异性。
47.根据本发明一种典型的实施方式,本发明的试剂盒还包含pcr反应液、酶制剂、阳性质 控品、阴性质控品、复溶液等6个组分。其中pcr反应液主要包括datps、dutps、dgtps、 dctps等四种核苷酸、用于检测毛霉菌病病原体的荧光pcr引物和荧光探针、含有镁离子的 缓冲液组成。其中酶制剂为包含有热启动的taq dna聚合酶和udg酶等干粉制剂。其中阳 性质控品为含插入米根霉(rhizopus oryzae)特异性保守序列的质粒载体,该重组质粒转化到 大肠杆菌dh5α中增殖后经提取纯化用分光光度计测定浓度和纯度后用无菌te缓冲液稀释。 其中优选的阳性质控品的浓度为1.0
×
106copies/ml。其中阴性质控品可以为无菌te缓冲液, 该缓冲液采用分子级水配制。其中复溶液为分子级水。
48.在本发明一优选的实施例中,基于荧光pcr技术的检测毛霉菌病病原体的方法,包括如 下操作步骤:
49.1)样本dna提取:样本dna提取得到的核酸产物用于接下来的核酸检测步骤。
50.2)首先吸取900μl加入到复溶液复溶酶冻干制剂的西林瓶中,涡旋混匀,然后按照下表 1配制反应体系:
51.表1
52.组分1人份n人份(n 1阳性 1阴性)复溶酶冻干制剂5μl5
×
(n 3)
pcr反应液10μl10
×
(n 3)
53.3)然后按照每反应15μl的体系进行分装,然后加入5μl提取得到的核酸产物,混匀后 按照下列程序进行设置扩增检测。
54.4)常规qpcr仪博日gene-9660上扩增程序设置表2:
55.表2
[0056][0057][0058]
采用该程序40分钟以内可以完成全部扩增。
[0059]
5)结果分析:
[0060]
5.1实验结束后保存检测数据文件。
[0061]
5.2分析条件设置:根据分析后图像调节基线(baseline)的start值、stop值以及阈值 (threshold)的value值(用户可根据实际情况自行调整,start值可以在3-15、end值可以在 5-20,调整阴性对照的扩增曲线平直或低于阈值线),使仪器给出正确的结果。
[0062]
(1)质量控制
[0063]
阴性对照:fam通道和vic通道均无扩增曲线;
[0064]
阳性对照:fam通道和vic通道均有扩增曲线,且ct值均≤32;
[0065]
以上两个要求需在同一次实验中同时满足,否则,本次实验无效,需要重新进行实验。
[0066]
(2)结果判读
[0067]
当fam通道有扩增曲线,且ct值均≤35时可判定毛霉菌病病原体核酸阳性;
[0068]
当fam通道无扩增曲线,且ct值显示为undet或no ct,vic通道有扩增曲线且ct值 均≤35时可判定毛霉菌病病原体核酸阴性;
[0069]
当fam通道有扩增曲线,35<ct值≤40,vic通道有扩增曲线,且ct值均≤35时建议重 复一次实验,如果结果同上,可判定为毛霉菌病病原体阳性,如果无扩增,可判定为毛霉菌 病病原体阴性;
[0070]
当fam通道和rox通道均无扩增曲线,且ct值显示为undet或no ct,实验无效、建 议更换一批试剂重新实验。
[0071]
其中,ct值(cycle threshold,ct)的定义为:每个反应管内荧光信号达到设定阈值时 所经历的循环数。阈值的设定一般是将其设定为恰好可以覆盖住阴性对照和空白对照的荧光 值处,因此可以很好的去除反应管荧光值即背景。
[0072]
下面结合具体实施例,进一步详细陈述本发明,应理解,这些实施例仅用于说明本发明 而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件 如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年) 中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数
按重量计 算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
[0073]
实施例1
[0074]
引物探针的设计
[0075]
根据毛霉菌病病原体各个亚型的18s rna序列,分析其基因的保守区域,并在这些保守 区域设计多组特异性引物和探针序列。
[0076]
在上述引物和探针的设计过程中,尽可能避免发卡结构、引物内部二聚体、引物间二聚 体以及错配的形成等。通过对ncbi blast在线数据库(https://blast.ncbi.nlm.nih.gov/blast.cgi) 对上述设计的毛霉菌病病原体特异性引物和探针序列进行比对分析避免与其他致病菌或人类 基因发生非特异结合和扩增。
[0077]
在常规实时荧光定量pcr仪上进行多轮筛选和优化后,最终确定一套灵敏度和特异性最 优的引物和探针组合。
[0078]
表3毛霉菌病病原体特异性引物和探针序列
[0079]
ttgggctctggggggagtatggacgcaag
[0097]
其中雅致小克银汉霉(cunninghamellaelegans)(ah009069.2)序列,命名为cue(seqidno.26):
[0098]
aagttgagggatcgaagacgattagataccgtcgtagtcttaaccacaaactatgccgactagcgattggatcctcgccactggcaggattcagcagcttagcgaaagtaaagtttttgggttctggggggagtatgggacgcaag
[0099]
其中雅致鳞质霉(apophysomyceselegans)(af113411.1)序列,命名为ape(seqidno.27):
[0100]
aaagttaggggatcgaagacgattagataccgtcgtagtcctaaccataaactatgccgactagggatcgggtttgctctatggcttactcggaaccttagcgaaagtaaagtttttgggctctggggggagtatggtacgcaaga
[0101]
采用下列扩增体系配制三组引物探针组合,对比三组引物探针组合的扩增效率。
[0102]
表4引物探针组合单重扩增体系表
[0103][0104][0105]
注:“单重”的意思是同一管加6个探针,但是只放一种阳性质粒。
[0106]
模板采用上述构建的9种毛霉菌代表株目标片段阳性质粒梯度稀释产物,选择其
中浓度 为1
×
107copies/ml、1
×
106copies/ml、1
×
105copies/ml三个梯度,分别标记为a7、a6、a5。
[0107]
扩增程序采用下表5所示。
[0108]
表5常规荧光定量pcr仪-abi7500扩增程序
[0109][0110]
扩增结果如下表6所示:
[0111]
表6第1组引物探针组合在abi7500扩增数据
[0112]
[0113][0114]
表7第2组引物探针组合在abi7500扩增数据
[0115]
[0116]
[0117][0118]
表8第3组引物探针组合在abi7500扩增数据
[0119]
[0120][0121]
结果参见附图,其中,图1示出了引物筛选-三组引物探针组合扩增米根霉(rhizopusoryzae)阳性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下: 第3组引物探针数据);图2示出了引物筛选-三组引物探针组合扩增同合根霉(rhizopushomothallicus)阳性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据; 下:第3组引物探针数据);图3示出了引物筛选-三组引物探针组合扩增小孢根霉(rhizopusmicrosporus)阳性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据; 下:第3组引物探针数据);图4示出了引物筛选-三组引物探针组合扩增刺囊毛霉(mucorspinosus)阳性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下: 第3组引物探针数据);图5示出了引物筛选-三组引物探针组合扩增暗褐色
毛霉(mucor fuscus) 阳性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组 引物探针数据);图6示出了引物筛选-三组引物探针组合扩增横梗霉(lichtheimia ramosa)阳 性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组引 物探针数据);图7示出了引物筛选-三组引物探针组合扩增微小根毛霉(rhizomucor pusillus) 阳性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组引物探针数据;下:第3组 引物探针数据);图8示出了引物筛选-三组引物探针组合扩增雅致小克银汉霉 (cunninghamella elegans)阳性质粒的扩增曲线图(上:第1组引物探针数据;中:第2组 引物探针数据;下:第3组引物探针数据);图9示出了引物筛选-三组引物探针组合扩增雅 致鳞质霉(apophysomyces elegans)阳性质粒的扩增曲线图(上:第1组引物探针数据;中: 第2组引物探针数据;下:第3组引物探针数据);图10示出了引物筛选-三组引物探针组合 扩增黑曲霉(aspergillus niger)样本核酸;健康人唾液样本核酸和阴性对照的扩增曲线图(上: 第1组引物探针数据;中:第2组引物探针数据;下:第3组引物探针数据);从上述结果可 以看出:第二组引物探针在相同体系下扩增相同模板时性能表现较差,ct值相对于另外两组 有一定的滞后;第一、三组引物探针在相同体系下扩增相同模板时性能表现较好。
[0122]
实施例2
[0123]
灵敏度检测
[0124]
合成构建含有目的片段的质粒样本(9种含有毛霉菌阳性片段的质粒),通过浓度测定后 将相关的阳性质粒稀释到合适的浓度后再进行2倍倍比稀释,浓度分别为1000copies/ml、 500copies/ml、250copies/ml。采用上述确定的检测体系、产品形式以及循环参数对上述构建 的阳性质粒进行检测,部分结果可以参考图11,分别针对构建的9个毛霉菌菌种的浓度为 500copies/ml阳性质粒进行确认,结果参考图12a、图12b和图12c。结果表明,本发明的检 测方法具有较高灵敏度,灵敏度能够达到500copies/ml。
[0125]
实施例3
[0126]
特异性检测(参见实施例1,采用abi7500设备完成)
[0127]
本发明采用大肠杆菌、醋酸钙不动杆菌、肺炎克雷伯氏菌、奇艺变形杆菌、阴沟肠杆菌、 铜绿假单胞菌、嗜麦芽假食单胞菌、金黄色葡萄球菌、粪肠球菌、屎肠球菌、白色念珠菌、 热带念珠菌、近平滑念珠菌、黑曲霉、黄曲霉、毕赤酵母等作为特异性样本进行检测。
[0128]
检测结果如图13所示,检测特异性阳性质粒(大肠杆菌、醋酸钙不动杆菌、肺炎克雷伯 氏菌、奇艺变形杆菌、阴沟肠杆菌、铜绿假单胞菌、嗜麦芽假食单胞菌、金黄色葡萄球菌、 粪肠球菌、屎肠球菌、白色念珠菌、热带念珠菌、近平滑念珠菌、黑曲霉、黄曲霉、毕赤酵 母)。检测结果均为阴性,表明本发明的试剂盒特异性良好。
[0129]
实施例4
[0130]
重复性检测
[0131]
本发明选取浓度为1.0e 05copies/ml、500copies/ml的阳性质粒样本(含有9种毛霉菌阳 性片段的质粒)进行检测,采用上述确定的检测体系和循环参数,进行重复测试。
[0132]
检测结果参考图14,结果表明本发明的试剂盒和检测方法重复性较好。
[0133]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员 来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何
修改、等 同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。