1.本发明涉及干细胞技术领域,具体地,涉及一种外周血单个核细胞制备肝脏类器官的方法。
背景技术:
2.肝脏是人体最大的代谢器官,基于肝脏的遗传代谢性疾病种类繁多,包括脂肪肝、先天性胆道闭锁、柠檬素缺乏症、α-1抗胰蛋白酶缺乏症、酪氨酸血症ⅰ型、肝豆状核变性等等。这些肝脏疾病的发生发展研究需要良好的体内外模型,虽然国内外已根据各种疾病构建了多种动物模型,但是动物和人类在发育、生理结构和病理状态等方面存在较大差异,动物模型很难复制人类疾病的进展,因此亟需更优的疾病模型出现。
3.此时诱导多能干细胞的出现解决了这一问题,将具有患者遗传背景的多能干细胞系定向分化为类器官,可为遗传代谢疾病的个体化研究提供完整的发育及病理生理模型,为药物的筛选、基因治疗的实现提供更加安全的体外疾病模型。
4.同时,目前阶段,终末期肝病的唯一治愈手段只有肝脏移植,但供肝的短缺、移植后的免疫排斥反应及昂贵的费用把大部分患者拦在了治愈的门外。肝脏类器官也许是解决这一难题的重要突破点,将患者来源的肝脏类器官在体外扩增培养既可以解决供肝的短缺,也可以解决移植后排斥的问题。虽然现阶段类器官的培养昂贵且仍有很多不足,但未来可期。
5.诱导肝脏类器官的原理是获得肝脏祖细胞或者肝脏干细胞,由肝祖细胞或者肝干细胞进一步诱导分化为具有3d结构的肝脏类器官。目前获取人肝脏干细胞的方式主要有两种:
6.一种是从人体肝脏组织中通过分离培养获取的原代肝干细胞,但是获得肝脏组织是有创操作,尤其是对于肝功能异常或者衰竭的患者来说,肝穿刺或者肝切除等有创操作会大大增加出血风险或进一步加重肝功能恶化,因此获得肝脏组织有限而且困难。
7.另外一种重要的方式是模拟人体发育的过程,由人诱导多能干细胞(induced pluripotent stem cell,ipscs)通过诱导分化获得,由于ipscs可以由志愿者外周血单核细胞(peripheral blood mononuclear cells,pbmcs)重编程获得,采血的过程简单且相对无创,因此由外周血单核细胞重编程得到ipscs,后再由ipscs进一步诱导分化取得可以传代和扩增的人类肝脏类器官,这也许将是未来替代人类肝脏器官的重要来源。
技术实现要素:
8.目前已经存在肝脏类器官诱导方案是从原代肝脏祖细胞或者干细胞诱导得来,这种诱导方案虽可以获得和捐献者具有相同遗传背景的肝脏类器官,但是取材方式创伤过大,尤其是对于已经存在肝脏疾病或者肝衰竭的患者来说,风险极大。且原代来源的肝脏祖细胞或者干细胞在体外难以稳定扩增及保持其干细胞特性,如需要再次诱导仍需反复取材。本发明的目的是为了克服现有技术的上述不足,提供一种外周血单个核细胞制备肝脏
类器官的方法。本发明解决了这一难题,即通过一种相对无创的方式获得具有个体遗传信息的,可以在体外充分模拟肝脏发育及肝脏相关疾病病理生理过程的肝脏类器官模型,且诱导多能干细胞可在体外无限扩增及保存,为肝脏类器官的反复及规模化生产提供了基础。
9.因此本发明的第一个目的是提供一种肝祖细胞球的增殖培养基。
10.本发明的第二个目的是提供一种肝脏类器官的诱导培养基。
11.本发明的第三个目的是提供所述肝祖细胞球的增殖培养基和/或、肝脏类器官的诱导培养基在制备肝脏类器官中的应用。
12.本发明的第四个目的是提供一种多能干细胞细胞制备肝脏类器官的方法。
13.本发明的第五个目的是提供任一所述方法制备得到的肝脏类器官。
14.同时,目前对肝脏祖细胞球的培养多采用在孔板底部滴入基质胶滴,建立一个圆顶(doom)的方式,但胶滴的贴壁面极易形成贴壁细胞,不利于基质胶内3d类器官的形成。且孔板底面积有限,制作的胶滴也就数量有限。本发明设计了一种可以通过简单的离心管及枪头即可实现的胶滴制作方法,采取此种方法培养3d类器官不会出现细胞贴壁生长的情况,且凝固的基质胶可以在普通细菌皿内批量培养,为3d类器官的规模培养提供了简单的方式。
15.为了实现上述目的,本发明是通过以下方案予以实现的:
16.一种肝祖细胞球的增殖培养基,所述增殖培养基为含有n-2羟乙基哌嗪-n-2-乙烷磺酸(hepes)、glutamax、乙酰半胱氨酸、n2、b27无血清细胞培养添加剂、烟酰胺、胃泌素、a83-01、forskolin、r-spondin-1蛋白、wnt3a蛋白、和表皮细胞生长因子egf的dmem/f12基础培养基。
17.优选地,所述增殖培养基为含有9~11mm n-2羟乙基哌嗪-n-2-乙烷磺酸、0.9~1.1%(体积比)glutamax、1.20~1.3mm乙酰半胱氨酸、0.9~1.1(体积比)n2、0.9~1.1%(体积比)b27无血清细胞培养添加剂、9.5~10.5mm烟酰胺、9.5~10.5mm胃泌素、4.5~5.5μm a83-01、9.5~10.5μm forskolin、245~255μm r-spondin-1蛋白、95~105μm wnt3a蛋白、和45~55μm表皮细胞生长因子egf的dmem/f12基础培养基。
18.更优选地,所述增殖培养基为含有10mm n-2羟乙基哌嗪-n-2-乙烷磺酸、1%(体积比)glutamax、1.25mm乙酰半胱氨酸、1%(体积比)n2、1%(体积比)b27无血清细胞培养添加剂、10mm烟酰胺、10mm胃泌素、5μm a83-01、10μm forskolin、250μm r-spondin-1蛋白、100μm wnt3a蛋白、和50μm表皮细胞生长因子egf的dmem/f12基础培养基。
19.一种肝脏类器官的诱导培养基,所述诱导培养基为含有牛血清白蛋白、b27细胞培养添加剂、its细胞培养添加物、l-ascorbic acid trisodium salt、乙酰半胱氨酸、肝细胞生长因子hgf蛋白、抑瘤素m、地塞米松、表皮细胞生长因子egf蛋白、egf、8-溴-环磷酸腺苷、维生素k2、石胆酸、和y27632的hm基础培养基。
20.优选地,所述诱导培养基为0.9~1.1(质量体积比)含有牛血清白蛋白、0.9~1.1%(体积比)b27细胞培养添加剂、0.9~1.1%(体积比)its细胞培养添加物、0.15~0.25mm l-ascorbic acid trisodium salt、1.20~1.30mm乙酰半胱氨酸、19.5~20.5μm肝细胞生长因子hgf蛋白、19.5~20.5μm抑瘤素m、0.45~0.55μm地塞米松、9.5~10.5μm表皮细胞生长因子egf蛋白、95~105μm 8-溴-环磷酸腺苷、9.5~10.5μm维生素k2、9.5~10.5μm
石胆酸、和9.5~10.5μm y27632的hm基础培养基。
21.更优选地,所述诱导培养基为1%(质量体积比)含有牛血清白蛋白、1%(体积比)b27细胞培养添加剂、1%(体积比)its细胞培养添加物、0.2mm l-ascorbic acidtrisodium salt、1.25mm乙酰半胱氨酸、20μm肝细胞生长因子hgf蛋白、20μm抑瘤素m、0.5μm地塞米松、10μm表皮细胞生长因子egf蛋白、100μm 8-溴-环磷酸腺苷、10μm维生素k2、10μm石胆酸、和10μm y27632的hm基础培养基。
22.所述肝祖细胞球的增殖培养基和/或所述肝脏类器官的诱导培养基在制备肝脏类器官中的应用。
23.优选地,在多能干细胞制备肝脏类器官中的应用。
24.一种多能干细胞细胞制备肝脏类器官的方法,包括以下步骤:
25.s1.将多能干细胞诱导分化为末端前肠内胚层细胞;
26.s2.将末端前肠内胚层细胞在基质胶内重悬,之后用所述肝祖细胞球的增殖培养基培养,得到类器官细胞球;
27.s3.解离并消化上一步的得到的类器官细胞球,用所述肝脏类器官的诱导培养基培养。
28.优选地,步骤s1中,多能干细平面培养诱导分化为末端前肠内胚层细胞。
29.优选地,步骤s1中,所述多能干细胞是外周血单个核细胞重编程得到的,即所述多能干细胞是外周血单个核细胞转入oct4、sox2、klf4及c-myc后制备得到的。
30.更优选地,步骤s1中,利用重组仙台病毒载体将oct4、sox2、klf4及c-myc转入外周血单个核细胞后,在铺有饲养层细胞的细胞皿中培养,直至细胞克隆样生长,即得。
31.优选地,步骤s1中,包括以下步骤:
32.s11.将多能干细胞mtesr培养基至细胞密度达到80%,消化处理,接种于含有y27632的mtesr培养基;
33.s12.使用内胚层诱导培养基1培养,其中内胚层诱导培养基1为含有b27、wnt3a蛋白、和activin a蛋白的rpmi 1640培养基;
34.s13.使用内胚层诱导培养基2培养,其中内胚层诱导培养基2为含有b27、和activin a蛋白的rpmi 1640培养基;
35.s14.使用前肠内胚层细胞培养基培养,其中前肠内胚层细胞培养基为含有fgf2蛋白和bmp4蛋白的hcm bulletkit肝细胞培养基(lonza(cc-3199&cc-4182))。
36.更优选地,内胚层诱导培养基1为含有0.9~1.1%b27、49.5~50.5ng/ml wnt3a蛋白、和95~105ng/ml activin a蛋白的rpmi 1640培养基;
37.进一步优选地,内胚层诱导培养基1为含有1%b27、50ng/ml wnt3a蛋白、和100ng/ml activin a蛋白的rpmi 1640培养基;
38.更优选地,内胚层诱导培养基2为含有0.9~1.1%b27、和95~105ng/ml activin a蛋白的rpmi 1640培养基。
39.进一步优选地,内胚层诱导培养基2为含有1%b27、和100ng/ml activin a蛋白的rpmi 1640培养基。
40.更优选地,前肠内胚层细胞培养基为含有9.5~10.5ng/ml fgf2蛋白和19.5~20.5ng/ml bmp4蛋白的hcm bulletkit肝细胞培养基(lonza(cc-3199&cc-4182))。
41.进一步优选地,前肠内胚层细胞培养基为含有10ng/ml fgf2蛋白和20ng/ml bmp4蛋白的hcm bulletkit肝细胞培养基(lonza(cc-3199&cc-4182))。
42.更优选地,步骤s11中,接种于含有9.5~10.5μm y27632的mtesr培养基。
43.进一步优选地,步骤s11中,接种于含有10μm y27632的mtesr培养基。
44.更优选地,步骤s11中,消化处理为accutase消化处理。
45.更优选地,步骤s12中,培养0.8~1.2天。
46.进一步优选地,步骤s12中,培养1天。
47.更优选地,步骤s13中,培养2~3天。
48.进一步优选地,步骤s13中,培养2天。
49.更优选地,步骤s14中,培养5~6天。
50.进一步优选地,步骤s14中,培养5天。
51.优选地,步骤s2中,将末端前肠内胚层细胞在基质胶内重悬,所述基质胶形成的胶滴呈立体形状。
52.更优选地,步骤s2中,形成的胶滴在所述肝祖细胞球的增殖培养基培养中悬浮培养。
53.更优选地,步骤s2中,将末端前肠内胚层细胞在基质胶内重悬的方法包括以下步骤:
54.s21.将末端前肠内胚层细胞消化处理,固液分离,取细胞沉淀;
55.s22.matrigel基质胶与沉淀细胞混合,吹吸充分混合,并避免混入气泡,保持避免基质胶凝固,得到细胞基质胶悬液;
56.s23.将细胞基质胶悬液加入具有尖底或锥底的容器中,保持在容器的尖底或锥底,孵育至全部基质胶凝固;
57.s24.吹打尖底或锥底的容器底部的基质胶,转移至后续培养容器中。
58.更优选地,步骤s2中,按1~2万个细胞/50μl基质胶在基质胶内重悬。
59.优选地,步骤s2中,每2~4更换一次所述肝祖细胞球的增殖培养基。
60.更优选地,步骤s2中,每2天更换一次所述肝祖细胞球的增殖培养基。
61.优选地,步骤s2中,使用所述肝祖细胞球的增殖培养基共培养10~14天。
62.更优选地,步骤s2中,使用所述肝祖细胞球的增殖培养基共培养14天。
63.优选地,步骤s3中,枪头通过吹打的方式解离上一步的得到的类器官细胞球。
64.优选地,步骤s3中,胰酶消化上一步的得到的类器官细胞球。
65.优选地,步骤s3中,使用超低吸附表面的培养容器,用所述肝脏类器官的诱导培养基培养。
66.优选地,步骤s3中,每1~3天更换一次所述肝脏类器官培养基。
67.更优选地,步骤s3中,每2天更换一次肝脏类器官培养基。
68.优选地,步骤s3中,使用所述肝脏类器官的诱导培养基共培养10~14天。
69.更优选地,步骤s3中,使用所述肝脏类器官的诱导培养基共培养10天。
70.任一所述方法制备得到的肝脏类器官,也属于本发明的保护范围。
71.优选地,所述肝脏类器官具有肝细胞及胆管细胞。
72.与现有技术相比,本发明具有以下有益效果:
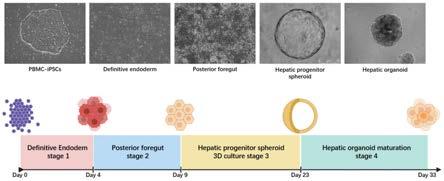
73.本发明通过一种相对无创的方式获得具有个体遗传信息的,在体外充分模拟肝脏发育及肝脏相关疾病病理生理过程的肝脏类器官模型。将采集的pbmcs通过重编程为诱导多能干细胞,进一步诱导多能干细胞诱导分化为肝脏类器官,通过这两大步骤实现上述目标,且诱导多能干细胞可在体外无限扩增及保存,为肝脏类器官的规模化生产提供了基础。
附图说明
74.图1为ipscs多能性标志物的免疫荧光鉴定、rt-pcr结果、核型分析及碱性磷酸酶染色结果。
75.图2为ipscs向内胚层分化的特异性标志物(sox17及foxa2)免疫荧光染色及rt-pcr结果。
76.图3为ipscs向肝脏类器官分化路径的白光图及模式图。
77.图4为末端前肠内胚层细胞的免疫荧光染色及rt-pcr结果。
78.图5为诱导所得末端前肠内胚层细胞hnf4a阳性的细胞比例为93.46%,诱导所得肝祖细胞球afp及alb双阳的细胞比例为95.33%。
79.图6为肝祖细胞球3d培养的第1天及第12天的对比图,特殊方法进行基质胶内细胞重悬的枪头及ep管。
80.图7为肝祖细胞球特异性标志物的免疫荧光染色及rt-pcr结果。
81.图8为肝脏类器官特异性标志物的免疫荧光染色及rt-pcr结果。
82.图9为肝脏类器官的吲哚菁绿(icg)的摄入及释放试验。
83.图10为肝脏类器官的糖原沉积染色(左)及罗丹明123染色(右)。
具体实施方式
84.下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
85.实施例中使用到所有抗体和引物信息分别见表1和表2。
86.表1:
87.抗体名称公司货号nanogcst4903sox2abcamab97959oct4santa cruzsc-9081sseasigma-aldrichmab4304tra-1-60sigma-aldrichmab4360tra-1-80sigma-aldrichmab4381sox17r&daf1924foxa2abcamab60721hnf4aabcamab41898ki67abcamab15580
tbx3abcamab99302afpr&dmab1368ck19abcamab7754epcamabcamab223582sox9abcamab185966albdakoa 0001albsigma-aldricha6684ck18abcamab181597tfabcamab214039cyp3a4santa cruzsc-53850ass1santa cruzsc-365475fahorigeneap51509pu-n
88.表2:
89.[0090][0091]
实施例1 pbmcs诱导为具有多项分化潜能的ipscs
[0092]
本实施例从捐献者的外周血中分离提取pbmcs(标本的采集获得医院伦理委员会的批准)。
[0093]
一、实验方法
[0094]
1、通过ficoll-paque梯度离心法提取pbmcs
[0095]
使用肝素抗凝管抽取捐献者外周血3ml,置于冰上备用。在15ml离心管中加入6ml淋巴细胞分离液,将试管倾斜45
°
放置。使用枪头将抗凝血混匀后,沿着试管壁缓慢加在淋巴细胞分离液上方,使淋巴细胞分离液与抗凝血形成清晰的分界线。将离心管在12摄氏度
离心,2500rpm,升速为1,降速为0,离心20分钟。离心后吸取第二层pbmcs层转移至新的离心管,加入3ml pbs清洗两次后得到pbmsc细胞悬液。
[0096]
2、将pbmcs重编程为具有多向分化潜能的ipscs
[0097]
将提取的pbmcs加入超低吸附表面ps(聚苯乙烯)24孔培养板(corning公司货号:3473)中以pbmcs作为起始细胞,使用cytotune
tm-ips 2.0仙台病毒重编程试剂盒(货号:a16517)以仙台病毒为载体在pbmcs中转染oct4、sox2、klf4及c-myc四个yamanaka因子(利用该试剂盒中的三个载体),得到克隆样生长的多能干细胞,即为具有多向分化潜能的ipscs。即将体细胞变为诱导多能干细胞,与胚胎干细胞(来源于胚胎)具有相同的功能。
[0098]
按照试剂盒说明书进行如下操作:
[0099]
(1)对提取的pbmcs进行细胞计数,按照每孔5
×
105cells接种细胞,培养两天;
[0100]
(2)使用三个仙台病毒重编程载体转导pbmcs,孵育过夜;
[0101]
(3)pbmcs全换液,去除仙台病毒重编程载体,继续培养两天;
[0102]
(4)将经过仙台病毒处理的pbmcs接种到铺有饲养层细胞的细胞皿中,继续培养两天;
[0103]
(5)使用多能干细胞培养基(mtesr catalog#05825,或者其他的多能干细胞培养基,如e8等均可)半换液一天,之后使用多能干细胞培养基全换液;
[0104]
(6)培养一周左右可看到明显的ipscs克隆生长。当ipscs克隆长至适当大小(克隆的直径为30~45um大小左右)时,在镜下挑取ipscs克隆转移至matrigel包被的培养板中,使用多能干细胞培养基继续扩增,得到具有多向分化潜能的hipsc。
[0105]
pbmcs经过重编程得到的ipscs在镜下观察,可见ipscs呈克隆样生长,核质比例高如图1中所示。
[0106]
3、将重编程所得的ipscs进行多能性标志物的免疫荧光鉴定
[0107]
使用pbs将上一步制备得到的生长在孔板的具有多向分化潜能的ipscs清洗2遍,加入4%pfa固定30min。使用0.3%tritonx-100穿透15分钟,并在室温下用10%bsa封闭45分钟,然后用对应的一抗在4℃孵育过夜。接下来,将孔板用pbs洗涤5次,每次5分钟,然后与相应的二抗在室温下孵育2小时,切片用pbs洗涤5次,每次5分钟。细胞核用dapi复染5分钟,加入pbs清洗2次后进行共聚焦显微镜观察。
[0108]
4、将重编程所得的ipscs进行碱性磷酸酶染色
[0109]
将上一步制备得到的具有多向分化潜能的ipscs在4%pfa中固定20分钟,使用碱性磷酸酶染色试剂盒进行染色。
[0110]
5、将重编程多的ipscs进行rt-pcr鉴定
[0111]
使用rnazol提取将上一步制备得到的具有多向分化潜能的ipscs的rna,通过逆转录试剂盒逆转录为cdna。使用sybr rt-pcr mix试剂盒对cdna进行rt-pcr分析。
[0112]
6、将重编程所得的ipscs进行核型分析:
[0113]
将将上一步制备得到的具有多向分化潜能的ipscs用20μg/ml秋水仙碱处理3h,然后用accutase消化成单个细胞收获,送达安基因进行检测。
[0114]
二、实验结果
[0115]
如图1中所示,对扩增的ipscs在镜下观察,可见ipscs呈克隆样生长,核质比例高(图1a);免疫荧光染色结果表明,获得的ipscs表达一系列多能性标记物,包括oct4、sox2、
nanog、ssea4、tra-1-60和tra-1-81(图1c);rt-pcr将ipscs与胚胎干细胞对比,ipscs中内源性oct4、nanog和sox2 mrna高表达(图1d);核型分析提示细胞经过重编程后染色体正常(图1e);碱性磷酸酶染色提示重编程获得的ipscs碱性磷酸酶高活性(图1b)。
[0116]
实施例2将具有多向分化潜能的ipscs经定向内胚层细胞诱导成为末端前肠内胚层细胞(posterior foregut)
[0117]
一、实验方法
[0118]
将上述实施例1制备得到的具有多向分化潜能的ipscs细胞用mtesr培养基在37℃、5%co2条件下培养,每2天更换一次培养液,扩增ipscs。当细胞密度达到80%时,用accutase消化5min,加入培养液终止消化,1100rpm离心4min。细胞计数,按照0.5~1
×
105个/cm2接种于细胞板中,使用mtesh 10μm y27632培养过夜,用于下一步向内胚层诱导。
[0119]
之后,第一天(d1)更换内胚层诱导培养基1:rpmi 1640培养基 1%(v/v)b27 50ng/ml wnt3a蛋白 100ng/ml activin a蛋白,培养一天,第二至三天(d2~d3)更换为内胚层诱导培养基2:rpmi 1640培养基 1%b27 100ng/ml activin a。诱导三天(d1~d3)可得到内胚层细胞(图3,definitive endoderm,stage1),检测表达内胚层特异性标志物sox17及foxa2。
[0120]
将上述得到的内胚层细胞更换为前肠内胚层细胞培养基:hcm bulletkit肝细胞培养基(lonza(cc-3199&cc-4182)) 10ng/ml fgf2蛋白 20ng/ml bmp4蛋白,继续培养5天(d4~d8),每天换液,可得到末端前肠内胚层细胞(图3,posterior foregut,stage2)。第八天(d8)进行末端前肠内胚层细胞特异性标志物(hnf4a、sox9、tbx3、afp、ki67、ck19及epcam)的染色;rt-qpct鉴定表达末端前肠内胚层细胞特异性标志物(hnf4a、sox9、tbx3、afp、ki67、ck19及epcam);将末端前肠内胚层细胞进行流式分析。
[0121]
二、实验结果
[0122]
内胚层继续发育可以分化为前肠、中肠及后肠。肝脏主要来源于前肠内胚层末端的细胞,即“末端前肠内胚层细胞”,英文描述是posterior foregut。
[0123]
rt-qpct鉴定内胚层特异性标志物sox17及foxa2,结果图2所示,说明了ipscs可高效率诱导为内胚层细胞。末端前肠内胚层细胞染色的结果如图4所示,结果显示ipscs诱导的末端前肠内胚层细胞可表达末端前肠内胚层细胞特异性标志物hnf4a、sox9、tbx3、afp、ki67、ck19及epcam。末端前肠内胚层细胞进行流式分析的结果如图5左所示,可见hnf4a阳性的细胞占93.46%,说明了本诱导方法效率高。
[0124]
实施例3将末端前肠内胚层细胞在基质胶内重悬培养诱导成为肝祖细胞球
[0125]
一、实验方法
[0126]
1、末端前肠内胚层细胞在基质胶内重悬
[0127]
第九天(d9)将平面培养的末端前肠内胚层细胞用pbs清洗2遍,加入accutace消化为单个细胞后加入培养基终止消化,收集在离心管中,1100rpm,离心4分钟。将细胞计数,按1~2万个细胞/50μl基质胶的细胞密度收集20~40万个细胞在1.5ml离心管中,离心后弃上清,将离心管置于冰上备用。
[0128]
取matrigel基质胶原液1ml置于冰上融化成液态,枪头放置在4℃冰箱中预冷。将1ml的matrigel基质胶加入含有细胞沉淀的离心管中,用枪头充分混匀,操作全程需在冰上进行避免基质胶凝固,且操作过程需避免混入气泡。依次吸取50μl细胞基质胶悬液加入到
备好的1.5ml离心管管底,立放于离心管架上,直至全部的细胞悬液分装完毕,图6b为其中一管分装的细胞基质胶悬液。将离心管架置于37℃培养箱中孵育20min至全部基质胶凝固,得到立体的悬浮有末端前肠内胚层细胞的基质胶滴。
[0129]
使用1ml枪头吸取培养基依次吹打离心管底部的基质胶,固态的基质胶被吹打后从离心管底部解离,使用截短的枪头(图6a)吸取基质胶及培养基加入细菌皿。
[0130]
2、肝祖细胞球的3d诱导培养
[0131]
给立体的悬浮有末端前肠内胚层细胞的基质胶滴补充足够的肝祖细胞球的增殖培养基,在37℃、5%co2条件下培养,每2天换液直至3d类器官细胞球的出现。
[0132]
其中,肝祖细胞球的增殖培养基的配方为在dmem/f12基础培养基中加入表3以下成分。
[0133]
表3
[0134]
成分终浓度n-2羟乙基哌嗪-n-2-乙烷磺酸(hepes)(gibco:15630-080)10mmglutamax(细胞培养添加剂)(gibco:35050061)1%(体积比)乙酰半胱氨酸(sigma:a9165)1.25mmn2(细胞培养添加剂)(gibco:17502-048)1%(体积比)b27无血清细胞培养添加剂(gibco:17504-044)1%(体积比)烟酰胺(sigma:n0636)10mm胃泌素(sigma:g9145)10nma83-01(selleck:s7692)5μmforskolin(selleck:s2449)10μmr-spondin-1蛋白(novoprotein:cx83)250μmwnt3a蛋白(novoprotein:c06d)100μm表皮细胞生长因子egf(novoprotein:c029)50μm
[0135]
二、实验结果
[0136]
末端前肠内胚层细胞悬浮在基质胶内第一天时为单个细胞,如图6中的day1(d9)所示,经过11天的培养,基质胶内可见3d细胞球的增殖(图6中的day12(d20),图3中的hepatic progenitor spheroid,stage3)。afp及alb的共表达可达95.33%,如图5右所示;肝祖细胞球特异性标志物的染色,如图7所示,说明了诱导的肝祖细胞球成功表达肝祖细胞特异性标志物,本方法可成功诱导得到肝脏祖细胞球。
[0137]
实施例4将肝祖细胞球诱导成为肝脏类器官
[0138]
一、实验方法
[0139]
1、肝脏类器官的诱导
[0140]
在将实施例3培养得到的3d类器官细胞球再培养3天,即共14天(d22)左右,用枪头通过吹打的方式将实施例3培养得到的含有3d类器官细胞球的基质胶滴解离成小块,同时使得基质胶内的肝祖细胞球也被吹打成小细胞团,用pbs清洗两遍后加入适量0.25%(质量体积比)胰酶消化10分钟。1500rpm,离心4分钟后可得到单细胞沉淀,将细胞使用肝脏类器官诱导培养基重悬,加入超低吸附表面ps(聚苯乙烯)培养皿中,每2天换一次液,共培养10天。肝脏类器官诱导培养基的配方为在hm基础培养基中加入表4以下成分。
[0141]
表4:
[0142][0143]
单个细胞在肝类器官诱导培养基的培养下聚集成团并增殖,形成具有肝脏功能的肝脏类器官(图3hepatic organoid,stage 4),对肝脏类器官进行免疫荧光染色,对成熟肝细胞及胆管细胞特异性特异性标志物alb、ck19、ck18、tf、cyp3a4、ass1及fah进行检测。
[0144]
2、肝脏类器官的功能鉴定
[0145]
(1)吲哚菁绿(icg)的摄入及释放试验
[0146]
去除制备得到的肝脏类器官的上清,使用pbs清洗3次,加入含1mg/ml的吲哚菁绿的hcm培养基培养箱内孵育30min,去除培养液,继续用pbs清洗3遍,加入hcm培养基。使用dmi8显微镜进行明场拍照,每小时一次直至吲哚菁绿释放完全。
[0147]
(2)糖原沉积染色
[0148]
去除制备得到的肝脏类器官的培养基,使用pbs清洗3次,使用4%pfa固定30分钟。加入高碘酸溶液10min,后用水清洗5遍。加入schiff染液避光染色5分钟,可见肝脏类器官变成紫色。用流水再次清洗5遍,使用dmi8显微镜进行明场拍照。
[0149]
(3)罗丹明123染色
[0150]
去除制备得到的肝脏类器官的培养基,使用pbs清洗3次,加入含有100um的罗丹明123的hcm培养基,在37℃孵育5min后在dmi8荧光显微镜下拍摄,可见肝脏类器官呈现绿色荧光。
[0151]
二、实验结果
[0152]
结果如图8所示,得到的具有肝脏功能的肝脏类器官的细胞,可表达肝细胞及胆管细胞特异性标志物如:alb、cyp3a4、ass1、fah、ck19、ck18及tf。
[0153]
结果如图9所示,可见诱导的肝脏类器官在0小时时摄入了吲哚菁绿,经过8小时的释放,可恢复原状态,这是肝脏的重要功能之一。
[0154]
结果如图10左所示,得到的肝脏类器官经pas染色后成紫红色,说明肝脏类器官细胞可储存糖原,此为肝脏的重要功能之一。
[0155]
结果如图10右所示,可见肝脏类器官呈现绿色荧光,说明肝脏类器官内具有活性
的线粒体被标记,这是肝脏细胞的重要功能之一。
[0156]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
