1.本技术属于合成化学技术领域,尤其涉及一种芳香胺基嘧啶唑类化合物的合成方法。
背景技术:
2.嘧啶胺类衍生物可以用于各类酶抑制剂研究工作中,例如有报道嘧啶胺类衍生物可以用于光激酶抑制剂,或者用于核内酪氨酸激酶wee-1抑制剂。嘧啶胺类骨架可作为优异的氢键受体和氢键供体,因此引入嘧啶胺类骨架对提升酶抑制剂的活性有重要帮助。嘧啶衍生物的胺化技术已经多次报道,但现有合成方法相对较为复杂,存在反应温度较高(如高达到150℃)、条件较为苛刻(如需要用到催化剂)、后续处理较为繁琐等诸多不足。
3.含唑类化合物可以广泛用于医药研究领域,前景广阔。比如用于治疗高血脂症药物pemafibrate和呼吸系统药物acebilustat,另外苯并噻唑类药物对丙型肝炎病毒(hepatitis c virus,hcv)也具备较好的抑制作用。但是,相关化合物的胺化合成技术对底物适用性不强,且耗时较长,反应条件比较苛刻,当芳香底物含有氰基等基团时极易被破坏掉,不利于规模化合成。
技术实现要素:
4.本技术的目的在于提供一种芳香胺基嘧啶唑类化合物的合成方法,旨在解决如何简单、低成本地制备芳香胺基嘧啶唑类化合物的技术问题。
5.为实现上述申请目的,本技术采用的技术方案如下:
6.本技术提供一种芳香胺基嘧啶唑类化合物的合成方法,包括如下步骤:
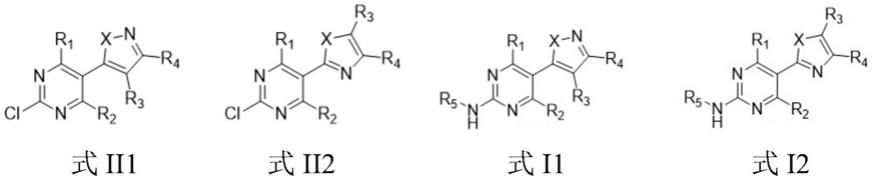
7.将式ii1或式ii2所示的氯嘧啶类化合物与芳香胺r
5-nh2混合,进行胺化反应,得到式i1或式i2所示的芳香胺基嘧啶唑类化合物;
[0008][0009]
当所述氯嘧啶类化合物的结构通式为式ii1时,所述芳香胺基嘧啶唑类化合物的结构通式为式i1;当所述氯嘧啶类化合物的结构通式为式ii2时,所述芳香胺基嘧啶唑类化合物的结构通式为式i2;
[0010]
其中,
[0011]
r1选自氢、卤素、被取代的或未被取代的c
1-c
20
烷基、被取代的或未被取代的c
1-c
20
烷氧基中的至少一种;
[0012]
r2选自氢、卤素、被取代的或未被取代的c
1-c
20
烷基、被取代的或未被取代的c
1-c
20
烷氧基、被取代的或未被取代的c
3-c
20
环烷基、被取代的或未被取代的多元脂杂环基、被取
代的或未被取代的c
6-c
20
芳基中的至少一种;
[0013]
r3选自氢、被取代的或未被取代的c
1-c
20
烷基中的至少一种;
[0014]
r4选自氢、被取代的或未被取代的c
1-c
20
烷基中的至少一种;
[0015]
r5选自被取代的或未被取代的c
6-c
20
芳基、被取代的或未被取代的芳香杂环基中的至少一种;
[0016]
x为氧或硫。
[0017]
本技术提供的芳香胺基嘧啶唑类化合物合成方法,将式ii1或式ii2所示的氯嘧啶类化合物与芳香胺r
5-nh2混合进行胺化反应从而可以得到相应的芳香胺基嘧啶唑类化合物,该反应过程的底物适用性较好,而且可以不需要钯催化剂,反应条件温和,无副反应,收率较高,因此可以适合规模化合成。
具体实施方式
[0018]
为了使本技术要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合实施例,对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。
[0019]
本技术中,术语“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b的情况。其中a,b可以是单数或者复数。字符“/”一般表示前后关联对象是一种“或”的关系。
[0020]
本技术中,“至少一种”是指一种或者多种,“多种”是指两种或两种以上。“以下至少一项(个)”或其类似表达,是指的这些项中的任意组合,包括单项(个)或复数项(个)的任意组合。
[0021]
应理解,在本技术的各种实施例中,上述各过程的序号的大小并不意味着执行顺序的先后,部分或全部步骤可以并行执行或先后执行,各过程的执行顺序应以其功能和内在逻辑确定,而不应对本技术实施例的实施过程构成任何限定。
[0022]
在本技术实施例中使用的术语是仅仅出于描述特定实施例的目的,而非旨在限制本技术。在本技术实施例和所附权利要求书中所使用的单数形式的“一种”、“所述”和“该”也旨在包括多数形式,除非上下文清楚地表示其他含义。
[0023]
本技术实施例说明书中所提到的相关成分的重量不仅仅可以指代各组分的具体含量,也可以表示各组分间重量的比例关系,因此,只要是按照本技术实施例说明书相关组分的含量按比例放大或缩小均在本技术实施例说明书公开的范围之内。具体地,本技术实施例说明书中所述的质量可以是μg、mg、g、kg等化工领域公知的质量单位。
[0024]
本技术实施例中所涉及的化合物及其衍生物均是按照iupac(国际纯粹与应用化学联合会)或cas(化学文摘服务社,位于俄亥俄州哥伦布市)命名系统命名的。因此,本技术实施例中具体涉及到的化合物基团做如下阐述与说明:
[0025]“烷基”是指直链或带有支链的、单价的、饱和脂肪链,包括但不限于如甲基、乙基、丙基、异丙基、丁基、异丁基、戊基、异戊基、己基以及其它类似基团。
[0026]“烷氧基”是指与一氧原子键合的直链或带有支链的饱和脂肪链,包括但不限于如甲氧基、乙氧基、丙氧基、丁氧基、异丁氧基、叔丁氧基以及其它类似基团。(c
a-cb)烷氧基指任何含“a”至“b”个碳原子的烷基与一氧原子键合的直链或带有支链的、单价的、饱和脂肪
链。
[0027]“环烷基”是指饱和的单环或多环烷基。环烷基包括但不限于如环丙基、环丁基、环戊基、环己基、环庚基以及其它类似基团。
[0028]“多元脂杂环基”是指没有芳香特征的杂环基,是指环烷基中的一个或多个碳原子已被如氮、氧或硫等杂原子取代。可以是三元杂环基如环氧乙烷基、四元杂环基如丙内酯基、五元杂环基等。
[0029]“芳基”是指一种环状的芳香烃,可以是单环或多环或稠环芳香烃,包括但不限于如苯基、萘基、蒽基、菲基以及其它类似基团。
[0030]“芳香杂环基”又称杂芳基,是指单环或多环或稠环芳香烃中的一个或多个碳原子已被如氮、氧或硫等杂原子取代。如果杂芳基含有不止一个杂原子,则这些杂原子可能是相同,也可能是不同的。杂芳基包括但不限于如苯并呋喃基、苯并噻吩基、苯并咪唑基、苯并恶唑基、苯并噻唑基、苯并吡喃基、呋喃基、咪唑基、吲唑基、吲嗪基、吲哚基、异苯并呋喃基、异吲哚基、异喹啉基、异噻唑基、异恶唑基、萘啶基、噁二唑基、噁嗪基、噁唑基、酞嗪基、蝶啶基、嘌呤基、吡喃基、吡嗪基、吡唑基、哒嗪基、吡啶[3,4-b]吲哚基、吡啶基、嘧啶基、吡咯基、喹嗪基、喹啉基、喹喔啉基、噻二唑基、噻三唑基、噻唑基、噻吩基、三嗪基、三唑基、呫吨基以及其它类似基团。
[0031]
上述杂原子,可以是氧原子、氮原子、硫原子等。卤素可以是包括氟、氯、溴、碘。
[0032]
未被取代的,是指上述烷基、烷氧基、环烷基、多元脂杂环基、芳基、芳香杂环基等基团的碳原子上的氢没有被取代后的基团;被取代的,是指上述烷基、烷氧基、环烷基、多元脂杂环基、芳基、芳香杂环基的碳原子上的部分氢有被取代后的基团;取代基可以是卤素、c
1-c5烷基、c
1-c5烷氧基、羟基、巯基、硝基等。
[0033]
本技术实施例提供一种芳香胺基嘧啶唑类化合物的合成方法,该合成方法包括如下步骤:
[0034]
将式ii1所示的氯嘧啶类化合物与芳香胺r
5-nh2混合,进行胺化反应,得到式i1所示的芳香胺基嘧啶唑类化合物;或者,
[0035]
将式ii2所示的氯嘧啶类化合物与芳香胺r
5-nh2混合,进行胺化反应,得到式i2所示的芳香胺基嘧啶唑类化合物;
[0036][0037]
其中,
[0038]
r1选自氢、卤素、被取代的或未被取代的c
1-c
20
烷基、被取代的或未被取代的c
1-c
20
烷氧基中的至少一种;
[0039]
r2选自氢、卤素、被取代的或未被取代的c
1-c
20
烷基、被取代的或未被取代的c
1-c
20
烷氧基、被取代的或未被取代的c
3-c
20
环烷基、被取代的或未被取代的多元脂杂环基、被取代的或未被取代的c
6-c
20
芳基中的至少一种;
[0040]
r3选自氢、被取代的或未被取代的c
1-c
20
烷基中的至少一种;
[0041]
r4选自氢、被取代的或未被取代的c
1-c
20
烷基中的至少一种;
[0042]
r5选自被取代的或未被取代的c
6-c
20
芳基、被取代的或未被取代的芳香杂环基中的至少一种;
[0043]
x为氧或硫。
[0044]
本技术实施例提供的芳香胺基嘧啶唑类化合物合成方法,将式ii1或式ii2所示的氯嘧啶类化合物与芳香胺r
5-nh2混合进行胺化反应从而可以得到相应的芳香胺基嘧啶唑类化合物,该反应过程的底物适用性较好,而且可以不需要钯催化剂,反应条件温和,无副反应,收率较高,因此可以适合规模化合成。
[0045]
在一些实施例中,式ii1或式ii2所示的氯嘧啶类化合物中,r1选自氢、卤素、被取代的或未被取代的c
1-c
20
烷基、被取代的或未被取代的c
1-c
20
烷氧基中的至少一种;其中,被取代的或未被取代的c
1-c
20
烷基可以是含1-20个碳原子的直链或者带支链的烷基,被取代的或未被取代的c
1-c
20
烷氧基可以是含1-20个碳原子的直链或者带支链的烷氧基。具体地,r1选自氢、卤素、被取代的或未被取代的c
1-c
10
烷基、被取代的或未被取代的c
1-c
10
烷氧基中的至少一种。在本技术一些实施例中,r1选自氢、卤素、未被取代的c
1-c6烷基或未被取代的c
1-c6烷氧基。
[0046]
在一些实施例中,式ii1或式ii2所示的氯嘧啶类化合物中,r2选自氢、卤素、被取代的或未被取代的c
1-c
20
烷基、被取代的或未被取代的c
1-c
20
烷氧基、被取代的或未被取代的c
3-c
20
环烷基、被取代的或未被取代的多元脂杂环基、被取代的或未被取代的c
6-c
20
芳基中的至少一种;其中,被取代的或未被取代的c
3-c
20
环烷基可以是含3-20个碳原子的单环或多环烷基,被取代的或未被取代的多元脂杂环基可以是含杂原子和2-20个碳原子的杂环基,被取代的或未被取代的c
6-c
20
芳基可以是含6-20个碳原子的芳香烃。具体地,r2选自氢、卤素、被取代的或未被取代的c
1-c
10
烷基、被取代的或未被取代的c
1-c
10
烷氧基、被取代的或未被取代的c
3-c
10
环烷基、被取代的或未被取代的多元脂杂环基、被取代的或未被取代的c
6-c
14
芳基中的至少一种。在本技术一些实施例中,r2选自氢、卤素、未被取代的c
1-c6烷基、未被取代的c
1-c6烷氧基、未被取代的c
3-c6环烷基、未被取代的三~七元脂杂环基或未被取代的c
6-c
14
芳基。
[0047]
在一些实施例中,式ii1或式ii2所示的氯嘧啶类化合物中,r3选自氢、被取代的或未被取代的c
1-c
20
烷基中的至少一种;r4选自氢、被取代的或未被取代的c
1-c
20
烷基中的至少一种;r3和r4可以相同或不同。具体地,r3选自氢、被取代的或未被取代的c
1-c
10
烷基中的至少一种;r4选自氢、被取代的或未被取代的c
1-c
10
烷基中的至少一种。在本技术一些实施例中,r3选自氢或未被取代的c
1-c6烷基,r4选自氢或未被取代的c
1-c6烷基。
[0048]
在一些实施例中,芳香胺r
5-nh2中的选自被取代的或未被取代的c
6-c
20
芳基、被取代的或未被取代的芳香杂环基中的至少一种;其中,被取代的或未被取代的芳香杂环基可以是含杂原子和3-20个碳原子的杂芳基,如五元或六元杂芳基、苯并杂环、杂环并杂环。具体地,r5选自被取代的或未被取代的c
6-c
14
芳基、被取代的或未被取代的芳香杂环基中的至少一种。在本技术一些实施例中,r5选自苯基、萘基、蒽基或菲基。
[0049]
在一些实施例中,式ii1或式ii2所示的氯嘧啶类化合物与芳香胺r
5-nh2以摩尔比1:0.6~0.8混合进行胺化反应。通过氯嘧啶类化合物的过量,可以更好地生成芳香胺基嘧啶唑类化合物。
[0050]
在一些实施例中,将式ii1或式ii2所示的氯嘧啶类化合物与芳香胺r
5-nh2溶于溶剂中,进行胺化反应。其中,溶剂包括1,4-二氧六环。进一步地,溶剂包括1,4-二氧六环和醋酸;以1,4-二氧六环和醋酸混合形成的溶剂,可以更好地促进氯嘧啶类化合物与芳香胺进行胺化反应。具体的,以1,4-二氧六环与醋酸体积比1~10:1混合,形成反应溶剂。更具体的,1,4-二氧六环与醋酸体积比优选1~5:1。
[0051]
在一些实施例中,式ii1或式ii2所示的氯嘧啶类化合物与芳香胺r
5-nh2混合进行胺化反应的温度为50~100℃,时间为1~10h。更进一步地,温度为60~100℃,时间为2~4h。上述温度和时间条件下可以更好地进行胺化反应。
[0052]
在一些实施例中,式ii1或式ii2所示的氯嘧啶类化合物,由对应的硫甲基嘧啶类化合物和含氯化合物进行氯化反应得到。
[0053]
具体地,上述含氯化合物选自磺酰氯、氯化亚砜和三氯氧磷中的至少一种;上述氯化反应的温度为0~室温(25℃),时间为0.5~24h,具体可以是2~4h。硫甲基嘧啶类化合物和含氯化合物可以在溶剂中进行氯化反应,具体地,硫甲基氯化所用溶剂可以是二氯甲烷(dcm)、醋酸等。
[0054]
具体地,本技术实施例的芳香胺基嘧啶唑类化合物的合成可以包括:(1)硫甲基嘧啶类化合物和磺酰氯等含氯化合物反应,得到产物:式ii1或式ii2所示的氯嘧啶类化合物;(2)上述氯嘧啶类化合物与相应芳香胺r
5-nh2进行反应,得到目标化合物:式i1或式i2所示的芳香胺基嘧啶唑类化合物。具体过程如下所示:
[0055][0056]
本技术实施例的上述式i1或式i2所示的芳香胺基嘧啶唑类化合物的合成方法,可以采用硫甲基嘧啶唑类化合物经反应得到对应的氯嘧啶唑类化合物后,再与芳香胺类化合物经过胺化反应即可获得。该过程可以避免钯催化剂的使用,使用的试剂及原料易得,底物适用性较好,具有反应时间短且温和、无副反应、后处理简单等诸多优点,适合将i1或式i2所示的芳香胺基嘧啶唑类化合物即芳香胺基嘧啶恶(噻)唑类化合物的规模化合成。
[0057]
下面结合具体实施例进行说明。
[0058]
实施例中的硫甲基嘧啶类化合物的合成可参考(j.med.chem.2009,52,1081
–
1099),(chem.eur.j.2011,17,9385
–
9394),(bioorg.med.chem.2015,23,5725
–
5733),(j.med.chem.2012,55,2846-2857),us 9133178 b2以及wo 2012055942。
[0059]
实施例1
[0060]
一种芳香胺基嘧啶唑类化合物的合成:
[0061]
式i1中,x为o,r1为h,r2为甲氧基,r3与r4均为h,r5为1-萘基。具体合成步骤如下:
[0062]
(1)5-(2-氯-4-甲氧基嘧啶-5-基)异恶唑合成
[0063]
在100ml圆底烧瓶中加入5-(2-甲硫基-4-甲氧基嘧啶-5-基)异恶唑500mg,加入二氯甲烷50ml,于0℃下缓慢滴加磺酰氯0.5ml,加毕后自然升至室温下反应2h反应完毕,旋干即可得到产品5-(2-氯-4-甲氧基嘧啶-5-基)异恶唑450mg,收率95.0%。用于进行下一步胺化反应。
[0064]
(2)胺化反应
[0065][0066]
于5ml圆底烧瓶中加入1-萘胺(20mg,0.14mmol),5-(2-氯-4-甲氧基嘧啶-5-基)异恶唑(44mg,0.21mmol),1,4-二氧六环2ml,冰醋酸1ml,对体系氩气置换3次,90℃反应2h,降至室温(25℃),乙酸乙酯萃取,柱层析(pe:ea=5:1),得到5-(异恶唑-5-基)-4-甲氧基-n-(萘-1-基)嘧啶-2-胺30mg,收率68.0%,纯度95%。
[0067]
所得到的产物经质谱和核磁共振确认结构,结果为:1h nmr(300mhz,cdcl3)δ(ppm):8.72(s,1h),8.18(d,j=3hz,1h),8.12(d,j=3hz,1h),7.80(d,j=3hz,1h),7.69(d,j=3hz,1h),7.54-7.59(m,1h),7.50-7.53(m,1h),7.47-7.48(m,1h),7.45(d,j=3hz,1h),6.87(d,j=3hz,1h),4.00(s,3h).ms(esi):[m h ]:319.
[0068]
实施例2
[0069]
一种芳香胺基嘧啶唑类化合物的合成:
[0070]
式i1中,x为o,r1为h,r2为甲氧基,r3与r4均为h,r5为2-蒽基。具体合成步骤如下:
[0071]
(1)5-(2-氯-4-甲氧基嘧啶-5-基)异恶唑合成
[0072]
参考实施例1。
[0073]
(2)胺化反应
[0074][0075]
于5ml圆底烧瓶中加入2-蒽基胺(20mg,0.10mmol),5-(2-氯-4-甲氧基嘧啶-5-基)异恶唑(33mg,0.16mmol),1,4-二氧六环2ml,冰醋酸1ml,对体系氩气置换3次,90℃反应2h,降至室温,乙酸乙酯萃取,柱层析(pe:ea=5:1),得到5-(异恶唑-5-基)-4-甲氧基-n-(2-蒽基)嘧啶-2-胺30mg,收率78.9%,纯度95%。
[0076]
所得到的产物经质谱和核磁共振确认结构,结果为:1h nmr(500mhz,cdcl3)δ(ppm):8.82(s,1h),8.72(s,1h),8.34(s,1h),8.30(s,1h),8.18(d,j=5hz,1h),8.01(d,j=5hz,1h),7.99(d,j=5hz,1h),7.86(d,j=10hz,1h),7.56(d,j=5hz,1h),7.52-7.55(m,1h),7.50-7.52(m,1h),6.87(d,j=5hz,1h),4.00(s,3h).ms(esi):[m h ]:367.
[0077]
实施例3
[0078]
一种芳香胺基嘧啶唑类化合物的合成:
[0079]
式i1中,x为o,r1为h,r2为甲氧基,r3甲基,r4为h,r5为1-萘基。具体合成步骤如下:
[0080]
(1)5-(2-氯-4-甲氧基嘧啶-5-基)4-甲基异恶唑合成
[0081]
在100ml圆底烧瓶中加入5-(2-甲硫基-4-甲氧基嘧啶-5-基)4-甲基异恶唑500mg,加入二氯甲烷50ml,于0℃下缓慢滴加磺酰氯0.4ml,加毕后自然升至室温下反应2h反应完毕,旋干即可得到产品5-(2-氯-4-甲氧基嘧啶-5-基)4-甲基异恶唑460mg,收率97.0%。用于进行下一步胺化反应。
[0082]
(2)胺化反应
[0083][0084]
于5ml圆底烧瓶中加入1-萘胺(20mg,0.14mmol),5-(2-氯-4-甲氧基嘧啶-5-基)4-甲基异恶唑(47mg,0.21mmol),1,4-二氧六环2ml,冰醋酸1ml,对体系氩气置换3次,90℃反应2h,降至室温,乙酸乙酯萃取,柱层析(pe:ea=5:1),得到5-(4-甲基异恶唑-5-基)-4-甲氧基-n-(萘-1-基)嘧啶-2-胺30mg,收率64.7%,纯度95%。
[0085]
所得到的产物经质谱和核磁共振确认结构,结果为:1h nmr(400mhz,cdcl3)δ(ppm):8.70(s,1h),8.45(s,1h),8.12(d,j=8hz,1h),7.79(d,j=4hz,1h),7.69(d,j=4hz,1h),7.56-7.58(m,1h),7.50-7.52(m,1h),7.47-7.48(m,1h),7.45(d,j=4hz,1h),3.99(s,3h),2.32(s,3h).ms(esi):[m h ]:333.
[0086]
实施例4
[0087]
一种芳香胺基嘧啶唑类化合物的合成:
[0088]
式i1中,x为o,r1为h,r2为甲氧基,r3甲基,r4为h,r5为2-萘基,具体合成步骤如下:
[0089]
(1)5-(2-氯-4-甲氧基嘧啶-5-基)4-甲基异恶唑合成
[0090]
参考实施例3。
[0091]
(2)胺化反应
[0092][0093]
于5ml圆底烧瓶中加入2-萘胺(20mg,0.14mmol),5-(2-氯-4-甲氧基嘧啶-5-基)4-甲基异恶唑(47mg,0.21mmol),1,4-二氧六环2ml,冰醋酸1ml,对体系氩气置换3次,90℃反应2h,降至室温,乙酸乙酯萃取,柱层析(pe:ea=5:1),得到5-(4-甲基异恶唑-5-基)-4-甲氧基-n-(萘-2-基)嘧啶-2-胺32mg,收率69.6%,纯度95%。
[0094]
所得到的产物经质谱和核磁共振确认结构,结果为:1h nmr(400mhz,cdcl3)δ(ppm):8.70(s,1h),8.52(s,1h),8.45(s,1h),7.82(d,j=4hz,1h),7.77(d,j=4hz,1h),7.74(d,j=4hz,1h),7.59(d,j=8hz,1h),7.47-7.49(m,1h),7.44-7.46(m,1h),4.00(s,3h),2.31(s,3h).ms(esi):[m h ]:333.
[0095]
以上所述仅为本技术的较佳实施例而已,并不用以限制本技术,凡在本技术的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本技术的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。