1.本发明涉及细胞检测技术领域,具体涉及一种脊髓瘢痕组织细胞急性快速分离方法。
背景技术:
2.脊髓损伤发生后,损伤区会形成瘢痕,以往认为瘢痕组织虽然封闭填充损伤区域,但其会阻碍轴突再生。随着目前研究的深入,发现瘢痕成分复杂,其形成是一个复杂的多细胞相互作用的过程,最终在损伤区形成一个由过度活化星形胶质细胞组成的半暗带(神经胶质瘢痕)和由多种基质细胞(少突胶质前体细胞、软脑膜来源源的成纤维细胞、血管来源的成纤维细胞、周细胞、室管膜细胞和巨噬细胞等)及其分泌的基质成分(胶原蛋白基质、纤连蛋白和多种蛋白聚糖等)组成的瘢痕中心(纤维瘢痕)。纤维瘢痕是阻碍轴突再生最重要的因素,研究纤维瘢痕形成的分子机制并探讨其对轴突再生的影响,寻找新的脊髓损伤治疗靶点,具有重要的科学价值和临床意义。目前对纤维瘢痕的研究通常采用免疫组织化学技术,该技术只能做终点检测,而将脊髓瘢痕组织细胞急性分离则可以进行全面的检测,可进一步推动纤维瘢痕形成的分子机制研究,而如何从脊髓瘢痕组织中分离获得足够数量且具有很好活力的成纤维细胞是以上研究的关键步骤。
3.目前,尚无针对脊髓瘢痕组织中的基质细胞的急性分离方法,常规皮肤瘢痕组织中成纤维细胞的急性分离培养方法主要是酶消化法,酶消化法利用胰蛋白酶、胶原酶等对皮肤组织进行消化,去除组织表皮后,再进行离心、重悬和培养,得到皮肤成纤维细胞。该方法可以把单个细胞从组织块中分离出来,但操作较为繁琐,对操作员的技术要求也较高,细胞分离提取效率低。
技术实现要素:
4.基于以上问题,本发明提供一种脊髓瘢痕组织细胞急性快速分离方法,本方法快速高效、操作简便,对细胞伤害小,可稳定进行多种检测,实用性强,在保证细胞活性高的同时能有效提高提取效率。
5.为解决以上技术问题,本发明提供了一种脊髓瘢痕组织细胞急性快速分离方法,包括如下步骤:
6.s1:将脊髓损伤模型大鼠麻醉后,进行背部皮肤剃毛,用碘酒或酒精消毒剃毛区,沿大鼠背部损伤区域皮肤做正中切口,钝性分离肌肉,以损伤处为中心,于上下1cm处剪断脊柱,同时剪掉两侧肋骨,即分离获得组织块,将组织块整体放入冰浴的含10%胎牛血清和2%双抗的高糖dmem中浸泡;
7.s2:将步骤s1中浸泡后的组织块转移至含双抗的pbs中,洗涤3~5遍;
8.s3:将经步骤s2处理之后的组织块置于体视显微镜下,在体视显微镜下小心分离组织块的损伤局部粘连组织,使用巴氏滴管将脊髓组织从椎管中分离,即得脊髓组织块;
9.s4:将步骤s3中的脊髓组织块转移至冰浴的含双抗的dmem培养液中,于体视显微
镜下剥离软、硬脊膜,将脊髓瘢痕组织分离,置入新的培养皿中,使用眼科剪剪碎至无肉眼可见的组织块为止,加入混合消化液,于37℃、120rpm条件下孵育30min;混合消化液由如下成分组成:木瓜蛋白酶、i型胶原酶、ii型胶原酶、iv型胶原酶和dna酶;
10.s5:向经步骤s4处理之后的溶液中加入等体积含10%胎牛血清的高糖dmem终止消化,之后使用巴氏管快吸快打组织团块,此过程需避免气泡产生;
11.s6:将步骤s5中的组织团块吹打至无明显组织块后,收集单细胞悬液,用70um网筛过滤后于800rpm条件下离心5min,收集基质细胞,备用。
12.进一步的,步骤s2中的pbs为提前置于冰水中预冷的pbs,所述pbs中含有两倍的青霉素-链霉素双抗混合物,含量为2%。
13.进一步的,步骤s4中混合消化液中各个成分的含量如下:20u/ml木瓜蛋白酶、1mg/ml i型胶原酶、1mg/ml ii型胶原酶、1mg/ml iv型胶原酶和15μg/ml dna酶。
14.进一步的,步骤s6中获得的基质细胞的分离纯化培养方法具体步骤如下:使用fc抗体阻断非特异性fc介导的相互作用后,搭配流式抗体实现4色分选,每106个细胞作为一个测试单元,使用fc抗体4℃封闭5min后,流式抗体4色分选抗体组合 dapi,包括标记周细胞的pdgfrβr-pe、标记星形胶质细胞的gfapalexa-488、标记小胶质细胞/巨噬细胞的cd11bapc和标记成纤维细胞的vimentin 750,4℃孵育半小时,用预冷pbs于400g、5min条件下洗三次后,上机;采用流式无菌分选技术,将基质细胞分选为不同的细胞种类,分选后回测,之后离心,弃上清,用选择性培养基重悬细胞并接种到新培养皿中培养,每3天半量换液,当细胞汇合度达80%~90%时得到更高纯度的某种特定的基质细胞。
15.与现有技术相比,本发明的有益效果是:本发明弥补了脊髓瘢痕组织细胞急性分离方法的空缺,所使用的混合消化液可温和消化组织,避免细胞被破坏,提高了细胞的获得效率,从而提高瘢痕细胞的培养成功率,本发明的培养成功率可高达84%,另外,本发明的基质细胞的分离纯化培养方法可将细胞纯度提高至99%,可同时分离出四种不同的瘢痕细胞,为疾病机制研究、药理转化及细胞治疗提供了有效的技术手段;本发明可大大减小瘢痕中基质细胞的损失,有效缩短成基质细胞分离的时间,对细胞伤害小,可稳定进行多种检测,操作简便,实用性强,在基质细胞急性分离及其应用等方面具有广阔的应用前景,本发明不仅适用于脊髓瘢痕组织细胞的急性分离,同时也适用于其他部位瘢痕组织细胞的急性分离或原代细胞培养。
附图说明
16.图1为本发明的实施例中流式无菌分选前样本中的细胞状态图;
17.图2为本发明的实施例中流式四色分选的抗体配色图;
18.图3为本发明的实施例中流式四色分选的分选方案图;
19.图4为本发明的实施例中周细胞原代培养明场图片;
20.图5为本发明的实施例中细胞活力结果图;
21.图6为本发明的实施例中周细胞原代培养鉴定图片;
22.图7为本发明的实施例中小胶质细胞原代培养明场图片;
23.图8为本发明的实施例中细胞活力结果图;
24.图9为本发明的实施例中小胶质细胞原代培养鉴定图片;
25.图10为本发明的实施例中星形胶质细胞原代培养明场图片;
26.图11为本发明的实施例中细胞活力结果图;
27.图12为本发明的实施例中星形胶质细胞原代培养鉴定图片;
28.图13为本发明的实施例中成纤维细胞原代培养明场图片;
29.图14为本发明的实施例中细胞活力结果图;
30.图15为本发明的实施例中成纤维细胞原代培养鉴定图片。
具体实施方式
31.为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例和附图,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
32.实施例:
33.本实施例在无菌环境中建立了大鼠胸10节段脊髓挫伤模型,术后4天,采用如下步骤进行培养:
34.s1:将所有待使用实验用具进行高温高压灭菌,并在超净台紫外灯下灭菌30min,备用;配制含10%胎牛血清和2%双抗的高糖dmem及pbs(含2%双抗),置于冰上,备用;脊髓损伤模型大鼠安乐死后,进行背部皮肤剃毛,用碘酒或酒精消毒,沿背部损伤区域皮肤做正中切口,钝性分离肌肉,以损伤处为中心,于上下1cm处剪断脊柱,同时剪掉两侧肋骨,连同脊柱在2min内取下,即分离获得组织块,将组织块整体放入冰浴的含10%胎牛血清和2%双抗的高糖dmem中浸泡;
35.s2:将步骤s1中浸泡后的组织块转移至含双抗的pbs中,洗涤3~5遍,以在分离细胞前洗去血丝,尽可能降低血细胞及其他杂细胞的残余量,防止污染;本实施例的pbs为提前置于冰水中预冷的pbs,所述pbs中含有两倍的青霉素-链霉素双抗混合物;
36.s3:将经步骤s2处理之后的组织块置于体视显微镜下,在体视显微镜下使用显微镊及显微剪小心分离组织块的损伤局部粘连组织,使用巴氏滴管将脊髓组织从椎管中分离,即得脊髓组织块;
37.s4:将步骤s3中的脊髓组织块转移至冰浴的含双抗的dmem培养液中,于体视显微镜下剥离软、硬脊膜,将脊髓瘢痕组织分离,置入新的培养皿中,使用眼科剪剪碎至无肉眼可见的组织块为止,加入混合消化液,于37℃、120rpm条件下孵育30min;混合消化液由如下成分组成:木瓜蛋白酶、i型胶原酶、ii型胶原酶、iv型胶原酶和dna酶,本实施例的混合消化液中各个成分的含量如下:20u/ml木瓜蛋白酶、1mg/ml i型胶原酶、1mg/ml ii型胶原酶、1mg/ml iv型胶原酶和15μg/ml dna酶;体视显微镜下剥离软硬脊膜,分离脊髓瘢痕组织,整个分离过程在体视显微镜下完成,充分的剥离硬脊膜和软脊膜,避免其含有的成纤维细胞对瘢痕细胞的分离有效率、准确性产生影响;
38.s5:向经步骤s4处理之后的溶液中加入等体积含10%胎牛血清的高糖dmem终止消化,之后使用巴氏管快吸快打组织团块,此过程需避免气泡产生;
39.s6:将步骤s5中的组织团块吹打至无明显组织块后,收集单细胞悬液,用70um网筛过滤后于800rpm条件下离心5min,收集基质细胞,做后续实验分析(如原代培养、流式细胞分析、单细胞测序等);本实施例采用800rpm低速离心,可减少对细胞的剪切力损害。
40.本实施例对前述步骤中获得的基质细胞做了流式细胞分析分选,具体步骤如下:使用fc抗体阻断非特异性fc介导的相互作用后,搭配流式抗体实现4色分选,每106个细胞作为一个测试单元,使用fc抗体4℃封闭5min后,流式抗体4色分选抗体组合 dapi(标记周细胞的pdgfrβr-pe、标记星形胶质细胞的gfapalexa-488、标记小胶质细胞/巨噬细胞的cd11bapc和标记成纤维细胞的vimentin 750)4℃孵育半小时,预冷pbs洗三次后(400g,5min每次),上机;采用流式无菌分选技术,将基质细胞分选为不同的细胞种类,分选后回测,见表1,各管中细胞阳性率达90%;将分选后的各组分细胞悬液离心,弃上清,用选择性培养基重悬细胞并接种到新培养皿培养,每3天半量换液,当细胞汇合度达80%~90%时得到更高纯度的某种特定的基质细胞。
41.表1流式分选后细胞纯度鉴定-流式回测结果
42.细胞分类回测阳性率pdgfrβ
周细胞90%cd11b
小胶质细胞/巨噬细胞91.6%gfap
星形胶质细胞90.6%vimentin
成纤维细胞93%
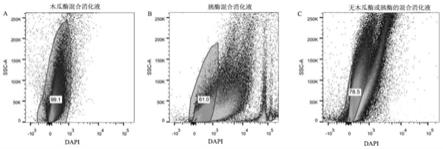
43.为了凸显本发明的优势,本实施例还采用胰酶替代木瓜蛋白酶及不加木瓜蛋白酶或胰酶(胶原酶与dna酶浓度不变)的混合消化液处理组织块,提取单细胞悬液,见附图1,本实施例在细胞分离后和开始分选前,采用dapi阳性检测死亡细胞比例,可见利用本发明的方法处理之后99%为活细胞,活细胞比例明显高于其他处理组。见附图2,其中虚线为激发光,实线为发射光,可见各荧光配色可以很好的区分,为流式分选提供了基础。见附图3,为本实施例中流式四色分选的分选方案图,分选采用排除模式。
44.见附图4,为本实施例中周细胞原代培养第3天、5天、7天、9天、11天、13天明场图片,待融合度达到90%传代对细胞进行增值能力检测,根据图4可以看出周细胞的增长符合增长曲线,传代后1-3天增长缓慢,第4-6天,细胞增长迅速,进入生长对数期,第7天达平台期,生长缓慢;见附图5,图5表明细胞活力良好。见附图6,为本实施例中周细胞原代培养使用特异性抗体pdgfrβ鉴定的图片。
45.见附图7,为本实施例中小胶质细胞原代培养第5天、9天、14天明场图片,待融合度达到90%传代对细胞进行增值能力检测,根据图7可以看出周细胞的增长符合增长曲线,传代后1-3天增长缓慢,第4-5天,细胞增长迅速,进入生长对数期,第6-7天达平台期,生长缓慢。见附图8,图8表明细胞活力良好。见附图9,为本实施例中小胶质细胞原代培养鉴定图片。
46.见附图10,为本实施例中星形胶质细胞原代培养第3天、5天、7天、9天、11天、13天明场图片,待融合度达到90%传代对细胞进行增值能力检测,根据图10可以看出周细胞的增长符合增长曲线,传代后1-2天增长缓慢,第3-5天,细胞增长迅速,进入生长对数期,第6-7天达平台期,生长缓慢。见附图11,图11表明细胞活力良好。
47.见附图12,为本实施例中星形胶质细胞原代培养鉴定图片。
48.见附图13,为本实施例中成纤维细胞原代培养第5天、7天、9天、11天、13天明场图片,待融合度达到90%传代对细胞进行增值能力检测,根据图13可以看出周细胞的增长符合增长曲线,传代后1-2天增长缓慢,第3-4天,细胞增长迅速,进入生长对数期,第5-6天达
平台期,生长缓慢。见附图14,图14表明细胞活力良好。
49.见附图15,为本实施例中成纤维细胞原代培养鉴定图片。
50.如上即为本发明的实施例。上述实施例以及实施例中的具体参数仅是为了清楚表述发明验证过程,并非用以限制本发明的专利保护范围,本发明的专利保护范围仍然以其权利要求书为准,凡是运用本发明的说明书及附图内容所作的等同结构变化,同理均应包含在本发明的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。