1.本发明涉及分析检测技术领域,具体涉及一种肉毒毒素特异性底物肽、检测试剂盒和检测方法。
背景技术:
2.肉毒毒素(肉毒神经毒素)是由肉毒梭状芽孢杆菌产生的一种已知对人类毒性最强的天然蛋白质毒素,对人的半数致死量为0.1-1.0ng/kg。肉毒毒素共分为a、b、c、d、e、f、g七个血清型,其中a、b、e、f型对人类有毒害作用,c、d型能引起动物中毒,g型很少见。肉毒毒素a、b两个型别在临床上广泛用于神经内科、整形外科、康复科等多领域。肉毒梭菌中毒可造成食源性疫情发生。肉毒毒素血清型的鉴别、质量控制在医疗、疫情防控领域均具有非常重要的作用。
3.目前,小鼠动物实验仍是肉毒毒素检测的国标方法,但该方法操作繁琐、结果变异系数大、试验周期长,动物需求量大、成本高,因此,需要寻找动物实验替代的方法,相关研究主要从免疫学、细胞学、质谱法等方面开展。目前商业化的肉毒毒素检测试剂盒仅有a型肉毒毒素检测elisa试剂盒。因此,建立肉毒毒素快速、灵敏的鉴定、分型方法具有极其重要的意义。
技术实现要素:
4.本发明的目的是提供一种肉毒毒素特异性底物肽、检测试剂盒和检测方法。
5.本发明的主要构思如下:具有活性(毒性)的肉毒毒素可以作为酶切割肽段的特异位点,根据不同血清型的肉毒毒素特异性切割的位点不同,本发明设计了针对a、b、e、f血清型肉毒毒素特异性的底物肽段,该肽段在被样本中有活性的肉毒毒素特异性切割后会形成两条新的型别特异性目的肽段,通过质谱检测这两条目标肽段即可判断样本中是否有肉毒毒素并确定血清型。
6.具体地,本发明提供以下技术方案:第一方面,本发明提供肉毒毒素特异性底物肽,所述底物肽为氨基酸序列如seq id no.1-4所示的多肽中的一种或多种,其中,seq id no.1所示序列中,xaa代表正亮氨酸,seq id no.3所示序列中xaa代表高精氨酸。
7.上述底物肽中,氨基酸序列如seq id no.1所示的底物肽为a型肉毒毒素特异性底物肽,能够被a型肉毒毒素特异性、高效切割并产生两条特征性产物肽,且不会被b、e和f型肉毒毒素切割。
8.氨基酸序列如seq id no.2所示的底物肽为b型肉毒毒素特异性底物肽,能够被b型肉毒毒素特异性、高效切割并产生两条特征性产物肽,且不会被a、e和f型肉毒毒素切割。
9.氨基酸序列如seq id no.3所示的底物肽为e型肉毒毒素特异性底物肽,能够被e型肉毒毒素特异性、高效切割并产生两条特征性产物肽,且不会被a、b和f型肉毒毒素切割。
10.氨基酸序列如seq id no.4所示的底物肽为f型肉毒毒素特异性底物肽,能够被f
型肉毒毒素特异性、高效切割并产生两条特征性产物肽,且不会被a、b、e型肉毒毒素切割。
11.上述底物肽的n端和/或c端还可包含乙酰基、氨基的修饰。
12.在本发明的一些实施方式中,本发明提供的肉毒毒素特异性底物肽为以下多肽:a型:acetyl-rgsnkkpidagnqratrxlggr-nh2;其中,x代表正亮氨酸;b型:lselddraadlqagasqfessaaklkrkywwknlk;e型:wwwaklgqeidrtnrqkdximakadsnkr-nh2;其中,x代表高精氨酸;f型:tsnrrlqqtqaqvdevvdirmvnvdkvlerdqklselddradal。
13.其中,a型特异性底物肽的质荷比m/z为2406
±
1,b型特异性底物肽的质荷比m/z为4025
±
1,e型特异性底物肽的质荷比m/z为3614
±
1,f型特异性底物肽的质荷比m/z为5111
±
1。
14.采用上述四种底物肽并结合其经切割产生的特征性目的肽段进行a、b、e、f血清型肉毒毒素的鉴定,具有较高的特异性和灵敏度。
15.第二方面,本发明提供与上述肉毒毒素特异性底物肽相关的生物材料,所述生物材料为以下(1)-(4)中的任一种:(1)核酸分子,所述核酸分子编码所述肉毒毒素特异性底物肽;(2)表达盒,所述表达盒包含(1)中所述的核酸分子;(3)载体,所述载体包含(1)中所述的核酸分子;(4)宿主细胞,所述宿主细胞包含(1)中所述的核酸分子,或包含(2)中所述的表达盒,或包含(3)中所述的载体。
16.基于上述提供的肉毒毒素特异性底物肽的氨基酸序列以及密码子规则,本领域技术人员能够获得编码所述肉毒毒素特异性底物肽的核酸分子的核苷酸序列,基于密码子的简并性,编码所述肉毒毒素特异性底物肽的核酸分子的核苷酸序列并不唯一,但所有能够编码产生具有上述氨基酸序列的多肽的核酸分子均在本发明的保护范围内。
17.上述(2)中,所述表达盒可由启动子和编码所述肉毒毒素特异性底物肽的基因组成。根据表达需要以及表达盒上下游序列的不同,表达盒中还可包含终止子,或者含有增强子等其他转录、翻译调控元件。
18.上述(3)中,所述载体可为质粒载体、噬菌体、病毒等载体,其中,质粒载体包括复制型载体和非复制型载体,复制型载体包括表达载体和克隆载体。
19.上述(4)中,所述宿主细胞为微生物细胞或动物细胞,所述微生物细胞包括但不限于大肠杆菌,所述动物细胞可为常用于蛋白表达的动物细胞。
20.第三方面,本发明提供一种检测肉毒毒素的特征性多肽组,所述特征性多肽组为氨基酸序列如seq id no.5-6所示的多肽组、seq id no.7-8所示的多肽组、seq id no.9-10所示的多肽组和/或seq id no.11-12所示的多肽组,其中,seq id no.6所示序列中,xaa代表正亮氨酸,seq id no.9所示序列中xaa代表高精氨酸。
21.所述特征性多肽组为质荷比m/z分别为1427
±
1和999
±
1的多肽组、质荷比m/z分别为1760
±
1和2283
±
1的多肽组、质荷比m/z分别为2501
±
1和1133
±
1的多肽组和/或质荷比m/z分别为3784
±
1和1346
±
1的多肽组。
22.上述特征性多肽组由两条、四条、六条或八条特征性多肽组成。
23.所述特征性多肽为由所述肉毒毒素特异性底物肽分别经其对应的血清型肉毒毒
素(a、b、e、f型)切割后产生的产物肽。其中,氨基酸序列如seq id no.5-6所示的多肽组(质荷比m/z分别为1427
±
1和999
±
1)是由氨基酸序列如seq id no.1所示的底物肽经a型肉毒毒素切割产生;氨基酸序列如seq id no.7-8所示的多肽组(质荷比m/z分别为1760
±
1和2283
±
1)是由氨基酸序列如seq id no.2所示的底物肽经b型肉毒毒素切割产生;氨基酸序列如seq id no.9-10所示的多肽组(质荷比m/z分别为2501
±
1和1133
±
1)是由氨基酸序列如seq id no.3所示的底物肽经e型肉毒毒素切割产生;氨基酸序列如seq id no.11-12所示的多肽组(质荷比m/z分别为3784
±
1和1346
±
1)是由氨基酸序列如seq id no.4所示的底物肽经f型肉毒毒素切割产生。
24.在本发明的一些实施方式中,本发明提供的特征性多肽为以下多肽:a型特征性多肽:acetyl-rgsnkkpidagnq和ratrxlggr-nh2;其中,x代表正亮氨酸;b型特征性多肽:lselddraadlqagasq和fessaaklkrkywwknlk;e型特征性多肽:wwwaklgqeidrtnrqkdx和imakadsnkr-nh2,其中,x代表高精氨酸;f型特征性多肽:tsnrrlqqtqaqvdevvdirmvnvdkvlerdq和klselddradal。
25.第四方面,本发明提供所述肉毒毒素特异性底物肽或所述生物材料或所述检测肉毒毒素的特征性多肽组的以下(1)-(3)中的任一种应用:(1)在制备用于检测肉毒毒素的产品中的应用;(2)在制备用于甄别a、b、e和f血清型肉毒毒素的产品中的应用;(3)在非疾病诊断目的的肉毒毒素检测中的应用。
26.上述(1)中,检测肉毒毒素优选为检测待测样品中是否含有肉毒毒素,尤其是是否含有肉毒毒素a、b、e和/或f血清型。其中,所述肉毒毒素特异性底物肽可制备为检测试剂的反应底物。
27.上述(2)中,甄别a、b、e和f血清型肉毒毒素优选为甄别待测样品中所含肉毒毒素的血清型为a、b、e、f血清型中的哪一种。其中,所述肉毒毒素特异性底物肽可制备为检测试剂的反应底物。
28.上述待测样品可为已确定含有或疑似含有肉毒毒素的样品,利用本发明提供的底物肽和检测方法可鉴别其所含有的肉毒毒素血清型,也可为不确定是否含有肉毒毒素的样品,利用本发明提供的底物肽和检测方法可确定其是否含有肉毒毒素并鉴别其所含有的肉毒毒素血清型。
29.上述待测样品包括但不限于人或动物的体液(例如:尿液或血液)、呕吐物或排泄物、食品、化妆品、药品、环境样品(例如:水或土壤)等。
30.上述产品包括检测试剂或试剂盒。
31.第五方面,本发明提供一种肉毒毒素检测试剂盒,所述试剂盒包含以下(1)和/或(2):(1)所述肉毒毒素特异性底物肽;(2)所述检测肉毒毒素的特征性多肽组。
32.为便于待测样品处理和检测,所述试剂盒还包含样本富集试剂和/或反应缓冲液;其中,所述样本富集试剂包含链霉亲和素-生物素磁珠偶联的与肉毒毒素血清型对应的抗体;
所述反应缓冲液包含0.05-0.1m hepes、20-30mm dtt和15-25μm zncl2。
33.上述样本富集试剂能够通过磁珠富集待测样品中的肉毒毒素,便于肉毒毒素的检测。
34.上述反应缓冲液用于作为肉毒毒素切割其对应的特异性底物肽的反应。
35.此外,所述试剂盒还可包含选自pbst、bsa、α-氢基-4-羟基肉桂酸、质谱仪标准校正液中的一种或多种。
36.上述试剂盒基于质谱(优选为基质辅助激光解吸电离飞行时间质谱(maldi-tof ms))技术对待测样品进行检测,采用待测样品对所述肉毒毒素特异性底物肽进行酶切处理,得到酶切产物;将所述酶切产物进行质谱分析,根据酶切产物的氨基酸序列或质谱峰的质荷比m/z判断待测样品中是否含有肉毒毒素及其所含肉毒毒素的血清型。
37.具体地,若酶切产物中含有氨基酸序列如seq id no.5-6所示的多肽,或者质谱峰中含有质荷比m/z为1427
±
1和999
±
1的特征峰,则待测样品中含有a血清型肉毒毒素;若酶切产物中含有氨基酸序列如seq id no.7-8所示的多肽,或者质谱峰中含有质荷比m/z为1760
±
1和2283
±
1的特征峰,则待测样品中含有b血清型肉毒毒素;若酶切产物中含有氨基酸序列如seq id no.9-10所示的多肽,或者质谱峰中含有质荷比m/z为2501
±
1和1133
±
1的特征峰,则待测样品中含有e血清型肉毒毒素;若酶切产物中含有氨基酸序列如seq id no.11-12所示的多肽,或者质谱峰中含有质荷比m/z为3784
±
1和1346
±
1的特征峰,则待测样品中含有f血清型肉毒毒素;其中,seq id no.6所示序列中,xaa代表正亮氨酸,seq id no.9所示序列中xaa代表高精氨酸。
38.第六方面,本发明提供一种非疾病诊断目的的肉毒毒素检测方法,所述方法包括:采用待测样品对所述肉毒毒素特异性底物肽进行酶切处理,得到酶切产物;将所述酶切产物进行质谱分析,根据酶切产物的氨基酸序列或质谱峰的质荷比m/z获得以下结果中的至少一种:(1)待测样品是否含有肉毒毒素;(2)待测样品含有的肉毒毒素的血清型。
39.其中,根据质谱峰的质荷比m/z进行结果判断的方法为:若酶切产物中含有氨基酸序列如seq id no.5-6所示的多肽,或者质谱峰中含有质荷比m/z为1427
±
1和999
±
1的特征峰,则待测样品中含有a血清型肉毒毒素;若酶切产物中含有氨基酸序列如seq id no.7-8所示的多肽,或者质谱峰中含有质荷比m/z为1760
±
1和2283
±
1的特征峰,则待测样品中含有b血清型肉毒毒素;若酶切产物中含有氨基酸序列如seq id no.9-10所示的多肽,或者质谱峰中含有质荷比m/z为2501
±
1和1133
±
1的特征峰,则待测样品中含有e血清型肉毒毒素;若酶切产物中含有氨基酸序列如seq id no.11-12所示的多肽,或者质谱峰中含有质荷比m/z为3784
±
1和1346
±
1的特征峰,则待测样品中含有f血清型肉毒毒素;其中,seq id no.6所示序列中,xaa代表正亮氨酸,seq id no.9所示序列中xaa代表高精氨酸。
40.优选地,所述方法包括:将待测样品与pbst溶液混合(优选的混合比例为:待测样品与pbst溶液的体积比
1:10-20),得到第一混合液;将所述第一混合液与样本富集试剂混合(优选的混合比例为:样本富集试剂与待测样品的体积比2-3:1),得到第二混合液;将所述第二混合液于15-30℃孵育30min-2h后,收集磁珠沉淀得到第一磁珠沉淀(在收集磁珠沉淀后,优选还包括对磁珠进行洗涤的步骤,洗涤可先采用pbst、再采用水进行);将所述第一磁珠沉淀与bsa混合,于25-40℃孵育(优选的孵育时间为0.5-2h)后,收集磁珠沉淀得到第二磁珠沉淀;将所述第二磁珠沉淀与反应缓冲液和肉毒毒素特异性底物肽混合(优选的混合比例为:肉毒毒素特异性底物肽的待测样品的体积比为1:10-15,反应缓冲液与待测样品的体积比为1.5-2:1),于30-40℃反应30min-4h;反应结束后,收集反应上清液进行质谱分析(优选将反应上清液覆盖α-氢基-4-羟基肉桂酸后进行质谱分析)。
41.其中,所述样本富集试剂包含链霉亲和素-生物素磁珠偶联抗体;所述反应缓冲液包含0.05-0.1m hepes、20-30mm dtt和15-25μm zncl2。
42.本发明的有益效果在于:本发明将生化方法与质谱技术相结合,提供了用于全部具有人源毒性的肉毒毒素a型、b型、e型、f型鉴定分析的四个特异性底物肽,利用这四个特异性底物肽结合其经特异性切割产生的血清型特异性目的肽段,能够实现较为特异、灵敏的肉毒毒素及其血清型鉴定。
43.本发明还提供了含有特异性底物肽的检测试剂盒以及检测方法,利用该试剂盒和方法能够快速、高通量、灵敏、准确地进行肉毒毒素及其血清型鉴定,其优势具体如下:(1)本发明的检测方法可在1-6h内完成96份样本中a、b、e、f四种对人有毒性的活性肉毒毒素的检测,检测灵敏度与动物实验相当,检测时间远远小于目前肉毒毒素检测金标准的动物实验(至少3轮实验,每轮实验至少3天,96份样本至少需要1个月才可完成四种血清型的肉毒毒素检测,并且需要大量的小鼠);(2)本发明的检测方法的样本使用量仅需10μl,远远低于一次动物实验的样本使用量(2只小鼠,至少要100μl样本);(3)本发明的检测方法可直接判断样品中所含的肉毒毒素是否具有活性,而目前仅有的进口商品化试剂盒——a型肉毒毒素检测的elisa试剂盒却无法确定所检测的肉毒毒素是否具有活性;(4)采用本发明的试剂盒进行国际测评任务的18份样本,在5小时内准确定性鉴定其中的6份阳性样本,与同时进行的elisa及动物实验相比,灵敏度和特异性均好于elisa试剂盒,检测时长远远小于动物实验的一轮96小时,最低检测样本浓度达到0.5 ng/ml。
44.本发明提供的检测试剂盒和检测方法可以真正实现准确、高通量、快速、使用简便、经济的特性,适用于肉毒毒素生产质控、临床确诊、疾病监测、流行病学调查、公共卫生应急处理等相关领域,为肉毒毒素检测提供新型技术支撑,为我国缺乏自主知识产权的肉毒毒素检测方法及检测试剂、肉毒毒素检测仍依赖于动物实验的状态提供解决方案。
附图说明
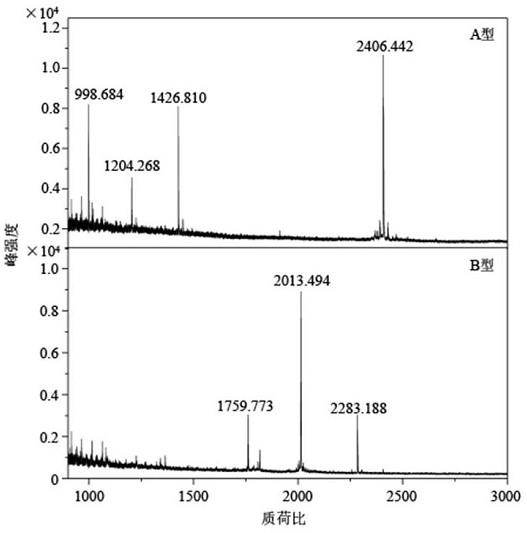
45.图1为本发明实施例1中底物肽的特异性检测结果。
46.图2为本发明实施例3中不同浓度b型肉毒毒素切割底物肽得到的产物的质谱检测结果。
47.图3为本发明实施例3中加入链霉亲和素磁珠偶联生物素化单抗后的孵育时间优化结果。
48.图4为本发明实施例4中检测的阳性样本的质谱图结果。
具体实施方式
49.以下实施例用于说明本发明,但不用来限制本发明的范围。
50.以下实施例中使用的生物素、链霉素偶联磁珠购自赛默飞世尔公司;hepes、dtt、zncl2、超纯水等试剂均购自于sigma公司;质谱仪标准校正液购自于bruker公司。
51.实施例1 肉毒毒素血清型特异性底物肽段的确定及合成本发明通过筛选和优化,获得了分别针对肉毒毒素a、b、e、f血清型特异性的四个底物肽,这四个底物肽的氨基酸序列分别如seq id no.1-4所述。
52.对上述四个底物肽进行合成(由上海强耀生物科技有限公司合成),合成的底物肽具体如下:a型:acetyl-rgsnkkpidagnqratrxlggr-nh2;其中,x代表正亮氨酸;b型:lselddraadlqagasqfessaaklkrkywwknlk;e型:wwwaklgqeidrtnrqkdximakadsnkr-nh2;其中,x代表高精氨酸;f型:tsnrrlqqtqaqvdevvdirmvnvdkvlerdqklselddradal。
53.上述四个底物肽经其对应的血清型肉毒毒素特异性切割后,产生的目的肽段的质荷比如下:a型,m/z 1427
±
1,999
±
1;b型,m/z 1760
±
1,2283
±
1;e型,m/z 2501
±
1,1133
±
1;f型,m/z 3784
±
1,1346
±
1。
54.对已知分别含有a、b两种血清型别肉毒毒素的样本,利用上述筛选得到的a、b、e、f四种特异性底物肽段同时进行检测(检测方法参考实施例3中经优化确定的检测方法,各血清型别样本中均同时加入a、b、e、f四种特异性底物肽段)。
55.结果如图1所示,上述四种特异性底物肽段能够准确鉴定样本中对应的肉毒毒素血清型别,各特异性底物肽仅能够被其对应的血清型别肉毒毒素切割产生特征性多肽,具有100%的特异性。
56.实施例2 肉毒毒素检测试剂盒的开发本实施例提供一种肉毒毒素检测试剂盒,该试剂盒包括试剂1、试剂2、试剂3、试剂4、试剂5、试剂6、试剂7;其中,试剂1为pbst溶液;试剂2为样本富集试剂,试剂3为1-2mg/ml bsa溶液;试剂4为反应缓冲液;试剂5为实施例1合成的四个底物肽(序列如seq id no.1-4所示);试剂6为α-氢基-4-羟基肉桂酸(chca)饱和液;试剂7为质谱仪标准校正液。
57.上述反应缓冲液的组成如下:0.05m hepes,25mm dtt,20μm zncl2,以超纯水配制。
58.上述样本富集试剂用于富集样本中微量的肉毒毒素,其包含链霉亲和素-生物素磁珠偶联抗体,制备方法如下:(1)单克隆抗体生物素化取1支10 mg的生物素平衡至室温后,加入超纯水224 μl,得到10 mm生物素母液;将肉毒毒素a、b、e、f血清型特异性的肉毒毒素单克隆抗体根据质量配制成浓度为1-4 mg/ml的溶液;加入生物素母液体积为60-80v/3(μl),其中v为抗体体积(ml)。掰断蛋白纯化柱凝胶柱的尾部,拧松盖子,置于1.5 ml离心管中,离心去除储存液,吸去底部多余液体。换新的收集管,加样30-130 μl,样本吸收完成后,离心收集产物。
59.(2)链霉亲和素磁珠偶联生物素化单抗取100 μl磁珠置于八联排管中,放置磁力架上静置2 min,弃去上清液;加入100 μl pbst,吹打均匀,在磁力架上静置1~2 min,去除上清,加入100 μl pbst,重悬磁珠,转移至2 ml ep管中。按照2-15μg 抗体~50-100 μl磁珠的配比,向重悬磁珠中加入步骤(1)制得的生物素化后的抗体溶液,室温下偶联1 h后放置磁力架上2 min,弃去上清,加入100 μl pbst洗涤后重悬得到样本富集试剂。
60.实施例3肉毒毒素检测方法的建立1、样本稀释倍数及检测限确定b型肉毒毒素样本毒素浓度分别300 ng/ml、150 ng/ml、30 ng/ml,采用pbst按体积比1:1、1:4和1:20稀释,然后加入20 μl链霉亲和素磁珠偶联生物素化单抗,室温孵育1h。后续经过洗涤、封闭和酶切反应后,上质谱检测。以酶切质谱峰响应值为标准,确定最优稀释倍数。
61.结果如图2所示,酶切质谱峰响应值随着稀释比例增大而减小。最大稀释倍数为1:20时,仍然可以检测到酶切质谱峰,即b型肉毒毒素检测线可达1.5 ng/ml。
62.(2)孵育时间优化上述样本用pbst按照适当比例稀释后,加入链霉亲和素磁珠偶联生物素化单抗后,在室温下分别孵育30min、1h和2h。后续经过洗涤、封闭和酶切反应后,上机检测。以酶切质谱峰响应值为标准,确定最佳孵育时间。
63.结果如图3所示,酶切质谱峰响应值随着孵育时间的延长逐渐增大。孵育2h的酶切质谱峰响应值增幅较小,考虑整体分析时间和不同样本组成,孵育时间选择30min-1h。
64.(3)酶切反应时间优化上述样本用pbst按照适当比例稀释后,加入链霉亲和素磁珠偶联生物素化单抗后,在室温下分别孵育一段时间。后续经过洗涤、封闭、酶切反应。分别取30min、1h、2h、4h和6h的酶切反应上清液,上机检测。以酶切质谱峰响应值为标准,确定最优反应时间。
65.结果显示,酶切质谱峰响应值随着反应时间的延长逐渐增大,当样本中肉毒毒素处于高浓度范围,30min可检测到对应酶切质谱峰,并随着时间的延长逐渐增大。当样本中肉毒毒素处于低浓度范围,4h可检测到对应酶切质谱峰,并且将反应时间延长至6h可小幅度提高质谱峰响应值。
66.因此,综合样本中肉毒毒素浓度和整体分析时间,在反应30min时取上清液检测,若检测到肉毒毒素则停止反应。若未检测到肉毒毒素,继续反应至4h时取上清液检测。
67.数据采集所使用的质谱为布鲁克公司的microflex lrf。采用反射模式进行数据
采集,质量范围为900~5500 da,源1电压(ion source 1)为18.00 kv,源2电压(ion source 2)为15.20 kv,透镜电压(lens)为8.70 kv,反射器电压(reflector)为19.00 kv,激光频率为60 hz。采用布鲁克多肽校正品进行质谱的质量轴校正,校正后分子质量平均偏差小于200 ppm。
68.综合上述优化结果,本实施例提供一种肉毒毒素的检测方法,该方法利用实施例2的检测试剂盒进行检测,包括如下步骤:向2 ml ep管中加入200 μl 试剂1,再加入10 μl待检测的样本,吹打均匀;加入20 μl试剂2,封口膜密封后,室温孵育1h;孵育结束后,转移至八联排管中,放置于磁力架上静置2 min,弃去上清液;加入200 μl 试剂1,吹打均匀,放置于磁力架上静置2 min,弃去上清液;加入230 μl灭菌水,吹打均匀放置于磁力架上2 min,弃去上清液;加入20 μl 试剂3,37℃孵育1 h后将八联排管放置于磁力架上2 min,弃去上清液;加入18 μl试剂4,2 μl试剂5,吹打混匀,37℃反应30min~4h;反应结束后,将八联排管放置于磁力架上2 min,取1 μl反应上清液点靶,覆盖试剂6溶液后上质谱分析,质谱仪采用试剂7校准,根据是否检测到型别特异性对应残基峰判断样本中是否含有肉毒毒素,根据型别特异残基峰的质荷比判断是何种血清型的肉毒毒素。
69.实施例4试剂盒实际检测效果评价利用本发明实施例2中的检测试剂盒和实施例3中的检测方法进行了国际测评任务的18份样本检测。样本采用1:20稀释,反应时间为30min-4h,质谱检测模式为反射模式。
70.结果显示(图4),在5小时内准确定性鉴定其中的6份阳性样本,其中4个样本含有a型肉毒毒素,1个样本含有b型肉毒毒素,1个样本有a、b两种血清型的肉毒毒素。与同时进行的动物实验比对,检测时长远远小于动物实验的一轮96小时,所检测样本的最低浓度为10 ng/ml,对于同时含有两种毒素且浓度相差较大的样本,本发明的方法较动物实验具有更好的特异性。
71.本发明的检测方法具有分析时间短,准确度高,易操作,成本低等优势,该方法是一种实用的、对人具有毒性的所有血清型肉毒毒素的检测技术,解决了目前缺少肉毒毒素快速检测试剂盒的瓶颈问题,为肉毒梭菌感染及肉毒毒素中毒相关疾病的诊断、疫情防控和相关产品中肉毒毒素的快速检出提供了关键技术支撑。
72.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
